Method Article
ייצור בקנה מידה ללא תאים ותוספת אדג'ובנטית לחלבון קרום חיצוני עיקרי רקומביננטי מכלמידיה מורידרום לפיתוח חיסונים
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר שימוש בערכות ביטוי מסחריות של חלבונים נטולי תאים כדי לייצר חלבוני ממברנה הנתמכים בננו-דיסק שיכולים לשמש כאנטיגנים בחיסונים תת-יחידתיים.
Abstract
חיסונים תת-יחידתיים מציעים יתרונות על פני חיסונים מסורתיים יותר מומתים או מוחלשים שמקורם בתאים שלמים בבטיחות, יציבות וייצור סטנדרטי. כדי להשיג חיסון יעיל מבוסס חלבון תת-יחידה, האנטיגן החלבוני צריך לעתים קרובות לאמץ קונפורמציה דמוית יליד. זה חשוב במיוחד עבור אנטיגנים פני השטח של פתוגן שהם חלבונים הקשורים לקרום. שיטות נטולות תאים שימשו בהצלחה לייצור חלבון ממברנה פונקציונלי מקופל כראוי באמצעות תרגום משותף של חלקיקי ננוליפופרוטאין (NLPs), הידוע בכינויו ננודיסקים.
אסטרטגיה זו יכולה לשמש לייצור חיסונים תת-יחידתיים המורכבים מחלבוני ממברנה בסביבה קשורה לשומנים. עם זאת, ייצור חלבון ללא תאים מוגבל לעתים קרובות בקנה מידה קטן (<1 מ"ל). כמות החלבון המיוצרת בריצות ייצור בקנה מידה קטן מספיקה בדרך כלל למחקרים ביוכימיים וביופיזיקליים. עם זאת, התהליך נטול התאים צריך להיות מורחב, אופטימלי ונבדק בקפידה כדי להשיג מספיק חלבון למחקרי חיסונים במודלים של בעלי חיים. תהליכים אחרים המעורבים בייצור חיסונים, כגון טיהור, תוספת אדג'ובנטית וליופיליזציה, צריכים להיות אופטימליים במקביל. מאמר זה מדווח על פיתוח פרוטוקול מורחב לביטוי, טיהור וניסוח חיסון תת-יחידה חלבוני הקשור לקרום.
תגובות מוגדלות ללא תאים דורשות אופטימיזציה של ריכוזים ויחסים של פלסמיד בעת שימוש במספר וקטורים של ביטוי פלסמיד, בחירת שומנים ותוספת אדג'ובנטית לייצור ברמה גבוהה של חלקיקי ננו-ליפופרוטאין מנוסחים. השיטה מודגמת כאן עם ביטוי של חלבון קרום חיצוני גדול כלמידיאלי (MOMP), אך ניתן ליישם אותה באופן נרחב על אנטיגנים אחרים של חלבון הממברנה. ניתן להעריך את יעילות האנטיגן in vivo באמצעות מחקרי חיסון למדידת ייצור נוגדנים, כפי שהוכח כאן.
Introduction
ליזטים פרוקריוטים או אאוקריוטים לביטוי ללא תאים של חלבונים זמינים בקלות כמוצרים מסחריים לסינתזה של חלבונים מעניינים (לסקירה מלאה, ראה 1). מערכות ביטוי אלה זמינות בקני מידה שונים ומשתמשות בליזטים מאורגניזמים שונים, כולל E. coli, צמחי טבק ותרביות יונקים. ליזטים נטולי תאים מציעים יתרונות רבים על פני גישות מסורתיות לייצור חלבון רקומביננטי, כולל קלות שימוש וייצור חלבון חזק ומהיר. בעוד גישות אלה משמשות בעיקר לייצור חלבונים מסיסים, קבוצה זו הייתה חלוצה בגישה לשימוש בהם כדי לבטא חלבונים ממברנה.
גישה חדשנית זו מבצעת שינויים קלים במערכות ביטוי חופשיות תאים קיימות על ידי הכללת DNA המקודד שני תוצרי חלבון לביטוי, אפוליפופרוטאין וחלבון הממברנה המעניין. אפוליפופרוטאין מבוטא (נגזרות של ApoA1 או ApoE4) אינטראקציה עם שומנים שנוספו לליזט ללא תאים כדי להרכיב באופן ספונטני (~ 20 ננומטר) NLPs. בתרגום משותף עם חלבון ממברנה מעניין, חלבון ה-NLP והממברנה יוצרים קומפלקס ננו-חלקיקים מסיס שבו חלבון הממברנה מוטמע בתוך דו-שכבת השומנים של NLP. לפיכך, חלבון הממברנה נגיש יותר ליישומים במורד הזרם, מכיוון שהוא כלול בתוך חלקיקים מסיסים ובדידים. גישה זו יכולה לייצר קומפלקסים פונקציונליים של חלבונים אוליגומריים בתוך NLP bilayer2 ויכולה לייצר את מרכיב האנטיגן של חיסון תת-יחידה, אשר לאחר מכן מעורבב עם אדג'ובנטים ליפופיליים ליצירת חיסון ננו-חלקיקים הכולל אנטיגן מקומי ואדג'ובנט המתאים להערכת in vivo .
שיטה נוכחית זו שונה מפרוטוקול3 שפורסם בעבר. שינויים עיקריים מתמקדים בקנה מידה של התגובה ללא תאים וטיהור לאחר מכן של קומפלקס חלבון NLP. שינוי נוסף כולל תוספת של פולימר אמפיפילי המכונה טלודנדרימר, אשר מעורבב תחילה עם השומנים לפני הוספה לתגובה ללא תאים. תרגום משותף של הפלסמידים בנוכחות הטלודנדרימר והשומנים מייצר NLP של טלודנדרימר (tNLP). תוספת הטלודנדרימר מסייעת גם לווסת את הגודל והחד-פיזור של חלקיקי tNLP4 המתקבלים. פרוטוקול זה מותאם במיוחד למחקרי חיסון בקנה מידה גדול לייצור חלבון אנטיגן תת-יחידה הקשור לממברנה, כלמידיאלי MOMP 5,6. השיטה מייצרת MOMP רקומביננטי הקשור ל-tNLP ליצירת קומפלקס MOMP-tNLP מסיס ביותר השומר על אוליגומריזציה של MOMP. ייצור מורחב טיפוסי של 3 מ"ל מניב >1.5 מ"ג של MOMP מטוהר. MOMP-tNLP המיוצר ללא תאים מקובל על תוספת אדג'ובנטית מהירה לבדיקת אימונוגניות in vivo.
Protocol
כל המחקרים בבעלי חיים בוצעו באוניברסיטת קליפורניה, אירווין, במתקנים מובטחים של שירות בריאות הציבור (PHS) בהתאם להנחיות שנקבעו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים.
1. הכנת כלי זכוכית
הערה: כל החומרים המשמשים לייצור פורמולציות ברמת חיסון לבעלי חיים הם נטולי אנדוטוקסינים.
- כדי להשמיד אנדוטוקסין מזהם, אפו כלי זכוכית נקיים שיחזיקו את החוצצים בתנור בטמפרטורה של 180 מעלות צלזיוס למשך 4 שעות.
2. הכנת חיץ
- הכן 250 מ"ל של מאגרי טיהור זיקה Ni המפורטים בטבלה 1. אחסנו אותם בטמפרטורה של 4°C למשך עד 6 חודשים.
3. הכנת תגובה
- שקלו 20 מ"ג של 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) לתוך צינור צנטריפוגה 1.5 מ"ל נטול אנדוטוקסין. ממיסים אותו ב-1 מ"ל מים נטולי אנדוטוקסין, ממיסים לפחות ארבע פעמים ב-6 אמפר למשך דקה אחת, עם הפסקה של דקה בין לבין, עד לנקיון. הסר כל מתכת מזהמת מהבדיקה על ידי צנטריפוגה ב 13,000 × גרם למשך 2 דקות ב 22 ° C ולאחר מכן להעביר את השומנים המסיסים לצינור חדש 1.5 מ"ל ללא אנדוטוקסין.
- שקלו 1 מ"ג של טלודנדרימר PEG5k-CA8 לתוך צינור נטול אנדוטוקסין בנפח 1.5 מ"ל. יש להמיס במים נטולי אנדוטוקסין לריכוז של 20 מ"ג/מ"ל. מערבלים עד להמסה מלאה ומדוללים ל-2 מ"ג/מ"ל.
- בצינור חדש ללא אנדוטוקסין, שלב 210 μL של 20 מ"ג / מ"ל תמיסת DMPC עם 210 μL של 2 מ"ג / מ"ל תמיסת טלודנדרימר.
4. ייצור ללא תאים של MOMP-tNLPs עבור פורמולציות חיסון תת-יחידות
- הכן MOMP-tNLPs באמצעות שיטות ללא תאים ששונו מפרוטוקול שפורסם בעבר5.
- שעתיים לפני הגדרת התגובה נטולת התא, פתחו את ערכת ביטוי החלבון נטול התאים הפרוקריוטי והפשירו את אחד ממאגרי ההרכבה מחדש. לאחר ההפשרה, הוסיפו טבליה אחת של קוקטייל מעכב פרוטאז ללא EDTA והניחו לו להתמוסס במלואו.
- עקוב אחר פרוטוקול זה באמצעות ערכה המיועדת להריץ 5 x 1 מ"ל תגובות.
הערה: ייצור קנה מידה טיפוסי הוא 3 x 1 מ"ל.- עבור כל תגובה של 1 מ"ל, יש להוסיף 525 μL של חיץ הרכבה מחדש לבקבוק E. coli lysate ולגלגל בעדינות להתמוססות. יש להוסיף 250 μL של חיץ הרכבה מחדש לבקבוק המכיל תוספי תגובה (למשל, ATP, GTP) ולגלגל בעדינות להתמוססות.
- יש להוסיף 8.1 מ"ל של חיץ הרכבה מחדש לבקבוק הזנת התגובה, לסגור עם פקק גומי (יש להיזהר לא לגעת בחלק הפנימי של פקק הגומי) ולהפך/לגלגל בעדינות כדי להתמוסס.
- יש להוסיף 3 מ"ל של חיץ הרכבה מחדש לבקבוק תערובת חומצות האמינו, לסגור מחדש עם פקק גומי ולהפוך/לגלגל בעדינות כדי להתמוסס.
הערה: היזהר לא לגעת בחלק הפנימי של פקק הגומי מכיוון שהדבר עלול להוביל לזיהום. - יש להוסיף 1.8 מ"ל של חיץ הרכבה מחדש לבקבוק המתיונין, לגלגל בעדינות להתמוססות ולאחר מכן לאחסן על קרח עד לשימוש.
- הכן את פתרון התגובה.
- לבקבוק E. coli lysate, יש להוסיף 225 μL של תערובת תגובה משוחזרת, 270 μL של תערובת חומצות אמינו משוחזרות ללא מתיונין, ו-30 μL של מתיונין משוחזר. בנוסף, הוסף 400 μL של תערובת DMPC/telodendrimer, 15 מיקרוגרם של פלסמיד MOMP, ו 0.6 מיקרוגרם של פלסמיד Δ49ApoA1. מגלגלים/מנערים בעדינות כדי לערבב.
הערה: ודא ששני הפלסמידים בנויים מאותו עמוד שדרה של פלסמיד. אין לערבל. - קח 20 μL של התמיסה הכוללת ולשים אותו בצד בצינור 1.5 מ"ל עבור תגובת הבקרה מבטאת GFP (ראה להלן).
- לבקבוק E. coli lysate, יש להוסיף 225 μL של תערובת תגובה משוחזרת, 270 μL של תערובת חומצות אמינו משוחזרות ללא מתיונין, ו-30 μL של מתיונין משוחזר. בנוסף, הוסף 400 μL של תערובת DMPC/telodendrimer, 15 מיקרוגרם של פלסמיד MOMP, ו 0.6 מיקרוגרם של פלסמיד Δ49ApoA1. מגלגלים/מנערים בעדינות כדי לערבב.
- הכן את פתרון ההזנה. לבקבוק תערובת ההזנה, הוסיפו 2.65 מ"ל של תערובת חומצות אמינו משוחזרות ללא מתיונין ו-300 מיקרוליטר של מתיונין משוחזר. מגלגלים/מנערים בעדינות עד להתמוססות.
הערה: בשלב זה, ניתן להחזיר את מאגר ההרכבה מחדש ואת מתיונין שאינם בשימוש למקפיא לאחסון. - העבר 1 מ"ל מתמיסת התגובה לתא התגובה הפנימי שסופק בערכת התגובה ללא תאים ואטם כאשר הוא מלא. העברת 10 מ"ל של תמיסת הזנה לתא החיצוני של כלי התגובה וחותם.
הערה: אין למלא את התאים יתר על המידה! נוכחות של בועות אוויר בחלק העליון של תא התגובה הפנימי ותא ההזנה הפנימי תשפיע לרעה על התגובה. כל פתרון תגובה שנותר יכול להיות ממוקם בתוך צינור 1.5 מ"ל ומותר לערבב לצד הכלי הראשי. - הוסף 0.5 μL של פלסמיד בקרת GFP (0.5 מ"ג / מ"ל) לתערובת התגובה הקודמת של 20 μL.
הערה: ערכות רבות מסופקות עם פלסמיד בקרה למטרות בקרת איכות. רוב הפלסמיד המבטא GFP עם מקדם T7 ואתר קשירת ריבוזום E.coli (RBS) יכול לשמש גם כפלסמיד הבקרה. - הניחו את התגובה בשייקר ב-300 סל"ד, 30°C למשך עד 18 שעות. כדי לוודא שהתגובה הייתה מוצלחת, השתמשו במקור אור אולטרה-סגול כדי לבדוק פלואורסצנטיות כתוצאה מהסינתזה של GFP הבקרה (איור 1A) לאחר 15 דקות בלבד של דגירה.
הערה: ייתכן שיהיה צורך למטב תנאים אלה, במיוחד טמפרטורה, לביטוי חלבוני ממברנה אחרים.
5. טיהור MOMP-tNLP
- השתמש בכרומטוגרפיית זיקה לניקל משותק כדי לטהר את קומפלקס ננו-חלקיקי MOMP-tNLP מתערובת התגובה נטולת התאים באמצעות התג His-tag על חלבון Δ49ApoA1.
- מעבירים 1 מ"ל של 50% שרף טיהור His-Tag לעמודת כרומטוגרפיה חד פעמית של 10 מ"ל ומאזנים אותו עם 3 מ"ל של חיץ קשירה.
- תנו למאגר להתרוקן, סגרו את השקע והוסיפו 250 מיקרוליטר של חיץ קשירה לשרף.
- לפני הוספת התגובה נטולת התאים לעמודה, שמור 20 μL לניתוח מאוחר יותר על-ידי SDS-PAGE. ערבבו את התגובה נטולת התאים עם השרף המאוזן ודגרו עליו על נדנדת מעבדה בטמפרטורה של 4°C למשך שעה אחת.
- פתח את מכסה העמודה, שטוף את המכסה עם 500 μL של מאגר קשירה נוסף, והוסף נוזל זה לשאר העמודה.
- אסוף את זרימת הנוזל מהעמודה לניתוח מאוחר יותר על-ידי SDS-PAGE.
- שטפו את העמוד עם 1 מ"ל של חיץ כביסה המכיל 20 mM imidazole שש פעמים ואספו שברים. יש להיזהר לא לתת לשרף להתייבש בין השטיפות. בשטיפה השנייה, להתסיס במרץ את השרף על ידי pipeting למעלה ולמטה באמצעות פיפטה 1 מ"ל.
- הצטיאו את MOMP-tNLPs בשישה שברים של 300 μL של חיץ Elution 1 (המכיל 250 mM imidazole), ולאחר מכן אלוציה סופית אחת עם 300 μL של Elution buffer 2 (המכיל 500 mM imidazole). על ההדבקה השנייה, להתסיס במרץ את השרף על ידי pipeting למעלה ולמטה באמצעות פיפטה 1 מ"ל.
6. ניתוח על ידי SDS-PAGE
הערה: יש לנתח את כל שברי האלוציה על ידי SDS-PAGE כדי לבדוק את הכמות והטוהר של החלבון המעניין.
- טען 1 μL כל אחד מכלל הליזט והזרימה ולאחר מכן 5 μL עבור כל שטיפות שנאספו ושברי elution.
- ערבב aliquots של MOMP-tNLPs מדולל, שטיפות, זרימה דרך ו lysate הכולל עם 4x SDS-PAGE דגימת טעינת חוצץ. יש לערבב ולחמם את הדגימות עם חומר להפחתת דגימות פי 10, אלא אם צוין אחרת.
- נתח את השברים באמצעות אלקטרופורזה בג'ל באמצעות ג'ל Bis-Tris SDS-PAGE בגודל 1.0 מ"מ, 4 עד 12%, עם חיץ ריצה MES-SDS אחד, יחד עם תקן משקל מולקולרי מתאים. הפעל את הג'לים במשך 35 דקות ב 200 V.
- מכתימים את הג'לים בהתאם להוראות היצרן.
- מוציאים את הג'ל מהקלטת ומניחים אותו בכתם ג'ל 60 מ"ל. חממו את הג'ל בכתם הג'ל למשך 30 שניות, ונענעו בעדינות את המיכל למשך 30 שניות כדי לפזר חום באופן שווה. חממו במיקרוגל את הג'ל בכתם לטמפרטורה של 80-85 מעלות צלזיוס למשך 30 שניות נוספות, והניחו את הג'ל על שייקר אורביטלי לרוק למשך 5 דקות.
- חממו את הג'ל במיקרוגל בפעם השלישית למשך 30 שניות, ואז חזרו לשייקר האורביטלי כדי להתנדנד למשך 23 דקות נוספות.
- מעבירים את הג'ל למיכל נקי ושוטפים בתמיסת שטיפה של 100 מ"ל (10% מתנול, 7% חומצה אצטית) למשך 30 דקות.
הערה: זהו שלב קריטי מכיוון שחיוני להימנע מחימום תמיסת הכביסה. אי ביצוע פעולה זו עלול לגרום לכתמי רקע ואי סדרים בתמונת הג'ל הסופית. - לאחר השטיפה, שטפו את הג'ל במים טהורים במיוחד פעמיים במשך 5 דקות כל אחד.
- דמיינו את הג'לים באמצעות מצלמת ג'ל ב-600 ננומטר (איור 2). השתמש ב- SDS-PAGE כדי לכמת את כמות החלבון הבודד בתמיסת ננו-חלקיקים אם קיים תקן חלבון להשוואה.
הערה: בדוגמה זו, דילולים סדרתיים של MOMP המבוטאים באופן רקומביננטי נפתרים על-ידי SDS-PAGE וצפיפויות הפסים מכומתות באמצעות תוכנת כלי נגינה. - צור עקומה סטנדרטית באמצעות הצפיפויות של רצועות MOMP. פתרו את דגימות MOMP-tNLP באותו ג'ל SDS-PAGE וחשבו את רכיב MOMP של החלקיקים באמצעות עקומת תקן MOMP (איור 3).
7. כתמים מערביים ונקודות ואחסון
- עבור הכתמה מערבית, יש לפתור את הדגימות באמצעות SDS-PAGE ולהעביר את הג'לים באמצעות מערכת מסחרית לניקוי יבש עם הגדרות סטנדרטיות בהתאם לפרוטוקול היצרן.
- הסר את הכתמים מהערימה לאחר השלמת ההעברה, ודגר על כל כתם למשך הלילה ב -4 מעלות צלזיוס במאגר חסימה מתאים המכיל 0.2% Tween 20 ו- 0.5 מ"ג / מ"ל MAb40 או 0.2 מ"ג / מ"ל MAbHIS נוגדן אנטי-His-tag המכוון נגד תג His-tag מחלבון Δ49ApoA1.
הערה: דילולי הנוגדנים המשמשים לכתישה הם 1:1,000 עבור MAb40 ו-1:500-1,000 עבור נוגדן MAbHIS. - שטפו כל כתם 3 פעמים במשך 5 דקות עם PBS-T (1x PBS, 0.2% Tween 20, pH 7.4).
- לדגור על הכתמים במשך שעה אחת בחיץ חוסם המכיל נוגדן משני מצומד לפלואורופור (למשל, IRDye) בדילול של 1:10,000.
- שטפו מחדש את הכתמים 3 פעמים למשך 5 דקות עם PBS-T. השתמש בהדמיה פלואורסצנטית כדי לצלם את הכתמים לאחר הכביסה הסופית.
- הסר את הכתמים מהערימה לאחר השלמת ההעברה, ודגר על כל כתם למשך הלילה ב -4 מעלות צלזיוס במאגר חסימה מתאים המכיל 0.2% Tween 20 ו- 0.5 מ"ג / מ"ל MAb40 או 0.2 מ"ג / מ"ל MAbHIS נוגדן אנטי-His-tag המכוון נגד תג His-tag מחלבון Δ49ApoA1.
- עבור כתמי נקודות, כתם 3 מיקרוגרם של MOMP-tNLP מטוהר ו-tNLP ריק באמצעות מנגנון כתם נקודה. לחסום ולפתח את הכתמים באותן שיטות שתוארו לעיל עבור כתמים מערביים.
8. הערכת אנדוטוקסין
- כמת את רמות האנדוטוקסין באמצעות מערכת בדיקת אנדוטוקסין המבוססת על בדיקת לימולוס אמבוציטים ליזט (LAL). הכינו ללא אנדוטוקסין 25 mM Tris, pH 7.4, מאגר דגימה באמצעות תמיסת הידרוכלוריד 1 M Tris ומים נטולי אנדוטוקסין.
הערה: בדרך כלל, יש לדלל דגימות באמצעות מאגר דגימה זה, ולהתאים את הדילולים כדי למצוא את הטווח המתאים לדגימות בודדות. כאן, דגימות MOMP-tNLP מדוללות פי 500 במאגר הדגימה ו- 25 μL נטענות לכל באר של מחסנית מכשיר עם רגישות של 0.05 EU/mL. רמות האנדוטוקסין של MOMP-tNLP ו-tNLP ריק ששימשו במחקרי עכברים המתוארים להלן הן בין 0.4 ל-12 חלבון EU/μg, בהתאם לדגימה.
9. ליופיליזציה
- Lyophilize ולאחסן את חלקיקי MOMP-tNLP לשימוש לטווח ארוך (עד שנים) ב -20 ° C. כדי להכין מתלי tNLP ו- MOMP-tNLP לליופיליזציה, הוסף טרהלוז כמגן במהלך תהליך ההקפאה והליופיליזציה.
הערה: תהליך זה אומת בהרחבה עבור מגוון נוסחאות tNLP 7,8. - חלק את הנפח הנוכחי של תמיסת MOMP-tNLP ב- 9 כדי לקבל את הנפח של 1 M טרהלוז במים סטריליים, נטולי אנדוטוקסינים ונטולי יונים, הדרושים כדי להגיע לריכוז סופי של 0.1 M טרהלוז. שימו לב לנפח הסופי והכניסו לצינורות פוליפרופילן נטולי אנדוטוקסין 15 מ"ל או 50 מ"ל לפי הצורך.
- מקפיאים את התמיסה המעורבת על קרח יבש והופכים אותה למשך הלילה לליופיליזר. אחסנו את הפורמולות המיובשות בטמפרטורה של -20°C עד לצורך.
- לבנות מחדש tNLPs lyophilized באמצעות מים נטולי אנדוטוקסין. מגלגלים בעדינות עד שהעוגה מומסת לחלוטין ומיובשת מחדש. כדי להסיר טרהלוז, dialyze את הפתרון נגד PBS באמצעות קרום דיאליזה 3.5 kDa cutoff.
10. תוספת אדג'ובנטית
הערה: נוסחאות חיסון תת-יחידות מבוססות NLP אלה ודומות אחרות יכולות לשלב בקלות אדג'ובנטים ליפופיליים כגון CpG-ODN1826 ו- FSL-1. CpG-ODN1826 הוא אוליגונוקלאוטיד CpG Class B שונה (5'-tccatgacgttcctgacgtgacgtt-3') עם עמוד שדרה זרחני מלא הכולל 5' כולסטרול moiety (5'-chol-C6). הצמידות של CpG-ODN1826 ל-tNLPs מתווכת על ידי אינטראקציות הידרופוביות בין הכולסטרול moiety לבין דו-שכבת הפוספוליפידים של tNLP והודגמה ומאופיינת היטב, כפי שדווח בעבר 9,10.
- לפני השילוב בנוסחאות אלה, לטהר את CpG מהונדס כולסטרול על ידי כרומטוגרפיה הפוכה כדי להסיר אנדוטוקסין מזהם, כמו גם כל מולקולות CpG שלא השתנו.
- עם קבלתו מהספק, יש לייבש מחדש את חומר ה-CpG שעבר ליופיליזציה במים נטולי אנדוטוקסין ולטהר אותו על עמודת הכנה C4 RP-HPLC באמצעות שיפוע הפרדה המורכב מ-10 mM triethylammonium אצטט (TEAA) (שלב A נייד) ואצטוניטריל (Mobile phase B).
הערה: פרטים נוספים זמינים בטבלה 2. - אגרו ו lyophilize את השברים המכילים CpG מהונדס כולסטרול. כדי להבטיח הסרה מלאה של שאריות TEAA, להקים מחדש את CpG עם 15 מ"ל של מים נטולי אנדוטוקסין ו re-lyophilize אותו שלוש פעמים.
- לאחר הליאופיליזציה הסופית, יש ליצור מחדש CpG במים נטולי אנדוטוקסין (>20 מ"ג/מ"ל ריכוז CpG סופי), aliquot, ולאחסן אותו ב -80 ° C עד הצורך. בנוסף לפורמולציות, לדלל את ה- CpG לריכוז של 1-2.5 מ"ג / מ"ל.
הערה: FSL-1 זמין כאבקה ליופילית בדרגת חיסון. זה משוחזר באמצעות מים סטריליים נטולי אנדוטוקסין בריכוז של 1 מ"ג / מ"ל. החיסון ניתן תוך שרירית (i.m.), כאשר כל מנה מכילה 10 מיקרוגרם MOMP בנפח כולל של 50 μL.
- עם קבלתו מהספק, יש לייבש מחדש את חומר ה-CpG שעבר ליופיליזציה במים נטולי אנדוטוקסין ולטהר אותו על עמודת הכנה C4 RP-HPLC באמצעות שיפוע הפרדה המורכב מ-10 mM triethylammonium אצטט (TEAA) (שלב A נייד) ואצטוניטריל (Mobile phase B).
- כדי להשיג את מינון הפורמולציה הרצוי, דיאליזה של הננו-חלקיקים לתוך PBS ורכז אותם באמצעות רכז ואקום צנטריפוגלי לפני הוספה אדג'ובנטית. היזהר בעת ביצוע פעולה זו כדי למנוע התייבשות מוחלטת של הדגימה - בדוק את נפח הדגימה כל 20-30 דקות במהלך הצנטריפוגה.
- הוסיפו את האדג'ובנט בתנאים סטריליים לארון בטיחות ביולוגית. כדי להעריך שילוב מוצלח, נתח את הניסוחים הסופיים ואת מרכיביהם על ידי כרומטוגרפיה אנליטית של אי הכללת גודל (SEC).
הערה: עבור תכשירים אלה, נעשה שימוש בטור SEC בחיץ PBS (קצב זרימה של 0.5 מ"ל/מ'), וזוהה אלוציה באמצעות גלאי מערך דיודות UV-vis. ההתאגדות הוערכה על ידי השוואת הבליעה של החלקיקים האדג'ובנטים לזו של החלקיקים הלא אדג'ובנטים ב-214 ו-280 ננומטר. - יש לאחסן את MOMP-tNLP האדג'ובנטי ולרוקן את ה-tNLP בטמפרטורה של 4°C לפני השימוש בבעלי חיים לתקופה של עד 14 יום. כדי להעריך באופן מלא את היציבות של נוסחת tNLP חדשה, נתח מעת לעת את tNLPs המאוחסנים על ידי SEC.
הערה: היציבות תשתנה מניסוח לניסוח.
11. בדיקת סרום
- השג נקבות עכברים בנות 3 שבועות (BALB/c, n = 6).
- חסן את העכברים תוך שרירית (i.m.) בכל גפה אחורית עם 10 מיקרוגרם של MOMP בצורה של MOMP-tNLP אדג'ובנט עם 5 מיקרוגרם של CpG ו 1 מיקרוגרם FSL-1 (נפח כולל לכל זריקה = 50 מ"ל).
- לאחר החיסון, התבוננו בעכברים עד שהם מסוגלים לשמור על עצם החזה.
- ארבעה שבועות לאחר החיסון הראשוני (ראשוני), חסן את בעלי החיים פעם שנייה (דחיפה) עם 10 מיקרוגרם של MOMP בצורה של MOMP-tNLP אדג'ובנט עם 5 מיקרוגרם של CpG ו 1 מיקרוגרם FSL-1 (נפח כולל לכל זריקה = 50 מ"ל).
- ביום ה-56 לאחר החיסון הראשוני, יש לאסוף דם כדי להעריך נוגדנים. התחל על ידי הרדמת העכברים על ידי הזרקת I.P. תמיסה של xylazine (0.3 מ"ג / 20 גרם משקל גוף) וקטמין (3.0 מ"ג / 20 גרם משקל גוף). צבטו את הרגליים הקדמיות והאחוריות כדי לוודא שלא מתרחשות טלטלות. יש למרוח וזלין סביב העיניים כדי למנוע יובש בעיניים במהלך ההרדמה.
- באמצעות צינור נימי מיקרו-המטוקריט, לנקב את מקלעת רטרו-מסלולית. לאסוף 100 מ"ל של דם בצינור microcentrifuge.
- לאחר איסוף הדם, התבוננו בעכברים עד שהם מתאוששים מההרדמה ויכולים לשמור על עצם החזה.
- תנו לדם להיקרש בטמפרטורת החדר למשך 30 דקות ואז יסתחררו ב-2,000 × גרם למשך 10 דקות. לאסוף את הסרום ולהקפיא ב -80 ° C.
- בשלב זה, אתגרו את בעלי החיים עם Chlamydia muridarum או הרדימו אותם. הרדימו את העכברים על ידי הזרקת I.P. תחילה תמיסה של קסילזין (0.3 מ"ג / 20 גרם משקל גוף) וקטמין (3.0 מ"ג / 20 גרם משקל גוף) ולאחר מכן נקע צוואר הרחם.
- בדיקת נוגדנים בסרום ספציפי עבור MOMP באמצעות טכניקות הכתמה מערביות כמתואר לעיל. סרו עכבר בריכה מכל העכברים המחוסנים והשתמשו בסרום המשולב במקום נוגדן ראשוני בדילול של 1:5,000.
תוצאות
פרופיל SDS-PAGE של טיהור זיקה Ni של MOMP-tNLP מתגובה נטולת תאים של 1 מ"ל מוצג באיור 1B. התגובה הביאה לרמות ביטוי גבוהות הן עבור MOMP והן עבור חלבון Δ49ApoA1. תוצאות קודמות הראו כי הביטוי החופשי של Δ49ApoA1 בנוכחות DMPC וטלודנדרימר הביא להיווצרות חלקיקי ננו-ליפופרוטאין של טלודנדרימר (tNLPs)4. שיתוף הפעולה של MOMP עם Δ49ApoA1 הצביע על כך ש-MOMP משויך ל-tNLPs, מכיוון שהתג His-tag קיים רק על פיגום ה-tNLP Δ49ApoA1 ולא על MOMP. MOMP הוא חלבון בלתי מסיס מאוד שניתן לדלל רק באמצעות קומפלקס עם tNLPs, אשר הוכחו כמסייעים למסיסות של חלבוני ממברנה.
שברי האלוציה המכילים MOMP-tNLPs אוגמו וריכוז החלבון הכולל נקבע באמצעות מכשיר כימות מבוסס פלואורסצנטיות, או מכשיר המודד ריכוז באמצעות ספיגה ב-280 ננומטר, בהתאם להוראות היצרן לכימות חלבונים. כדי לאפשר מינון מדויק של חיסון MOMP, חשוב גם לקבוע את ריכוז MOMP בקומפלקסים מטוהרים. פיתחנו שיטה לכימות MOMP המבוססת על דנסיטומטריית ג'ל (איור 2), שבה MOMP רקומביננטי מטוהר עם ריכוז ידוע שימש כסטנדרט. על ידי קביעת העקומה הסטנדרטית והשוואתה למדגם MOMP-tNLP, ניתן לכמת את ריכוז MOMP במדויק. קביעת ריכוז MOMP במדגם המטוהר אפשרה להעריך את תפוקת MOMP בתגובות נטולות תאים בקני מידה שונים, דבר חשוב לתכנון מערך התגובה המתאים למחקרים במורד הזרם (טבלה 3).
MOMP צריך ליצור אוליגומרים כדי לעורר תגובה חיסונית חזקה11. כדי לבחון את המצב האוליגומרי של MOMP, MOMP-tNLP נותח בנוכחות ובהיעדר חום וחומר מחזר dithiothreitol (DTT, 50 mM, איור 3A). אוליגומרים מסדר גבוה יותר של MOMP זוהו באמצעות SDS-PAGE כאשר הדגימות לא טופלו בחום וב-DTT. לשם השוואה, דגימות שטופלו בחום בנוכחות DTT הראו בעיקר שני פסים נפרדים על הג'ל, המתאימים ל-MOMP ול-Δ49ApoA1 (כ-40 kDa ו-22 kDa, בהתאמה). תוצאות אלה דומות מאוד לדפוס פסי הג'ל המיוחס להיווצרות אוליגומרים של MOMP, שהוא קריטי ליעילותו.
ניתוח כתמים מערבי נוסף באמצעות MAb40, נוגדן כנגד האפיטופ הליניארי בתחום המשתנה של חלבון MOMP, הראה דפוס פסים דומה, המאשר את היווצרות האוליגומרים על-ידי חלבון MOMP במצבו הלא-מפורק (איור 3B). גורם חשוב המשפיע על היווצרות אוליגומרים של MOMP הוא היחס בין פלסמיד MOMP לבין פלסמיד Δ49ApoA1 במהלך מערך התגובה נטולת התא. טבלה 4 מפרטת את היחס בין פלסמידים לבין קצב ההחדרה של MOMP ל-tNLPs. מחקרים קודמים הצביעו על כך ש-MOMP כלמידיאלי וחלבוני ממברנה חיצוניים אחרים עשויים להתקיים בעיקר כטרימרים12. כדי למקסם את היווצרות הטרימר בתגובה נטולת תאים, רצוי שקצב ההחדרה יהיה קרוב לשלושה חלבוני MOMP לכל NLP, המתאים ליחס פלסמיד ~25:1 MOMP-to-Δ49ApoA1.
בדיקת כתם נקודה שימשה כשיטה יעילה יותר לזיהוי נוכחות של MOMP ו- tNLP. הנוגדן MAb40 שימש לזיהוי MOMP כולל. נוגדן MAbHIS הממוקד לתג His-tag על פיגום Δ49ApoA1 של tNLP שימש להערכת נוכחות tNLP. האיתות המשותף של נוגדני MAb40 ו-MAbHIS הצביע על היווצרות MOMP-tNLP. תגובת הבקרה יצרה tNLP ריק, שהראה רק אות חיובי מ-MAbHIS (איור 3C). כדי לבדוק את האימונוגניות של MOMP-tNLPs המיוצרים בתגובה נטולת תאים, אספנו MOMP-tNLP עם CpG + FSL-1 והזרקנו תוך שרירית (i.m.) לעכברים במשטר דחיפה ראשוני כמתואר לעיל. סרה נאסף מהעכברים המחוסנים, ונוגדן IgG ספציפי ל-MOMP נמדד באמצעות בדיקת כתם מערבי (איור 4). הסרה מעכברים שהוזרקו להם MOMP-tNLP אדג'ובנטי הראתה קשירת MOMP חזקה, מה שמצביע על כך ש-MOMP-tNLP יכול לעורר תגובה חיסונית in vivo.
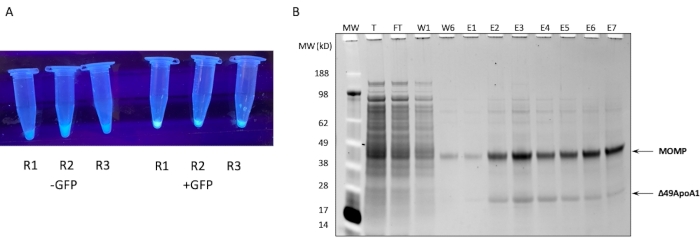
איור 1: ביטוי וטיהור של MOMP-tNLP. (A) תמונה של צינורות המכילים אליציטוטים קטנים של תגובה נטולת תאים שביטאה בהצלחה פקדי GFP המוארים תחת מקור אור UV (מימין) בהשוואה לליזטים ללא פלסמיד GFP (משמאל). (B) ג'ל חלבון המוכתם ב-SYPRO Ruby לאחר SDS-PAGE מציג את פרופיל הטיהור של MOMP-tNLP. MOMP נודד ב- 40 kDa ו- 49ApoA1 נודד ב- 22 kDa. קיצורים: MOMP = חלבון קרום חיצוני גדול chlamydial; tNLP = חלקיק ננוליפופרוטאין טלודנדרימר; MOMP-tNLP = קומפלקס MOMP-tNLP; GFP = פלסמיד מקודד חלבון פלואורסצנטי ירוק; MW = סמן משקל מולקולרי; T = סך הכל ליזט ללא תאים; FT = זרימה; R1-R3 = aliquots תגובה ללא תאים; W1, W6 = כביסה 1 ו 6; E1-E7 = אלוציות 1 עד 7; Δ49ApoA1 = נגזרת ApoA1 של העכבר המתויג שלו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: כימות MOMP בדגימות MOMP-tNLP . (A) ג'ל SDS-PAGE מוכתם ברובי SYPRO לכימות MOMP. MOMP רקומביננטי עם ריכוז ידוע הועמס על הג'ל כדי לקבל את העקומה הסטנדרטית. כל נתיב הכיל 0.1 מיקרוגרם, 0.5 מיקרוגרם, 1.0 מיקרוגרם, 2.0 מיקרוגרם ו-4.0 מיקרוגרם MOMP. דגימות MOMP-tNLP שכומתו הועמסו על אותו ג'ל. (B) עקומת תקן ריכוז MOMP נוצרה באמצעות צפיפות. נקבעה משוואה המתייחסת לצפיפות הפסים המנורמלת ולכמות MOMP. המשוואה שימשה לחישוב תוכן MOMP בדגימות הלא ידועות. קיצורים: MOMP = חלבון קרום חיצוני גדול chlamydial; tNLP = חלקיק ננוליפופרוטאין טלודנדרימר; MOMP-tNLP = קומפלקס MOMP-tNLP; SDS-PAGE = נתרן דודצילסולפט פוליאקרילאמיד ג'ל אלקטרופורזה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
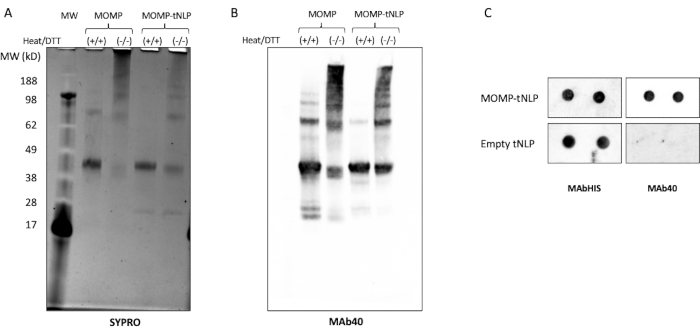
איור 3: MOMP-tNLP המיוצר ללא תאים מאפשר ל-MOMP ליצור מבנים מסדר גבוה יותר. (A) ג'ל SDS-PAGE של MOMP-tNLP עם וללא טיפול בחום ובחומר מחזר DTT, מוכתם ב-SYPRO Ruby. עם חום ו-DTT, MOMP הופיע בעיקר כרצועת מונומרים ב~40 kDa, מכיוון שהחום והחומר המחזר שברו את רוב מבנה ה-MOMP מסדר גבוה יותר. בהיעדר חום ו-DTT, היו להקות מסדר גבוה יותר, מה שמצביע על קונפורמציה של אוליגומרים MOMP. (B) כתם מערבי של MOMP-tNLP ו-MOMP בלבד, ללא טיפול וטיפול בחום וב-DTT. לאחר ההעברה, הממברנה נבדקה עם MAb40 (דילול 1:1,000). נצפתה תבנית פסים הדומה לג'ל המוכתם SYPRO Ruby, שאישרה כי הפסים בעלי המשקל המולקולרי הגבוה יותר היו אכן אוליגומרים מסוג MOMP. (C) כתם נקודה של MOMP-tNLP ודגימות tNLP ריקות (כפולות) שנבדקו עם MAb40 ו-MAbHIS. קיצורים: MOMP = חלבון קרום חיצוני גדול chlamydial; tNLP = חלקיק ננוליפופרוטאין טלודנדרימר; MOMP-tNLP = קומפלקס MOMP-tNLP; SDS-PAGE = נתרן דודצילסולפט פוליאקרילאמיד ג'ל אלקטרופורזה; DTT = dithiothreitol. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
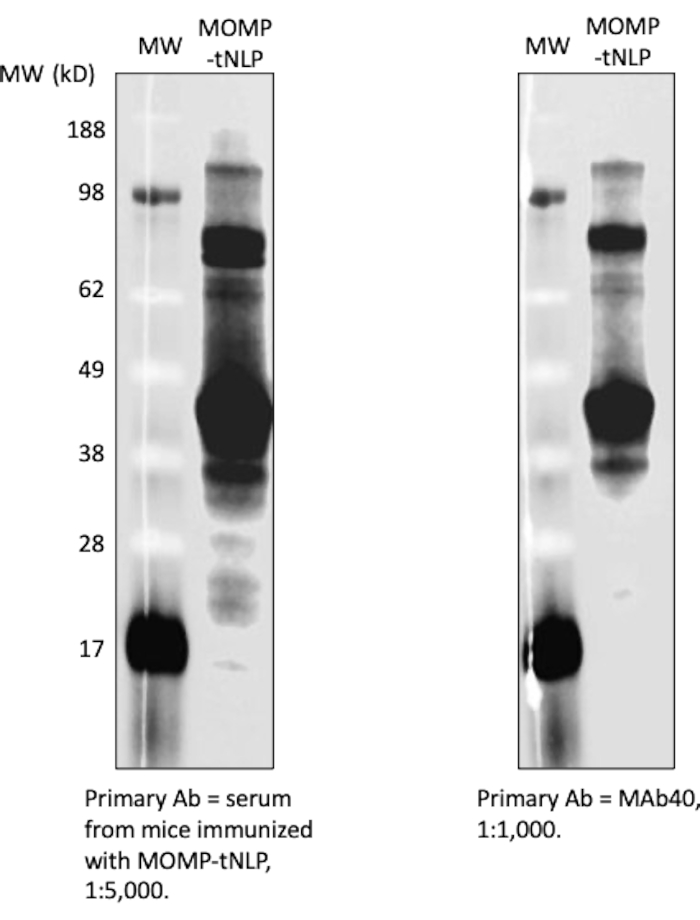
איור 4: MOMP-tNLP המיוצר ללא תאים הוא אימונוגני מאוד. סרום מעכברים מחוסנים הראה אות נוגד MOMP IgG חזק. MOMP-tNLP אדג'ובנט עם CpG + FSL-1 שימש לחיסון עכברים. סרה משישה עכברים מחוסנים נאספו, אוגמו ושימשו לבדיקת MOMP-tNLP. הסרום הצליח להיקשר ל-MOMP בבדיקת כתם מערבית והראה אות IgG חזק (משמאל). הכתם המערבי שהשתמש ב-MAb40 כנוגדן ראשוני (מימין) הראה פסים דומים, מה שמצביע על כך שהסרום הכיל IgG ספציפי ל-MOMP. קיצורים: MOMP = חלבון קרום חיצוני גדול chlamydial; tNLP = חלקיק ננוליפופרוטאין טלודנדרימר; MOMP-tNLP = קומפלקס MOMP-tNLP; CpG = אדג'ובנט CpG מהונדס כולסטרול; FSL-1 = אדג'ובנט ליפופילי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| שם מאגר | NaH2PO4 | NaCl | אימידזול | pH |
| מאגר מחייב | 50 מ"מ | 300 מ"מ | 10 מ"מ | 8.0 |
| חיץ כביסה | 50 מ"מ | 300 מ"מ | 20 מ"מ | 8.0 |
| Elution Buffer 1 | 50 מ"מ | 300 מ"מ | 250 מ"מ | 8.0 |
| Elution Buffer 2 | 50 מ"מ | 300 מ"מ | 500 מ"מ | 8.0 |
טבלה 1: רשימת מאגרים הדרושים לטיהור זיקה לניקל המפרטת ריכוזים של כל רכיב ו- pH.
| זמן ריצה | 50 דק' |
| קצב זרימה | 6.0 מ"ל/דקה |
| סוג מעבר צבע | בינארי |
| חיץ א' | 10 מ"מ TEAA ב H20 |
| חיץ B | MeCN |
| הדרגתי | % חיץ B |
| 0 דקות | 25% |
| 30 דק' | 60% |
| 30.5 דק' | 100% |
| 40 דק' | 100% |
| 40.5 דק' | 25% |
| 50 דק' | 25% |
טבלה 2: תנאים לטיהור HPLC שלב הפוך של CpG מהונדס כולסטרול. קיצורים: TEAA = triethylammonium אצטט; MeCN = אצטוניטריל.
| ליזט ללא תאים (מ"ל) | DMPC שומנים (מ"ג) | טלודנדרימר (מ"ג) | פלסמיד MOMP (מיקרוגרם) | תפוקת MOMP מטוהרת (מ"ג) |
| 1 | 4 | 0.4 | 15 | 0.5 |
| 2 | 8 | 0.8 | 30 | 1.1 |
| 3 | 12 | 1.2 | 45 | 1.6 |
| 5 | 20 | 2 | 75 | 2.7 |
טבלה 3: כמות השומנים, הטלודנדרימרים והפלסמידים המשמשים לתגובות נטולות תאים בקנה מידה שונה והתשואות המתאימות. קיצורים: MOMP = חלבון קרום חיצוני גדול chlamydial; DMPC = 1,2-dimyristoyl-sn-glycero-3-phosphocholine.
| יחסים של קלט פלסמיד, MOMP : Δ49ApoA1 | 1:1 | 5:1 | 10:1 | 25:1 | 50:1 | 100:1 | |
| יחסי כמות החלבון המיוצר, MOMP : Δ49ApoA1 | 0.02 | 0.32 | 0.64 | 3.46 | 6.55 | 20.04 | |
| מספר משוער של הכנסת MOMP לכל tNLP | 0.03 | 0.37 | 0.75 | 4.04 | 7.65 | 23.39 | |
טבלה 4: יחסי הפלסמיד בתגובה נטולת תאים וקצבי החדרת MOMP כתוצאה מכך. קיצורים: MOMP = חלבון קרום חיצוני גדול chlamydial; tNLP = חלקיק ננוליפופרוטאין טלודנדרימר; Δ49ApoA1 = נגזרת ApoA1 של העכבר המתויג שלו.
Discussion
כלמידיה היא הזיהום הנפוץ ביותר המועבר במגע מיני המשפיע על גברים ונשים כאחד. למרות שמחקר החיסונים על כלמידיה משתרע על פני עשרות שנים, חיסון בטוח ויעיל שניתן להרחיב אותו לייצור המוני נותר חמקמק13. ה-MOMP הכלמידיאלי נחשב למועמד המוביל כאנטיגן מגן לחיסון; עם זאת, MOMP הוא הידרופובי מאוד ונוטה לקיפול שגוי14,15. מחקר נוסף גילה כי MOMP קיים במצבים אוליגומריים החיוניים לאימונוגניות שלו11. להלן שיטת ביטוי משותף מאומתת ונטולת תאים המייצרת MOMP אוליגומרי שנוצר בתוך ננו-חלקיק tNLP כחיסון, עם תפוקות של כ-1.5 מ"ג MOMP מטוהר לכל 3 מ"ל ליזט. הליך זה שנאסף במלואו יכול להיות מורחב עוד יותר לייצור תעשייתי, להגדיל את הסיכויים שלה כגישה שימושית לייצור חיסונים.
פרסמנו בעבר על שימוש בביטוי חופשי של תאים כדי לייצר חלבוני ממברנה המשובצים בתוך NLPs 3,16, כמו גם ביטוי לתוך דיסקים מיוצבים טלודנדרימר. עם זאת, טכניקה אחרונה זו ייצרה חלקיקי חלבון קרום עם הטרוגניות גדולה יותר ומסיסות נמוכה יותר. 4 בנוסף, האימונוגניות של חלקיקי MOMP-telodendrimer אינה ברורה בהשוואה לחלקיקי MOMP-tNLP6.
הליך זה יכול להיות מותאם כדי להגדיל את הביטוי של חלבוני קרום חיידקי כי הם מועמדים מבטיחים כמו אנטיגנים לשימוש בחיסונים תת יחידה. לא רק שהליך זה מייצר חלבון קרום חיידקי מסיס, אלא שהמבנה הכולל של ננו-חלקיקים ניתן לשינוי נוסף באמצעות מגוון אדג'ובנטים של חיסון ליפופילי, כולל, אך לא רק, CpG מצומד לכולסטרול moiety או FSL-1. ביטוי של אנטיגנים מועמדים אחרים מחיידקים הוא אפשרי, אם כי ייתכן שיהיה צורך לחקור פרמטרים כגון טמפרטורת ביטוי, בחירת שומנים וסוג מערכת הביטוי כדי להשיג תפוקות אופטימליות.
בנוסף, בחירת פלסמיד ויחס הם קריטיים בתהליך זה. שני הפלסמידים המשמשים צריכים להיות בנויים מאותה עמוד שדרה. אם התוספות הן בערך באותו אורך, היחסים יכולים להתבסס על המסה של פלסמיד הוסיף, כמתואר כאן. עם זאת, יחס המבוסס על שומות ייתן תוצאות ניתנות יותר לשחזור, במיוחד בעת שינוי קנה המידה של התגובות. יחסים שפועלים היטב בתגובות בקנה מידה של מסך (< 0.5 מ"ל) עשויים שלא להיות ישימים לתגובות גדולות יותר ולדרוש מיטוב נוסף. חלבונים שאינם ממברנות עדיין ניתנים לביטוי באמצעות ערכות נטולות תאים, אך ייתכן שלא יזדקקו לננו-חלקיק שומנים (ביטוי משותף) כדי לייצר תוצר מסיס. בנוסף, בעוד פרוטוקול זה מתאר אדג'ובנטים עם CpG ו-FSL-1, מערכת זו ניתנת לניסוח עם אדג'ובנטים ליפופיליים אחרים או לערבוב עם אדג'ובנטים מסיסים לפי הצורך.
חיוני להימנע מזיהום בעת הגדרת תגובת הביטוי החופשי של התא, שכן זה יכול להשפיע על התשואות. כל תוספים לתגובה, כולל פלסמידים עצמם, צריך להיות טהור מאוד. בנוסף, החלבונים המבוטאים צריכים להיות במגע רק עם חומרים ותמיסות שאינם נקיים מזיהום אנדוטוקסין. זיהום אנדוטוקסין בניסוחים מועמדים יכול להוביל לתוצאות לא עקביות ומזויפות של בדיקות אימונולוגיות ויכול להזיק בכמויות מספיקות. אמנם לא מתואר כאן, טיהור נוסף בעקבות כרומטוגרפיית זיקה לניקל עשוי להיות נחוץ אם מזהמים רבים נצפים בשלבי ניתוח הבאים כגון באמצעות SDS-PAGE. ניתן להשיג זאת עם SEC, אם כי התנאים עשויים לדרוש אופטימיזציה על בסיס ניסוח על בסיס ניסוח.
Disclosures
המחברים מצהירים כי אין להם אינטרסים כלכליים מתחרים ידועים או קשרים אישיים שיכלו להשפיע לכאורה על העבודה המדווחת במאמר זה.
Acknowledgements
עבודה זו נתמכה על ידי מענק שירות בריאות הציבור R21 AI20925 ו- U19 AI144184 מהמכון הלאומי לאלרגיה ומחלות זיהומיות. עבודה זו בוצעה בחסות משרד האנרגיה של ארה"ב על ידי המעבדה הלאומית לורנס ליברמור תחת חוזה DE-AC52-07NA27344 [LLNL-JRNL-822525, LLNL-VIDEO-832788].
Materials
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) as powder | Avanti Polar Lipids | 850345 | |
| 1.5 mL endotoxin-free centrifuge tubes | Eppendorf | 2600028 | |
| 1 M Trizma hydrochloride solution | Millipore Sigma | T2194 | |
| Acetic acid, glacial, ACS reagent, ≥99.7% | Millipore Sigma | 695092 | |
| Bio-Dot apparatus | Bio-Rad | 1706545 | |
| Buffer Dam for XCell SureLock | Life Technologies | EI0012 | |
| C24 Incubator shaker | New Brunswick Scientific | ||
| Cell-Free Expression System: RTS 500 ProteoMaster E. coli HY Kit | BiotechRabbit | BR1400201 | |
| cOmplete His-Tag Purification Resin | Roche Molecular Diagnostics | 5893682001 | |
| cOmplete, EDTA-free Protease Inhibitor Cocktail | Roche Molecular Diagnostics | 4693132001 | |
| CpG-ODN1826 | Biosearch Technologies | T9449 | |
| D-(+)-Trehalose dihydrate | Millipore Sigma | 71509 | |
| Dialysis tubes D-Tube Dialyzer Maxi | Millipore Sigma | 71508-3 | |
| Disposable, polypropylene fritted columns 10 mL capacity | Bio-Rad | 7311550EDU | |
| Dulbecco’s Phosphate-buffered Saline (PBS) | Millipore Sigma | D8537 | |
| Electrophoresis Power Supply | |||
| Endosafe PTS cartridge | Thermo Fisher Scientific | NC9594798 | |
| Endosafe-PTS Testing System | Charles River | ||
| Gel wash solution: 10% methanol, 7% acetic acid | |||
| HCl and NaOH solutions for pH adjustment | |||
| HPLC with UV-vis diode array detector | Shimadzu | ||
| HyClone HyPure culture-grade water | VWR | 82007-328 | |
| iBlot 2 Dry Blotting System | Life Technologies | ||
| iBlot 2 Transfer Stacks, PVDF | Life Technologies | IB24001 | |
| Image Studio V2.0 software | Li-COR Biiosciences | ||
| Imidazole | Millipore Sigma | I5513 | |
| Immun-Blot PVDF Membrane | Bio-Rad | 1620177 | |
| LI-COR Odyssey Fc imager | Li-COR Biiosciences | ||
| Lyophilizer | Labconco | ||
| Methanol (≥99.9%) | Millipore Sigma | 34860 | |
| Microcentrifuge | |||
| Microwave oven | |||
| NanoDrop One/OneC Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | ND-ONE-W | |
| NuPAGE 4 to 12%, Bis-Tris, 1.0 mm | Life Technologies | NP0321 | |
| NuPAGE LDS Sample Buffer (4x) | Life Technologies | NP0007 | |
| NuPAGE MES SDS Running Buffer (20x) | Life Technologies | NP000202 | |
| NuPAGE Sample Reducing Agent (10x) | Life Technologies | NP0009 | |
| Odyssey Blocking Buffer in TBS containing 0.2% Tween 20 | Li-COR Biosciences | 927-50000 | |
| Orbital Shaker | |||
| PBS-T (1x PBS, 0.2% Tween 20, pH 7.4) | |||
| PEG5K-CA8 Telodendrimer (custom synthesis product) | |||
| pIVEX2.4d vector | Roche Molecular Diagnostics | ||
| Plasmid Maxi Kit | Qiagen | 12162 | |
| Primary antibody: MAb40 (monoclonal antibody to the variable domain 1 (VD1) of C. muridarum MOMP, de la Maza laboratory)4 | |||
| Primary antibody: MAbHIS, Penta-His antibody | Qiagen | 34660 | |
| Probe sonicator | |||
| Qubit 3.0 Fluorometer | Life Technologies | Q33216 | |
| Qubit Protein Assay Kit | Life Technologies | Q33212 | |
| Rainin Pipette tips: LTS 1000 µL | Rainin | 17002428 | |
| Rainin Pipette tips: LTS 20 µL | Rainin | 17002429 | |
| Rainin Pipette tips: LTS 200 µL | Rainin | 17002426 | |
| Rainin Pipettes | Rainin | ||
| Secondary antibody: IRDye 800CW goat (polyclonal) anti-mouse IgG (heavy and light) | Li-COR Biosciences | 926-32210 | |
| SeeBlue Plus2 Pre-stained Protein Standard | Life Technologies | LC5925 | |
| Sodium chloride NaCl | Millipore Sigma | S7653 | |
| Sodium phosphate monobasic NaH2PO4 | Millipore Sigma | S0751 | |
| Superdex 200, 5/150 GL column | Cytiva | GE28-9909-45 | |
| Synthetic diacylated lipoprotein-TLR2/6 FSL-1 | Invivogen | tlrl-fsl | |
| SYPRO Ruby Protein Gel Stain | Life Technologies | S12001 | |
| TWEEN 20 | Millipore Sigma | P1379 | |
| UV light source | |||
| Vacufuge Bench Top Centrifuge | Eppendorf | ||
| Vortexer | |||
| VWR 15 mL conicals (89039-666) | VWR | ||
| VWR 50 mL conicals (89039-656) | VWR | ||
| XCell SureLock Mini-Cell (Life Technologies ) | Life Technologies | EI0001 |
References
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: applications come of age. Biotechnology Advances. 30 (5), 1185-1194 (2012).
- Coleman, M. A., et al. Expression and association of the Yersinia pestis translocon proteins, YopB and YopD, are facilitated by nanolipoprotein particles. PLoS One. 11 (3), 0150166(2016).
- Cappuccio, J. A., et al. Cell-free co-expression of functional membrane proteins and apolipoprotein, forming soluble nanolipoprotein particles. Molecular & Cellular Proteomics: MCP. 7 (11), 2246-2253 (2008).
- He, W., et al. Controlling the diameter, monodispersity, and solubility of ApoA1 nanolipoprotein particles using telodendrimer chemistry. Protein Science. 22 (8), 1078-1086 (2013).
- He, W., et al. Cell-free production of a functional oligomeric form of a Chlamydia major outer-membrane protein (MOMP) for vaccine development. Journal of Biological Chemistry. 292 (36), 15121-15132 (2017).
- Tifrea, D. F., et al. Induction of protection in mice against a Chlamydia muridarum respiratory challenge by a vaccine formulated with the major outer membrane protein in nanolipoprotein particles. Vaccines. 9 (7), 755(2021).
- Cleveland, T. E., et al. Small-angle X-ray and neutron scattering demonstrates that cell-free expression produces properly formed disc-shaped nanolipoprotein particles. Protein Science. 27 (3), 780-789 (2018).
- Fischer, N. O., et al. Conjugation to nickel-chelating nanolipoprotein particles increases the potency and efficacy of subunit vaccines to prevent West Nile encephalitis. Bioconjugate Chemistry. 21 (6), 1018-1022 (2010).
- Fischer, N. O., et al. Colocalized delivery of adjuvant and antigen using nanolipoprotein particles enhances the immune response to recombinant antigens. Journal of the American Chemical Society. 135 (6), 2044-2047 (2013).
- Fischer, N. O., et al. Evaluation of nanolipoprotein particles (NLPs) as an in vivo delivery platform. PLoS One. 9 (3), 93342(2014).
- Pal, S., Peterson, E. M., de la Maza, L. M. Vaccination with the Chlamydia trachomatis major outer membrane protein can elicit an immune response as protective as that resulting from inoculation with live bacteria. Infection and Immunity. 73 (12), 8153-8160 (2005).
- Sun, G., et al. Structural and functional analyses of the major outer membrane protein of Chlamydia trachomatis. Journal of Bacteriology. 189 (17), 6222-6235 (2007).
- Hafner, L. M., Wilson, D. P., Timms, P. Development status and future prospects for a vaccine against Chlamydia trachomatis infection. Vaccine. 32 (14), 1563-1571 (2014).
- Findlay, H. E., McClafferty, H., Ashley, R. H. Surface expression, single-channel analysis and membrane topology of recombinant Chlamydia trachomatis Major Outer Membrane Protein. BMC Microbiology. 5, 5(2005).
- Sun, G., Pal, S., Weiland, J., Peterson, E. M., de la Maza, L. M. Protection against an intranasal challenge by vaccines formulated with native and recombinant preparations of the Chlamydia trachomatis major outer membrane protein. Vaccine. 27 (36), 5020-5025 (2009).
- He, W., et al. Cell-free expression of functional receptor tyrosine kinases. Scientific Reports. 5 (1), 12896(2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved