Method Article
Cuantificación del impacto potencial de los productos a base de glifosato en los microbiomas
En este artículo
Resumen
Los productos a base de glifosato (GBP) son los herbicidas de amplio espectro más comunes en todo el mundo. En este artículo, presentamos pautas generales para cuantificar el efecto de GBP en los microbiomas, desde experimentos de campo hasta análisis bioinformáticos.
Resumen
Los productos a base de glifosato (GBP) son los herbicidas de amplio espectro más comunes en todo el mundo. El objetivo del glifosato es la enzima 5-enolpiruvylshikimate-3-fosfato sintasa (EPSPS) en la vía del shikimato, que es prácticamente universal en las plantas. La inhibición de la enzima detiene la producción de tres aminoácidos esenciales: fenilalanina, tirosina y triptófano. EPSPS también está presente en hongos y procariotas, como arqueas y bacterias; por lo tanto, el uso de GBP puede tener un impacto en la composición del microbioma de suelos, plantas, herbívoros y consumidores secundarios. Este artículo tiene como objetivo presentar pautas generales para evaluar el efecto de GBP en los microbiomas, desde experimentos de campo hasta análisis bioinformáticos y proporcionar algunas hipótesis comprobables. Se presentan dos experimentos de campo para probar el GBP en organismos no objetivo. En primer lugar, se muestrean y analizan los microbios asociados a plantas de 10 parcelas de control replicadas y de tratamiento GBP que simulan el cultivo sin labranza. En el segundo experimento, se obtuvieron muestras de parcelas experimentales fertilizadas por estiércol de aves de corral que contenía residuos de glifosato o estiércol de control no tratado. El análisis bioinformático de secuencias de proteínas EPSPS se utiliza para determinar la sensibilidad potencial de los microbios al glifosato. El primer paso para estimar el efecto de GBP en los microbiomas es determinar su sensibilidad potencial a la enzima diana (EPSPS). Las secuencias microbianas se pueden obtener de repositorios públicos o mediante amplificación por PCR. Sin embargo, en la mayoría de los estudios de campo, la composición del microbioma se ha determinado en función de marcadores de ADN universales como el ARNr 16S y el espaciador transcrito interno (ITS). En estos casos, la sensibilidad al glifosato solo se puede estimar a través de un análisis probabilístico de secuencias EPSPS utilizando especies estrechamente relacionadas. La cuantificación de la sensibilidad potencial de los organismos al glifosato, basada en la enzima EPSPS, proporciona un enfoque sólido para futuros experimentos para estudiar mecanismos resistentes objetivos y no objetivo.
Introducción
El uso intensivo de plaguicidas en la agricultura moderna es claramente un importante contribuyente a la disminución de la biodiversidad1. Este documento se centra en el glifosato porque los productos a base de glifosato (GGB) se han convertido en los pesticidas más utilizados a nivel mundial debido a su eficiencia y precio asequible 2,3. Además de matar malezas en los campos agrícolas, los GMP se usan comúnmente en silvicultura, entornos urbanos y huertos familiares; además, se han proclamado como no tóxicos para los organismos no objetivo si se utilizan de acuerdo con las instrucciones del fabricante. Sin embargo, un número cada vez mayor de estudios recientes han revelado que los residuos de glifosato y sus productos de degradación pueden ser retenidos y transportados en los suelos, lo que tiene efectos en cascada sobre organismos no objetivo 4,5,6,7,8 . Los efectos del glifosato no se limitan solo a las plantas, la vía del shikimato también está presente en muchos hongos y procariotas. El glifosato se dirige a la enzima 5-enolpiruvylshikimate-3-fosfato sintasa (EPSPS) en la vía del shikimato, también conocida como aroA9. Esta enzima está en el centro de la vía del shikimato en la síntesis de los tres aminoácidos aromáticos esenciales (fenilalanina, tirosina y triptófano), y está presente en la mayoría de los procariotas, plantas y hongos10,11. Algunas especies microbianas han desarrollado resistencia parcial o absoluta al glifosato por medio de varios mecanismos, incluyendo mutaciones en las secuencias EPSPS. Por lo tanto, se ha sugerido que el uso de GBPs puede tener un efecto directo sobre los microbiomas de plantas y animales, incluido el microbioma intestinal humano 12,13,14. Sin embargo, el uso de GBP puede tener un impacto adverso en prácticamente cualquier función y servicio del ecosistema que dependa de microbios y procesos facilitados por microbios. Las amenazas consiguientes pueden referirse a los procesos bioquímicos del suelo, la biología de la polinización y el bienestar animal y humano. Esto requiere una comprensión más completa de cómo el glifosato afecta las vías y métodos de shikimate para evaluar la sensibilidad de los microbios al glifosato.
En este protocolo, presentamos una tubería para probar el efecto del glifosato y la GBP en el microbioma, desde experimentos de campo hasta análisis bioinformáticos. Describimos en detalle un método bioinformático recientemente publicado que se puede utilizar para determinar la sensibilidad potencial de los organismos al glifosato12. Según el conocimiento de los investigadores, esta es la primera y hasta ahora, la única herramienta bioinformática para evaluar la sensibilidad intrínseca de la enzima EPSPS al componente activo de los GMP. Este método bioinformático se basa en la detección de marcadores de aminoácidos conocidos en la enzima diana del glifosato (EPSPS)12. La tubería se divide en cinco fases de trabajo principales (Figura 1): 1) una breve introducción a dos experimentos de campo para probar el efecto de los GBP, 2) un breve resumen de los análisis del microbioma (gen 16S rRNA, ITS y EPSPS ), 3) recopilación de secuencias EPSPS de repositorios públicos, 4) determinación de la sensibilidad potencial de los organismos al glifosato, y 5) evaluación de la clase EPSPS a partir de marcadores microbianos universales (16S rRNA e ITS).
Protocolo
1. Dos experimentos de campo para probar el efecto de los GGB
NOTA: Este protocolo presenta dos ejemplos de diseños experimentales de campo para probar el efecto de los GGB en los microbios asociados a las plantas. Ambos experimentos se llevaron a cabo en campos de retirada de tierras sin antecedentes de herbicidas o usos agrícolas en el Jardín Botánico de la Universidad de Turku Ruissalo en Finlandia (60º26'N, 22º10'E). El suelo es arcilloso arenoso con una alta proporción de materia orgánica.
- Experimento 1
NOTA: Este experimento fue diseñado para simular las prácticas agrícolas generales de la agricultura sin labranza con aplicaciones de GBP antes y después de la temporada de crecimiento para combatir las malas hierbas.- Dividir el campo experimental en 10 parcelas de control replicadas y de tratamiento GBP (23 m x 1,5 m) con franjas tampón de vegetación entre las parcelas (en este estudio en primavera de 201415) (Figura 2).
- Asegúrese de que las parcelas se labran con un timón rotativo a una profundidad de 5 cm y se traten dos veces al año. Aquí, las parcelas se trataron a principios (mayo) y finales (octubre) de la temporada de crecimiento.
- Tratar las parcelas de control con agua del grifo (5 L/parcela) y las parcelas GBP con GBP comercial (concentración de glifosato 450 g· L-1, tasa de aplicación 6,4 L·ha-1 en 5 L de agua del grifo por parcela) para imitar la dosis máxima permitida de glifosato en las prácticas agrícolas (3 kg·ha-1).
- Aplique los tratamientos con un tanque de presión operado a mano que tiene un pulverizador manual. Dos semanas después de la solicitud de GBP, siembre avena (Avena sativa), habas (Vicia faba), colzas de nabo (Brassica rapa subsp. oleifera) y patatas vegetales (Solanum tuberosum) en las parcelas de acuerdo con las prácticas agrícolas.
- Durante la temporada de crecimiento, deshierbe a mano las parcelas para mantener la competencia de la planta y la estructura del suelo lo más similar posible en las parcelas de control y tratadas con GBP.
- Muestree la microbiota de plantas experimentales. En este estudio, la microbiota se muestreó consecutivamente desde 2017 hasta 2020 en las parcelas de tratamiento tratadas con GBP y de control una vez por temporada de crecimiento en el transcurso del estudio.
- Recoger diez réplicas de las muestras de plantas (raíz y hoja) del campo, colocarlas inmediatamente en hielo y llevarlas al laboratorio para su posterior procesamiento, como se describe en la sección 2.1.
- Experimento 2
NOTA: Este experimento fue diseñado para probar los riesgos asociados con la economía alimentaria circular; más precisamente, fue diseñado para examinar las consecuencias de los residuos de GBP en el estiércol aplicado como fertilizante a las plantas de cultivo2 (Figura 3).- Recolecte camas, incluidas virutas de madera, heces y algunos alimentos derramados, de codornices alimentadas con alimentos contaminados con GBP o de control en un experimento de aviario de 12meses 16,17.
NOTA: El alimento contaminado con GBP consistió en alimento orgánico para pollos ponedores combinado con un equivalente de 160 mg de glifosato / kg, que corresponde a una ingesta diaria de 12-20 mg de glifosato por kilogramo de masa corporal en codornices japonesas adultas16,17. - Para su validación, envíe las muestras a un laboratorio acreditado para mediciones de concentración de glifosato en seis lotes de alimento.
- Además, mida los residuos de glifosato en muestras de excrementos de codornices después de 12 meses de exposición. El grupo de control fue alimentado con el mismo alimento orgánico sin adición de GBP16,17.
- Durante el experimento del aviario, cambie las camas quincenalmente. Recoja las camas usadas regularmente de 8 a 12 meses de exposición del tratamiento y los controles de GBP, acumule por tratamiento y guárdela en recipientes cerrados en una sala de almacenamiento seca y oscura a 6 ° C antes de usarlas como fertilizante.
- Distribuya 12 L de las camas manualmente en cada una de las parcelas de control de 18 GBP y 18 (tamaño 1 m x 1 m) en una cuadrícula de tablero de ajedrez de 6 x 6 en el campo experimental en dos puntos de tiempo. En este estudio, las camas se extendieron en agosto de 2018 y en mayo de 2019.
- Envíe las muestras de ropa de cama a un laboratorio acreditado para las mediciones de concentración de glifosato directamente después de su propagación (en este estudio en mayo de 2019).
- Planta plantas perennes de hierba y fresa en cada parcela para estudiar su microbiota radicular y foliar.
NOTA: En este estudio se plantaron cuatro plantas de hierba perenne (Festuca pratensis) y dos plantas de fresa (Fragaria x vescana) en cada parcela y se estudiaron por su microbiota radicular y foliar.
- Recolecte camas, incluidas virutas de madera, heces y algunos alimentos derramados, de codornices alimentadas con alimentos contaminados con GBP o de control en un experimento de aviario de 12meses 16,17.
2. Análisis de microbioma (gen 16S rRNA, ITS y EPSPS )
NOTA: La mayoría de los estudios de microbioma se basan en el análisis del gen 16S rRNA para regiones bacterianas y de espaciador transcrito interno (ITS) para comunidades fúngicas utilizando tecnologías de secuenciación de próxima generación. Por lo tanto, el documento no tiene información sobre el tipo de EPSPS. Las secuencias EPSPS de miles de especies están disponibles en repositorios públicos (Sección 3 del Protocolo) (Figura 4).
- Gen 16S rRNA
- A partir de las muestras de hojas y raíces separadas recolectadas en los experimentos descritos anteriormente, identifique los microbios endófitos (es decir, los microbios que viven dentro de los tejidos de las plantas).
- Lave las muestras de plantas con agua del grifo y luego esterilícelas para eliminar los microbios epífitos (es decir, los microbios en la superficie de los tejidos de las plantas). Esterilizar con lejía al 3% durante 3 min, seguido de una solución de etanol al 70% durante 1 min, y lavar tres veces con agua ultrapura en autoclave durante 1 min cada una.
- Congelar las muestras a -80 °C hasta la extracción de ADN genómico.
- Realice la extracción de ADN genómico utilizando un kit de extracción de ADN de planta disponible comercialmente siguiendo el protocolo del fabricante.
- Dirigirse a las regiones variables V6-V8 del gen 16S rRNA a partir de muestras de ADN extraídas utilizando un enfoque anidado con cebadores discriminadores que se unen específicamente al ADN bacteriano18, minimizando así la amplificación del ADN de la planta huésped.
- Después de tres rondas de reacción en cadena de la polimerasa (PCR), etiquete el gen objetivo con secuencias de código de barras y adaptador para prepararlo como plantilla para la secuenciación. Siga los pasos 2.1.7- 2.1.11 para la amplificación por PCR
- Prepare la mezcla maestra de PCR para el número requerido de muestras de modo que cada reacción tenga un volumen total de 30 μLof y conste de 30 ng de ADN, 1x tampón de PCR, 0,2 mM de dNTP, 0,3 μM de cada imprimación y 2000 U/mL de ADN polimerasa. Siga el mismo paso para la segunda y tercera ronda de PCR.
- Para la primera ronda de PCR, use cebadores 799F19 y 1492R (modificados de20) (Tabla 1). Configure el perfil de amplificación en el termociclador (desnaturalización inicial de 3 minutos a 95 °C, seguido de 35 ciclos de desnaturalización a 95 °C durante 45 s, recocido a 54 °C durante 45 s y extensión a 72 °C durante 1 min). Realizar la extensión final a 72 °C durante 5 min.
- Como plantilla para la segunda ronda de PCR, verifique la amplificación por electroforesis (5 μL de los productos de PCR en gel de agarosa al 1,5%) y luego diluya el resto 25 μL del producto PCR en agua ultrapura en autoclave en la proporción de 1:10.
- Repetir PCR con las plantillas de PCR diluidas y cebadores uni-1062F21 y uni-1390R22 (Tabla 1). Mantener las mismas condiciones de reacción de PCR y perfil de amplificación (paso 2.1.8), excepto reduciendo el número de ciclos a 25.
- Diluya los productos de PCR resultantes en agua ultrapura en autoclave en la proporción de 1: 1. Realice la tercera ronda de PCR para etiquetar los productos con los códigos de barras y la secuencia del adaptador P1 con 8 ciclos del mismo perfil de PCR como se menciona en el paso 2.1.8.
- Preparación de la biblioteca
- Verificar la concentración y calidad de los productos de PCR en un bioanalizador y agrupar los volúmenes que constituyen 30 ng de ADN de cada muestra en un tubo de 1,5 mL para preparar una biblioteca equimolar.
- Seleccione los amplicones de tamaño 350-550 pb por fraccionamiento de tamaño utilizando un sistema automatizado de selección de tamaño de ADN en un cassette de gel de agarosa. Tenga en cuenta que esto también elimina los amplicones no específicos y los reactivos de PCR de la biblioteca. Recoja el eluido que consiste en amplicones del tamaño especificado en un vial en el cassette, lo que resulta en una biblioteca de genes 16S rRNA purificada.
- Pipetee el eluido en un tubo de 1,5 ml y verifique la pureza y la concentración en el bioanalizador. Diluir la biblioteca de ADN utilizando agua ultrapura en autoclave a una concentración final de 26 pM; la muestra está lista para la secuenciación.
- SU
NOTA: La región ITS se amplifica utilizando cebadores específicos de ITS (Tabla 1), y el producto de PCR resultante se etiqueta con códigos de barras y una secuencia de adaptador P1 para la secuenciación.- Preparar la mezcla maestra de PCR según el mismo protocolo mencionado en la sección 2.1 con cebadores ITS .
- Establezca el perfil de amplificación en el termociclador como desnaturalización inicial de 5 minutos a 95 °C, seguido de 35 ciclos de desnaturalización, recocido y extensión a 95 °C durante 30 s, 55 °C durante 30 s, 72 °C durante 1 min, respectivamente, y extensión final 72 °C durante 7 min.
- Analizar 5 μL del producto de PCR en gel de agarosa al 1,5 % y diluir los 25 μL restantes a 1:10 utilizando agua ultrapura en autoclave. Utilice el producto de PCR diluido como plantilla para la segunda ronda de PCR.
- Prepare la mezcla maestra de PCR para el número requerido de muestras (consulte el paso 2.1.6) con cebadores hacia adelante etiquetados con códigos de barras y cebadores inversos etiquetados con el adaptador P1. Amplifique con el mismo perfil de amplificación que en el paso 2.3.2, excepto con 8 ciclos.
- Preparar los productos de PCR resultantes para la secuenciación según los protocolos mencionados en la sección 2.2.
- Gen EPSPS
- Secuenciar y analizar los genes EPSPS de los microbios.
NOTA: En el interés de encontrar si la exposición a GBP cambió la composición de los microbios sensibles al glifosato y resistentes en la comunidad, los genes EPSPS de los microbios deben secuenciarse y analizarse. Por lo tanto, se recopilaron 353 secuencias de genes EPSPS de una amplia colección de taxones microbianos en la base de datos Alignable Tight Genomic Clusters (ATGC), y todas las secuencias de proteínas se alinearon22. Estas alineaciones están disponibles en la base de datosATGC 23 y se pueden utilizar para generar cebadores de regiones conservadas. Una herramienta bioinformática fácil de usar está diseñada para identificar regiones conservadas a partir de una alineación de secuencias múltiples, y esto está disponible en la página de investigación de Pere Puigbo página24. Sin embargo, está fuera del alcance de esta publicación proporcionar una descripción detallada de este servidor web. Sin embargo, en la Figura 4 se proporciona un protocolo prospectivo para utilizar estos cebadores para la amplificación del gen EPSPS para encontrar la sensibilidad del microbioma al glifosato.
- Secuenciar y analizar los genes EPSPS de los microbios.
3. Recopilación de secuencias de proteínas EPSPS de repositorios públicos
- Secuencias EPSPS para ser utilizadas en estudios de macroevolución
- Recopilar proteínas EPSPS de repositorios públicos como PFAM23 (una base de datos de familias de proteínas25), GenBank24 (una base de datos de genes, genomas y proteínas26 ), COG25 (Clusters of Orthologous Groups27; una base de datos de proteínas ortólogas de arqueas y bacterias); y PDB26 (Protein Data Bank28; una base de datos de estructuras de proteínas).
NOTA: Un estudio reciente realizado por los investigadores mostró que estas proteínas podrían utilizarse para realizar análisis microevolutivos y comparativos del efecto potencial del glifosato en organismos que tienen la vía shikimato12. Los autores han desarrollado un sitio web fácil de usar que recopila información sobre decenas de miles de secuencias de proteínas EPSPS29, incluido un conjunto de datos curado manualmente de proteínas del microbioma intestinal humano12. La información en estos conjuntos de datos precalculados incluye la clasificación actual de EPSPS en supuestos sensibles y resistentes al glifosato, información taxonómica sobre especies, anotaciones del sitio activo de EPSPS y enlaces a bases de datos PDB y NCBI. Además, el servidor web incluye los códigos de identificación del EPSPS y enlaces a varias bases de datos externas (Tabla 2).
- Recopilar proteínas EPSPS de repositorios públicos como PFAM23 (una base de datos de familias de proteínas25), GenBank24 (una base de datos de genes, genomas y proteínas26 ), COG25 (Clusters of Orthologous Groups27; una base de datos de proteínas ortólogas de arqueas y bacterias); y PDB26 (Protein Data Bank28; una base de datos de estructuras de proteínas).
- Secuencias EPSPS para ser utilizadas en estudios de microevolución ATGC
NOTA: Los repositorios generales de secuencias de proteínas son útiles para realizar estudios comparativos entre organismos relativamente distantes; sin embargo, el efecto potencial del glifosato es relativamente reciente desde un punto de vista evolutivo. Por lo tanto, en algunos estudios, es necesario comparar especies estrechamente relacionadas (por ejemplo, diferentes cepas de la misma especie bacteriana) para determinar el efecto del glifosato14. En estos casos, la base de datos de Alignable Tight Genomic Clusters (ATGC)30, que contiene una lista completa de genomas arqueales y bacterianos estrechamente relacionados, es un recurso más adecuado. La base de datos ATGC contiene información de varios millones de proteínas de miles de genomas organizados en cientos de grupos30. Cada grupo de genomas es alineable (los genomas comparten sintenia sobre ≥85% de sus longitudes) y apretado (tiene una tasa de sustitución sinónima por debajo de la saturación). Los investigadores utilizaron el conjunto de datos ATGC en un estudio reciente para analizar los cambios microevolutivos en las proteínas EPSPS14. Los siguientes pasos son necesarios para identificar la secuencia de proteínas EPSPS en el ATGC:- Descargue toda la base de datos de ATGC desde el enlace31 y todas las proteínas del COG0128 (código correspondiente a las proteínas EPSPS en la base de datos)32 en un proyecto local.
NOTA: Si los investigadores / experimentadores tienen su sede en Finlandia, el Centro CSC-IT para la Ciencia33 proporciona almacenamiento e instalaciones de software. Es importante reunir todas las secuencias en formato FASTA. - Se construyó una base de datos de explosión del COG0128 que contiene ortólogos de la proteína EPSPS en un conjunto representativo de especies de procariotas. El CSC tiene el programa blast34 preinstalado, permitiendo el uso del comando makeblastdb -in COG0128.fa -dbtype prot para crear una base de datos de referencia de secuencias EPSPS.
- Asigne la base de datos ATGC a COG0128.fa (proteínas EPSPS) utilizando una búsqueda iterativa de blastos con el comando blastp -query [ATGC_X.fa] -db [COG0128.fa] -max_target_seqs 1 -outfmt 6 -out tmpfile -evalue 1e-150.
- Como resultado, crea un conjunto de datos de secuencias de proteínas EPSPS dentro de cada una. Un conjunto de datos precalculado de secuencias de proteínas EPSPS estrechamente relacionadas de la base de datos ATGC está disponible29.
- Descargue toda la base de datos de ATGC desde el enlace31 y todas las proteínas del COG0128 (código correspondiente a las proteínas EPSPS en la base de datos)32 en un proyecto local.
4. Algoritmo para determinar la sensibilidad potencial de los organismos al glifosato (servidor web EPSPSClass: entradas, procesamiento y salidas)
NOTA: Los investigadores han implementado un servidor fácil de usar que está disponible gratuitamente a los 29 años para determinar la clase de secuencias de proteínas EPSPS12,35. El servidor solo requiere una entrada de secuencia de proteínas en formato FASTA para determinar el porcentaje de identidad para cada una de las clases epsps y su sensibilidad potencial al glifosato. Además, los usuarios pueden utilizar el servidor web para probar sus propias secuencias de referencia y marcadores de aminoácidos. En primer lugar, el algoritmo (Figura 5) alinea secuencias de consulta y secuencias de referencia utilizando un programa de alineación de secuencias múltiples35 para determinar las posiciones de aminoácidos. Luego, busca la presencia de marcadores de aminoácidos para identificar la clase EPSPS (I, II, III o IV) de la secuencia de consulta.
- Introduzca una secuencia de proteínas EPSPS en formato FASTA en el cuadro de texto de entrada para identificar la clase de la enzima (Figura 6A) y pulse Enviar.
- Evaluar la sensibilidad potencial de la secuencia de consulta al glifosato (Figura 6B-E) desde el servidor proporcionó resultados:
Salida 1: Fracción de marcadores de aminoácidos (es decir, identidad) presentes en las secuencias de consulta (clase I, II y IV) y el número de motivos (clase III).
Salida 2: Alineaciones de las secuencias de consulta y referencia basadas en residuos de marcadores.
Salida 3: Alineaciones completas por pares de las secuencias de consulta y referencia.
Salida 4: Secuencias de referencia EPSPS: Vibrio cholerae(vcEPSPS, clase I), Coxiella burnetii(cbEPSPS, clase II), Brevundimonas vesicularis(bvEPSPS, clase III), Streptomyces davawensis(sdEPSPS, clase IV). - Al final de la página de salida, busque enlaces a herramientas externas como blastp y dominios conservados para analizar más a fondo la secuencia EPSPS de consulta (Figura 6F).
5. Evaluación de la clase EPSPS a partir de marcadores microbianos universales (ARNr 16S e ITS )
NOTA: La mayoría de los estudios de microbioma se basan en el análisis del ARNr 16S y/o ITS36. En tales casos, no es posible realizar un análisis directo de la secuencia EPSPS. Por lo tanto, es necesario un enfoque probabilístico para estimar la sensibilidad potencial de los organismos al glifosato. Este análisis es sencillo y proporciona una estimación razonable del tipo de secuencias EPSPS en un proyecto de microbioma. El proceso se divide en 3 pasos (Figura 7 y Figura 8):
- Identifique secuencias EPSPS de repositorios públicos. La clase EPSPS de un conjunto de datos completo de secuencias representativas ha sido compilada y precalculada a partir de PFAM37, GenBank38, COG39, PDB40, ATGC30. Acceda a estos conjuntos de datos desde la página principal del servidor EPSPSClass, que contiene información taxonómica y la clase EPSPS de más de 50.000 secuencias (Figura 7).
- Mida la altura de las plantas experimentales quincenalmente durante la temporada de crecimiento y pese la biomasa sobre el suelo de las plantas al final de la temporada de campo para comparar el crecimiento de las plantas en GBP y las parcelas de control.
NOTA: Los análisis de microbiota de los experimentos de campo aún no se han analizado completamente. - Utilice una hoja de cálculo para mapear las OTU bacterianas (basadas en ARNr 16S o ITS) de experimentos de microbioma en conjuntos de datos precalculados.
NOTA: Estudios anteriores han demostrado que la clase EPSPS (es decir, la sensibilidad intrínseca al glifosato) está altamente conservada dentro de un grupo filogenético14. Por lo tanto, es relativamente seguro suponer que las especies estrechamente relacionadas de taxones altamente conservados pueden tener respuestas EPSPS similares al glifosato (Figura 8). - En la misma hoja de cálculo, calcule la sensibilidad intrínseca al glifosato, basándose en una puntuación probabilística (S = s / (s + r + u) donde S: Puntuación de sensibilidad; s: número de secuencias potencialmente sensibles; r: número de secuencias potencialmente resistentes; u: número de secuencias no clasificadas) calculada a partir de secuencias EPSPS conocidas en bases de datos públicas.
NOTA: Esta puntuación varía de 0 (no se encuentran secuencias EPSPS sensibles en un taxón) a 1 (todas las secuencias de un taxón son sensibles al glifosato) (Figura 8). Además, hay valores intermedios, es decir, especies con cepas sensibles, resistentes o desconocidas.
Resultados
El objetivo de este protocolo es proporcionar una tubería general, desde experimentos de campo hasta análisis bioinformáticos, que cuantifique la sensibilidad potencial de los organismos al herbicida glifosato. En el Experimento 2, la concentración promedio de glifosato en el alimento de codornices fue de 164 mg / kg y la concentración promedio de glifosato de las muestras de excrementos (orina y materia fecal combinadas) fue de 199 mg / kg. Las camas recolectadas de codornices alimentadas con alimentos contaminados con GBP tenían, en promedio, 158 mg / kg y camas de control que medían 0,17 mg / kg de glifosato (Tabla 3). En los experimentos de campo, las especies de plantas respondieron de manera diferente a los residuos de glifosato en los suelos (sección 1). La biomasa de avena y colza fue mayor en los suelos de control en comparación con los suelos tratados con GBP. Sin embargo, los frijoles faba y la papa parecieron beneficiarse del tratamiento gbp al final de la temporada de crecimiento15. El glifosato en estiércol de aves de corral disminuyó el crecimiento de las plantas en gramíneas (Festuca pratensis) y fresas (Fragaria x vescana) (sección 1). Los análisis de microbiota de los experimentos de campo aún no se han analizado completamente y no se presentan aquí (sección 2). Los resultados de este protocolo, cuando se leen directamente (como se muestra en las secciones 3 y 4) o indirectamente (sección 5), proporcionan una medida de la proporción de organismos potencialmente sensibles y resistentes al glifosato en un conjunto de datos (Figura 9). El uso de este método se probó con una colección de secuencias de proteínas EPSPS de especies microbianas del microbioma intestinal humano central que se obtuvieron de repositorios públicos12. En el estudio, se analizaron 890 cepas de las 101 especies bacterianas más abundantes con el método EPSPSClass para cuantificar la proporción de bacterias sensibles y resistentes. Los resultados mostraron que el 54% de las especies en el microbioma intestinal humano central son potencialmente sensibles al glifosato12. Esta tendencia también se observa en la mayor parte del mundo procariota; además, en eucariotas (principalmente plantas y hongos), la proporción de especies potencialmente sensibles es aún mayor12. Además, hemos utilizado este método para cuantificar los cambios en la sensibilidad de la proteína EPSPS a nivel microevolutivo (Figura 10)14. Se identificaron cambios en el estado de sensibilidad en 12 de los 32 grupos estrechamente relacionados de procariotas analizados (Tabla 4)14. Por lo tanto, el uso continuo de los GBP puede producir disbiosis microbiana (es decir, un desequilibrio de especies bacterianas sensibles y resistentes) en microbiomas de plantas, animales y suelos. Además, se ha planteado la hipótesis de que un aumento de las bacterias resistentes al glifosato puede promover microbiomas multirresistentes 14,41,42. Por lo tanto, este protocolo arroja luz sobre la interpretación de todos estos escenarios, ya que el método de clasificación EPSPS proporciona una estimación directa de la sensibilidad intrínseca de los microbiomas al glifosato. Debido a la sensibilidad intrínseca de la proteína EPSPS al glifosato que se conserva filogenéticamente14, es posible extrapolar los resultados de los conjuntos de datos existentes en microbiomas desconocidos (Figura 8).
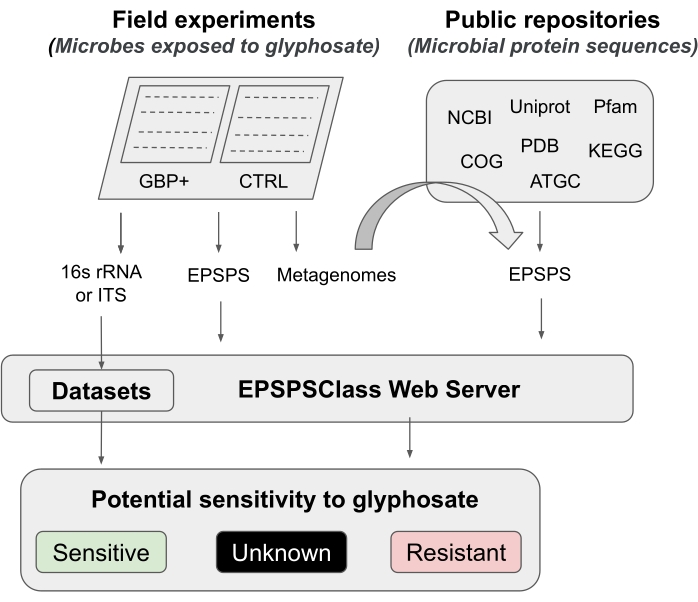
Figura 1: Pipeline general Esta es una tubería general para analizar la sensibilidad a GBP desde experimentos de campo hasta análisis bioinformático. Haga clic aquí para ver una versión más grande de esta figura.
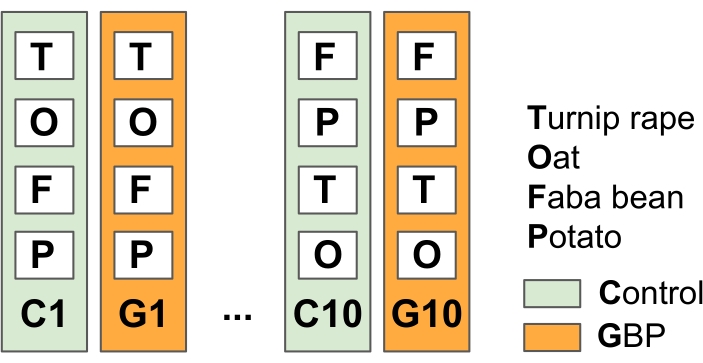
Figura 2: Experimento de campo 1 para probar los efectos de los residuos de GBP en los microbios asociados a las plantas de cultivo. El campo experimental consiste en alternar 10 parcelas de control y 10 parcelas de tratamiento GBP (23 m x 1,5 m) con tiras tampón de 1,5 m entre parcelas. Dos veces al año desde 2014, las parcelas GBP fueron tratadas con GBP comercial (concentración de glifosato 450 g L-1, tasa de aplicación 6,4 L ha-1 en 5 L de agua del grifo por parcela) y las parcelas de control con la misma cantidad de agua del grifo sin glifosato. Los tratamientos se aplicaron con un tanque de presión operado a mano utilizando una campana de plástico en la punta del rociador para proteger a los GGB de propagarse fuera de las parcelas de tratamiento. Después de un período de seguridad de dos semanas después de la aplicación de GBP, se sembraron avena (Avena sativa), habas (Vicia faba) y colzas de nabo (Brassica rapa subsp. oleifera) y se plantaron papas (Solanum tuberosum) en las parcelas. Las muestras de microbiota de las plantas de cultivo estudiadas, hojas y raíces, se recogieron varias veces desde el inicio del experimento en 2014. Haga clic aquí para ver una versión más grande de esta figura.
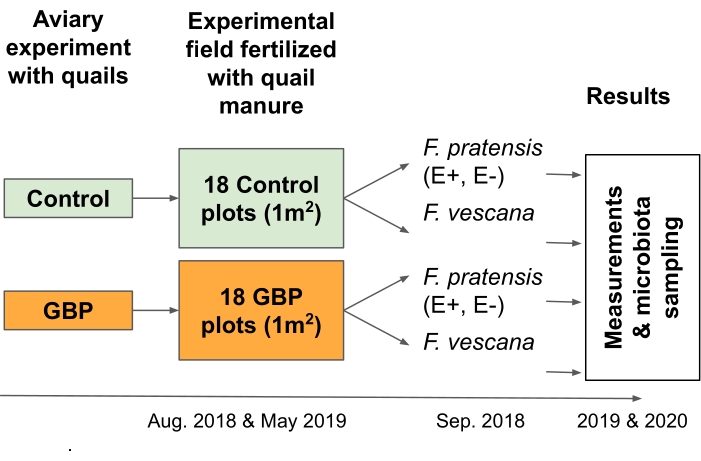
Figura 3: El experimento de campo 2 probó las consecuencias de los residuos de GBP en el fertilizante de estiércol para dos cultivos perennes y su microbiota asociada. Las camas recolectadas de un experimento de aviario de 12 meses con codornices japonesas alimentadas con alimentos controlados o contaminados con GBP se utilizaron como fertilizante de estiércol en un experimento de campo. El campo experimental consistió en 18 parcelas de control y 18 GBP (1 m x 1 m) dispuestas en una cuadrícula de tablero de ajedrez de 6 x 6. Las camas se extendieron en el campo experimental dos veces, en agosto de 2018 y mayo de 2019 (25 L / parcela). Las parcelas de control se fertilizaron con lechos recolectados de codornices alimentadas con alimento de control y parcelas de GBP con lechos de codornices alimentados con alimento contaminado con GBP. Los residuos de glifosato en las camas de control fueron de 0,17 mg/kg de glifosato y en la ropa de cama GBP, la cantidad fue de 158 mg/kg de glifosato. Dos Endófitos-simbióticos (E+), dos Endófitos libres (E-) Festuca pratensis y dos Fragaria x vescana fueron plantados por parcela en septiembre de 2018, aproximadamente un mes después de la propagación de las primeras camas. Las mediciones del rendimiento y la aptitud de las plantas, así como el muestreo de la microbiota asociada a la raíz y las hojas, se realizaron durante dos temporadas de crecimiento consecutivas (2019 y 2020). Haga clic aquí para ver una versión más grande de esta figura.
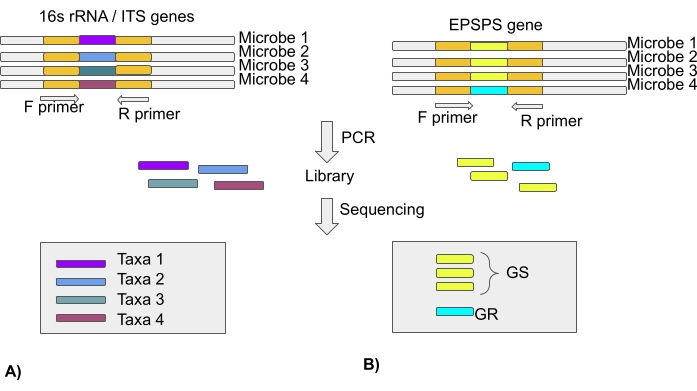
Figura 4: Análisis de los taxones microbianos utilizando el gen 16S rRNA/región ITS y sensibilidad de los microbiomas al glifosato utilizando el gen EPSPS . (A) Análisis de secuencias 16S rRNA o ITS para identificar taxones microbianos. (B) Análisis de secuencias epsps para identificar la sensibilidad de los microbios al glifosato (GS-glifosato sensible/GR-glifosato resistente) Haga clic aquí para ver una versión más grande de esta figura.
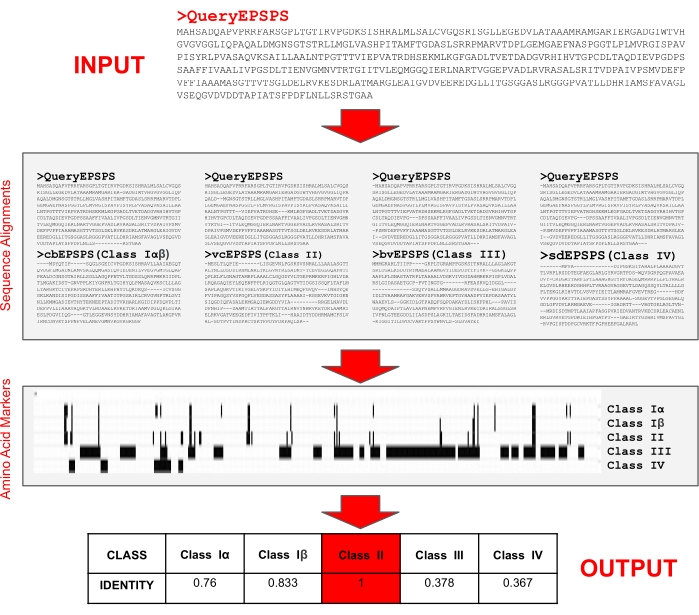
Figura 5: Algoritmo para identificar la clase de secuencias de proteínas EPSPS. La entrada es una secuencia de proteínas EPSPS en formato FASTA. El algoritmo realiza comparaciones con marcadores de aminoácidos conocidos en secuencias de proteínas de referencia que determinan la sensibilidad potencial al glifosato. El algoritmo se implementó en el servidor web de libre acceso EPSPSClass29. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Entradas y salidas básicas del servidor web EPSPSClass. (A) Entrada: una secuencia de proteínas EPSPS en formato FASTA. (B) Salida 1 - identidad: fracción de marcadores de aminoácidos presentes en las secuencias de consulta (Clases I-IV) y motivos (Clase III). (C) Salida 2 - identidad: alineaciones de las secuencias de consulta y referencia. (D) Salida 3 : alineaciones por pares de las secuencias de consulta y referencia. (E) Secuencias EPSPS de referencia: Vibrio cholerae (vcEPSPS, clase I), Coxiella burnetii (cbEPSPS, clase II), Brevundimonas vesicularis (bvEPSPS, clase III), Streptomyces davawensis (sdEPSPS, clase IV). (F) Enlaces para realizar búsquedas de blastp adicionales e identificación de dominios conservados Haga clic aquí para ver una versión más grande de esta figura.
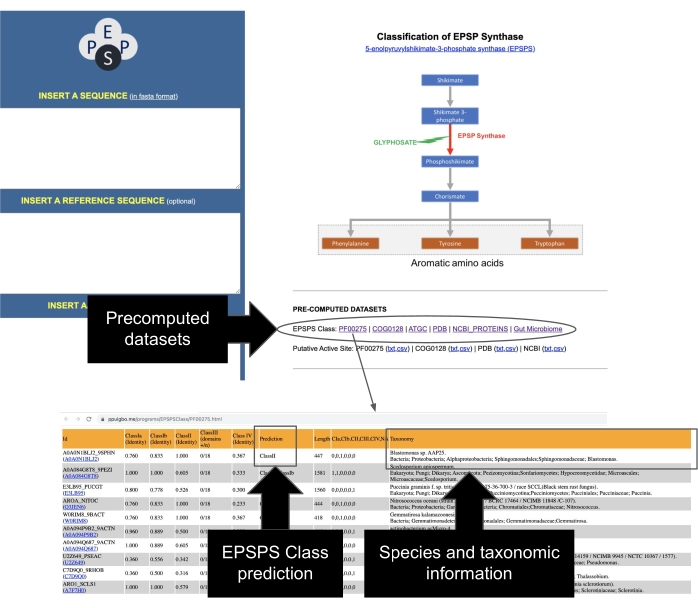
Figura 7: Acceso a conjuntos de datos precalculados de secuencias EPSPS. Siga las indicaciones de la figura para acceder al conjunto de datos precalculado de secuencias EPSPS. Haga clic aquí para ver una versión más grande de esta figura.
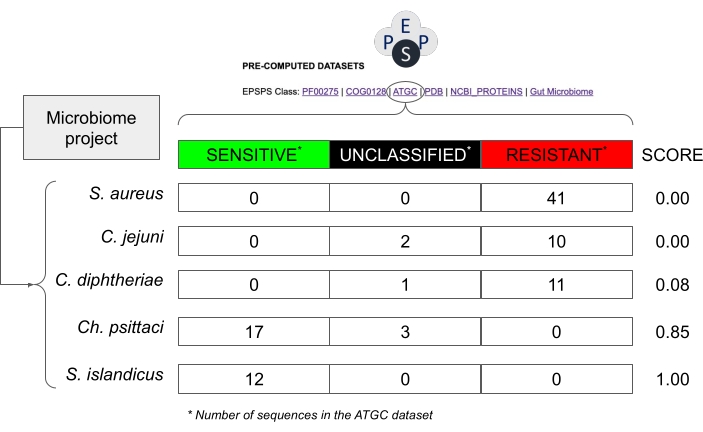
Figura 8: Ejemplo de cómo estimar la sensibilidad potencial en proyectos de microbioma sin secuencias EPSPS. El ejemplo utiliza valores de la base de datos de Alignable Tight Genomic Clusters30, que contiene secuencias de especies procariotas. Las especies hipotéticas de un proyecto de microbioma son Staphylococcus aureus, Corynebacterium diphtheriae, Campylobacter jejuni, Chlamydia psittaci y Sulfolobus islandicus. La puntuación de sensibilidad al glifosato se calcula como Number_Sensitive_Sequences/Total_Number_Of_Sequences. Haga clic aquí para ver una versión más grande de esta figura.
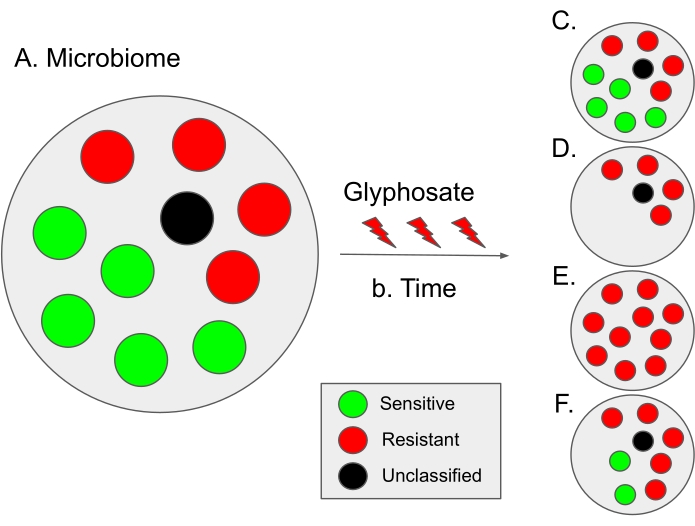
Figura 9: Esquema de la interpretación de los resultados de este protocolo y escenarios evolutivos hipotéticos. (A) En un microbioma, la proporción de bacterias potenciales de sensibilidad (en verde) y resistencia (en rojo) es de aproximadamente 50:50. Los puntos negros denotan especies microbianas no clasificadas; por lo tanto, se desconoce su sensibilidad al glifosato. En algunos microbiomas, la proporción de bacterias sensibles es ligeramente mayor, como en el microbioma intestinal humano12. (B) Con el tiempo, el uso de glifosato puede conducir a la disbiosis microbiana (es decir, un desequilibrio en la proporción de bacterias sensibles y resistentes) que conduce a diferentes escenarios hipotéticos. (C) Caso hipotético 1 (sin selección): El uso de glifosato no influye en el microbioma; por lo tanto, la proporción de bacterias sensibles y resistentes permanece constante. (D) Caso hipotético 2: El uso de glifosato elimina las bacterias sensibles al glifosato de la población. Especulamos que este escenario puede depender de la dosis. (E) Caso hipotético 3: La presión de selección del uso de glifosato mejora las mutaciones en el gen EPSPS que cambian el estado de sensibilidad de las bacterias. Por lo tanto, toda la población microbiana se vuelve resistente al glifosato. Además, en este escenario, podría haber un aumento en las bacterias resistentes a múltiples medicamentos. (F) Caso hipotético 4: el uso de glifosato altera la composición de ciertas especies bacterianas, produciendo un desequilibrio hacia las bacterias resistentes, mientras que algunas especies bacterianas permanecen inalteradas, posiblemente debido a mecanismos resistentes adicionales como bombas de eflujo o por sobreexpresión del gen EPSPS 13. Este escenario también puede conducir a un aumento de las bacterias resistentes al glifosato, así como a un aumento de la resistencia bacteriana a antibióticos adicionales. Haga clic aquí para ver una versión más grande de esta figura.
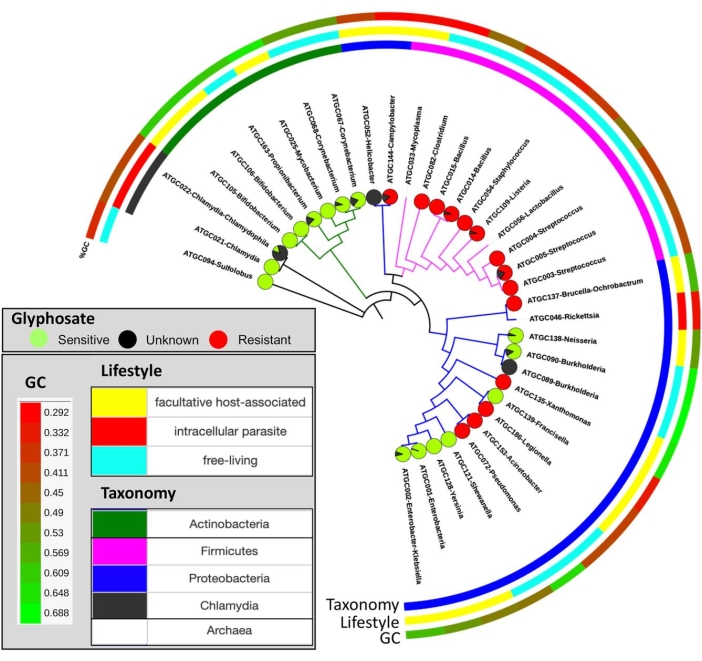
Figura 10: Distribución de la sensibilidad prevista al glifosato en todo el árbol de especies. Los gráficos circulares indican la proporción de especies que son supuestamente sensibles (verde) o resistentes (rojo) al glifosato, y no clasificadas (negro). Esta cifra ha sido adaptada con permiso de Rainio et al.14. Haga clic aquí para ver una versión más grande de esta figura.
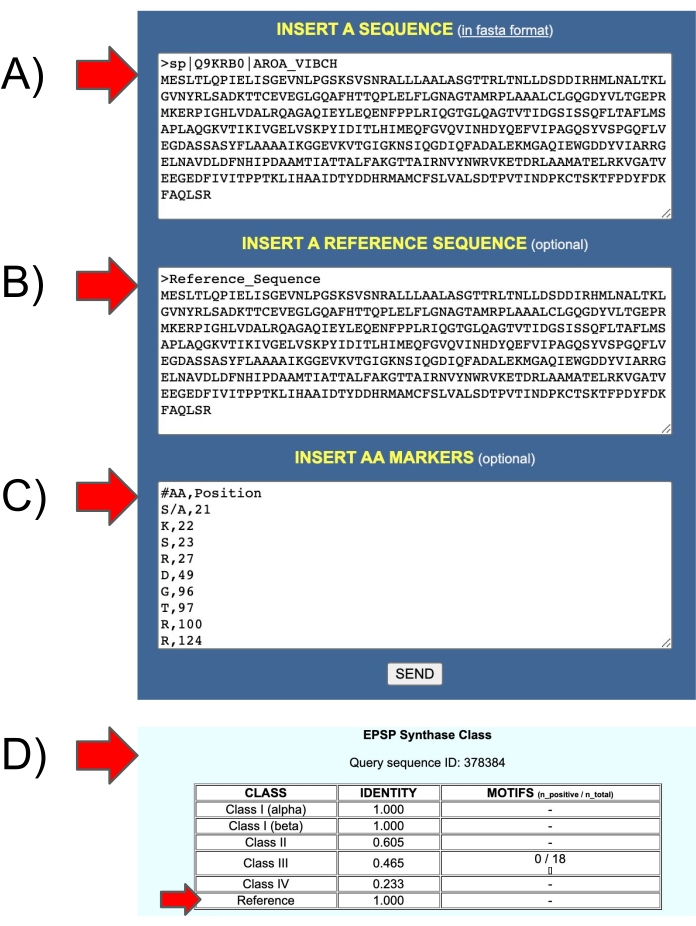
Figura 11: Entradas y salidas del servidor web EPSPSClass para probar la propia secuencia de referencia del usuario. (A) Entrada 1: secuencia de consulta. (B) Entrada 2: secuencia de referencia. (C) Entrada 3: marcadores de aminoácidos en las secuencias de referencia. (D) Salida: identidad: fracción de marcadores de aminoácidos en las secuencias de consulta (clase I-IV y secuencias de referencia propias del usuario). Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Lista de cebadores para la amplificación por PCR del gen 16S rRNA y la región ITS en el análisis del microbioma Haga clic aquí para descargar esta Tabla.
Tabla 2: Códigos de la enzima 5-enolpiruvylshikimate-3-fosfato sintasa (EPSPS) en diferentes bases de datos Haga clic aquí para descargar esta Tabla.
Tabla 3: Concentración media de glifosato Haga clic aquí para descargar esta Tabla.
Tabla 4: Cuadro sinóptico del porcentaje de especies sensibles/resistentes al glifosato. Esta tabla ha sido adaptada con permiso de Rainio et al.14. Haga clic aquí para descargar esta tabla.
Tabla 5: Posiciones de los marcadores de aminoácidos en las secuencias de referencia Haga clic aquí para descargar esta Tabla.
Discusión
Este protocolo proporciona orientación general sobre cómo cuantificar el efecto de GBP en los microbiomas basado en el análisis de la proteína EPSPS. El protocolo tiene tres pasos críticos principales: (i) Cuantificación de la proteína EPSPS a partir de datos de microbioma. Este paso es crítico porque EPSPS es la enzima objetivo directa del herbicida. Por lo tanto, las especies que tienen una copia del gen EPSPS pueden verse afectadas por el uso de GBP. Sin embargo, incluso las especies que carecen de una copia del gen EPSPS pueden verse afectadas por el herbicida a través de mecanismos alternativos no objetivo43,44. (ii) Si el análisis del gen EPSPS no está incluido en el diseño del estudio, es posible obtener una buena estimación analizando el ARNr 16S (bacterias) o ITS (hongos). En este caso, es esencial confiar en una tabla de referencia completa (por ejemplo, la base de datos ATGC proporciona secuencias de la proteína EPSPS de varias especies estrechamente relacionadas). iii) La proteína EPSPS se divide en potencialmente sensible o resistente al glifosato en función de ciertos residuos de aminoácidos del sitio activo del EPSPS. Sin embargo, las mutaciones que afectan a un solo aminoácido pueden alterar esta clasificación45 y las transiciones entre clases pueden ocurrir en un período de tiempo relativamente corto14.
La sensibilidad potencial de los organismos al glifosato se puede determinar mediante genomas de referencia, marcadores de aminoácidos y alineaciones de secuencias. i) Genomas de referencia: La enzima EPSPS puede clasificarse como potencialmente sensible (clase I [alfa o beta]46,47) o resistente (clases II48,49, III50 y IV51) al glifosato en función de la presencia de marcadores y motivos de aminoácidos (en el caso de la clase III). Estos marcadores y motivos de aminoácidos se basan en la ubicación de residuos de aminoácidos en la proteína EPSPS de Vibrio cholerae (vcEPSPS, clase I), Coxiella burnetii (cbEPSPS, clase II), Brevundimonas vesicularis (bvEPSPS, clase III) y Streptomyces davawensis (sdEPSPS, clase IV). (ii) Marcadores de aminoácidos: El glifosato interactúa con la enzima EPSPS y compite con el fosfoenolpiruvato (PEP, el segundo sustrato de la enzima EPSPS)52,53. En ciertas especies, pequeños cambios de aminoácidos en la secuencia de EPSPS proporcionan una mayor afinidad por la PEP y una resistencia al glifosato 12,14,52,54,55. En otras secuencias, el glifosato se une a la secuencia EPSPS en una conformación no inhibitoria 45. Aunque se han descrito muchas secuencias resistentes 12,14,48,49,52,54,55 y tolerantes 56,57 EPSP al glifosato, el sistema de clasificación actual para el EPSPS se divide en cuatro clases principales (I-IV)12 (Tabla 5 ). (iii) Alineaciones de secuencia: Para clasificar una enzima EPSPS, realizamos alineaciones por pares, con una alineación de secuencia múltiple -parámetros predeterminadosdel programa 35-, de la secuencia de consulta contra cada una de las secuencias de referencia (vcEPSPS, cbEPSPS, bvEPSPS y sdEPSPS). Estas alineaciones son necesarias para identificar las posiciones de los marcadores de aminoácidos en la secuencia de consulta. Como resultado, una enzima se clasifica como descrita12-clase I, II y / o IV en función de la presencia de marcadores de aminoácidos y marcadores de motivos basados en clase III.
El protocolo se basa en cuatro tipos conocidos de EPSPS: un tipo es sensible, los otros tres son resistentes). Sin embargo, aproximadamente el 10% de las secuencias de EPSPS en procariotas aún no están clasificadas (16% en arqueas y 8% en bacterias)12. Por lo tanto, la investigación adicional debe analizar esas secuencias para determinar la sensibilidad al glifosato. El servidor EPSPSClass proporciona una opción para probar nuevos marcadores genéticos. La identificación de las clases conocidas del EPSPS es sencilla, como se muestra en la sección 4.4. y figura 5. Además, en aquellos casos en los que los usuarios desean comparar sus propias proteínas de consulta y referencia, el servidor proporciona una opción para incluir manualmente una secuencia de referencia y un conjunto de marcadores de aminoácidos (Figura 11). Esta opción se puede utilizar para identificar nuevas clases de EPSPS, así como para probar otros herbicidas y secuencias objetivo.
El análisis de la clase EPSPS se determina mediante el análisis de secuencia y la presencia/ausencia de marcadores de aminoácidos. Esta es una estimación preliminar que se puede utilizar para la prueba de hipótesis en el campo. Los marcadores de aminoácidos se han determinado en la literatura a partir de estudios empíricos y observacionales 46,47,48,49,50,51. Sin embargo, las secuencias de proteínas de referencia para determinar la clase de EPSPS se han probado solo en un número limitado de especies y ocasionalmente pueden no explicar la resistencia al glifosato. El efecto de las mutaciones compensatorias y los dominios asociados a EPSPS (principalmente en hongos) también pueden afectar la sensibilidad al glifosato58. El análisis de este documento se basa en cuatro clases de EPSPS. Una encuesta de bacterias en el microbioma intestinal humano mostró que alrededor del 30% de ellas no estaban clasificadas (es decir, las proteínas EPSPS de estas especies no pertenecen a ninguna de las clases conocidas), y se necesitan estudios adicionales para identificar otras clases de EPSPS. Además, debe tenerse en cuenta que la secuencia de proteínas EPSPS en bacterias y plantas es un principio unido, mientras que las proteínas fúngicas EPSPS contienen varios dominios59. Por lo tanto, un plegamiento de proteínas en hongos puede conducir a una respuesta diferente de la enzima EPSPS al glifosato. Además, no se consideran otros mecanismos no objetivo de resistencia (por ejemplo, bombas de eflujo y sobreexpresión del gen EPSPS 13) o sensibilidad al glifosato (por ejemplo, el efecto del glifosato en la cadena de transporte mitocondrial12).
Aunque los GBP han existido como herbicida desde 1974 y se han utilizado ampliamente desde 1991, este es el primer método bioinformático para determinar la sensibilidad potencial de los organismos al glifosato. El método se basa en la identificación de residuos de aminoácidos conocidos en la secuencia objetivo. Por lo tanto, nuestro método proporciona una estimación de referencia del efecto potencial del glifosato en la especie. En un futuro próximo, los nuevos métodos bioinformáticos deberían incluir clases adicionales de la proteína EPSPS para determinar la sensibilidad potencial al glifosato de secuencias no clasificadas 12,54,55. Además, dado que el comportamiento exacto de la enzima EPSPS puede variar según los cambios de un solo aminoácido 12,14,52,54,55, los experimentos in silico adicionales deben tener en cuenta pequeñas variaciones en el plegamiento de la proteína EPSPS, así como el efecto de los dominios asociados a EPSPS en la estructura de la proteína en hongos58 . Además, se ha demostrado que la tolerancia al glifosato puede producirse por sobreexpresión de la proteína EPSPS56,57; por lo tanto, los análisis bioinformáticos basados en la mejora del uso del codón60 pueden utilizarse para identificar nuevas secuencias de EPSPS que maximicen o minimicen la expresión génica.
Los agricultores, los políticos y los responsables de la toma de decisiones necesitan urgentemente una comprensión profunda de los riesgos asociados con el uso intensivo de pesticidas. Por lo tanto, son necesarias tanto herramientas bioinformáticas que revelen la sensibilidad potencial de los organismos a los pesticidas como estudios experimentales bien replicados, aleatorios y realistas en el campo realizados en diferentes entornos. El método bioinformático presentado diseñado para examinar la sensibilidad de los organismos al glifosato puede ser modulado para otros pesticidas. Del mismo modo, los métodos de ecología experimental se pueden aplicar para estudiar cualquier cuestión ecológica relacionada. Juntos, los métodos se pueden usar para demostrar las víctimas entre las observaciones de campo, los datos genómicos y el uso de pesticidas. Todos los métodos presentados son invaluables en la evaluación de riesgos. Los métodos bioinformáticos se pueden utilizar, por ejemplo, para monitorear las adaptaciones microbianas a los agroquímicos y para proporcionar un método cuantitativo para probar los posibles otros riesgos asociados, como un aumento en la resistencia de los patógenos a los agroquímicos, los efectos negativos en los microbios utilizados como agentes de control biológico en el manejo integrado de plagas (MIP) y la resistencia a los antibióticos en las bacterias.
Divulgaciones
Conflictos de intereses: ninguno.
Agradecimientos
Este trabajo fue financiado por la Academia de Finlandia (subvención nº 311077 a Marjo Helander).
Materiales
| Name | Company | Catalog Number | Comments |
| 2100 Bioanalyzer Instrument | Agilent | G2939B | To check the concentration and quality of PCR products |
| dNTP mix (10 mM each) | ThermoFisher Scientific | R0192 | For PCR reactions |
| GoTaq G2 DNA Polymerase kit | Promega | M7848 | PCR buffer and DNA Polymerase for PCR amplification |
| Invisorb Spin Plant Mini Kit | INVITEK Molecular | 1037100300 | Genomic DNA extraction from plant tissues |
| Ion Chip Minifuge | ThermoFisher Scientific | 4479672 | For targeted sequencing of microbial PCR products |
| Ion PGM System | ThermoFisher Scientific | 4462921 | For targeted sequencing of microbial PCR products |
| Ion PGM Torrent Server | ThermoFisher Scientific | 4483643 | For targeted sequencing of microbial PCR products |
| Pippinprep | SageScience | PIP0001 | For size fractionation of PCR amplicons |
| Pressure tank | Berthoud | 102140 | For sprayin glyphosate based products in field |
| Primers | Sigma Aldrich | Custom-made | For PCR amplification |
| Rotary tiller | Grillo | 984511 | For tilling the soil in experimental plots |
| S1000 ThermalCycler | BIO-RAD | 1852196 | For PCR amplification |
Referencias
- Williams, G. M., Kroes, R., Munro, I. C. Safety evaluation and risk assessment of the herbicide Roundup and its active ingredient, glyphosate, for humans. Regulatory Toxicology and Pharmacology. 31, 117-165 (2000).
- Muola, A., et al. Risk in the circular food economy: Glyphosate-based herbicide residues in manure fertilizers decrease crop yield. The Science of the Total Environment. 750, 141422(2021).
- Helander, M., Saloniemi, I., Saikkonen, K. Glyphosate in northern ecosystems. Trends in Plant Science. 17 (10), 569-574 (2012).
- Fuchs, B., Saikkonen, K., Helander, M. Glyphosate-Modulated Biosynthesis Driving Plant Defense and Species Interactions. Trends in Plant Science. 26 (4), 312-323 (2021).
- Helander, M., Saloniemi, I., Omacini, M., Druille, M., Salminen, J. -P., Saikkonen, K. Glyphosate decreases mycorrhizal colonization and affects plant-soil feedback. The Science of the Total Environment. 642, 285-291 (2018).
- Bai, S. H., Ogbourne, S. M. Glyphosate: environmental contamination, toxicity and potential risks to human health via food contamination. Environmental Science and Pollution Research International. 23 (19), 18988-19001 (2016).
- Cuhra, M., Bøhn, T., Cuhra, P. Glyphosate: too much of a good thing. Frontiers in Environmental Science. 4, (2016).
- de Brito Rodrigues, L., et al. Impact of the glyphosate-based commercial herbicide, its components and its metabolite AMPA on non-target aquatic organisms. Mutation Research. 842, 94-101 (2019).
- Steinrücken, H. C., Amrhein, N. The herbicide glyphosate is a potent inhibitor of 5-enolpyruvylshikimic acid-3-phosphate synthase. Biochemical and Biophysical Research Communications. 94 (4), 1207-1212 (1980).
- Bentley, R. The shikimate pathway--a metabolic tree with many branches. Critical Reviews in Biochemistry and Molecular Biology. 25 (5), 307-384 (1990).
- Richards, T. A., et al. Evolutionary origins of the eukaryotic shikimate pathway: gene fusions, horizontal gene transfer, and endosymbiotic replacements. Eukaryotic Cell. 5 (9), 1517-1531 (2006).
- Leino, L., et al. Classification of the glyphosate target enzyme (5-enolpyruvylshikimate-3-phosphate synthase) for assessing sensitivity of organisms to the herbicide. Journal Of Hazardous Materials. 408, 124556(2021).
- Rainio, M. J., Ruuskanen, S., Helander, M., Saikkonen, K., Saloniemi, I., Puigbò, P. Adaptation of bacteria to glyphosate: a microevolutionary perspective of the enzyme 5-enolpyruvylshikimate-3-phosphate (EPSP) synthase. BioRxiv. , (2020).
- Rainio, M. J., Ruuskanen, S., Helander, M., Saikkonen, K., Saloniemi, I., Puigbò, P. Adaptation of bacteria to glyphosate: a microevolutionary perspective of the enzyme 5-enolpyruvylshikimate-3-phosphate synthase. Environmental Microbiology Reports. 13 (3), 309-316 (2021).
- Helander, M., Pauna, A., Saikkonen, K., Saloniemi, I. Glyphosate residues in soil affect crop plant germination and growth. Scientific Reports. 9 (1), 19653(2019).
- Ruuskanen, S., Rainio, M. J., Uusitalo, M., Saikkonen, K., Helander, M. Effects of parental exposure to glyphosate-based herbicides on embryonic development and oxidative status: a long-term experiment in a bird model. Scientific Reports. 10 (1), 6349(2020).
- Ruuskanen, S., et al. female preference and adverse developmental effects of glyphosate-based herbicides on ecologically relevant traits in Japanese quails. Environmental Science & Technology. 54 (2), 1128-1135 (2020).
- Mäki, A., Rissanen, A. J., Tiirola, M. A practical method for barcoding and size-trimming PCR templates for amplicon sequencing. Biotechniques. 60 (2), 88-90 (2016).
- Chelius, M. K., Triplett, E. W. The diversity of archaea and bacteria in association with the roots of Zea mays L. Microbial Ecology. 41 (3), 252-263 (2001).
- Lane, D. J. 16S/23S rRNA sequencing. Nucleic acid techniques in bacterial systematics. , John Wiley & Sons. New York. 115-175 (1991).
- Ghyselinck, J., Pfeiffer, S., Heylen, K., Sessitsch, A., De Vos, P. The effect of primer choice and short read sequences on the outcome of 16S rRNA gene based diversity studies. Plos One. 8 (8), 71360(2013).
- Zheng, D., Alm, E. W., Stahl, D. A., Raskin, L. Characterization of universal small-subunit rRNA hybridization probes for quantitative molecular microbial ecology studies. Applied and Environmental Microbiology. 62 (12), 4504-4513 (1996).
- JoVE Supplementary Material. , Available from: https://ppuigbo.me/programs/EPSPSClass/JOVE_SM (2021).
- Alignments Conserved Positions. , Available from: https://ppuigbo.me/programs/primers (2021).
- Protein Families. , Available from: http://pfam.xfam.org (2021).
- NCBI GenBank. , Available from: https://www.ncbi.nim.nih.gov/genbank (2021).
- COG Database. , Available from: https://www.ncbi.nim.nih.gov/research/cog (2021).
- Protein Data Bank. , Available from: https://www.rcsb.org (2021).
- EPSPSClass. , Available from: https://ppuigbo.me/programs/EPSPSClass (2021).
- Kristensen, D. M., Wolf, Y. I., Koonin, E. V. ATGC database and ATGC-COGs: an updated resource for micro- and macro-evolutionary studies of prokaryotic genomes and protein family annotation. Nucleic Acids Research. 45, 210-218 (2017).
- ATG_NCBI. , Available from: http://ftp.ncbi.nim.nih.gov/pub/kristensen/ATGC/atgc_home.html (2021).
- COG2020. , Available from: http://ftp.ncbi.nim.nih.gov/pub/COG/COG2020/data (2021).
- CSC - IT CENTER FOR SCIENCE LTD. , Available from: https://www.csc.fi (2021).
- Altschul, S. F., Gish, W., Miller, W., Myers, E. W., Lipman, D. J. Basic local alignment search tool. Journal of Molecular Biology. 215 (3), 403-410 (1990).
- Edgar, R. C. MUSCLE: multiple sequence alignment with high accuracy and high throughput. Nucleic Acids Research. 32 (5), 1792-1797 (2004).
- Tkacz, A., Hortala, M., Poole, P. S. Absolute quantitation of microbiota abundance in environmental samples. Microbiome. 6 (1), 110(2018).
- El-Gebali, S., et al. The Pfam protein families database in 2019. Nucleic Acids Research. 47, 427-432 (2019).
- Benson, D. A., et al. GenBank. Nucleic Acids Research. 41, Database issue 36-42 (2013).
- Galperin, M. Y., Makarova, K. S., Wolf, Y. I., Koonin, E. V. Expanded microbial genome coverage and improved protein family annotation in the COG database. Nucleic Acids Research. 43, Database issue 261-269 (2015).
- Burley, S. K., Berman, H. M., Kleywegt, G. J., Markley, J. L., Nakamura, H., Velankar, S. Protein data bank (PDB): the single global macromolecular structure archive. Methods in Molecular Biology. 1607, 627-641 (2017).
- Raoult, D., Hadjadj, L., Baron, S. A., Rolain, J. -M. Role of glyphosate in the emergence of antimicrobial resistance in bacteria. The Journal of Antimicrobial Chemotherapy. 76 (7), 1655-1657 (2021).
- Liu, J., Gefen, O., Ronin, I., Bar-Meir, M., Balaban, N. Q. Effect of tolerance on the evolution of antibiotic resistance under drug combinations. Science. 367 (6474), 200-204 (2020).
- Peixoto, F. Comparative effects of the Roundup and glyphosate on mitochondrial oxidative phosphorylation. Chemosphere. 61 (8), 1115-1122 (2005).
- Peillex, C., Pelletier, M. The impact and toxicity of glyphosate and glyphosate-based herbicides on health and immunity. Journal of Immunotoxicology. 17 (1), 163-174 (2020).
- Funke, T., Han, H., Healy-Fried, M. L., Fischer, M., Schönbrunn, E. Molecular basis for the herbicide resistance of Roundup Ready crops. Proceedings of the National Academy of Sciences of the United States of America. 103 (35), 13010-13015 (2006).
- Light, S. H., Krishna, S. N., Minasov, G., Anderson, W. F. An unusual cation-binding site and distinct domain-domain interactions distinguish Class II Enolpyruvylshikimate-3-phosphate synthases. Biochemistry. 55 (8), 1239-1245 (2016).
- Firdous, S., Iqbal, S., Anwar, S., Jabeen, H. Identification and analysis of 5-enolpyruvylshikimate-3-phosphate synthase (EPSPS) gene from glyphosate-resistant Ochrobactrum intermedium Sq20. Pest Management Science. 74 (5), 1184-1196 (2018).
- Barry, G. F., Kishore, G. M., Padgette, S. R., Stallings, W. C. Glyphosate-tolerant 5-enolpyruvylshikimate-3-phosphate synthases. United States Patient. , US5627061A (1997).
- Priestman, M. A., Funke, T., Singh, I. M., Crupper, S. S., Schönbrunn, E. 5-Enolpyruvylshikimate-3-phosphate synthase from Staphylococcus aureus is insensitive to glyphosate. FEBS Letters. 579, 728-732 (2005).
- Carozzi, N., Carr, B., Hammer, P. E. Identification of a new class of EPSP synthases. World Intellectual Property Organization Publ.of the Int.Appl. without Int.search. , REP. WO2006US13161 (2006).
- Lira, J. M., Cicchillo, R. M., Nair, S. K. Novel class of glyphosate resistance genes. US Patent. , US20130217577A1 (2013).
- Funke, T., et al. Structural basis of glyphosate resistance resulting from the double mutation Thr97 -> Ile and Pro101 -> Ser in 5-enolpyruvylshikimate-3-phosphate synthase from Escherichia coli. The Journal of Biological Chemistry. 284 (15), 9854-9860 (2009).
- Schönbrunn, E., et al. Interaction of the herbicide glyphosate with its target enzyme 5-enolpyruvylshikimate 3-phosphate synthase in atomic detail. Proceedings of the National Academy of Sciences of the United States of America. 98 (4), 1376-1380 (2001).
- Stalker, D. M., Hiatt, W. R., Comai, L. A single amino acid substitution in the enzyme 5-enolpyruvylshikimate-3-phosphate synthase confers resistance to the herbicide glyphosate. The Journal of Biological Chemistry. 260 (8), 4724-4728 (1985).
- Eschenburg, S., Healy, M. L., Priestman, M. A., Lushington, G. H., Schönbrunn, E. How the mutation glycine96 to alanine confers glyphosate insensitivity to 5-enolpyruvyl shikimate-3-phosphate synthase from Escherichia coli. Planta. 216 (1), 129-135 (2002).
- Achary, V. M. M., et al. Overexpression of improved EPSPS gene results in field level glyphosate tolerance and higher grain yield in rice. Plant Biotechnology Journal. 18 (12), 2504-2519 (2020).
- Huang, Z., Liu, Y., Zhang, C., Jiang, C., Huang, H., Wei, S. Molecular basis of natural tolerance to glyphosate in Convolvulus arvensis. Scientific Reports. 9 (1), 8133(2019).
- Tall, T. A census analysis of the 5-enolpyruvylshikimate-3-phosphate (EPSP) synthase and EPSP-associated domains. , (2020).
- Tall, T., Puigbò, P. The glyphosate target enzyme 5-Enolpyruvyl Shikimate 3-Phosphate Synthase (EPSPS) contains several EPSPS-associated domains in fungi. ATLA Summary of Proceedings. 76 (1), 6(2020).
- Puigbò, P., Guzmán, E., Romeu, A., Garcia-Vallvé, S. OPTIMIZER: a web server for optimizing the codon usage of DNA sequences. Nucleic Acids Research. 35, Web server issue 126-131 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados