Method Article
כימות ההשפעה הפוטנציאלית של מוצרים מבוססי גלייפוסט על מיקרוביום
In This Article
Summary
מוצרים מבוססי גלייפוסט (GBP) הם קוטלי העשבים הנפוצים ביותר בספקטרום רחב ברחבי העולם. במאמר זה אנו מציגים קווים מנחים כלליים לכימות ההשפעה של GBP על מיקרוביום, מניסויי שדה ועד ניתוחי ביואינפורמטיקה.
Abstract
מוצרים מבוססי גלייפוסט (GBP) הם קוטלי העשבים הנפוצים ביותר בספקטרום רחב ברחבי העולם. המטרה של גלייפוסט היא האנזים 5-enolpyruvylshikimate-3-פוספט סינתאז (EPSPS) במסלול שיקימט, שהוא כמעט אוניברסלי בצמחים. עיכוב האנזים עוצר את הייצור של שלוש חומצות אמינו חיוניות: פנילאלנין, טירוזין וטריפטופן. EPSPS קיים גם בפטריות ובפרוקריוטים, כגון ארכיאה וחיידקים; לפיכך, השימוש בליש"ט עשוי להשפיע על הרכב המיקרוביום של קרקעות, צמחים, אוכלי עשב וצרכנים משניים. מאמר זה נועד להציג קווים מנחים כלליים להערכת ההשפעה של GBP על מיקרוביום מניסויי שדה ועד ניתוחי ביואינפורמטיקה ולספק כמה השערות הניתנות לבדיקה. שני ניסויי שדה מוצגים כדי לבחון את הליש"ט על אורגניזמים שאינם מטרה. ראשית, מיקרובים הקשורים לצמחים מ-10 חלקות בקרה וליש"ט משוכפלות המדימות חיתוך ללא עיבוד נדגמים ומנותחים. בניסוי השני התקבלו דגימות ממחלקות ניסיוניות שהופרו על ידי זבל עופות המכיל שאריות גלייפוסט או זבל בקרה שלא טופל. ניתוח ביואינפורמטיקה של רצפי חלבוני EPSPS מנוצל כדי לקבוע את הרגישות הפוטנציאלית של מיקרובים לגלייפוסט. הצעד הראשון בהערכת ההשפעה של ליש"ט על המיקרוביום הוא לקבוע את הרגישות הפוטנציאלית שלהם לאנזים המטרה (EPSPS). רצפים מיקרוביאליים ניתן לקבל ממאגרים ציבוריים או באמצעות הגברת PCR. עם זאת, ברוב מחקרי השדה, הרכב המיקרוביום נקבע על סמך סמני דנ"א אוניברסליים כגון rRNA 16S והספייסר המתומלל הפנימי (ITS). במקרים אלה, ניתן להעריך את הרגישות לגלייפוסט רק באמצעות ניתוח הסתברותי של רצפי EPSPS באמצעות מינים קרובים. הכימות של הרגישות הפוטנציאלית של אורגניזמים לגלייפוסט, בהתבסס על האנזים EPSPS, מספק גישה איתנה לניסויים נוספים לחקר מנגנוני מטרה ומנגנונים שאינם עמידים למטרה.
Introduction
השימוש הכבד בחומרי הדברה בחקלאות המודרנית הוא ללא ספק תורם מרכזי לירידה במגוון הביולוגי1. מאמר זה מתמקד בגלייפוסט מכיוון שמוצרים מבוססי גלייפוסט (GBPs) הפכו לחומרי ההדברה הנפוצים ביותר בעולם בשל יעילותם ומחירם הזול 2,3. בנוסף להרג עשבים שוטים בשדות חקלאיים, GBPs משמשים בדרך כלל בסילוויקולטורה, סביבות עירוניות וגינות ביתיות; בנוסף, הם הוכרזו כלא רעילים לאורגניזמים שאינם ממוקדי מטרה אם נעשה בהם שימוש בהתאם להוראות היצרן. עם זאת, מספר גדל והולך של מחקרים אחרונים גילו כי שאריות של גלייפוסט ותוצרי הפירוק שלו עשויות להישמר ולהובל בקרקעות, ובכך להיות בעלות השפעות מדורגות על אורגניזמים שאינם מטרה 4,5,6,7,8 . ההשפעות של גלייפוסט אינן מוגבלות רק לצמחים - מסלול השיקימט קיים גם בפטריות ובפרוקריוטים רבים. גלייפוסט מכוון לאנזים 5-enolpyruvylshikimate-3-פוספט סינתאז (EPSPS) במסלול שיקימט, הידוע גם בשם aroA9. אנזים זה נמצא במרכז מסלול השיקימט בסינתזה של שלוש חומצות האמינו הארומטיות החיוניות (פנילאלנין, טירוזין וטריפטופן), והוא נמצא ברוב הפרוקריוטים, הצמחים והפטריות10,11. כמה מינים מיקרוביאליים פיתחו עמידות חלקית או מוחלטת לגלייפוסט באמצעות מספר מנגנונים, כולל מוטציות ברצפי EPSPS. לפיכך, הוצע כי לשימוש ב-GBPs עשויה להיות השפעה ישירה על המיקרוביום של צמחים ובעלי חיים, כולל המיקרוביום של המעי האנושי 12,13,14. עם זאת, לשימוש בליש"ט עלולה להיות השפעה שלילית על כמעט כל פונקציה ושירות של המערכת האקולוגית המסתמכים על מיקרובים ותהליכים מקלים על מיקרובים. האיומים הנובעים מכך עשויים לעסוק בתהליכי קרקע ביוכימיים, בביולוגיה של האבקה וברווחת בעלי חיים ובני אדם. זה דורש הבנה מקיפה יותר של האופן שבו גלייפוסט משפיע על מסלולים ושיטות של שיקימטים להערכת הרגישות של מיקרובים לגלייפוסט.
בפרוטוקול זה אנו מציגים צינור לבדיקת ההשפעה של גלייפוסט וליש"ט על המיקרוביום, מניסויי שדה ועד ניתוחי ביואינפורמטיקה. אנו מתארים בפירוט שיטת ביואינפורמטיקה שפורסמה לאחרונה, שניתן להשתמש בה כדי לקבוע את הרגישות הפוטנציאלית של אורגניזמים לגלייפוסט12. למיטב ידיעת החוקרים, זהו הכלי הראשון ועד כה, היחיד בביואינפורמטיקה המעריך את הרגישות הפנימית של האנזים EPSPS למרכיב הפעיל של GBPs. שיטת ביואינפורמטיקה זו מבוססת על זיהוי סמני חומצות אמינו ידועים באנזים המטרה גלייפוסט (EPSPS)12. הצינור מחולק לחמישה שלבי עבודה עיקריים (איור 1): 1) מבוא קצר לשני ניסויי שדה כדי לבחון את ההשפעה של GBPs, 2) סיכום קצר של ניתוחי מיקרוביום (גן 16S rRNA, ITS ו-EPSPS ), 3) איסוף רצפי EPSPS ממאגרים ציבוריים, 4) קביעת הרגישות הפוטנציאלית של אורגניזמים לגלייפוסט, ו-5) הערכת מחלקת EPSPS מסמנים מיקרוביאליים אוניברסליים (16S rRNA ו-ITS).
Protocol
1. שני ניסויי שדה לבדיקת ההשפעה של GBPs
הערה: פרוטוקול זה מציג שתי דוגמאות לתכנון ניסויי שדה כדי לבחון את ההשפעה של GBPs על מיקרובים הקשורים לצמחים. שני הניסויים נערכו בשדות מושקעים ללא היסטוריה קודמת של קוטל עשבים או שימושים חקלאיים בגן הבוטני של אוניברסיטת טורקו רואיסאלו בפינלנד (60º26'N, 22º10'E). הקרקע היא חרסית חולית עם שיעור גבוה של חומר אורגני.
- ניסוי 1
הערה: ניסוי זה נועד לדמות את השיטות החקלאיות הכלליות של חקלאות ללא עיבוד עם יישומי GBP לפני ואחרי עונת הגידול כדי להילחם בעשבים שוטים.- חלקו את שדה הניסוי ל-10 חלקות טיפול משוכפלות וליש"ט (23 מ' x 1.5 מ') עם רצועות חיץ של צמחייה בין החלקות (במחקר זה באביב 201415) (איור 2).
- יש לוודא כי החלקות מעובדות עם מטח סיבובי לעומק של 5 ס"מ ומטופלות פעמיים בשנה. כאן, החלקות טופלו בתחילת (מאי) ובסוף (אוקטובר) של עונת הגידול.
- טפלו בחלקות הבקרה במי ברז (5 ליטר לחלקה) ובחלקות הליש"ט עם ליש"ט מסחריות (ריכוז גלייפוסט 450 גרם· L-1, קצב היישום 6.4 L·ha-1 ב-5 ליטר של מי ברז לכל חלקה) כדי לחקות את מינון הגלייפוסט המרבי המותר בשיטות חקלאיות (3 ק"ג·חה-1).
- יש למרוח את הטיפולים באמצעות מיכל לחץ המופעל ביד בעל מרסס ידני. שבועיים לאחר יישום הליש"ט, זריעת שיבולת שועל (Avena sativa), שעועית פאבה (Vicia faba), אונס לפת (Brassica rapa subsp. oleifera), ותפוחי אדמה נטועים (Solanum tuberosum) בחלקות על פי שיטות חקלאיות.
- במהלך עונת הגידול, עשבו את החלקות ביד כדי לשמור על התחרות על הצמח ומבנה הקרקע דומים ככל האפשר בחלקות הבקרה והתינוקות בליש"ט.
- דגימת המיקרוביוטה מצמחי ניסוי. במחקר זה, המיקרוביוטה נדגמה ברצף בין השנים 2017 ל-2020 הן בחלקות הטיפול שטופלו ב-GBP והן בחלקות הטיפול בבקרה אחת לעונת הגידול במהלך המחקר.
- אספו עשרה העתקים של דגימות הצמח (שורש ועלה) מהשדה, הניחו אותן מיד על קרח והביאו אותן למעבדה להמשך עיבוד, כמתואר בסעיף 2.1.
- ניסוי 2
הערה: ניסוי זה נועד לבחון סיכונים הקשורים לכלכלת המזון המעגלית; ליתר דיוק, הוא תוכנן לבחון את ההשלכות של שאריות ליש"ט בזבל המיושם כדשן על צמחי יבול2 (איור 3).- אספו מצעים, כולל שבבי עץ, צואה וחלק מהמזון שנשפך, משליו שניזונו ממזון מזוהם ב-GBP או ממזון מבוקר בניסוי של 12 חודשים ב-16,17.
הערה: ההזנה המזוהמת בליש"ט כללה מזון אורגני להנחת תרנגולות בשילוב עם שווה ערך ל-160 מ"ג גלייפוסט/ק"ג, התואם צריכה יומית של 12-20 מ"ג גלייפוסט לקילוגרם מסת גוף בשליו יפני בוגר16,17. - לצורך אימות, שלחו את הדגימות למעבדה מוסמכת למדידות ריכוז גלייפוסט בשש אצוות של הזנה.
- בנוסף, יש למדוד את שאריות הגלייפוסט בדגימות הפרשת שליו לאחר 12 חודשי חשיפה. קבוצת הביקורת הוזנה באותו מזון אורגני ללא תוספת של16,17 ליש"ט.
- במהלך ניסוי העופות, החליפו את המצעים דו-שבועיים. אספו את המצעים המשומשים באופן קבוע בין 8-12 חודשים של חשיפה מטיפול ובקרה של GBP, בריכה לכל טיפול, ואחסנו במיכלים סגורים במחסן יבש וחשוך בטמפרטורה של 6 מעלות צלזיוס לפני השימוש כדשן.
- פרשו 12 ליטר מהמצעים באופן ידני על כל אחת ממגרשי הבקרה של 18 GBP ו-18 (גודל 1 מ' x 1 מ') ברשת לוחות שחמט בגודל 6x6 בתחום הניסוי בשתי נקודות זמן. במחקר זה, המצעים הופצו באוגוסט 2018 ובמאי 2019.
- שלח את דגימות המצעים למעבדה מוסמכת למדידות ריכוז הגלייפוסט מיד לאחר התפשטותו (במחקר זה במאי 2019).
- לשתול עשב רב שנתי וצמחי תות בכל חלקת אדמה כדי לחקור את המיקרוביוטה של השורש והעלים שלהם.
הערה: במחקר זה נשתלו לכל חלקה ארבעה צמחי דשא רב-שנתיים (Festuca pratensis) ושני צמחי תות (Fragaria x vescana) ושני צמחי תות שדה (Fragaria x vescana) ונחקרו עבור המיקרוביוטה של השורש והעלים שלהם.
- אספו מצעים, כולל שבבי עץ, צואה וחלק מהמזון שנשפך, משליו שניזונו ממזון מזוהם ב-GBP או ממזון מבוקר בניסוי של 12 חודשים ב-16,17.
2. אנליזות מיקרוביום (גן 16S rRNA, ITS ו-EPSPS )
הערה: רוב מחקרי המיקרוביום מבוססים על ניתוח של הגן 16S rRNA עבור אזורי ספייסר מתועתקים (ITS) חיידקיים ופנימיים עבור קהילות פטרייתיות באמצעות טכנולוגיות ריצוף מהדור הבא. לפיכך, במאמר אין מידע על סוג EPSPS. רצפי EPSPS מאלפי מינים זמינים במאגרים ציבוריים (פרוטוקול סעיף 3) (איור 4).
- גן 16S rRNA
- מתוך דגימות העלים והשורשים המנותקות שנאספו בניסויים שתוארו לעיל, זהה את המיקרובים האנדופיטיים (כלומר, מיקרובים החיים בתוך רקמות צמחים).
- שטפו את דגימות הצמחים במי ברז ולאחר מכן עקרו אותן כדי להסיר את המיקרובים האפיפיטיים (כלומר, מיקרובים על פני השטח של רקמות הצמח). מעקרים באמצעות אקונומיקה של 3% למשך 3 דקות, ולאחר מכן תמיסת אתנול של 70% למשך דקה אחת, ושטופים שלוש פעמים במים אולטרה-פורים אוטוקלבים למשך דקה אחת כל אחד.
- הקפיאו את הדגימות בטמפרטורה של -80 מעלות צלזיוס עד למיצוי DNA גנומי.
- בצע מיצוי דנ"א גנומי באמצעות ערכת מיצוי DNA צמחית זמינה מסחרית בהתאם לפרוטוקול היצרן.
- התמקדו באזורים המשתנים V6-V8 של הגן 16S rRNA מדגימות דנ"א שחולצו באמצעות גישה מקוננת עם פריימרים מפלים הנקשרים במיוחד לדנ"א חיידקי18, ובכך ממזערים את ההגברה מהדנ"א של הצמח המארח.
- לאחר שלושה סבבים של תגובת שרשרת פולימראז (PCR), תייג את גן המטרה עם רצפי ברקוד ומתאם כדי להכין אותו כתבנית לריצוף. בצע את השלבים 2.1.7- 2.1.11 להגברת PCR
- הכן את תערובת האב של PCR למספר הדגימות הנדרש כך שלכל תגובה יהיה נפח כולל של 30 μLof והיא מורכבת מ-30 ננוגרם של דנ"א, מאגר PCR 1x, 0.2 mM dNTPs, 0.3 μM של כל פריימר, ו-2000 U/mL DNA פולימראז. בצע את אותו שלב עבור הסיבוב השני והשלישי של PCR.
- עבור הסבב הראשון של PCR, השתמש בפריימרים 799F19 ו- 1492R (שונה מ- 20) (טבלה 1). הגדר את פרופיל ההגברה על התרמוצילר (דנטורציה ראשונית של 3 דקות ב- 95 ° C, ואחריה 35 מחזורים של דנטורינג ב- 95 ° C במשך 45 שניות, חישול ב - 54 ° C עבור 45 שניות, והרחבה ב - 72 ° C למשך דקה אחת). בצע את ההרחבה הסופית ב 72 °C (72 °F) למשך 5 דקות.
- כתבנית לסיבוב השני של PCR, ודא הגברה על ידי אלקטרופורזה (5 μL של מוצרי PCR על 1.5% ג'ל אגרוז) ולאחר מכן דילל את שאר 25 μL של מוצר ה- PCR במים אולטרה-אפורים אוטוקלבים ביחס של 1:10.
- חזור על PCR עם תבניות PCR מדולל ופריימרים uni-1062F21 ו- uni-1390R22 (טבלה 1). שמור על אותם תנאי תגובת PCR ופרופיל הגברה (שלב 2.1.8) למעט הפחתת מספר המחזורים ל -25.
- דיללו את מוצרי ה-PCR המתקבלים במים אולטרה-פוריים אוטו-חלביים ביחס של 1:1. בצע את הסיבוב השלישי של PCR כדי לתייג את המוצרים עם הברקודים ורצף מתאם P1 עם 8 מחזורים של אותו פרופיל PCR שהוזכר בשלב 2.1.8.
- הכנת הספרייה
- אמתו את הריכוז והאיכות של מוצרי PCR בביואנליזר ואגדו את הנפחים המרכיבים 30 ננוגרם של דנ"א של כל דגימה בצינור של 1.5 מ"ל כדי להכין ספרייה שקולה.
- בחר את האמפליקונים בגודל 350-550 bp לפי פיצול גודל באמצעות מערכת אוטומטית לבחירת גודל DNA על קלטת ג'ל אגרוז. שים לב שזה גם מבטל אמפליקונים לא ספציפיים וריאגנטים PCR מהספרייה. אספו את ה-elute המורכב מאמפליקונים בגודל שצוין לתוך בקבוקון בקלטת, והתוצאה היא ספריית גנים מטוהרת של 16S rRNA.
- פיפטה את האלוט החוצה לתוך צינור 1.5 מ"ל ולאמת את הטוהר והריכוז על הביואנליזר. דיללו את ספריית הדנ"א באמצעות מים אולטרה-פוריים אוטו-חלביים לריכוז סופי של 26 pM; המדגם מוכן לריצוף.
- שלה
הערה: אזור ITS מוגבר באמצעות פריימרים ספציפיים ל-ITS (טבלה 1), ומוצר ה-PCR המתקבל מסומן בברקודים וברצף מתאם P1 לריצוף.- הכן את תערובת המאסטר PCR בהתאם לאותו פרוטוקול שהוזכר בסעיף 2.1 עם פריימרים של ITS .
- הגדר את פרופיל ההגברה על התרמוצילר כ- denaturation ראשוני של 5 דקות ב- 95 ° C ואחריו 35 מחזורים של denaturing, חישול והרחבה ב- 95 ° C עבור 30 s, 55 ° C עבור 30 s, 72 ° C למשך דקה אחת, בהתאמה, והרחבה סופית 72 ° C למשך 7 דקות.
- לנתח 5 μL של מוצר PCR על 1.5 % ג'ל אגרוז ולדלל את הנותרים 25 μL עד 1:10 באמצעות מים ultrapure autoclaved. השתמש במוצר ה-PCR המדולל כתבנית לסיבוב השני של PCR.
- הכן תערובת מאסטר PCR עבור מספר הדגימות הנדרש (עיין בשלב 2.1.6) עם פריימרים קדמיים המתויגים על ידי ברקוד ופריימרים אחוריים המתויגים על ידי מתאם P1. הגברה עם אותו פרופיל הגברה כמו בשלב 2.3.2, למעט שימוש ב-8 מחזורים.
- הכן את מוצרי ה- PCR המתקבלים לריצוף בהתאם לפרוטוקולים המוזכרים בסעיף 2.2.
- גן EPSPS
- לרצף ולנתח את הגנים EPSPS של המיקרובים.
הערה: כדי למצוא אם חשיפה ליש"ט שינתה את הרכב המיקרובים הרגישים לגלייפוסט ועמידים בקהילה, יש לרצף ולנתח את הגנים EPSPS של המיקרובים. לפיכך, נאספו 353 רצפים של גנים של EPSPS מאוסף רחב של טקסונים מיקרוביאליים במסד הנתונים של אשכולות גנומיים הדוקים הניתנים ליישור (ATGC), וכל רצפי החלבונים היו מיושרים22. יישורים אלה זמינים במסד הנתוניםATGC 23 וניתן להשתמש בהם ליצירת פריימרים מאזורים שמורים. כלי ביואינפורמטיקה קל לשימוש נועד לזהות אזורים שמורים מתוך יישור רצפים מרובים, וזה זמין בעמוד24 של מחקר Pere Puigbo. עם זאת, זה מחוץ לתחום של פרסום זה כדי לספק תיאור מפורט של שרת אינטרנט זה. אף על פי כן, פרוטוקול פרוספקטיבי לשימוש בפריימרים אלה להגברת הגן EPSPS כדי למצוא את הרגישות של המיקרוביום לגלייפוסט מסופק באיור 4.
- לרצף ולנתח את הגנים EPSPS של המיקרובים.
3. איסוף רצפי חלבוני EPSPS ממאגרים ציבוריים
- רצפי EPSPS שישמשו במחקרי מאקרו-אבולוציה
- לאסוף חלבוני EPSPS ממאגרים ציבוריים כגון PFAM23 (מסד נתונים של משפחות חלבונים25), GenBank24 (מסד נתונים של גנים, גנומים וחלבונים26 ), COG25 (אשכולות של קבוצות אורתולוגיות27; מסד נתונים של חלבונים אורתולוגיים מארכאים וחיידקים); ו- PDB26 (בנק נתוני חלבונים28; מסד נתונים של מבני חלבונים).
הערה: מחקר שנערך לאחרונה על ידי החוקרים הראה כי ניתן להשתמש בחלבונים אלה כדי לבצע ניתוחים מיקרו-אבולוציוניים והשוואתיים של ההשפעה הפוטנציאלית של גלייפוסט על אורגניזמים בעלי מסלול שיקימט12. המחברים פיתחו אתר ידידותי למשתמש שאוסף מידע על עשרות אלפי רצפי חלבוני EPSPS29, כולל מערך נתונים ידני של חלבונים מהמיקרוביום של המעי האנושי12. המידע במערכי נתונים מחושבים מראש אלה כולל את הסיווג הנוכחי של EPSPS לרגישים ועמידים בפני גלייפוסט, מידע טקסונומי על מינים, ביאורים של האתר הפעיל EPSPS וקישורים למאגרי PDB ו- NCBI. יתר על כן, שרת האינטרנט כולל את קודי הזיהוי של EPSPS וקישורים למספר מסדי נתונים חיצוניים (טבלה 2).
- לאסוף חלבוני EPSPS ממאגרים ציבוריים כגון PFAM23 (מסד נתונים של משפחות חלבונים25), GenBank24 (מסד נתונים של גנים, גנומים וחלבונים26 ), COG25 (אשכולות של קבוצות אורתולוגיות27; מסד נתונים של חלבונים אורתולוגיים מארכאים וחיידקים); ו- PDB26 (בנק נתוני חלבונים28; מסד נתונים של מבני חלבונים).
- רצפי EPSPS שישמשו במחקרי מיקרו-אבולוציה ATGC
הערה: מאגרים כלליים של רצפי חלבונים שימושיים לביצוע מחקרים השוואתיים בקרב אורגניזמים רחוקים יחסית; עם זאת, ההשפעה הפוטנציאלית של גלייפוסט היא חדשה יחסית מנקודת מבט אבולוציונית. לכן, במחקרים מסוימים, יש צורך להשוות בין מינים קרובים (למשל, זנים שונים מאותו מין חיידקי) כדי לקבוע את ההשפעה של גלייפוסט14. במקרים אלה, מסד הנתונים של אשכולות גנומיים הדוקים הניתנים ליישור (ATGC)30, המכיל רשימה מקיפה של גנומים ארכאיים וחיידקיים קרובים זה לזה, הוא משאב מתאים יותר. מסד הנתונים של ATGC מכיל מידע של כמה מיליוני חלבונים מאלפי גנומים המאורגנים במאות אשכולות30. כל צביר גנום הוא מיושר (גנומים חולקים סינטניה מעל ≥85% מאורכם) והדוק (בעל שיעור תחלופה נרדף מתחת לרוויה). החוקרים השתמשו במערך הנתונים ATGC במחקר שנערך לאחרונה כדי לנתח שינויים מיקרו-אבולוציוניים בחלבוני EPSPS14. נדרשים השלבים הבאים כדי לזהות את רצף החלבון EPSPS ב- ATGC:- הורד את כל מסד הנתונים של ATGCs מהקישור31 ואת כל החלבונים של COG0128 (קוד המתאים לחלבונים EPSPS במסד הנתונים)32 לפרויקט מקומי.
הערה: אם החוקרים/הנסיינים ממוקמים בפינלנד, מרכז CSC-IT למדע33 מספק מתקני אחסון ותוכנה. חשוב לאסוף את כל הרצפים בפורמט FASTA. - בנה מסד נתונים של פיצוץ של COG0128 המכילים אורתולוגים של חלבון EPSPS בקבוצה מייצגת של מינים של פרוקריוטים. ל- CSC יש את תוכנית הפיצוץ34 מותקנת מראש, המאפשרת את השימוש בפקודה makeblastdb -in COG0128.fa -dbtype prot כדי ליצור מסד נתונים ייחוס של רצפי EPSPS.
- מפה את מסד הנתונים של ATGC אל COG0128.fa (חלבוני EPSPS) באמצעות חיפוש פיצוץ איטרטיבי עם הפקודה blastp -query [ATGC_X.fa] -db [COG0128.fa] -max_target_seqs 1 -outfmt 6 -out tmpfile -evalue 1e-150.
- כתוצאה מכך, הוא יוצר מערך נתונים של רצפי חלבוני EPSPS בתוך כל אחד מהם. מערך נתונים מחושב מראש של רצפי חלבוני EPSPS קרובים ממסד הנתונים ATGC זמין29.
- הורד את כל מסד הנתונים של ATGCs מהקישור31 ואת כל החלבונים של COG0128 (קוד המתאים לחלבונים EPSPS במסד הנתונים)32 לפרויקט מקומי.
4. אלגוריתם לקביעת הרגישות הפוטנציאלית של אורגניזמים לגלייפוסט (שרת אינטרנט EPSPSClass: כניסות, עיבוד ויציאות)
הערה: החוקרים יישמו שרת קל לשימוש הזמין באופן חופשי ב-29 כדי לקבוע את הקטגוריה של רצפי חלבוני EPSPS12,35. השרת דורש רק קלט של רצף חלבונים בתבנית FASTA כדי לקבוע את אחוז הזהות לכל אחת ממחלקות EPSPS ואת הרגישות הפוטנציאלית שלהם לגלייפוסט. יתר על כן, משתמשים יכולים להשתמש בשרת האינטרנט כדי לבדוק רצפי ייחוס וסמני חומצות אמינו משלהם. ראשית, האלגוריתם (איור 5) מיישר רצפי שאילתות ורצפי ייחוס באמצעות תוכנית יישור רצפים מרובים35 כדי לקבוע את מיקומי חומצות האמינו. לאחר מכן, הוא מחפש נוכחות של סמני חומצות אמינו כדי לזהות את מחלקת EPSPS (I, II, III או IV) של רצף השאילתות.
- הציגו רצף חלבוני EPSPS בתבנית FASTA לתוך תיבת הטקסט של הקלט כדי לזהות את קבוצת האנזים (איור 6A), ולחצו על Send.
- הערך את הרגישות הפוטנציאלית של רצף השאילתות לגלייפוסט (איור 6B-E) מהפלטים שסופקו בשרת:
פלט 1: חלק מסמני חומצות האמינו (כלומר, זהות) הקיימים ברצפי השאילתות (מחלקה I, II ו-IV), ומספר המוטיבים (מחלקה III).
פלט 2: יישורים של השאילתה ורצפי ההפניות בהתבסס על שאריות סמנים.
פלט 3: יישור זוגי מלא של רצפי השאילתה וההפניות.
פלט 4: רצפי ייחוס EPSPS: Vibrio cholerae(vcEPSPS, class I), Coxiella burnetii(cbEPSPS, class II), Brevundimonas vesicularis(bvEPSPS, class III), Streptomyces davawensis(sdEPSPS, class IV). - בסוף דף הפלט, מצא קישורים לכלים חיצוניים כגון blastp ותחומים שמורים כדי לנתח עוד יותר את רצף EPSPS של השאילתה (איור 6F).
5. הערכת מחלקת EPSPS מסמנים מיקרוביאליים אוניברסליים (16S rRNA ו - ITS )
הערה: רוב מחקרי המיקרוביום מבוססים על ניתוח של 16S rRNA ו/או ITS36. במקרים כאלה, לא ניתן לבצע ניתוח ישיר של רצף EPSPS. לפיכך, יש צורך בגישה הסתברותית להערכת הרגישות הפוטנציאלית של אורגניזמים לגלייפוסט. ניתוח זה הוא פשוט ומספק הערכה סבירה של סוג רצפי EPSPS בפרויקט מיקרוביום. התהליך מחולק ל-3 שלבים (איור 7 ואיור 8):
- זהה רצפי EPSPS ממאגרים ציבוריים. מחלקת EPSPS של מערך נתונים מקיף של רצפים מייצגים נערך וחושב מראש מ- PFAM37, GenBank38, COG39, PDB40, ATGC30. גש לערכות נתונים אלה מהדף הראשי של שרת EPSPSClass, המכילות מידע טקסונומי וממחלקת EPSPS של יותר מ-50,000 רצפים (איור 7).
- מדוד את גובה הצמחים הניסיוניים באופן דו-שבועי בעונת הגידול, ושקול את הביומסה שמעל פני הקרקע של הצמחים בסוף עונת השדה כדי להשוות את צמיחת הצמחים בליש"ט ולשלוט בחלקות.
הערה: ניתוחי המיקרוביוטה מניסויי השדה טרם נותחו במלואם. - השתמש בגיליון אלקטרוני כדי למפות את ה-OTUs החיידקיים (המבוססים על 16S rRNA או ITS) מניסויים במיקרוביום לתוך מערכי נתונים מחושבים מראש.
הערה: מחקרים קודמים הראו כי מחלקת EPSPS (כלומר, הרגישות הפנימית לגלייפוסט) נשמרת מאוד בתוך קבוצה פילוגנטית14. לפיכך, סביר יחסית להניח שלמינים קרובים מטקסונים שמורים מאוד עשויים להיות תגובות EPSPS דומות לגלייפוסט (איור 8). - באותו גיליון אלקטרוני, חשב את הרגישות הפנימית לגלייפוסט, בהתבסס על ניקוד הסתברותי (S = s / (s + r + u) כאשר S: ציון רגישות; s: מספר רצפים רגישים פוטנציאליים; r: מספר רצפים עמידים פוטנציאלית; u: מספר רצפים לא מסווגים) המחושב מרצפי EPSPS ידועים במאגרי מידע ציבוריים.
הערה: ציון זה נע בין 0 (לא נמצאו רצפי EPSPS רגישים בטקסון) ל-1 (כל הרצפים בטקסון רגישים לגלייפוסט) (איור 8). יתר על כן, ישנם ערכים בין לבין - כלומר, מינים עם זנים רגישים, עמידים או לא ידועים.
תוצאות
מטרת פרוטוקול זה היא לספק צינור כללי, מניסויי שדה ועד ניתוחי ביואינפורמטיקה, המכמת את הרגישות הפוטנציאלית של אורגניזמים לקוטלי העשבים גלייפוסט. בניסוי 2 ריכוז הגלייפוסט הממוצע במזון השליו היה 164 מ"ג/ק"ג והריכוז הממוצע של גלייפוסט בדגימות ההפרשה (שתן וחומר צואה גם יחד) היה 199 מ"ג/ק"ג. מצעים שנאספו משליו שניזונו ממזון מזוהם בליש"ט היו בממוצע 158 מ"ג/ק"ג ומצעי בקרה שגודלם 0.17 מ"ג/ק"ג גלייפוסט (טבלה 3). בניסויי השדה, מיני צמחים הגיבו באופן שונה לשאריות גלייפוסט בקרקעות (סעיף 1). ביומסה של אונס שיבולת שועל ולפת הייתה גדולה יותר בקרקעות בקרה בהשוואה לקרקעות שטופלו בליש"ט. עם זאת, נראה כי פולי פאבה ותפוחי אדמה נהנו מטיפול בליש"ט בסוף עונת הגידול15. גלייפוסט בזבל עופות הפחית את צמיחת הצמחים בעשב (Festuca pratensis) ובתות שדה (Fragaria x vescana) (סעיף 1). ניתוחי המיקרוביוטה מניסויי השדה טרם נותחו במלואם ואינם מוצגים כאן (סעיף 2). התוצאות של פרוטוקול זה, כאשר הן נקראות באופן ישיר (כפי שמוצג בסעיפים 3 ו-4) או בעקיפין (סעיף 5), מספקות מדד לשיעור של אורגניזמים רגישים ועמידים פוטנציאליים לגלייפוסט במערך נתונים (איור 9). השימוש בשיטה זו נבדק עם אוסף של רצפי חלבוני EPSPS ממינים מיקרוביאליים של מיקרוביום הליבה של המעי האנושי שהתקבלו ממאגרים ציבוריים12. במחקר נותחו 890 זנים מ-101 מיני החיידקים הנפוצים ביותר בשיטת EPSPSClass כדי לכמת את שיעור החיידקים הרגישים והעמידות ביותר. התוצאות הראו כי 54% מהמינים במיקרוביום הליבה של המעיים האנושיים רגישים פוטנציאלית לגלייפוסט12. מגמה זו נצפתה גם ברוב העולם הפרוקריוטי; בנוסף, אצל אאוקריוטים (בעיקר צמחים ופטריות), שיעור המינים הרגישים הפוטנציאליים גבוה עוד יותרמ-12. יתר על כן, השתמשנו בשיטה זו כדי לכמת שינויים ברגישות בחלבון EPSPS ברמה מיקרו-אבולוציונית (איור 10)14. זיהינו שינויים במצב הרגישות ב-12 מתוך 32 קבוצות קרובות של פרוקריוטים שנותחו (טבלה 4)14. לפיכך, השימוש המתמשך ב-GBPs עלול לייצר דיסביוזה מיקרוביאלית (כלומר, חוסר איזון של מיני חיידקים רגישים ועמידים) במיקרוביום של צמחים, בעלי חיים וקרקע. יתר על כן, הועלתה ההשערה כי עלייה בחיידקים עמידים לגלייפוסט עשויה לקדם מיקרוביום עמיד למולטי-דרוג 14,41,42. לפיכך, פרוטוקול זה שופך אור על הפרשנות של כל התרחישים הללו, שכן שיטת סיווג EPSPS מספקת הערכה ישירה של הרגישות הפנימית של המיקרוביום לגלייפוסט. בשל הרגישות הפנימית של חלבון EPSPS לגלייפוסט נשמרת באופן פילוגנטי14, ניתן לבצע אקסטרפולציה של התוצאות ממערכי נתונים קיימים למיקרוביום לא ידוע (איור 8).
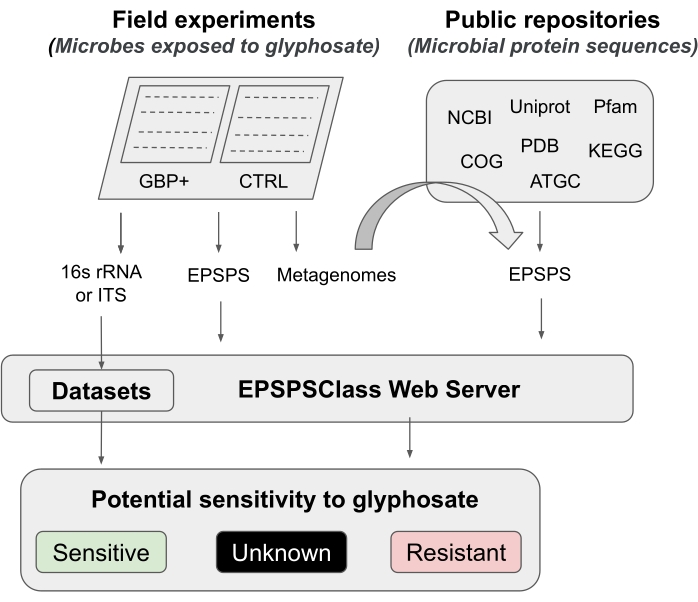
איור 1: צינור כללי זהו צינור כללי לניתוח רגישות לליש"ט מניסויי שדה ועד ניתוח ביואינפורמטיקה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
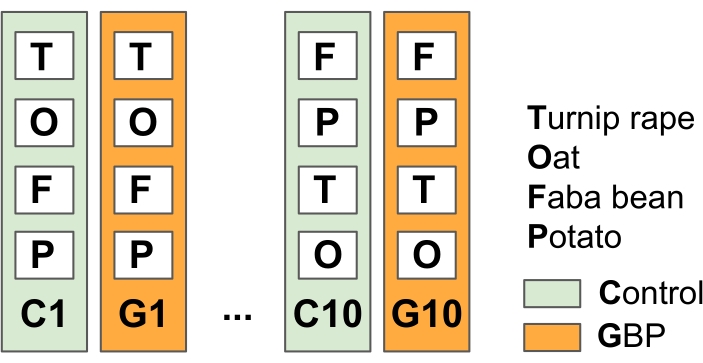
איור 2: ניסוי שדה 1 כדי לבחון את ההשפעות של שאריות ליש"ט על מיקרובים הקשורים לצמחי יבול. שדה הניסוי מורכב מ-10 חלקות בקרה מתחלפות ומחלקות טיפול של 10 ליש"ט (23 מ' x 1.5 מ') עם רצועות חיץ באורך 1.5 מ' בין החלקות. פעמיים בשנה מאז 2014, חלקות הליש"ט טופלו בליש"ט מסחריות (ריכוז גלייפוסט 450 גרם L-1, קצב יישום 6.4 ליטר ha-1 ב-5 ליטר של מי ברז לכל חלקה) ובחלקות הבקרה עם אותה כמות של מי ברז ללא גלייפוסט. הטיפולים יושמו באמצעות מיכל לחץ המופעל ביד באמצעות מכסה מנוע פלסטיק בקצה הממטרות כדי להגן על GBPs מפני התפשטות מחוץ לחלקות הטיפול. לאחר תקופת בטיחות של שבועיים בעקבות יישום הליש"ט, נזרעו שיבולת שועל (Avena sativa), שעועית פאבה (Vicia faba) ואונס לפת (Brassica rapa subsp. oleifera), ותפוחי אדמה (Solanum tuberosum) נשתלו בחלקות. דגימות מיקרוביוטה מצמחי היבול, העלים והשורשים שנחקרו, נאספו מספר פעמים מאז תחילת הניסוי בשנת 2014. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
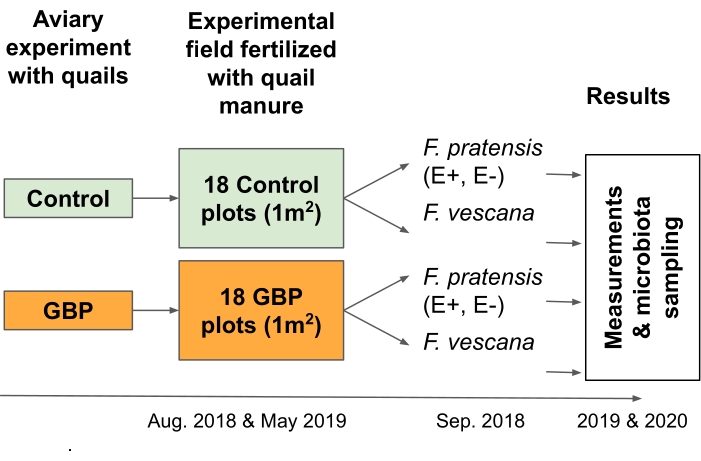
איור 3: ניסוי שדה 2 בדק את ההשלכות של שאריות ליש"ט בדשן זבל עבור שני גידולים רב-שנתיים והמיקרוביוטה הקשורה אליהם. מצעים שנאספו מניסוי של 12 חודשים בכלובים עם שליו יפניים שניזונו מהדברה או מזון מזוהם בליש"ט שימשו כדשן זבל בניסוי שדה. שדה הניסוי כלל 18 חלקות בקרה ו-18 ליש"ט (1 מ' x 1 מ') המסודרות ברשת של 6 X 6 על 6 לוח שחמט. המצעים היו מפוזרים על שדה הניסוי פעמיים, באוגוסט 2018 ובמאי 2019 (25 L / מגרש). חלקות הבקרה הופרו עם מצעים שנאספו משליו שהוזנו בהזנת בקרה וחלקות ליש"ט עם מצעים משליו שהוזנו במזון מזוהם ליש"ט. שאריות גלייפוסט במצעי בקרה היו 0.17 מ"ג/ק"ג גלייפוסט ובמצעי ליש"ט הכמות הייתה 158 מ"ג/ק"ג גלייפוסט. שני אנדופיטים-סימביוטיים (E+), שניים ללא אנדופיטים (E-) Festuca pratensis, ושני ווקנה של Fragaria x נשתלו לכל חלקה בספטמבר 2018, כחודש לאחר התפשטות המצעים הראשונים. מדידות של ביצועי הצמח וכושרו, כמו גם דגימה של מיקרוביוטה הקשורה לשורש ועלים, נערכו במהלך שתי עונות גידול רצופות (2019 ו-2020). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
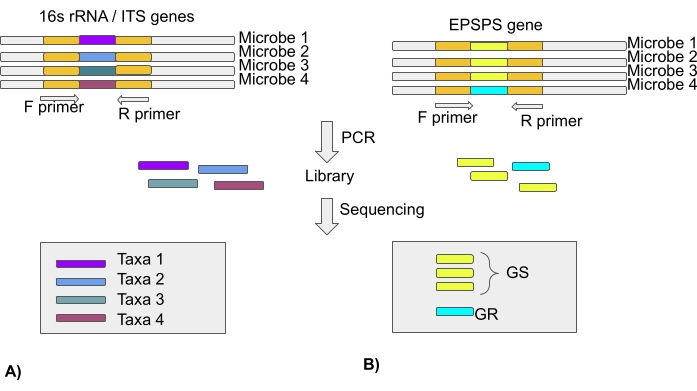
איור 4: ניתוח של הטקסה המיקרוביאלית באמצעות גן 16S rRNA/אזור ITS ורגישות של מיקרוביום לגלייפוסט באמצעות הגן EPSPS . (A) ניתוח של רצפי 16S rRNA או ITS לזיהוי טקסה מיקרוביאלית. (B) ניתוח רצפי EPSPS כדי לזהות רגישות של חיידקים לגלייפוסט (GS-גלייפוסט רגיש/GR-גלייפוסט עמיד) אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
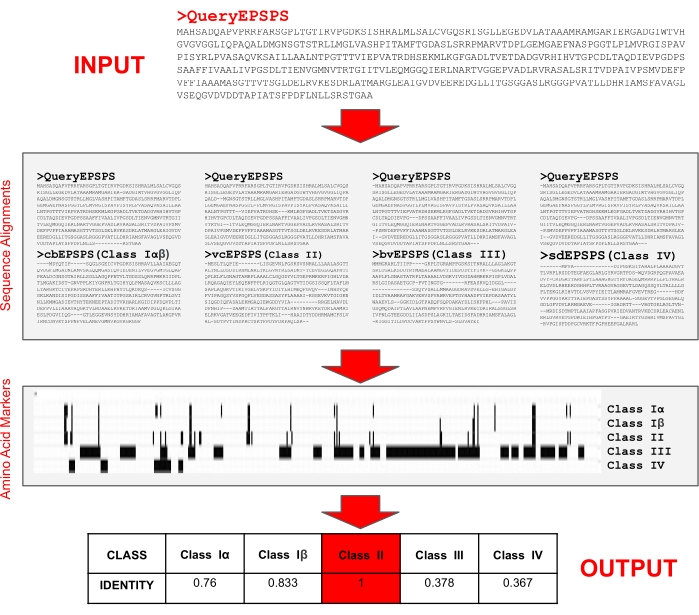
איור 5: אלגוריתם לזיהוי המחלקה של רצפי חלבוני EPSPS. הקלט הוא רצף חלבונים EPSPS בפורמט FASTA. האלגוריתם מבצע השוואות עם סמנים ידועים של חומצות אמינו ברצפי חלבוני ייחוס הקובעים את הרגישות הפוטנציאלית לגלייפוסט. האלגוריתם יושם בשרת האינטרנט הנגיש באופן חופשי EPSPSClass29. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 6: כניסות ויציאות בסיסיות של שרת האינטרנט EPSPSClass. (A) קלט: רצף חלבון EPSPS בפורמט FASTA. (B) פלט 1 - זהות: שבר של סמני חומצות אמינו הנמצאים ברצפי השאילתות (מחלקות I-IV) ובמוטיבים (Class III). (C) פלט 2 - זהות: יישורים של השאילתה ורצפי ההפניה. (D) פלט 3 - יישור זוגי של רצפי השאילתה וההפניות. (E) רצפי EPSPS ייחוס: Vibrio cholerae (vcEPSPS, מחלקה I), Coxiella burnetii (cbEPSPS, מחלקה II), Brevundimonas vesicularis (bvEPSPS, מחלקה III), Streptomyces davawensis (sdEPSPS, מחלקה IV). (ו) קישורים לביצוע חיפושי פיצוץ נוספים וזיהוי של דומיינים שמורים אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
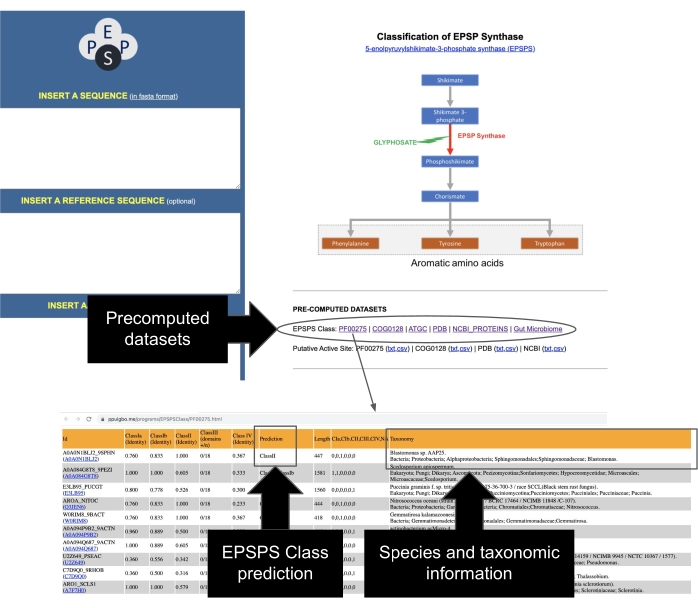
איור 7: גישה לערכות נתונים מחושבות מראש של רצפי EPSPS. עקוב אחר האינדיקציות באיור כדי לגשת לערכת הנתונים המחושבת מראש של רצפי EPSPS. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
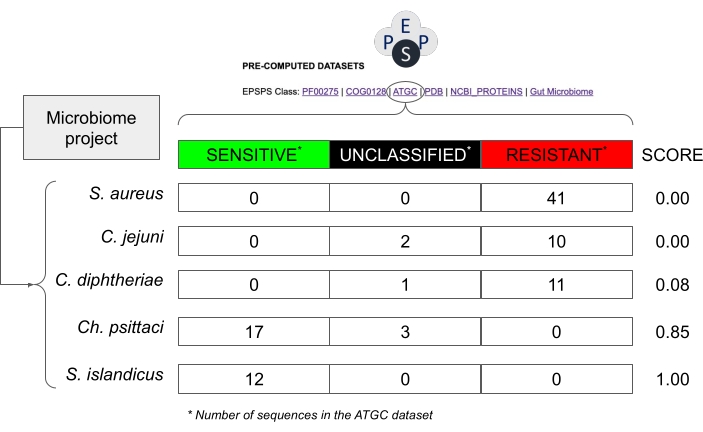
איור 8: דוגמה לאופן שבו ניתן להעריך את הרגישות הפוטנציאלית בפרויקטים של מיקרוביום ללא רצפי EPSPS. הדוגמה משתמשת בערכים ממסד הנתונים של צבירים גנומיים הדוקים הניתנים ליישור30, המכיל רצפים ממינים פרוקריוטים. מינים היפותטיים מפרויקט מיקרוביום הם סטפילוקוקוס אאורוס, קורינביבקטריום דיפתריה, קמפילובקטר ג'ג'וני, כלמידיה פסיטאצ'י וסולפולובוס איילנדיקוס. ציון הרגישות לגלייפוסט מחושב כ Number_Sensitive_Sequences/Total_Number_Of_Sequences. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
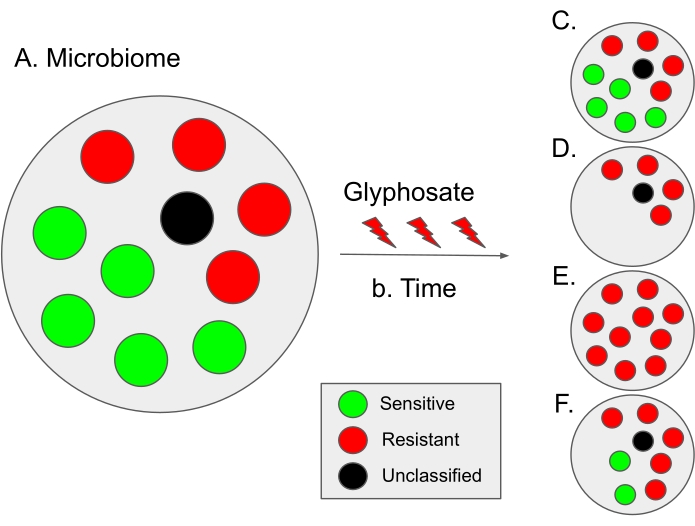
איור 9: סכמת הפרשנות של התוצאות מפרוטוקול זה ומתרחישים אבולוציוניים היפותטיים. נקודות שחורות מציינות מינים מיקרוביאליים שאינם מסווגים; לפיכך, רגישותם לגלייפוסט אינה ידועה. בחלק מהמיקרוביום, שיעור החיידקים הרגישים מעט גבוה יותר, כמו במיקרוביום של המעייםהאנושיים 12. (B) לאורך זמן, השימוש בגלייפוסט עלול להוביל לדיסביוזה מיקרוביאלית (כלומר, חוסר איזון בשיעור החיידקים הרגישים והעמידות) ולהוביל לתרחישים היפותטיים שונים. (C) מקרה היפותטי 1 (ללא סלקציה): השימוש בגלייפוסט אינו משפיע על המיקרוביום; לפיכך, חלקם של חיידקים רגישים ועמידים נשאר קבוע. (D) מקרה היפותטי 2: השימוש בגלייפוסט מסיר מהאוכלוסייה חיידקים הרגישים לגלייפוסט. אנו משערים כי תרחיש זה עשוי להיות תלוי מינון. (E) מקרה היפותטי 3: לחץ בחירה משימוש בגלייפוסט משפר מוטציות בגן EPSPS שמשנות את מצב הרגישות של חיידקים. לפיכך, כל האוכלוסייה המיקרוביאלית הופכת עמידה בפני גלייפוסט. יתר על כן, בתרחיש זה, ייתכן שתהיה עלייה בחיידקים עמידים למולטי-דרוגים. (F) מקרה היפותטי 4: השימוש בגלייפוסט משנה את הרכבם של מיני חיידקים מסוימים, ומייצר חוסר איזון כלפי חיידקים עמידים, בעוד שכמה מיני חיידקים נותרים ללא שינוי, אולי בשל מנגנונים עמידים נוספים כגון משאבות efflux או על ידי ביטוי יתר של הגן EPSPS 13. תרחיש זה עשוי גם להוביל לעלייה בחיידקים עמידים לגלייפוסט, כמו גם לעלייה בעמידות החיידקים לאנטיביוטיקה נוספת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
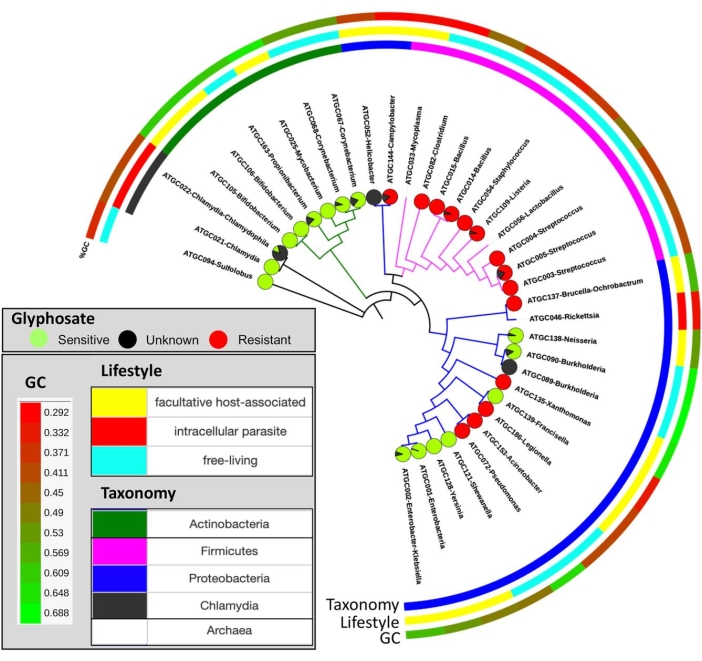
איור 10: התפלגות הרגישות החזויה לגלייפוסט על פני עץ המין. תרשימי עוגה מציינים את שיעור המינים הרגישים (ירוק) או עמידים (אדומים) לגלייפוסט, ולא מסווגים (שחורים). נתון זה הותאם באישור Rainio et al.14. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
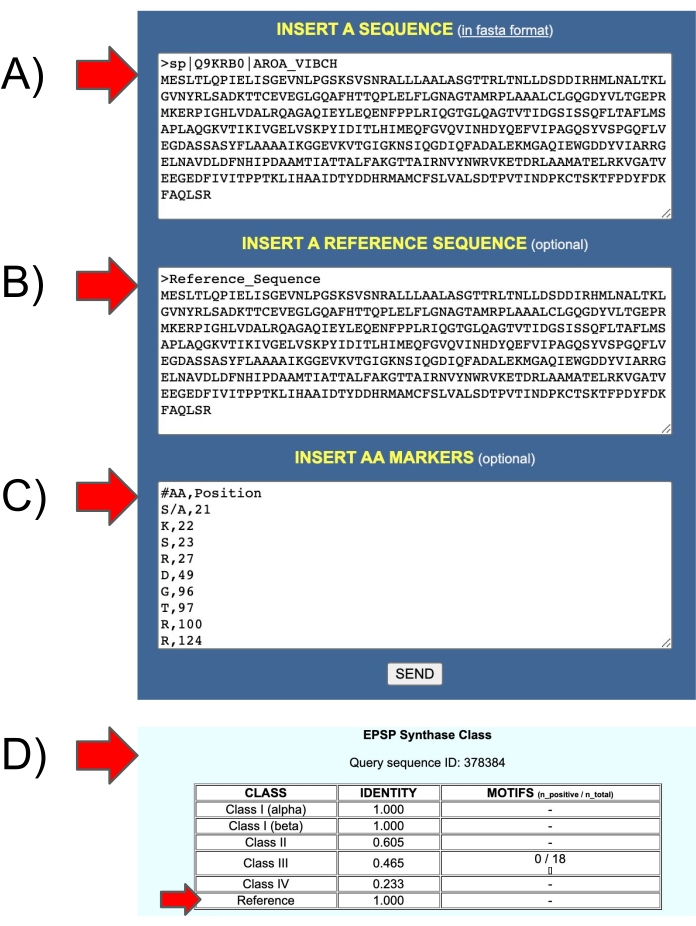
איור 11: כניסות ויציאות של שרת האינטרנט EPSPSClass כדי לבדוק את רצף ההפניות של המשתמש עצמו. (ב) קלט 2: רצף ייחוס. (C) קלט 3: סמני חומצות אמינו ברצפי הייחוס. (D) פלט: זהות: שבר של סמני חומצות אמינו ברצפי השאילתות (מחלקה I-IV ורצפי הייחוס של המשתמש עצמו). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
טבלה 1: רשימת פריימרים להגברת PCR של גן 16S rRNA ואזור ITS בניתוח מיקרוביום אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: קודים של האנזים 5-enolpyruvylshikimate-3-פוספט סינתאז (EPSPS) במסדי נתונים שונים אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: ריכוז גלייפוסט ממוצע אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 4: טבלה מסכמת של אחוז המינים הרגישים/עמידים לגלייפוסט. טבלה זו הותאמה באישור Rainio et al.14. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 5: מיקומי סמני חומצות האמינו ברצפי הייחוס אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
פרוטוקול זה מספק הדרכה כללית כיצד לכמת את ההשפעה של GBP על מיקרוביום בהתבסס על ניתוח של חלבון EPSPS. לפרוטוקול יש שלושה שלבים קריטיים עיקריים: (i) כימות של חלבון EPSPS מנתוני מיקרוביום. שלב זה הוא קריטי מכיוון ש-EPSPS הוא אנזים המטרה הישיר של קוטל העשבים. לפיכך, מינים שיש להם עותק של הגן EPSPS עשויים להיות מושפעים מהשימוש בליש"ט. עם זאת, אפילו מינים שאין להם עותק של הגן EPSPS עשויים להיות מושפעים מקוטל העשבים באמצעות מנגנונים חלופיים שאינם מטרה43,44. (ii) אם הניתוח של הגן EPSPS אינו נכלל בתכנון המחקר, ניתן לקבל הערכה טובה על ידי ניתוח 16S rRNA (חיידקים) או ITS (פטריות). במקרה זה, חיוני להסתמך על טבלת ייחוס מקיפה (לדוגמה, מסד הנתונים ATGC מספק רצפים של חלבון EPSPS מכמה מינים קרובים). (iii) חלבון ה-EPSPS מחולק לרגיש או עמיד בפני גלייפוסט, בהתאם לשאריות מסוימות של חומצות אמינו של האתר הפעיל של ה-EPSPS. עם זאת, מוטציות המשפיעות על חומצת אמינו אחת עשויות לשנות סיווג זה45 ומעברים בין המעמדות עשויים להתרחש בפרק זמן קצר יחסית14.
את הרגישות הפוטנציאלית של אורגניזמים לגלייפוסט ניתן לקבוע על ידי גנומים של ייחוס, סמני חומצות אמינו ויישור רצפים. (i) גנומים של ייחוס: ניתן לסווג את האנזים EPSPS כרגיש פוטנציאלית (סוג I [אלפא או בטא]46,47) או עמיד (דרגות II 48,49, III50 ו- IV51) לגלייפוסט בהתבסס על נוכחותם של סמנים ומוטיבים של חומצות אמינו (במקרה של מחלקה III). סמנים ומוטיבים אלה של חומצות אמינו מבוססים על מיקומם של שאריות חומצות אמינו בחלבון EPSPS של Vibrio cholerae (vcEPSPS, מחלקה I), Coxiella burnetii (cbEPSPS, מחלקה II), Brevundimonas vesicularis (bvEPSPS, class III) ו-Streptomyces davawensis (sdEPSPS, מחלקה IV). (ii) סמני חומצות אמינו: גלייפוסט מתקשר עם האנזים EPSPS ומתחרה בפוספונולפירובט (PEP, הסובסטרט השני של אנזים EPSPS)52,53. במינים מסוימים, שינויים קטנים בחומצות אמינו ברצף EPSPS מספקים זיקה גבוהה יותר ל-PEP ועמידות בפני גלייפוסט 12,14,52,54,55. ברצפים אחרים, גלייפוסט קושר את רצף EPSPS בקונפורמציה לא מעכבת 45. למרות שתוארו רצפים עמידים רבים של 12,14,48,49,52,54,55 וסובלניים ל-56,57 EPSP לגלייפוסט, מערכת הסיווג הנוכחית של ה-EPSPS מחולקת לארבע מחלקות עיקריות (I-IV)12 (טבלה 5) ). (iii) יישור רצפים: על מנת לסווג אנזים EPSPS, ביצענו יישורים זוגיים, עם פרמטרים מרובים של תוכנית יישור רצף כברירת מחדל35-, של רצף השאילתה כנגד כל אחד מרצפי הייחוס (vcEPSPS, cbEPSPS, bvEPSPS ו- sdEPSPS). יישורים אלה נחוצים כדי לזהות את מיקומם של סמני חומצות האמינו ברצף השאילתה. כתוצאה מכך, אנזים מסווג כמתוארב-12 דרגות I, II ו/או IV בהתבסס על נוכחותם של סמני חומצות אמינו וסמני מוטיבים מבוססי דרגה III.
הפרוטוקול מבוסס על ארבעה סוגים ידועים של EPSPS: סוג אחד רגיש, שלושת האחרים עמידים). עם זאת, כ-10% מרצפי ה-EPSPS בפרוקריוטים עדיין אינם מסווגים (16% בארכיאה ו-8% בחיידקים)12. לפיכך, מחקר נוסף צריך לנתח את הרצפים האלה כדי לקבוע את הרגישות לגלייפוסט. שרת EPSPSClass מספק אפשרות לבדיקת סמנים גנטיים חדשים. הזיהוי של מחלקות ידועות של EPSPS הוא פשוט, כפי שמוצג בסעיף 4.4. ואיור 5. יתר על כן, באותם מקרים שבהם משתמשים רוצים להשוות בין חלבוני השאילתה וההתייחסות שלהם, השרת מספק אפשרות לכלול באופן ידני רצף ייחוס וקבוצה של סמני חומצות אמינו (איור 11). ניתן להשתמש באפשרות זו כדי לזהות סוגים חדשים של EPSPS, כמו גם כדי לבדוק קוטלי עשבים אחרים ורצפי מטרה.
הניתוח של מחלקת EPSPS נקבע על ידי ניתוח רצף ונוכחות /היעדר סמנים של חומצות אמינו. זוהי הערכה ראשונית שיכולה לשמש לבדיקת השערות בתחום. סמני חומצות אמינו נקבעו בספרות על סמך מחקרים אמפיריים ותצפיתיים 46,47,48,49,50,51. עם זאת, רצפי חלבוני ייחוס לקביעת מחלקת EPSPS נבדקו רק במספר מוגבל של מינים, ולעתים הם עלולים שלא להסביר את העמידות לגלייפוסט. ההשפעה של מוטציות מפצות, ותחומים הקשורים ל-EPSPS (בעיקר בפטריות) עשויה גם היא להשפיע על הרגישות לגלייפוסט58. הניתוח של מאמר זה מבוסס על ארבע מחלקות EPSPS. סקר שנערך בקרב חיידקים במיקרוביום של המעיים האנושיים הראה שכ-30% מהם לא היו מסווגים (כלומר, חלבוני EPSPS ממינים אלה אינם שייכים לאף אחד מהסוגים הידועים), ויש צורך במחקרים נוספים כדי לזהות סוגים אחרים של EPSPS. כמו כן, יש לשים לב כי רצף החלבון EPSPS בחיידקים ובצמחים הוא יונידומאין, בעוד שחלבוני EPSPS פטרייתיים מכילים מספר תחומים59. לפיכך, קיפול חלבון בפטריות עשוי להוביל לתגובה שונה של אנזים EPSPS לגלייפוסט. יתר על כן, מנגנוני התנגדות נוספים שאינם מטרה (למשל, משאבות efflux וביטוי יתר של הגן EPSPS 13) או רגישות לגלייפוסט (למשל, השפעת גלייפוסט על שרשרת ההובלה המיטוכונדרית12) אינם נלקחים בחשבון.
אף על פי ש-GBPs קיימים כקוטל עשבים מאז 1974 ונמצאים בשימוש נרחב מאז 1991, זוהי השיטה הביואינפורמטית הראשונה שקובעת את הרגישות הפוטנציאלית של אורגניזמים לגלייפוסט. השיטה מבוססת על זיהוי שאריות חומצות אמינו ידועות ברצף המטרה. לפיכך, השיטה שלנו מספקת הערכה בסיסית של ההשפעה הפוטנציאלית של גלייפוסט על המין. בעתיד הקרוב, שיטות ביואינפורמטיקה חדשניות צריכות לכלול סוגים נוספים של חלבון EPSPS כדי לקבוע את הרגישות הפוטנציאלית לגלייפוסט של רצפים לא מסווגים 12,54,55. בנוסף, בהתחשב בכך שההתנהגות המדויקת של האנזים EPSPS עשויה להשתנות בהתאם לשינויים בחומצת אמינו בודדת 12,14,52,52,54,55, בהמשך בניסויי סיליקו יש לקחת בחשבון שינויים קטנים בקיפול חלבון EPSPS, כמו גם את ההשפעה של התחומים הקשורים ל- EPSPS על מבנה החלבון בפטריות 58 . יתר על כן, הוכח כי סובלנות לגלייפוסט עשויה להיות מיוצרת על ידי ביטוי יתר של חלבון EPSPS56,57; לפיכך, ניתן להשתמש בניתוחי ביואינפורמטיקה המבוססים על ההנמקה של השימוש בקודון60 כדי לזהות רצפי EPSPS חדשים שממקסמים או ממזערים את ביטוי הגנים.
חקלאים, פוליטיקאים ומקבלי החלטות זקוקים בדחיפות להבנה מעמיקה של הסיכונים הכרוכים בשימוש הכבד בחומרי הדברה. לפיכך, הן כלים ביואינפורמטיים החושפים את הרגישות הפוטנציאלית של אורגניזמים לחומרי הדברה והן מחקרים ניסיוניים משוכפלים היטב, אקראיים ומציאותיים בשדה שנערכו בסביבות שונות הם נחוצים. השיטה הביואינפורמטית המוצגת, שנועדה לבחון את רגישותם של אורגניזמים לגלייפוסט, ניתנת לווסת עבור חומרי הדברה אחרים. באופן דומה, ניתן ליישם את שיטות האקולוגיה הניסויית כדי לחקור כל שאלה אקולוגית קשורה. יחד, ניתן להשתמש בשיטות כדי להדגים נפגעים בין תצפיות שדה, נתונים גנומיים ושימוש בחומרי הדברה. כל השיטות המוצגות אינן יסולא בפז בהערכת סיכונים. שיטות ביואינפורמטיות יכולות לשמש, למשל, לניטור התאמות מיקרוביאליות לאגרוכימיקלים ולספק שיטה כמותית לבדיקת הסיכונים הפוטנציאליים האחרים הקשורים, כגון עלייה בעמידות של פתוגנים לאגרוכימיקלים, השפעות שליליות על חיידקים המשמשים כחומרי הדברה ביולוגית בניהול מזיקים משולב (IPM), ועמידות לאנטיביוטיקה בחיידקים.
Disclosures
ניגודי עניינים: אין.
Acknowledgements
עבודה זו מומנה על ידי האקדמיה של פינלנד (מענק מס '311077 למרג'ו הלנדר).
Materials
| Name | Company | Catalog Number | Comments |
| 2100 Bioanalyzer Instrument | Agilent | G2939B | To check the concentration and quality of PCR products |
| dNTP mix (10 mM each) | ThermoFisher Scientific | R0192 | For PCR reactions |
| GoTaq G2 DNA Polymerase kit | Promega | M7848 | PCR buffer and DNA Polymerase for PCR amplification |
| Invisorb Spin Plant Mini Kit | INVITEK Molecular | 1037100300 | Genomic DNA extraction from plant tissues |
| Ion Chip Minifuge | ThermoFisher Scientific | 4479672 | For targeted sequencing of microbial PCR products |
| Ion PGM System | ThermoFisher Scientific | 4462921 | For targeted sequencing of microbial PCR products |
| Ion PGM Torrent Server | ThermoFisher Scientific | 4483643 | For targeted sequencing of microbial PCR products |
| Pippinprep | SageScience | PIP0001 | For size fractionation of PCR amplicons |
| Pressure tank | Berthoud | 102140 | For sprayin glyphosate based products in field |
| Primers | Sigma Aldrich | Custom-made | For PCR amplification |
| Rotary tiller | Grillo | 984511 | For tilling the soil in experimental plots |
| S1000 ThermalCycler | BIO-RAD | 1852196 | For PCR amplification |
References
- Williams, G. M., Kroes, R., Munro, I. C. Safety evaluation and risk assessment of the herbicide Roundup and its active ingredient, glyphosate, for humans. Regulatory Toxicology and Pharmacology. 31, 117-165 (2000).
- Muola, A., et al. Risk in the circular food economy: Glyphosate-based herbicide residues in manure fertilizers decrease crop yield. The Science of the Total Environment. 750, 141422 (2021).
- Helander, M., Saloniemi, I., Saikkonen, K. Glyphosate in northern ecosystems. Trends in Plant Science. 17 (10), 569-574 (2012).
- Fuchs, B., Saikkonen, K., Helander, M. Glyphosate-Modulated Biosynthesis Driving Plant Defense and Species Interactions. Trends in Plant Science. 26 (4), 312-323 (2021).
- Helander, M., Saloniemi, I., Omacini, M., Druille, M., Salminen, J. -. P., Saikkonen, K. Glyphosate decreases mycorrhizal colonization and affects plant-soil feedback. The Science of the Total Environment. 642, 285-291 (2018).
- Bai, S. H., Ogbourne, S. M. Glyphosate: environmental contamination, toxicity and potential risks to human health via food contamination. Environmental Science and Pollution Research International. 23 (19), 18988-19001 (2016).
- Cuhra, M., Bøhn, T., Cuhra, P. Glyphosate: too much of a good thing. Frontiers in Environmental Science. 4, (2016).
- de Brito Rodrigues, L., et al. Impact of the glyphosate-based commercial herbicide, its components and its metabolite AMPA on non-target aquatic organisms. Mutation Research. 842, 94-101 (2019).
- Steinrücken, H. C., Amrhein, N. The herbicide glyphosate is a potent inhibitor of 5-enolpyruvylshikimic acid-3-phosphate synthase. Biochemical and Biophysical Research Communications. 94 (4), 1207-1212 (1980).
- Bentley, R. The shikimate pathway--a metabolic tree with many branches. Critical Reviews in Biochemistry and Molecular Biology. 25 (5), 307-384 (1990).
- Richards, T. A., et al. Evolutionary origins of the eukaryotic shikimate pathway: gene fusions, horizontal gene transfer, and endosymbiotic replacements. Eukaryotic Cell. 5 (9), 1517-1531 (2006).
- Leino, L., et al. Classification of the glyphosate target enzyme (5-enolpyruvylshikimate-3-phosphate synthase) for assessing sensitivity of organisms to the herbicide. Journal Of Hazardous Materials. 408, 124556 (2021).
- Rainio, M. J., Ruuskanen, S., Helander, M., Saikkonen, K., Saloniemi, I., Puigbò, P. Adaptation of bacteria to glyphosate: a microevolutionary perspective of the enzyme 5-enolpyruvylshikimate-3-phosphate (EPSP) synthase. BioRxiv. , (2020).
- Rainio, M. J., Ruuskanen, S., Helander, M., Saikkonen, K., Saloniemi, I., Puigbò, P. Adaptation of bacteria to glyphosate: a microevolutionary perspective of the enzyme 5-enolpyruvylshikimate-3-phosphate synthase. Environmental Microbiology Reports. 13 (3), 309-316 (2021).
- Helander, M., Pauna, A., Saikkonen, K., Saloniemi, I. Glyphosate residues in soil affect crop plant germination and growth. Scientific Reports. 9 (1), 19653 (2019).
- Ruuskanen, S., Rainio, M. J., Uusitalo, M., Saikkonen, K., Helander, M. Effects of parental exposure to glyphosate-based herbicides on embryonic development and oxidative status: a long-term experiment in a bird model. Scientific Reports. 10 (1), 6349 (2020).
- Ruuskanen, S., et al. female preference and adverse developmental effects of glyphosate-based herbicides on ecologically relevant traits in Japanese quails. Environmental Science & Technology. 54 (2), 1128-1135 (2020).
- Mäki, A., Rissanen, A. J., Tiirola, M. A practical method for barcoding and size-trimming PCR templates for amplicon sequencing. Biotechniques. 60 (2), 88-90 (2016).
- Chelius, M. K., Triplett, E. W. The diversity of archaea and bacteria in association with the roots of Zea mays L. Microbial Ecology. 41 (3), 252-263 (2001).
- Lane, D. J. 16S/23S rRNA sequencing. Nucleic acid techniques in bacterial systematics. , 115-175 (1991).
- Ghyselinck, J., Pfeiffer, S., Heylen, K., Sessitsch, A., De Vos, P. The effect of primer choice and short read sequences on the outcome of 16S rRNA gene based diversity studies. Plos One. 8 (8), 71360 (2013).
- Zheng, D., Alm, E. W., Stahl, D. A., Raskin, L. Characterization of universal small-subunit rRNA hybridization probes for quantitative molecular microbial ecology studies. Applied and Environmental Microbiology. 62 (12), 4504-4513 (1996).
- . JoVE Supplementary Material Available from: https://ppuigbo.me/programs/EPSPSClass/JOVE_SM (2021)
- . Alignments Conserved Positions Available from: https://ppuigbo.me/programs/primers (2021)
- . NCBI GenBank Available from: https://www.ncbi.nim.nih.gov/genbank (2021)
- . COG Database Available from: https://www.ncbi.nim.nih.gov/research/cog (2021)
- . Protein Data Bank Available from: https://www.rcsb.org (2021)
- . EPSPSClass Available from: https://ppuigbo.me/programs/EPSPSClass (2021)
- Kristensen, D. M., Wolf, Y. I., Koonin, E. V. ATGC database and ATGC-COGs: an updated resource for micro- and macro-evolutionary studies of prokaryotic genomes and protein family annotation. Nucleic Acids Research. 45, 210-218 (2017).
- . CSC - IT CENTER FOR SCIENCE LTD Available from: https://www.csc.fi (2021)
- Altschul, S. F., Gish, W., Miller, W., Myers, E. W., Lipman, D. J. Basic local alignment search tool. Journal of Molecular Biology. 215 (3), 403-410 (1990).
- Edgar, R. C. MUSCLE: multiple sequence alignment with high accuracy and high throughput. Nucleic Acids Research. 32 (5), 1792-1797 (2004).
- Tkacz, A., Hortala, M., Poole, P. S. Absolute quantitation of microbiota abundance in environmental samples. Microbiome. 6 (1), 110 (2018).
- El-Gebali, S., et al. The Pfam protein families database in 2019. Nucleic Acids Research. 47, 427-432 (2019).
- Benson, D. A., et al. GenBank. Nucleic Acids Research. 41, 36-42 (2013).
- Galperin, M. Y., Makarova, K. S., Wolf, Y. I., Koonin, E. V. Expanded microbial genome coverage and improved protein family annotation in the COG database. Nucleic Acids Research. 43, 261-269 (2015).
- Burley, S. K., Berman, H. M., Kleywegt, G. J., Markley, J. L., Nakamura, H., Velankar, S. Protein data bank (PDB): the single global macromolecular structure archive. Methods in Molecular Biology. 1607, 627-641 (2017).
- Raoult, D., Hadjadj, L., Baron, S. A., Rolain, J. -. M. Role of glyphosate in the emergence of antimicrobial resistance in bacteria. The Journal of Antimicrobial Chemotherapy. 76 (7), 1655-1657 (2021).
- Liu, J., Gefen, O., Ronin, I., Bar-Meir, M., Balaban, N. Q. Effect of tolerance on the evolution of antibiotic resistance under drug combinations. Science. 367 (6474), 200-204 (2020).
- Peixoto, F. Comparative effects of the Roundup and glyphosate on mitochondrial oxidative phosphorylation. Chemosphere. 61 (8), 1115-1122 (2005).
- Peillex, C., Pelletier, M. The impact and toxicity of glyphosate and glyphosate-based herbicides on health and immunity. Journal of Immunotoxicology. 17 (1), 163-174 (2020).
- Funke, T., Han, H., Healy-Fried, M. L., Fischer, M., Schönbrunn, E. Molecular basis for the herbicide resistance of Roundup Ready crops. Proceedings of the National Academy of Sciences of the United States of America. 103 (35), 13010-13015 (2006).
- Light, S. H., Krishna, S. N., Minasov, G., Anderson, W. F. An unusual cation-binding site and distinct domain-domain interactions distinguish Class II Enolpyruvylshikimate-3-phosphate synthases. Biochemistry. 55 (8), 1239-1245 (2016).
- Firdous, S., Iqbal, S., Anwar, S., Jabeen, H. Identification and analysis of 5-enolpyruvylshikimate-3-phosphate synthase (EPSPS) gene from glyphosate-resistant Ochrobactrum intermedium Sq20. Pest Management Science. 74 (5), 1184-1196 (2018).
- Barry, G. F., Kishore, G. M., Padgette, S. R., Stallings, W. C. Glyphosate-tolerant 5-enolpyruvylshikimate-3-phosphate synthases. United States Patient. , (1997).
- Priestman, M. A., Funke, T., Singh, I. M., Crupper, S. S., Schönbrunn, E. 5-Enolpyruvylshikimate-3-phosphate synthase from Staphylococcus aureus is insensitive to glyphosate. FEBS Letters. 579, 728-732 (2005).
- Carozzi, N., Carr, B., Hammer, P. E. Identification of a new class of EPSP synthases. World Intellectual Property Organization Publ.of the Int.Appl. without Int.search. , (2006).
- Lira, J. M., Cicchillo, R. M., Nair, S. K. Novel class of glyphosate resistance genes. US Patent. , (2013).
- Funke, T., et al. Structural basis of glyphosate resistance resulting from the double mutation Thr97 -> Ile and Pro101 -> Ser in 5-enolpyruvylshikimate-3-phosphate synthase from Escherichia coli. The Journal of Biological Chemistry. 284 (15), 9854-9860 (2009).
- Schönbrunn, E., et al. Interaction of the herbicide glyphosate with its target enzyme 5-enolpyruvylshikimate 3-phosphate synthase in atomic detail. Proceedings of the National Academy of Sciences of the United States of America. 98 (4), 1376-1380 (2001).
- Stalker, D. M., Hiatt, W. R., Comai, L. A single amino acid substitution in the enzyme 5-enolpyruvylshikimate-3-phosphate synthase confers resistance to the herbicide glyphosate. The Journal of Biological Chemistry. 260 (8), 4724-4728 (1985).
- Eschenburg, S., Healy, M. L., Priestman, M. A., Lushington, G. H., Schönbrunn, E. How the mutation glycine96 to alanine confers glyphosate insensitivity to 5-enolpyruvyl shikimate-3-phosphate synthase from Escherichia coli. Planta. 216 (1), 129-135 (2002).
- Achary, V. M. M., et al. Overexpression of improved EPSPS gene results in field level glyphosate tolerance and higher grain yield in rice. Plant Biotechnology Journal. 18 (12), 2504-2519 (2020).
- Huang, Z., Liu, Y., Zhang, C., Jiang, C., Huang, H., Wei, S. Molecular basis of natural tolerance to glyphosate in Convolvulus arvensis. Scientific Reports. 9 (1), 8133 (2019).
- Tall, T. . A census analysis of the 5-enolpyruvylshikimate-3-phosphate (EPSP) synthase and EPSP-associated domains. , (2020).
- Tall, T., Puigbò, P. The glyphosate target enzyme 5-Enolpyruvyl Shikimate 3-Phosphate Synthase (EPSPS) contains several EPSPS-associated domains in fungi. ATLA Summary of Proceedings. 76 (1), 6 (2020).
- Puigbò, P., Guzmán, E., Romeu, A., Garcia-Vallvé, S. OPTIMIZER: a web server for optimizing the codon usage of DNA sequences. Nucleic Acids Research. 35, 126-131 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved