Method Article
Количественная оценка потенциального воздействия продуктов на основе глифосата на микробиомы
В этой статье
Резюме
Продукты на основе глифосата (GBP) являются наиболее распространенными гербицидами широкого спектра действия во всем мире. В этой статье мы представляем общие рекомендации по количественной оценке влияния GBP на микробиомы, от полевых экспериментов до анализа биоинформатики.
Аннотация
Продукты на основе глифосата (GBP) являются наиболее распространенными гербицидами широкого спектра действия во всем мире. Мишенью глифосата является фермент 5-энолпирувилшикимат-3-фосфатсинтаза (EPSPS) в шикиматном пути, который практически универсален в растениях. Ингибирование фермента останавливает выработку трех незаменимых аминокислот: фенилаланина, тирозина и триптофана. EPSPS также присутствует в грибах и прокариотах, таких как археи и бактерии; таким образом, использование GBP может оказать влияние на микробиомный состав почв, растений, травоядных животных и вторичных потребителей. Эта статья направлена на то, чтобы представить общие рекомендации по оценке влияния GBP на микробиомы от полевых экспериментов до биоинформатических анализов и предоставить несколько проверяемых гипотез. Представлены два полевых эксперимента для тестирования GBP на нецелевых организмах. Во-первых, отбираются и анализируются ассоциированные с растениями микробы из 10 реплицированных контрольных и обрабатывающих участков GBP, имитирующих непрохождение. Во втором эксперименте были получены образцы с экспериментальных участков, оплодотворенных либо птичим пометом, содержащим остатки глифосата, либо необработанным контрольным навозом. Биоинформатический анализ последовательностей белков EPSPS используется для определения потенциальной чувствительности микробов к глифосату. Первым шагом в оценке влияния GBP на микробиомы является определение их потенциальной чувствительности к ферменту-мишени (EPSPS). Микробные последовательности могут быть получены либо из публичных хранилищ, либо с помощью амплификации ПЦР. Однако в большинстве полевых исследований состав микробиома был определен на основе универсальных маркеров ДНК, таких как 16S рРНК и внутренний транскрибированный спейсер (ITS). В этих случаях чувствительность к глифосату может быть оценена только путем вероятностного анализа последовательностей EPSPS с использованием близкородственных видов. Количественная оценка потенциальной чувствительности организмов к глифосату, основанная на ферменте EPSPS, обеспечивает надежный подход для дальнейших экспериментов по изучению целевых и нецелевых резистентных механизмов.
Введение
Интенсивное использование пестицидов в современном сельском хозяйстве, несомненно, является одним из основных факторов, способствующих сокращениюбиоразнообразия1. В этой статье основное внимание уделяется глифосату, потому что продукты на основе глифосата (GBP) стали наиболее широко используемыми пестицидами во всем мире из-за их эффективности и доступной цены 2,3. В дополнение к уничтожению сорняков на сельскохозяйственных полях, GBP обычно используются в лесоводстве, городской среде и домашних садах; кроме того, они были объявлены нетоксичными для нецелевых организмов, если они используются в соответствии с инструкциями производителя. Однако все большее число недавних исследований показало, что остатки глифосата и продуктов его разложения могут задерживаться и переноситься в почвах, тем самым оказывая каскадное воздействие на нецелевые организмы 4,5,6,7,8. Эффекты глифосата не ограничиваются только растениями - шикиматный путь присутствует во многих грибах и прокариотах. Глифосат нацелен на фермент 5-энолпирувилшикимат-3-фосфатсинтазу (EPSPS) в шикиматном пути, также известном как aroA9. Этот фермент находится в центре шикиматного пути в синтезе трех незаменимых ароматических аминокислот (фенилаланина, тирозина и триптофана), и он присутствует в большинстве прокариот, растений и грибов10,11. Некоторые виды микроорганизмов развили частичную или абсолютную устойчивость к глифосату с помощью нескольких механизмов, включая мутации в последовательностях EPSPS. Таким образом, было высказано предположение, что использование GBP может оказывать прямое влияние на микробиомы растений и животных, включая микробиом кишечника человека 12,13,14. Тем не менее, использование GBP может оказать неблагоприятное воздействие практически на любую экосистемную функцию и услугу, основанную на микробах и процессах, облегчаемых микробами. Последующие угрозы могут касаться биохимических почвенных процессов, биологии опыления, а также благополучия животных и человека. Это требует более полного понимания того, как глифосат влияет на пути шикимата и методы оценки чувствительности микробов к глифосату.
В этом протоколе мы представляем конвейер для проверки влияния глифосата и GBP на микробиом, от полевых экспериментов до анализа биоинформатики. Мы подробно описываем недавно опубликованный метод биоинформатики, который может быть использован для определения потенциальной чувствительности организмов кглифосату 12. Насколько известно исследователям, это первый и пока единственный инструмент биоинформатики для оценки внутренней чувствительности фермента EPSPS к активному компоненту GBP. Этот метод биоинформатики основан на обнаружении известных аминокислотных маркеров в ферменте-мишени глифосата (EPSPS)12. Конвейер разделен на пять основных рабочих фаз (рисунок 1): 1) краткое введение в два полевых эксперимента для проверки эффекта GBP, 2) краткое резюме анализов микробиома (16S рРНК, ITS и ген EPSPS ), 3) сбор последовательностей EPSPS из общедоступных хранилищ, 4) определение потенциальной чувствительности организмов к глифосату и 5) оценка класса EPSPS по универсальным микробным маркерам (16S рРНК и ITS).
протокол
1. Два полевых эксперимента для проверки эффекта ГПП
ПРИМЕЧАНИЕ: В этом протоколе представлены два примера полевых экспериментальных проектов для проверки влияния GBP на микробы, связанные с растениями. Оба эксперимента были проведены на отведенных полях без предшествующей истории гербицидного или сельскохозяйственного использования в Ботаническом саду Университета Турку Руиссало в Финляндии (60º26'N, 22º10'E). Почва песчаная глина с высокой долей органического вещества.
- Эксперимент 1
ПРИМЕЧАНИЕ: Этот эксперимент был разработан для моделирования общих сельскохозяйственных методов беспахотного земледелия с применением GBP до и после вегетационного периода для борьбы с сорняками.- Разделите экспериментальное поле на 10 реплицированных контрольных и очистных участков GBP (23 м х 1,5 м) с буферными полосами растительности между участками (в данном исследовании весной 2014 г. 15) (Рисунок 2).
- Убедитесь, что участки обрабатываются роторным культиватором на глубину 5 см и обрабатываются два раза в год. Здесь участки обрабатывались в начале (май) и конце (октябрь) вегетационного периода.
- Обработать контрольные участки водопроводной водой (5 л/участок) и участки ГБИТ коммерческими ГМП (концентрация глифосата 450 г· L-1, норма внесения 6,4 л·га-1 в 5 л водопроводной воды на участок) для имитации максимально допустимой дозировки глифосата в сельскохозяйственной практике (3 кг·га-1).
- Применяйте процедуры с помощью ручного напорного бака с ручным опрыскивателем. Через две недели после применения GBP посейте овес (Avena sativa), бобы фаба (Vicia faba), рапс репы (Brassica rapa subsp. oleifera) и картофель (Solanum tuberosum) на участках в соответствии с сельскохозяйственной практикой.
- В течение вегетационного периода вручную пропалывайте участки, чтобы сохранить конкуренцию растений и структуру почвы как можно более похожими на контрольных и обработанных GBP участках.
- Возьмите пробу микробиоты из экспериментальных растений. В этом исследовании микробиота была отобрана последовательно с 2017 по 2020 год как на обработанных GBP, так и на контрольных участках лечения один раз в вегетационный период в течение исследования.
- Соберите десять реплик образцов растения (корня и листа) с поля, немедленно поместите их на лед и доставьте в лабораторию для дальнейшей обработки, как описано в разделе 2.1.
- Эксперимент 2
ПРИМЕЧАНИЕ: Этот эксперимент был разработан для проверки рисков, связанных с циркулярной продовольственной экономикой; точнее, он был разработан для изучения последствий остатков GBP в навозе, применяемом в качестве удобрения к сельскохозяйственным растениям2 (рисунок 3).- Собирайте подстилки, в том числе древесную стружку, фекалии и некоторые пролитые корма, от перепелов, питающихся загрязненными GBP или контрольными кормами в 12-месячном вольерном эксперименте16,17.
ПРИМЕЧАНИЕ: Корм, загрязненный GBP, состоял из органического корма для кур-несушек в сочетании с эквивалентом 160 мг глифосата / кг, что соответствует суточному потреблению 12-20 мг глифосата на килограмм массы тела у взрослых японских перепелов16,17. - Для валидации отправьте образцы в аккредитованную лабораторию для измерения концентрации глифосата в шести партиях корма.
- Кроме того, измерьте остатки глифосата в образцах экскрементов перепелов после 12 месяцев воздействия. Контрольную группу кормили тем же органическим кормом без добавления GBP16,17.
- Во время эксперимента в вольера меняйте постельные принадлежности еженедельно. Регулярно собирайте использованные постельные принадлежности в течение 8-12 месяцев воздействия от обработки GBP и контроля, бассейна за обработкой и храните в закрытых контейнерах в сухом, темном помещении для хранения при 6 ° C перед использованием в качестве удобрения.
- Распределите 12 л постельных принадлежностей вручную на каждом из 18 GBP и 18 контрольных участков (размер 1 м х 1 м) в сетке шахматной доски 6 x 6 в экспериментальном поле в двух точках времени. В этом исследовании постельные принадлежности были распространены в августе 2018 года и в мае 2019 года.
- Отправьте образцы постельного слоя в аккредитованную лабораторию для измерения концентрации глифосата непосредственно после его распространения (в этом исследовании в мае 2019 года).
- Посадите многолетние травы и клубничные растения на каждом участке, чтобы изучить их корневую и листовую микробиоту.
ПРИМЕЧАНИЕ: В этом исследовании четыре многолетних травяных растения (Festuca pratensis) и два растения клубники (Fragaria x vescana) были посажены на каждый участок и изучены на предмет их корневой и листовой микробиоты.
- Собирайте подстилки, в том числе древесную стружку, фекалии и некоторые пролитые корма, от перепелов, питающихся загрязненными GBP или контрольными кормами в 12-месячном вольерном эксперименте16,17.
2. Анализ микробиома (16S рРНК, ген ITS и EPSPS )
ПРИМЕЧАНИЕ: Большинство исследований микробиома основаны на анализе гена 16S рРНК для бактериальных и внутренних транскрибированных спейсерных областей (ITS) для грибковых сообществ с использованием технологий секвенирования следующего поколения. Таким образом, в документе отсутствует информация о типе EPSPS. Последовательности EPSPS от тысяч видов доступны в общедоступных репозиториях (раздел 3 протокола) (рисунок 4).
- Ген 16S рРНК
- Из отдельных образцов листьев и корней, собранных в экспериментах, описанных выше, идентифицируют эндофитные микробы (т.е. микробы, живущие внутри растительных тканей).
- Промыть образцы растений водопроводной водой, а затем стерилизовать их, чтобы удалить эпифитные микробы (то есть микробы на поверхности растительных тканей). Стерилизуют с использованием 3% отбеливателя в течение 3 мин, затем 70% раствор этанола в течение 1 мин, и трижды промывают автоклавной сверхчистой водой по 1 мин каждый.
- Заморозьте образцы при -80 °C до извлечения геномной ДНК.
- Выполните геномную экстракцию ДНК с использованием коммерчески доступного набора для экстракции ДНК растений в соответствии с протоколом производителя.
- Нацеливайтесь на переменные области V6-V8 гена 16S рРНК из извлеченных образцов ДНК, используя вложенный подход с дискриминирующими праймерами, которые связываются специфически с бактериальной ДНК18, тем самым сводя к минимуму амплификацию от ДНК растений-хозяев.
- После трех раундов полимеразной цепной реакции (ПЦР) пометьте ген-мишень штрих-кодом и последовательностями адаптеров, чтобы подготовить его в качестве шаблона для секвенирования. Выполните шаги 2.1.7- 2.1.11 для амплификации ПЦР
- Подготовьте мастер-смесь ПЦР для необходимого количества образцов таким образом, чтобы каждая реакция имела общий объем 30 мкФ и состояла из 30 нг ДНК, 1 буфера ПЦР, 0,2 мМ дНТП, 0,3 мкМ каждого праймера и 2000 Ед/мл ДНК-полимеразы. Выполните тот же шаг для второго и третьего раундов ПЦР.
- Для первого раунда ПЦР используют праймеры 799F19 и 1492R (модифицированные из20) (таблица 1). Установите профиль усиления на термоциклере (3-минутная начальная денатурация при 95 °C, за которой следуют 35 циклов денатурации при 95 °C в течение 45 с, отжиг при 54 °C в течение 45 с и расширение при 72 °C в течение 1 мин). Проводят окончательное наращивание при 72 °C в течение 5 мин.
- В качестве шаблона для второго раунда ПЦР проверяют амплификацию электрофорезом (5 мкл продуктов ПЦР на 1,5% агарозного геля) и затем разводят остальные 25 мкл продукта ПЦР в автоклавной сверхчистой воде в соотношении 1:10.
- Повторить ПЦР с разбавленными шаблонами ПЦР и праймерами uni-1062F21 и uni-1390R22 (таблица 1). Поддерживать те же условия реакции ПЦР и профиль амплификации (этап 2.1.8), за исключением уменьшения числа циклов до 25.
- Полученные продукты ПЦР разводят в автоклавной сверхчистой воде в соотношении 1:1. Провести третий раунд ПЦР для маркировки продуктов штрих-кодами и последовательностью P1-адаптеров с 8 циклами того же профиля ПЦР, как указано на этапе 2.1.8.
- Подготовка библиотеки
- Проверить концентрацию и качество продуктов ПЦР на биоанализаторе и объединить объемы, составляющие 30 нг ДНК каждого образца в пробирке объемом 1,5 мл, чтобы подготовить эквимолярную библиотеку.
- Выбирайте ампликоны размером 350-550 bp по размерному фракционированию с помощью автоматизированной системы подбора размера ДНК на кассете с агарозным гелем. Отметим, что это также исключает из библиотеки неспецифические ампликоны и реагенты ПЦР. Соберите элют, состоящий из ампликонов указанного размера, во флакон в кассете, в результате чего получится очищенная библиотека генов 16S рРНК.
- Выделите элют в пробирку объемом 1,5 мл и проверьте чистоту и концентрацию на биоанализаторе. Разбавить библиотеку ДНК с помощью автоклавной сверхчистой воды до конечной концентрации 26 пМ; образец готов к секвенированию.
- СВОЙ
ПРИМЕЧАНИЕ: Область ITS усиливается с помощью специфических для ITS праймеров (таблица 1), а полученный продукт ПЦР маркируется штрих-кодами и последовательностью адаптеров P1 для секвенирования.- Подготовьте мастер-микс ПЦР по тому же протоколу, что и упомянутый в разделе 2.1, с праймерами ITS .
- Установите профиль усиления на термоциклере в виде 5-минутной начальной денатурации при 95 °C с последующим 35 циклами денатурации, отжига и удлинения при 95 °C в течение 30 с, 55 °C в течение 30 с, 72 °C в течение 1 мин, соответственно, и конечного расширения 72 °C в течение 7 мин.
- Анализируют 5 мкл продукта ПЦР на 1,5 % агарозном геле и разводят оставшиеся 25 мкл до 1:10 с помощью автоклавной сверхчистой воды. Используйте разбавленный продукт ПЦР в качестве шаблона для второго раунда ПЦР.
- Подготовьте мастер-микс ПЦР для необходимого количества образцов (см. шаг 2.1.6) с помощью фармер со штрих-кодом и обратных грунтовок с маркировкой P1.1. Усиление с тем же профилем усиления, что и на шаге 2.3.2, за исключением использования 8 циклов.
- Подготовьте полученные продукты ПЦР к секвенированию в соответствии с протоколами, упомянутыми в разделе 2.2.
- Ген EPSPS
- Секвенировать и проанализировать гены EPSPS микробов.
ПРИМЕЧАНИЕ: В интересах выяснения того, изменило ли воздействие GBP состав чувствительных к глифосату и резистентных микробов в сообществе, гены EPSPS микробов должны быть секвенированы и проанализированы. Таким образом, было собрано 353 последовательности генов EPSPS из широкой коллекции микробных таксонов в базе данных Alignable Tight Genomic Clusters (ATGC), и все белковые последовательности были выровнены22. Эти выравнивания доступны в базе данныхATGC 23 и могут быть использованы для генерации грунтовок из законсервированных регионов. Простой в использовании инструмент биоинформатики предназначен для идентификации сохраненных областей из нескольких последовательностей, и это доступно на странице исследования Pere Puigbo24. Однако предоставление подробного описания этого веб-сервера выходит за рамки данной публикации. Тем не менее, перспективный протокол для использования этих праймеров для амплификации гена EPSPS для определения чувствительности микробиома к глифосату приведен на рисунке 4.
- Секвенировать и проанализировать гены EPSPS микробов.
3. Сбор последовательностей белков EPSPS из публичных репозиториев
- Последовательности EPSPS будут использоваться в исследованиях макроэволюции
- Собирать белки EPSPS из общедоступных репозиториев, таких как PFAM23 (база данных белковых семейств25), GenBank24 (база данных генов, геномов и белков26 ), COG25 (Кластеры ортологичных групп27; база данных ортологичных белков архей и бактерий); и PDB26 (Protein Data Bank28; база данных белковых структур).
Недавнее исследование, проведенное учеными, показало, что эти белки могут быть использованы для выполнения микроэволюционного и сравнительного анализа потенциального влияния глифосата на организмы, имеющие шикиматный путь12. Авторы разработали удобный веб-сайт, который собирает информацию о десятках тысяч последовательностей белков EPSPS29, включая вручную курируемый набор данных белков из микробиома кишечника человека12. Информация в этих предварительно вычисленных наборах данных включает текущую классификацию EPSPS на предполагаемые чувствительные и устойчивые к глифосату, таксономическую информацию о видах, аннотации активного сайта EPSPS и ссылки на базы данных PDB и NCBI. Кроме того, веб-сервер включает в себя идентификационные коды EPSPS и ссылки на несколько внешних баз данных (таблица 2).
- Собирать белки EPSPS из общедоступных репозиториев, таких как PFAM23 (база данных белковых семейств25), GenBank24 (база данных генов, геномов и белков26 ), COG25 (Кластеры ортологичных групп27; база данных ортологичных белков архей и бактерий); и PDB26 (Protein Data Bank28; база данных белковых структур).
- Последовательности EPSPS будут использоваться в исследованиях микроэволюции ATGC
ПРИМЕЧАНИЕ: Общие хранилища белковых последовательностей полезны для проведения сравнительных исследований среди относительно отдаленных организмов; однако потенциальный эффект глифосата относительно недавний с эволюционной точки зрения. Таким образом, в некоторых исследованиях необходимо сравнивать близкородственные виды (например, различные штаммы одного и того же вида бактерий), чтобы определить эффект глифосата14. В этих случаях база данных Alignable Tight Genomic Clusters (ATGC)30, которая содержит полный список тесно связанных архейных и бактериальных геномов, является более подходящим ресурсом. База данных ATGC содержит информацию о нескольких миллионах белков из тысяч геномов, организованных в сотни кластеров30. Каждый кластер генома является выровненным (геномы разделяют синтению более ≥85% их длины) и плотным (имеющим синонимическую скорость замещения ниже насыщения). Исследователи использовали набор данных ATGC в недавнем исследовании для анализа микроэволюционных изменений в белках EPSPS14. Для идентификации последовательности белка EPSPS в ATGC необходимы следующие шаги:- Загрузите всю базу данных АТГК по ссылке31 и все белки COG0128 (код, соответствующий белкам EPSPS в базе данных)32 в локальный проект.
ПРИМЕЧАНИЕ: Если исследователи/экспериментаторы базируются в Финляндии, CSC-IT Center for Science33 предоставляет средства хранения и программного обеспечения. Важно собрать все последовательности в формате FASTA. - Построена бластная база данных COG0128, содержащая ортологи белка EPSPS в репрезентативном наборе видов прокариот. CSC имеет предустановленную программу blast34 , позволяющую использовать команду makeblastdb -in COG0128.fa -dbtype prot для создания эталонной базы данных последовательностей EPSPS.
- Сопоставьте базу данных ATGC с COG0128.fa (белки EPSPS) с помощью итеративного бластного поиска с помощью команды blastp -query [ATGC_X.fa] -db [COG0128.fa] -max_target_seqs 1 -outfmt 6 -out tmpfile -evalue 1e-150.
- В результате он создает набор данных белковых последовательностей EPSPS внутри каждого из них. Предварительно вычисленный набор данных тесно связанных последовательностей белков EPSPS из базы данных ATGC доступен29.
- Загрузите всю базу данных АТГК по ссылке31 и все белки COG0128 (код, соответствующий белкам EPSPS в базе данных)32 в локальный проект.
4. Алгоритм определения потенциальной чувствительности организмов к глифосату (веб-сервер EPSPSClass: входы, обработка и выходы)
ПРИМЕЧАНИЕ: Исследователи реализовали простой в использовании сервер, который находится в свободном доступе в 29 для определения класса белковых последовательностей EPSPS12,35. Серверу требуется только ввод последовательности белка в формате FASTA для определения процента идентичности для каждого из классов EPSPS и их потенциальной чувствительности к глифосату. Кроме того, пользователи могут использовать веб-сервер для тестирования своих собственных эталонных последовательностей и аминокислотных маркеров. Во-первых, алгоритм (рисунок 5) выравнивает последовательности запросов и эталонные последовательности с помощью программы35 выравнивания нескольких последовательностей для определения положений аминокислот. Затем он ищет наличие аминокислотных маркеров для идентификации класса EPSPS (I, II, III или IV) последовательности запросов.
- Введите последовательность белка EPSPS в формате FASTA в текстовое поле ввода для определения класса фермента (рисунок 6A) и нажмите Send.
- Оцените потенциальную чувствительность последовательности запросов к глифосату (рисунок 6B-E) с предоставленных сервером выходных данных:
Результат 1: Доля аминокислотных маркеров (т.е. идентичности), присутствующих в последовательностях запросов (класс I, II и IV), и количество мотивов (класс III).
Вывод 2: Выравнивание последовательностей запросов и ссылок на основе остатков маркеров.
Вывод 3: Полное попарное выравнивание последовательностей запроса и ссылок.
Результат 4: Эталонные последовательности EPSPS: Vibrio cholerae (vcEPSPS, класс I), Coxiella burnetii (cbEPSPS, класс II), Brevundimonas vesicularis (bvEPSPS, класс III), Streptomyces davawensis (sdEPSPS, класс IV). - В конце выходной страницы найдите ссылки на внешние инструменты, такие как blastp и сохраненные домены, для дальнейшего анализа последовательности запросов EPSPS (рисунок 6F).
5. Оценка класса EPSPS по универсальным микробным маркерам (16S рРНК и ИТС )
ПРИМЕЧАНИЕ: Большинство исследований микробиома основаны на анализе 16S рРНК и/или ITS36. В таких случаях невозможно выполнить прямой анализ последовательности EPSPS. Таким образом, необходим вероятностный подход к оценке потенциальной чувствительности организмов к глифосату. Этот анализ прост и дает разумную оценку типа последовательностей EPSPS в проекте микробиома. Процесс разделен на 3 этапа (рисунок 7 и рисунок 8):
- Идентификация последовательностей EPSPS из общедоступных репозиториев. Класс EPSPS всеобъемлющего набора репрезентативных последовательностей был скомпилирован и предварительно вычислен из PFAM37, GenBank38, COG39, PDB40, ATGC30. Доступ к этим наборам данных осуществляется с главной страницы сервера EPSPSClass, содержащей таксономическую информацию и класс EPSPS из более чем 50 000 последовательностей (рисунок 7).
- Измерьте высоту экспериментальных растений два раза в неделю в течение вегетационного периода и взвесьте надземную биомассу растений в конце полевого сезона, чтобы сравнить рост растений на GBP и контрольных участках.
ПРИМЕЧАНИЕ: Анализы микробиоты из полевых экспериментов еще не были полностью проанализированы. - Используйте электронную таблицу для отображения бактериальных ОТУ (на основе 16S рРНК или ITS) из экспериментов с микробиомом в предварительно вычисленные наборы данных.
ПРИМЕЧАНИЕ: Предыдущие исследования показали, что класс EPSPS (т.е. внутренняя чувствительность к глифосату) высоко сохраняется в филогенетической группе14. Таким образом, относительно можно с уверенностью предположить, что близкородственные виды из высококонсервативных таксонов могут иметь аналогичные реакции EPSPS на глифосат (рисунок 8). - В той же электронной таблице рассчитайте внутреннюю чувствительность к глифосату на основе вероятностной оценки (S = s / (s + r + u), где S: Оценка чувствительности; s: количество потенциально чувствительных последовательностей; r: количество потенциально устойчивых последовательностей; u: количество неклассифицированных последовательностей), рассчитанных из известных последовательностей EPSPS в общедоступных базах данных.
ПРИМЕЧАНИЕ: Эта оценка колеблется от 0 (в таксоне нет чувствительных последовательностей EPSPS) до 1 (все последовательности в таксоне чувствительны к глифосату) (рисунок 8). Кроме того, существуют промежуточные значения, т.е. виды с чувствительными, устойчивыми или неизвестными штаммами.
Результаты
Цель этого протокола состоит в том, чтобы обеспечить общий конвейер, от полевых экспериментов до биоинформатических анализов, который количественно определяет потенциальную чувствительность организмов к гербициду глифосату. В эксперименте 2 средняя концентрация глифосата в корме для перепелов составляла 164 мг/кг, а средняя концентрация глифосата в образцах экскрементов (моча и фекалии вместе взятые) составляла 199 мг/кг. Подстилки, собранные у перепелов, которых кормили кормом, загрязненным GBP, имели в среднем 158 мг/кг, а контрольные подстилки - 0,17 мг/кг глифосата (таблица 3). В полевых экспериментах виды растений по-разному реагировали на остатки глифосата в почвах (раздел 1). Биомасса овса и рапса репы была выше в контрольных почвах по сравнению с почвами, обработанными GBP. Тем не менее, бобы фаба и картофель, по-видимому, выиграли от обработки GBP в конце15-го вегетационного периода. Глифосат в птичьем помете уменьшал рост растений в траве (Festuca pratensis) и клубнике (Fragaria x vescana) (секция 1). Анализы микробиоты из полевых экспериментов еще не были полностью проанализированы и не представлены здесь (раздел 2). Результаты этого протокола при чтении либо напрямую (как показано в разделах 3 и 4), либо косвенно (раздел 5), обеспечивают измерение доли потенциально чувствительных и устойчивых организмов к глифосату в наборе данных (рисунок 9). Использование этого метода было протестировано с коллекцией белковых последовательностей EPSPS из микробных видов основного микробиома кишечника человека, которые были получены из общественных хранилищ12. В исследовании 890 штаммов из 101 наиболее распространенных видов бактерий были проанализированы с помощью метода EPSPSClass для количественной оценки доли чувствительных и резистентных бактерий. Результаты показали, что 54% видов в основном микробиоме кишечника человека потенциально чувствительны кглифосату 12. Эта тенденция также наблюдается в большей части прокариотического мира; кроме того, у эукариот (в основном растений и грибов) доля потенциально чувствительных видов еще выше12. Более того, мы использовали этот метод для количественной оценки изменений чувствительности белка EPSPS на микроэволюционном уровне (рисунок 10)14. Мы выявили изменения статуса чувствительности в 12 из 32 тесно связанных групп проанализированных прокариот (таблица 4)14. Таким образом, непрерывное использование GBP может привести к микробному дисбактериозу (т.е. дисбалансу чувствительных и резистентных видов бактерий) в растительных, животных и почвенных микробиомах. Кроме того, было выдвинуто предположение, что увеличение количества устойчивых к глифосату бактерий может способствовать развитию микробиомов с множественной лекарственной устойчивостью 14,41,42. Таким образом, этот протокол проливает свет на интерпретацию всех этих сценариев, поскольку метод классификации EPSPS обеспечивает прямую оценку внутренней чувствительности микробиомов к глифосату. Благодаря внутренней чувствительности белка EPSPS к глифосату, филогенетически сохраненному14, можно экстраполировать результаты из существующих наборов данных в неизвестные микробиомы (рисунок 8).
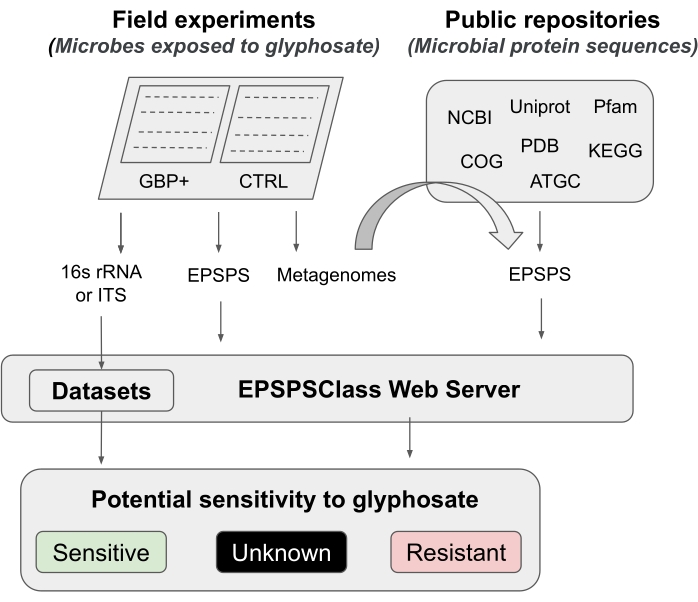
Рисунок 1: Общий конвейер Это общий конвейер для анализа чувствительности к GBP от полевых экспериментов до анализа биоинформатики. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
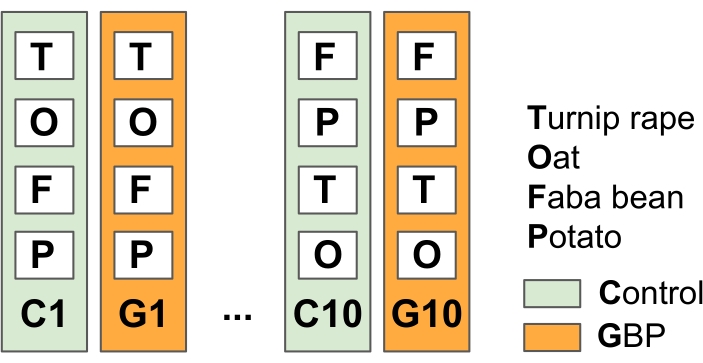
Рисунок 2: Полевой эксперимент 1 для проверки воздействия остатков GBP на микробы, связанные с растениями. Экспериментальное поле состоит из чередующихся 10 контрольных участков и 10 графиков обработки GBP (23 м х 1,5 м) с буферными полосами 1,5 м между участками. Два раза в год, начиная с 2014 года, участки GBP обрабатывались коммерческим GBP (концентрация глифосата 450 г L-1, норма внесения 6,4 л га-1 в 5 л водопроводной воды на участок) и контрольными участками с таким же количеством водопроводной воды без глифосата. Обработка применялась с помощью ручного напорного бака с использованием пластиковой вытяжки в наконечнике спринклера для защиты GBP от распространения за пределы участков обработки. После двухнедельного периода безопасности после применения GBP были посеяны овес (Avena sativa), бобы фаба (Vicia faba) и рапс репы (Brassica rapa subsp. oleifera), а картофель (Solanum tuberosum) был посажен на участках. Образцы микробиоты из изученных растений, листьев и корней, собирались несколько раз с начала эксперимента в 2014 году. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
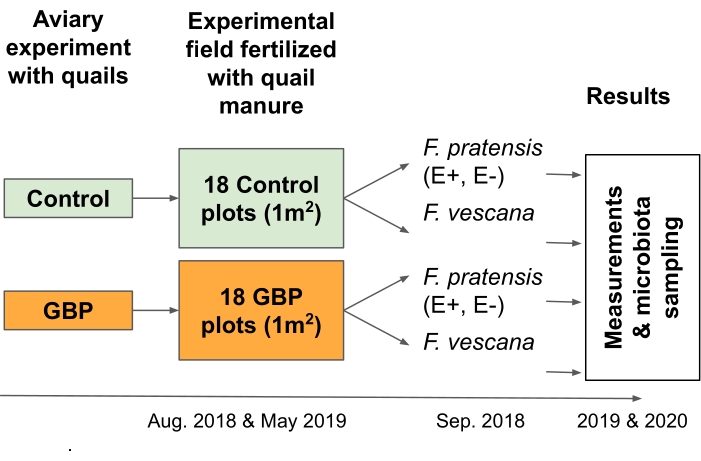
Рисунок 3: Полевой эксперимент 2 проверил последствия остатков GBP в удобрении навоза для двух многолетних культур и связанной с ними микробиоты. Подстилки, собранные из 12-месячного эксперимента с японскими перепелами, которых кормили контрольным или загрязненным GBP кормом, использовались в качестве удобрения для навоза в полевом эксперименте. Экспериментальное поле состояло из 18 контрольных и 18 фунтов стерлингов (1 м х 1 м), расположенных в шахматной сетке 6 х 6. Подстилки были распространены на экспериментальном поле дважды, в августе 2018 года и мае 2019 года (25 л/участок). Контрольные участки были удобрены подстилками, собранными с перепелов, которых кормили контрольным кормом, и участками GBP с подстилками от перепелов, которых кормили кормом, загрязненным GBP. Остатки глифосата в контрольных подстилках составляли 0,17 мг/кг глифосата, а в GBP-подстилке - 158 мг/кг глифосата. Два эндофита-симбиотика (E+), два безэндофита (E-) Festuca pratensis и две Fragaria x vescana были посажены на участок в сентябре 2018 года, примерно через месяц после распространения первых подстилок. Измерения продуктивности и пригодности растений, а также отбор проб для микробиоты, связанной с корнями и листьями, проводились в течение двух последовательных вегетационных периодов (2019 и 2020 годы). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
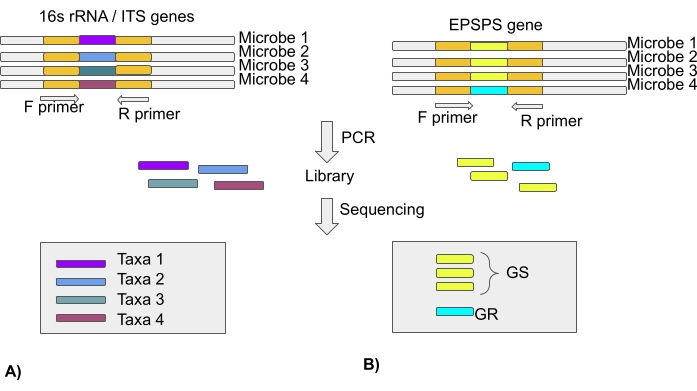
Рисунок 4: Анализ микробных таксонов с использованием области гена/ITS 16S рРНК и чувствительности микробиомов к глифосату с использованием гена EPSPS . (A) Анализ последовательностей 16S рРНК или ITS для идентификации микробных таксонов. (B) Анализ последовательностей EPSPS для определения чувствительности микробов к глифосату (чувствительный к GS-глифосату / устойчивый к GR-глифосату) Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
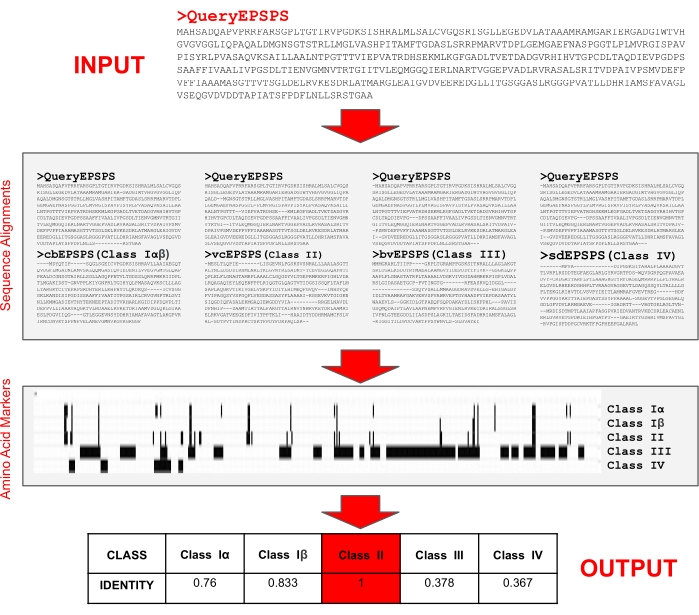
Рисунок 5: Алгоритм идентификации класса белковых последовательностей EPSPS. Вход представляет собой последовательность белка EPSPS в формате FASTA. Алгоритм выполняет сравнения с известными аминокислотными маркерами в эталонных белковых последовательностях, которые определяют потенциальную чувствительность к глифосату. Алгоритм реализован на свободно доступном веб-сервере EPSPSClass29. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Основные входы и выходы веб-сервера EPSPSClass. (A) Вход: последовательность белка EPSPS в формате FASTA. (B) Результат 1 - идентичность: доля аминокислотных маркеров, присутствующих в последовательностях запросов (классы I-IV) и мотивах (класс III). (C) Результат 2 - идентификация: выравнивание последовательностей запросов и ссылок. (D) Выходные данные 3 - попарное выравнивание последовательностей запроса и эталонных последовательностей. (E) Эталонные последовательности EPSPS: Vibrio cholerae (vcEPSPS, класс I), Coxiella burnetii (cbEPSPS, класс II), Brevundimonas vesicularis (bvEPSPS, класс III), Streptomyces davawensis (sdEPSPS, класс IV). (F) Ссылки для выполнения дополнительного поиска blastp и идентификации сохраненных доменов Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
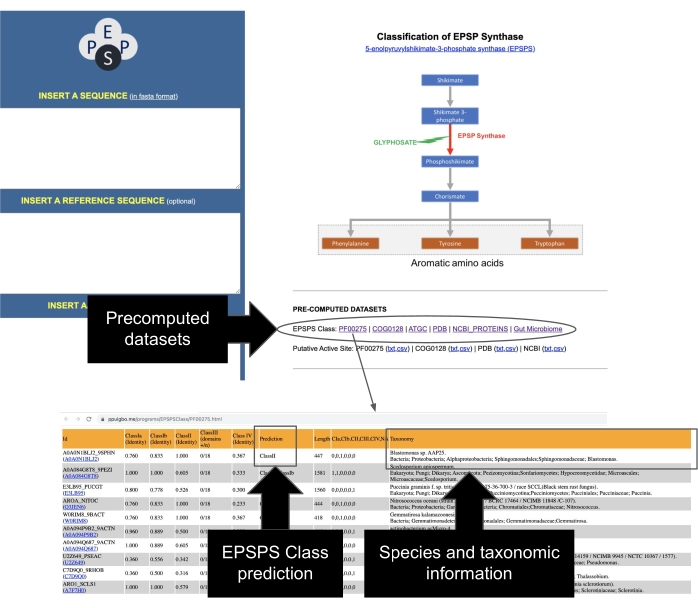
Рисунок 7: Доступ к предварительно вычисленным наборам данных последовательностей EPSPS. Следуйте указаниям на рисунке, чтобы получить доступ к предварительно вычисленному набору данных последовательностей EPSPS. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
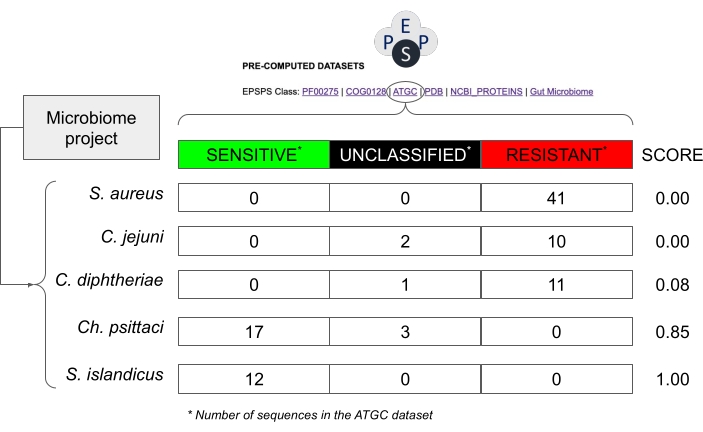
Рисунок 8: Пример оценки потенциальной чувствительности в проектах микробиома без последовательностей EPSPS. В примере используются значения из базы данных Alignable Tight Genomic Clusters30, которая содержит последовательности из прокариотических видов. Гипотетическими видами из проекта микробиома являются Staphylococcus aureus, Corynebacterium diphtheriae, Campylobacter jejuni, Chlamydia psittaci и Sulfolobus islandicus. Показатель чувствительности к глифосату рассчитывается как Number_Sensitive_Sequences/Total_Number_Of_Sequences. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
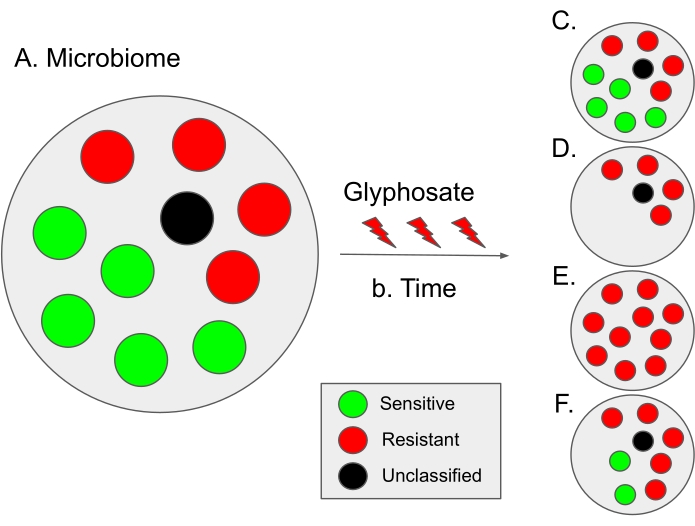
Рисунок 9: Схема интерпретации результатов из этого протокола и гипотетических эволюционных сценариев. (А) В микробиоме доля потенциальной чувствительности (зеленым цветом) и резистентности (красным) бактерий составляет примерно 50:50. Черные точки обозначают неклассифицированные микробные виды; таким образом, их чувствительность к глифосату неизвестна. В некоторых микробиомах доля чувствительных бактерий несколько выше, как в кишечном микробиоме человека12. (B) Со временем использование глифосата может привести к микробному дисбактериозу (т.е. дисбалансу в пропорции чувствительных и резистентных бактерий), что приведет к различным гипотетическим сценариям. (C) Гипотетический случай 1 (без отбора): использование глифосата не влияет на микробиом; таким образом, доля чувствительных и резистентных бактерий остается постоянной. (D) Гипотетический случай 2: Использование глифосата удаляет бактерии, чувствительные к глифосату, из популяции. Мы предполагаем, что этот сценарий может быть дозозависимым. (E) Гипотетический случай 3: Давление отбора от использования глифосата усиливает мутации в гене EPSPS , которые изменяют статус чувствительности бактерий. Таким образом, вся микробная популяция становится устойчивой к глифосату. Более того, в этом сценарии может наблюдаться увеличение количества бактерий с множественной лекарственной устойчивостью. (F) Гипотетический случай 4: использование глифосата изменяет состав некоторых видов бактерий, вызывая дисбаланс в сторону резистентных бактерий, в то время как некоторые виды бактерий остаются неизменными, возможно, из-за дополнительных устойчивых механизмов, таких как эффлюксные насосы или путем гиперэкспрессии гена EPSPS 13. Этот сценарий может также привести к увеличению резистентных к глифосату бактерий, а также к увеличению устойчивости бактерий к дополнительным антибиотикам. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
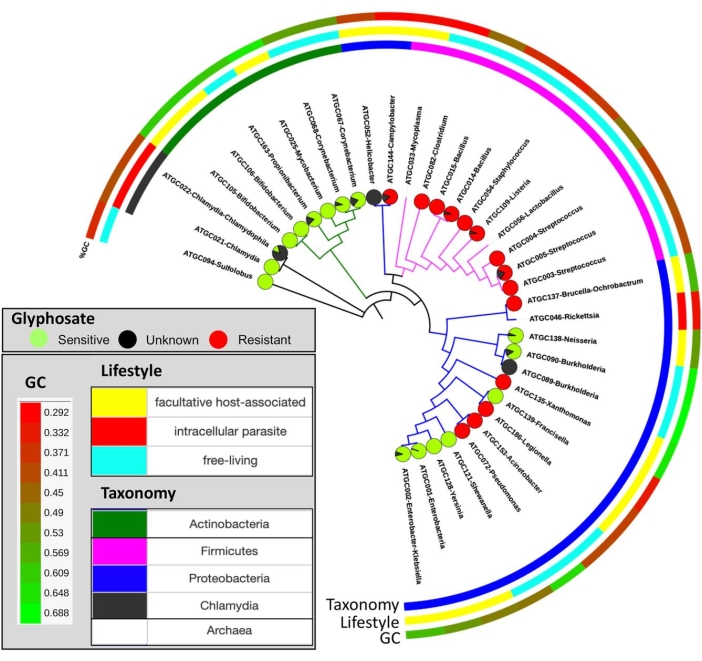
Рисунок 10: Распределение прогнозируемой чувствительности к глифосату по видовому дереву. Круговые диаграммы показывают долю видов, которые предположительно чувствительны (зеленый) или устойчивы (красный) к глифосату и неклассифицированы (черный). Эта цифра была адаптирована с разрешения Rainio et al.14. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
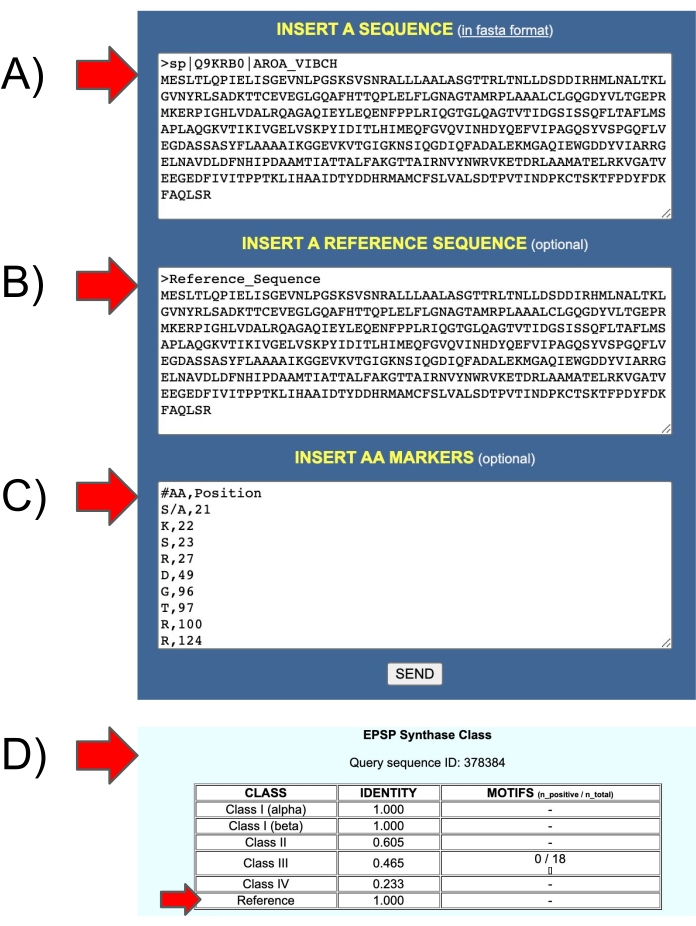
Рисунок 11: Входы и выходы веб-сервера EPSPSClass для тестирования собственной эталонной последовательности пользователя. (A) Вход 1: последовательность запросов. (B) Вход 2: эталонная последовательность. (C) Вход 3: аминокислотные маркеры в эталонных последовательностях. (D) Выходные данные: идентичность: доля аминокислотных маркеров в последовательностях запросов (класс I-IV и собственные эталонные последовательности пользователя). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Список праймеров для амплификации ПЦР гена 16S рРНК и области ITS в анализе микробиома Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Коды фермента 5-энолпирувилшикимат-3-фосфатсинтазы (EPSPS) в различных базах данных Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 3: Средняя концентрация глифосата Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 4: Сводная таблица процентной доли видов, чувствительных/устойчивых к глифосату. Эта таблица была адаптирована с разрешения Rainio et al.14. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 5: Положения аминокислотных маркеров в эталонных последовательностях Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Этот протокол предоставляет общие рекомендации о том, как количественно оценить влияние GBP на микробиомы на основе анализа белка EPSPS. Протокол состоит из трех основных критических этапов: (i) количественная оценка белка EPSPS на основе данных микробиома. Этот шаг имеет решающее значение, потому что EPSPS является ферментом-мишенью гербицида. Таким образом, виды, которые имеют копию гена EPSPS, могут быть затронуты использованием GBP. Тем не менее, даже виды, у которых отсутствует копия гена EPSPS, могут подвергаться воздействию гербицида с помощью альтернативных нецелевых механизмов 43,44. (ii) Если анализ гена EPSPS не включен в дизайн исследования, можно получить хорошую оценку, проанализировав 16S рРНК (бактерии) или ITS (грибы). В этом случае важно полагаться на всеобъемлющую справочную таблицу (например, база данных ATGC предоставляет последовательности белка EPSPS от нескольких близкородственных видов). (iii) Белок EPSPS подразделяется на потенциально чувствительные или устойчивые к глифосату в зависимости от определенных аминокислотных остатков активного центра EPSPS. Однако мутации, влияющие на одну аминокислоту, могут изменить эту классификацию45, и переходы между классами могут произойти за относительно короткий период времени14.
Потенциальная чувствительность организмов к глифосату может быть определена с помощью эталонных геномов, аминокислотных маркеров и выравниваний последовательностей. (i) Эталонные геномы: фермент EPSPS может быть классифицирован как потенциально чувствительный (класс I [альфа или бета]46,47) или устойчивый (классы II 48,49, III50 и IV51) к глифосату на основе присутствия аминокислотных маркеров и мотивов (в случае класса III). Эти аминокислотные маркеры и мотивы основаны на расположении аминокислотных остатков в белке EPSPS Vibrio cholerae (vcEPSPS, класс I), Coxiella burnetii (cbEPSPS, класс II), Brevundimonas vesicularis (bvEPSPS, класс III) и Streptomyces davawensis (sdEPSPS, класс IV). ii) Аминокислотные маркеры: глифосат взаимодействует с ферментом EPSPS и конкурирует с фосфоенолпируватом (PEP, второй субстрат фермента EPSPS)52,53. У некоторых видов небольшие аминокислотные изменения в последовательности EPSPS обеспечивают более высокое сродство к PEP и устойчивость к глифосату 12,14,52,54,55. В других последовательностях глифосат связывает последовательность EPSPS в неингибирующей конформации 45. Хотя было описано много устойчивых к глифосату последовательностей 12,14,48,49,52,54,55 и устойчивых к глифосату 56,57 EPSP, нынешняя система классификации EPSPS разделена на четыре основных класса (I-IV)12 (таблица 5). ). (iii) Выравнивание последовательностей: Чтобы классифицировать фермент EPSPS, мы выполнили попарные выравнивания с несколькими параметрами программы выравнивания последовательностей по умолчанию35- последовательности запросов для каждой из эталонных последовательностей (vcEPSPS, cbEPSPS, bvEPSPS и sdEPSPS). Эти выравнивания необходимы для определения положений аминокислотных маркеров в последовательности запросов. В результате фермент классифицируется как описанный12-й класс I, II и/или IV на основе наличия аминокислотных маркеров и мотивных маркеров класса III.
Протокол основан на четырех известных типах EPSPS: один тип чувствителен, остальные три устойчивы). Однако примерно 10% последовательностей EPSPS у прокариот еще не классифицированы (16% у архей и 8% у бактерий)12. Таким образом, дальнейшие исследования должны проанализировать эти последовательности, чтобы определить чувствительность к глифосату. Сервер EPSPSClass предоставляет возможность тестирования новых генетических маркеров. Идентификация известных классов EPSPS проста, как показано в разделе 4.4. и рисунок 5. Кроме того, в тех случаях, когда пользователи хотят сравнить свои собственные запросы и эталонные белки, сервер предоставляет возможность вручную включить эталонную последовательность и набор аминокислотных маркеров (рисунок 11). Этот вариант может быть использован для идентификации новых классов EPSPS, а также для тестирования других гербицидов и целевых последовательностей.
Анализ класса EPSPS определяется анализом последовательности и наличием/отсутствием аминокислотных маркеров. Это предварительная оценка, которая может быть использована для проверки гипотез в полевых условиях. Аминокислотные маркеры были определены в литературе на основе эмпирических и обсервационных исследований 46,47,48,49,50,51. Тем не менее, эталонные последовательности белков для определения класса EPSPS были протестированы только на ограниченном количестве видов и иногда могут не объяснять устойчивость к глифосату. Эффект компенсаторных мутаций и EPSPS-ассоциированных доменов (в основном у грибов) также может влиять на чувствительность кглифосату 58. Анализ данной статьи основан на четырех классах EPSPS. Исследование бактерий в кишечном микробиоме человека показало, что около 30% из них были неклассифицированы (то есть белки EPSPS из этих видов не принадлежат ни к одному из известных классов), и необходимы дополнительные исследования для выявления других классов EPSPS. Кроме того, следует отметить, что последовательность белка EPSPS у бактерий и растений является unidomain, тогда как грибковые белки EPSPS содержат несколько доменов59. Таким образом, сворачивание белка в грибах может привести к различной реакции фермента EPSPS на глифосат. Кроме того, не рассматриваются дополнительные нецелевые механизмы резистентности (например, эффлюксные насосы и сверхэкспрессия гена EPSPS 13) или чувствительности к глифосату (например, влияние глифосата на митохондриальную транспортную цепь12).
Хотя GBP существуют в качестве гербицида с 1974 года и широко используются с 1991 года, это первый метод биоинформатики для определения потенциальной чувствительности организмов к глифосату. Способ основан на идентификации известных аминокислотных остатков в целевой последовательности. Таким образом, наш метод обеспечивает базовую оценку потенциального влияния глифосата на вид. В ближайшем будущем новые методы биоинформатики должны включать дополнительные классы белка EPSPS для определения потенциальной чувствительности к глифосату неклассифицированных последовательностей 12,54,55. Кроме того, учитывая, что точное поведение фермента EPSPS может изменяться при изменении однойаминокислоты 12,14,52,54,55, дальнейшие эксперименты in silico должны учитывать небольшие вариации в сворачивании белка EPSPS, а также влияние EPSPS-ассоциированных доменов на структуру белка в грибах58 . Кроме того, было показано, что толерантность к глифосату может быть получена путем гиперэкспрессии белка EPSPS 56,57; таким образом, биоинформатический анализ, основанный на улучшении использования кодона60, может быть использован для идентификации новых последовательностей EPSPS, которые максимизируют или минимизируют экспрессию генов.
Фермеры, политики и лица, принимающие решения, срочно нуждаются в глубоком понимании рисков, связанных с интенсивным использованием пестицидов. Таким образом, необходимы как биоинформационные инструменты, раскрывающие потенциальную чувствительность организмов к пестицидам, так и хорошо воспроизведенные, рандомизированные и полевые реалистичные экспериментальные исследования, проводимые в различных средах. Представленный биоинформационный метод, предназначенный для изучения чувствительности организмов к глифосату, может модулироваться для других пестицидов. Точно так же методы экспериментальной экологии могут быть применены для изучения любых связанных с ними экологических вопросов. Вместе эти методы могут быть использованы для демонстрации потерь между полевыми наблюдениями, геномными данными и использованием пестицидов. Все представленные методы неоценимы в оценке рисков. Биоинформационные методы могут быть использованы, например, для мониторинга микробной адаптации к агрохимикатам и для обеспечения количественного метода проверки потенциальных других связанных рисков, таких как повышение устойчивости патогенов к агрохимикатам, негативное воздействие на микробы, используемые в качестве агентов биологического контроля в комплексной борьбе с вредителями (IPM), и устойчивость бактерий к антибиотикам.
Раскрытие информации
Конфликт интересов: отсутствует.
Благодарности
Эта работа финансировалась Академией Финляндии (грант No 311077 Марьо Хеландер).
Материалы
| Name | Company | Catalog Number | Comments |
| 2100 Bioanalyzer Instrument | Agilent | G2939B | To check the concentration and quality of PCR products |
| dNTP mix (10 mM each) | ThermoFisher Scientific | R0192 | For PCR reactions |
| GoTaq G2 DNA Polymerase kit | Promega | M7848 | PCR buffer and DNA Polymerase for PCR amplification |
| Invisorb Spin Plant Mini Kit | INVITEK Molecular | 1037100300 | Genomic DNA extraction from plant tissues |
| Ion Chip Minifuge | ThermoFisher Scientific | 4479672 | For targeted sequencing of microbial PCR products |
| Ion PGM System | ThermoFisher Scientific | 4462921 | For targeted sequencing of microbial PCR products |
| Ion PGM Torrent Server | ThermoFisher Scientific | 4483643 | For targeted sequencing of microbial PCR products |
| Pippinprep | SageScience | PIP0001 | For size fractionation of PCR amplicons |
| Pressure tank | Berthoud | 102140 | For sprayin glyphosate based products in field |
| Primers | Sigma Aldrich | Custom-made | For PCR amplification |
| Rotary tiller | Grillo | 984511 | For tilling the soil in experimental plots |
| S1000 ThermalCycler | BIO-RAD | 1852196 | For PCR amplification |
Ссылки
- Williams, G. M., Kroes, R., Munro, I. C. Safety evaluation and risk assessment of the herbicide Roundup and its active ingredient, glyphosate, for humans. Regulatory Toxicology and Pharmacology. 31, 117-165 (2000).
- Muola, A., et al. Risk in the circular food economy: Glyphosate-based herbicide residues in manure fertilizers decrease crop yield. The Science of the Total Environment. 750, 141422 (2021).
- Helander, M., Saloniemi, I., Saikkonen, K. Glyphosate in northern ecosystems. Trends in Plant Science. 17 (10), 569-574 (2012).
- Fuchs, B., Saikkonen, K., Helander, M. Glyphosate-Modulated Biosynthesis Driving Plant Defense and Species Interactions. Trends in Plant Science. 26 (4), 312-323 (2021).
- Helander, M., Saloniemi, I., Omacini, M., Druille, M., Salminen, J. -. P., Saikkonen, K. Glyphosate decreases mycorrhizal colonization and affects plant-soil feedback. The Science of the Total Environment. 642, 285-291 (2018).
- Bai, S. H., Ogbourne, S. M. Glyphosate: environmental contamination, toxicity and potential risks to human health via food contamination. Environmental Science and Pollution Research International. 23 (19), 18988-19001 (2016).
- Cuhra, M., Bøhn, T., Cuhra, P. Glyphosate: too much of a good thing. Frontiers in Environmental Science. 4, (2016).
- de Brito Rodrigues, L., et al. Impact of the glyphosate-based commercial herbicide, its components and its metabolite AMPA on non-target aquatic organisms. Mutation Research. 842, 94-101 (2019).
- Steinrücken, H. C., Amrhein, N. The herbicide glyphosate is a potent inhibitor of 5-enolpyruvylshikimic acid-3-phosphate synthase. Biochemical and Biophysical Research Communications. 94 (4), 1207-1212 (1980).
- Bentley, R. The shikimate pathway--a metabolic tree with many branches. Critical Reviews in Biochemistry and Molecular Biology. 25 (5), 307-384 (1990).
- Richards, T. A., et al. Evolutionary origins of the eukaryotic shikimate pathway: gene fusions, horizontal gene transfer, and endosymbiotic replacements. Eukaryotic Cell. 5 (9), 1517-1531 (2006).
- Leino, L., et al. Classification of the glyphosate target enzyme (5-enolpyruvylshikimate-3-phosphate synthase) for assessing sensitivity of organisms to the herbicide. Journal Of Hazardous Materials. 408, 124556 (2021).
- Rainio, M. J., Ruuskanen, S., Helander, M., Saikkonen, K., Saloniemi, I., Puigbò, P. Adaptation of bacteria to glyphosate: a microevolutionary perspective of the enzyme 5-enolpyruvylshikimate-3-phosphate (EPSP) synthase. BioRxiv. , (2020).
- Rainio, M. J., Ruuskanen, S., Helander, M., Saikkonen, K., Saloniemi, I., Puigbò, P. Adaptation of bacteria to glyphosate: a microevolutionary perspective of the enzyme 5-enolpyruvylshikimate-3-phosphate synthase. Environmental Microbiology Reports. 13 (3), 309-316 (2021).
- Helander, M., Pauna, A., Saikkonen, K., Saloniemi, I. Glyphosate residues in soil affect crop plant germination and growth. Scientific Reports. 9 (1), 19653 (2019).
- Ruuskanen, S., Rainio, M. J., Uusitalo, M., Saikkonen, K., Helander, M. Effects of parental exposure to glyphosate-based herbicides on embryonic development and oxidative status: a long-term experiment in a bird model. Scientific Reports. 10 (1), 6349 (2020).
- Ruuskanen, S., et al. female preference and adverse developmental effects of glyphosate-based herbicides on ecologically relevant traits in Japanese quails. Environmental Science & Technology. 54 (2), 1128-1135 (2020).
- Mäki, A., Rissanen, A. J., Tiirola, M. A practical method for barcoding and size-trimming PCR templates for amplicon sequencing. Biotechniques. 60 (2), 88-90 (2016).
- Chelius, M. K., Triplett, E. W. The diversity of archaea and bacteria in association with the roots of Zea mays L. Microbial Ecology. 41 (3), 252-263 (2001).
- Lane, D. J. 16S/23S rRNA sequencing. Nucleic acid techniques in bacterial systematics. , 115-175 (1991).
- Ghyselinck, J., Pfeiffer, S., Heylen, K., Sessitsch, A., De Vos, P. The effect of primer choice and short read sequences on the outcome of 16S rRNA gene based diversity studies. Plos One. 8 (8), 71360 (2013).
- Zheng, D., Alm, E. W., Stahl, D. A., Raskin, L. Characterization of universal small-subunit rRNA hybridization probes for quantitative molecular microbial ecology studies. Applied and Environmental Microbiology. 62 (12), 4504-4513 (1996).
- . JoVE Supplementary Material Available from: https://ppuigbo.me/programs/EPSPSClass/JOVE_SM (2021)
- . Alignments Conserved Positions Available from: https://ppuigbo.me/programs/primers (2021)
- . NCBI GenBank Available from: https://www.ncbi.nim.nih.gov/genbank (2021)
- . COG Database Available from: https://www.ncbi.nim.nih.gov/research/cog (2021)
- . Protein Data Bank Available from: https://www.rcsb.org (2021)
- . EPSPSClass Available from: https://ppuigbo.me/programs/EPSPSClass (2021)
- Kristensen, D. M., Wolf, Y. I., Koonin, E. V. ATGC database and ATGC-COGs: an updated resource for micro- and macro-evolutionary studies of prokaryotic genomes and protein family annotation. Nucleic Acids Research. 45, 210-218 (2017).
- . CSC - IT CENTER FOR SCIENCE LTD Available from: https://www.csc.fi (2021)
- Altschul, S. F., Gish, W., Miller, W., Myers, E. W., Lipman, D. J. Basic local alignment search tool. Journal of Molecular Biology. 215 (3), 403-410 (1990).
- Edgar, R. C. MUSCLE: multiple sequence alignment with high accuracy and high throughput. Nucleic Acids Research. 32 (5), 1792-1797 (2004).
- Tkacz, A., Hortala, M., Poole, P. S. Absolute quantitation of microbiota abundance in environmental samples. Microbiome. 6 (1), 110 (2018).
- El-Gebali, S., et al. The Pfam protein families database in 2019. Nucleic Acids Research. 47, 427-432 (2019).
- Benson, D. A., et al. GenBank. Nucleic Acids Research. 41, 36-42 (2013).
- Galperin, M. Y., Makarova, K. S., Wolf, Y. I., Koonin, E. V. Expanded microbial genome coverage and improved protein family annotation in the COG database. Nucleic Acids Research. 43, 261-269 (2015).
- Burley, S. K., Berman, H. M., Kleywegt, G. J., Markley, J. L., Nakamura, H., Velankar, S. Protein data bank (PDB): the single global macromolecular structure archive. Methods in Molecular Biology. 1607, 627-641 (2017).
- Raoult, D., Hadjadj, L., Baron, S. A., Rolain, J. -. M. Role of glyphosate in the emergence of antimicrobial resistance in bacteria. The Journal of Antimicrobial Chemotherapy. 76 (7), 1655-1657 (2021).
- Liu, J., Gefen, O., Ronin, I., Bar-Meir, M., Balaban, N. Q. Effect of tolerance on the evolution of antibiotic resistance under drug combinations. Science. 367 (6474), 200-204 (2020).
- Peixoto, F. Comparative effects of the Roundup and glyphosate on mitochondrial oxidative phosphorylation. Chemosphere. 61 (8), 1115-1122 (2005).
- Peillex, C., Pelletier, M. The impact and toxicity of glyphosate and glyphosate-based herbicides on health and immunity. Journal of Immunotoxicology. 17 (1), 163-174 (2020).
- Funke, T., Han, H., Healy-Fried, M. L., Fischer, M., Schönbrunn, E. Molecular basis for the herbicide resistance of Roundup Ready crops. Proceedings of the National Academy of Sciences of the United States of America. 103 (35), 13010-13015 (2006).
- Light, S. H., Krishna, S. N., Minasov, G., Anderson, W. F. An unusual cation-binding site and distinct domain-domain interactions distinguish Class II Enolpyruvylshikimate-3-phosphate synthases. Biochemistry. 55 (8), 1239-1245 (2016).
- Firdous, S., Iqbal, S., Anwar, S., Jabeen, H. Identification and analysis of 5-enolpyruvylshikimate-3-phosphate synthase (EPSPS) gene from glyphosate-resistant Ochrobactrum intermedium Sq20. Pest Management Science. 74 (5), 1184-1196 (2018).
- Barry, G. F., Kishore, G. M., Padgette, S. R., Stallings, W. C. Glyphosate-tolerant 5-enolpyruvylshikimate-3-phosphate synthases. United States Patient. , (1997).
- Priestman, M. A., Funke, T., Singh, I. M., Crupper, S. S., Schönbrunn, E. 5-Enolpyruvylshikimate-3-phosphate synthase from Staphylococcus aureus is insensitive to glyphosate. FEBS Letters. 579, 728-732 (2005).
- Carozzi, N., Carr, B., Hammer, P. E. Identification of a new class of EPSP synthases. World Intellectual Property Organization Publ.of the Int.Appl. without Int.search. , (2006).
- Lira, J. M., Cicchillo, R. M., Nair, S. K. Novel class of glyphosate resistance genes. US Patent. , (2013).
- Funke, T., et al. Structural basis of glyphosate resistance resulting from the double mutation Thr97 -> Ile and Pro101 -> Ser in 5-enolpyruvylshikimate-3-phosphate synthase from Escherichia coli. The Journal of Biological Chemistry. 284 (15), 9854-9860 (2009).
- Schönbrunn, E., et al. Interaction of the herbicide glyphosate with its target enzyme 5-enolpyruvylshikimate 3-phosphate synthase in atomic detail. Proceedings of the National Academy of Sciences of the United States of America. 98 (4), 1376-1380 (2001).
- Stalker, D. M., Hiatt, W. R., Comai, L. A single amino acid substitution in the enzyme 5-enolpyruvylshikimate-3-phosphate synthase confers resistance to the herbicide glyphosate. The Journal of Biological Chemistry. 260 (8), 4724-4728 (1985).
- Eschenburg, S., Healy, M. L., Priestman, M. A., Lushington, G. H., Schönbrunn, E. How the mutation glycine96 to alanine confers glyphosate insensitivity to 5-enolpyruvyl shikimate-3-phosphate synthase from Escherichia coli. Planta. 216 (1), 129-135 (2002).
- Achary, V. M. M., et al. Overexpression of improved EPSPS gene results in field level glyphosate tolerance and higher grain yield in rice. Plant Biotechnology Journal. 18 (12), 2504-2519 (2020).
- Huang, Z., Liu, Y., Zhang, C., Jiang, C., Huang, H., Wei, S. Molecular basis of natural tolerance to glyphosate in Convolvulus arvensis. Scientific Reports. 9 (1), 8133 (2019).
- Tall, T. . A census analysis of the 5-enolpyruvylshikimate-3-phosphate (EPSP) synthase and EPSP-associated domains. , (2020).
- Tall, T., Puigbò, P. The glyphosate target enzyme 5-Enolpyruvyl Shikimate 3-Phosphate Synthase (EPSPS) contains several EPSPS-associated domains in fungi. ATLA Summary of Proceedings. 76 (1), 6 (2020).
- Puigbò, P., Guzmán, E., Romeu, A., Garcia-Vallvé, S. OPTIMIZER: a web server for optimizing the codon usage of DNA sequences. Nucleic Acids Research. 35, 126-131 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены