Method Article
Focalización de la placa neural murina mediante nanoinyección in utero (NEPTUNE) en el día embrionario 7.5
En este artículo
Resumen
En este protocolo, describimos cómo inyectar lentivirus la cavidad amniótica del ratón en E7.5, lo que lleva a una transducción uniforme de toda la placa neural, con efectos perjudiciales mínimos sobre la supervivencia o el desarrollo embrionario.
Resumen
La manipulación de la expresión génica en el cerebro del ratón en desarrollo en el útero tiene un gran potencial para los estudios de genética funcional. Sin embargo, anteriormente se ha restringido en gran medida a la manipulación de etapas embrionarias posteriores a la neurulación. Se desarrolló un protocolo para inyectar la cavidad amniótica en el día embrionario (E)7.5 y administrar lentivirus, codificando cDNA o shRNA, apuntando al >95% de las células de la placa neural y la cresta neural, contribuyendo al futuro cerebro, médula espinal y sistema nervioso periférico. Este protocolo describe los pasos necesarios para lograr una transducción exitosa, incluida la molienda de las agujas capilares de vidrio, la verificación del embarazo, la estadificación del desarrollo mediante imágenes de ultrasonido y los volúmenes de inyección óptimos adaptados a las etapas embrionarias.
Siguiendo este protocolo, es posible lograr la transducción del >95% del cerebro en desarrollo con lentivirus de alto título y, por lo tanto, realizar la manipulación genética de todo el cerebro. En contraste, es posible lograr la transducción en mosaico utilizando títulos virales más bajos, lo que permite la detección genética o el rastreo del linaje. La inyección en E7.5 también se dirige al ectodermo y la cresta neural que contribuyen a distintos compartimentos del ojo, la lengua y el sistema nervioso periférico. Por lo tanto, esta técnica ofrece la posibilidad de manipular la expresión génica en tejidos derivados de la placa neuronal y el ectodermo de ratón desde las etapas de preneurulación, con el beneficio de reducir el número de ratones utilizados en experimentos.
Introducción
El cerebro y la médula espinal están entre los primeros órganos en iniciar la formación durante la embriogénesis 1,2. Aunque se están identificando los genes asociados con los trastornos del neurodesarrollo, el interrogatorio funcional de las variantes genéticas se haquedado atrás 3,4. Como la generación de ratones knockout condicionales puede llevar meses o años, una técnica alternativa para investigar rápidamente la función de los genes en el cerebro en desarrollo es de interés. En embriones de ratón, la neurulación, el proceso morfogenético por el cual la placa neural se transforma en el tubo neural para dar lugar al sistema nervioso central (SNC), ocurre entre los días 8 y 10 después de la concepción5. Antes del inicio de la neurulación, la placa neural, como parte del ectodermo, consiste en una sola capa de células columnares que proliferarán y se diferenciarán en los numerosos tipos de células neuronales y gliales dentro del SNC 6,7. Por lo tanto, para inducir experimentalmente alteraciones duraderas en la expresión génica en el SNC, dirigirse a la placa neural ofrece ventajas obvias, incluida la accesibilidad de todas las células progenitoras.
En neurociencia, la electroporación in ovo 8,9 y la transducción viral de embriones de ratón se han utilizado para manipular la expresión génica embrionaria del SNC. El embrión de pollo en desarrollo ha sido un modelo de elección para estudiar la función génica durante el desarrollo de la médula espinal debido a la accesibilidad del embrión de pollo en el huevo y la facilidad resultante de manipular la expresión génica. En particular, la electroporación in ovo plásmido genera condiciones experimentales y de control en cada médula espinal de pollo. La electroporación causa permeabilización de la membrana celular y dirige el ADN cargado negativamente lejos del cátodo (negativo) hacia el ánodo (positivo) aplicando un pulso eléctrico a través de dos electrodos al embrión. En ratones, la electroporación in utero generalmente se ha limitado a etapas embrionarias en las que la neurulación se ha completado, y el cerebro o la médula espinal ya consta de varias capas celulares, lo que resulta en una baja eficiencia de electroporación10. La electroporación de plásmidos da lugar a la expresión génica transitoria y generalmente se dirige a pocas células.
La microinyección in utero guiada por ultrasonido se ha utilizado para manipular diferentes estructuras embrionarias como la piel y el cerebro11,12,13,14. Sin embargo, las inyecciones dirigidas al SNC murino en desarrollo han mostrado baja eficacia o han impactado negativamente la supervivencia embrionaria12,13,14. Por lo tanto, se desarrolló un protocolo mejorado para la administración de lentivirus de alto título en la cavidad amniótica (CA) en E7.5, que se denominó NEPTUNO para la integración final enel útero 15. Las inyecciones dieron como resultado una eficacia de focalización duradera del >95% de todo el cerebro en E13.5. Además, se introdujo un paso de estadificación durante la verificación por ultrasonido del embarazo para clasificar a las hembras y los embarazos por etapa de desarrollo para minimizar los procedimientos innecesarios en animales de investigación y maximizar el éxito de la inyección. La eficiencia de la inyección y la supervivencia están estrechamente relacionadas con el aumento del tamaño de la CA. Por lo tanto, este documento describe cómo medir el tamaño de CA antes de la inyección para entregar un volumen adecuado a la CA que no causará la reabsorción del embrión. NEPTUNE es una alternativa robusta a los enfoques actuales en el útero y puede adaptarse para varios usos, incluidos, entre otros, estudios de ganancia y pérdida de función, rastreo de linaje o detección15,16.
Protocolo
Los ratones CD1 de tipo salvaje fueron alojados de acuerdo con las regulaciones europeas, con un ciclo estándar de día y noche con comida y agua ad libitum. Las hembras CD1 se aparearon con machos CD1 durante la noche, y los tapones vaginales se revisaron por la mañana (E0.3). Solo se utilizaron mujeres embarazadas para la inyección. La aprobación ética para todos los experimentos descritos aquí fue otorgada por la Junta Sueca de Agricultura (Jordbruksverket).
1. Preparación de agujas de vidrio: extracción de agujas y molienda
NOTA: Aunque las agujas de premolido se pueden comprar, tirar de las agujas internamente permite ajustar fácilmente la longitud de la aguja, el orificio y el ángulo del bisel.
- Monte un capilar de vidrio en la micropipeta/extractor capilar. Utilice los siguientes ajustes utilizando el equipo especificado (consulte la Tabla de materiales): calentar 580 unidades; velocidad 140 unidades; tiempo 200 unidades; presión 500-800 unidades.
NOTA: Las unidades de diferentes parámetros son definidas por el extractor capilar. Las unidades pueden variar para diferentes equipos. - Presione Pull para separar el capilar produciendo dos capilares de vidrio con extremos cónicos.
NOTA: Después de tirar, las puntas de los dos capilares de vidrio se fusionan debido a la alta temperatura del extractor de micropipetas. - Corte la punta con tijeras quirúrgicas para obtener una longitud de aguja de ~7 mm (medida desde donde la aguja comienza a estrecharse) (Figura 1A).
NOTA: Para las inyecciones de E7.5, una aguja larga y fina es crítica ya que la región de inyección es muy pequeña y delicada. Las agujas cortas y anchas resultarán en muertes embrionarias. - Moler la punta de la aguja cortada para crear un bisel afilado (Figura 1C-F).
- Moler la aguja en un ángulo de 20° a velocidad máxima durante al menos 30-45 min.
NOTA: Se agrega agua ultrapura a la placa de molienda para actuar como lubricante, reducir la fricción / temperatura y eliminar las partículas de vidrio (Figura 1B). Sin embargo, el exceso de líquido puede ralentizar el molinillo. - Asegúrese de que la punta de la aguja (Figura 1C) toque la superficie de la placa de molienda (Figura 1D) pero no se doble (Figura 1E).
NOTA: La molienda doblada da como resultado una punta de aguja larga y frágil de un ángulo cónico incorrecto, que puede romperse fácilmente durante la inyección. Romper agujas puede dañar el embrión y debe ser reemplazado por una aguja intacta. En la Figura 1F,G se muestra una punta de tierra correcta. Después de la molienda, se espera que el orificio de la aguja resultante tenga un diámetro interior (ID) de ~ 15 μm y un diámetro exterior (OD) de ~ 35 μm (Figura 1G).
- Moler la aguja en un ángulo de 20° a velocidad máxima durante al menos 30-45 min.
- Llene una jeringa de 1 ml con aceite mineral y coloque una aguja de 27 G.
- Retire el capuchón de la aguja e inserte la aguja de la jeringa en el capilar de vidrio recién molido. Inyecte aceite mineral hasta que el aceite gotee de la punta capilar. Siga inyectando mientras retira la aguja de 27 G hasta que la aguja capilar se llene con aceite mineral, después de lo cual se puede quitar la aguja de la jeringa.
- Almacene las agujas molidas y llenas de aceite mineral en un ambiente cerrado para evitar daños y acumulación de polvo. Para el almacenamiento, inserte dos rollos de arcilla para modelar en una placa de Petri regular para que sirvan como soportes (Figura 1H). Coloque suavemente las agujas en la arcilla y espaciarlas para recuperarlas fácilmente.
NOTA: Como la preparación de la aguja lleva mucho tiempo, es mejor preparar las agujas al menos un día antes de las inyecciones. Deseche las agujas después de dos camadas como máximo, ya que se volverán romas. Siempre prepare agujas de respaldo en caso de daño de la aguja durante la preparación o inyección.
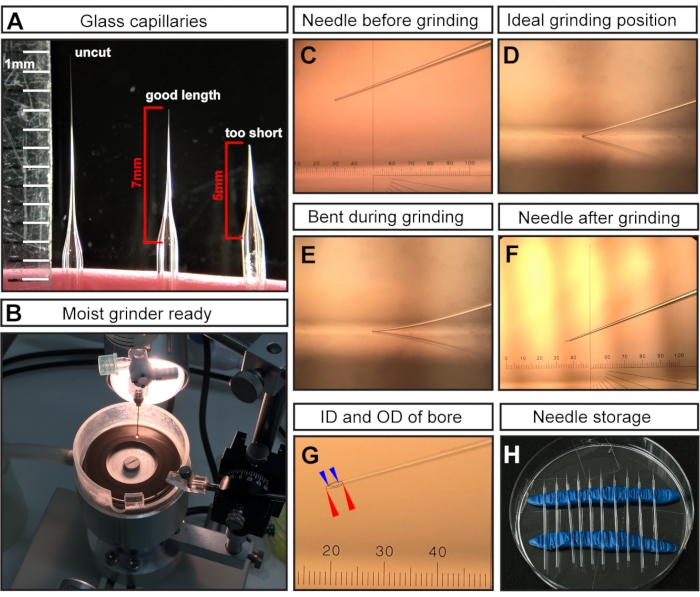
Figura 1: Preparación de la aguja para inyecciones de cavidad amniótica E7.5. (A) Ejemplos representativos de una aguja capilar de vidrio tirada pero sin cortar (izquierda), una aguja capilar cortada a la longitud óptima para las inyecciones E7.5 (centro) y un corte capilar demasiado corto (derecha). (B) El molinillo con cobertura uniforme de agua, que está listo para la molienda de agujas. (C-F) Ejemplos representativos de diferentes puntas de aguja. (C) punta de aguja cortada pero sin moler montada en el molinillo; (D) posición ideal de molienda con la punta de la aguja tocando el molinillo; (E) aguja bajada demasiado y doblada durante el proceso de molienda; (F) una punta de aguja molida ideal para inyecciones de CA E7.5. (G) Una punta de aguja molida que muestre el orificio con un diámetro interior de ~ 15 μm y un diámetro exterior de ~ 35 μm, que es adecuado para la inyección de CA E7.5. El orificio de la aguja se muestra como líneas discontinuas. Diámetro exterior denotado con puntas de flecha rojas; Diámetro interior denotado con puntas de flecha azules. (H) Almacenamiento de agujas: placa de Petri llena de agujas tiradas y molidas. Dos filas de arcilla para modelar sirven como soportes. NOTA: Para el micrómetro ocular en C, F, G, 1 cm se divide en 100 pasos; el objetivo es 3x; por lo tanto, 1 paso = 10.000 μm/(100 × 3) ≈ 33,4 μm. Abreviaturas: AC = cavidad amniótica; ID = diámetro interno; DO = diámetro exterior. Haga clic aquí para ver una versión más grande de esta figura.
2. Día antes de la inyección: preparar el banco para la verificación ecográfica del embarazo
NOTA: Todo el trabajo debe llevarse a cabo en un banco ventilado de nivel de bioseguridad 2 (BSL 2) cuando se trabaja con lentivirus. La verificación por ultrasonido del embarazo se puede realizar en un banco ventilado.
- Encienda la máquina de ultrasonido, la mesa de calentamiento y el suministro deO2 para la bomba de isoflurano (puede variar entre el equipo).
NOTA: Compruebe el sistema de isoflurano para asegurarse de que no haya fugas de isoflurano al aire. - Coloque una bolsa de residuos vacía (pegada con cinta adhesiva a la pared interior para facilitar el acceso), crema depilatoria, hisopos de algodón estériles, agua, papel de seda y cinta quirúrgica dentro del banco BSL 2.
- Prepare cuatro piezas de cinta quirúrgica (~ 7 cm de largo) para asegurar las extremidades del ratón durante la revisión por ultrasonido del embarazo.
3. Ecografía para confirmar el embarazo
NOTA: Este paso se puede realizar el día antes de las inyecciones E7.5, en E6.5. Consulte la discusión para obtener detalles sobre el control de la edad gestacional.
- Coloque el ratón hembra apareado en el tiempo en la cámara de inducción.
- Encienda el flujo de gas con un flujo de oxígeno de ~ 2.1 LPM y una dosis inicial de 3-4% de isoflurano para inducir la anestesia.
- Verifique que la hembra esté completamente anestesiada revisando el reflejo de la pata. Si el reflejo de la pata está ausente, reduzca el isoflurano al 1,5-2%.
NOTA: Se tarda aproximadamente 3 minutos para inducir la anestesia. - Cambie el flujo de gas de la cámara de inducción al cono de la nariz de la mesa de calentamiento.
- Coloque a la hembra anestesiada en posición supina (abdomen hacia arriba) en la mesa de calentamiento y coloque el hocico en el cono nasal adjunto para garantizar el mantenimiento de la anestesia durante el control de ultrasonido del embarazo.
- Sujete las cuatro patas a la mesa con los trozos preparados de cinta quirúrgica sin estirar el cuerpo de la hembra ni atrapar los bigotes.
- Aplique una cantidad del tamaño de un guisante de crema depilatoria en la parte inferior del abdomen. Con un hisopo de algodón, distribuya la crema sobre la parte inferior del abdomen (un cuadrado de ~ 3 x 3 cm) y masajee suavemente enrollando el hisopo de algodón hacia adelante y hacia atrás.
- Una vez que el pelaje comience a desprenderse de la piel, humedezca un papel de seda y retire la crema y el pelaje. Limpie el área despeludida con papel de seda húmedo hasta que toda la crema y el cabello hayan desaparecido. Secar la piel.
- Aplique una cantidad de gel de ultrasonido del tamaño de una ciruela en el área afeitada y proceda a identificar el útero mediante ultrasonido mediante cualquiera de los siguientes tres enfoques.
- Para hacer esto manualmente, sostenga la sonda de ultrasonido en el gel de ultrasonido y mueva la sonda para encontrar el útero.
- Para la aproximación semimanual #1, coloque la sonda de ultrasonido (conectada al sistema de barandilla) por encima del abdomen femenino aflojando y moviendo parte del riel a lo largo del plano x. Baje la sonda de ultrasonido en el gel (plano z) y escanee a través de la parte inferior del abdomen (plano y) (Figura 2A).
- Para el enfoque semimanual # 2, baje la sonda de ultrasonido (conectada al sistema de barandilla) en el gel para obtener imágenes de la parte inferior del abdomen. Mantenga la sonda de ultrasonido estacionaria durante el proceso y mueva la mesa de calentamiento con las ruedas conectadas a lo largo de los planos x y/o y (Figura 2B).
NOTA: En estas primeras etapas embrionarias, los órganos internos, por ejemplo, el intestino, pueden parecer similares al útero en las imágenes de ultrasonido. Sin embargo, mientras que los embriones y la decidua aparecen como una secuencia de esferas (similar a las cuentas a lo largo de un collar), el intestino tiene la apariencia de un tubo continuo. La conectividad de los espacios luminales (esferas separadas vs. un tubo continuo) se puede evaluar escaneando hacia adelante y hacia atrás a través de la estructura de interés para determinar si la estructura es una esfera discreta (embrión / decidua) (Figura 2C) o un tubo continuo (intestino) (Figura 2D). En esta etapa, no es necesario registrar el número de embriones; Basta con confirmar su presencia o ausencia.
- Una vez que se determine el estado del embarazo, levante la sonda de ultrasonido lejos del abdomen y limpie la parte inferior del abdomen con papel de seda húmedo para eliminar el gel de ultrasonido.
- Apague la bomba de isoflurano y retire la cinta quirúrgica para liberar las patas.
- Coloque a la hembra en decúbito prono (boca abajo) en una jaula limpia sobre una placa calefactora a 40 °C. Mantenga a la hembra bajo estrecha observación hasta que recupere la conciencia, lo que toma de 2 a 6 minutos.
NOTA: Asegúrese de que la revisión de ultrasonido para una mujer sea de <10 minutos para minimizar la exposición al isoflurano. - Retire todos los materiales y desechos y limpie todas las superficies con etanol al 70%. Limpie cualquier gel de ultrasonido sobrante de la sonda de ultrasonido con un pañuelo de papel seco, suave y sin pelusa. Apague la máquina de ultrasonido, el banco ventilado / banco BSL2, la mesa de calentamiento y el suministro deO2 .
4. Comprobación ecográfica para la estadificación embrionaria
NOTA: Este paso se realiza antes de la cirugía y sirve para estratificar a las hembras embarazadas según sus tamaños de CA. Este paso es crucial en E7.5 cuando el objetivo es apuntar al SNC en desarrollo. En esta etapa temprana del desarrollo, una diferencia de unas pocas horas en el desarrollo influye significativamente en el tamaño de la CA y la progresión de la neurulación.
- Anestesiar a la primera hembra de ratón embarazada siguiendo los pasos de los pasos 3.1-3.5.
- Coloque y fije a la hembra en la mesa como se describe en el paso 3.6.
- Aplique una cantidad de gel de ultrasonido del tamaño de una ciruela en el abdomen afeitado y baje la sonda de ultrasonido para obtener imágenes de la parte inferior del abdomen de la mujer.
NOTA: Este paso asume que la hembra fue inspeccionada por ultrasonido el día anterior para el embarazo y ya se le ha quitado el pelaje en el abdomen. Si este no es el caso, el pelaje debe eliminarse antes de la adición de gel de ultrasonido siguiendo los pasos 3.7-3.8. En E7.5, el útero y las deciduas son más grandes y más fáciles de distinguir de los órganos internos. Además, el CA es más grande y se puede distinguir de la cavidad exocelómica (ExC). - Escanee a través de los cuernos uterinos izquierdo y derecho lo más completamente posible.
NOTA: Algunos embriones se encuentran más profundamente dentro del cuerpo de la hembra y pueden pasarse por alto. - Registre el número y las etapas de los embriones. Tome nota del número de cavidades amnióticas de tamaño ideal, cavidades aceptables y deciduas sin cavidad (Figura 2E-G).
- Estadificar todos los embarazos y clasificarlos en consecuencia.
- Inyecte a las mujeres la mayoría de los AC de tamaño ideal inmediatamente después de la ecografía (paso 4.4) siguiendo las instrucciones de los pasos 4.5-4.7.
- Para las mujeres con una mayoría aceptable (en la que las cavidades exocelómicas y amnióticas aún no están claramente divididas en dos cavidades) o ausentes, posponga la inyección y vuelva a estadificarlas después de un par de horas. Si la mayoría de las cavidades aún son demasiado pequeñas, posponga las inyecciones de 10 a 12 h.
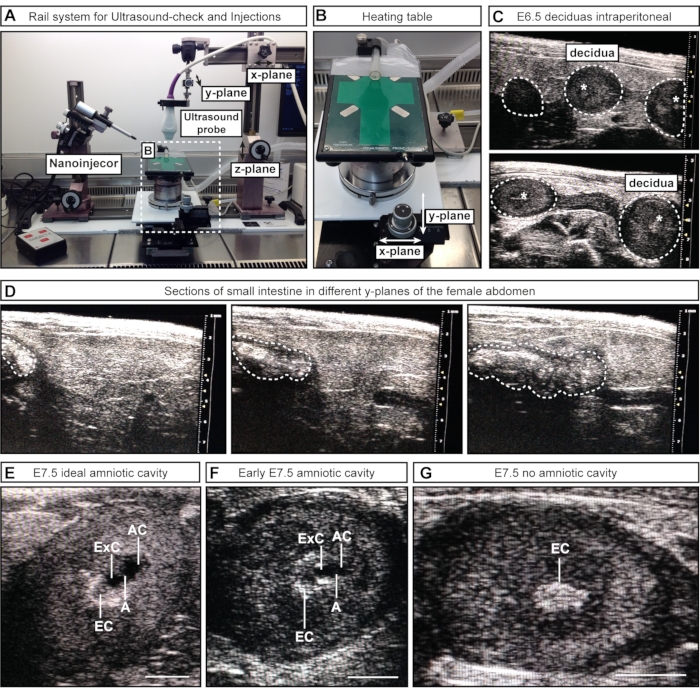
Figura 2: Inspección y estadificación de las cavidades amnióticas durante la ecografía. (A) Descripción general del sistema de rieles con sonda de ultrasonido conectada, nanoinyector y mesa de calentamiento. La sonda de ultrasonido se puede mover en los planos x, y y z para lograr una alineación óptima con el abdomen femenino o los AC. (B) La mesa de calentamiento se puede mover a través de dos ruedas en planos X y / o Y para permitir un escaneo y evaluación precisos de los CA, mientras que la sonda de ultrasonido puede permanecer estática. (C) Imágenes ecográficas representativas de deciduas E6.5 dentro del abdomen femenino durante la ecografía para confirmar el embarazo (contornos punteados blancos). No se han formado cavidades en este punto; Sin embargo, a veces, el cono ectoplacentario (asteriscos blancos) es visible. Las deciduas pueden reconocerse por su forma esférica y distinguirse del intestino, que aparece como un tubo continuo. (D) Secuencia de imagen representativa del intestino delgado (contornos punteados blanqueados), que es continua en la exploración a través de la parte inferior del abdomen. (E-G) Imágenes de ultrasonido representativas durante la estadificación de la cavidad antes de las inyecciones E7.5. Las cavidades amniótica y exocelómica se han formado y están separadas por el amnios. El cono ectoplacentario sirve como el principal suministro de sangre y aparece como un punto brillante en el ultrasonido. La CA es más distal desde el cono ectoplacentario. (E) Las CA de tamaño ideal parecen más grandes que la cavidad exocelómica, mientras que las cavidades de tamaño mediano parecen más pequeñas (F). Si no hay cavidades visibles (G), esto significa que el embrión está reabsorbido o aún no ha alcanzado E7.5. Barras de escala = 1 mm. Abreviaturas: A = Amnios; CA = cavidad amniótica; ExC = cavidad exocelómica; EC = Cono ectoplacentario. Haga clic aquí para ver una versión más grande de esta figura.
5. Día de la inyección: preparar el banco BSL2 para la cirugía
- Pegue una pieza de membrana elástica a la abertura central redonda de una placa de Petri modificada disponible comercialmente. Asegúrese de que la membrana esté bien unida a la placa de Petri para evitar fugas.
NOTA: Si el plato tiene fugas o no está bien pegado, los bordes de la membrana elástica se pueden asegurar aún más con cinta adhesiva. - Haga una incisión de 1-1.5 cm de largo en el centro de la membrana elástica.
- Encienda la máquina de ultrasonido, el banco BSL2, la placa calefactora, el suministro deO2 para la bomba de isoflurano y el esterilizador de perlas de vidrio (ajustado a 300 °C).
- Dentro del banco BSL2, coloque una bolsa de residuos vacía (pegada a la pared interior para facilitar el acceso); hisopos de algodón empacados estériles (use uno nuevo para cada cirugía / cada mujer); herramientas quirúrgicas (tijeras, pinzas, clips, sutura) y cinta quirúrgica; un frasco lleno de solución salina tamponada con fosfato (PBS) a temperatura ambiente, un frasco vacío para la recogida de residuos y una pipeta de 25 ml; una placa de Petri con membrana elástica para cirugía; la tapa de la placa de Petri con una pieza de parafilm de 2 x 2-3 x 3 cm asegurada a la tapa con una gota de agua; arcilla para modelar: 4 bolas o cubos más grandes (~3 x 3 x 3 cm3 ) y una pieza cilíndrica (~4 x 1 cm); una jeringa con analgésico (por ejemplo, buprenorfina, 0.05-0.1 mg/kg de peso corporal) y gel para los ojosNOTA: Las bolas (o cubos) de arcilla para modelar servirán como "pies" o soportes / soportes para la placa de Petri una vez que el plato se coloca en la parte superior del abdomen de la hembra. La pieza cilíndrica de arcilla asegura los embriones dentro del plato. Si se inyecta más de una solución, o la aguja necesita ser rellenada durante las inyecciones, se puede usar la misma pieza de parafilm si las soluciones se pueden separar.
6. Carga de la aguja
- Limpie cualquier exceso de aceite mineral con papel de seda para un mejor agarre.
NOTA: Siempre limpie lejos de la punta para evitar daños o lesiones. - Asegúrese de que todos los componentes (una junta tórica de sellado, un espaciador y una junta frontal, todos alojados debajo de la pinza, Figura 3A) estén instalados en la orientación correcta (Figura 3B, pinza retirada para visualización) para mantener la aguja capilar en su lugar y crear una conexión hermética, evitando la formación de burbujas al avanzar o retraer el émbolo metálico dentro de la aguja.
- Asegúrese de que el émbolo metálico del nanoinyector esté completamente retraído. Verifique presionando Rellenar y espere un pitido doble que indique que el émbolo está completamente retraído.
- Con la pinza unida pero ligeramente aflojada (desenroscada 45-90 grados), deslice la aguja de vidrio sobre el émbolo metálico y empuje la aguja capilar junto con el émbolo metálico a través de la junta delantera hasta que llegue al espaciador (Figura 3C, D, pinza retirada para su visualización).
NOTA: Aparece cierta resistencia cuando el émbolo pasa a través de la junta y disminuye cuando llega al espaciador. Asegúrese de que la aguja capilar esté firmemente insertada en el espaciador para crear una conexión hermética (Figura 3D). - Asegure la aguja apretando la pinza del nanoinyector (vuelva a atornillar de forma segura).
NOTA: No apriete demasiado, ya que esto puede aplastar la aguja. - Presione Empty para empujar el émbolo dentro de la aguja y expulsar el aceite de la punta de la aguja. Si la aguja de vidrio se mueve, retraiga el émbolo, retire la aguja y vuelva a cargar. Si esto hace que se formen burbujas de aire, retire la aguja y vuelva a llenar con aceite mineral.
NOTA: Una aguja bien asegurada no debe moverse con el émbolo. - Coloque una gota del virus (~ 6 μL) u otra solución inyectable en un trozo de parafilm1 (Figura 3E; El tinte azul Evans se utiliza con fines de visualización).
NOTA: El volumen máximo del nanoinyector es ~5 μL. - Presione Rellenar para crear una burbuja de aire que sirva como divisor entre el aceite y la solución (Figura 3F).
NOTA: Esto también sirve como marcador de posicionamiento al llenar o vaciar la aguja. - Baje la aguja, sumerja la punta en la solución y presione Rellenar (Figura 3F, G).
- Observe el nivel de líquido a medida que se carga la solución después de la burbuja de aire. Presione Empty para expulsar la obstrucción y vuelva a cargar presionando Fill si la burbuja de aire se alarga sin que el líquido entre en la aguja. Si esto no resuelve el problema, cambie la aguja.
- Cuando la aguja esté completamente cargada (Figura 3H), levante la aguja en el plano z y aspire un pequeño volumen de aire en la punta para evitar la evaporación de la solución en la punta de la aguja y la obstrucción de la aguja.
- Gire el nanoinyector con la aguja adjunta lejos del operador, hacia la parte posterior del banco, para evitar cualquier daño o lesión accidental.

Figura 3: Fijación de la aguja al nanoinyector y carga de la solución. (A) Posición inicial antes de montar la aguja en el nanoinyector: émbolo metálico completamente retraído y pinza adherida. (B) Debajo de la pinza, los tres componentes para sostener y asegurar la aguja se muestran en el orden correcto (de izquierda a derecha): junta tórica de sellado (delgada y negra), espaciador (blanco), junta tórica (negra) con un orificio grande (por el que debe pasar la aguja). Para garantizar una conexión hermética, la aguja de vidrio se desliza sobre el émbolo metálico (C) y se empuja a través de la abertura de la junta tórica delantera hasta que llega al espaciador (D). (E-H) Carga de la solución en la aguja. (E) Se coloca una gota de solución en un trozo de parafilm en la tapa de una placa. (F) Cree una burbuja de aire presionando Llenar antes de cargar la solución y sumerja la punta de la aguja en la solución. (G) La solución se está cargando en la aguja. (H) La solución se carga en la aguja. NOTA: La pinza se ha eliminado en (B-D) para su visualización, pero debe permanecer unida durante los experimentos. El paso final para asegurar la aguja es apretar la pinza. El tinte azul Evans se utiliza para la visualización en E-H. Haga clic aquí para ver una versión más grande de esta figura.
7. Inyecciones
NOTA: Todos los instrumentos utilizados en este procedimiento se esterilizan antes de la cirugía y entre cada ratón.
- Anestesiar a la primera hembra con caries de tamaño ideal (ver sección 4).
- Coloque y fije a la hembra en la mesa, como se describe en los pasos 3.1-3.6.
- Aplique gel para los ojos en los ojos para prevenir la desecación corneal e inyecte analgésicos por vía subcutánea.
NOTA: Analgésicos recomendados: Buprenorfina (0,05-0,1 mg/kg de peso corporal) o Flunixina (2,5 mg/kg) o similar de acuerdo con las regulaciones locales de bienestar animal. La analgesia perioperatoria multimodal se mantiene con analgésicos inyectados e isoflurano. - Prepare asépticamente la parte inferior del abdomen limpiando con un paño empapado con 0,5 mg / ml de solución de clorhexidina (o similar) y seque la piel. Use tijeras quirúrgicas para hacer una incisión vertical de 1.5-2.0 cm en la línea media de la piel en la parte inferior del abdomen.
NOTA: Prepare el área quirúrgica siguiendo las rutinas de desinfección aprobadas localmente. - Levante la piel suavemente y libere la piel de la capa muscular subyacente, aproximadamente 1 cm alrededor del punto de incisión, para facilitar la sutura después de la cirugía.
- Haga una incisión vertical de 1 cm en la línea media en la capa muscular.
- Con un par de fórceps, levante un lado de la piel y la capa muscular y con el otro par, busque los cuernos uterinos.
NOTA: Las deciduas están dispuestas como cuentas en un collar, mientras que el intestino es un tubo largo y continuo (Figura 4A). - Con fórceps, saque con cuidado ambos cuernos uterinos del abdomen. Sostener el tejido entre embriones; no los apriete directamente (Figura 4B).
NOTA: El útero está unido al cuerpo en el cuello uterino, y los dos ovarios / oviductos están unidos a través de ligamentos. No tire ni desprenda el útero de estos puntos de anclaje. - Cuente y tome nota del número de embriones en los lados izquierdo y derecho.
- Numere los embriones desde el ovario hasta el cuello uterino o desde el cuello uterino hasta el ovario.
NOTA: Esto es especialmente importante si los embriones inyectados se recolectarán en etapas embrionarias. - Con un hisopo de algodón húmedo, empuje suavemente todos los embriones hacia la cavidad abdominal, excepto los tres primeros que se inyectarán.
- Coloque una gota de PBS en el elástico en la placa de Petri y sosténgala inmediatamente por encima de los embriones.
- Inserte fórceps cerrados en la incisión del elástico y suelte los fórceps para abrir la incisión elástica para que el líquido caiga sobre los embriones.
NOTA: Esto asegura la rehidratación de los embriones y que la membrana elástica se adhiera a la piel húmeda de la hembra, evitando fugas de PBS en los siguientes pasos. - Tire de una sección del útero, correspondiente a tres embriones, a través del elástico con fórceps, y coloque suavemente la placa de Petri en el abdomen de la hembra.
- Con los fórceps y un hisopo de algodón húmedo, ajuste la posición del útero y el elástico para asegurarse de que el elástico esté sellado a la piel de la hembra para evitar fugas de PBS.
- Use los cuatro pies de arcilla para asegurar y sujetar la placa de Petri inmediatamente por encima del abdomen, reduciendo la presión sobre la hembra y la sensibilidad de las imágenes a la respiración y los latidos del corazón de la hembra.
- Presione el cilindro de arcilla para modelar hacia abajo a la derecha de los embriones/útero para fijar el útero (Figura 4C).
NOTA: Esta instrucción de orientación asume que la aguja está a la izquierda de la hembra y que los embriones del cuerno uterino izquierdo de la hembra están expuestos. El lado del útero (cuerno uterino izquierdo o derecho) es crucial ya que el CA se enfrenta a la aguja (cuerno izquierdo; Figura 4D) o se enfrenta al cilindro de arcilla estabilizadora (cuerno derecho; Figura 4E). - Para inyectar embriones desde el cuerno uterino derecho, coloque el cilindro de arcilla en el lado izquierdo de los embriones (Figura 4F) y gire la mesa de calentamiento 180° (Figura 4G) para lograr la orientación correcta. Si la aguja se puede mover en su lugar, adáptela según corresponda para la configuración correspondiente.
- Agregue PBS a la placa de Petri hasta que los embriones y el útero estén cubiertos con PBS.
- Baje la sonda de ultrasonido en el PBS y ajuste el ratón / mesa quirúrgica para que el primer embrión esté alineado con la sonda de ultrasonido para facilitar el registro de las inyecciones.
NOTA: "Primero" se refiere a la numeración de embriones desde el ovario hasta el cuello uterino. - Escanee los tres embriones e inspeccione las AC. Determine el volumen de inyección de la siguiente manera:
- Mida el diámetro del aire acondicionado con la máquina de ultrasonido. Inyecte 69 nL si el diámetro de CA es de ≤0,2 mm; inyectar 2 x 69 nL (= 138 nL) si el diámetro de CA es >0,2 mm y ≤0,29 mm; e inyecte 3 x 69 nL (= 207 nL) si el diámetro de CA > 0,29 mm (Figura 4H).
NOTA: Experimentos anteriores han demostrado que hasta 207 volúmenes de inyección de nL son bien tolerados en E7.515. Las inyecciones exitosas con un impacto mínimo en la supervivencia se logran cuando el aumento del volumen relativo de la CA no supera el 90%15. La variación en el tamaño de CA entre compañeros de camada o cepas de ratón es común y puede requerir una mayor optimización.
- Mida el diámetro del aire acondicionado con la máquina de ultrasonido. Inyecte 69 nL si el diámetro de CA es de ≤0,2 mm; inyectar 2 x 69 nL (= 138 nL) si el diámetro de CA es >0,2 mm y ≤0,29 mm; e inyecte 3 x 69 nL (= 207 nL) si el diámetro de CA > 0,29 mm (Figura 4H).
- Ajuste los volúmenes de inyección con el controlador de inyección.
- Ajuste la velocidad de inyección para que disminuya con una velocidad de inyección de 23 nL/s.
NOTA: Diferentes modelos de equipos pueden resultar en diferentes fuerzas de inyección. - Baje la aguja en el PBS utilizando las ruedas principales del sistema de riel (planos x y z, figura 4I) y presione Empty en el controlador del nanoinyector hasta que el líquido llegue a la punta de la aguja.
NOTA: Si la aguja se ha obstruido, pulsar Empty puede disolver la obstrucción y/o expulsar la obstrucción. - Levante la aguja del PBS y presione Inyectar. Verifique que se descargue una gota del volumen deseado aproximado.
- Baje la aguja en el PBS y alinéela con la sonda de ultrasonido y el embrión moviendo el nanoinyector con la rueda del plano en Y en el micromanipulador (Figura 4J).
NOTA: La punta de la aguja está perfectamente alineada cuando aparece como un punto brillante en la imagen de ultrasonido (Figura 4K, L). La aguja se puede mover en los tres planos de dirección con el micromanipulador. - Ajuste el ángulo de la aguja con la rueda angular de inyección para asegurar un ángulo de inyección casi perpendicular en relación con la pared uterina. Inserte la aguja en el aire acondicionado con un solo movimiento utilizando la rueda de inyección del micromanipulador (Figura 4J-M). Vigile el brillo de la punta de la aguja. Si la punta de la aguja desaparece de la imagen de ultrasonido, mueva la sonda de ultrasonido hacia adelante o hacia atrás para volver a enfocar la aguja.
NOTA: Una vez que la aguja está dentro del aire acondicionado, se pueden hacer modificaciones menores en la posición y el enfoque de la aguja sin dañar el embrión (ajustes dentro de ~ 0.3 mm). No ajuste la posición de la aguja más que esto. - Presione Inyectar (para 207 nL, ajuste el volumen a 69 nL e inyecte tres veces). Después de la inyección, espere 5-10 s adicionales antes de retraer la aguja en un movimiento suave.
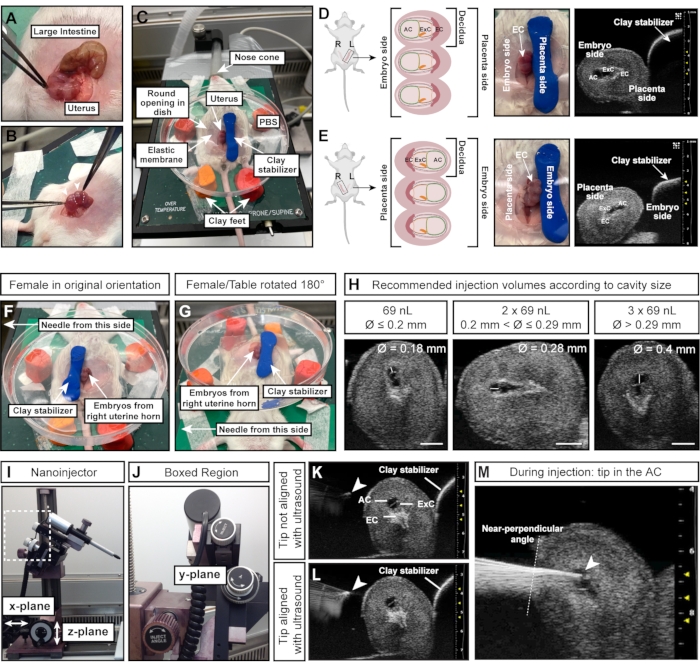
Figura 4: Tamaño y orientación óptimos de la cavidad amniótica para inyecciones exitosas . (A) Cuerno uterino con múltiples deciduas E7.5, en forma de cadena de esferas (abajo) en comparación con el intestino grueso (arriba). (B) Agarrar el tejido uterino (líneas punteadas blancas) entre las deciduas. Evite apretar las deciduas (puntas de flecha blancas) directamente con fórceps, ya que las deciduas y los embriones en desarrollo son frágiles en esta etapa temprana y propensos a la reabsorción por fuerza externa excesiva. (C) Hembra en posición supina con deciduas expuestas en una placa de Petri llena de PBS y montada sobre cuatro pies de arcilla para modelar. Las deciduas se estabilizan mediante una pieza adicional de arcilla de modelar, con forma de cilindro. (D, E) La orientación del CA está influenciada por el lado del cuerno uterino que está expuesto. Si se usan deciduas del cuerno uterino izquierdo, el CA se alejará del estabilizador de arcilla y será fácilmente accesible para la aguja de la izquierda (D). Sin embargo, si se usa el cuerno uterino derecho, el cono ectoplacentario se enfrentará a la aguja, lo que dificultará el acceso al AC (E). Por lo tanto, al inyectar en el cuerno uterino derecho, el estabilizador de arcilla se coloca hacia el lado orientado hacia la aguja (F), y toda la mesa de calentamiento se gira 180 ° (G). (H) Volúmenes de inyección recomendados según los tamaños de CA. En general, las cavidades con un diámetro ≤ 0,2 mm se pueden inyectar con un máximo de 69 nL. Los diámetros > 0,2 mm y ≤ 0,29 mm toleran volúmenes de hasta 2 x 69 nL (138 nL) y las cavidades > 0,29 mm se pueden inyectar con 3 x 69 nL (207 nL). Barras de escala = 1 mm. (I, J) El nanoinyector está conectado al sistema de rieles y se puede mover en planos x y / o z. El ángulo de la aguja se puede ajustar con la rueda angular de inyección . (K, L) La punta de la aguja (punta de flecha blanca) se alinea con el CA cuando aparece más brillante en el ultrasonido (L). (M) Imagen de ultrasonido que muestra el proceso de inyección, en el que la punta de la aguja está en el aire acondicionado y bien alineada (punta de flecha blanca). Abreviaturas: A = Amnios; CA = cavidad amniótica; ExC = cavidad exocelómica; EC = Cono ectoplacentario. Haga clic aquí para ver una versión más grande de esta figura.
- Mueva la etapa al siguiente embrión y repita los pasos 7.22-7.26 para los otros dos embriones si tienen tamaños de CA adecuados.
- Levante la sonda de ultrasonido y la aguja fuera del PBS usando el micromanipulador. Gire la aguja lejos del operador para evitar daños y lesiones.
- Con fórceps, dirija los embriones 1º y2º hacia el abdomen de la hembra empujándolos suavemente a través del elástico. Agarre suavemente el tejido adyacente al 3erembrión y tire del útero hacia el extremo superior de la incisión elástica. Tire suavemente de los embriones 4º-6º con fórceps y permita que el3º embrión vuelva a entrar en el abdomen.
NOTA: Este paso se puede realizar sin cambiar el PBS o eliminar la placa de Petri. - Repita según sea necesario hasta que se hayan inyectado todos los embriones con CA óptimos o se haya alcanzado el límite de tiempo.
- Empuje suavemente los embriones / útero hacia el abdomen de la hembra.
- Aspirar el PBS y retirar la placa de Petri. Si se ha utilizado un virus, manéjelo como residuo infeccioso.
- Cose la capa muscular con Vicryl (USP 6-0, longitud de la aguja 13 mm, círculo 3/8) en suturas simples continuas o interrumpidas y cierre la piel con 1-2 clips (consulte la Tabla de materiales).
- Apague la bomba de isoflurano.
- Retire la cinta quirúrgica y coloque a la hembra en posición prona (boca abajo) en una jaula limpia sobre una placa calefactora a 40 °C.
NOTA: Se espera que la hembra recupere la conciencia y se mueva dentro de los 10 minutos. Asegúrese de que el procedimiento se complete en 30 minutos. Los antecedentes genéticos, la edad y el peso de la mujer pueden influir en la sensibilidad a la anestesia. Controle a los ratones durante la cirugía para detectar signos de respiración lenta (respiración lenta significa que la anestesia es demasiado profunda) o movimiento (la anestesia es demasiado ligera). La buprenorfina (0,05-0,1 mg/kg de peso corporal) o flunixina (2,5 mg/kg) o similar de acuerdo con las regulaciones locales de bienestar animal, se puede administrar 8 horas después de la primera inyección si es necesario. - Si se va a inyectar otra hembra, prepare el área quirúrgica mientras monitorea el despertar de la primera.
- Limpie las herramientas quirúrgicas con etanol al 70% para eliminar cualquier sangre o tejido residual y esterilícelas en el esterilizador de perlas de vidrio precalentado durante 10 s. Deseche los hisopos de algodón y el papel de seda usado. Limpie la placa de Petri y los trozos de arcilla con papel de seda.
- Repita los pasos 7.1-7.35 hasta que todas las hembras hayan sido inyectadas.
- Vacíe y deseche la aguja.
- Si queda un virus o una solución inyectable en la aguja, pulse Empty en el nanoinyector y vacíe el contenido de la aguja en papel de seda.
- Retraiga el émbolo metálico completamente presionando Rellenar hasta que haya un pitido doble del controlador, lo que indica que el émbolo está completamente retraído.
- Afloje la pinza y deslice la aguja del émbolo metálico. Deseche la aguja en el contenedor de residuos de objetos punzantes.
- Limpie el banco BSL-2.
- Si se usó un virus, rocíe todo el campo quirúrgico con desinfectante (consulte la Tabla de materiales). Después de 15 minutos, limpie el desinfectante y limpie todo el campo quirúrgico con etanol al 70%. Si no se utilizó ningún virus, limpie todas las superficies con etanol al 70%.
- Limpie cualquier PBS restante de la sonda de ultrasonido con papel de seda seco, suave y sin pelusa.
- Deseche los residuos de acuerdo con las pautas de bioseguridad.
- Apague la máquina de ultrasonido, la mesa de calentamiento, el banco BSL2 y el suministro deO2 .
Resultados
Los embriones inyectados en E7.5 con lentivirus11,12 hPGK-H2B-GFP se recolectaron en E13.5 y se examinaron bajo el microscopio de disección fluorescente (Figura 5A). La transducción exitosa de la placa neural da como resultado embriones con una fuerte expresión de un reportero fluorescente en el cerebro principalmente y en otros tejidos derivados del ectodermo, por ejemplo, la piel (Figura 5A, B). La inyección de un volumen excesivamente alto (mayor que los volúmenes recomendados aquí, por ejemplo, ≥500 nL) aumenta la presión en la CA y puede resultar en una reabsorción completa (datos no mostrados) o defectos del tubo neural como exencefalia (Figura 5A). Las inyecciones exitosas en E7.5 dan como resultado una transducción uniforme del cerebro anterior al cerebro posterior (Figura 5C-J).
Los títulos lentivirales de alrededor de 2 × 10 10 unidades infecciosas (IFU) logran más del 95% de focalización, mientras que los títulos de ~1 ×10 9 IFU logran una eficiencia de focalización del 15%15. Además, también se dirigen a estructuras que anteriormente han sido difíciles de atacar mediante electroporación, como el plexo coroideo17,18 (Figura 5 E, F). La eficacia de la transducción se puede modificar ajustando el título viral administrado en la CA. Las inyecciones de título bajo dan como resultado la transducción de clones de células individuales (Figura 5C, Figura 5E y Figura 5G, H), mientras que el uso del virus de título alto transduce casi el 100% de todo el cerebro (Figura 5D, Figura 5F, Figura 5H y Figura 5J ). Por lo tanto, NEPTUNE se puede utilizar para la transducción clonal, el rastreo del linaje y los enfoques de detección genética o para estudiar los efectos globales de la sobreexpresión de genes o la regulación negativa en todo el cerebro.
El desarrollo del ojo de los mamíferos es el resultado de una comunicación bien organizada entre tres derivados del ectodermo embrionario: la retina neural (NR) y el epitelio pigmentario de la retina (EPR) se derivan del neuroepitelio del prosencéfalo ventral, mientras que el ectodermo superficial da lugar al futuro cristalino y epitelio corneal. Sin embargo, el estroma central y el endotelio posterior, las otras dos capas de la córnea, se derivan de las células de la cresta neural del mesénquima periocular19,20. Las secciones coronales a través de embriones E13.5, inyectados en E7.5 con lentivirus de alto título mostraron, similar al cerebro, una transducción alta y uniforme del tejido neural del ojo, así como del cristalino, la córnea y el mesénquima (Figura 5K). A medida que la neurulación progresa, las inyecciones en E8.5 y E9.5 dan como resultado la orientación continua del cristalino y el epitelio corneal (Figura 5L y Figura 5N), mientras que la transducción de los tejidos derivados del neuroectodermo del ojo es menos eficiente en E8.5 (Figura 5L, M) o no dirigida a E9.5 (Figura 5N).
Mientras que la mayoría de las partículas virales infectan los tejidos expuestos después de la inyección, algunas partículas transducen tejidos derivados no ectodérmicos que se desarrollan más tarde (Figura 6A). Las glándulas y conductos salivales se desarrollan alrededor de E11.5 a partir del epitelio oral21 y son atacados con NEPTUNO (Figura 6B). Después de las inyecciones en E9.5, el epitelio lingual de la lengua se transduce bien; sin embargo, el mesénquima subyacente es negativo (Figura 6C; los corchetes denotan células transducidas; asteriscos denotan señales de autofluorescencia no células transducidas). Además, hay grupos positivos dentro del epitelio lingual, separados por secciones negativas (Figura 6C, puntas de flecha blancas), lo que sugiere la transducción de la superficie de la papila. Las células de la cresta neural han sido descritas en el mesénquima subyacente de la lengua y dentro del epitelio lingual, donde están involucradas en el desarrollo de papilas gustativas y papilas gustativas22. De hecho, las inyecciones en E7.5 dan como resultado una transducción generalizada del mesénquima de la lengua en E13.5 (Figura 6D), lo que sugiere que las inyecciones tempranas se dirigen a las células de la cresta neural, contribuyendo al mesénquima en la lengua.
En los vertebrados, los ganglios de la raíz dorsal (GRD) son un componente central del sistema nervioso periférico (SNP), ya que toda la entrada somatosensorial de la periferia del cuerpo (temperatura, dolor, presión) se transmite al cerebro a través de la activación de las neuronas DRG23. Tanto las neuronas como las células gliales del DRG se derivan de las células de la cresta neural del tronco24. La inyección lentiviral, en la que el promotor ubicuo de hPGK controla la expresión del reportero fluorescente, conduce a una orientación generalizada del sistema nervioso central y periférico (Figura 7A), transduciendo tanto neuronas como progenitores en la médula espinal (Figura 7B), así como el DRG (Figura 7C). El uso de un MiniPromoter para la doble cortina25 permite limitar la expresión de GFP solo a las neuronas (15 y Figura 7D, E).
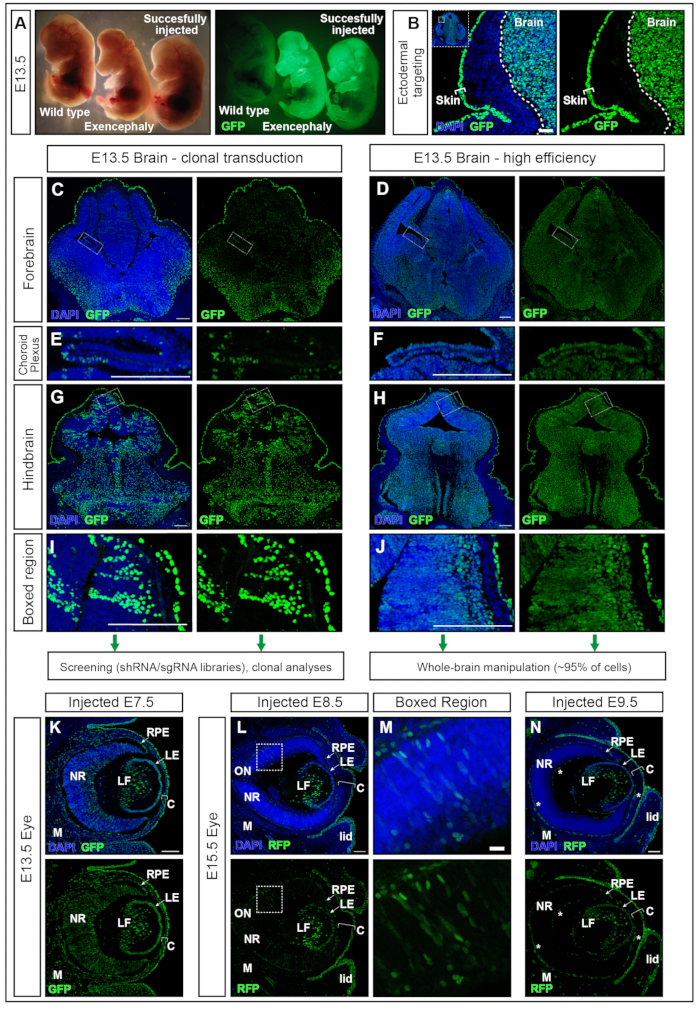
Figura 5: Alta eficiencia o transducción clonal con NEPTUNE. (A) embriones E13.5 bajo un microscopio de disección iluminados con iluminación estándar (panel izquierdo) y los mismos embriones iluminados para GFP (panel derecho). Embrión no inyectado en el extremo izquierdo, embrión inyectado con éxito en el extremo derecho, produciendo señal positiva en el cerebro (embrión más a la derecha). Embrión exencefálico por exceso de volumen inyectado (embrión medio). (B) Orientación de la piel y el cerebro con inyección E7.5. Barra de escala = 50 μm. (C, D) E13.5 imágenes confocales del cerebro anterior con baja transducción clonal (C) o transducción de alta eficiencia (D). (C, E, G, I) Transducción clonal de diferentes regiones del cerebro. (D, F, H, J) Transducción de alta eficiencia de diferentes regiones del cerebro. Barras de escala = 200 μm. Las diferentes eficacias de transducción son representativas de otras áreas del SNC. (E, F) Orientación del plexo coroideo, clonalmente (E) o con alta eficiencia (F). Barras de escala = 200 μm. (G, H) Orientación clonal (G) y focalización de alta eficiencia (H) del cerebro posterior, ampliada en (I, J). Barras de escala = 200 μm. (K) Expresión del reportero de GFP en el ojo en E13.5 después de la inyección en el útero en E7.5 (L, M) Expresión del reportero de GFP en el ojo en E15.5 después de la inyección en el útero en E8.5 (L), región en caja ampliada en (M), o en E9.5 (N). Los vasos sanguíneos autofluorescentes están marcados con estrellas blancas. Barras de escala = 100 μm. Abreviaturas: NEPTUNO = ne ural plate targeting with in uteronano-injection; C = córnea; LE = epitelio del cristalino; LF = Fibras de lente; M = mesénquima; NR = retina neural; ON = nervio óptico; EPR = epitelio pigmentario de la retina; GFP = proteína verde fluorescente; SNC = sistema nervioso central. Haga clic aquí para ver una versión más grande de esta figura.
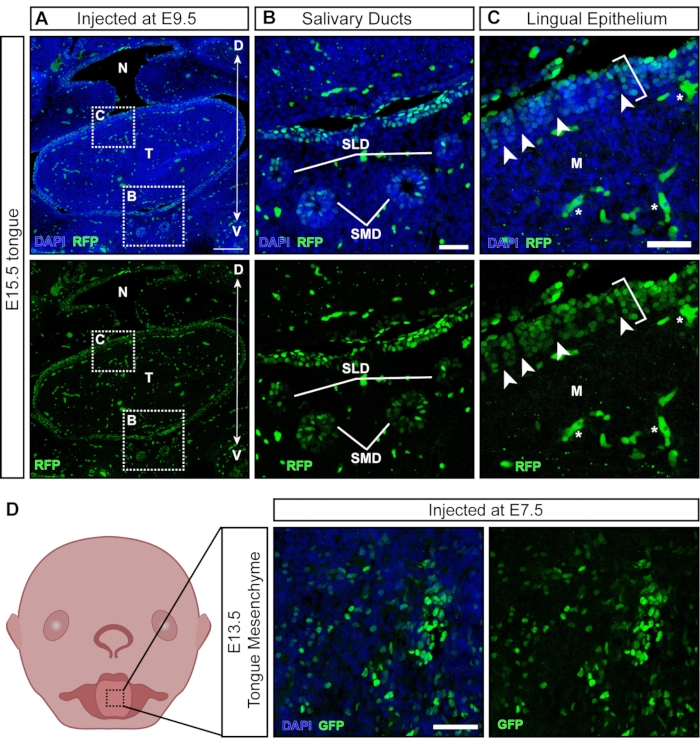
Figura 6: Transducción in utero de tejidos no neurales. (A) Imagen confocal de la cavidad oral E15.5. El embrión fue inyectado con lentivirus reportero fluorescente en E9.5. Barra de escala = 200 μm. (B, C) (B) Ampliación del panel insertado; epitelio del conducto salival transducido con virus. (C) Ampliación del panel insertado; epitelio lingual dorsal transducido con el virus reportero GFP (corchete blanco). El mesénquima subyacente derivado de las células de la cresta neural es negativo. Las puntas de flecha blancas indican papilas con células negativas de la cresta neural rodeadas de células epiteliales transducidas por virus (las células / vasos sanguíneos autofluorescentes están marcados con estrellas blancas). Barras de escala = 50 μm. (D) Imagen esquemática y confocal del mesénquima de la lengua E13.5 después de inyecciones con virus reportero fluorescente en E7.5. Barra de escala = 50 μm. Abreviaturas: D = Dorsal; M = mesénquima; N = nasofaringe; SLD = conducto sublingual; SMD = conducto submandibular; T = lengua; V = Ventral; GFP = proteína verde fluorescente. Haga clic aquí para ver una versión más grande de esta figura.
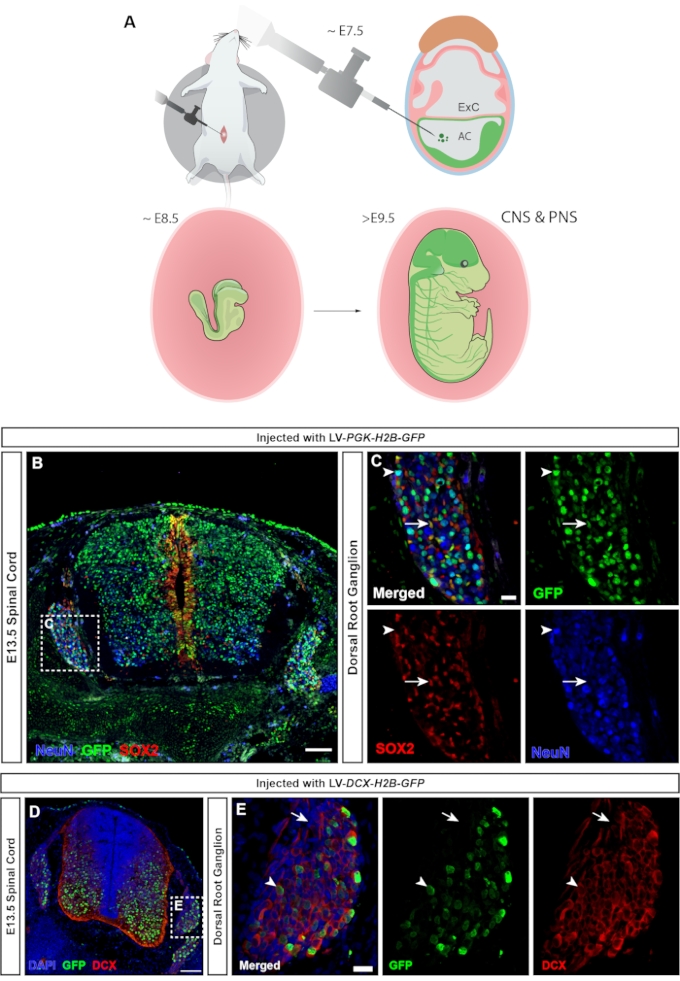
Figura 7: Transducción de células ganglionares de la raíz dorsal derivadas de la cresta neural. (A) La focalización de NEPTUNO en E7.5 permite la focalización tanto del SNC como del SNP. (B) La imagen confocal de la médula espinal E13.5 y DRG inyectados con lentivirus reportero hPGK-H2B-GFP en E7.5 muestra la transducción de progenitores neurales SOX2 + y neuronas NeuN +. Barra de escala = 100 μm. (C) Región recuadrada de B que muestra el DRG con expresión de GFP en poblaciones celulares SOX2+ (flechas blancas) y NeuN+ (puntas de flecha blancas). Barra de escala = 20 μm. (D) Imagen confocal de la médula espinal E13.5 y DRG inyectada con lentivirus DCX-H2B-GFP en E7.5, dirigida solo a células DCX +. Barra de escala = 100 μm. (E) Región en caja de D que muestra DRG con expresión de GFP restringida a neuronas DCX+ (puntas de flecha blancas). Las celdas DCX son negativas para GFP (flechas blancas). Barra de escala = 20 μm. Abreviaturas: NEPTUNO = ne ural plate targeting with in utero nano-injection; SNC = sistema nervioso central; SNP = sistema nervioso periférico; DRG = ganglios de la raíz dorsal; GFP = proteína verde fluorescente. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Hay varios pasos en este protocolo que influyen en la supervivencia embrionaria, la calidad de las inyecciones y la lectura. La edad gestacional de los embriones se define como E0.5 al mediodía del día del tapón vaginal después del apareamiento nocturno. Realizar la verificación de ultrasonido para el embarazo en E6.5 al final de la tarde / noche asegura que los embriones estén lo suficientemente desarrollados como para ser identificados por ultrasonido. El control (1) permite la preselección de cuántos ratones con tapón positivo están realmente embarazadas, (2) garantiza que ningún virus se descongele innecesariamente y se desperdicie en caso de que los ratones con tapón positivo no estén embarazadas, y (3) reduce las intervenciones innecesarias en ratones (evita la cirugía en hembras no embarazadas).
En E7.5, los embriones son sensibles a las fuerzas externas y deben manipularse con cuidado. Por ejemplo, tirar de los cuernos uterinos o apretar las deciduas puede conducir a la reabsorción embrionaria. El tejido uterino siempre debe mantenerse húmedo cuando está fuera del abdomen femenino para evitar que el tejido se seque. La mayoría de las deciduas deben permanecer dentro del abdomen femenino, con solo 3-4 expuestas para inyecciones. La nitidez de la aguja es otro determinante crucial para el éxito de las inyecciones. Las puntas de aguja romas o rotas dan como resultado un pinchazo repetido de deciduas o compresión contra la arcilla de modelado antes de ingresar al aire acondicionado, lo que puede aumentar la tasa de reabsorción. Por lo tanto, las agujas bien molidas y afiladas siempre deben almacenarse de manera segura y reemplazarse después de un máximo de 2 hembras.
Este protocolo describe cómo dirigirse a la placa neural con una sola inyección de lentivirus. Además, muestra cómo la eficacia de la transducción se puede adaptar de clones de células individuales a todo el cerebro. Sin embargo, otros tejidos no neurales, incluyendo la piel y el epitelio oral, también están dirigidos. Además, se transducen todos los tipos celulares (progenitores y células diferenciadas), lo que hace que este enfoque sea eficiente pero inespecífico. El uso de MiniPromoters en la construcción viral conduce a la expresión específica del transgén en neuronas o astrocitos15. Esto tiene la ventaja de evitar el uso de animales Cre transgénicos dedicados y, por lo tanto, reduce la cantidad de mano de obra (mantenimiento de cepas y genotipado) y los costos.
Las limitaciones de NEPTUNE incluyen su dificultad técnica, los desafíos para obtener hembras preñadas a un ritmo predecible y consistente, y los costos de adquirir instrumentación especializada. Además, la orientación no selectiva de las células por lentivirus puede verse como un beneficio y una limitación de la técnica. La inyección de mayores volúmenes en el CA resulta en exencefalia13, aunque las malformaciones cerebrales y la exencefalia se evitan con los volúmenes descritos aquí15. Un impacto negativo en el desarrollo del cerebro es, por lo tanto, un riesgo con nanoinyecciones in utero que deben evitarse cuidadosamente inyectando volúmenes correctos adaptados a la etapa embrionaria y al tamaño de AC.
Las adaptaciones futuras de la técnica pueden centrarse en el tropismo viral. Los virus adenoasociados (AAV) tienen diferentes serotipos, que han demostrado dirigirse robustamente a diferentes tipos de células en el SNC17,26. Sin embargo, los AAV no se integran en el genoma de la célula huésped y, por lo tanto, pueden perderse en células con una alta tasa de división. Aunque hay varias maneras de aumentar la especificidad de NEPTUNO, los animales transgénicos siguen siendo el estándar de oro cuando se trata de manipulación de genes in vivo. Los ratones Cas9 y el lentivirus que codifica sgRNA se han utilizado para el cribado genético en la epidermis embrionaria27 y también pueden adaptarse al SNC en desarrollo.
Las inyecciones en el CA en E7.5 se dirigen eficientemente a las células del neuroectodermo antes del inicio de la neurulación y se dirigen al cerebro en desarrollo de manera más eficiente que la electroporación en el útero . Esto permite el estudio de señales genéticas importantes para el desarrollo del cerebro desde un punto de tiempo anterior. A diferencia de los modelos genéticos clásicos de ratón, NEPTUNE ofrece un enfoque flexible para realizar análisis genéticos funcionales. Los fenotipos después de la sobreexpresión o la eliminación de genes se pueden estudiar en días o semanas en comparación con meses o años. Las inyecciones de múltiples construcciones virales permiten la manipulación de varios genes dentro de un embrión y evitan la generación de animales knockout doble o triple. Por lo tanto, NEPTUNE no solo ahorra tiempo, sino que también puede reducir el número de animales utilizados en la investigación.
Divulgaciones
Los autores declaran que no hay intereses contrapuestos.
Agradecimientos
Agradecemos a Bettina Semsch y Jia Sun (Infinigene) por el cuidado experto de ratones; Florian Salomons y Göran Månsson de Biomedicum Imaging Core (BIC) por su asistencia con la adquisición y consulta de imágenes. Financiación: Agradecemos a los siguientes financiadores por su apoyo a este proyecto: El Consejo Sueco de Investigación, Karolinska Institutet (KI Foundations, Career Development Grant, Ph.D. estudiante KID funding, y SFO StratNeuro funding, el Centro de Medicina Innovadora), The Ollie and Elof Ericssons Foundation, the Tornspiran Foundation, the Jeansssons Foundation, Sven and Ebba-Christina Hagbergs Prize and research Grant, Knut and Alice Wallenberg Project Grant, Fredrik and Ingrid Thurings Foundation, Lars Hiertas Minne, The Childhood Cancer Foundation (Barncancerfonden), The Åhlen Foundation, Åke Wibergs Foundation, Tore Nilssons Foundation, and the Swedish Foundations Starting Grant to ERA. Las figuras 4D,E fueron creadas con BioRender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | BD Bioscience | 309628 | |
| 27 G Needle | BD Bioscience | 300635 | |
| 3.5 inches capillaries | Drummond Scientific | 3000203G/X | Were used to pull in house needles |
| 70 MHz MS Series transducer | Visual Sonics | MS700 | |
| Aquasonic clear ultrasound gel | Parker Laboratories | Mar-50 | |
| Autoclip Applier 9 mm | Angthos | 12020-09 | |
| CD1 mice | Charles River, Germany | Crl:CD1(ICR) | Females: from age of 8 weeks old Males: from the age of 12 weeks old |
| Cotton Swab | OneMed Sverige AB | 120788 | |
| DPBS | Gibco | 14190094 | |
| Dressing forceps delicate straight 13 cm | Agnthos | 08-032-130 | |
| EG-400 Narishige Micropipette Grinder | Narishige | NA | |
| EZ clips 9 mm | Angthos | 59027 | clips |
| Iris Scissors, Super Cut, straight, 9 cm | Agnthos | 307-336-090 | |
| Isofluorane | Baxter Medical AB | EAN: 50085412586613 | Purchased from Swedish Pharmacy |
| Kimwipes | Kimberly Clarke | 7557 | |
| Membrane Tape | Visual Sonics | SA-11053 | |
| Micropipette Puller | Sutter Instrument | P-97 | |
| Modeling Clay | Sense AB | 10209 | |
| Mouse Handling Table | Visual Sonics | 50249 | |
| Nanoject II Auto Injector Kit | Drummond | 3-000-205A | |
| Parafilm | Bemis | HS234526C | |
| Petri dish with central opening (low wall) | Visual Sonics | SA-11620 | |
| Petri dish, (ØxH): 92 x 16 mm | Sarstedt | 82.1472.001 | |
| Rely+On Virkon | DuPont | 130000132037 | disinfectant |
| Silicone membrane | Visual Sonics | SA-11054 | |
| Steri 250, hot bead sterilizer | Angthos | 31100 | |
| Surgical Tape (1.25 cm x 9.14 m) | Medicarrier | 67034 | |
| Vevo Compact Dual (Med. Air & O2) Anesthesia System | Visual Sonics | VS-12055 | |
| Vevo Imaging Station 2 | Visual Sonics | VS-11983 | |
| Vevo2100 | Visual Sonics | VS-20047 | |
| Vicryl 6-0; C-3 needle, 45 cm purple filament | Agnthos | J384H |
Referencias
- Theiler, K. . The House mouse. Atlas of embryonic development. , (1989).
- Barresi, M. J. F., Gilbert, S. F. . Developmental biology. , (2016).
- Taylor, J. C., et al. Factors influencing success of clinical genome sequencing across a broad spectrum of disorders. Nature Genetics. 47 (7), 717-726 (2015).
- Pizzo, L., et al. Rare variants in the genetic background modulate cognitive and developmental phenotypes in individuals carrying disease-associated variants. Genetics in Medicine. 21 (4), 816-825 (2019).
- Sakai, Y. Neurulation in the mouse: Manner and timing of neural tube closure. The Anatomical Record. 223 (2), 194-203 (1989).
- Schoenwolf, G. C. Shaping and bending of the avian neuroepithelium: Morphometric analyses. Developmental Biology. 109 (1), 127-139 (1985).
- Smith, J. L., Schoenwolf, G. C., Quan, J. Quantitative analyses of neuroepithelial cell shapes during bending of the mouse neural plate. Journal of Comparative Neurology. 342 (1), 144-151 (1994).
- Katahira, T., Nakamura, H. Gene silencing in chick embryos with a vector-based small interfering RNA system. Development Growth and Differentiation. 45 (4), 361-367 (2003).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. I. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochemical and Biophysical Research Communications. 230 (2), 376-380 (1997).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Beronja, S., Livshits, G., Williams, S., Fuchs, E. Rapid functional dissection of genetic networks via tissue-specific transduction and RNAi in mouse embryos. Nature Medicine. 16 (7), 821-827 (2010).
- Pierfelice, T. J., Gaiano, N. Ultrasound-guided microinjection into the mouse forebrain in utero at E9.5. Journal of Visualized Experiments JoVE. (45), e2047 (2010).
- Gaiano, N., Kohtz, J. D., Turnbull, D. H., Fishell, G. A method for rapid gain-of-function studies in the mouse embryonic nervous system. Nature Neuroscience. 2 (9), 812-819 (1999).
- Slevin, J. C., et al. High resolution ultrasound-guided microinjection for interventional studies of early embryonic and placental development in vivo in mice. BMC Developmental Biology. 6, 10 (2006).
- Mangold, K., et al. Highly efficient manipulation of nervous system gene expression with NEPTUNE. Cell Reports Methods. 1, 100043 (2021).
- Kameneva, P., et al. Single-cell transcriptomics of human embryos identifies multiple sympathoblast lineages with potential implications for neuroblastoma origin. Nature Genetics. 53 (5), 694-706 (2021).
- Kaiser, K., et al. MEIS-WNT5A axis regulates development of fourth ventricle choroid plexus. Development. 148 (10), (2021).
- Haddad, M. R., Donsante, A., Zerfas, P., Kaler, S. G. Fetal brain-directed AAV gene therapy results in rapid, robust, and persistent transduction of mouse choroid plexus epithelia. Molecular Therapy. Nucleic Acids. 2 (6), 101 (2013).
- Heavner, W., Pevny, L. Eye development and retinogenesis. Cold Spring Harbor Perspectives in Biology. 4 (12), 008391 (2012).
- Swamynathan, S. K. Ocular surface development and gene expression. Journal of Ophthalmology. 2013, 103947 (2013).
- Amano, O., Mizobe, K., Bando, Y., Sakiyama, K. Anatomy and histology of rodent and human major salivary glands: -overview of the Japan Salivary Gland Society-sponsored workshop. Acta Histochemica et Cytochemica. 45 (5), 241-250 (2012).
- Liu, H. X., Komatsu, Y., Mishina, Y., Mistretta, C. M. Neural crest contribution to lingual mesenchyme, epithelium and developing taste papillae and taste buds. Developmental Biology. 368 (2), 294-303 (2012).
- Marmigère, F., Ernfors, P. Specification and connectivity of neuronal subtypes in the sensory lineage. Nature Reviews. Neuroscience. 8 (2), 114-127 (2007).
- Zirlinger, M., Lo, L., McMahon, J., McMahon, A. P., Anderson, D. J. Transient expression of the bHLH factor neurogenin-2 marks a subpopulation of neural crest cells biased for a sensory but not a neuronal fate. Proceedings of the National Academy of Sciences of the United States of America. 99 (12), 8084-8089 (2002).
- Portales-Casamar, E., et al. A regulatory toolbox of MiniPromoters to drive selective expression in the brain. Proceedings of the National Academy of Sciences of the United States of America. 107 (38), 16589-16594 (2010).
- Tervo, D. G. R., et al. A designer AAV variant permits efficient retrograde access to projection neurons. Neuron. 92 (2), 372-382 (2016).
- Loganathan, S. K., et al. Rare driver mutations in head and neck squamous cell carcinomas converge on NOTCH signaling. Science. 367 (6483), 1264-1269 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados