Method Article
Targeting della placca neurale murina mediante nano-iniezione in utero (NEPTUNE) al giorno embrionale 7.5
In questo articolo
Riepilogo
In questo protocollo, descriviamo come iniettare lentivirus nella cavità amniotica del topo a E7.5, portando a una trasduzione uniforme dell'intera piastra neurale, con effetti dannosi minimi sulla sopravvivenza o sullo sviluppo embrionale.
Abstract
La manipolazione dell'espressione genica nel cervello di topo in via di sviluppo in utero ha un grande potenziale per gli studi di genetica funzionale. Tuttavia, in precedenza è stato in gran parte limitato alla manipolazione degli stadi embrionali post-neurulazione. È stato sviluppato un protocollo per iniettare la cavità amniotica al giorno embrionale (E) 7.5 e fornire lentivirus, codificando cDNA o shRNA, mirando al >95% della piastra neurale e delle cellule della cresta neurale, contribuendo al futuro cervello, midollo spinale e sistema nervoso periferico. Questo protocollo descrive i passaggi necessari per ottenere una trasduzione di successo, tra cui la macinazione degli aghi capillari di vetro, la verifica della gravidanza, la stadiazione dello sviluppo mediante imaging ad ultrasuoni e volumi di iniezione ottimali abbinati agli stadi embrionali.
Seguendo questo protocollo, è possibile ottenere la trasduzione del >95% del cervello in via di sviluppo con lentivirus ad alto titolo e quindi eseguire la manipolazione genetica dell'intero cervello. Al contrario, è possibile ottenere la trasduzione del mosaico utilizzando titoli virali più bassi, consentendo lo screening genetico o il tracciamento del lignaggio. L'iniezione a E7.5 colpisce anche l'ectoderma e la cresta neurale che contribuiscono a compartimenti distinti dell'occhio, della lingua e del sistema nervoso periferico. Questa tecnica offre quindi la possibilità di manipolare l'espressione genica nei tessuti derivati da piastre neurali ed ectodermi di topo fin dalle fasi di preneurulazione, con il vantaggio di ridurre il numero di topi utilizzati negli esperimenti.
Introduzione
Il cervello e il midollo spinale sono tra i primi organi ad avviare la formazione durante l'embriogenesi 1,2. Sebbene i geni associati ai disturbi dello sviluppo neurologico siano stati identificati, l'interrogazione funzionale delle varianti genetiche è rimasta indietrorispetto a 3,4. Poiché la generazione di topi knockout condizionali può richiedere mesi o anni, una tecnica alternativa per studiare rapidamente la funzione genica nel cervello in via di sviluppo è interessante. Negli embrioni di topo, la neurulazione - il processo morfogenetico mediante il quale la piastra neurale si trasforma nel tubo neurale per dare origine al sistema nervoso centrale (SNC) - avviene tra i giorni 8 e 10 dopo il concepimento5. Prima dell'inizio della neurulazione, la piastra neurale, come parte dell'ectoderma, è costituita da un singolo strato di cellule colonnari che proliferano e si differenziano nei numerosi tipi di cellule neuronali e gliali all'interno del SNC 6,7. Pertanto, per indurre sperimentalmente alterazioni durature all'espressione genica nel SNC, il targeting della piastra neurale offre ovvi vantaggi, tra cui l'accessibilità di tutte le cellule progenitrici.
Nelle neuroscienze, nell'ovo l'elettroporazione 8,9 e la trasduzione virale di embrioni di topo sono stati utilizzati per manipolare l'espressione genica embrionale del SNC. L'embrione di pulcino in via di sviluppo è stato un modello di scelta per studiare la funzione genica durante lo sviluppo del midollo spinale a causa dell'accessibilità dell'embrione di pulcino nell'uovo e della conseguente facilità di manipolazione dell'espressione genica. In particolare, l'elettroporazione plasmidica in ovo genera condizioni sperimentali e di controllo in ogni midollo spinale di pulcino. L'elettroporazione provoca la permeabilizzazione della membrana cellulare e dirige il DNA caricato negativamente lontano dal catodo (negativo) verso l'anodo (positivo) applicando un impulso elettrico tramite due elettrodi all'embrione. Nei topi, l'elettroporazione in utero è stata generalmente limitata agli stadi embrionali in cui la neurulazione è stata completata e il cervello o il midollo spinale sono già costituiti da diversi strati cellulari, con conseguente bassa efficienza di elettroporazione10. L'elettroporazione plasmidica provoca un'espressione genica transitoria e generalmente colpisce poche cellule.
La microiniezione in utero guidata da ultrasuoni è stata utilizzata per manipolare diverse strutture embrionali come la pelle e il cervello11,12,13,14. Tuttavia, le iniezioni mirate al SNC murino in via di sviluppo hanno mostrato una bassa efficacia o hanno avuto un impatto negativo sulla sopravvivenza embrionale12,13,14. Pertanto, è stato sviluppato un protocollo migliorato per la somministrazione di lentivirus ad alto titolo nella cavità amniotica (AC) a E7.5, che è stato soprannominato NEPTUNE per l'argeting in uteronano-inj e ction 15. Le iniezioni hanno portato a un'efficacia mirata di lunga durata del >95% dell'intero cervello a E13.5. Inoltre, è stata introdotta una fase di stadiazione durante la verifica ecografica della gravidanza per ordinare le femmine e le gravidanze in base allo stadio di sviluppo per ridurre al minimo le procedure non necessarie sugli animali da ricerca e massimizzare il successo dell'iniezione. L'efficienza e la sopravvivenza dell'iniezione sono strettamente legate all'aumento delle dimensioni del condizionatore. Pertanto, questo documento descrive come misurare le dimensioni dell'AC prima dell'iniezione per fornire un volume adeguato all'AC che non causi il riassorbimento dell'embrione. NEPTUNE è una robusta alternativa agli attuali approcci in utero e può essere adattato per diversi usi, inclusi, ma non limitati a, studi di guadagno e perdita di funzione, tracciamento del lignaggio o screening15,16.
Protocollo
I topi CD1 wild-type sono stati ospitati secondo le normative europee, con un ciclo giorno e notte standard con cibo e acqua ad libitum. Le femmine CD1 sono state accoppiate con maschi CD1 durante la notte e i tappi vaginali sono stati controllati al mattino (E0.3). Solo le donne gravide sono state utilizzate per l'iniezione. L'approvazione etica per tutti gli esperimenti qui descritti è stata concessa dal Consiglio svedese dell'agricoltura (Jordbruksverket).
1. Preparazione di aghi di vetro: tiro e macinazione dell'ago
NOTA: Sebbene sia possibile acquistare aghi premacinati, gli aghi di trazione internamente consentono di regolare facilmente la lunghezza dell'ago, l'alesaggio e l'angolo di smussatura.
- Montare un capillare di vetro nella micropipetta/estrattore capillare. Utilizzare le seguenti impostazioni utilizzando l'apparecchiatura specificata (vedere la tabella dei materiali): riscaldare 580 unità; velocità 140 unità; tempo 200 unità; pressione 500-800 unità.
NOTA: Le unità dei diversi parametri sono definite dall'estrattore capillare. Le unità possono variare per le diverse apparecchiature. - Premere Tirare per separare il capillare producendo due capillari di vetro con estremità affusolate.
NOTA: Dopo la trazione, le punte dei due capillari di vetro vengono fuse a causa dell'alta temperatura dell'estrattore di micropipette. - Tagliare la punta con le forbici chirurgiche per ottenere una lunghezza dell'ago di ~ 7 mm (misurata dal punto in cui l'ago inizia a assottigliarsi) (Figura 1A).
NOTA: Per le iniezioni E7.5, un ago lungo e sottile è fondamentale poiché la regione di iniezione è molto piccola e delicata. Gli aghi corti e larghi provocheranno morti embrionali. - Macinare la punta dell'ago tagliata per creare una smussatura affilata (Figura 1C-F).
- Macinare l'ago con un angolo di 20° alla massima velocità per almeno 30-45 minuti.
NOTA: L'acqua ultrapura viene aggiunta alla piastra di macinazione per fungere da lubrificante, ridurre l'attrito/temperatura e lavare via le particelle di vetro (Figura 1B). Tuttavia, il liquido in eccesso può rallentare la smerigliatrice. - Assicurarsi che la punta dell'ago (Figura 1C) tocchi la superficie della piastra di rettifica (Figura 1D) ma non si pieghi (Figura 1E).
NOTA: la rettifica piegata provoca una punta dell'ago lunga e fragile con un angolo di smussatura errato, che può facilmente rompersi durante l'iniezione. La rottura degli aghi può danneggiare l'embrione e deve essere sostituita con un ago intatto. Una punta rettificata correttamente è mostrata nella figura 1F,G. Dopo la macinazione, il foro dell'ago risultante dovrebbe avere un diametro interno (ID) di ~ 15 μm e un diametro esterno (OD) di ~ 35 μm (Figura 1G).
- Macinare l'ago con un angolo di 20° alla massima velocità per almeno 30-45 minuti.
- Riempire una siringa da 1 mL con olio minerale e inserire un ago da 27 G.
- Rimuovere il cappuccio dell'ago e inserire l'ago della siringa nel capillare di vetro appena macinato. Iniettare olio minerale fino a quando l'olio gocciola dalla punta capillare. Continuare ad iniettare mentre si preleva l'ago da 27 G fino a riempire l'ago capillare con olio minerale, dopodiché l'ago della siringa può essere rimosso.
- Conservare gli aghi macinati e riempiti di olio minerale in un ambiente chiuso per evitare danni e accumulo di polvere. Per la conservazione, inserire due rotoli di argilla da modellare in una normale capsula di Petri da utilizzare come supporti (Figura 1H). Appollaiare delicatamente gli aghi sull'argilla e distanziarli per un facile recupero degli aghi.
NOTA: Poiché la preparazione dell'ago richiede molto tempo, è meglio preparare gli aghi almeno un giorno prima delle iniezioni. Scartare gli aghi dopo due cucciolate al massimo in quanto diventeranno smussati. Preparare sempre gli aghi di riserva in caso di danni all'ago durante la preparazione o l'iniezione.
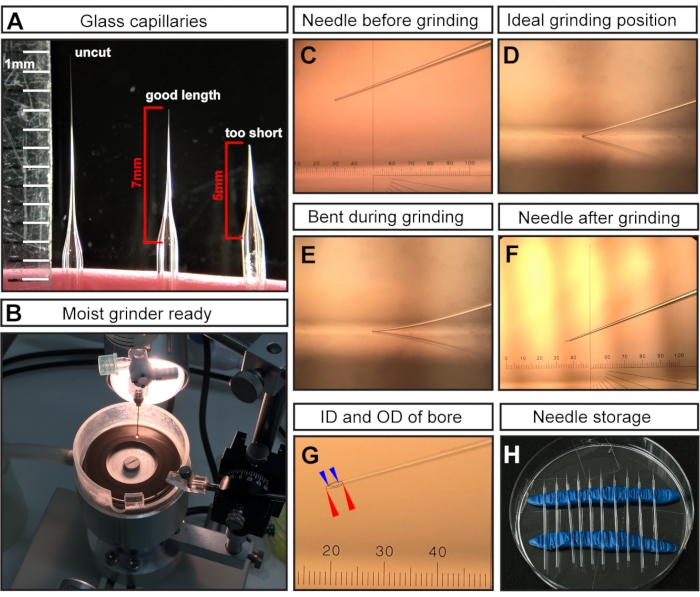
Figura 1: Preparazione dell'ago per iniezioni di cavità amniotica E7.5. (A) Esempi rappresentativi di un ago capillare di vetro tirato ma non tagliato (a sinistra), un ago capillare tagliato alla lunghezza ottimale per le iniezioni E7.5 (al centro) e un taglio capillare troppo corto (a destra). (B) La smerigliatrice con copertura uniforme di acqua, che è pronta per la macinazione dell'ago. (C-F) Esempi rappresentativi di diverse punte di aghi. (C) punta dell'ago tagliata ma non rettificata montata in smerigliatrice; (D) posizione di macinazione ideale con la punta dell'ago appena a contatto con la smerigliatrice; (E) ago abbassato troppo e piegato durante il processo di macinazione; (F) una punta dell'ago rettificata ideale per le iniezioni di E7,5 AC. (G) Una punta dell'ago rettificata che mostra il foro con un diametro interno di ~15 μm e un diametro esterno di ~35 μm, che è adatto per l'iniezione E7.5 AC. Il foro dell'ago viene mostrato come linee tratteggiate. Diametro esterno indicato con punte di freccia rosse; diametro interno indicato con punte di freccia blu. (H) Conservazione dell'ago: capsula di Petri riempita con aghi tirati e macinati. Due file di argilla da modellazione fungono da supporti. NOTA: Per il micrometro oculare in C, F, G, 1 cm è diviso in 100 tiri; l'obiettivo è 3x; Pertanto, 1 passo = 10.000 μm/(100 × 3) ≈ 33,4 μm. Abbreviazioni: AC = cavità amniotica; ID = diametro interno; OD = diametro esterno. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Giorno prima dell'iniezione: preparare il banco per la verifica ecografica della gravidanza
NOTA: Tutti i lavori devono essere eseguiti in un banco ventilato di Biosicurezza Livello 2 (BSL 2) quando si lavora con lentivirus. La verifica ecografica della gravidanza può essere eseguita su una panca ventilata.
- Accendere la macchina ad ultrasuoni, il tavolo riscaldante e l'alimentazione O2 per la pompa a isoflurano (può variare tra le apparecchiature).
NOTA: Controllare il sistema di isoflurano per assicurarsi che non vi siano perdite di isoflurano nell'aria. - Posizionare un sacchetto per rifiuti vuoto (fissato alla parete interna per un facile accesso), crema depilatoria, tamponi di cotone sterili, acqua, carta velina e nastro chirurgico all'interno del banco BSL 2.
- Preparare quattro pezzi di nastro chirurgico (~ 7 cm di lunghezza) per fissare gli arti del topo durante il controllo ecografico della gravidanza.
3. Controllo ecografico per confermare la gravidanza
NOTA: Questo passaggio può essere eseguito il giorno prima delle iniezioni E7.5, a E6.5. Vedi la discussione per i dettagli sul controllo dell'età gestazionale.
- Posizionare il topo femmina accoppiato nel tempo nella camera di induzione.
- Accendere il flusso di gas con un flusso di ossigeno di ~ 2,1 LPM e una dose iniziale di isoflurano al 3-4% per indurre l'anestesia.
- Verificare che la femmina sia completamente anestetizzata controllando il riflesso della zampa. Se il riflesso della zampa è assente, abbassare l'isoflurano all'1,5-2%.
NOTA: Ci vogliono circa 3 minuti per indurre l'anestesia. - Commutare il flusso di gas dalla camera di induzione al cono del naso del tavolo riscaldante.
- Posizionare la femmina anestetizzata in posizione supina (addome in alto) sul tavolo riscaldante e posizionare il muso nel cono nasale attaccato per garantire il mantenimento dell'anestesia durante il controllo ecografico della gravidanza.
- Fissare tutte e quattro le zampe al tavolo con i pezzi preparati di nastro chirurgico senza allungare il corpo della femmina o intrappolare i baffi.
- Applicare una quantità di crema depilatoria delle dimensioni di un pisello sul basso addome. Utilizzando un batuffolo di cotone, distribuire la crema sull'addome inferiore (un quadrato ~ 3 x 3 cm) e massaggiarla delicatamente arrotolando il batuffolo di cotone avanti e indietro.
- Una volta che la pelliccia inizia a staccarsi dalla pelle, inumidire una carta velina e rimuovere la crema e la pelliccia. Pulire l'area de-pelosa con carta velina umida fino a quando tutta la crema e i capelli sono spariti. Asciugare la pelle.
- Applicare una quantità di gel ad ultrasuoni delle dimensioni di una prugna sulla zona rasata e procedere all'identificazione dell'utero utilizzando gli ultrasuoni con uno dei seguenti tre approcci.
- Per farlo manualmente, tenere la sonda ad ultrasuoni nel gel ad ultrasuoni e spostare la sonda per trovare l'utero.
- Per l'approccio semimanuale #1, posizionare la sonda ad ultrasuoni (attaccata al sistema di ringhiera) sopra l'addome femminile allentando e spostando parte della guida lungo il piano x. Abbassare la sonda ad ultrasuoni nel gel (piano z) e scansionare attraverso l'addome inferiore (piano y) (Figura 2A).
- Per l'approccio semimanuale #2, abbassare la sonda ad ultrasuoni (collegata al sistema di ringhiera) nel gel per visualizzare l'addome inferiore. Mantenere la sonda ad ultrasuoni ferma durante il processo e spostare il tavolo riscaldante con le ruote collegate lungo i piani x e/o y (Figura 2B).
NOTA: In queste prime fasi embrionali, gli organi interni, ad esempio l'intestino, possono apparire simili all'utero nell'ecografia. Tuttavia, mentre embrioni e decidua appaiono come una sequenza di sfere (simili a perline lungo una collana), l'intestino ha l'aspetto di un tubo continuo. La connettività degli spazi luminali (sfere separate vs. un tubo continuo) può essere valutata scansionando avanti e indietro attraverso la struttura di interesse per determinare se la struttura è una sfera discreta (embrione / decidua) (Figura 2C) o un tubo continuo (intestino) (Figura 2D). In questa fase, non è necessario registrare il numero di embrioni; è sufficiente confermare la loro presenza o assenza.
- Una volta determinato lo stato di gravidanza, sollevare la sonda ad ultrasuoni lontano dall'addome e pulire l'addome inferiore con carta velina umida per rimuovere il gel ad ultrasuoni.
- Spegnere la pompa di isoflurano e rimuovere il nastro chirurgico per rilasciare le zampe.
- Posizionare la femmina in posizione prona (pancia in giù) in una gabbia pulita su una piastra riscaldante a 40 °C. Tenere la femmina sotto stretta osservazione fino a quando non riprende conoscenza, il che richiede 2-6 minuti.
NOTA: Assicurarsi che il controllo ecografico per una femmina sia di <10 minuti per ridurre al minimo l'esposizione all'isoflurano. - Rimuovere tutti i materiali e i rifiuti e pulire tutte le superfici con etanolo al 70%. Rimuovere qualsiasi gel ad ultrasuoni residuo dalla sonda ad ultrasuoni con un fazzoletto di carta asciutto, morbido e privo di lanugine. Spegnere la macchina ad ultrasuoni, il banco ventilato / banco BSL2, il tavolo riscaldante e l'alimentazione O2 .
4. Controllo ecografico per la stadiazione embrionale
NOTA: Questo passaggio viene eseguito prima dell'intervento chirurgico e serve a stratificare le femmine gravide in base alle loro dimensioni AC. Questo passaggio è cruciale in E7.5 quando l'obiettivo è quello di indirizzare il SNC in via di sviluppo. In questa fase iniziale dello sviluppo, una differenza di poche ore nello sviluppo influenza significativamente le dimensioni dell'AC e la progressione della neurulazione.
- Anestetizzare il primo topo femmina gravido seguendo i passaggi nei passaggi 3.1-3.5.
- Posizionare e fissare la femmina sul tavolo come descritto al punto 3.6.
- Applicare una quantità di gel per ultrasuoni delle dimensioni di una prugna sull'addome rasato e abbassare la sonda ad ultrasuoni per visualizzare l'addome inferiore della femmina.
NOTA: Questo passaggio presuppone che la femmina sia stata ispezionata mediante ecografia il giorno precedente per la gravidanza e abbia già rimosso la pelliccia sull'addome. In caso contrario, la pelliccia deve essere rimossa prima dell'aggiunta di gel per ultrasuoni seguendo i passaggi 3.7-3.8. A E7.5, l'utero e le decidue sono più grandi e più facili da distinguere dagli organi interni. Inoltre, l'AC è più grande e può essere distinto dalla cavità esocelomica (ExC). - Scansiona attraverso le corna uterine sinistra e destra nel modo più completo possibile.
NOTA: Alcuni embrioni si trovano più in profondità all'interno del corpo della femmina e possono essere persi. - Registrare il numero e le fasi degli embrioni. Prendi nota del numero di cavità amniotiche di dimensioni ideali, cavità accettabili e decidue senza cavità (Figura 2E-G).
- Metti in scena tutte le gravidanze e classificale di conseguenza.
- Iniettare nelle femmine la maggior parte dei condizionatori di aria condizionata di dimensioni ideali immediatamente dopo il controllo ecografico (fase 4.4) seguendo le istruzioni nei passaggi 4.5-4.7.
- Per le femmine con una maggioranza di cavità accettabili (in cui le cavità esocelomica e amniotica non sono ancora chiaramente divise in due cavità) o assente, posticipare l'iniezione e metterle in scena di nuovo dopo un paio d'ore. Se la maggior parte delle cavità sono ancora troppo piccole, posticipare le iniezioni di 10-12 ore.
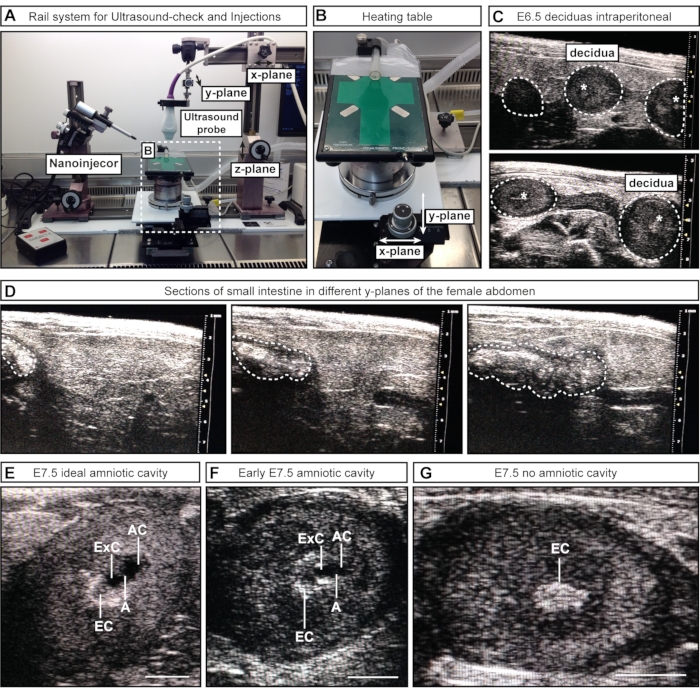
Figura 2: Ispezione e stadiazione delle cavità amniotiche durante il controllo ecografico. (A) Panoramica del sistema ferroviario con sonda a ultrasuoni collegata, nanoiniettore e tavolo riscaldante. La sonda ad ultrasuoni può essere spostata nei piani x, y e z per ottenere un allineamento ottimale con l'addome femminile o gli AC. (B) La tavola riscaldante può essere spostata tramite due ruote nei piani x e/o y per consentire una scansione e una valutazione precise dei condizionatori d'aria, mentre la sonda a ultrasuoni può rimanere statica. (C) Immagini ecografiche rappresentative di E6,5 decidue all'interno dell'addome femminile durante il controllo ecografico per confermare la gravidanza (contorni tratteggiati bianchi). Nessuna cavità si è formata a questo punto; Tuttavia, a volte, il cono ectoplacentare (asterischi bianchi) è visibile. Le decidue possono essere riconosciute dalla loro forma sferica e distinte dall'intestino, che appare come un tubo continuo. (D) Sequenza di immagini rappresentative dell'intestino tenue (contorni tratteggiati sbiancati), che è continua nella scansione attraverso l'addome inferiore. (E-G) Immagini ecografiche rappresentative durante la stadiazione della cavità prima delle iniezioni di E7.5. Le cavità amniotiche ed esocelomiche si sono formate e sono separate dall'amnione. Il cono ectoplacentare funge da principale apporto di sangue e appare come un punto luminoso nell'ecografia. L'AC è più distale dal cono ectoplacentare. (E) I condizionatori di dimensioni ideali appaiono più grandi della cavità esocelomica, mentre le cavità di medie dimensioni appaiono più piccole (F). Se non sono visibili cavità (G), ciò significa che l'embrione è riassorbito o non ha ancora raggiunto E7.5. Barre della scala = 1 mm. Abbreviazioni: A = Amnion; AC = cavità amniotica; ExC = cavità esocelomica; EC = Cono ectoplacentare. Fare clic qui per visualizzare una versione ingrandita di questa figura.
5. Giorno dell'iniezione: preparare la panca BSL2 per l'intervento chirurgico
- Incollare un pezzo di membrana elastica all'apertura rotonda centrale di una capsula di Petri modificata disponibile in commercio. Assicurarsi che la membrana sia ben attaccata alla capsula di Petri per evitare perdite.
NOTA: Se il piatto perde o non è ben incollato, i bordi della membrana elastica possono essere ulteriormente fissati con nastro adesivo. - Fare un'incisione lunga 1-1,5 cm al centro della membrana elastica.
- Accendere la macchina ad ultrasuoni, il banco BSL2, la piastra riscaldante, l'alimentazione O2 per la pompa isoflurano e lo sterilizzatore a perline di vetro (impostato a 300 °C).
- All'interno del banco BSL2, posizionare un sacchetto di rifiuti vuoto (fissato alla parete interna per un facile accesso); tamponi di cotone sterili confezionati (utilizzarne uno nuovo per ogni intervento chirurgico / ogni femmina); strumenti chirurgici (forbici, pinzette, clip, sutura) e nastro chirurgico; un flacone pieno di soluzione salina tamponata fosfato (PBS) a temperatura ambiente, un flacone vuoto per la raccolta dei rifiuti e una pipetta da 25 ml; una capsula di Petri con membrana elastica per la chirurgia; il coperchio della capsula di Petri con un parafilm di 2 x 2-3 x 3 cm fissato al coperchio con una goccia d'acqua; argilla da modellare: 4 sfere o cubi più grandi (~3 x 3 x 3 cm3 ) e un pezzo cilindrico (~4 x 1 cm); una siringa con analgesico (ad esempio, buprenorfine, 0,05-0,1 mg/kg di peso corporeo) e gel per gli occhiNOTA: Le palline (o cubi) di argilla da modellare serviranno come "piedi" o supporti / supporti per la capsula di Petri una volta che il piatto è posizionato sopra l'addome della femmina. Il pezzo cilindrico di argilla fissa gli embrioni all'interno del piatto. Se viene iniettata più di una soluzione o se l'ago deve essere riempito nuovamente durante le iniezioni, lo stesso pezzo di parafilm può essere utilizzato se le soluzioni possono essere distanziate.
6. Caricamento dell'ago
- Rimuovere l'olio minerale in eccesso con carta velina per una presa migliore.
NOTA: pulire sempre lontano dalla punta per evitare danni o lesioni. - Assicurarsi che tutti i componenti (un O-ring di tenuta, un distanziatore e una guarnizione anteriore, tutti alloggiati sotto la pinza, Figura 3A) siano installati nell'orientamento corretto (Figura 3B, pinza rimossa per la visualizzazione) per mantenere l'ago capillare in posizione e creare una connessione ermetica, evitando la formazione di bolle quando si avanza o si ritrae lo stantuffo metallico all'interno dell'ago.
- Assicurarsi che lo stantuffo metallico del nanoiniettore sia completamente retratto. Verificare premendo Fill e attendere un doppio segnale acustico che indichi che lo stantuffo è completamente retratto.
- Con la pinza attaccata ma leggermente allentata (svitata 45-90 gradi), far scorrere l'ago di vetro sullo stantuffo metallico e spingere l'ago capillare insieme allo stantuffo metallico attraverso la guarnizione anteriore fino a raggiungere il distanziatore (Figura 3C, D, pinza rimossa per la visualizzazione).
NOTA: una certa resistenza appare quando lo stantuffo passa attraverso la guarnizione e diminuisce quando raggiunge il distanziatore. Assicurarsi che l'ago capillare sia inserito saldamente nel distanziatore per creare una connessione ermetica (Figura 3D). - Fissare l'ago stringendo la pinza del nanoiniettore (riavvitare saldamente).
NOTA: Non stringere eccessivamente in quanto ciò potrebbe schiacciare l'ago. - Premere Svuota per spingere lo stantuffo nell'ago ed espellere l'olio dalla punta dell'ago. Se l'ago di vetro si muove, ritrarre lo stantuffo, rimuovere l'ago e ricaricare. Se questo provoca la formazione di bolle d'aria, rimuovere l'ago e riempirlo nuovamente con olio minerale.
NOTA: un ago correttamente fissato non deve muoversi con lo stantuffo. - Porre una goccia del virus (~ 6 μL) o un'altra soluzione per iniezione su un pezzo di parafilm1 (Figura 3E; Il colorante blu Evans viene utilizzato per scopi di visualizzazione).
NOTA: Il volume massimo del nanoiniettore è ~ 5 μL. - Premere Fill per creare una bolla d'aria che funga da divisore tra l'olio e la soluzione (Figura 3F).
NOTA: serve anche come indicatore di posizione quando si riempie o si svuota l'ago. - Abbassare l'ago, immergere la punta nella soluzione e premere Fill (Figura 3F,G).
- Guarda il livello del fluido mentre la soluzione viene caricata dopo la bolla d'aria. Spingere Svuota per espellere lo zoccolo e ricaricare premendo Fill se la bolla d'aria si allunga senza che il fluido entri nell'ago. Se questo non risolve il problema, cambiare l'ago.
- Quando l'ago è completamente carico (Figura 3H), sollevare l'ago nel piano z e aspirare un piccolo volume d'aria sulla punta per evitare l'evaporazione della soluzione sulla punta dell'ago e l'intasamento dell'ago.
- Ruotare il nanoiniettore con l'ago collegato lontano dall'operatore, verso la parte posteriore del banco, per evitare danni o lesioni accidentali.

Figura 3: Fissaggio dell'ago al nanoiniettore e caricamento della soluzione. (A) Posizione iniziale prima che l'ago sia montato sul nanoiniettore: stantuffo metallico completamente retratto e pinza fissata. (B) Sotto la pinza, tutti e tre i componenti per tenere e fissare l'ago sono mostrati nell'ordine corretto (da sinistra a destra): O-ring di tenuta (sottile e nero), distanziatore (bianco), O-ring (nero) con grande foro (che l'ago deve passare attraverso). Per garantire una connessione ermetica, l'ago di vetro viene fatto scorrere sullo stantuffo metallico (C) e spinto attraverso l'apertura dell'O-ring anteriore fino a raggiungere il distanziatore (D). (E-H) Caricamento della soluzione nell'ago. (E) Una goccia di soluzione viene posta su un pezzo di parafilm su un coperchio di piastra. (F) Creare una bolla d'aria premendo Fill prima di caricare la soluzione e immergere la punta dell'ago nella soluzione. (G) La soluzione si sta caricando nell'ago. (H) La soluzione viene caricata nell'ago. NOTA: la pinza è stata rimossa in (B-D) per la visualizzazione, ma deve rimanere attaccata durante gli esperimenti. Il passo finale per fissare l'ago è stringere la pinza. Il colorante blu Evans viene utilizzato per la visualizzazione in E-H. Fare clic qui per visualizzare una versione ingrandita di questa figura.
7. Iniezioni
NOTA: Tutti gli strumenti utilizzati in questa procedura vengono sterilizzati prima dell'intervento chirurgico e tra ciascun topo.
- Anestetizzare la prima femmina con cavità di dimensioni ideali (vedere paragrafo 4).
- Posizionare e fissare la femmina sul tavolo, come descritto nei passaggi 3.1-3.6.
- Applicare il gel per gli occhi agli occhi per prevenire l'essiccazione corneale e iniettare antidolorifici per via sottocutanea.
NOTA: Analgesici consigliati: Buprenorfina (0,05-0,1 mg/kg di peso corporeo) o Flunixin (2,5 mg/kg) o simili in conformità con le normative locali sul benessere degli animali. L'analgesia perioperatoria multimodale viene mantenuta con analgesici iniettati e isoflurano. - Preparare asetticamente l'addome inferiore strofinando con un panno imbevuto di 0,5 mg / ml di soluzione di clorexidina (o simile) e asciugare la pelle. Utilizzare le forbici chirurgiche per eseguire un'incisione cutanea verticale mediana di 1,5-2,0 cm nell'addome inferiore.
NOTA: Preparare l'area chirurgica seguendo le routine di disinfezione approvate localmente. - Sollevare delicatamente la pelle e liberare la pelle dallo strato muscolare sottostante, circa 1 cm attorno al punto di incisione, per facilitare la sutura dopo l'intervento chirurgico.
- Fai un'incisione verticale della linea mediana di 1 cm nello strato muscolare.
- Con un paio di pinze, sollevare un lato della pelle e dello strato muscolare e con l'altra coppia, cercare le corna uterine.
NOTA: Le decidue sono disposte come perline su una collana, mentre l'intestino è un lungo tubo continuo (Figura 4A). - Con una pinza, estrarre con cura entrambe le corna uterine dall'addome. Tenere il tessuto tra gli embrioni; non comprimerli direttamente (Figura 4B).
NOTA: L'utero è attaccato al corpo alla cervice e le due ovaie / ovidotti sono attaccati tramite legamenti. Non tirare / staccare l'utero da questi punti di ancoraggio. - Conta e prendi nota del numero di embrioni sui lati sinistro e destro.
- Numerare gli embrioni dall'ovaio alla cervice o dalla cervice all'ovaio.
NOTA: Questo è particolarmente importante se gli embrioni iniettati saranno raccolti nelle fasi embrionali. - Con un batuffolo di cotone umido, spingere delicatamente tutti gli embrioni nella cavità addominale, tranne i primi tre da iniettare.
- Posizionare una goccia di PBS sull'elastico nella piastra di Petri e tenerlo immediatamente sopra gli embrioni.
- Inserire una pinza chiusa nell'incisione dell'elastico e rilasciare la pinza per aprire l'incisione elastica in modo che il liquido cada sugli embrioni.
NOTA: Questo assicura la reidratazione degli embrioni e che la membrana elastica aderisce alla pelle bagnata della femmina, prevenendo la fuoriuscita di PBS nelle fasi successive. - Tirare una sezione dell'utero, corrispondente a tre embrioni, attraverso l'elastico con una pinza, e appollaiare delicatamente la capsula di Petri sull'addome della femmina.
- Con la pinza e un batuffolo di cotone umido, regolare il posizionamento dell'utero e l'elastico per garantire che l'elastico sia sigillato alla pelle della femmina per evitare perdite di PBS.
- Usa i quattro piedi di argilla per fissare e fissare la capsula di Petri immediatamente sopra l'addome, riducendo la pressione sulla femmina e la sensibilità dell'imaging alla respirazione e al battito cardiaco della femmina.
- Premere il cilindro di argilla modellante verso il basso a destra degli embrioni / utero per fissare l'utero (Figura 4C).
NOTA: Questa istruzione di orientamento presuppone che l'ago sia a sinistra della femmina e che gli embrioni del corno uterino sinistro della femmina siano esposti. Il lato dell'utero (corno uterino sinistro o destro) è cruciale in quanto l'AC è rivolto verso l'ago (corno sinistro; Figura 4D) o affronta il cilindro di argilla stabilizzante (corno destro; Figura 4E). - Per iniettare embrioni dal corno uterino destro, posizionare il cilindro di argilla sul lato sinistro degli embrioni (Figura 4F) e ruotare il tavolo riscaldante di 180° (Figura 4G) per ottenere l'orientamento corretto. Se invece l'ago può essere spostato, adattarlo come appropriato per la configurazione pertinente.
- Aggiungere PBS alla capsula di Petri fino a quando gli embrioni e l'utero sono coperti di PBS.
- Abbassare la sonda ecografica nel PBS e regolare il mouse / tavolo chirurgico in modo che il primo embrione sia allineato con la sonda ad ultrasuoni per facilitare la registrazione delle iniezioni.
NOTA: "Primo" si riferisce alla numerazione degli embrioni dall'ovaio alla cervice. - Scansiona tutti e tre gli embrioni e ispeziona gli AC. Determinare il volume di iniezione come segue:
- Misurare il diametro dell'AC con la macchina ad ultrasuoni. Iniettare 69 nL se il diametro CA è ≤0,2 mm; iniettare 2 x 69 nL (= 138 nL) se il diametro AC è >0,2 mm e ≤0,29 mm; e iniettare 3 x 69 nL (= 207 nL) se il diametro CA > 0,29 mm (Figura 4H).
NOTA: Esperimenti precedenti hanno dimostrato che fino a 207 nL di volumi di iniezione sono ben tollerati a E7.515. Le iniezioni di successo con un impatto minimo sulla sopravvivenza si ottengono quando l'aumento del volume relativo dell'AC non supera il 90%15. La variazione delle dimensioni dell'AC tra i compagni di cucciolata o i ceppi di topo è comune e può richiedere un'ulteriore ottimizzazione.
- Misurare il diametro dell'AC con la macchina ad ultrasuoni. Iniettare 69 nL se il diametro CA è ≤0,2 mm; iniettare 2 x 69 nL (= 138 nL) se il diametro AC è >0,2 mm e ≤0,29 mm; e iniettare 3 x 69 nL (= 207 nL) se il diametro CA > 0,29 mm (Figura 4H).
- Impostare i volumi di iniezione con il controller di iniezione.
- Impostare la velocità di iniezione in modo che rallenti con una velocità di iniezione di 23 nL/s.
NOTA: diversi modelli di apparecchiature possono comportare forze di iniezione diverse. - Abbassare l'ago nel PBS utilizzando le ruote principali sul sistema di binari (piani x e z, Figura 4I) e premere Empty sul controller del nanoiniettore fino a quando il liquido raggiunge la punta dell'ago.
NOTA: se l'ago si è intasato, premendo Svuota è possibile sciogliere lo zoccolo e/o espellere lo zoccolo. - Sollevare l'ago dal PBS e premere Inject. Verificare che sia stata scaricata una goccia del volume approssimativo desiderato.
- Abbassare l'ago nel PBS e allinearlo con la sonda ad ultrasuoni e l'embrione spostando il nanoiniettore con la ruota del piano y sul micromanipolatore (Figura 4J).
NOTA: La punta dell'ago è perfettamente allineata quando appare come un punto luminoso sull'immagine ecografica (Figura 4K,L). L'ago può essere spostato in tutti e tre i piani di direzione con il micromanipolatore. - Regolare l'angolo dell'ago con la ruota dell'angolo di iniezione per garantire un angolo di iniezione quasi perpendicolare rispetto alla parete uterina. Inserire l'ago nel condizionatore in un unico movimento utilizzando la ruota di iniezione sul micromanipolatore (Figura 4J-M). Tieni d'occhio la luminosità della punta dell'ago. Se la punta dell'ago scompare dall'immagine ecografica, spostare la sonda ecografica in avanti o indietro per riportare l'ago a fuoco.
NOTA: Una volta che l'ago è all'interno del condizionatore, è possibile apportare piccole modifiche alla posizione e alla messa a fuoco dell'ago senza danneggiare l'embrione (regolazioni entro ~ 0,3 mm). Non regolare la posizione dell'ago più di così. - Premere Inject (per 207 nL, impostare il volume su 69 nL e iniettare tre volte). Dopo l'iniezione, attendere altri 5-10 secondi prima di ritrarre l'ago con un movimento delicato.
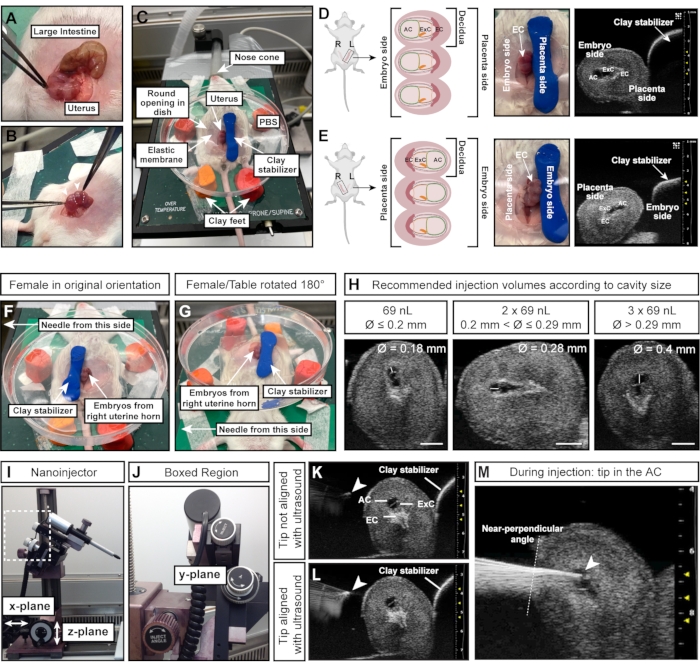
Figura 4: Dimensioni e orientamento ottimali della cavità amniotica per iniezioni riuscite. (A) Corno uterino con decidue multiple E7,5, a forma di stringa di sfere (in basso) rispetto all'intestino crasso (in alto). (B) Afferrare il tessuto uterino (linee tratteggiate bianche) tra le decidue. Evitare di spremere le decidue (punte di freccia bianche) direttamente con una pinza poiché le decidue e gli embrioni in via di sviluppo sono fragili in questa fase iniziale e inclini al riassorbimento in caso di eccessiva forza esterna. (C) Femmina in posizione supina con decidue esposte in una capsula di Petri riempita di PBS e montata su quattro piedi di argilla da modellare. Le decidue sono stabilizzate da un ulteriore pezzo di argilla da modellare, a forma di cilindro. (D, E) L'orientamento dell'AC è influenzato dal lato del corno uterino che è esposto. Se vengono utilizzate decidue dal corno uterino sinistro, l'AC sarà rivolto lontano dallo stabilizzatore di argilla e sarà facilmente accessibile all'ago a sinistra (D). Tuttavia, se viene utilizzato il corno uterino destro, il cono ectoplacentare sarà invece rivolto verso l'ago, rendendo più difficile l'accesso all'AC (E). Pertanto, quando si inietta nel corno uterino destro, lo stabilizzatore di argilla viene posizionato verso il lato rivolto verso l'ago (F) e l'intera tavola riscaldante viene ruotata di 180 ° (G). (H) Volumi di iniezione raccomandati in base alle dimensioni CA. In generale, le cavità con un diametro ≤ 0,2 mm possono essere iniettate con un massimo di 69 nL. Diametri > 0,2 mm e ≤ 0,29 mm tollerano volumi fino a 2 x 69 nL (138 nL) e cavità > 0,29 mm possono essere iniettate con 3 x 69 nL (207 nL). Barre di scala = 1 mm. (I, J) Il nanoiniettore è collegato al sistema di binari e può essere spostato nei piani x e / o z. L'angolo dell'ago può essere regolato con la ruota angolare di iniezione . (K, L) La punta dell'ago (punta di freccia bianca) è allineata con l'AC quando appare più luminosa nell'ecografia (L). (M) Immagine ecografica che mostra il processo di iniezione, in cui la punta dell'ago è nel condizionatore e ben allineata (punta di freccia bianca). Abbreviazioni: A = Amnion; AC = cavità amniotica; ExC = cavità esocelomica; EC = Cono ectoplacentare. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Spostare lo stadio all'embrione successivo e ripetere i passaggi 7.22-7.26 per gli altri due embrioni se hanno dimensioni AC adeguate.
- Sollevare la sonda ad ultrasuoni e l'ago dal PBS utilizzando il micromanipolatore. Allontanare l'ago dall'operatore per evitare danni e lesioni.
- Con una pinza, dirigere il 1 ° e il 2° embrione nell'addome della femmina spingendoli delicatamente attraverso l'elastico. Afferrare delicatamente il tessuto adiacente al 3° embrione e tirare l'utero verso l'estremità superiore dell'incisione elastica. Tirare delicatamente il 4 °-6 ° embrione con una pinza e lasciare che il 3° embrione rientri nell'addome.
NOTA: questo passaggio può essere eseguito senza modificare il PBS o rimuovere la capsula di Petri. - Ripetere se necessario fino a quando tutti gli embrioni con AC ottimali sono stati iniettati o il limite di tempo è stato raggiunto.
- Spingere delicatamente gli embrioni / utero nell'addome della femmina.
- Aspirare il PBS e rimuovere la capsula di Petri. Se è stato utilizzato un virus, maneggiare come rifiuti infettivi.
- Cucire insieme lo strato muscolare con Vicryl (USP 6-0, lunghezza ago 13 mm, 3/8 Circle) in semplici suture continue o interrotte e chiudere la pelle con 1-2 clip (vedi la tabella dei materiali).
- Spegnere la pompa dell'isoflurano.
- Rimuovere il nastro chirurgico e posizionare la femmina in posizione prona (pancia in giù) in una gabbia pulita su una piastra riscaldante a 40 °C.
NOTA: Ci si aspetta che la femmina riprenda conoscenza e sia mobile entro 10 minuti. Assicurarsi che la procedura sia completata entro 30 minuti. Il background genetico, l'età e il peso della femmina possono influenzare la sensibilità all'anestesia. Monitorare i topi durante l'intervento chirurgico per segni di respirazione lenta (respirazione lenta significa che l'anestesia è troppo profonda) o movimento (l'anestesia è troppo leggera). Buprenorfina (0,05-0,1 mg/kg di peso corporeo) o Flunixin (2,5 mg/kg) o simili in conformità con le normative locali sul benessere degli animali, possono essere somministrati 8 ore dopo la prima iniezione, se necessario. - Se un'altra femmina deve essere iniettata, preparare l'area chirurgica mentre si monitora il risveglio della prima.
- Pulire gli strumenti chirurgici con etanolo al 70% per rimuovere qualsiasi residuo di sangue o tessuto e sterilizzarli nello sterilizzatore di perline di vetro preriscaldato per 10 secondi. Eliminare i tamponi di cotone e la carta velina usata. Asciugare la piastra di Petri e i pezzi di argilla con carta velina.
- Ripetere i passaggi 7.1-7.35 fino a quando tutte le femmine sono state iniettate.
- Svuotare ed eliminare l'ago.
- Se nell'ago è rimasto un virus o una soluzione iniettabile, premere Svuota sul nanoiniettore e svuotare il contenuto dell'ago su carta velina.
- Ritrarre completamente lo stantuffo metallico premendo Fill fino a quando non viene emesso un doppio segnale acustico dal controller, che indica che lo stantuffo è completamente ritratto.
- Allentare la pinza e far scorrere l'ago dallo stantuffo metallico. Gettare l'ago nel contenitore dei rifiuti taglienti.
- Pulire il banco BSL-2.
- Se è stato utilizzato un virus, spruzzare l'intero campo chirurgico con disinfettante (vedere la tabella dei materiali). Dopo 15 minuti, rimuovere il disinfettante e pulire l'intero campo chirurgico con etanolo al 70%. Se non è stato utilizzato alcun virus, pulire tutte le superfici con etanolo al 70%.
- Rimuovere qualsiasi PBS residuo dalla sonda ad ultrasuoni con carta velina asciutta, morbida e priva di lanugine.
- Eliminare i rifiuti secondo le linee guida sulla biosicurezza.
- Spegnere la macchina ad ultrasuoni, il tavolo riscaldante, il banco BSL2 e l'alimentazione O2 .
Risultati
Gli embrioni iniettati a E7.5 con hPGK-H2B-GFP lentivirus11,12 sono stati raccolti a E13.5 ed esaminati al microscopio a dissezione fluorescente (Figura 5A). La trasduzione riuscita della piastra neurale si traduce in embrioni con forte espressione di un reporter fluorescente nel cervello principalmente e in altri tessuti derivati dall'ectoderma, ad esempio la pelle (Figura 5A,B). L'iniezione di un volume eccessivamente elevato (superiore ai volumi qui raccomandati, ad esempio ≥500 nL) aumenta la pressione nel condizionatore e può provocare un riassorbimento completo (dati non mostrati) o difetti del tubo neurale come l'encefalia (Figura 5A). Le iniezioni riuscite a E7.5 determinano una trasduzione uniforme dal proencefalo al cervello posteriore (Figura 5C-J).
I titoli lentivirali intorno a 2 × 10 10 unità infettive (IFU) raggiungono oltre il 95% di targeting, mentre titoli di ~ 1 ×10 9 IFU raggiungono il 15% di efficienza di targeting15. Inoltre, sono prese di mira anche strutture che in precedenza erano difficili da colpire usando l'elettroporazione, come il plesso coroideo17,18 (Figura 5 E,F). L'efficacia della trasduzione può essere modificata regolando il titolo virale erogato nell'AC. Le iniezioni di basso titolo provocano la trasduzione di cloni a singola cellula (Figura 5C, Figura 5E e Figura 5G, H) mentre l'uso del virus ad alto titolo trasduce quasi il 100% dell'intero cervello (Figura 5D, Figura 5F, Figura 5H e Figura 5J ). Pertanto, NEPTUNE può essere utilizzato per la trasduzione clonale, il tracciamento del lignaggio e gli approcci di screening genetico o per studiare gli effetti globali della sovraespressione genica o della downregulation nell'intero cervello.
Lo sviluppo dell'occhio dei mammiferi è il risultato di una comunicazione ben organizzata tra tre derivati dell'ectoderma embrionale: la retina neurale (NR) e l'epitelio pigmentato retinico (RPE) derivano dal neuroepitelio del proencefalo ventrale, mentre l'ectoderma superficiale dà origine al futuro cristallino e all'epitelio corneale. Tuttavia, lo stroma centrale e l'endotelio posteriore, gli altri due strati della cornea, derivano dalle cellule della cresta neurale del mesenchima perioculare19,20. Le sezioni coronali attraverso embrioni E13.5, iniettati a E7.5 con lentivirus ad alto titolo, hanno mostrato, simile al cervello, un'elevata e uniforme trasduzione del tessuto neurale dell'occhio, così come del cristallino, della cornea e del mesenchima (Figura 5K). Con il progredire della neurulazione, le iniezioni a E8.5 ed E9.5 determinano il continuo targeting del cristallino e dell'epitelio corneale (Figura 5L e Figura 5N), mentre la trasduzione dei tessuti dell'occhio derivati dal neuroectoderma è meno efficiente a E8.5 (Figura 5L,M) o non mirata a E9.5 (Figura 5N).
Mentre la maggior parte delle particelle virali infetta i tessuti esposti dopo l'iniezione, alcune particelle trasducono tessuti derivati non ectodermici che si sviluppano successivamente (Figura 6A). Le ghiandole e i dotti salivari si sviluppano intorno a E11.5 dall'epitelio orale21 e sono mirati a NEPTUNE (Figura 6B). Dopo iniezioni a E9.5, l'epitelio linguale della lingua è ben trasdotto; tuttavia, il mesenchima sottostante è negativo (Figura 6C; le parentesi indicano cellule trasdotte; gli asterischi indicano il segnale di autofluorescenza non le cellule trasdotte). Inoltre, ci sono gruppi positivi all'interno dell'epitelio linguale, separati da sezioni negative (Figura 6C, punte di freccia bianche), suggerendo la trasduzione della superficie della papilla. Le cellule della cresta neurale sono state descritte nel mesenchima della lingua sottostante e all'interno dell'epitelio linguale, dove sono coinvolte nello sviluppo delle papille gustative e delle papille gustative22. Infatti, le iniezioni a E7.5 provocano una trasduzione diffusa del mesenchima della lingua a E13.5 (Figura 6D), suggerendo che le iniezioni precoci colpiscono le cellule della cresta neurale, contribuendo al mesenchima nella lingua.
Nei vertebrati, i gangli delle radici dorsali (DRG) sono un componente centrale del sistema nervoso periferico (PNS), poiché tutti gli input somatosensoriali dalla periferia del corpo (temperatura, dolore, pressione) vengono trasmessi al cervello tramite l'attivazione dei neuroni DRG23. Sia i neuroni che le cellule gliali del DRG derivano dalle cellule della cresta neurale del tronco24. L'iniezione lentivirale, in cui l'onnipresente promotore hPGK controlla l'espressione del reporter fluorescente, porta a un targeting diffuso del sistema nervoso centrale e periferico (Figura 7A), trasducendo sia i neuroni che i progenitori nel midollo spinale (Figura 7B), così come il DRG (Figura 7C). L'uso di un MiniPromoter per la doppia cortina25 consente di limitare l'espressione di GFP ai soli neuroni (15 e Figura 7D,E).
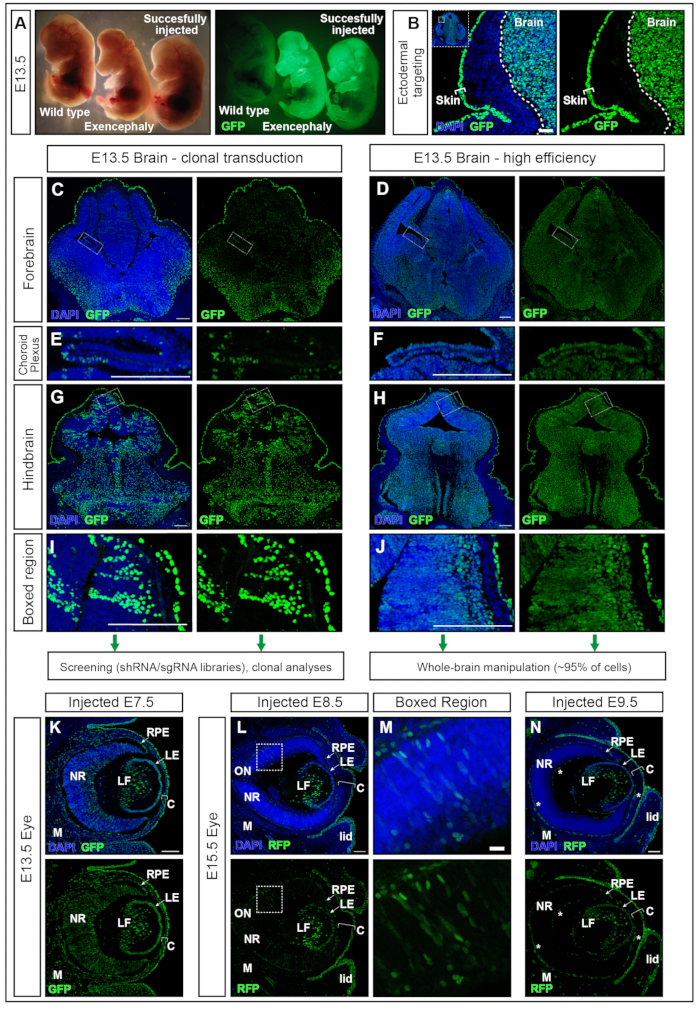
Figura 5: Alta efficienza o trasduzione clonale con NETTUNO. (A) embrioni E13.5 al microscopio da dissezione illuminato con illuminazione standard (pannello di sinistra) e stessi embrioni illuminati per GFP (pannello di destra). Embrione non iniettato all'estrema sinistra, embrione iniettato con successo all'estrema destra, che produce un segnale positivo nel cervello (embrione più a destra). Embrione encefalico dovuto all'eccesso di volume iniettato (embrione medio). (B) Targeting della pelle e del cervello con iniezione di E7.5. Barra di scala = 50 μm. (C, D) E13.5 immagini confocali del proencefalo con bassa trasduzione clonale (C) o trasduzione ad alta efficienza (D). (C, E, G, I) Trasduzione clonale di diverse regioni del cervello. (D, F, H, J) Trasduzione ad alta efficienza di diverse regioni del cervello. Barre della scala = 200 μm. Diverse efficaci di trasduzione sono rappresentative di altre aree del SNC. (E, F) Targeting del plesso coroideo, clonale (E) o ad alta efficienza (F). Barre di scala = 200 μm. (G, H) Targeting clonale (G) e targeting ad alta efficienza (H) del cervello posteriore, ingrandito in (I, J). Barre di scala = 200 μm. (K) Espressione del reporter GFP nell'occhio a E13.5 dopo iniezione in utero a E7.5 (L, M) Espressione del reporter GFP nell'occhio a E15.5 dopo iniezione in utero a E8.5 (L), regione in scatola ingrandita in (M) o a E9.5 (N). I vasi sanguigni autofluorescenti sono contrassegnati da stelle bianche. Barre della scala = 100 μm. Abbreviazioni: NEPTUNE = neural plate targeting with in uteronano-injection; C = Cornea; LE = epitelio del cristallino; LF = fibre di lenti; M = Mesenchima; NR = Retina neurale; ON = nervo ottico; RPE = epitelio pigmentato retinico; GFP = proteina fluorescente verde; SNC = sistema nervoso centrale. Fare clic qui per visualizzare una versione ingrandita di questa figura.
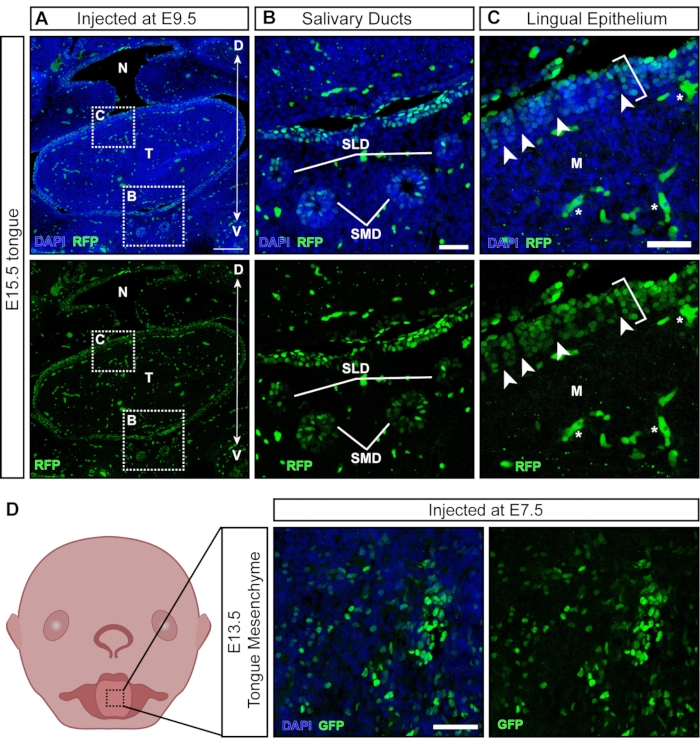
Figura 6: Trasduzione in utero di tessuti non neurali. (A) Immagine confocale della cavità orale E15.5. All'embrione è stato iniettato il lentivirus reporter fluorescente a E9.5. Barra di scala = 200 μm. (B, C) (B) Ingrandimento del pannello inserito; epitelio del dotto salivare trasdotto con virus. (C) Ingrandimento del pannello inserito; epitelio linguale dorsale trasdotto con GFP reporter virus (parentesi bianca). Il mesenchima sottostante derivato dalle cellule della cresta neurale è negativo. Le punte di freccia bianche indicano papille con cellule della cresta neurale negative circondate da cellule epiteliali trasdotte da virus (le cellule / vasi sanguigni autofluorescenti sono contrassegnati con stelle bianche). Barre della scala = 50 μm. (D) Immagine schematica e confocale del mesenchima della lingua E13.5 dopo iniezioni con virus reporter fluorescente a E7.5. Barra di scala = 50 μm. Abbreviazioni: D = dorsale; M = Mesenchima; N = rinofaringe; SLD = dotto sublinguale; SMD = dotto sottomandibolare; T = lingua; V = ventrale; GFP = proteina fluorescente verde. Fare clic qui per visualizzare una versione ingrandita di questa figura.
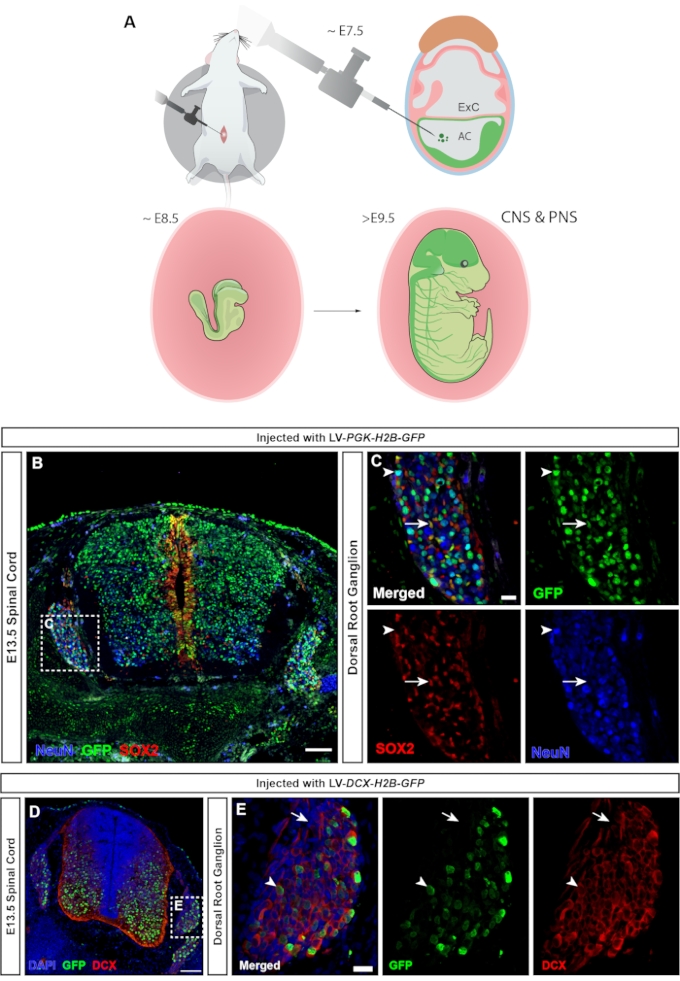
Figura 7: Trasduzione delle cellule gangliari della radice dorsale derivate dalla cresta neurale. (A) Il targeting di NETTUNO a E7.5 consente di colpire sia il SNC che il PNS. (B) L'immagine confocale del midollo spinale E13.5 e dei DRG iniettati con lentivirus reporter hPGK-H2B-GFP a E7.5 mostra la trasduzione sia dei progenitori neurali SOX2+ che dei neuroni NeuN+. Barra di scala = 100 μm. (C) Regione in scatola di B che mostra il DRG con espressione GFP nelle popolazioni cellulari SOX2+ (frecce bianche) e NeuN+ (punte di freccia bianche). Barra della scala = 20 μm. (D) Immagine confocale del midollo spinale E13.5 e DRG iniettato con lentivirus DCX-H2B-GFP a E7.5, mirato solo alle cellule DCX+. Barra di scala = 100 μm. (E) Regione in scatola di D che mostra DRG con espressione GFP limitata ai neuroni DCX+ (punte di freccia bianche). Le celle DCX sono negative per GFP (frecce bianche). Barra della scala = 20 μm. Abbreviazioni: NEPTUNE = neural plate targeting with in utero nano-injection; SNC = sistema nervoso centrale; PNS = sistema nervoso periferico; DRG = gangli della radice dorsale; GFP = proteina fluorescente verde. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Ci sono diversi passaggi in questo protocollo che influenzano la sopravvivenza embrionale, la qualità delle iniezioni e la lettura. L'età gestazionale degli embrioni è definita come E0,5 a mezzogiorno del giorno del tappo vaginale dopo l'accoppiamento notturno. L'esecuzione del controllo ecografico per la gravidanza a E6.5 nel tardo pomeriggio / sera assicura che gli embrioni siano abbastanza sviluppati da essere identificati mediante ultrasuoni. Il controllo (1) consente lo screening preliminare di quanti topi plug-positivi sono effettivamente gravidi, (2) assicura che nessun virus venga scongelato inutilmente e sprecato nel caso in cui i topi plug-positivi non siano incinta e (3) riduce gli interventi non necessari sui topi (evita interventi chirurgici su femmine non gravide).
A E7.5, gli embrioni sono sensibili alle forze esterne e devono essere maneggiati con cura. Ad esempio, tirare le corna uterine o spremere le decidue può portare al riassorbimento dell'embrione. Il tessuto uterino deve essere sempre mantenuto umido quando si trova all'esterno dell'addome femminile per evitare che il tessuto si secchi. La maggior parte delle decidue dovrebbe rimanere all'interno dell'addome femminile, con solo 3-4 esposti per iniezioni. La nitidezza dell'ago è un altro fattore determinante per iniezioni di successo. Le punte degli aghi smussate o rotte provocano ripetuti colpi di decidue o compressione contro l'argilla modellante prima di entrare nell'AC, il che può aumentare il tasso di riassorbimento. Pertanto, gli aghi ben macinati e affilati devono essere sempre conservati in modo sicuro e sostituiti dopo un massimo di 2 femmine.
Questo protocollo descrive come indirizzare la piastra neurale con una singola iniezione di lentivirus. Inoltre, mostra come l'efficacia della trasduzione possa essere adattata da cloni monocellulari all'intero cervello. Tuttavia, anche altri tessuti non neurali, tra cui la pelle e l'epitelio orale, sono presi di mira. Inoltre, tutti i tipi di cellule (progenitori e cellule differenziate) vengono trasdotti, rendendo questo approccio efficiente ma non specifico. L'uso di MiniPromoters nel costrutto virale porta all'espressione specifica del transgene nei neuroni o negli astrociti15. Ciò ha il vantaggio di evitare l'uso di animali Cre transgenici dedicati e quindi riduce la quantità di lavoro (mantenimento dello sforzo e genotipizzazione) e i costi.
I limiti di NEPTUNE includono la sua difficoltà tecnica, le sfide nell'ottenere donne incinte a un ritmo prevedibile e coerente e i costi di acquisizione di strumentazione specializzata. Inoltre, il targeting non selettivo delle cellule da parte del lentivirus può essere visto sia come un vantaggio che come una limitazione della tecnica. L'iniezione di volumi maggiori nell'AC provoca l'enencefalia13, sebbene le malformazioni cerebrali e l'enencefalia siano evitate con i volumi descritti qui15. Un impatto negativo sullo sviluppo del cervello è quindi un rischio con nano-iniezioni in utero che devono essere accuratamente evitate iniettando volumi corretti adattati allo stadio embrionale e alle dimensioni dell'AC.
I futuri adattamenti della tecnica potrebbero concentrarsi sul tropismo virale. I virus adeno-associati (AAV) hanno sierotipi diversi, che hanno dimostrato di colpire in modo robusto diversi tipi di cellule nel SNC17,26. Tuttavia, gli AAV non si integrano nel genoma della cellula ospite e quindi possono essere persi in cellule con un alto tasso di divisione. Sebbene ci siano diversi modi per aumentare la specificità di NETTUNO, gli animali transgenici sono ancora il gold standard quando si tratta di manipolazione genica in vivo. I topi Cas9 e il lentivirus codificante l'sgRNA sono stati utilizzati per lo screening genetico nell'epidermide embrionale27 e possono anche essere adattati al SNC in via di sviluppo.
Le iniezioni nell'AC a E7.5 colpiscono in modo efficiente le cellule del neuroectoderma prima dell'inizio della neurulazione e colpiscono il cervello in via di sviluppo in modo più efficiente rispetto all'elettroporazione in utero . Ciò consente lo studio di segnali genetici importanti per lo sviluppo del cervello da un punto temporale precedente. A differenza dei classici modelli genetici murini, NEPTUNE offre un approccio flessibile per eseguire l'analisi genica funzionale. I fenotipi che seguono la sovraespressione o la delezione genica possono essere studiati in pochi giorni o settimane rispetto a mesi o anni. Le iniezioni di più costrutti virali consentono la manipolazione di diversi geni all'interno di un embrione ed evitano la generazione di animali knockout doppi o tripli. Pertanto, NEPTUNE non solo consente di risparmiare tempo, ma può anche ridurre il numero di animali utilizzati nella ricerca.
Divulgazioni
Gli autori non dichiarano interessi concorrenti.
Riconoscimenti
Ringraziamo Bettina Semsch e Jia Sun (Infinigene) per la cura esperta dei topi; Florian Salomons e Göran Månsson di Biomedicum Imaging Core (BIC) per l'assistenza nell'acquisizione e nella consultazione delle immagini. Finanziamento: Ringraziamo i seguenti finanziatori per il loro sostegno a questo progetto: The Swedish Research Council, Karolinska Institutet (KI Foundations, Career Development Grant, Ph.D. student KID funding e SFO StratNeuro funding, Center of Innovative Medicine), The Ollie and Elof Ericssons Foundation, the Tornspiran Foundation, the Jeansssons Foundation, Sven and Ebba-Christina Hagbergs Prize and research Grant, Knut e Alice Wallenberg Project Grant, Fredrik and Ingrid Thurings Foundation, Lars Hiertas Minne, The Childhood Cancer Foundation (Barncancerfonden), The Åhlen Foundation, Åke Wibergs Foundation, Tore Nilssons Foundation e le fondazioni svedesi Starting Grant to ERA. Figura 4D,E sono stati creati con BioRender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | BD Bioscience | 309628 | |
| 27 G Needle | BD Bioscience | 300635 | |
| 3.5 inches capillaries | Drummond Scientific | 3000203G/X | Were used to pull in house needles |
| 70 MHz MS Series transducer | Visual Sonics | MS700 | |
| Aquasonic clear ultrasound gel | Parker Laboratories | Mar-50 | |
| Autoclip Applier 9 mm | Angthos | 12020-09 | |
| CD1 mice | Charles River, Germany | Crl:CD1(ICR) | Females: from age of 8 weeks old Males: from the age of 12 weeks old |
| Cotton Swab | OneMed Sverige AB | 120788 | |
| DPBS | Gibco | 14190094 | |
| Dressing forceps delicate straight 13 cm | Agnthos | 08-032-130 | |
| EG-400 Narishige Micropipette Grinder | Narishige | NA | |
| EZ clips 9 mm | Angthos | 59027 | clips |
| Iris Scissors, Super Cut, straight, 9 cm | Agnthos | 307-336-090 | |
| Isofluorane | Baxter Medical AB | EAN: 50085412586613 | Purchased from Swedish Pharmacy |
| Kimwipes | Kimberly Clarke | 7557 | |
| Membrane Tape | Visual Sonics | SA-11053 | |
| Micropipette Puller | Sutter Instrument | P-97 | |
| Modeling Clay | Sense AB | 10209 | |
| Mouse Handling Table | Visual Sonics | 50249 | |
| Nanoject II Auto Injector Kit | Drummond | 3-000-205A | |
| Parafilm | Bemis | HS234526C | |
| Petri dish with central opening (low wall) | Visual Sonics | SA-11620 | |
| Petri dish, (ØxH): 92 x 16 mm | Sarstedt | 82.1472.001 | |
| Rely+On Virkon | DuPont | 130000132037 | disinfectant |
| Silicone membrane | Visual Sonics | SA-11054 | |
| Steri 250, hot bead sterilizer | Angthos | 31100 | |
| Surgical Tape (1.25 cm x 9.14 m) | Medicarrier | 67034 | |
| Vevo Compact Dual (Med. Air & O2) Anesthesia System | Visual Sonics | VS-12055 | |
| Vevo Imaging Station 2 | Visual Sonics | VS-11983 | |
| Vevo2100 | Visual Sonics | VS-20047 | |
| Vicryl 6-0; C-3 needle, 45 cm purple filament | Agnthos | J384H |
Riferimenti
- Theiler, K. . The House mouse. Atlas of embryonic development. , (1989).
- Barresi, M. J. F., Gilbert, S. F. . Developmental biology. , (2016).
- Taylor, J. C., et al. Factors influencing success of clinical genome sequencing across a broad spectrum of disorders. Nature Genetics. 47 (7), 717-726 (2015).
- Pizzo, L., et al. Rare variants in the genetic background modulate cognitive and developmental phenotypes in individuals carrying disease-associated variants. Genetics in Medicine. 21 (4), 816-825 (2019).
- Sakai, Y. Neurulation in the mouse: Manner and timing of neural tube closure. The Anatomical Record. 223 (2), 194-203 (1989).
- Schoenwolf, G. C. Shaping and bending of the avian neuroepithelium: Morphometric analyses. Developmental Biology. 109 (1), 127-139 (1985).
- Smith, J. L., Schoenwolf, G. C., Quan, J. Quantitative analyses of neuroepithelial cell shapes during bending of the mouse neural plate. Journal of Comparative Neurology. 342 (1), 144-151 (1994).
- Katahira, T., Nakamura, H. Gene silencing in chick embryos with a vector-based small interfering RNA system. Development Growth and Differentiation. 45 (4), 361-367 (2003).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. I. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochemical and Biophysical Research Communications. 230 (2), 376-380 (1997).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Beronja, S., Livshits, G., Williams, S., Fuchs, E. Rapid functional dissection of genetic networks via tissue-specific transduction and RNAi in mouse embryos. Nature Medicine. 16 (7), 821-827 (2010).
- Pierfelice, T. J., Gaiano, N. Ultrasound-guided microinjection into the mouse forebrain in utero at E9.5. Journal of Visualized Experiments JoVE. (45), e2047 (2010).
- Gaiano, N., Kohtz, J. D., Turnbull, D. H., Fishell, G. A method for rapid gain-of-function studies in the mouse embryonic nervous system. Nature Neuroscience. 2 (9), 812-819 (1999).
- Slevin, J. C., et al. High resolution ultrasound-guided microinjection for interventional studies of early embryonic and placental development in vivo in mice. BMC Developmental Biology. 6, 10 (2006).
- Mangold, K., et al. Highly efficient manipulation of nervous system gene expression with NEPTUNE. Cell Reports Methods. 1, 100043 (2021).
- Kameneva, P., et al. Single-cell transcriptomics of human embryos identifies multiple sympathoblast lineages with potential implications for neuroblastoma origin. Nature Genetics. 53 (5), 694-706 (2021).
- Kaiser, K., et al. MEIS-WNT5A axis regulates development of fourth ventricle choroid plexus. Development. 148 (10), (2021).
- Haddad, M. R., Donsante, A., Zerfas, P., Kaler, S. G. Fetal brain-directed AAV gene therapy results in rapid, robust, and persistent transduction of mouse choroid plexus epithelia. Molecular Therapy. Nucleic Acids. 2 (6), 101 (2013).
- Heavner, W., Pevny, L. Eye development and retinogenesis. Cold Spring Harbor Perspectives in Biology. 4 (12), 008391 (2012).
- Swamynathan, S. K. Ocular surface development and gene expression. Journal of Ophthalmology. 2013, 103947 (2013).
- Amano, O., Mizobe, K., Bando, Y., Sakiyama, K. Anatomy and histology of rodent and human major salivary glands: -overview of the Japan Salivary Gland Society-sponsored workshop. Acta Histochemica et Cytochemica. 45 (5), 241-250 (2012).
- Liu, H. X., Komatsu, Y., Mishina, Y., Mistretta, C. M. Neural crest contribution to lingual mesenchyme, epithelium and developing taste papillae and taste buds. Developmental Biology. 368 (2), 294-303 (2012).
- Marmigère, F., Ernfors, P. Specification and connectivity of neuronal subtypes in the sensory lineage. Nature Reviews. Neuroscience. 8 (2), 114-127 (2007).
- Zirlinger, M., Lo, L., McMahon, J., McMahon, A. P., Anderson, D. J. Transient expression of the bHLH factor neurogenin-2 marks a subpopulation of neural crest cells biased for a sensory but not a neuronal fate. Proceedings of the National Academy of Sciences of the United States of America. 99 (12), 8084-8089 (2002).
- Portales-Casamar, E., et al. A regulatory toolbox of MiniPromoters to drive selective expression in the brain. Proceedings of the National Academy of Sciences of the United States of America. 107 (38), 16589-16594 (2010).
- Tervo, D. G. R., et al. A designer AAV variant permits efficient retrograde access to projection neurons. Neuron. 92 (2), 372-382 (2016).
- Loganathan, S. K., et al. Rare driver mutations in head and neck squamous cell carcinomas converge on NOTCH signaling. Science. 367 (6483), 1264-1269 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon