Method Article
배아 일 7.5에서 자궁 내 나노 주사 (NEPTUNE)에 의한 뮤린 신경 판 표적화
요약
이 프로토콜에서는 E7.5의 마우스 양수에 렌티 바이러스를 주입하여 생존 또는 배아 발달에 미치는 해로운 영향을 최소화하면서 전체 신경판을 균일하게 형질 도입하는 방법을 설명합니다.
초록
자궁에서 발달중인 마우스 뇌 에서 유전자 발현을 조작하는 것은 기능적 유전학 연구에 큰 잠재력을 가지고 있습니다. 그러나 이전에는 신경화 후 배아 단계의 조작으로 크게 제한되었습니다. 배아 일 (E) 7.5에 양수를 주입하고 cDNA 또는 shRNA를 암호화하는 렌티 바이러스를 전달하여 신경판과 신경 볏 세포의 >95 %를 표적으로 삼아 미래의 뇌, 척수 및 말초 신경계에 기여하는 프로토콜이 개발되었습니다. 이 프로토콜은 유리 모세관 바늘의 연삭, 임신 확인, 초음파 영상을 사용한 발달 병기 결정 및 배아 단계에 맞는 최적의 주입량을 포함하여 성공적인 형질 도입을 달성하는 데 필요한 단계를 설명합니다.
이 프로토콜에 따라 고역가 렌티바이러스로 발달 중인 뇌의 >95%를 형질도입하여 전체 뇌 유전자 조작을 수행할 수 있습니다. 대조적으로, 더 낮은 바이러스 역가를 사용하여 모자이크 형질도입을 달성할 수 있어 유전자 스크리닝 또는 계통 추적이 가능합니다. E7.5에서의 주사는 또한 눈, 혀 및 말초 신경계의 뚜렷한 구획에 기여하는 외배엽과 신경 볏을 표적으로 합니다. 따라서 이 기술은 신경전 단계에서 마우스 신경판 및 외배엽 유래 조직에서 유전자 발현을 조작할 수 있는 가능성을 제공하여 실험에 사용되는 마우스의 수를 줄이는 이점이 있습니다.
서문
뇌와 척수는 배아 발생 1,2 동안 형성을 시작하는 최초의 기관 중 하나입니다. 신경 발달 장애와 관련된 유전자가 확인되고 있지만 유전 적 변이의 기능적 심문은 3,4에 뒤쳐져 있습니다. 조건부 녹아웃 마우스의 생성에는 몇 달 또는 몇 년이 걸릴 수 있으므로 발달중인 뇌에서 유전자 기능을 신속하게 조사하는 대체 기술이 중요합니다. 마우스 배아에서 신경판이 신경관으로 변형되어 중추 신경계 (CNS)를 생성하는 형태 형성 과정 인 신경 형성은 임신 후 8 일에서 10 일 사이에 발생합니다5. 신경화가 시작되기 전에 외배엽의 일부인 신경판은 CNS 6,7 내에서 수많은 신경 세포 및 신경교 세포 유형으로 증식하고 분화하는 단일 층의 원주 형 세포로 구성됩니다. 따라서 CNS에서 유전자 발현에 대한 오래 지속되는 변화를 실험적으로 유도하기 위해 신경판을 표적으로 하는 것은 모든 전구 세포의 접근성을 포함하여 명백한 이점을 제공합니다.
신경 과학에서, ovo 전기 천공 8,9 및 마우스 배아의 바이러스 형질 도입은 배아 CNS 유전자 발현을 조작하는 데 사용되었습니다. 발달중인 병아리 배아는 난자에서 병아리 배아의 접근성과 결과적으로 유전자 발현 조작의 용이성으로 인해 척수 발달 중 유전자 기능을 연구하기 위해 선택되는 모델이었습니다. 특히, ovo 플라스미드에서 전기천공은 각 병아리 척수에서 실험 및 제어 조건을 생성합니다. 전기 천공은 세포막 투과를 일으키고 두 개의 전극을 통해 배아에 전기 펄스를 적용하여 음전하를 띤 DNA를 (음성) 음극에서 (양성) 양극으로 향하게합니다. 마우스에서 자궁 내 전기 천공은 일반적으로 신경 화가 완료된 배아 단계로 제한되었으며 뇌 또는 척수는 이미 여러 세포층으로 구성되어있어 전기 천공 효율이 낮습니다10. 플라스미드 전기천공은 일시적인 유전자 발현을 초래하며 일반적으로 소수의 세포를 표적으로 합니다.
초음파 유도 자궁 미세 주사는 피부 및 뇌11,12,13,14와 같은 다양한 배아 구조를 조작하는 데 사용되었습니다. 그러나, 발달 중인 쥐 CNS를 표적으로 하는 주사는 낮은 효능을 나타내거나 배아 생존에 부정적인 영향을 미쳤다12,13,14. 따라서, E7.5에서 양수 (AC)로 고 역가 렌티 바이러스를 전달하기위한 개선 된 프로토콜이 개발되었으며, 이는 자궁 내ano-injection15와 함께 neural plate targeting에 대한 NEPTUNE이라고 불렸다. 주사는 E13.5에서 전체 뇌의 >95 %의 오래 지속되는 표적 효능을 가져 왔습니다. 또한, 임신 초음파 검증 시 병기 결정 단계를 도입하여 암컷과 임신을 발달 단계별로 분류하여 연구 동물에 대한 불필요한 시술을 최소화하고 주사 성공률을 극대화했습니다. 주입 효율과 생존은 AC 크기의 증가와 밀접한 관련이 있습니다. 따라서, 본 논문은 배아의 재흡수를 유발하지 않는 AC에 적절한 부피를 전달하기 위해 주사 전에 AC 크기를 측정하는 방법을 설명한다. NEPTUNE은 현재 자궁 내 접근 방식에 대한 강력한 대안이며 기능 연구의 획득 및 손실, 계통 추적 또는 스크리닝15,16을 포함하되 이에 국한되지 않는 여러 용도에 맞게 조정할 수 있습니다.
프로토콜
CD1 야생형 마우스는 유럽 규정에 따라 사육되었으며, 표준 낮과 밤 주기는 음식과 물을 자유롭게 사용했습니다. CD1 암컷은 밤새 CD1 수컷과 교미되었고, 질 플러그는 아침에 확인되었다 (E0.3). 임산부 만 주사에 사용되었습니다. 여기에 설명 된 모든 실험에 대한 윤리적 승인은 스웨덴 농업위원회 (Jordbruksverket)에 의해 부여되었습니다.
1. 유리 바늘의 준비 : 바늘 당기기 및 연삭
알림: 미리 접지된 바늘을 구입할 수 있지만 사내에서 바늘을 당기면 바늘 길이, 구멍 및 베벨 각도를 쉽게 조정할 수 있습니다.
- 유리 모세관을 마이크로피펫/모세관 풀러에 장착합니다. 지정된 장비를 사용하여 다음 설정을 사용하십시오 ( 재료 표 참조) : 열 580 단위; 속도 140 단위; 시간 200 단위; 압력 500-800 단위.
알림: 다른 매개변수의 단위는 모세관 풀러에 의해 정의됩니다. 단위는 장비에 따라 다를 수 있습니다. - Pull을 눌러 모세관을 분리하여 끝이 가늘어진 두 개의 유리 모세관 을 생성합니다.
알림: 당긴 후 두 유리 모세관의 팁은 마이크로피펫 풀러의 고온으로 인해 융합되어 닫힙니다. - 수술용 가위로 팁을 잘라 ~7mm의 바늘 길이(바늘이 가늘어지기 시작하는 위치에서 측정)를 얻습니다(그림 1A).
알림: E7.5 주사의 경우 주입 부위가 매우 작고 섬세하기 때문에 길고 가는 바늘이 중요합니다. 짧고 넓은 구멍의 바늘은 배아 사망을 초래할 것입니다. - 절단된 바늘 끝을 갈아서 날카로운 경사를 만듭니다(그림 1C-F).
- 최소 20-30분 동안 최대 속도로 45° 각도로 바늘을 연마합니다.
알림: 초순수가 연삭판에 첨가되어 윤활제 역할을 하고 마찰/온도를 줄이며 유리 입자를 씻어냅니다(그림 1B). 그러나 과도한 액체는 분쇄기의 속도를 늦출 수 있습니다. - 니들 팁(그림 1C)이 연삭판 표면(그림 1D)에 닿지만 구부러지지 않는지 확인합니다(그림 1E).
알림: 구부러진 연삭은 잘못된 경사 각도의 길고 깨지기 쉬운 바늘 끝을 초래하여 주입 중에 쉽게 부러질 수 있습니다. 바늘을 부러 뜨리면 배아에 해를 끼칠 수 있으므로 손상되지 않은 바늘로 교체해야합니다. 올바르게 접지된 팁은 그림 1F,G에 나와 있습니다. 연삭 후 결과 니들 보어는 ~15μm의 내경(ID)과 ~35μm의 외경(OD)을 가질 것으로 예상됩니다(그림 1G).
- 최소 20-30분 동안 최대 속도로 45° 각도로 바늘을 연마합니다.
- 1mL 주사기에 미네랄 오일을 채우고 27G 바늘을 부착합니다.
- 바늘 캡을 제거하고 주사기 바늘을 새로 연마 된 유리 모세관에 삽입합니다. 모세관 끝에서 기름이 떨어질 때까지 미네랄 오일을 주입하십시오. 모세관 바늘에 미네랄 오일이 채워질 때까지 27G 바늘을 빼면서 계속 주사 한 후 주사기 바늘을 제거 할 수 있습니다.
- 갈거나 미네랄 오일로 채워진 바늘은 손상과 먼지 축적을 방지하기 위해 밀폐 된 환경에 보관하십시오. 보관을 위해 두 개의 모델링 점토 롤을 일반 페트리 접시에 삽입하여 홀더 역할을 합니다(그림 1H). 점토에 바늘을 부드럽게 놓고 바늘을 쉽게 회수 할 수 있도록 멀리 간격을 두십시오.
알림: 바늘 준비는 시간이 많이 걸리므로 주사 최소 하루 전에 바늘을 준비하는 것이 가장 좋습니다. 바늘은 무뎌 질 수 있으므로 최대 2 리터 후에 폐기하십시오. 준비 또는 주사 중에 바늘이 손상된 경우 항상 백업 바늘을 준비하십시오.
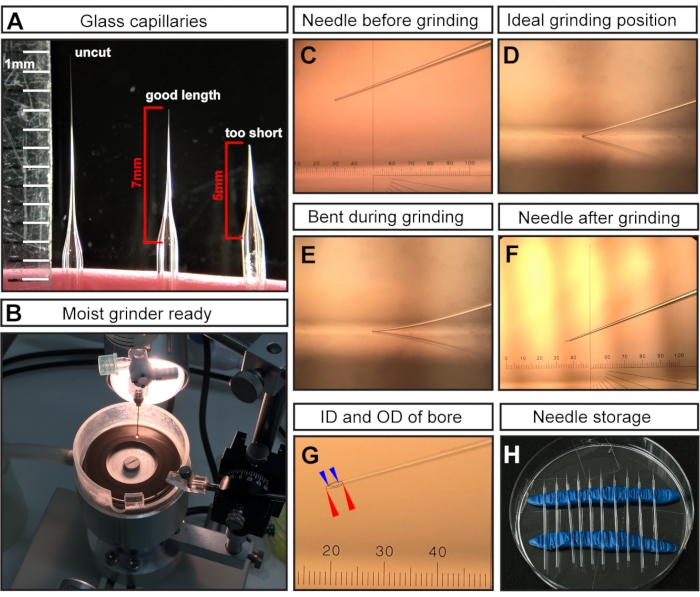
그림 1: E7.5 양강 주사를 위한 바늘 준비. (A) 당겨졌지만 절단되지 않은 유리 모세관 바늘(왼쪽), E7.5 주입을 위한 최적의 길이로 절단된 모세관 바늘(가운데) 및 너무 짧게 절단된 모세관 바늘(오른쪽)의 대표적인 예. (B) 바늘 연삭 준비가 된 균일 한 물 적용 범위를 가진 분쇄기. (C-F) 다양한 바늘 끝의 대표적인 예. (C) 그라인더에 장착 된 절단되지만 접지되지 않은 바늘 끝; (d) 바늘 끝이 그라인더에 닿는 이상적인 연삭 위치; (e) 연삭 공정 중에 바늘이 너무 많이 낮아지고 구부러지는 단계; (F) E7.5 AC 주입을 위한 이상적인 접지 바늘 팁. (G) E15 AC 주입에 적합한 ~35μm의 내경과 ~7.5μm의 외경을 가진 구멍을 보여주는 접지 바늘 팁. 바늘 구멍은 점선으로 표시됩니다. 빨간색 화살촉으로 표시된 외경; 파란색 화살촉으로 표시된 내경. (H) 바늘 보관 : 뽑고 빻은 바늘로 채워진 페트리 접시. 두 줄의 모델링 점토가 홀더 역할을합니다. 알림: C, F, G의 안구 마이크로 미터의 경우 1cm는 100 피치로 나뉩니다. 목표는 3x입니다. 따라서 1피치= 10,000μm/(100 × 3) ≈ 33.4μm입니다. 약어 : AC = 양수; ID = 내경; OD = 외경. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 주사 전날 : 임신 초음파 검사를위한 벤치 준비
알림: 모든 작업은 렌티바이러스로 작업할 때 통풍이 잘되는 생물안전 레벨 2(BSL 2) 벤치에서 수행해야 합니다. 임신의 초음파 검사는 환기 된 벤치에서 수행 할 수 있습니다.
- 초음파 기계, 가열 테이블 및 이소 플루 란 펌프 용 O2 공급 장치를 켭니다 (장비마다 다를 수 있음).
알림: 이소플루란 시스템을 점검하여 이소플루란이 공기 중으로 누출되지 않는지 확인하십시오. - 빈 쓰레기 봉투(쉽게 접근할 수 있도록 내벽에 테이프로 붙임), 제모 크림, 멸균 포장 면봉, 물, 티슈 페이퍼 및 수술용 테이프를 BSL 2 벤치 안에 놓습니다.
- 임신 초음파 검사 중에 마우스 팔다리를 고정하기 위해 4 개의 수술 용 테이프 (~ 7cm 길이)를 준비하십시오.
3. 임신 확인을 위한 초음파 검사
참고: 이 단계는 E7.5 주입 전날인 E6.5에서 수행할 수 있습니다. 재태 연령 확인에 대한 자세한 내용은 토론을 참조하십시오.
- 시간 짝짓기 된 암컷 마우스를 유도 챔버에 놓습니다.
- 마취를 유도하기 위해 ~ 2.1 LPM의 산소 흐름과 3-4 % 이소 플루 란의 초기 용량으로 가스 흐름을 켭니다.
- 발 반사를 확인하여 여성이 완전히 마취되었는지 확인하십시오. 발 반사가 없으면 이소 플루 란을 1.5-2 %로 낮추십시오.
참고: 마취를 유도하는 데 약 3분이 소요됩니다. - 유도 챔버에서 가열 테이블 노즈 콘으로 가스 흐름을 전환하십시오.
- 마취 된 여성을 가열 테이블의 앙와위 자세 (복부 위로)에 놓고 부착 된 코 콘에 주둥이를 놓아 임신 초음파 검사시 마취를 유지하십시오.
- 여성의 몸을 늘리거나 수염을 갇지 않고 준비된 수술 용 테이프 조각으로 네 발을 모두 테이블에 고정하십시오.
- 완두콩 크기의 제모 크림을 하복부에 바르십시오. 면봉을 사용하여 크림을 하복부 (~ 3 x 3cm 정사각형)에 바르고 면봉을 앞뒤로 굴려 부드럽게 마사지합니다.
- 모피가 피부에서 분리되기 시작하면 티슈 페이퍼를 적셔 크림과 모피를 제거하십시오. 크림과 머리카락이 모두 사라질 때까지 촉촉한 티슈 페이퍼로 털이 제거 된 부위를 청소하십시오. 피부를 말리십시오.
- 면도 부위에 자두 크기의 초음파 젤을 바르고 다음 세 가지 방법 중 하나로 초음파를 사용하여 자궁을 확인합니다.
- 수동으로 수행하려면 초음파 프로브를 초음파 젤에 넣고 프로브를 움직여 자궁을 찾으십시오.
- 반수동 접근 #1의 경우 x-평면을 따라 레일의 일부를 풀고 이동하여 초음파 프로브(난간 시스템에 부착됨)를 여성 복부 위에 놓습니다. 초음파 프로브를 젤(z-평면)에 넣고 하복부(y-평면)를 통해 스캔합니다(그림 2A).
- 반수동 접근 #2의 경우 초음파 프로브(난간 시스템에 부착됨)를 젤 속으로 내려 하복부를 이미지화합니다. 공정 중에 초음파 프로브를 고정시키고 부착 된 바퀴가있는 가열 테이블을 x 및 / 또는 y 평면을 따라 움직입니다 (그림 2B).
참고: 이러한 초기 배아 단계에서 내부 장기, 예를 들어 장은 초음파 영상에서 자궁과 유사하게 나타날 수 있습니다. 그러나 배아와 낙엽은 일련의 구체 (목걸이를 따라 구슬과 유사)로 나타나지만 장은 연속 튜브 모양입니다. 내강 공간(별도의 구체 대 연속 튜브)의 연결성은 관심 있는 구조를 앞뒤로 스캔하여 구조가 개별 구(배아/결정)(그림 2C) 또는 연속 튜브(장)(그림 2D)인지 여부를 결정함으로써 평가할 수 있습니다. 이 단계에서는 배아의 수를 기록 할 필요가 없습니다. 그들의 존재 또는 부재를 확인하는 것으로 충분합니다.
- 임신 상태가 확인되면 초음파 프로브를 복부에서 들어 올리고 젖은 티슈 페이퍼로 하복부를 깨끗하게 닦아 초음파 젤을 제거합니다.
- 이소 플루 란 펌프를 끄고 수술 용 테이프를 제거하여 발을 풀어줍니다.
- 암컷을 엎드린 자세 (배 아래로)에 40 ° C 가열판의 깨끗한 케이지에 넣습니다. 여성이 의식을 회복 할 때까지 2-6 분이 걸릴 때까지 면밀히 관찰하십시오.
알림: 이소플루란에 대한 노출을 최소화하기 위해 한 여성의 초음파 검사가 <10분인지 확인하십시오. - 모든 재료와 폐기물을 제거하고 70 % 에탄올로 모든 표면을 청소하십시오. 건조하고 부드럽고 보푸라기가없는 종이 티슈로 초음파 프로브에서 남은 초음파 젤을 닦아냅니다. 초음파 기계, 환기 벤치 / BSL2 벤치, 가열 테이블 및 O2 공급 장치를 끕니다.
4. 배아 병기 결정을위한 초음파 검사
알림: 이 단계는 수술 전에 수행되며 AC 크기에 따라 임산부를 계층화하는 역할을 합니다. 이 단계는 개발 중인 CNS를 표적으로 삼는 것이 목표인 E7.5에서 매우 중요합니다. 이 발달 초기 단계에서 발달 몇 시간의 차이는 AC의 크기와 신경화의 진행에 큰 영향을 미칩니다.
- 3.1-3.5단계의 단계에 따라 첫 번째 임산부 마우스를 마취합니다.
- 3.6 단계에서 설명한대로 암을 테이블 위에 놓고 고정하십시오.
- 면도 한 복부에 자두 크기의 초음파 젤을 바르고 초음파 프로브를 내려 여성의 하복부를 이미지화합니다.
알림: 이 단계에서는 여성이 임신 전날 초음파 검사를 받았고 이미 복부의 털을 제거했다고 가정합니다. 그렇지 않은 경우 3.7-3.8 단계에 따라 초음파 젤을 추가하기 전에 모피를 제거해야합니다. E7.5에서 자궁과 낙엽은 더 크고 내부 장기와 구별하기 쉽습니다. 또한, AC는 더 크고 외분비 캐비티 (ExC)와 구별 될 수있다. - 가능한 한 완벽하게 왼쪽 및 오른쪽 자궁 뿔을 스캔하십시오.
참고 : 일부 배아는 여성의 몸 안쪽 깊숙이 놓여 놓칠 수 있습니다. - 배아의 수와 단계를 기록하십시오. 이상적인 크기의 양수, 허용 가능한 충치 및 충치가 없는 낙엽의 수를 기록해 둡니다(그림 2E-G).
- 모든 임신을 단계화하고 그에 따라 순위를 매기십시오.
- 4.5-4.7단계의 지침에 따라 초음파 검사(4.4단계) 직후 암컷에게 이상적인 크기의 AC를 대부분 주사합니다.
- 수용 가능한 대다수 (외인성 및 양수가 아직 두 개의 충치로 명확하게 나뉘지 않은 경우) 또는 충치가없는 여성의 경우 주사를 연기하고 몇 시간 후에 다시 병기를 준비하십시오. 대부분의 충치가 여전히 너무 작 으면 주사를 10-12 시간 연기하십시오.
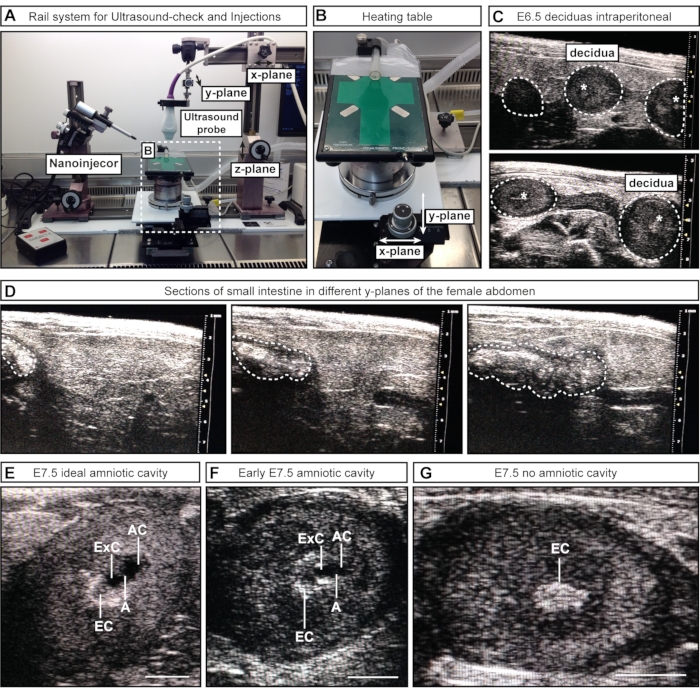
그림 2: 초음파 검사 중 양수의 검사 및 병기. (A) 초음파 프로브, 나노 주입기 및 가열 테이블이 부착 된 레일 시스템 개요. 초음파 프로브는 x, y 및 z 평면으로 이동하여 여성 복부 또는 AC와 최적의 정렬을 달성 할 수 있습니다. (B) 가열 테이블은 x- 및 / 또는 y- 평면의 두 바퀴를 통해 이동하여 AC의 정확한 스캐닝 및 평가를 가능하게하는 반면 초음파 프로브는 정적 상태를 유지할 수 있습니다. (C) 임신 확인을 위한 초음파 검사 중 여성 복부 내부의 E6.5 낙엽의 대표적인 초음파 이미지(흰색 점선 윤곽선). 이 시점에서 충치가 형성되지 않았습니다. 그러나 때로는 외반 원뿔 (흰색 별표)이 보입니다. Deciduas는 구형으로 인식 할 수 있으며 하나의 연속 튜브로 나타나는 장과 구별됩니다. (D) 하복부를 통해 연속적으로 스캔되는 소장의 대표적인 이미지 시퀀스(흰색 점선 윤곽선). (예) E7.5 주입 전 캐비티 스테이징 중 대표적인 초음파 이미지. 양수와 외분비 구멍이 형성되어 양막에 의해 분리됩니다. 외반 원뿔은 주요 혈액 공급 역할을하며 초음파에서 밝은 지점으로 나타납니다. AC는 외반 원뿔에서 가장 말단입니다. (E) 이상적인 크기의 AC는 외인강보다 크게 나타나고 중간 크기의 공동은 더 작게 보입니다 (F). 충치가 보이지 않으면 (G), 이는 배아가 재 흡수되었거나 아직 E7.5에 도달하지 않았 음을 의미합니다. 스케일 바 = 1mm. 약어: A = 양막; AC = 양수; ExC = 외분비 공동; EC = 외반 원뿔. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 주사 일 : 수술을 위해 BSL2 벤치 준비
- 한 조각의 탄성 막을 시중에서 판매되는 수정 된 페트리 접시의 둥근 중앙 개구부에 붙입니다. 누출을 방지하기 위해 멤브레인이 페트리 접시에 잘 부착되어 있는지 확인하십시오.
알림: 접시가 새거나 잘 접착되지 않으면 탄성 멤브레인의 가장자리를 덕트 테이프로 더 고정할 수 있습니다. - 탄성 막의 중앙에 1-1.5cm 길이의 절개를하십시오.
- 초음파 기계, BSL2 벤치, 가열판, 이소플루란 펌프용O2 공급 장치 및 유리 비드 멸균기(300°C로 설정)를 켭니다.
- BSL2 벤치 내부에 빈 쓰레기 봉투 1개를 놓습니다(쉽게 접근할 수 있도록 내벽에 테이프로 붙임). 멸균 포장 면봉 (각 수술 / 각 여성에 대해 새 면봉 사용); 수술 도구 (가위, 핀셋, 클립, 봉합사) 및 수술 용 테이프; 실온 인산염 완충 식염수(PBS) 1병, 폐기물 수거용 빈 병 1개, 25mL 피펫 1병; 수술을위한 탄성 막이있는 페트리 접시 1 개; 한 방울의 물로 뚜껑에 고정 된 2 x 2-3 x 3 cm 파라 필름 조각이있는 페트리 접시의 뚜껑; 모델링 점토 : 4 개의 큰 공 또는 큐브 (~ 3 x 3 x 3 cm3) 및 하나의 원통형 조각 (~ 4 x 1cm); 진통제 (예 : 부 프레 노르 핀, 0.05-0.1 mg / kg 체중) 및 눈 젤이 포함 된 주사기참고 : 모델링 점토의 공 (또는 큐브)은 접시가 여성의 복부 위에 놓이면 페트리 접시의 "발"또는 스탠드 / 홀더 역할을합니다. 원통형 점토 조각은 접시 안의 배아를 고정시킵니다. 하나 이상의 용액을 주입하거나 주사 중에 바늘을 다시 채워야하는 경우, 용액을 간격을 둘 수 있다면 동일한 파라 필름 조각을 사용할 수 있습니다.
6. 바늘 로딩
- 더 나은 그립을 위해 티슈 페이퍼로 과도한 미네랄 오일을 닦아냅니다.
알림: 손상이나 부상을 방지하기 위해 항상 팁에서 멀리 청소하십시오. - 모든 구성 요소(밀봉 O-링 1개, 스페이서 1개, 전면 개스킷 1개-모두 콜릿 아래에 있음, 그림 3A)가 올바른 방향(그림 3B, 시각화를 위해 콜릿 제거)으로 설치되어 모세관 바늘을 제자리에 고정하고 밀폐 연결을 만들어 바늘 내부의 금속 플런저를 전진하거나 후퇴시킬 때 기포 형성을 방지합니다.
- 나노 인젝터의 금속 플런저가 완전히 수축되었는지 확인하십시오. 채우기를 눌러 확인하고 플런저가 완전히 들어갔음을 나타내는 이중 신호음이 들릴 때까지 기다립니다.
- 콜릿이 부착되었지만 약간 느슨해진 상태(나사를 45-90도 풀음)한 상태에서 유리 바늘을 금속 플런저에 밀어 넣고 스페이서에 도달할 때까지 금속 플런저와 함께 모세관 바늘을 전면 개스킷을 통해 밀어 넣습니다(그림 3C, D, 시각화를 위해 제거된 콜릿).
알림: 플런저가 개스킷을 통과할 때 약간의 저항이 나타나고 스페이서에 도달하면 감소합니다. 모세관 바늘이 스페이서에 단단히 삽입되어 기밀 연결을 생성하는지 확인합니다(그림 3D). - 나노 주입기의 콜릿을 조여 바늘을 고정합니다 (단단히 다시 조입니다).
알림: 바늘이 부러질 수 있으므로 과도하게 조이지 마십시오. - Empty를 눌러 플런저를 바늘에 밀어 넣고 바늘 끝에서 오일을 배출합니다. 유리바늘이 움직이면 플런저를 집어넣고 바늘을 제거한 다음 다시 장전하십시오. 이로 인해 기포가 형성되면 바늘을 제거하고 미네랄 오일을 다시 채우십시오.
알림: 적절하게 고정 된 바늘은 플런저와 함께 움직이지 않아야합니다. - 파라필름1 조각에 바이러스(~6μL) 또는 다른 주사액 한 방울을 놓습니다(그림 3E; 에반스 블루 염료는 시각화 목적으로 사용됩니다).
참고 : 나노 주입기의 최대 부피는 ~ 5 μL입니다. - Fill을 눌러 오일과 용액 사이의 분배기 역할을 할 기포를 만듭니다(그림 3F).
알림: 이것은 또한 바늘을 채우거나 비울 때 위치 지정 마커 역할을 합니다. - 바늘을 내리고 팁을 용액에 담그고 채우기를 누릅니다(그림 3F,G).
- 기포 후에 용액이 적재될 때 유체 레벨을 관찰하십시오. Push Empty 를 눌러 막힘을 배출하고 액체가 바늘에 들어가지 않고 기포가 길어지면 Fill 을 눌러 다시 로드합니다. 그래도 문제가 해결되지 않으면 바늘을 교체하십시오.
- 바늘이 완전히 로드되면(그림 3H) Z 평면에서 바늘을 들어 올리고 끝에서 소량의 공기를 흡입하여 바늘 끝에서 용액이 증발하고 바늘이 막히는 것을 방지합니다.
- 우발적 인 손상이나 부상을 방지하기 위해 부착 된 바늘이있는 나노 주입기를 작업자로부터 벤치 뒤쪽으로 돌리십시오.

그림 3: 바늘을 나노 주입기에 부착하고 용액을 로딩합니다. (A) 바늘이 나노 주입기에 장착되기 전의 시작 위치 : 금속 플런저가 완전히 수축되고 콜릿이 부착됩니다. (B) 콜릿 아래에서 바늘을 잡고 고정하기위한 세 가지 구성 요소가 모두 올바른 순서 (왼쪽에서 오른쪽으로)로 표시됩니다 : O- 링 (얇고 검은 색), 스페이서 (흰색), 큰 구멍이있는 O- 링 (검은 색) (바늘이 통과해야 함). 기밀 연결을 보장하기 위해 유리 바늘을 금속 플런저 (C) 위로 밀어 넣고 스페이서 (D)에 도달 할 때까지 전면 O- 링의 개구부를 통해 밀어 넣습니다. (E-H) 바늘에 용액 로딩. (E) 한 방울의 용액을 플레이트 뚜껑의 파라 필름 조각에 놓습니다. (F) 용액을 넣기 전에 Fill을 눌러 기포를 만들고 바늘 끝을 용액에 담그십시오. (G) 용액이 바늘에 로딩됩니다. (H) 용액이 바늘에 적재됩니다. 참고: 콜릿은 시각화를 위해 (B-D)에서 제거되었지만 실험 중에는 부착된 상태로 유지되어야 합니다. 바늘을 고정하는 마지막 단계는 콜릿을 조이는 것입니다. 에반스 블루 염료는 E-H의 시각화에 사용됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
7. 주사
알림: 이 절차에 사용되는 모든 기구는 수술 전과 각 마우스 사이에 멸균됩니다.
- 이상적인 크기의 충치를 가진 첫 번째 여성을 마취하십시오 (섹션 4 참조).
- 3.1-3.6 단계에서 설명한대로 여성을 테이블 위에 놓고 고정하십시오.
- 눈 젤을 눈에 바르면 각막 건조를 방지하고 진통제를 피하 주사합니다.
참고: 권장 진통제: 현지 동물 복지 규정에 따라 부프레노르핀(0.05-0.1mg/kg 체중) 또는 플루닉신(2.5mg/kg) 또는 이와 유사한 약물. 다중 모드 수술 전후 진통제는 주입 된 진통제와 이소 플루 란으로 유지됩니다. - 0.5 mg / mL 클로르헥시딘 용액 (또는 유사)을 적신 천으로 닦아 하복부를 무균 적으로 준비하고 피부를 건조시킵니다. 수술 용 가위를 사용하여 하복부에 1.5-2.0cm 수직 정중선 피부 절개를하십시오.
알림: 현지에서 승인한 소독 루틴에 따라 수술 부위를 준비하십시오. - 피부를 부드럽게 들어 올리고 절개 지점 주위 약 1cm의 밑에있는 근육층에서 피부를 제거하여 수술 후 봉합을 용이하게합니다.
- 근육층에 수직 정중선 1cm 절개를하십시오.
- 한 쌍의 집게로 피부와 근육층의 한쪽을 들어 올리고 다른 쌍으로 자궁 뿔을 찾으십시오.
참고: 낙엽은 목걸이에 구슬처럼 배열되어 있는 반면 장은 하나의 길고 연속적인 튜브입니다(그림 4A). - 집게로 복부에서 두 자궁 뿔을 조심스럽게 빼냅니다. 배아 사이에 조직을 잡으십시오. 직접 짜지 마십시오(그림 4B).
참고: 자궁은 자궁경부의 신체에 부착되고 두 개의 난소/난관은 인대를 통해 부착됩니다. 이 앵커 포인트에서 자궁을 당기거나 분리하지 마십시오. - 왼쪽과 오른쪽에있는 배아의 수를 세고 기록하십시오.
- 난소에서 자궁 경부까지 또는 자궁 경부에서 난소까지 배아에 번호를 매기십시오.
참고: 이것은 주입된 배아가 배아 단계에서 수집되는 경우 특히 중요합니다. - 축축한 면봉으로 주입 할 처음 3 개를 제외한 모든 배아를 복강 내로 부드럽게 밀어 넣습니다.
- 페트리 접시의 고무줄에 PBS 한 방울을 놓고 배아 바로 위에 놓습니다.
- 닫힌 집게를 탄성 절개 부위에 삽입하고 집게를 풀어 탄성 절개 부위를 열어 액체가 배아에 떨어지도록 합니다.
알림: 이것은 배아의 재수 화를 보장하고 탄성막이 암컷의 젖은 피부에 달라 붙어 다음 단계에서 PBS의 누출을 방지합니다. - 3 개의 배아에 해당하는 자궁 부분을 집게로 탄성을 통해 당기고 여성의 복부에 페트리 접시를 부드럽게 앉 힙니다.
- 집게와 축축한 면봉으로 자궁 위치와 탄성을 조정하여 탄성이 여성의 피부에 밀봉되어 PBS 누출을 방지합니다.
- 4 개의 점토 발을 사용하여 페트리 접시를 복부 바로 위에 고정하고 고정하여 여성에 대한 압력과 여성의 호흡 및 심장 박동에 대한 이미징 감도를 줄입니다.
- 모델링 점토 실린더를 배아/자궁의 오른쪽으로 눌러 자궁을 고정합니다(그림 4C).
참고: 이 방향 지침은 바늘이 암컷의 왼쪽에 있고 암컷의 왼쪽 자궁 뿔의 배아가 노출되어 있다고 가정합니다. 자궁의 측면 (왼쪽 또는 오른쪽 자궁 뿔)은 AC가 바늘 (왼쪽 경적; 그림 4D) 또는 안정화 점토 실린더 (오른쪽 경적; 그림 4E). - 오른쪽 자궁 뿔에서 배아를 주입하려면 점토 실린더를 배아의 왼쪽에 놓고 (그림 4F) 가열 테이블을 180 ° (그림 4G) 돌려 올바른 방향을 얻습니다. 대신 바늘을 움직일 수 있는 경우 관련 설정에 맞게 조정하십시오.
- 배아와 자궁이 PBS로 덮일 때까지 페트리 접시에 PBS를 추가합니다.
- 초음파 프로브를 PBS로 내리고 첫 번째 배아가 초음파 프로브와 정렬되도록 마우스/수술 테이블을 조정하여 주사 기록을 용이하게 합니다.
참고 : "첫 번째"는 난소에서 자궁 경부까지의 배아 번호 매기기를 나타냅니다. - 세 개의 배아를 모두 스캔하고 AC를 검사합니다. 주입량을 다음과 같이 결정하십시오.
- 초음파 기계로 AC의 직경을 측정하십시오. AC 직경이 ≤0.2mm인 경우 69nL를 주입하십시오. AC 직경이 >0.2mm 및 ≤0.29mm인 경우 2 x 69nL(= 138nL)를 주입합니다. AC 직경이 3mm인 경우 69 x 207nL(= 0.29nL)> 주입합니다(그림 4H).
참고: 이전 실험에 따르면 E7.515에서 최대 207nL 주입 부피가 잘 견딥니다. 생존에 미치는 영향을 최소화하면서 성공적인 주입은 AC의 상대적 부피 증가가 90%15를 초과하지 않을 때 달성됩니다. 새끼나 마우스 균주 간의 AC 크기 차이는 일반적이며 추가 최적화가 필요할 수 있습니다.
- 초음파 기계로 AC의 직경을 측정하십시오. AC 직경이 ≤0.2mm인 경우 69nL를 주입하십시오. AC 직경이 >0.2mm 및 ≤0.29mm인 경우 2 x 69nL(= 138nL)를 주입합니다. AC 직경이 3mm인 경우 69 x 207nL(= 0.29nL)> 주입합니다(그림 4H).
- 주입 컨트롤러로 주입량을 설정합니다.
- 사출 속도를 23nL/s로 느리게 설정합니다.
알림: 장비 모델에 따라 분사력이 달라질 수 있습니다. - 레일 시스템(x면 및 z면, 그림 4I)의 메인 휠을 사용하여 바늘을 PBS로 내리고 액체가 바늘 끝에 도달할 때까지 나노 주입기 컨트롤러에서 Empty 를 누릅니다.
알림: 바늘이 막힌 경우 Empty 를 누르면 막힘이 녹거나 막힘이 배출 될 수 있습니다. - PBS에서 바늘을 들어 올리고 주입을 누릅니다. 대략적인 원하는 부피의 방울이 배출되는지 확인하십시오.
- 바늘을 PBS로 내리고 마이크로 매니퓰레이터의 y- 플레인 휠로 나노 주입기를 움직여 초음파 프로브 및 배아와 정렬합니다 (그림 4J).
알림: 바늘 끝은 초음파 이미지에서 밝은 점으로 나타날 때 완벽하게 정렬됩니다(그림 4K, L). 바늘은 마이크로 매니퓰레이터로 세 가지 방향 평면 모두에서 움직일 수 있습니다. - 주입 각도 휠로 바늘 각도를 조정하여 자궁벽에 대한 거의 수직에 가까운 주입 각도를 보장합니다. 마이크로 매니퓰레이터의 주입 휠을 사용하여 바늘을 한 번에 AC에 삽입합니다(그림 4J-M). 바늘 끝의 밝기를 주시하십시오. 바늘 끝이 초음파 이미지에서 사라지면 초음파 프로브를 앞뒤로 움직여 바늘의 초점을 다시 맞춥니다.
알림: 바늘이 AC 내부에 있으면 배아를 손상시키지 않고 바늘 위치와 초점을 약간 수정할 수 있습니다(~0.3mm 내에서 조정). 바늘 위치를 이보다 더 조정하지 마십시오. - 주입을 누릅니다(207nL의 경우 볼륨을 69nL로 설정하고 세 번 주입). 주사 후 한 번의 부드러운 움직임으로 바늘을 집어 넣기 전에 추가로 5-10 초 동안 기다리십시오.
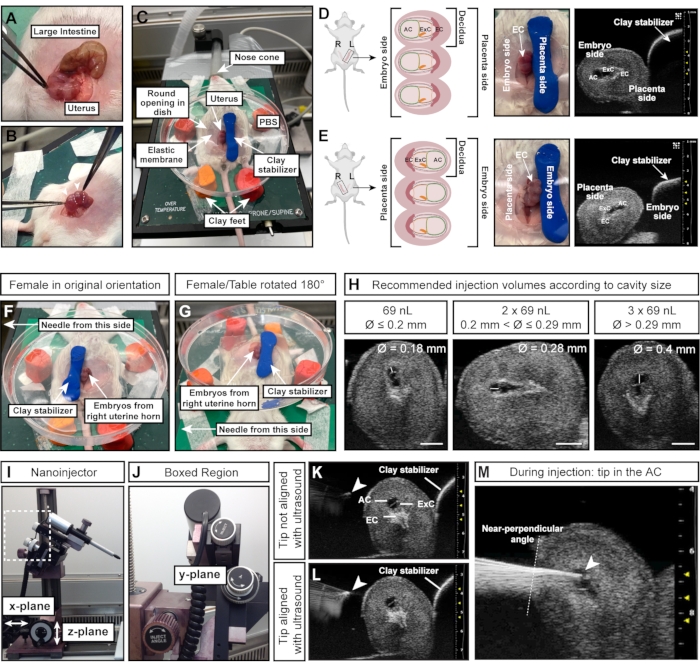
그림 4: 성공적인 주사를 위한 양강의 최적 크기와 방향 . (A) 대장 (상단)에 비해 구체 (하단)의 끈 모양 인 여러 개의 E7.5 낙엽이있는 자궁 경적. (B) 낙엽 사이의 자궁 조직 (흰색 점선)을 잡습니다. 낙엽과 발달 중인 배아는 이 초기 단계에서 깨지기 쉽고 과도한 외력에 의해 흡수되기 쉽기 때문에 데시두아(흰색 화살촉)를 집게로 직접 짜내는 것을 피하십시오. (C) PBS로 채워진 페트리 접시에 데시두아가 노출되고 모델링 점토의 4피트에 장착된 앙와위 자세의 여성. 낙엽은 실린더 모양의 추가 모델링 점토 조각으로 안정화됩니다. (D, E) AC의 방향은 노출되는 자궁 뿔의 측면에 의해 영향을받습니다. 왼쪽 자궁 뿔의 낙엽을 사용하면 AC가 점토 안정제에서 멀어지고 왼쪽 바늘에 쉽게 접근 할 수 있습니다 (D). 그러나 오른쪽 자궁 뿔을 사용하면 외태반 원뿔이 대신 바늘을 향하게되어 AC (E)에 접근하기가 더 어려워집니다. 따라서 오른쪽 자궁 뿔에 주입 할 때 점토 안정제를 바늘을 향한 쪽 (F)쪽으로 놓고 전체 가열 테이블을 180 ° 회전시킵니다 (G). (H) AC 크기에 따른 권장 주입량. 일반적으로 직경이 0.2 mm ≤ 캐비티는 최대 69 nL로 주입 할 수 있습니다. 직경> 0.2 mm 및 ≤ 0.29 mm는 최대 2 x 69 nL (138 nL)의 부피를 견딜 수 있으며 0.29 mm > 공동은 3 x 69 nL (207 nL)로 주입 할 수 있습니다. 스케일 바 = 1 mm. (I, J) 나노 인젝터는 레일 시스템에 부착되어 있으며 x 및 / 또는 z 평면으로 이동할 수 있습니다. 바늘의 각도는 사출 각도 휠로 조정할 수 있습니다. (케이, 패) 바늘 끝 (흰색 화살촉)은 초음파 (L)에서 가장 밝게 나타날 때 AC와 정렬됩니다. (M) 바늘 끝이 AC에 있고 잘 정렬된 주입 과정을 보여주는 초음파 이미지(흰색 화살촉). 약어 : A = 양막; AC = 양수; ExC = 외분비 공동; EC = 외반 원뿔. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 단계를 다음 배아로 옮기고 적절한 AC 크기가 있는 경우 다른 두 배아에 대해 7.22-7.26단계를 반복합니다.
- 마이크로 매니퓰레이터를 사용하여 초음파 프로브와 바늘을 들어 올려 PBS에서 꺼냅니다. 손상과 부상을 방지하기 위해 바늘을 작업자에게서 멀리 돌리십시오.
- 집게를 사용하여 1 번째 및 2번째 배아를 탄성을 통해 부드럽게 밀어 넣어 여성의 복부로 다시 향하게합니다. 제3 배아에 인접한 조직을 부드럽게 잡고 탄력 절개의 상단쪽으로 자궁을 당깁니다. 집게로 4-6 번째 배아를 부드럽게 잡아 당겨 3번째 배아가 복부에 다시 들어가도록합니다.
알림: 이 단계는 PBS를 변경하거나 페트리 접시를 제거하지 않고 수행할 수 있습니다. - 최적의 AC를 가진 모든 배아가 주입되거나 제한 시간에 도달 할 때까지 필요에 따라 반복하십시오.
- 배아 / 자궁을 여성의 복부로 부드럽게 밀어 넣습니다.
- PBS를 흡인하고 페트리 접시를 제거합니다. 바이러스가 사용 된 경우 감염성 폐기물로 취급하십시오.
- 간단한 연속 또는 중단 된 봉합사로 Vicryl (USP 6-0, 바늘 길이 13mm, 3/8 원)으로 근육층을 함께 꿰매고 1-2 개의 클립으로 피부를 닫습니다 ( 재료 표 참조).
- 이소플루란 펌프의 전원을 끕니다.
- 수술 용 테이프를 제거하고 암컷을 40 ° C 가열판의 깨끗한 케이지에 엎드린 자세 (배 아래로)에 놓습니다.
알림: 암컷은 의식을 회복하고 10분 이내에 움직일 것으로 예상됩니다. 절차가 30분 이내에 완료되었는지 확인하십시오. 여성의 유전 적 배경, 나이 및 체중은 마취에 대한 민감성에 영향을 미칠 수 있습니다. 수술 중 마우스의 느린 호흡 (느린 호흡은 마취가 너무 깊음을 의미 함) 또는 움직임 (마취가 너무 가볍다는 것을 의미 함)의 징후가 있는지 모니터링하십시오. 지역 동물 복지 규정에 따라 부 프레 노르 핀 (0.05-0.1 mg / kg 체중) 또는 플루 닉신 (2.5 mg / kg) 또는 이와 유사한 것은 필요한 경우 첫 번째 주사 후 8 시간 후에 제공 될 수 있습니다. - 다른 여성을 주사해야하는 경우 첫 번째 여성의 각성을 모니터링하면서 수술 부위를 준비하십시오.
- 70% 에탄올로 수술 도구를 닦아 잔류 혈액이나 조직을 제거하고 예열된 유리 비드 멸균기에서 10초 동안 멸균합니다. 면봉과 사용한 티슈 페이퍼는 버리십시오. 페트리 접시와 점토 조각을 티슈 페이퍼로 닦으십시오.
- 모든 암컷이 주사 될 때까지 7.1-7.35 단계를 반복하십시오.
- 바늘을 비우고 버립니다.
- 바늘에 바이러스 나 주사액이 남아 있으면 나노 주입기에서 Empty 를 누르고 바늘의 내용물을 티슈 페이퍼에 비우십시오.
- 컨트롤러에서 이중 신호음이 울릴 때까지 채우기를 눌러 금속 플런저를 완전히 집어넣으면 플런저가 완전히 수축되었음을 나타냅니다.
- 콜릿을 풀고 바늘을 금속 플런저에서 밀어냅니다. 바늘을 날카로운 물건 쓰레기통에 버리십시오.
- BSL-2 벤치를 청소하십시오.
- 바이러스가 사용 된 경우 수술 부위 전체에 소독제를 뿌리십시오 ( 재료 표 참조). 15 분 후 소독제를 닦아내고 70 % 에탄올로 수술 부위 전체를 청소하십시오. 바이러스를 사용하지 않은 경우 모든 표면을 70 % 에탄올로 청소하십시오.
- 건조하고 부드럽고 보푸라기가 없는 티슈 페이퍼로 초음파 프로브에서 남아 있는 PBS를 닦아냅니다.
- 생물 안전 지침에 따라 폐기물을 폐기하십시오.
- 초음파 기계, 가열 테이블, BSL2 벤치 및 O2 공급 장치를 끕니다.
결과
hPGK-H2B-GFP 렌티바이러스11,12와 함께 E7.5에 주입된 배아를 E13.5에서 수집하고 형광 해부 현미경으로 검사했습니다(그림 5A). 신경판의 성공적인 형질도입은 주로 뇌 및 다른 외배엽 유래 조직, 예를 들어 피부에서 형광 리포터의 강한 발현을 갖는 배아를 초래합니다(그림 5A,B). 지나치게 높은 부피(예: ≥500nL)를 주입하면 AC의 압력이 증가하고 완전한 재흡수(데이터는 표시되지 않음) 또는 뇌증과 같은 신경관 결함이 발생할 수 있습니다(그림 5A). E7.5에서 성공적인 주사는 전뇌에서 후뇌로 균일하게 전달됩니다 (그림 5C-J).
2 × 1010 감염 단위 (IFU) 주변의 렌티 바이러스 역가는 95 % 이상의 표적화를 달성하는 반면, ~ 1 × 109 IFU의 역가는 15 % 표적 효율15를 달성합니다. 또한 맥락막신경총 17,18과 같이 이전에 전기 천공을 사용하여 타겟팅하기 어려웠던 구조도 타겟팅됩니다 (그림 5 E, F). 형질도입 효능은 AC로 전달되는 바이러스 역가를 조정함으로써 변형될 수 있다. 낮은 역가의 주사는 단일 세포 클론의 형질도입을 초래하는 반면(그림 5C, 그림 5E 및 그림 5G,H) 고역가 바이러스의 사용은 전체 뇌의 거의 100%를 형질도입합니다(그림 5D, 그림 5F, 그림 5H 및 그림 5J ). 따라서 NEPTUNE은 클론 형질도입, 계통 추적 및 유전자 스크리닝 접근 방식 또는 전체 뇌에서 유전자 과발현 또는 하향조절의 글로벌 효과를 연구하는 데 사용할 수 있습니다.
포유류의 눈 발달은 배아 외배엽의 세 가지 유도체 사이의 잘 조직 된 통신의 결과입니다 : 신경 망막 (NR)과 망막 색소 상피 (RPE)는 복부 전뇌의 신경 상피에서 파생되는 반면, 표면 외배엽은 미래의 수정체와 각막 상피를 생성합니다. 그러나, 각막의 다른 두 층인 중앙 간질과 후방 내피는 안구 주위 중간 엽19,20의 신경 볏 세포에서 파생된다. E7.5에 고 역가 렌티 바이러스로 주입 된 E13.5 배아를 통한 관상 동맥 절편은 뇌와 유사하게 눈의 신경 조직뿐만 아니라 렌즈, 각막 및 중간 엽의 높고 균일 한 형질 도입을 보여주었습니다 (그림 5K). 신경화가 진행됨에 따라 E8.5 및 E9.5에서의 주사는 수정체와 각막 상피의 지속적인 표적화를 초래하는 반면(그림 5L 및 그림 5N), 눈의 신경외배엽 유래 조직의 형질도입은 E8.5(그림 5L,M)에서 덜 효율적이거나 E9.5(그림 5N)에서 표적화되지 않습니다.
대부분의 바이러스 입자는 주사시 노출 된 조직을 감염시키는 반면, 일부 입자는 나중에 발생하는 비 외배엽 유래 조직을 형질 도입합니다 (그림 6A). 타액선과 덕트는 구강 상피21 에서 E11.5 주변에서 발생하며 해왕성을 표적으로 합니다(그림 6B). E9.5에서 주사 한 후, 혀의 설측 상피가 잘 변형됩니다. 그러나, 하부 중간엽은 음성이다 (도 6C; 괄호는 형질도입된 세포를 나타내고, 별표는 형질도입되지 않은 세포를 나타냄). 또한 설측 상피 내에 양성 클러스터가 있으며 음수 부분 (그림 6C, 흰색 화살촉)으로 구분되어 유두 표면의 전달을 시사합니다. 신경 볏 세포는 밑에있는 혀 중간 엽과 설측 상피 내에서 기술되었으며, 여기서 그들은 미각 유두와 미뢰22의 발달에 관여합니다. 실제로, E7.5에서의 주사는 E13.5에서 혀 중간엽의 광범위한 형질도입을 초래하며(그림 6D), 이는 조기 주사가 신경 볏 세포를 표적으로 하여 혀의 중간엽에 기여한다는 것을 시사합니다.
척추동물에서, 등쪽 근신경절(DRGs)은 말초신경계(PNS)의 중심 성분이며, 이는 신체의 말초로부터의 모든 체성 감각 입력(온도, 통증, 압력)이 DRG 뉴런(23)의 활성화를 통해 뇌로 전달되기 때문이다. DRG의 뉴런과 신경교 세포 모두는 몸통 신경 볏 세포24로부터 유래된다. 유비쿼터스 hPGK 프로모터가 형광 리포터의 발현을 조절하는 렌티바이러스 주사는 DRG(그림 7C)뿐만 아니라 척수(그림 7B)의 뉴런과 전구세포를 모두 형질도입하여 중추 및 말초 신경계(그림 7A)의 광범위한 표적화를 유도합니다. 더블코르틴25에 미니프로모터를 사용하면 GFP 발현을 뉴런으로만 제한할 수 있습니다(15 및 그림 7D,E).
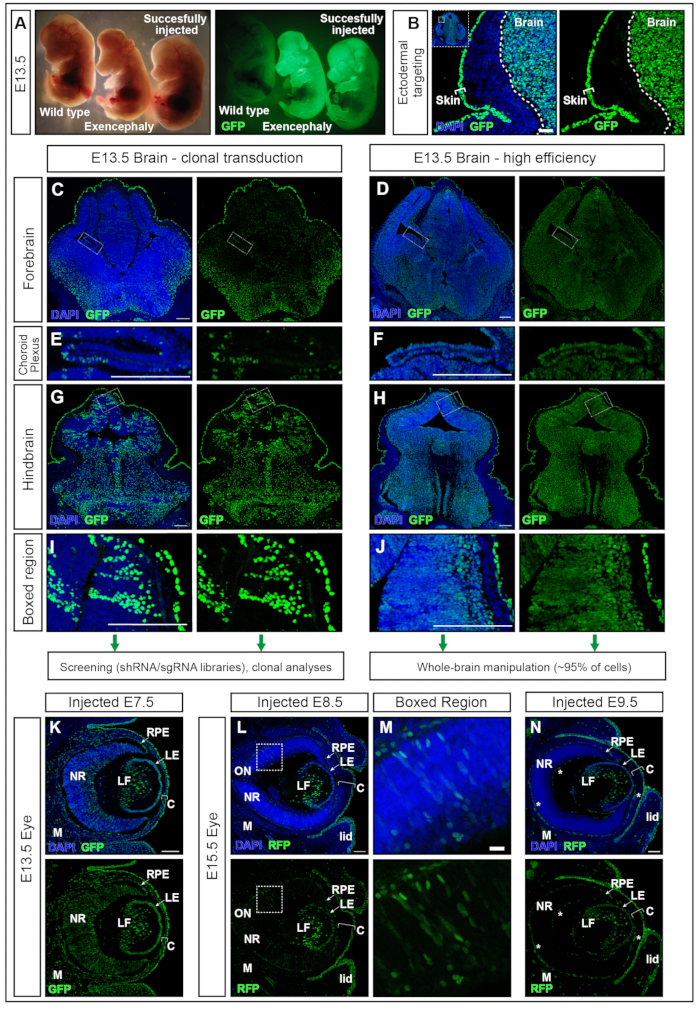
그림 5: NEPTUNE을 사용한 고효율 또는 클론 형질도입. (A) 표준 조명으로 조명된 해부 현미경 아래의 E13.5 배아(왼쪽 패널) 및 GFP용으로 조명된 동일한 배아(오른쪽 패널). 맨 왼쪽에 주입되지 않은 배아, 맨 오른쪽에 성공적으로 주입 된 배아, 뇌에서 긍정적 인 신호를 생성합니다 (가장 오른쪽 배아). 과도한 부피 주입으로 인한 뇌파 배아 (중간 배아). (B) E7.5 주사를 통한 피부 및 뇌 표적화. 스케일 바 = 50 μm. (C, D) E13.5 낮은 클론 변환 (C) 또는 고효율 변환 (D)을 가진 전뇌의 컨포칼 이미지. (C, E, G, I) 뇌의 다른 영역의 클론 형질 도입. (D, F, H, J) 뇌의 다른 영역의 고효율 형질 도입. 스케일 바 = 200 μm. 다른 형질 도입 효율은 CNS의 다른 영역을 대표합니다. (E, F) 맥락막 신경총 표적화, 클론 (E) 또는 고효율 (F). 스케일 바 = 200 μm. (G, H) 클론 타겟팅 (G) 및 고효율 (H) 후뇌 타겟팅, (I, J)에서 확대. 스케일 바 = 200 μm. (K) E7.5에서 자궁 내 주사 후 E13.5에서 눈에서의 GFP 리포터 발현 (L, M) E8.5에서 자궁 주사 후 E15.5에서 눈에서의 GFP 리포터 발현 (L), (M) 또는 E9.5 (N)에서 확대 된 박스 영역. 자가 형광 혈관에는 흰색 별이 표시되어 있습니다. 스케일 바 = 100 μm. 약어 : 해왕성 = neural plate tartgeting with uteronano-injection; C = 각막; LE = 렌즈 상피; LF = 렌즈 섬유; M = 중간엽; NR = 신경 망막; ON = 시신경; RPE = 망막 색소 상피; GFP = 녹색 형광 단백질; CNS = 중추 신경계. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
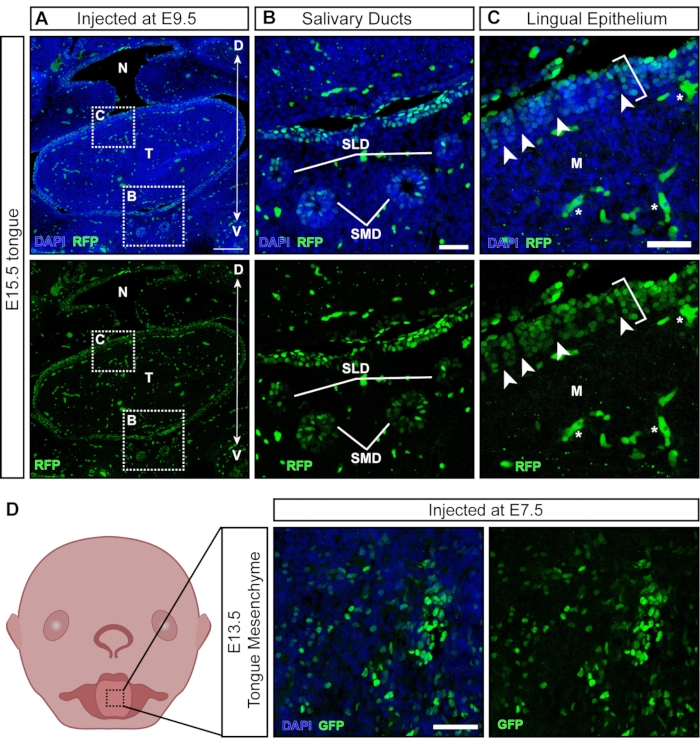
그림 6 : 비 신경 조직의 자궁 내 형질 도입. (A) E15.5 구강의 공초점 이미지. 배아에 형광 리포터 렌티바이러스를 E9.5에 주입하였다. 스케일 바 = 200 μm. (B, C) (B) 삽입 패널의 배율; 타액관 상피가 바이러스로 형질 도입되었습니다. (C) 삽입 패널의 확대; GFP 리포터 바이러스(흰색 브래킷)로 형질도입된 등쪽 설측 상피. 신경 볏 세포에서 파생 된 기본 중간 엽은 음성입니다. 흰색 화살촉은 바이러스 형질도입된 상피 세포로 둘러싸인 음성 신경 볏 세포가 있는 용의자를 나타냅니다(자가 형광 혈액 세포/혈관은 흰색 별표로 표시됨). 스케일 바 = 50 μm. (D) E7.5에서 형광 리포터 바이러스를 주사 한 후 E13.5 혀 중간 엽의 개략도 및 공초점 이미지. 스케일 바 = 50 μm. 약어 : D = 등쪽; M = 중간엽; N = 비 인두; SLD = 설하 덕트; SMD = 턱밑 덕트; T = 혀; V = 복부; GFP = 녹색 형광 단백질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
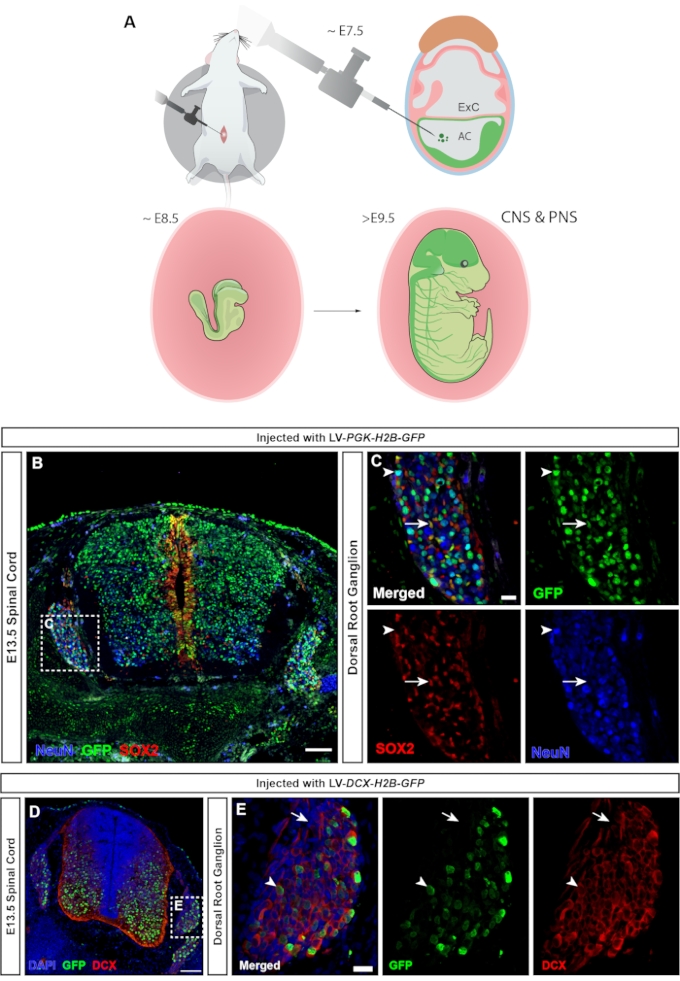
그림 7: 신경 볏 유래 등근 신경절 세포의 형질도입. (A) E7.5에서의 넵튠 표적화는 CNS 및 PNS 모두의 표적화를 허용한다. (B) E7.5에서 hPGK-H2B-GFP 리포터 렌티바이러스를 주입한 E13.5 척수 및 DRG의 컨포칼 이미지는 SOX2+ 신경 전구 세포와 NeuN+ 뉴런 모두의 형질도입을 보여줍니다. 스케일 바 = 100 μm. (C) SOX2+(흰색 화살표) 및 NeuN+(흰색 화살촉) 세포 집단에서 GFP 발현을 갖는 DRG를 보여주는 B의 박스형 영역. 스케일 바 = 20 μm. (D) DCX+ 세포만을 표적으로 하는 E7.5에서 DCX-H2B-GFP 렌티바이러스를 주입한 E13.5 척수 및 DRG의 공초점 이미지. 스케일 바 = 100 μm. (E) GFP 발현이 DCX+ 뉴런(흰색 화살촉)으로 제한된 DRG를 보여주는 D의 박스형 영역. DCX-세포는 GFP(흰색 화살표)에 대해 음성이다. 스케일 바 = 20 μm. 약어 : 해왕성 = neural plate tartgeting with utero nano-injection; CNS = 중추 신경계; PNS = 말초 신경계; DRGs = 등근 신경절; GFP = 녹색 형광 단백질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜에는 배아 생존, 주사의 질 및 판독에 영향을 미치는 몇 가지 단계가 있습니다. 배아의 재태 연령은 하룻밤 짝짓기 후 질 플러그 당일 정오에 E0.5로 정의됩니다. 늦은 오후 / 저녁에 E6.5에서 임신에 대한 초음파 검사를 수행하면 배아가 초음파로 식별 할 수있을만큼 충분히 발달됩니다. 이 검사는 (1) 얼마나 많은 플러그 양성 마우스가 실제로 임신했는지에 대한 사전 스크리닝을 허용하고, (2) 플러그 양성 마우스가 임신하지 않은 경우 바이러스가 불필요하게 해동되고 낭비되지 않도록하며, (3) 마우스에 대한 불필요한 개입을 줄입니다 (임신하지 않은 여성에 대한 수술을 피하십시오).
E7.5에서 배아는 외부 힘에 민감하므로 주의해서 다루어야 합니다. 예를 들어, 자궁 뿔을 당기거나 낙엽을 짜내면 배아 흡수가 발생할 수 있습니다. 자궁 조직은 조직이 건조되는 것을 방지하기 위해 여성 복부 외부에 있을 때 항상 촉촉하게 유지되어야 합니다. 대부분의 낙엽은 여성 복부 내부에 남아 있어야하며 주사를 위해 3-4 개만 노출됩니다. 바늘 선명도는 성공적인 주사를 위한 또 다른 중요한 결정 요인입니다. 뭉툭하거나 부러진 바늘 끝은 AC에 들어가기 전에 모델링 점토에 대해 낙엽을 반복적으로 찌르거나 압축하여 흡수율을 높일 수 있습니다. 따라서 잘 연마되고 날카로운 바늘은 항상 안전하게 보관해야하며 최대 2 명의 암컷 후에 교체해야합니다.
이 프로토콜은 렌티바이러스를 한 번 주사하여 신경판을 표적으로 삼는 방법을 설명합니다. 또한, 형질 도입 효능이 단일 세포 클론에서 전체 뇌로 어떻게 적응 될 수 있는지 보여줍니다. 그러나 피부와 구강 상피를 포함한 다른 비신경 조직도 표적화됩니다. 또한 모든 세포 유형(전구세포 및 분화된 세포)이 형질도입되어 이 접근 방식이 효율적이지만 비특이적입니다. 바이러스 구축물에서 MiniPromoters의 사용은 뉴런 또는 성상 세포15에서 전이 유전자의 특이적 발현을 유도한다. 이는 전용 Cre 형질전환 동물의 사용을 피할 수 있는 장점이 있으며, 따라서 노동량(균주 유지 및 유전형 분석)과 비용을 절감할 수 있다.
NEPTUNE의 한계에는 기술적 어려움, 예측 가능하고 일관된 속도로 임산부를 확보하는 데 따른 어려움, 특수 기기를 구입하는 비용이 포함됩니다. 또한, 렌티바이러스에 의한 세포의 비선택적 표적화는 이 기술의 이점이자 한계로 볼 수 있습니다. AC에 더 많은 부피를 주입하면 뇌전증13이 발생하지만, 여기에 설명된 부피로 뇌 기형과 뇌증은 피할 수 있습니다15. 따라서 뇌 발달에 부정적인 영향을 미치는 것은 배아 단계와 AC 크기에 맞는 정확한 양을 주입하여 조심스럽게 피해야하는 자궁 내 나노 주사의 위험입니다.
이 기술의 향후 적응은 바이러스 성 향성에 초점을 맞출 수 있습니다. 아데노 관련 바이러스(AAV)는 서로 다른 혈청형을 가지고 있으며, 이는 CNS17,26에서 다양한 세포 유형을 강력하게 표적으로 하는 것으로 나타났습니다. 그러나 AAV는 숙주 세포 게놈에 통합되지 않으므로 분열률이 높은 세포에서 손실 될 수 있습니다. NEPTUNE의 특이성을 높이는 방법에는 여러 가지가 있지만 형질전환 동물은 생체 내 유전자 조작과 관련하여 여전히 황금 표준입니다. Cas9 마우스 및 sgRNA-코딩 렌티바이러스는 배아 표피(27)에서 유전자 스크리닝을 위해 사용되었으며, 또한 발달 중인 CNS에 적응될 수 있다.
E7.5에서 AC로의 주사는 신경 형성을 시작하기 전에 신경 외배엽의 세포를 효율적으로 표적화하고 자궁 전기 천공보다 발달중인 뇌를 더 효율적으로 표적으로 삼습니다. 이를 통해 초기 시점부터 뇌 발달에 중요한 유전 적 단서를 연구 할 수 있습니다. 기존의 유전자 마우스 모델과 달리 NEPTUNE은 기능적 유전자 분석을 수행하기 위한 유연한 접근 방식을 제공합니다. 과발현 또는 유전자 결실에 따른 표현형은 수개월 또는 수년에 비해 며칠에서 몇 주 내에 연구할 수 있습니다. 여러 바이러스 구조의 주입은 하나의 배아 내에서 여러 유전자의 조작을 허용하고 이중 또는 삼중 녹아웃 동물의 생성을 방지합니다. 따라서 NEPTUNE은 시간을 절약할 뿐만 아니라 연구에 사용되는 동물의 수를 줄일 수 있습니다.
공개
저자는 경쟁 이익이 없다고 선언합니다.
감사의 말
우리는 쥐의 전문적인 보살핌에 대해 Bettina Semsch와 Jia Sun (Infinigene)에게 감사드립니다. Biomedicum Imaging Core (BIC)의 Florian Salomons와 Göran Månsson은 이미지 획득 및 상담에 대한 지원을 제공합니다. 기금 : 스웨덴 연구위원회, 카롤린스카 연구소 (KI 재단, 경력 개발 보조금, 박사 과정 학생 KID 기금 및 SFO StratNeuro 기금, 혁신 의학 센터), 올리와 엘로프 에릭슨 재단, 토른 스피란 재단, Jeansssons 재단, Sven and Ebba-Christina Hagbergs 상 및 연구 보조금, Knut and Alice Wallenberg Project Grant, Fredrik and Ingrid Thurings Foundation, Lars Hiertas Minne, The Childhood Cancer Foundation (Barncancerfonden), The Åhlen Foundation, Åke Wibergs Foundation, Tore Nilssons Foundation 및 Swedish Foundations Start Grant to ERA에 대한 보조금. 그림 4D, E 는 BioRender.com 로 작성되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | BD Bioscience | 309628 | |
| 27 G Needle | BD Bioscience | 300635 | |
| 3.5 inches capillaries | Drummond Scientific | 3000203G/X | Were used to pull in house needles |
| 70 MHz MS Series transducer | Visual Sonics | MS700 | |
| Aquasonic clear ultrasound gel | Parker Laboratories | Mar-50 | |
| Autoclip Applier 9 mm | Angthos | 12020-09 | |
| CD1 mice | Charles River, Germany | Crl:CD1(ICR) | Females: from age of 8 weeks old Males: from the age of 12 weeks old |
| Cotton Swab | OneMed Sverige AB | 120788 | |
| DPBS | Gibco | 14190094 | |
| Dressing forceps delicate straight 13 cm | Agnthos | 08-032-130 | |
| EG-400 Narishige Micropipette Grinder | Narishige | NA | |
| EZ clips 9 mm | Angthos | 59027 | clips |
| Iris Scissors, Super Cut, straight, 9 cm | Agnthos | 307-336-090 | |
| Isofluorane | Baxter Medical AB | EAN: 50085412586613 | Purchased from Swedish Pharmacy |
| Kimwipes | Kimberly Clarke | 7557 | |
| Membrane Tape | Visual Sonics | SA-11053 | |
| Micropipette Puller | Sutter Instrument | P-97 | |
| Modeling Clay | Sense AB | 10209 | |
| Mouse Handling Table | Visual Sonics | 50249 | |
| Nanoject II Auto Injector Kit | Drummond | 3-000-205A | |
| Parafilm | Bemis | HS234526C | |
| Petri dish with central opening (low wall) | Visual Sonics | SA-11620 | |
| Petri dish, (ØxH): 92 x 16 mm | Sarstedt | 82.1472.001 | |
| Rely+On Virkon | DuPont | 130000132037 | disinfectant |
| Silicone membrane | Visual Sonics | SA-11054 | |
| Steri 250, hot bead sterilizer | Angthos | 31100 | |
| Surgical Tape (1.25 cm x 9.14 m) | Medicarrier | 67034 | |
| Vevo Compact Dual (Med. Air & O2) Anesthesia System | Visual Sonics | VS-12055 | |
| Vevo Imaging Station 2 | Visual Sonics | VS-11983 | |
| Vevo2100 | Visual Sonics | VS-20047 | |
| Vicryl 6-0; C-3 needle, 45 cm purple filament | Agnthos | J384H |
참고문헌
- Theiler, K. . The House mouse. Atlas of embryonic development. , (1989).
- Barresi, M. J. F., Gilbert, S. F. . Developmental biology. , (2016).
- Taylor, J. C., et al. Factors influencing success of clinical genome sequencing across a broad spectrum of disorders. Nature Genetics. 47 (7), 717-726 (2015).
- Pizzo, L., et al. Rare variants in the genetic background modulate cognitive and developmental phenotypes in individuals carrying disease-associated variants. Genetics in Medicine. 21 (4), 816-825 (2019).
- Sakai, Y. Neurulation in the mouse: Manner and timing of neural tube closure. The Anatomical Record. 223 (2), 194-203 (1989).
- Schoenwolf, G. C. Shaping and bending of the avian neuroepithelium: Morphometric analyses. Developmental Biology. 109 (1), 127-139 (1985).
- Smith, J. L., Schoenwolf, G. C., Quan, J. Quantitative analyses of neuroepithelial cell shapes during bending of the mouse neural plate. Journal of Comparative Neurology. 342 (1), 144-151 (1994).
- Katahira, T., Nakamura, H. Gene silencing in chick embryos with a vector-based small interfering RNA system. Development Growth and Differentiation. 45 (4), 361-367 (2003).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. I. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochemical and Biophysical Research Communications. 230 (2), 376-380 (1997).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Beronja, S., Livshits, G., Williams, S., Fuchs, E. Rapid functional dissection of genetic networks via tissue-specific transduction and RNAi in mouse embryos. Nature Medicine. 16 (7), 821-827 (2010).
- Pierfelice, T. J., Gaiano, N. Ultrasound-guided microinjection into the mouse forebrain in utero at E9.5. Journal of Visualized Experiments JoVE. (45), e2047 (2010).
- Gaiano, N., Kohtz, J. D., Turnbull, D. H., Fishell, G. A method for rapid gain-of-function studies in the mouse embryonic nervous system. Nature Neuroscience. 2 (9), 812-819 (1999).
- Slevin, J. C., et al. High resolution ultrasound-guided microinjection for interventional studies of early embryonic and placental development in vivo in mice. BMC Developmental Biology. 6, 10 (2006).
- Mangold, K., et al. Highly efficient manipulation of nervous system gene expression with NEPTUNE. Cell Reports Methods. 1, 100043 (2021).
- Kameneva, P., et al. Single-cell transcriptomics of human embryos identifies multiple sympathoblast lineages with potential implications for neuroblastoma origin. Nature Genetics. 53 (5), 694-706 (2021).
- Kaiser, K., et al. MEIS-WNT5A axis regulates development of fourth ventricle choroid plexus. Development. 148 (10), (2021).
- Haddad, M. R., Donsante, A., Zerfas, P., Kaler, S. G. Fetal brain-directed AAV gene therapy results in rapid, robust, and persistent transduction of mouse choroid plexus epithelia. Molecular Therapy. Nucleic Acids. 2 (6), 101 (2013).
- Heavner, W., Pevny, L. Eye development and retinogenesis. Cold Spring Harbor Perspectives in Biology. 4 (12), 008391 (2012).
- Swamynathan, S. K. Ocular surface development and gene expression. Journal of Ophthalmology. 2013, 103947 (2013).
- Amano, O., Mizobe, K., Bando, Y., Sakiyama, K. Anatomy and histology of rodent and human major salivary glands: -overview of the Japan Salivary Gland Society-sponsored workshop. Acta Histochemica et Cytochemica. 45 (5), 241-250 (2012).
- Liu, H. X., Komatsu, Y., Mishina, Y., Mistretta, C. M. Neural crest contribution to lingual mesenchyme, epithelium and developing taste papillae and taste buds. Developmental Biology. 368 (2), 294-303 (2012).
- Marmigère, F., Ernfors, P. Specification and connectivity of neuronal subtypes in the sensory lineage. Nature Reviews. Neuroscience. 8 (2), 114-127 (2007).
- Zirlinger, M., Lo, L., McMahon, J., McMahon, A. P., Anderson, D. J. Transient expression of the bHLH factor neurogenin-2 marks a subpopulation of neural crest cells biased for a sensory but not a neuronal fate. Proceedings of the National Academy of Sciences of the United States of America. 99 (12), 8084-8089 (2002).
- Portales-Casamar, E., et al. A regulatory toolbox of MiniPromoters to drive selective expression in the brain. Proceedings of the National Academy of Sciences of the United States of America. 107 (38), 16589-16594 (2010).
- Tervo, D. G. R., et al. A designer AAV variant permits efficient retrograde access to projection neurons. Neuron. 92 (2), 372-382 (2016).
- Loganathan, S. K., et al. Rare driver mutations in head and neck squamous cell carcinomas converge on NOTCH signaling. Science. 367 (6483), 1264-1269 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유