Method Article
Murine Neural Plate Targeting by In Utero Nano-Injection (NEPTUNE) at Embryonic Day 7.5
In diesem Artikel
Zusammenfassung
In diesem Protokoll beschreiben wir, wie die Amnionhöhle der Maus bei E7.5 mit Lentivirus injiziert wird, was zu einer gleichmäßigen Transduktion der gesamten Neuralplatte führt, mit minimalen nachteiligen Auswirkungen auf das Überleben oder die Embryonalentwicklung.
Zusammenfassung
Die Manipulation der Genexpression im sich entwickelnden Mausgehirn in utero birgt großes Potenzial für funktionelle genetische Studien. Bisher war sie jedoch weitgehend auf die Manipulation embryonaler Stadien nach der Neurulation beschränkt. Es wurde ein Protokoll entwickelt, um die Fruchthöhle am Embryonaltag (E) 7,5 zu injizieren und Lentivirus zu liefern, das cDNA oder shRNA kodiert und auf >95% der Neuralplatten- und Neuralleistenzellen abzielt und zum zukünftigen Gehirn, Rückenmark und peripheren Nervensystem beiträgt. Dieses Protokoll beschreibt die Schritte, die notwendig sind, um eine erfolgreiche Transduktion zu erreichen, einschließlich des Schleifens der Glaskapillarnadeln, der Schwangerschaftsüberprüfung, des Entwicklungsstadiums mittels Ultraschallbildgebung und optimaler Injektionsvolumina, die auf die embryonalen Stadien abgestimmt sind.
Nach diesem Protokoll ist es möglich, eine Transduktion von >95% des sich entwickelnden Gehirns mit dem Lentivirus mit hohem Titer zu erreichen und somit eine genetische Manipulation des gesamten Gehirns durchzuführen. Im Gegensatz dazu ist es möglich, eine Mosaiktransduktion mit niedrigeren Virustitern zu erreichen, was ein genetisches Screening oder eine Abstammungsverfolgung ermöglicht. Die Injektion bei E7.5 zielt auch auf Ektoderm und Neuralleiste ab und trägt zu unterschiedlichen Kompartimenten des Auges, der Zunge und des peripheren Nervensystems bei. Diese Technik bietet somit die Möglichkeit, die Genexpression in neuronalen Platten- und Ektoderm-abgeleiteten Geweben der Maus aus Präneurulationsstadien zu manipulieren, mit dem Vorteil, die Anzahl der in Experimenten verwendeten Mäuse zu reduzieren.
Einleitung
Gehirn und Rückenmark gehören zu den ersten Organen, die während der Embryogenese mit der Bildung beginnen 1,2. Obwohl die mit neurologischen Entwicklungsstörungen assoziierten Gene identifiziert werden, hinkt die funktionelle Abfrage genetischer Varianten hinterher 3,4. Da die Erzeugung von bedingten Knockout-Mäusen Monate oder Jahre dauern kann, ist eine alternative Technik zur schnellen Untersuchung der Genfunktion im sich entwickelnden Gehirn von Interesse. Bei Mausembryonen tritt die Neurulation - der morphogenetische Prozess, bei dem sich die Neuralplatte in das Neuralrohr umwandelt, um das zentrale Nervensystem (ZNS) hervorzubringen - zwischen den Tagen 8 und 10 nach der Empfängnis5 statt. Vor Beginn der Neurulation besteht die Neuralplatte als Teil des Ektoderms aus einer einzigen Schicht säulenförmiger Zellen, die sich vermehren und in die zahlreichen neuronalen und Gliazelltypen innerhalb des ZNS 6,7 differenzieren. Um experimentell lang anhaltende Veränderungen der Genexpression im ZNS zu induzieren, bietet das Targeting der Neuralplatte offensichtliche Vorteile, einschließlich der Zugänglichkeit aller Vorläuferzellen.
In den Neurowissenschaften wurden in der Ovo-Elektroporation 8,9 und die virale Transduktion von Mausembryonen verwendet, um die embryonale ZNS-Genexpression zu manipulieren. Der sich entwickelnde Hühnerembryo war aufgrund der Zugänglichkeit des Hühnerembryos im Ei und der daraus resultierenden Leichtigkeit der Manipulation der Genexpression ein Modell der Wahl für die Untersuchung der Genfunktion während der Rückenmarksentwicklung. Insbesondere im Ovo-Plasmid erzeugt die Elektroporation experimentelle und Kontrollbedingungen in jedem Kükenrückenmark. Die Elektroporation bewirkt eine Permeabilisierung der Zellmembran und leitet negativ geladene DNA von der (negativen) Kathode weg zur (positiven) Anode, indem ein elektrischer Impuls über zwei Elektroden an den Embryo angelegt wird. Bei Mäusen war die In-utero-Elektroporation im Allgemeinen auf embryonale Stadien beschränkt, in denen die Neurulation abgeschlossen ist, und das Gehirn oder Rückenmark besteht bereits aus mehreren Zellschichten, was zu einer geringen Elektroporationseffizienz führt10. Die Plasmidelektroporation führt zu einer vorübergehenden Genexpression und zielt im Allgemeinen auf wenige Zellen ab.
Ultraschallgesteuerte Mikroinjektion in utero wurde verwendet, um verschiedene embryonale Strukturen wie Haut und Gehirn zu manipulieren11,12,13,14. Injektionen, die auf das sich entwickelnde murine ZNS abzielen, haben jedoch eine geringe Wirksamkeit gezeigt oder das embryonale Überleben negativ beeinflusst12,13,14. Daher wurde ein verbessertes Protokoll für die Abgabe von Lentivirus mit hohem Titer in die Fruchthöhle (AC) bei E7,5 entwickelt, das als NEPTUNE für neural plate targeting with in uteronano-injection15 bezeichnet wurde. Die Injektionen führten zu einer lang anhaltenden Targeting-Wirksamkeit von >95% des gesamten Gehirns bei E13,5. Darüber hinaus wurde während der Ultraschallüberprüfung der Schwangerschaft ein Staging-Schritt eingeführt, um Frauen und Schwangerschaften nach Entwicklungsstadien zu sortieren, um unnötige Eingriffe an Versuchstieren zu minimieren und den Injektionserfolg zu maximieren. Injektionseffizienz und Überleben sind eng mit der Zunahme der AC-Größe verbunden. Daher beschreibt dieser Artikel, wie die AC-Größe vor der Injektion gemessen wird, um ein geeignetes Volumen an das AC abzugeben, das keine Resorption des Embryos verursacht. NEPTUNE ist eine robuste Alternative zu aktuellen In-utero-Ansätzen und kann für verschiedene Anwendungen angepasst werden, einschließlich, aber nicht beschränkt auf Studien zum Gewinn und Verlust von Funktionen, Linienverfolgung oder Screening15,16.
Protokoll
CD1-Wildtyp-Mäuse wurden nach europäischen Vorschriften untergebracht, mit einem Standard-Tag-Nacht-Zyklus mit Nahrung und Wasser ad libitum. CD1-Weibchen wurden über Nacht mit CD1-Männchen verpaart, und Vaginalpfropfen wurden morgens überprüft (E0.3). Für die Injektion wurden nur schwangere Weibchen verwendet. Die ethische Genehmigung für alle hier beschriebenen Experimente wurde vom schwedischen Landwirtschaftsamt (Jordbruksverket) erteilt.
1. Vorbereitung von Glasnadeln: Nadelziehen und Schleifen
HINWEIS: Obwohl vorgeschliffene Nadeln gekauft werden können, ermöglicht das Ziehen von Nadeln im eigenen Haus eine einfache Einstellung von Nadellänge, Bohrung und Fasenwinkel.
- Montieren Sie eine Glaskapillare in die Mikropipette/den Kapillarzieher. Verwenden Sie die folgenden Einstellungen mit der angegebenen Ausrüstung (siehe Materialtabelle): 580 Einheiten erhitzen; Geschwindigkeit 140 Einheiten; Zeit 200 Einheiten; Druck 500-800 Einheiten.
HINWEIS: Die Einheiten der verschiedenen Parameter werden durch den Kapillarabzieher definiert. Die Einheiten können je nach Ausstattung variieren. - Drücken Sie Pull, um die Kapillare auseinander zu ziehen, wodurch zwei Glaskapillaren mit konischen Enden entstehen.
HINWEIS: Nach dem Ziehen sind die Spitzen der beiden Glaskapillaren aufgrund der hohen Temperatur des Mikropipettenziehers verschlossen. - Schneiden Sie die Spitze mit einer chirurgischen Schere ab, um eine Nadellänge von ~7 mm zu erhalten (gemessen von der Stelle, an der die Nadel beginnt, sich zu verjüngen) (Abbildung 1A).
HINWEIS: Bei E7.5-Injektionen ist eine lange und feine Nadel kritisch, da der Injektionsbereich sehr klein und empfindlich ist. Kurze und breite Nadeln führen zum Tod von Embryonen. - Schleifen Sie die geschnittene Nadelspitze, um eine scharfe Abschrägung zu erzeugen (Abbildung 1C-F).
- Schleifen Sie die Nadel in einem Winkel von 20° bei maximaler Geschwindigkeit für mindestens 30-45 min.
HINWEIS: Reinstwasser wird der Schleifplatte zugegeben, um als Schmiermittel zu wirken, Reibung/Temperatur zu reduzieren und Glaspartikel wegzuwaschen (Abbildung 1B). Überschüssige Flüssigkeit kann die Mühle jedoch verlangsamen. - Stellen Sie sicher, dass die Nadelspitze (Abbildung 1C) die Oberfläche der Schleifplatte berührt (Abbildung 1D), sich aber nicht verbiegt (Abbildung 1E).
HINWEIS: Beim gebogenen Schleifen kommt es zu einer langen und zerbrechlichen Nadelspitze mit einem falschen Fasenwinkel, die beim Einspritzen leicht brechen kann. Brechende Nadeln können den Embryo schädigen und müssen durch eine intakte Nadel ersetzt werden. Eine korrekt geschliffene Spitze ist in Abbildung 1F,G dargestellt. Nach dem Schleifen wird erwartet, dass die resultierende Nadelbohrung einen Innendurchmesser (ID) von ~15 μm und einen Außendurchmesser (OD) von ~35 μm hat (Abbildung 1G).
- Schleifen Sie die Nadel in einem Winkel von 20° bei maximaler Geschwindigkeit für mindestens 30-45 min.
- Füllen Sie eine 1 ml Spritze mit Mineralöl und befestigen Sie eine 27 G Nadel.
- Entfernen Sie die Nadelkappe und führen Sie die Spritzennadel in die neu geschliffene Glaskapillare ein. Injizieren Sie Mineralöl, bis Öl aus der Kapillarspitze tropft. Setzen Sie die Injektion fort, während Sie die 27 G-Nadel zurückziehen, bis die Kapillarnadel mit Mineralöl gefüllt ist, wonach die Spritzennadel entfernt werden kann.
- Lagern Sie gemahlene und mit Mineralöl gefüllte Nadeln in einer geschlossenen Umgebung, um Schäden und Staubansammlungen zu vermeiden. Legen Sie zur Lagerung zwei Rollen Modelliermasse in eine normale Petrischale, die als Halter dienen (Abbildung 1H). Setzen Sie die Nadeln vorsichtig auf den Ton und platzieren Sie sie weit auseinander, um die Nadeln leicht zu entnehmen.
HINWEIS: Da die Nadelvorbereitung zeitaufwendig ist, ist es am besten, Nadeln mindestens einen Tag vor der Injektion vorzubereiten. Entsorgen Sie die Nadeln nach maximal zwei Würfen, da sie stumpf werden. Bereiten Sie immer Backup-Nadeln für den Fall von Nadelschäden während der Vorbereitung oder Injektion vor.
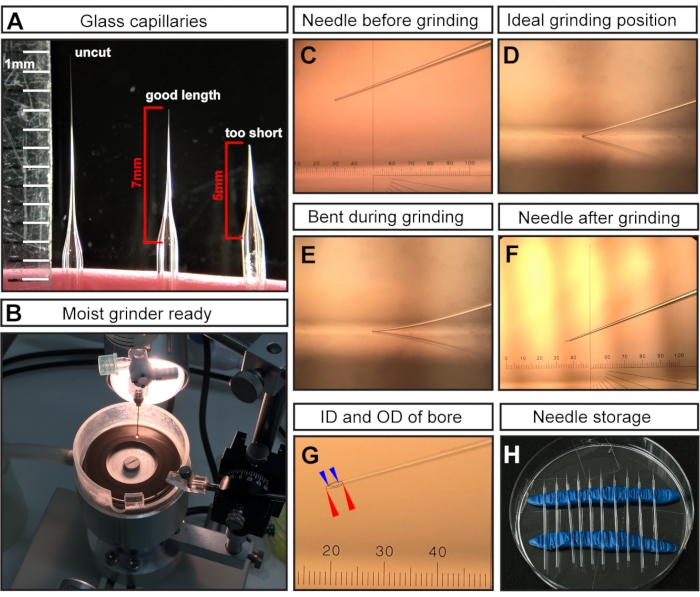
Abbildung 1: Nadelvorbereitung für E7.5-Amnionhöhleninjektionen. (A) Repräsentative Beispiele für eine gezogene, aber ungeschnittene Glaskapillarnadel (links), eine Kapillarnadel, die in der optimalen Länge für E7.5-Injektionen geschnitten wurde (Mitte) und eine zu kurz geschnittene Kapillare (rechts). (B) Die Mühle mit gleichmäßiger Wasserabdeckung, die zum Nadelschleifen bereit ist. (C-F) Repräsentative Beispiele für verschiedene Nadelspitzen. (C) Geschnittene, aber ungeschliffene Nadelspitze in Mühle montiert; (D) ideale Schleifposition, bei der die Nadelspitze nur die Mühle berührt; (E) Nadel zu weit abgesenkt und sich während des Schleifvorgangs biegen; (F) eine ideale geschliffene Nadelspitze für E7.5 AC-Injektionen. (G) Eine geschliffene Nadelspitze mit der Bohrung mit einem Innendurchmesser von ~15 μm und einem Außendurchmesser von ~35 μm, die für die E7,5 AC-Einspritzung geeignet ist. Die Nadelbohrung ist als gestrichelte Linien dargestellt. Außendurchmesser mit roten Pfeilspitzen gekennzeichnet; Innendurchmesser mit blauen Pfeilspitzen gekennzeichnet. (H) Nadellagerung: Petrischale gefüllt mit gezogenen und gemahlenen Nadeln. Zwei Reihen Modelliermasse dienen als Halter. HINWEIS: Für das Augenmikrometer in C, F, G ist 1 cm in 100 Tonhöhen unterteilt; das Ziel ist 3x; Daher ≈ 1 Tonhöhe = 10.000 μm/(100 × 3) 33,4 μm. Abkürzungen: AC = Fruchthöhle; ID = Innendurchmesser; OD = Außendurchmesser. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. Tag vor der Injektion: Bereiten Sie die Bank für die Ultraschallüberprüfung der Schwangerschaft vor
HINWEIS: Alle Arbeiten sollten bei der Arbeit mit Lentivirus in einer belüfteten Laborbank der Biosicherheitsstufe 2 (BSL 2) durchgeführt werden. Die Ultraschallprüfung der Schwangerschaft kann auf einer belüfteten Bank durchgeführt werden.
- Schalten Sie das Ultraschallgerät, den Heiztisch und dieO2-Versorgung für die Isofluranpumpe ein (kann je nach Gerät variieren).
HINWEIS: Überprüfen Sie das Isofluran-System, um sicherzustellen, dass kein Isofluran in die Luft gelangt. - Legen Sie einen leeren Abfallbeutel (an die Innenwand geklebt für einfachen Zugriff), Haarentfernungscreme, steril verpackte Wattestäbchen, Wasser, Seidenpapier und chirurgisches Klebeband in die BSL 2-Bank.
- Bereiten Sie vier Stücke chirurgisches Klebeband (~ 7 cm lang) vor, um die Mausgliedmaßen während der Ultraschalluntersuchung der Schwangerschaft zu sichern.
3. Ultraschalluntersuchung zur Bestätigung der Schwangerschaft
HINWEIS: Dieser Schritt kann am Tag vor den E7.5-Injektionen bei E6.5 durchgeführt werden. Siehe die Diskussion für Details zur Überprüfung des Gestationsalters.
- Legen Sie die zeitgepaarte weibliche Maus in die Induktionskammer.
- Schalten Sie den Gasstrom mit einem Sauerstofffluss von ~ 2,1 LPM und einer Anfangsdosis von 3-4% Isofluran ein, um eine Anästhesie zu induzieren.
- Stellen Sie sicher, dass das Weibchen vollständig betäubt ist, indem Sie den Pfotenreflex überprüfen. Wenn der Pfotenreflex fehlt, senken Sie Isofluran auf 1,5-2%.
HINWEIS: Es dauert ungefähr 3 Minuten, um eine Anästhesie einzuleiten. - Schalten Sie den Gasstrom von der Induktionskammer auf den Heiztischnasenkonus.
- Stellen Sie die anästhesierte Frau in Rückenlage (Bauch nach oben) auf den Heiztisch und legen Sie die Schnauze in den angebrachten Nasenkegel, um die Aufrechterhaltung der Anästhesie während der Ultraschalluntersuchung der Schwangerschaft sicherzustellen.
- Befestigen Sie alle vier Pfoten mit den vorbereiteten chirurgischen Bandstücken am Tisch, ohne den Körper der Frau zu dehnen oder die Schnurrhaare einzuklemmen.
- Tragen Sie eine erbsengroße Menge Haarentfernungscreme auf den Unterbauch auf. Verteilen Sie die Creme mit einem Wattestäbchen über den Unterbauch (ein Quadrat ~ 3 x 3 cm) und massieren Sie sie sanft ein, indem Sie das Wattestäbchen hin und her rollen.
- Sobald sich das Fell von der Haut löst, befeuchten Sie ein Seidenpapier und entfernen Sie die Creme und das Fell. Reinigen Sie den entpelzten Bereich mit feuchtem Seidenpapier, bis alle Cremes und Haare verschwunden sind. Trocknen Sie die Haut.
- Tragen Sie eine pflaumengroße Menge Ultraschallgel auf den rasierten Bereich auf und fahren Sie fort, die Gebärmutter mit Ultraschall durch einen der folgenden drei Ansätze zu identifizieren.
- Um dies manuell zu tun, halten Sie die Ultraschallsonde in das Ultraschallgel und bewegen Sie die Sonde, um die Gebärmutter zu finden.
- Für den halbmanuellen Ansatz #1 positionieren Sie die Ultraschallsonde (am Geländersystem befestigt) über dem weiblichen Bauch, indem Sie einen Teil der Schiene entlang der x-Ebene lösen und bewegen. Senken Sie die Ultraschallsonde in das Gel (z-Ebene) und scannen Sie durch den Unterbauch (Y-Ebene) (Abbildung 2A).
- Für den halbmanuellen Ansatz #2 senken Sie die Ultraschallsonde (am Geländersystem befestigt) in das Gel, um den Unterbauch abzubilden. Lassen Sie die Ultraschallsonde während des Prozesses stationär und bewegen Sie den Heiztisch mit den angebrachten Rädern entlang der x- und/oder y-Ebene (Abbildung 2B).
HINWEIS: In diesen frühen embryonalen Stadien können innere Organe, z. B. der Darm, in der Ultraschallbildgebung dem Uterus ähnlich erscheinen. Während Embryonen und Decidua jedoch als eine Abfolge von Kugeln erscheinen (ähnlich wie Perlen entlang einer Halskette), hat der Darm das Aussehen einer durchgehenden Röhre. Die Konnektivität von luminalen Räumen (separate Kugeln vs. eine durchgehende Röhre) kann durch Hin- und Herscannen der interessierenden Struktur beurteilt werden, um festzustellen, ob es sich bei der Struktur um eine diskrete Kugel (Embryo/Decidua) oder eine kontinuierliche Röhre (Darm) handelt (Abbildung 2D). In diesem Stadium ist es nicht notwendig, die Anzahl der Embryonen aufzuzeichnen; Es genügt, ihre Anwesenheit oder Abwesenheit zu bestätigen.
- Sobald der Schwangerschaftsstatus festgestellt ist, heben Sie die Ultraschallsonde vom Bauch weg und wischen Sie den Unterbauch mit feuchtem Seidenpapier ab, um das Ultraschallgel zu entfernen.
- Schalten Sie die Isofluranpumpe aus und entfernen Sie das OP-Band, um die Pfoten freizugeben.
- Setzen Sie das Weibchen in Bauchlage (Bauch nach unten) in einen sauberen Käfig auf einer 40 °C heißen Heizplatte. Halten Sie das Weibchen unter genauer Beobachtung, bis es das Bewusstsein wiedererlangt, was 2-6 Minuten dauert.
HINWEIS: Stellen Sie sicher, dass die Ultraschalluntersuchung für eine Frau <10 Minuten beträgt, um die Exposition gegenüber Isofluran zu minimieren. - Entfernen Sie alle Materialien und Abfälle und reinigen Sie alle Oberflächen mit 70% Ethanol. Wischen Sie übrig gebliebenes Ultraschallgel von der Ultraschallsonde mit einem trockenen, weichen und fusselfreien Papiertuch ab. Schalten Sie das Ultraschallgerät, die belüftete Bank / BSL2-Bank, den Heiztisch und dieO2-Versorgung aus.
4. Ultraschalluntersuchung für das Staging des Embryos
HINWEIS: Dieser Schritt wird vor der Operation durchgeführt und dient dazu, die schwangeren Frauen nach ihrer AC-Größe zu stratifizieren. Dieser Schritt ist bei E7.5 von entscheidender Bedeutung, wenn es darum geht, das sich entwickelnde ZNS anzusprechen. In diesem frühen Stadium der Entwicklung beeinflusst ein Unterschied von einigen Stunden in der Entwicklung signifikant die Größe des AC und das Fortschreiten der Neurulation.
- Betäuben Sie die erste trächtige weibliche Maus gemäß den Schritten in den Schritten 3.1-3.5.
- Legen und fixieren Sie die Frau wie in Schritt 3.6 beschrieben auf dem Tisch.
- Tragen Sie eine pflaumengroße Menge Ultraschallgel auf den rasierten Bauch auf und senken Sie die Ultraschallsonde, um den Unterbauch der Frau abzubilden.
HINWEIS: Bei diesem Schritt wird davon ausgegangen, dass das Weibchen am Vortag per Ultraschall auf Schwangerschaft untersucht wurde und bereits Fell am Bauch entfernt wurde. Ist dies nicht der Fall, muss das Fell vor der Zugabe von Ultraschallgel gemäß den Schritten 3.7-3.8 entfernt werden. Bei E7.5 sind der Uterus und die Deziduas größer und leichter von inneren Organen zu unterscheiden. Zudem ist der AC größer und kann von der Exozelomhöhle (ExC) unterschieden werden. - Scannen Sie die linken und rechten Gebärmutterhörner so vollständig wie möglich.
HINWEIS: Einige Embryonen liegen tiefer im Körper des Weibchens und können übersehen werden. - Notieren Sie die Anzahl und Stadien der Embryonen. Notieren Sie sich die Anzahl der Fruchtwasserhohlräume idealer Größe, akzeptabler Hohlräume und Deziduas ohne Hohlraum (Abbildung 2E-G).
- Inszenieren Sie alle Schwangerschaften und ordnen Sie sie entsprechend.
- Injizieren Sie den Frauen unmittelbar nach der Ultraschalluntersuchung (Schritt 4.4) die Mehrheit der ACs in idealer Größe, indem Sie den Anweisungen in den Schritten 4.5-4.7 folgen.
- Bei Frauen mit einer Mehrheit akzeptabler (bei denen die exocelomischen und Fruchtwasserhöhlen noch nicht eindeutig in zwei Hohlräume unterteilt sind) oder fehlenden Hohlräumen, verschieben Sie die Injektion und inszenieren Sie sie nach einigen Stunden erneut. Wenn die meisten Hohlräume noch zu klein sind, verschieben Sie die Injektionen um 10-12 h.
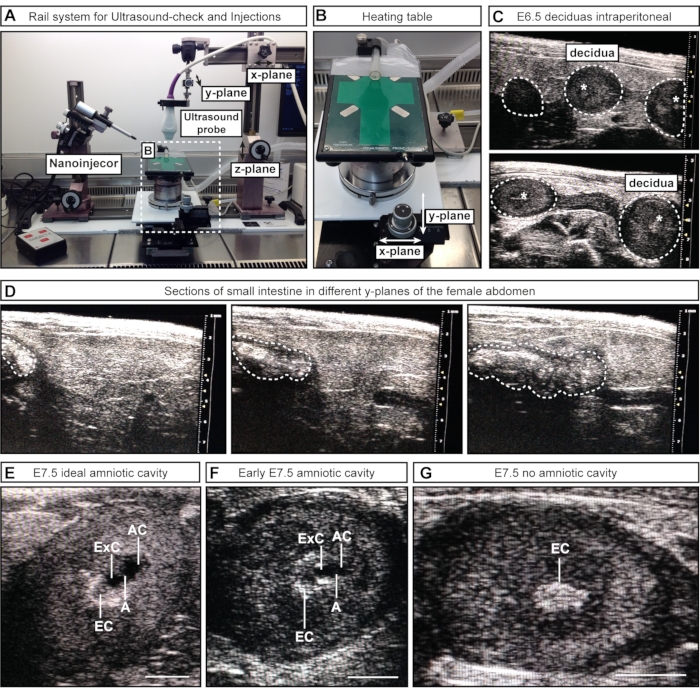
Abbildung 2: Inspektion und Staging von Fruchtwasserhohlräumen während der Ultraschalluntersuchung. (A) Überblick über das Schienensystem mit angeschlossener Ultraschallsonde, Nanoinjektor und Heiztisch. Die Ultraschallsonde kann in x-, y- und z-Ebenen bewegt werden, um eine optimale Ausrichtung auf den weiblichen Bauch oder die ACs zu erreichen. (B) Der Heiztisch kann über zwei Räder in x- und/oder y-Ebenen bewegt werden, um ein präzises Scannen und Beurteilen der ACs zu ermöglichen, während die Ultraschallsonde statisch bleiben kann. (C) Repräsentative Ultraschallbilder von E6,5-Deziduas im weiblichen Bauch während der Ultraschalluntersuchung zur Bestätigung der Schwangerschaft (weiß gepunktete Umrisse). Zu diesem Zeitpunkt haben sich keine Hohlräume gebildet; Manchmal ist jedoch der ektoplazentare Kegel (weiße Sternchen) sichtbar. Deziduas sind an ihrer kugelförmigen Form zu erkennen und vom Darm zu unterscheiden, der als eine durchgehende Röhre erscheint. (D) Repräsentative Bildsequenz des Dünndarms (weiß gepunktete Umrisse), die kontinuierlich durch den Unterbauch gescannt wird. (E-G) Repräsentative Ultraschallbilder während der Kavitäteninszenierung vor E7.5-Injektionen. Die Amnion- und Exozelomhöhle haben sich gebildet und sind durch das Amnion getrennt. Der ektoplazentare Kegel dient als Hauptblutversorgung und erscheint als heller Fleck im Ultraschall. Der AC ist am meisten distal vom ektoplazentaren Kegel. (E) Idealgroße ACs erscheinen größer als die exocelomische Höhle, während mittelgroße Hohlräume kleiner erscheinen (F). Wenn keine Hohlräume sichtbar sind (G), bedeutet dies, dass der Embryo entweder resorbiert ist oder E7.5 noch nicht erreicht hat. Maßstabsbalken = 1 mm. Abkürzungen: A = Amnion; AC = Fruchthöhle; ExC = Exozelom-Hohlraum; EC = Ektoplazenta-Kegel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
5. Tag der Injektion: Bereiten Sie die BSL2-Bank für die Operation vor
- Kleben Sie ein Stück elastische Membran auf die runde, zentrale Öffnung einer handelsüblichen, modifizierten Petrischale. Stellen Sie sicher, dass die Membran gut mit der Petrischale verbunden ist, um ein Auslaufen zu vermeiden.
HINWEIS: Wenn die Schale undicht wird oder nicht gut verklebt ist, können die Kanten der elastischen Membran mit Klebeband weiter gesichert werden. - Machen Sie einen 1-1,5 cm langen Schnitt in der Mitte der elastischen Membran.
- Ultraschallgerät, BSL2-Bank, Heizplatte,O2-Versorgung für die Isofluranpumpe und Glasperlensterilisator (auf 300 °C eingestellt) einschalten.
- Legen Sie einen leeren Abfallbeutel in die BSL2-Bank (für einfachen Zugang an die Innenwand geklebt); steril verpackte Wattestäbchen (verwenden Sie ein neues für jede Operation/jede Frau); chirurgische Instrumente (Schere, Pinzette, Clips, Naht) und chirurgisches Klebeband; eine volle Flasche phosphatgepufferte Kochsalzlösung (PBS), eine leere Flasche für die Abfallsammlung und eine 25-ml-Pipette; eine Petrischale mit elastischer Membran für die Operation; der Deckel der Petrischale mit einem 2 x 2-3 x 3 cm großen Stück Parafilm, das mit einem Wassertropfen am Deckel befestigt ist; Modelliermasse: 4 größere Kugeln oder Würfel (~3 x 3 x 3 cm3 ) und ein zylindrisches Stück (~4 x 1 cm); eine Spritze mit Analgetikum (z. B. Buprenorfin, 0,05-0,1 mg / kg Körpergewicht) und AugengelHINWEIS: Die Kugeln (oder Würfel) aus Modelliermasse dienen als "Füße" oder Ständer / Halter für die Petrischale, sobald die Schale auf den Bauch der Frau gelegt wird. Das zylindrische Stück Ton sichert die Embryonen im Inneren der Schale. Wenn mehr als eine Lösung injiziert wird oder die Nadel während der Injektionen nachgefüllt werden muss, kann dasselbe Stück Parafilm verwendet werden, wenn die Lösungen voneinander entfernt werden können.
6. Nadelbelastung
- Wischen Sie überschüssiges Mineralöl mit Seidenpapier ab, um einen besseren Halt zu erhalten.
HINWEIS: Reinigen Sie immer von der Spitze weg, um Schäden oder Verletzungen zu vermeiden. - Stellen Sie sicher, dass alle Komponenten (ein Dichtungs-O-Ring, ein Abstandshalter und eine vordere Dichtung – alle unter der Spannzange untergebracht, Abbildung 3A) in der richtigen Ausrichtung installiert sind (Abbildung 3B, Spannzange zur Visualisierung entfernt), um die Kapillarnadel an Ort und Stelle zu halten und eine luftdichte Verbindung herzustellen, um die Bildung von Blasen beim Vorschieben oder Zurückziehen des Metallkolbens in der Nadel zu vermeiden.
- Stellen Sie sicher, dass der Metallkolben des Nanoinjektors vollständig eingezogen ist. Überprüfen Sie, indem Sie Fill (Füllen) drücken , und warten Sie, bis ein doppelter Signalton angezeigt wird, der anzeigt, dass der Kolben vollständig eingezogen ist.
- Schieben Sie die Glasnadel bei befestigter, aber leicht gelöster Spannzange (45-90 Grad abgeschraubt) auf den Metallkolben und drücken Sie die Kapillarnadel zusammen mit dem Metallkolben durch die vordere Dichtung, bis sie den Abstandshalter erreicht (Abbildung 3C, D, Spannzange zur Visualisierung entfernt).
HINWEIS: Ein gewisser Widerstand tritt auf, wenn der Kolben durch die Dichtung verläuft, und nimmt ab, wenn er den Abstandhalter erreicht. Stellen Sie sicher, dass die Kapillarnadel fest in den Abstandshalter eingeführt ist, um eine luftdichte Verbindung herzustellen (Abbildung 3D). - Sichern Sie die Nadel, indem Sie die Spannzange des Nanoinjektors festziehen (sicher wieder anschrauben).
HINWEIS: Nicht zu fest anziehen, da dies die Nadel zerquetschen kann. - Drücken Sie Leer, um den Kolben in die Nadel zu drücken und das Öl aus der Nadelspitze zu entfernen. Wenn sich die Glasnadel bewegt, ziehen Sie den Kolben zurück, entfernen Sie die Nadel und laden Sie sie neu. Wenn sich dadurch Luftblasen bilden, entfernen Sie die Nadel und füllen Sie sie mit Mineralöl nach.
HINWEIS: Eine ordnungsgemäß gesicherte Nadel sollte sich nicht mit dem Kolben bewegen. - Einen Tropfen des Virus (~ 6 μL) oder einer anderen Injektionslösung auf ein Stück Parafilm1 geben (Abbildung 3E; Evans blauer Farbstoff wird für Visualisierungszwecke verwendet).
HINWEIS: Das maximale Volumen des Nanoinjektors beträgt ~5 μL. - Drücken Sie Fill, um eine Luftblase zu erzeugen, die als Trennlinie zwischen Öl und Lösung dient (Abbildung 3F).
HINWEIS: Dies dient auch als Positionierungsmarkierung beim Befüllen oder Entleeren der Nadel. - Senken Sie die Nadel, tauchen Sie die Spitze in die Lösung, und drücken Sie Fill (Füllen) (Abbildung 3F,G).
- Beobachten Sie den Flüssigkeitsstand, während die Lösung nach der Luftblase geladen wird. Drücken Sie Leer , um die Verstopfung zu entfernen, und laden Sie sie neu, indem Sie Fill (Füllen ) drücken, wenn sich die Luftblase verlängert, ohne dass die Flüssigkeit in die Nadel gelangt. Wenn das Problem dadurch nicht behoben wird, wechseln Sie die Nadel.
- Wenn die Nadel voll geladen ist (Abbildung 3H), heben Sie die Nadel in der Z-Ebene an und saugen Sie eine kleine Luftmenge an der Spitze ab, um eine Verdunstung der Lösung an der Nadelspitze und ein Verstopfen der Nadel zu verhindern.
- Drehen Sie den Nanoinjektor mit der angebrachten Nadel vom Bediener weg zur Rückseite der Bank, um versehentliche Schäden oder Verletzungen zu vermeiden.

Abbildung 3: Anbringen der Nadel am Nanoinjektor und Beladung der Lösung. (A) Ausgangsposition, bevor die Nadel auf den Nanoinjektor montiert wird: Metallkolben vollständig eingefahren und Spannzange befestigt. (B) Unter der Spannzange sind alle drei Komponenten zum Halten und Sichern der Nadel in der richtigen Reihenfolge (von links nach rechts) dargestellt: Dichtungs-O-Ring (dünn und schwarz), Abstandshalter (weiß), O-Ring (schwarz) mit großem Loch (durch das die Nadel hindurchgehen muss). Um eine luftdichte Verbindung zu gewährleisten, wird die Glasnadel über den Metallkolben (C) geschoben und durch die Öffnung des vorderen O-Rings geschoben, bis sie den Abstandshalter (D) erreicht. (E-H) Laden der Lösung in die Nadel. (E) Ein Tropfen Lösung wird auf ein Stück Parafilm auf einem Plattendeckel gegeben. (F) Erzeugen Sie eine Luftblase, indem Sie vor dem Laden der Lösung auf Fill drücken und die Nadelspitze in die Lösung eintauchen. (G) Die Lösung wird in die Nadel geladen. (H) Die Lösung wird in die Nadel geladen. HINWEIS: Die Spannzange wurde zur Visualisierung in (B-D) entfernt, sollte aber während der Experimente angebracht bleiben. Der letzte Schritt zur Sicherung der Nadel ist das Festziehen der Spannzange. Evans blauer Farbstoff wird für die Visualisierung in E-H verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
7. Injektionen
HINWEIS: Alle Instrumente, die bei diesem Verfahren verwendet werden, werden vor der Operation und zwischen jeder Maus sterilisiert.
- Betäuben Sie das erste Weibchen mit ideal großen Karies (siehe Abschnitt 4).
- Legen und fixieren Sie das Weibchen auf dem Tisch, wie in den Schritten 3.1-3.6 beschrieben.
- Tragen Sie Augengel auf die Augen auf, um das Austrocknen der Hornhaut zu verhindern, und injizieren Sie Schmerzmittel subkutan.
HINWEIS: Empfohlene Analgetika: Buprenorphin (0,05-0,1 mg/kg Körpergewicht) oder Flunixin (2,5 mg/kg) oder ähnliches gemäß den örtlichen Tierschutzbestimmungen. Die multimodale perioperative Analgesie wird mit injizierten Analgetika und Isofluran aufrechterhalten. - Bereiten Sie den Unterbauch aseptisch vor, indem Sie ihn mit einem mit 0,5 mg / ml Chlorhexidinlösung (oder ähnlichem) getränkten Tuch abwischen und die Haut trocknen. Verwenden Sie eine chirurgische Schere, um einen 1,5-2,0 cm vertikalen Mittellinienschnitt im Unterbauch zu machen.
HINWEIS: Bereiten Sie den Operationsbereich nach lokal genehmigten Desinfektionsroutinen vor. - Heben Sie die Haut sanft an und befreien Sie die Haut von der darunter liegenden Muskelschicht, ca. 1 cm um den Schnittpunkt, um das Nähen nach der Operation zu erleichtern.
- Machen Sie einen 1 cm vertikalen Mittellinienschnitt in die Muskelschicht.
- Heben Sie mit einer Pinzette eine Seite der Haut und der Muskelschicht an und suchen Sie mit dem anderen Paar nach den Gebärmutterhörnern.
HINWEIS: Die Deziduas sind wie Perlen an einer Halskette angeordnet, während der Darm eine lange, durchgehende Röhre ist (Abbildung 4A). - Ziehen Sie mit einer Pinzette vorsichtig beide Gebärmutterhörner aus dem Bauch. Halten Sie das Gewebe zwischen den Embryonen; Drücken Sie sie nicht direkt zusammen (Abbildung 4B).
HINWEIS: Die Gebärmutter ist am Gebärmutterhals am Körper befestigt, und die beiden Eierstöcke / Eileiter sind über Bänder befestigt. Ziehen / lösen Sie die Gebärmutter nicht von diesen Ankerpunkten. - Zählen und notieren Sie die Anzahl der Embryonen auf der linken und rechten Seite.
- Nummerieren Sie die Embryonen entweder vom Eierstock bis zum Gebärmutterhals oder vom Gebärmutterhals bis zum Eierstock.
HINWEIS: Dies ist besonders wichtig, wenn injizierte Embryonen in embryonalen Stadien entnommen werden. - Drücken Sie mit einem feuchten Wattestäbchen alle Embryonen vorsichtig zurück in die Bauchhöhle, mit Ausnahme der ersten drei, die injiziert werden sollen.
- Geben Sie einen Tropfen PBS auf das Gummiband in der Petrischale und halten Sie es unmittelbar über die Embryonen.
- Führen Sie geschlossene Pinzetten in den Schnitt des Gummis ein und lassen Sie die Pinzette los, um den elastischen Schnitt zu öffnen, so dass die Flüssigkeit auf die Embryonen fällt.
HINWEIS: Dies gewährleistet die Rehydratation der Embryonen und dass die elastische Membran an der nassen Haut des Weibchens haftet, wodurch das Austreten von PBS in den nächsten Schritten verhindert wird. - Ziehen Sie einen Abschnitt der Gebärmutter, der drei Embryonen entspricht, mit einer Pinzette durch das Gummiband und setzen Sie die Petrischale vorsichtig auf den Bauch des Weibchens.
- Passen Sie mit der Pinzette und einem feuchten Wattestäbchen die Gebärmutterpositionierung und das Gummiband an, um sicherzustellen, dass das Gummiband mit der Haut des Weibchens abgedichtet ist, um ein Austreten von PBS zu verhindern.
- Verwenden Sie die vier Tonfüße, um die Petrischale unmittelbar über dem Bauch zu sichern und zu befestigen, wodurch der Druck auf das Weibchen und die Empfindlichkeit der Bildgebung für die Atmung und den Herzschlag des Weibchens reduziert werden.
- Drücken Sie den Modelliertonzylinder rechts neben die Embryonen/Gebärmutter, um die Gebärmutter zu fixieren (Abbildung 4C).
HINWEIS: Diese Orientierungsanleitung geht davon aus, dass sich die Nadel links vom Weibchen befindet und dass die Embryonen des linken Gebärmutterhörners des Weibchens freigelegt sind. Die Seite der Gebärmutter (linkes oder rechtes Uterushorn) ist entscheidend, da der AC entweder der Nadel zugewandt ist (linkes Horn; Abbildung 4D) oder blickt auf den stabilisierenden Tonzylinder (rechtes Horn; Abbildung 4E). - Um Embryonen aus dem rechten Gebärmutterhorn zu injizieren, platzieren Sie den Tonzylinder auf der linken Seite der Embryonen (Abbildung 4F) und drehen Sie den Heiztisch um 180° (Abbildung 4G), um die richtige Ausrichtung zu erreichen. Wenn die Nadel stattdessen bewegt werden kann, passen Sie sie entsprechend der entsprechenden Konfiguration an.
- Fügen Sie PBS zur Petrischale hinzu, bis die Embryonen und die Gebärmutter mit PBS bedeckt sind.
- Senken Sie die Ultraschallsonde in das PBS und stellen Sie die Maus / den Operationstisch so ein, dass der erste Embryo mit der Ultraschallsonde ausgerichtet ist, um die Aufzeichnung der Injektionen zu erleichtern.
HINWEIS: "Erste" bezieht sich auf die Nummerierung der Embryonen vom Eierstock bis zum Gebärmutterhals. - Scannen Sie alle drei Embryonen und inspizieren Sie die ACs. Bestimmen Sie das Injektionsvolumen wie folgt:
- Messen Sie den Durchmesser des Wechselstroms mit dem Ultraschallgerät. 69 nL einspritzen, wenn der Wechselstromdurchmesser ≤0,2 mm beträgt; 2 x 69 nL (= 138 nL) einspritzen, wenn der Wechselstromdurchmesser >0,2 mm und ≤0,29 mm beträgt; und injizieren Sie 3 x 69 nL (= 207 nL), wenn der AC-Durchmesser 0,29 mm > (Abbildung 4H).
HINWEIS: Frühere Experimente haben gezeigt, dass bis zu 207 nL Injektionsvolumina bei E7.515 gut vertragen werden. Erfolgreiche Injektionen mit minimalen Auswirkungen auf das Überleben werden erreicht, wenn die relative Volumenzunahme des AC 90% nicht überschreitet15. Variationen in der AC-Größe zwischen Wurfgeschwistern oder Mausstämmen sind üblich und erfordern möglicherweise weitere Optimierungen.
- Messen Sie den Durchmesser des Wechselstroms mit dem Ultraschallgerät. 69 nL einspritzen, wenn der Wechselstromdurchmesser ≤0,2 mm beträgt; 2 x 69 nL (= 138 nL) einspritzen, wenn der Wechselstromdurchmesser >0,2 mm und ≤0,29 mm beträgt; und injizieren Sie 3 x 69 nL (= 207 nL), wenn der AC-Durchmesser 0,29 mm > (Abbildung 4H).
- Stellen Sie die Injektionsvolumina mit dem Injektionsregler ein.
- Stellen Sie die Einspritzgeschwindigkeit mit einer Injektionsrate von 23 nL/s auf verlangsamt ein.
HINWEIS: Unterschiedliche Gerätemodelle können zu unterschiedlichen Einspritzkräften führen. - Senken Sie die Nadel mit den Haupträdern des Schienensystems (x- und z-Ebenen, Abbildung 4I) in das PBS, und drücken Sie auf der Nanoinjektorsteuerung auf Leeren , bis die Flüssigkeit die Nadelspitze erreicht.
HINWEIS: Wenn die Nadel verstopft ist, kann das Drücken von Leeren die Verstopfung auflösen und/oder die Verstopfung ausstoßen. - Heben Sie die Nadel aus dem PBS und drücken Sie Inject. Stellen Sie sicher, dass ein Tropfen des ungefähren gewünschten Volumens entladen wird.
- Senken Sie die Nadel in das PBS und richten Sie sie mit der Ultraschallsonde und dem Embryo aus, indem Sie den Nanoinjektor mit dem Y-Ebenenrad am Mikromanipulator bewegen (Abbildung 4J).
HINWEIS: Die Nadelspitze ist perfekt ausgerichtet, wenn sie als heller Fleck auf dem Ultraschallbild erscheint (Abbildung 4K,L). Die Nadel kann mit dem Mikromanipulator in alle drei Richtungsebenen bewegt werden. - Stellen Sie den Nadelwinkel mit dem Einspritzwinkelrad ein, um einen nahezu senkrechten Injektionswinkel relativ zur Gebärmutterwand zu gewährleisten. Führen Sie die Nadel mit einer Bewegung in den Wechselstrom ein, indem Sie das Einspritzrad am Mikromanipulator verwenden (Abbildung 4J-M). Achten Sie auf die Helligkeit der Nadelspitze. Wenn die Nadelspitze aus dem Ultraschallbild verschwindet, bewegen Sie die Ultraschallsonde nach vorne oder hinten, um die Nadel wieder scharf zu stellen.
HINWEIS: Sobald sich die Nadel im AC befindet, können geringfügige Änderungen an der Nadelposition und dem Fokus vorgenommen werden, ohne den Embryo zu schädigen (Anpassungen innerhalb von ~ 0,3 mm). Stellen Sie die Nadelposition nicht mehr ein. - Drücken Sie Inject (für 207 nL stellen Sie das Volumen auf 69 nL ein und spritzen Sie dreimal). Warten Sie nach der Injektion weitere 5-10 s, bevor Sie die Nadel mit einer sanften Bewegung zurückziehen.
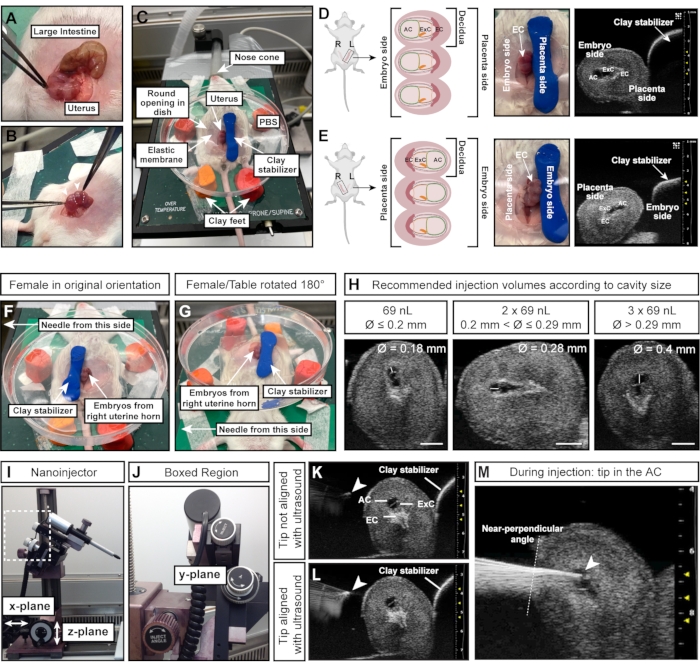
Abbildung 4: Optimale Größe und Ausrichtung der Fruchthöhle für erfolgreiche Injektionen. (A) Uterushorn mit mehreren E7,5-Deziduen, geformt wie eine Kugelkette (unten) im Vergleich zum Dickdarm (oben). (B) Uterusgewebe (weiß gepunktete Linien) zwischen Deziduas greifen. Vermeiden Sie es, die Deziduas (weiße Pfeilspitzen) direkt mit einer Pinzette zu quetschen, da Deziduas und sich entwickelnde Embryonen in diesem frühen Stadium zerbrechlich sind und anfällig für Resorption durch übermäßige äußere Kraft sind. (C) Weibchen in Rückenlage mit Deciduas, die in einer mit PBS gefüllten Petrischale freigelegt und auf vier Fuß Modelliermasse montiert sind. Die Deziduas werden durch ein zusätzliches Stück Modelliermasse in Form eines Zylinders stabilisiert. (D, E) Die Ausrichtung des AC wird durch die exponierte Seite des Uterushorns beeinflusst. Wenn Deziduas aus dem linken Uterushorn verwendet werden, zeigt der AC vom Tonstabilisator weg und ist für die Nadel auf der linken Seite leicht zugänglich (D). Wenn jedoch das rechte Uterushorn verwendet wird, wird der ektoplazentare Kegel stattdessen der Nadel zugewandt, was den Zugang zum AC erschwert (E). Daher wird bei der Injektion in das rechte Uterushorn der Tonstabilisator zur Nadelseite (F) hin platziert und der gesamte Heiztisch um 180 ° (G) gedreht. (H) Empfohlene Injektionsvolumina entsprechend den AC-Größen. Im Allgemeinen können Kavitäten mit einem Durchmesser ≤ 0,2 mm mit maximal 69 nL injiziert werden. Durchmesser > 0,2 mm und ≤ 0,29 mm tolerieren Volumina bis zu 2 x 69 nL (138 nL) und Kavitäten > 0,29 mm können mit 3 x 69 nL (207 nL) eingespritzt werden. Maßstäbe = 1 mm. (I, J) Der Nanoinjektor ist am Schienensystem befestigt und kann in x- und/oder z-Ebenen bewegt werden. Der Winkel der Nadel kann mit dem Einspritzwinkelrad eingestellt werden. (K, L) Die Nadelspitze (weiße Pfeilspitze) ist mit dem AC ausgerichtet, wenn sie im Ultraschall am hellsten erscheint (L). (M) Ultraschallbild, das den Injektionsprozess zeigt, bei dem sich die Nadelspitze im Wechselstrom befindet und gut ausgerichtet ist (weiße Pfeilspitze). Abkürzungen: A = Amnion; AC = Fruchthöhle; ExC = Exozelom-Hohlraum; EC = Ektoplazenta-Kegel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Verschieben Sie das Stadium zum nächsten Embryo und wiederholen Sie die Schritte 7.22-7.26 für die anderen beiden Embryonen, wenn sie geeignete AC-Größen haben.
- Heben Sie die Ultraschallsonde und die Nadel mit dem Mikromanipulator aus dem PBS. Drehen Sie die Nadel vom Bediener weg, um Schäden und Verletzungen zu vermeiden.
- Mit einer Pinzette leiten Sie den 1. und 2. Embryo zurück in den Bauch des Weibchens, indem Sie sie sanft durch das Gummiband drücken. Fassen Sie vorsichtig das Gewebe neben dem 3. Embryo und ziehen Sie die Gebärmutter zum oberen Ende des elastischen Schnitts. Ziehen Sie die 4. bis 6.Embryonen vorsichtig mit einer Pinzette hoch und lassen Sie den 3. Embryo wieder in den Bauch eintreten.
HINWEIS: Dieser Schritt kann durchgeführt werden, ohne das PBS zu ändern oder die Petrischale zu entfernen. - Wiederholen Sie diesen Vorgang nach Bedarf, bis alle Embryonen mit optimalen ACs injiziert wurden oder das Zeitlimit erreicht ist.
- Schieben Sie die Embryonen/Gebärmutter vorsichtig zurück in den Bauch des Weibchens.
- Saugen Sie das PBS ab und entfernen Sie die Petrischale. Wenn ein Virus verwendet wurde, als infektiösen Abfall behandeln.
- Nähen Sie die Muskelschicht mit Vicryl (USP 6-0, Nadellänge 13 mm, 3/8 Kreis) in einfachen kontinuierlichen oder unterbrochenen Nähten zusammen und schließen Sie die Haut mit 1-2 Clips (siehe Materialtabelle).
- Schalten Sie die Isofluranpumpe aus.
- Entfernen Sie das OP-Tape und setzen Sie das Weibchen in Bauchlage (Bauch nach unten) in einen sauberen Käfig auf einer 40 °C heißen Heizplatte.
HINWEIS: Es wird erwartet, dass das Weibchen innerhalb von 10 Minuten das Bewusstsein wiedererlangt und mobil ist. Stellen Sie sicher, dass der Vorgang innerhalb von 30 Minuten abgeschlossen ist. Der genetische Hintergrund, das Alter und das Gewicht der Frau können die Anästhesieempfindlichkeit beeinflussen. Überwachen Sie die Mäuse während der Operation auf Anzeichen einer langsamen Atmung (langsame Atmung bedeutet, dass die Anästhesie zu tief ist) oder Bewegung (die Anästhesie ist zu leicht). Buprenorphin (0,05-0,1 mg/kg Körpergewicht) oder Flunixin (2,5 mg/kg) oder ähnliches gemäß den örtlichen Tierschutzbestimmungen kann bei Bedarf 8 Stunden nach der ersten Injektion verabreicht werden. - Wenn ein anderes Weibchen injiziert werden soll, bereiten Sie den Operationsbereich vor und überwachen Sie das Erwachen des ersten.
- Wischen Sie die chirurgischen Instrumente mit 70% Ethanol ab, um restliches Blut oder Gewebe zu entfernen, und sterilisieren Sie sie im vorgewärmten Glasperlensterilisator für 10 s. Entsorgen Sie die Wattestäbchen und das gebrauchte Seidenpapier. Wischen Sie die Petrischale und die Tonstücke mit Seidenpapier trocken.
- Wiederholen Sie die Schritte 7.1-7.35, bis alle weiblichen Tiere injiziert wurden.
- Entleeren und entsorgen Sie die Nadel.
- Wenn sich ein Virus oder eine Injektionslösung in der Nadel befindet, drücken Sie auf dem Nanoinjektor auf Empty und entleeren Sie den Inhalt der Nadel auf Seidenpapier.
- Ziehen Sie den Metallkolben vollständig ein, indem Sie Fill drücken, bis ein doppelter Signalton vom Controller ertönt, der anzeigt, dass der Kolben vollständig eingezogen ist.
- Lösen Sie die Spannzange und schieben Sie die Nadel vom Metallkolben. Entsorgen Sie die Nadel in den Abfallbehälter für scharfe und spitze Gegenstände.
- Reinigen Sie die BSL-2-Bank.
- Wenn ein Virus verwendet wurde, besprühen Sie das gesamte Operationsfeld mit Desinfektionsmittel (siehe Materialtabelle). Nach 15 min das Desinfektionsmittel abwischen und das gesamte OP-Feld mit 70% Ethanol reinigen. Wenn kein Virus verwendet wurde, reinigen Sie alle Oberflächen mit 70% Ethanol.
- Wischen Sie restliches PBS von der Ultraschallsonde mit trockenem, weichem und fusselfreiem Seidenpapier ab.
- Abfall gemäß den Biosicherheitsrichtlinien entsorgen.
- Schalten Sie das Ultraschallgerät, den Heiztisch, die BSL2-Bank und dieO2-Versorgung aus.
Ergebnisse
Embryonen, die bei E7.5 mit hPGK-H2B-GFP Lentivirus11,12 injiziert wurden, wurden bei E13.5 entnommen und unter dem Fluoreszenzdissektionsmikroskop untersucht (Abbildung 5A). Die erfolgreiche Transduktion der Neuralplatte führt zu Embryonen mit starker Expression eines fluoreszierenden Reporters im Gehirn hauptsächlich und in anderen Ektoderm-abgeleiteten Geweben, z.B. der Haut (Abbildung 5A,B). Die Injektion eines zu hohen Volumens (größer als die hier empfohlenen Volumina, z. B. ≥500 nL) erhöht den Druck im Wechselstrom und kann entweder zu einer vollständigen Resorption (Daten nicht gezeigt) oder zu Neuralrohrdefekten wie Exenzephalie führen (Abbildung 5A). Erfolgreiche Injektionen bei E7,5 führen zu einer gleichmäßigen Transduktion vom Vorderhirn zum Hinterhirn (Abbildung 5C-J).
Lentivirale Titer um 2 × 1010 infektiöse Einheiten (IFU) erreichen über 95% Targeting, während Titer von ~1 × 109 IFU 15% Targeting-Effizienzerreichen 15. Darüber hinaus werden auch Strukturen ins Visier genommen, die bisher nur schwer mit Elektroporation anvisiert werden konnten, wie der Plexus choroideus17,18, (Abbildung 5 E,F). Die Wirksamkeit der Transduktion kann durch Anpassung des in das AC abgegebenen Virustiters modifiziert werden. Injektionen von niedrigem Titer führen zur Transduktion von Einzelzellklonen (Abbildung 5C, Abbildung 5E und Abbildung 5G, H), während die Verwendung von Hochtiterviren fast 100% des gesamten Gehirns transduziert (Abbildung 5D, Abbildung 5F, Abbildung 5H und Abbildung 5J ). Daher kann NEPTUNE entweder für klonale Transduktion, Linienverfolgung und genetische Screening-Ansätze oder für die Untersuchung der globalen Auswirkungen von Genüberexpression oder -herunterregulierung im gesamten Gehirn verwendet werden.
Die Entwicklung des Auges von Säugetieren ist das Ergebnis einer gut organisierten Kommunikation zwischen drei Derivaten des embryonalen Ektoderms: Die neuronale Netzhaut (NR) und das retinale Pigmentepithel (RPE) stammen aus dem Neuroepithel des ventralen Vorderhirns ab, während das Oberflächenektoderm die zukünftige Linse und das Hornhautepithel hervorbringt. Das zentrale Stroma und das hintere Endothel, die beiden anderen Schichten der Hornhaut, stammen jedoch von Neuralleistenzellen des periokularen Mesenchyms19,20 ab. Koronale Schnitte durch E13,5-Embryonen, die bei E7.5 mit einem Lentivirus mit hohem Titer injiziert wurden, zeigten ähnlich wie im Gehirn eine hohe und gleichmäßige Transduktion des Nervengewebes des Auges sowie der Linse, Hornhaut und Mesenchym (Abbildung 5K). Mit fortschreitender Neurulation führen Injektionen an E8,5 und E9,5 zu einer fortgesetzten Ausrichtung der Linse und des Hornhautepithels (Abbildung 5L und Abbildung 5N), während die Transduktion der Neuroektoderm-abgeleiteten Gewebe des Auges bei E8,5 (Abbildung 5L,M) weniger effizient ist oder nicht auf E9,5 gerichtet ist (Abbildung 5N).
Während die meisten Viruspartikel das exponierte Gewebe bei der Injektion infizieren, transduzieren einige Partikel nicht-ektodermale Gewebe, die sich später entwickeln (Abbildung 6A). Speicheldrüsen und -gänge entwickeln sich um E11,5 aus dem oralen Epithel21 und werden mit NEPTUN anvisiert (Abbildung 6B). Nach Injektionen bei E9,5 wird das linguale Epithel der Zunge gut transduziert; Das zugrunde liegende Mesenchym ist jedoch negativ (Abbildung 6C; Klammern bezeichnen transduzierte Zellen; Sternchen bezeichnen Autofluoreszenzsignal, nicht transduzierte Zellen). Darüber hinaus gibt es positive Cluster innerhalb des lingualen Epithels, die durch negative Abschnitte getrennt sind (Abbildung 6C, weiße Pfeilspitzen), was auf eine Transduktion der Papillenoberfläche hindeutet. Neuralleistenzellen wurden im darunter liegenden Zungenmesenchym und im Lingualepithel beschrieben, wo sie an der Entwicklung von Geschmackspapillen und Geschmacksknospen beteiligt sind22. Tatsächlich führen Injektionen bei E7,5 zu einer weit verbreiteten Transduktion des Zungenmesenchyms bei E13,5 (Abbildung 6D), was darauf hindeutet, dass frühe Injektionen auf Neuralleistenzellen abzielen und zum Mesenchym in der Zunge beitragen.
Bei Wirbeltieren sind die dorsalen Wurzelganglien (DRGs) ein zentraler Bestandteil des peripheren Nervensystems (PNS), da alle somatosensorischen Eingaben aus der Körperperipherie (Temperatur, Schmerz, Druck) über die Aktivierung der DRG-Neuronen an das Gehirn weitergeleitetwerden 23. Sowohl Neuronen als auch Gliazellen der DRG stammen von Stamm-Neuralleistenzellen24 ab. Die lentivirale Injektion, bei der der ubiquitäre hPGK-Promotor die Expression des fluoreszierenden Reporters steuert, führt zu einem weit verbreiteten Targeting des zentralen und peripheren Nervensystems (Abbildung 7A), wobei sowohl Neuronen als auch Vorläuferzellen im Rückenmark (Abbildung 7B) sowie die DRG (Abbildung 7C) übertragen werden. Die Verwendung eines MiniPromoters für Doppelcortin25 ermöglicht es, die GFP-Expression nur auf Neuronen zu beschränken (15 und Abbildung 7D,E).
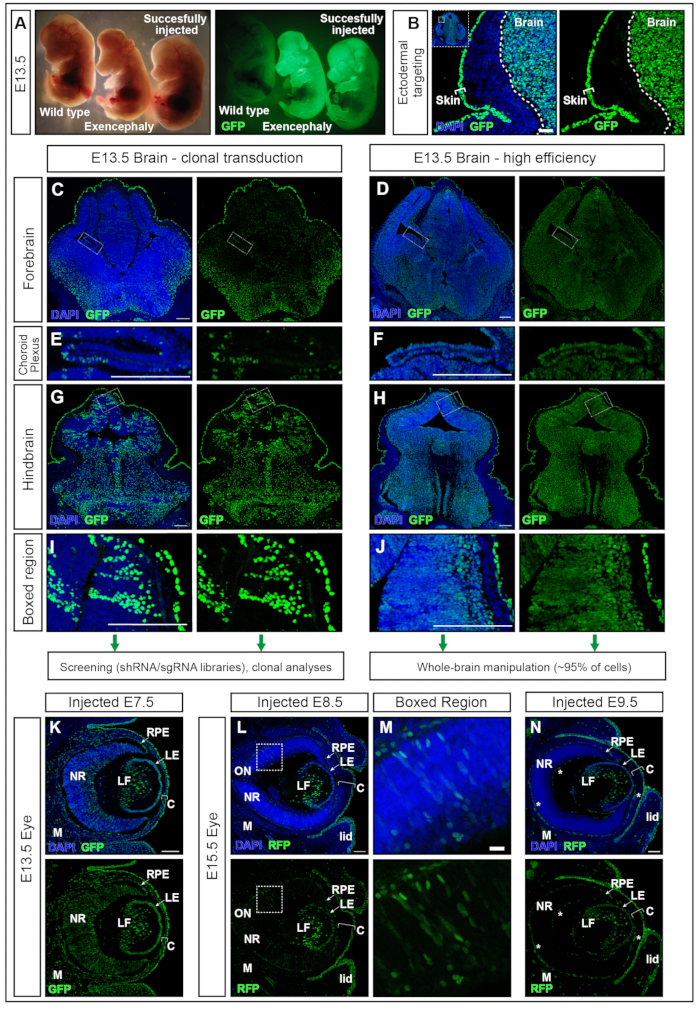
Abbildung 5: Hocheffiziente oder klonale Transduktion mit NEPTUNE. (A) E13.5-Embryonen unter einem Dissektionsmikroskop, das mit Standardbeleuchtung beleuchtet wurde (linkes Bild) und dieselben Embryonen, die für GFP beleuchtet wurden (rechtes Bild). Nicht injizierter Embryo ganz links, erfolgreich injizierter Embryo ganz rechts, was zu einem positiven Signal im Gehirn führt (ganz rechts). Exenzephaler Embryo aufgrund des injizierten Übervolumens (mittlerer Embryo). (B) Haut- und Gehirn-Targeting mit E7.5-Injektion. Maßstabsbalken = 50 μm. (C, D) E13.5 konfokale Aufnahmen des Vorderhirns mit niedriger klonaler Transduktion (C) oder hocheffizienter Transduktion (D). (C, E, G, I) Klonale Transduktion verschiedener Regionen im Gehirn. (D, F, H, J) Hocheffiziente Transduktion verschiedener Regionen im Gehirn. Maßstabsbalken = 200 μm. Unterschiedliche Transduktionswirksamkeiten sind repräsentativ für andere Bereiche des ZNS. (E, F) Aderhautplexus zielt, klonal (E) oder mit hoher Effizienz (F). Maßstabsbalken = 200 μm. (G, H) Klonales Targeting (G) und hocheffizientes (H) Targeting des Hinterhirns, vergrößert in (I, J). Maßstabsbalken = 200 μm. (K) GFP-Reporterexpression im Auge bei E13,5 nach In-utero-Injektion bei E7,5 (L, M) GFP-Reporterexpression im Auge bei E15,5 nach In-utero-Injektion bei E8,5 (L), Box-Region vergrößert in (M) oder bei E9,5 (N). Autofluoreszierende Blutgefäße sind mit weißen Sternen markiert. Maßstabsbalken = 100 μm. Abkürzungen: NEPTUNE = neural plate targeting with in uteronano-injection; C = Hornhaut; LE = Linsenepithel; LF = Linsenfasern; M = Mesenchym; NR = Neuronale Netzhaut; ON = Sehnerv; RPE = Retinal Pigment Epithel; GFP = grün fluoreszierendes Protein; ZNS = zentrales Nervensystem. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
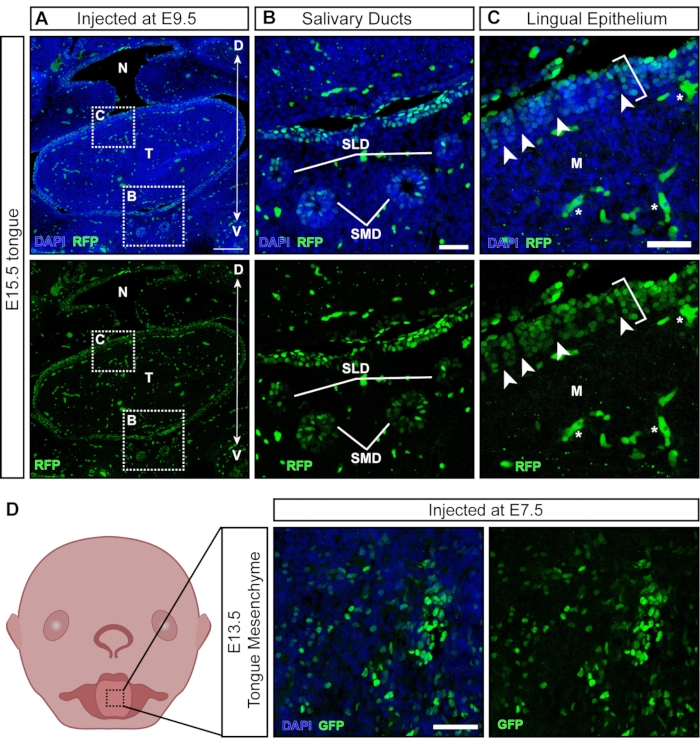
Abbildung 6: In-utero-Transduktion von nicht-neuralen Geweben. (A) Konfokales Bild der E15,5 Mundhöhle. Dem Embryo wurde bei E9,5 das fluoreszierende Reporterlentivirus injiziert. Maßstabsbalken = 200 μm. (B, C) (B) Vergrößerung des eingesetzten Panels; Speichelgangepithel mit Virus transduziert. (C) Vergrößerung des eingesetzten Panels; dorsales linguales Epithel transduziert mit GFP-Reportervirus (weiße Klammer). Das zugrunde liegende Mesenchym aus Neuralleistenzellen ist negativ. Weiße Pfeilspitzen zeigen Papillen mit negativen Neuralleistenzellen an, die von virustransduzierten Epithelzellen umgeben sind (autofluoreszierende Blutzellen/-gefäße sind mit weißen Sternen markiert). Maßstabsbalken = 50 μm. (D) Schematische und konfokale Darstellung des E13.5-Zungenmesenchyms nach Injektionen mit fluoreszierendem Reportervirus bei E7.5. Maßstabsbalken = 50 μm. Abkürzungen: D = Dorsal; M = Mesenchym; N = Nasopharynx; SLD = Sublingualgang; SMD = Submandibulargang; T = Zunge; V = Ventral; GFP = grün fluoreszierendes Protein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
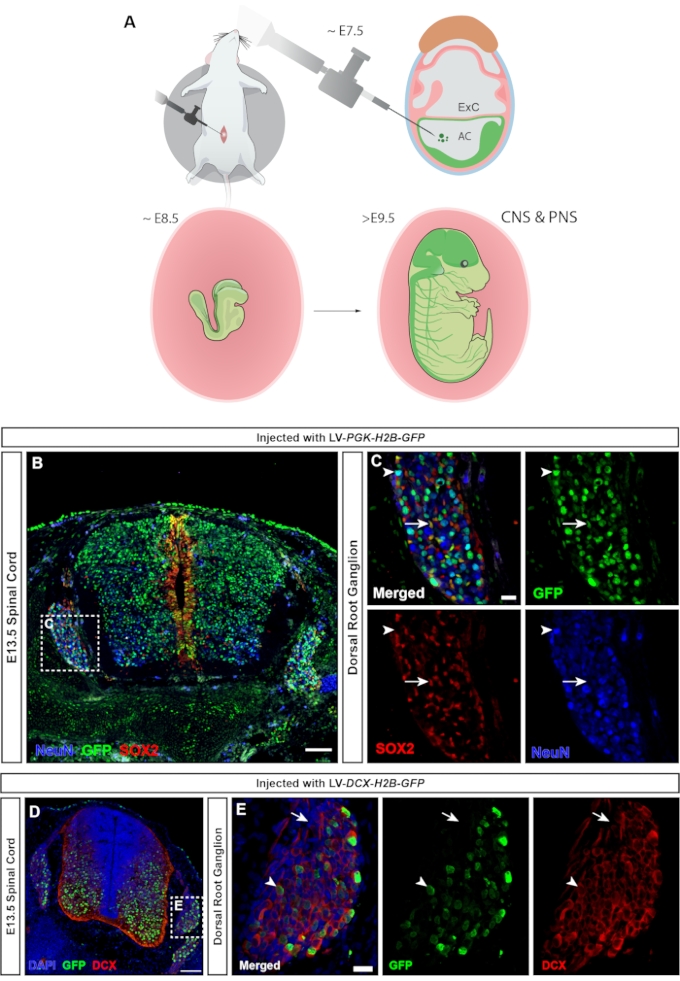
Abbildung 7: Transduktion von dorsalen Wurzelganglienzellen aus Neuralleisten. (A) NEPTUNE-Targeting bei E7.5 ermöglicht das Targeting von ZNS und PNS. (B) Konfokales Bild von E13.5-Rückenmark und DRGs, die mit hPGK-H2B-GFP-Reporterlentivirus bei E7.5 injiziert wurden, zeigt die Transduktion sowohl von SOX2+ neuronalen Vorläuferzellen als auch von NeuN+ Neuronen. Maßstabsbalken = 100 μm. (C) Boxed Region von B, die die DRG mit GFP-Expression in SOX2+ (weiße Pfeile) und NeuN+ (weiße Pfeilspitzen) Zellpopulationen zeigt. Maßstabsbalken = 20 μm. (D) Konfokales Bild von E13.5-Rückenmark und DRG, injiziert mit DCX-H2B-GFP-Lentivirus bei E7.5, das nur auf DCX+-Zellen abzielt. Maßstabsbalken = 100 μm. (E) Boxed Region von D mit DRG mit GFP-Expression, die auf DCX+-Neuronen beschränkt ist (weiße Pfeilspitzen). DCX-Zellen sind negativ für GFP (weiße Pfeile). Maßstabsbalken = 20 μm. Abkürzungen: NEPTUNE = neural plate targeting with in utero nano-injection; ZNS = zentrales Nervensystem; PNS = peripheres Nervensystem; DRGs = dorsale Wurzelganglien; GFP = grün fluoreszierendes Protein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Es gibt mehrere Schritte in diesem Protokoll, die das Überleben des Embryos, die Qualität der Injektionen und das Auslesen beeinflussen. Das Gestationsalter der Embryonen ist definiert als E0,5 am Mittag des Tages des Vaginalpfropfens nach nächtlicher Paarung. Die Durchführung der Ultraschalluntersuchung auf Schwangerschaft bei E6,5 am späten Nachmittag/Abend stellt sicher, dass die Embryonen so weit entwickelt sind, dass sie durch Ultraschall identifiziert werden können. Die Überprüfung (1) ermöglicht ein Vorscreening, wie viele pfropfpositive Mäuse tatsächlich schwanger sind, (2) stellt sicher, dass kein Virus unnötig aufgetaut und verschwendet wird, falls pfropfpositive Mäuse nicht schwanger sind, und (3) reduziert unnötige Eingriffe an Mäusen (vermeidet Operationen an nicht schwangeren Weibchen).
Bei E7.5 reagieren Embryonen empfindlich auf äußere Kräfte und sollten vorsichtig behandelt werden. Zum Beispiel kann das Ziehen an den Gebärmutterhörnern oder das Zusammendrücken der Deziduas zu einer Resorption des Embryos führen. Das Gebärmuttergewebe sollte außerhalb des weiblichen Bauches immer feucht gehalten werden, um ein Austrocknen des Gewebes zu verhindern. Die Mehrheit der Deziduas sollte im weiblichen Bauch bleiben, wobei nur 3-4 für Injektionen exponiert sind. Die Nadelschärfe ist eine weitere entscheidende Determinante für erfolgreiche Injektionen. Stumpfe oder gebrochene Nadelspitzen führen zu wiederholtem Stoßen von Deziduas oder Kompression gegen die Modelliermasse vor dem Eintritt in den Wechselstrom, was die Resorptionsrate erhöhen kann. Daher sollten gut geschliffene und scharfe Nadeln immer sicher gelagert und nach maximal 2 Weibchen ersetzt werden.
Dieses Protokoll beschreibt, wie man die Neuralplatte mit einer einzigen Injektion von Lentivirus angreift. Darüber hinaus zeigt es, wie die Transduktionswirksamkeit von einzelligen Klonen auf das gesamte Gehirn übertragen werden kann. Andere nicht-neurale Gewebe, einschließlich der Haut und des oralen Epithels, werden jedoch ebenfalls ins Visier genommen. Darüber hinaus werden alle Zelltypen (Vorläuferzellen und differenzierte Zellen) transduziert, was diesen Ansatz effizient, aber unspezifisch macht. Die Verwendung von MiniPromotern im viralen Konstrukt führt zur spezifischen Expression des Transgens in Neuronen oder Astrozyten15. Dies hat den Vorteil, dass die Verwendung von dedizierten transgenen Cre-Tieren vermieden wird und somit der Arbeitsaufwand (Stammerhaltung und Genotypisierung) und die Kosten reduziert werden.
Zu den Einschränkungen von NEPTUNE gehören seine technischen Schwierigkeiten, Herausforderungen, schwangere Frauen mit einer vorhersehbaren und konsistenten Rate zu erhalten, und die Kosten für die Anschaffung spezieller Instrumente. Darüber hinaus kann das nichtselektive Targeting von Zellen durch Lentivirus sowohl als Vorteil als auch als Einschränkung der Technik angesehen werden. Die Injektion größerer Volumina in den Wechselstrom führt zu Exenzephalie13, obwohl Hirnfehlbildungen und Exenzephalie mit den hier beschriebenen Voluminavermieden werden 15. Ein negativer Einfluss auf die Entwicklung des Gehirns ist daher ein Risiko bei In-utero-Nanoinjektionen , die sorgfältig vermieden werden müssen, indem korrekte Volumina injiziert werden, die an das embryonale Stadium und die AC-Größe angepasst sind.
Zukünftige Anpassungen der Technik könnten sich auf viralen Tropismus konzentrieren. Adeno-assoziierte Viren (AAVs) haben unterschiedliche Serotypen, von denen gezeigt wurde, dass sie im ZNS17,26 robust auf verschiedene Zelltypen abzielen. AAVs integrieren sich jedoch nicht in das Genom der Wirtszelle und können daher in Zellen mit einer hohen Teilungsrate verloren gehen. Obwohl es mehrere Möglichkeiten gibt, die Spezifität von NEPTUN zu erhöhen, sind transgene Tiere immer noch der Goldstandard, wenn es um Genmanipulation in vivo geht. Cas9-Mäuse und sgRNA-kodierende Lentiviren wurden für das genetische Screening in der embryonalen Epidermis27 verwendet und können auch an das sich entwickelnde ZNS angepasst werden.
Injektionen in das AC bei E7,5 zielen effizient auf Zellen des Neuroektoderms vor Beginn der Neurulation ab und zielen effizienter auf das sich entwickelnde Gehirn ab als bei der Utero-Elektroporation . Dies ermöglicht die Untersuchung genetischer Hinweise, die für die Entwicklung des Gehirns von einem früheren Zeitpunkt an wichtig sind. Im Gegensatz zu klassischen genetischen Mausmodellen bietet NEPTUNE einen flexiblen Ansatz zur Durchführung funktioneller Genanalysen. Phänotypen nach Überexpression oder Gendeletion können innerhalb von Tagen bis Wochen im Vergleich zu Monaten oder Jahren untersucht werden. Injektionen mehrerer viraler Konstrukte ermöglichen die Manipulation mehrerer Gene innerhalb eines Embryos und vermeiden die Erzeugung von Doppel- oder Dreifach-Knockout-Tieren. Daher spart NEPTUN nicht nur Zeit, sondern kann auch die Anzahl der in der Forschung verwendeten Tiere reduzieren.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Wir danken Bettina Semsch und Jia Sun (Infinigene) für die fachkundige Betreuung der Mäuse; Florian Salomons und Göran Månsson von Biomedicum Imaging Core (BIC) für Unterstützung bei der Bildaufnahme und Beratung. Finanzierung: Wir danken den folgenden Förderern für ihre Unterstützung dieses Projekts: The Swedish Research Council, Karolinska Institutet (KI Foundations, Career Development Grant, Ph.D. Student KID Funding und SFO StratNeuro Funding, das Center of Innovative Medicine), The Ollie and Elof Ericssons Foundation, The Tornspiran Foundation, The Jeansssons Foundation, Sven and Ebba-Christina Hagbergs Prize and Research Grant, Knut und Alice Wallenberg Project Grant, Fredrik und Ingrid Thurings Foundation, Lars Hiertas Minne, The Childhood Cancer Foundation (Barncancerfonden), The Åhlen Foundation, Åke Wibergs Foundation, Tore Nilssons Foundation und die Swedish Foundations Starting Grant to ERA. Abbildung 4D,E wurden mit BioRender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | BD Bioscience | 309628 | |
| 27 G Needle | BD Bioscience | 300635 | |
| 3.5 inches capillaries | Drummond Scientific | 3000203G/X | Were used to pull in house needles |
| 70 MHz MS Series transducer | Visual Sonics | MS700 | |
| Aquasonic clear ultrasound gel | Parker Laboratories | Mar-50 | |
| Autoclip Applier 9 mm | Angthos | 12020-09 | |
| CD1 mice | Charles River, Germany | Crl:CD1(ICR) | Females: from age of 8 weeks old Males: from the age of 12 weeks old |
| Cotton Swab | OneMed Sverige AB | 120788 | |
| DPBS | Gibco | 14190094 | |
| Dressing forceps delicate straight 13 cm | Agnthos | 08-032-130 | |
| EG-400 Narishige Micropipette Grinder | Narishige | NA | |
| EZ clips 9 mm | Angthos | 59027 | clips |
| Iris Scissors, Super Cut, straight, 9 cm | Agnthos | 307-336-090 | |
| Isofluorane | Baxter Medical AB | EAN: 50085412586613 | Purchased from Swedish Pharmacy |
| Kimwipes | Kimberly Clarke | 7557 | |
| Membrane Tape | Visual Sonics | SA-11053 | |
| Micropipette Puller | Sutter Instrument | P-97 | |
| Modeling Clay | Sense AB | 10209 | |
| Mouse Handling Table | Visual Sonics | 50249 | |
| Nanoject II Auto Injector Kit | Drummond | 3-000-205A | |
| Parafilm | Bemis | HS234526C | |
| Petri dish with central opening (low wall) | Visual Sonics | SA-11620 | |
| Petri dish, (ØxH): 92 x 16 mm | Sarstedt | 82.1472.001 | |
| Rely+On Virkon | DuPont | 130000132037 | disinfectant |
| Silicone membrane | Visual Sonics | SA-11054 | |
| Steri 250, hot bead sterilizer | Angthos | 31100 | |
| Surgical Tape (1.25 cm x 9.14 m) | Medicarrier | 67034 | |
| Vevo Compact Dual (Med. Air & O2) Anesthesia System | Visual Sonics | VS-12055 | |
| Vevo Imaging Station 2 | Visual Sonics | VS-11983 | |
| Vevo2100 | Visual Sonics | VS-20047 | |
| Vicryl 6-0; C-3 needle, 45 cm purple filament | Agnthos | J384H |
Referenzen
- Theiler, K. . The House mouse. Atlas of embryonic development. , (1989).
- Barresi, M. J. F., Gilbert, S. F. . Developmental biology. , (2016).
- Taylor, J. C., et al. Factors influencing success of clinical genome sequencing across a broad spectrum of disorders. Nature Genetics. 47 (7), 717-726 (2015).
- Pizzo, L., et al. Rare variants in the genetic background modulate cognitive and developmental phenotypes in individuals carrying disease-associated variants. Genetics in Medicine. 21 (4), 816-825 (2019).
- Sakai, Y. Neurulation in the mouse: Manner and timing of neural tube closure. The Anatomical Record. 223 (2), 194-203 (1989).
- Schoenwolf, G. C. Shaping and bending of the avian neuroepithelium: Morphometric analyses. Developmental Biology. 109 (1), 127-139 (1985).
- Smith, J. L., Schoenwolf, G. C., Quan, J. Quantitative analyses of neuroepithelial cell shapes during bending of the mouse neural plate. Journal of Comparative Neurology. 342 (1), 144-151 (1994).
- Katahira, T., Nakamura, H. Gene silencing in chick embryos with a vector-based small interfering RNA system. Development Growth and Differentiation. 45 (4), 361-367 (2003).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. I. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochemical and Biophysical Research Communications. 230 (2), 376-380 (1997).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Beronja, S., Livshits, G., Williams, S., Fuchs, E. Rapid functional dissection of genetic networks via tissue-specific transduction and RNAi in mouse embryos. Nature Medicine. 16 (7), 821-827 (2010).
- Pierfelice, T. J., Gaiano, N. Ultrasound-guided microinjection into the mouse forebrain in utero at E9.5. Journal of Visualized Experiments JoVE. (45), e2047 (2010).
- Gaiano, N., Kohtz, J. D., Turnbull, D. H., Fishell, G. A method for rapid gain-of-function studies in the mouse embryonic nervous system. Nature Neuroscience. 2 (9), 812-819 (1999).
- Slevin, J. C., et al. High resolution ultrasound-guided microinjection for interventional studies of early embryonic and placental development in vivo in mice. BMC Developmental Biology. 6, 10 (2006).
- Mangold, K., et al. Highly efficient manipulation of nervous system gene expression with NEPTUNE. Cell Reports Methods. 1, 100043 (2021).
- Kameneva, P., et al. Single-cell transcriptomics of human embryos identifies multiple sympathoblast lineages with potential implications for neuroblastoma origin. Nature Genetics. 53 (5), 694-706 (2021).
- Kaiser, K., et al. MEIS-WNT5A axis regulates development of fourth ventricle choroid plexus. Development. 148 (10), (2021).
- Haddad, M. R., Donsante, A., Zerfas, P., Kaler, S. G. Fetal brain-directed AAV gene therapy results in rapid, robust, and persistent transduction of mouse choroid plexus epithelia. Molecular Therapy. Nucleic Acids. 2 (6), 101 (2013).
- Heavner, W., Pevny, L. Eye development and retinogenesis. Cold Spring Harbor Perspectives in Biology. 4 (12), 008391 (2012).
- Swamynathan, S. K. Ocular surface development and gene expression. Journal of Ophthalmology. 2013, 103947 (2013).
- Amano, O., Mizobe, K., Bando, Y., Sakiyama, K. Anatomy and histology of rodent and human major salivary glands: -overview of the Japan Salivary Gland Society-sponsored workshop. Acta Histochemica et Cytochemica. 45 (5), 241-250 (2012).
- Liu, H. X., Komatsu, Y., Mishina, Y., Mistretta, C. M. Neural crest contribution to lingual mesenchyme, epithelium and developing taste papillae and taste buds. Developmental Biology. 368 (2), 294-303 (2012).
- Marmigère, F., Ernfors, P. Specification and connectivity of neuronal subtypes in the sensory lineage. Nature Reviews. Neuroscience. 8 (2), 114-127 (2007).
- Zirlinger, M., Lo, L., McMahon, J., McMahon, A. P., Anderson, D. J. Transient expression of the bHLH factor neurogenin-2 marks a subpopulation of neural crest cells biased for a sensory but not a neuronal fate. Proceedings of the National Academy of Sciences of the United States of America. 99 (12), 8084-8089 (2002).
- Portales-Casamar, E., et al. A regulatory toolbox of MiniPromoters to drive selective expression in the brain. Proceedings of the National Academy of Sciences of the United States of America. 107 (38), 16589-16594 (2010).
- Tervo, D. G. R., et al. A designer AAV variant permits efficient retrograde access to projection neurons. Neuron. 92 (2), 372-382 (2016).
- Loganathan, S. K., et al. Rare driver mutations in head and neck squamous cell carcinomas converge on NOTCH signaling. Science. 367 (6483), 1264-1269 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten