Method Article
胎内ナノ注射(NEPTUNE)によるマウス神経板ターゲティング(胎内7.5日目)
要約
このプロトコルでは、E7.5のマウス羊膜腔にレンチウイルスを注入し、生存や胚発生への有害な影響を最小限に抑えながら、神経板全体の均一な形質導入をもたらす方法について説明します。
要約
胎内発達中のマウス脳における遺伝子発現の操作は、機能遺伝学研究の大きな可能性を秘めています。しかし、以前は主に神経形成後の胚期の操作に限定されていました。胚の日(E)7.5に羊膜腔を注入し、cDNAまたはshRNAをコードするレンチウイルスを神経板と神経堤細胞の>95%を標的とし、将来の脳、脊髄、末梢神経系に寄与するプロトコルが開発されました。このプロトコルでは、ガラス毛細血管針の研削、妊娠確認、超音波イメージングを使用した発生病期分類、胚期に合わせた最適な注入量など、形質導入を成功させるために必要な手順について説明します。
このプロトコルに従って、発達中の脳の>95%を高力価レンチウイルスで形質導入し、全脳遺伝子操作を実行することが可能です。対照的に、より低いウイルス力価を用いてモザイク形質導入を達成することが可能であり、遺伝子スクリーニングまたは系統追跡を可能にする。E7.5での注射は、眼、舌、および末梢神経系の明確なコンパートメントに寄与する外胚葉および神経堤も標的とする。したがって、この技術は、マウスの神経板および外胚葉由来の組織における遺伝子発現を前神経形成段階から操作する可能性を提供し、実験に使用するマウスの数を減らすという利点をもたらします。
概要
脳と脊髄は、胚形成中に形成を開始する最初の器官の1つです1,2。神経発達障害に関連する遺伝子は同定されていますが、遺伝的変異の機能的調査は遅れています3,4。条件付きノックアウトマウスの作製には数か月から数年かかることがあるため、発達中の脳の遺伝子機能を迅速に調べるための代替技術が注目されています。マウス胚では、神経形成(神経板が神経管に変化して中枢神経系(CNS)を生じさせる形態形成プロセス)は、受胎後8日目から10日目の間に発生します5。神経形成の開始前に、神経板は、外胚葉の一部として、CNS 6,7内の多数のニューロンおよびグリア細胞型に増殖および分化する柱状細胞の単層からなる。したがって、CNSにおける遺伝子発現の長期的な変化を実験的に誘導するために、神経板を標的とすることは、すべての前駆細胞のアクセス可能性を含む明らかな利点を提供する。
神経科学では、ovoエレクトロポレーション8,9およびマウス胚のウイルス形質導入において、胚性CNS遺伝子発現を操作するために使用されてきた。発生中のニワトリ胚は、卵子内のニワトリ胚へのアクセス可能性とその結果としての遺伝子発現の操作の容易さのために、脊髄発生中の遺伝子機能を研究するための選択モデルであった。特に、ovoプラスミドエレクトロポレーションでは、各ひよこ脊髄における実験条件および対照条件を生成する。エレクトロポレーションは細胞膜透過処理を引き起こし、2つの電極を介して胚に電気パルスを印加することにより、負に帯電したDNAを(負の)陰極から(正の)陽極に向けます。マウスでは、子宮内でのエレクトロポレーションは一般に神経形成が完了した胚期に限定されており、脳または脊髄はすでにいくつかの細胞層で構成されているため、エレクトロポレーション効率は低くなります10。プラスミドエレクトロポレーションは一過性の遺伝子発現をもたらし、一般に少数の細胞を標的とします。
子宮内マイクロインジェクションにおける超音波ガイド下は、皮膚および脳などの異なる胚構造を操作するために使用されてきた11、12、13、14。しかし、発生中のマウスCNSを標的とする注射は、有効性が低いか、胚の生存に悪影響を及ぼしています12、13、14。そのため、E7.5の羊膜腔(AC)に高力価のレンチウイルスを送達するための改良されたプロトコルが開発され、これは子宮内で発生するネプチューンと呼ばれました15。注射は、E13.5で脳全体の>95%の長期的な標的効果をもたらしました。さらに、妊娠の超音波検証中に病期分類ステップを導入し、研究動物の不要な手順を最小限に抑え、注射の成功を最大化するために、発達段階ごとに女性と妊娠を分類しました。注入効率と生存率は、ACサイズの増加と密接に関連しています。したがって、この論文では、注入前にACサイズを測定して、胚の再吸収を引き起こさない適切な体積をACに送達する方法について説明します。海王星は、現在の子宮内アプローチの堅牢な代替手段であり、機能研究の獲得と喪失、系統追跡、またはスクリーニングを含むがこれらに限定されないいくつかの用途に適応することができます15,16。
プロトコル
CD1野生型マウスは、ヨーロッパの規制に従って、餌と水を 自由に摂取した標準的な昼と夜のサイクルで飼育されました。CD1の雌はCD1の雄と一晩交配し、膣栓は朝にチェックされました(E0.3)。妊娠中の女性のみが注射に使用されました。ここに記載されているすべての実験の倫理的承認は、スウェーデン農業委員会(Jordbruksverket)によって付与されました。
1.ガラス針の準備:針の引っ張りと研削
注意: 予備粉砕針は購入できますが、社内で針を引くことで、針の長さ、ボア、かさ角を簡単に調整できます。
- ガラスキャピラリーをマイクロピペット/キャピラリープーラーに取り付けます。指定された機器を使用して次の設定を使用します( 材料の表を参照)。 580ユニットを加熱します。速度140単位;時間200単位。圧力500-800単位。
注意: さまざまなパラメータの単位は、キャピラリープーラーによって定義されます。ユニットは機器によって異なります。 - Pullを押してキャピラリーを引き離し、端が先細りの2つのガラスキャピラリーを生成します。
注意: 引っ張った後、マイクロピペットプーラーの温度が高いため、2つのガラスキャピラリーの先端が融合して閉じます。 - 外科用ハサミで先端を切断し、針の長さを~7 mm(針が先細りになり始めたところから測定)にします(図1A)。
注:E7.5注射の場合、注射領域が非常に小さく繊細であるため、長くて細い針が重要です。短くて広い穴の針は胚の死をもたらします。 - カットした針先を研磨して、鋭いベベルを作成します(図1C-F)。
- 針を最高速度で20°の角度で少なくとも30〜45分間粉砕します。
注:超純水を研削プレートに追加して潤滑剤として機能し、摩擦/温度を低減し、ガラス粒子を洗い流します(図1B)。ただし、過剰な液体はグラインダーの速度を低下させる可能性があります。 - 針先(図1C)が研削盤の表面(図1D)に接触しているが、曲がっていないことを確認します(図1E)。
注意: 曲がった研削は、誤ったベベル角度の長くて壊れやすい針先をもたらし、射出中に簡単に破損する可能性があります。針を折ると胚に害を及ぼす可能性があるため、無傷の針と交換する必要があります。正しく接地された先端を 図1F、Gに示します。研削後、得られるニードルボアの内径(ID)は~15 μm、外径(OD)は~35 μmになると予想されます(図1G)。
- 針を最高速度で20°の角度で少なくとも30〜45分間粉砕します。
- 1 mLシリンジにミネラルオイルを入れ、27 Gの針を取り付けます。
- ニードルキャップを取り外し、シリンジニードルを新しく研磨したガラスキャピラリーに挿入します。キャピラリー先端からオイルが滴り落ちるまで鉱物油を注入します。毛細管針が鉱物油で満たされるまで27G針を引き出しながら注入を続け、その後シリンジ針を取り外すことができます。
- 損傷やほこりの蓄積を防ぐために、粉砕および鉱物油で満たされた針は密閉された環境に保管してください。保管するには、2つのロールのモデリング粘土を通常のペトリ皿に挿入してホルダーとして使用します(図1H)。針を粘土にそっととめ、針を簡単に取り出せるように離します。
注:針の準備には時間がかかるため、注射の少なくとも1日前に針を準備するのが最善です。針は鈍くなるので、最大2リットル後に廃棄してください。準備中または注射中に針が損傷した場合に備えて、常にバックアップ針を準備してください。
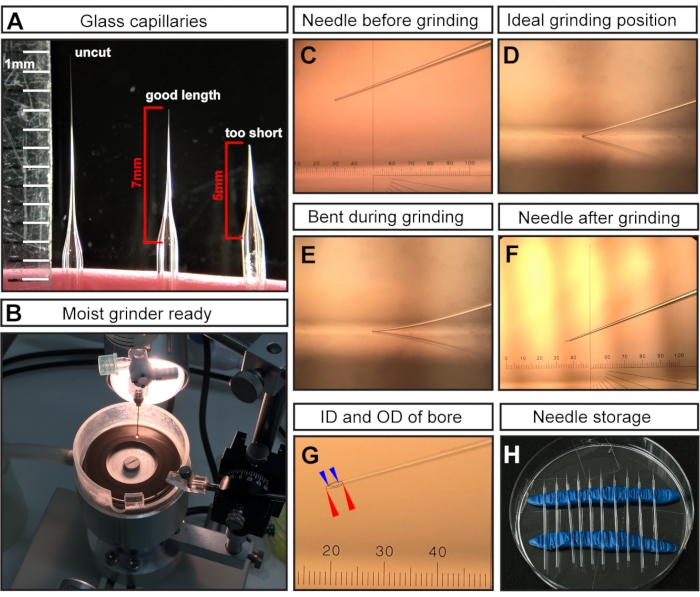
図1:E7.5羊膜腔注射用の針の準備。 (A)引っ張られているがカットされていないガラス毛細血管針(左)、E7.5注射に最適な長さに切断された毛細血管針(中央)、および短すぎる毛細血管切断(右)の代表例。(B)針研削の準備ができている水の均一なカバレッジを備えたグラインダー。(C-F)異なる針先の代表例。(C)グラインダーに取り付けられた切断されたが粉砕されていない針先。(D)針先がグラインダーに触れるだけの理想的な研削位置。(E)研削プロセス中に針が下がりすぎて曲がる。(F)E7.5 AC注射に最適なグラウンドニードルチップ。(g)内径~15μm、外径~35μmの穴を示す接地針先で、E7.5AC注入に適しています。針穴は破線で表示されます。外径は赤い矢印で示されます。内径は青い矢印で示されています。(H)針の保管:引っ張られて粉砕された針で満たされたペトリ皿。2列のモデリング粘土がホルダーとして機能します。注:C、F、Gの眼マイクロメータの場合、1 cmは100ピッチに分割されます。目標は3倍です。したがって、1ピッチ= 10,000 μm/(100 × 3)≈33.4 μmです。略語:AC =羊膜腔;ID = 内径;OD = 外径。この図の拡大版を表示するには、ここをクリックしてください。
2.注射の前日:妊娠の超音波検査のためのベンチを準備します
注:レンチウイルスを使用する場合は、換気されたバイオセーフティレベル2(BSL 2)ベンチですべての作業を行う必要があります。妊娠の超音波検査は換気されたベンチで行うことができます。
- 超音波装置、加熱テーブル、およびイソフルランポンプのO2 供給をオンにします(機器によって異なる場合があります)。
注意: イソフルランシステムをチェックして、イソフルランが空気中に漏れていないことを確認してください。 - 空のゴミ袋(簡単にアクセスできるように内壁にテープで留められています)、脱毛クリーム、滅菌パックされた綿棒、水、ティッシュペーパー、およびサージカルテープをBSL 2ベンチ内に置きます。
- 妊娠の超音波検査中にマウスの手足を固定するためのサージカルテープ(~7cm)を4本用意します。
3.妊娠を確認するための超音波検査
注:この手順は、E7.5注射の前日のE6.5で実行できます。在胎週数のチェックの詳細については、ディスカッションを参照してください。
- タイムメイトしたメスマウスを誘導チャンバーに入れます。
- 麻酔を誘発するために、~2.1 LPMの酸素流と3〜4%イソフルランの初期用量でガス流をオンにします。
- 足の反射をチェックして、女性が完全に麻酔をかけていることを確認します。足の反射がない場合は、イソフルランを1.5〜2%に下げます。
注:麻酔を誘発するのに約3分かかります。 - 誘導室からのガスの流れを加熱テーブルのノーズコーンに切り替えます。
- 麻酔をかけた女性を加熱台上で仰臥位(腹部を上にして)置き、鼻を付属のノーズコーンに入れて、妊娠の超音波チェック中に麻酔を維持します。
- 女性の体を伸ばしたり、ひげを閉じ込めたりすることなく、準備したサージカルテープで4本の足すべてをテーブルに固定します。
- エンドウ豆サイズの脱毛クリームを下腹部に塗ります。綿棒を使って下腹部(~3×3cm四方)にクリームを塗り、綿棒を前後に転がして優しくマッサージします。
- 毛皮が皮膚から剥がれ始めたら、ティッシュペーパーを湿らせ、クリームと毛皮を取り除きます。すべてのクリームと髪がなくなるまで、湿ったティッシュペーパーで脱皮部分をきれいにします。肌を乾かします。
- 剃毛部位に梅サイズの超音波ジェルを塗布し、次の3つのアプローチのいずれかで超音波を使用して子宮を特定します。
- これを手動で行うには、超音波プローブを超音波ゲルに保持し、プローブを動かして子宮を見つけます。
- 半手動アプローチ#1の場合、x平面に沿ってレールの一部を緩めて移動することにより、超音波プローブ(手すりシステムに取り付けられている)を女性の腹部の上に配置します。超音波プローブをゲル(z面)に下げ、下腹部(y面)をスキャンします(図2A)。
- 半手動アプローチ#2の場合、超音波プローブ(手すりシステムに取り付けられている)をゲルに下げて、下腹部を画像化します。プロセス中は超音波プローブを静止させ、取り付けられたホイールを使用して加熱テーブルをx面および/またはy面に沿って移動します(図2B)。
注:これらの初期の胚段階では、内臓、例えば腸は、超音波画像診断において子宮に類似して見えることがある。ただし、胚と脱落膜は一連の球体(ネックレスに沿ったビーズに似ています)として現れますが、腸は連続したチューブのように見えます。管腔空間(別々の球と連続したチューブ)の接続性は、目的の構造を前後にスキャンして、構造が個別の球(胚/脱落膜)(図2C)か連続チューブ(腸)(図2D)かを判断することで評価できます。この段階では、胚の数を記録する必要はありません。それらの存在または不在を確認するだけで十分です。
- 妊娠状態が判断されたら、超音波プローブを腹部から持ち上げ、湿ったティッシュペーパーで下腹部をきれいに拭いて超音波ジェルを取り除きます。
- イソフルランポンプのスイッチを切り、サージカルテープをはがして足を解放します。
- 女性を腹臥位(腹を下にして)で40°Cの加熱プレート上の清潔なケージに入れます。彼女が意識を取り戻すまで、女性を注意深く観察してください、それは2-6分かかります。
注:イソフルランへの曝露を最小限に抑えるために、1人の女性の超音波検査が<10分であることを確認してください。 - すべての材料と廃棄物を取り除き、70%エタノールですべての表面をきれいにします。超音波プローブから残っている超音波ゲルを、乾燥した柔らかく、糸くずの出ない紙のティッシュで拭き取ります。超音波装置、換気ベンチ/ BSL2ベンチ、加熱テーブル、およびO2 電源の電源を切ります。
4.胚病期分類のための超音波検査
注:このステップは手術前に実行され、ACサイズに応じて妊娠中の女性を層別化するのに役立ちます。このステップは、開発中のCNSをターゲットにすることが目的である場合、E7.5で非常に重要です。発達のこの初期段階では、発達における数時間の違いがACのサイズと神経の進行に大きく影響します。
- 手順3.1〜3.5の手順に従って、最初の妊娠中の雌マウスを麻酔します。
- 手順3.6の説明に従って、女性をテーブルに置いて固定します。
- 剃った腹部に梅サイズの超音波ジェルを塗布し、超音波プローブを下げて女性の下腹部を画像化します。
注:このステップでは、女性が前日に妊娠について超音波検査を受け、腹部の毛皮がすでに除去されていることを前提としています。そうでない場合は、手順3.7〜3.8に従って超音波ゲルを追加する前に毛皮を除去する必要があります。E7.5では、子宮と脱落膜が大きく、内臓と区別しやすくなっています。さらに、ACはより大きく、外頸腔(ExC)と区別することができる。 - 左右の子宮角をできるだけ完全にスキャンします。
注:一部の胚は女性の体の奥深くにあり、見逃される可能性があります。 - 胚の数と病期を記録します。理想的なサイズの羊膜腔、許容可能な空洞、および空洞のない落膜の数をメモします(図2E-G)。
- すべての妊娠をステージングし、それに応じてランク付けします。
- 超音波チェック(ステップ4.4)の直後に、ステップ4.5〜4.7の指示に従って、女性に理想的なサイズのACの大部分を注射します。
- 許容範囲の大部分(外頸腔および羊膜腔がまだ2つの空洞に明確に分割されていない)または空洞がない女性の場合は、注射を延期し、数時間後に再び段階を整えます。それでもほとんどの空洞が小さすぎる場合は、注射を10〜12時間延期します。
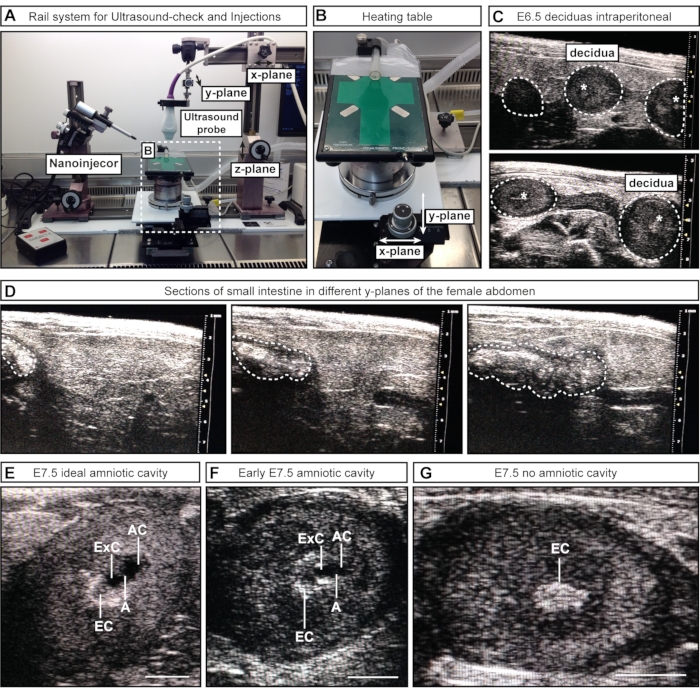
図2:超音波検査時の羊膜腔の検査と病期分類。 (A)超音波プローブ、ナノインジェクター、加熱テーブルが取り付けられたレールシステムの概要。超音波プローブは、x、y、z平面で移動して、女性の腹部またはACとの最適な位置合わせを実現できます。(B)加熱テーブルは、X面および/またはY面の2つの車輪を介して移動でき、ACの正確なスキャンと評価を可能にし、超音波プローブは静的なままにすることができます。(C)妊娠確認のための超音波検査中の女性腹部内のE6.5脱落膜の代表的な超音波画像(白い点線の輪郭)。この時点では空洞は形成されていません。ただし、場合によっては、外胎盤円錐(白いアスタリスク)が見えることがあります。落膜は球形によって認識でき、1つの連続した管として現れる腸と区別できます。(d)下腹部を連続的にスキャンする小腸の代表的な画像配列(白点線の輪郭)。(E-G)E7.5注射前の空洞病期分類中の代表的な超音波画像。羊膜および外眼腔が形成され、羊膜によって分離されている。外胎盤円錐は主要な血液供給として機能し、超音波の輝点として現れます。ACは外胎盤円錐から最も遠位です。(E)理想的なサイズのACは外脳腔よりも大きく見えますが、中型の空洞は小さく見えます(F)。空洞が見えない場合(G)、これは胚が再吸収されているか、まだE7.5に達していないことを意味します。スケールバー= 1 mm。 略語:A =アムニオン;AC =羊膜腔;ExC =外脳腔;EC =外胎盤円錐。この図の拡大版を表示するには、ここをクリックしてください。
5.注射日:手術のためにBSL2ベンチを準備します
- 市販の修正ペトリ皿の丸い中央開口部に1枚の弾性膜を接着します。漏れを防ぐために、メンブレンがペトリ皿にしっかりと取り付けられていることを確認してください。
注意: 皿が漏れたり、十分に接着されていない場合は、弾性膜の端をさらにダクトテープで固定できます。 - 弾性膜の中央に1〜1.5 cmの長さの切開を行います。
- 超音波装置、BSL2ベンチ、加熱プレート、イソフルランポンプ用のO2 供給、およびガラスビーズ滅菌器(300°Cに設定)の電源を入れます。
- BSL2ベンチ内に、空のゴミ袋を1つ置きます(簡単にアクセスできるように内壁にテープで留められています)。滅菌パック綿棒(各手術/各女性に新しい綿棒を使用してください);手術器具(はさみ、ピンセット、クリップ、縫合糸)、および外科用テープ。室温リン酸緩衝生理食塩水(PBS)のフルボトル1本、廃棄物収集用の空のボトル1本、および25 mLピペット1本。手術用の弾性膜を備えた1つのペトリ皿。ペトリ皿の蓋に2 x 2〜3 x 3 cmのパラフィルムを水滴で蓋に固定する。モデリング粘土:4つの大きなボールまたは立方体(~3 x 3 x 3 cm3)と1つの円筒形片(~4 x 1 cm)。鎮痛剤(例:ブプレノルフィン、体重0.05〜0.1 mg / kg)とアイジェルを含む注射器注:モデリング粘土のボール(または立方体)は、皿が女性の腹部の上に置かれると、ペトリ皿の「足」またはスタンド/ホルダーとして機能します。円筒形の粘土片が皿の中の胚を固定します。複数の溶液を注入する場合、または注射中に針を補充する必要がある場合、溶液の間隔を空けることができれば、同じパラフィルムを使用できます。
6.ニードルローディング
- グリップを良くするために、ティッシュペーパーで余分なミネラルオイルを拭き取ります。
注意: 損傷や怪我を防ぐために、常に先端から離れて清掃してください。 - すべてのコンポーネント(1つのシーリングOリング、1つのスペーサー、および1つのフロントガスケット-すべてコレットの下に収納、図 3A)が正しい向きで取り付けられていることを確認します(図3B、視覚化のためにコレットを取り外しました)キャピラリーニードルを所定の位置に保持し、気密接続を作成し、ニードル内の金属プランジャーを前進または収縮させるときに気泡が形成されないようにします。
- ナノインジェクターの金属プランジャーが完全に引っ込められていることを確認してください。 [Fill] を押して確認し、プランジャーが完全に格納されたことを示すビープ音が2回鳴るまで待ちます。
- コレットを取り付けた状態で、わずかに緩めた状態で(ネジを45〜90度緩めます)、ガラス針を金属プランジャーにスライドさせ、キャピラリー針を金属プランジャーと一緒にフロントガスケットに通してスペーサーに到達するまで押し込みます(図3C、D、視覚化のためにコレットを取り外しました)。
注意: プランジャーがガスケットを通過すると抵抗が現れ、スペーサーに到達すると減少します。キャピラリーニードルがスペーサーにしっかりと挿入され、気密接続されていることを確認します(図3D)。 - ナノインジェクターのコレットを締めて針を固定します(しっかりとねじ込みます)。
注意: 針を押しつぶす可能性があるため、締めすぎないでください。 - 空を押してプランジャーを針に押し込み、針先からオイルを排出します。ガラス針が動いたら、プランジャーを引っ込め、針を取り外してリロードします。気泡が発生した場合は、針を外して鉱物油を補充してください。
注意: 適切に固定された針は、プランジャーと一緒に動かないでください。 - ウイルス(~6 μL)または他の注射液をパラフィルム1 の上に置きます(図3E;エバンスブルー染料は視覚化の目的で使用されます)。
注:ナノインジェクターの最大容量は~5μLです。 - フィルを押して気泡を作成し、オイルと溶液の間の仕切りとして機能します(図3F)。
注意: これは、針を充填または空にするときの位置決めマーカーとしても機能します。 - 針を下げ、先端を溶液に浸し、 塗りつぶ しを押します(図3F、G)。
- 気泡の後に溶液がロードされるときの液面を監視します。 Empty を押して詰まりを排出し、液体が針に入らずに気泡が細長くなった場合は Fill を押してリロードします。これで問題が解決しない場合は、針を交換してください。
- 針が完全にロードされたら(図3H)、z平面で針を持ち上げ、先端で少量の空気を吸引して、針の先端での溶液の蒸発と針の詰まりを防ぎます。
- 偶発的な損傷や怪我を防ぐために、針を取り付けたナノインジェクターをオペレーターから遠ざけ、ベンチの後ろに向かって回します。

図3:ナノインジェクターへの針の取り付けと溶液の装填。 (A)ニードルがナノインジェクターに取り付けられる前の開始位置:金属プランジャーが完全に引っ込められ、コレットが取り付けられます。(B)コレットの下には、針を保持して固定するための3つのコンポーネントすべてが正しい順序(左から右へ)で示されています:シーリングOリング(薄くて黒)、スペーサー(白)、大きな穴のあるOリング(黒)(針が通過する必要があります)。気密接続を確保するために、ガラス針を金属プランジャー(C)の上をスライドさせ、スペーサー(D)に到達するまでフロントOリングの開口部から押し込みます。(E-H)針への溶液の装填。(e)1滴の溶液をプレート蓋上のパラフィルムの上に置く。(F)溶液をロードする前にフィルを押して気泡を作成し、針先を溶液に浸します。(G)溶液が針にロードされています。(h)溶液を針に装填する。注:コレットは視覚化のために(B-D)で削除されていますが、実験中は添付されたままにしておく必要があります。針を固定する最後のステップは、コレットを締めることです。エバンスブルー染料は、E-Hでの視覚化に使用されます。この図の拡大版を表示するには、ここをクリックしてください。
7.注射
注:この手順で使用されるすべての器具は、手術前および各マウス間で滅菌されます。
- 理想的なサイズの空洞を持つ最初の女性を麻酔します(セクション4を参照)。
- 手順3.1〜3.6で説明されているように、女性をテーブルに置いて固定します。
- アイジェルを目に塗り、角膜の乾燥を防ぎ、鎮痛剤を皮下注射します。
注:推奨される鎮痛薬:ブプレノルフィン(0.05-0.1 mg / kg体重)またはフルニキシン(2.5 mg / kg)または地域の動物福祉規制に従った同様のもの。マルチモーダル周術期鎮痛は、注射された鎮痛薬とイソフルランで維持されます。 - 0.5 mg / mLクロルヘキシジン溶液(または同様のもの)に浸した布で拭いて下腹部を無菌的に準備し、皮膚を乾燥させます。.外科用ハサミを使用して、下腹部に1.5〜2.0 cmの垂直正中線皮膚切開を行います。
注意: 地元で承認された消毒ルーチンに従って手術領域を準備します。 - 皮膚をやさしく持ち上げ、切開点の約1cmの筋肉層から皮膚を解放して、手術後の縫合を容易にします。
- 筋肉層に1cmの垂直正中線切開を行います。
- 一対の鉗子で、皮膚と筋肉層の片側を持ち上げ、もう一方の対で子宮角を探します。
注:落膜はネックレスにビーズのように配置されていますが、腸は1本の長い連続したチューブです(図4A)。 - 鉗子を使用して、腹部から両方の子宮角を慎重に引き出します。胚の間に組織を保持します。それらを直接絞らないでください(図4B)。
注:子宮は子宮頸部で体に取り付けられており、2つの卵巣/卵管は靭帯を介して取り付けられています。これらのアンカーポイントから子宮を引っ張ったり取り外したりしないでください。 - 左側と右側の胚の数を数えてメモします。
- 卵巣から子宮頸部まで、または子宮頸部から卵巣までのいずれかの胚に番号を付けます。
注:これは、注入された胚が胚の段階で収集される場合に特に重要です。 - 湿った綿棒で、注射する最初の3つを除くすべての胚を腹腔内にそっと押し戻します。
- ペトリ皿の弾性体にPBSを一滴置き、胚のすぐ上に保持します。
- 閉じた鉗子を弾性の切開部に挿入し、鉗子を解放して弾性切開を開き、液体が胚に落ちるようにします。
注:これにより、胚の水分補給が保証され、弾性膜が女性の濡れた皮膚に付着し、次のステップでのPBSの漏れを防ぎます。 - 鉗子で弾性を通して、3つの胚に対応する子宮の部分を引っ張り、女性の腹部にペトリ皿をそっととめます。
- 鉗子と湿った綿棒を使用して、子宮の位置と弾性体を調整して、PBSの漏れを防ぐために弾性体が女性の皮膚に密閉されるようにします。
- 4本の粘土の足を使用して、腹部のすぐ上にペトリ皿を固定して固定し、女性への圧力と、女性の呼吸と心拍に対する画像の感度を軽減します。
- モデリング粘土シリンダーを胚/子宮の右側に押し下げて、子宮を固定します(図4C)。
注:この方向指示は、針が女性の左側にあり、女性の左子宮角の胚が露出していることを前提としています。ACは針(左角; 図 4D)または安定化粘土シリンダー(右ホーン; 図4E)。 - 右の子宮角から胚を注入するには、粘土シリンダーを胚の左側に置き(図4F)、加熱テーブルを180°回して(図4G)、正しい向きにします。代わりに針を動かすことができる場合は、関連するセットアップに合わせて調整してください。
- 胚と子宮がPBSで覆われるまで、ペトリ皿にPBSを追加します。
- 超音波プローブをPBSに下げ、最初の胚が超音波プローブと整列するようにマウス/手術台を調整して、注射の記録を容易にします。
注:「最初」とは、卵巣から子宮頸部までの胚の番号付けを指します。 - 3つの胚すべてをスキャンし、ACを検査します。次のように注入量を決定します。
- 超音波装置でACの直径を測定します。AC直径が≤0.2 mmの場合は69 nLを注入します。AC直径が>0.2mmおよび≤0.29mmの場合、2 x 69nL(= 138nL)を注入します。AC直径が0.29 mmの場合は、3 x 69 nL(= 207 nL)>注入します(図4H)。
注:以前の実験では、E7.515で最大207nLの注入量が十分に許容されることが示されています。生存への影響を最小限に抑えた注射の成功は、ACの相対体積増加が90%を超えない場合に達成されます15。同腹仔またはマウス系統間のACサイズの変動は一般的であり、さらなる最適化が必要な場合があります。
- 超音波装置でACの直径を測定します。AC直径が≤0.2 mmの場合は69 nLを注入します。AC直径が>0.2mmおよび≤0.29mmの場合、2 x 69nL(= 138nL)を注入します。AC直径が0.29 mmの場合は、3 x 69 nL(= 207 nL)>注入します(図4H)。
- 注入コントローラーで注入量を設定します。
- 射出速度を23nL/sで 遅く 設定します。
注意: 機器モデルが異なれば、射出力も異なります。 - レールシステムの主輪(x面とz面、 図4I)を使用して針をPBSに下げ、液体が針の先端に到達するまでナノインジェクターコントローラーの Empty を押します。
注意: 針が詰まっている場合は、 空 を押すと詰まりが解消されたり、詰まりが排出されたりする可能性があります。 - 針をPBSから持ち上げて、 注入を押します。おおよその希望の量の滴が排出されていることを確認します。
- 針をPBSに下げ、マイクロマニピュレーターのy面ホイールでナノインジェクターを動かして、超音波プローブと胚に合わせます(図4J)。
注意: 針の先端は、超音波画像に明るいスポットとして表示される場合、完全に位置合わせされています(図4K、L)。針は、マイクロマニピュレータで3つの方向すべての平面に移動できます。 - 注入角度ホイールで針の角度を調整して、子宮壁に対してほぼ垂直な注入角度を確保します。マイクロマニピュレーターの注入ホイールを使用して、針をACに1回の動きで挿入します(図4J-M)。針先の明るさに注意してください。針先が超音波画像から消えた場合は、超音波プローブを前後に動かして針の焦点を元に戻します。
注:針がAC内に入ると、胚に害を与えることなく、針の位置と焦点にわずかな変更を加えることができます(~0.3 mm以内の調整)。これ以上針の位置を調整しないでください。 - インジェクションを押します(207 nLの場合は、容量を69 nLに設定し、3回注入します)。注射後、さらに5〜10秒待ってから、針を1回の穏やかな動きで引っ込めます。
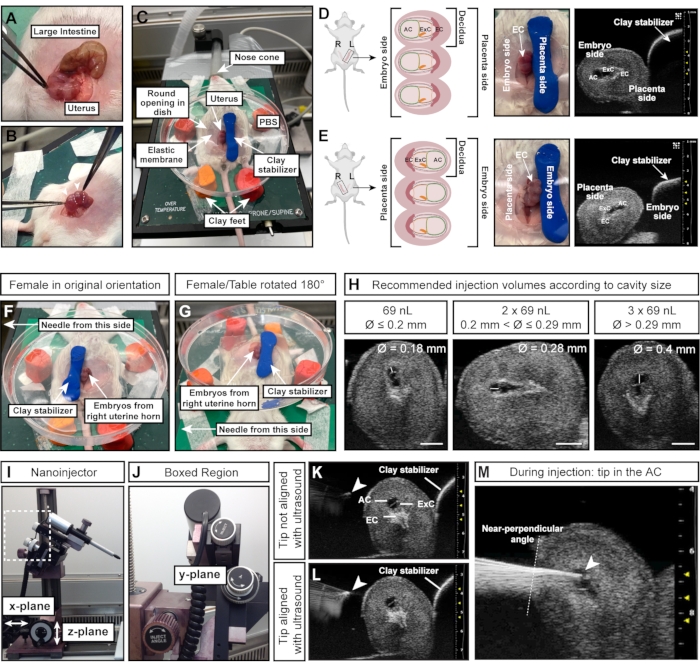
図4:注射を成功させるための羊膜腔の最適なサイズと向き 。 (A)大腸(上)と比較して球のストリング(下)のような形をした、複数のE7.5脱落膜を持つ子宮角。(B)脱落膜の間の子宮組織(白い点線)をつかみます。落葉筋(白矢じり)を鉗子で直接絞るのは、落葉筋や発育中の胚はこの初期段階では壊れやすく、過度の外力で吸収されやすいため、避けてください。(C)PBSで満たされたペトリ皿にデシダスが露出し、4フィートのモデリング粘土に取り付けられた仰臥位の女性。落膜は、円柱のような形をした追加のモデリング粘土によって安定しています。(D、 E)ACの向きは、露出している子宮角の側面に影響されます。左の子宮角からの落葉体を使用する場合、ACは粘土安定剤の反対側を向いており、左側の針に簡単にアクセスできます(D)。ただし、右の子宮角を使用すると、外胎盤円錐が代わりに針に面するため、AC(E)へのアクセスがより困難になります。そのため、右子宮角に注入する場合、粘土安定剤を針を向いた側(F)に向けて配置し、加熱台全体を180°回転させる(G)。(H)ACサイズに応じた推奨注入量。一般に、直径0.2mm≤キャビティは最大69nLで注入できます。直径 0.2 mm ≤および 0.29 mm >最大 2 x 69 nL (138 nL) の容量を許容し、0.29 mm >空洞には 3 x 69 nL (207 nL) を注入できます。スケールバー= 1 mm。 (I、J) ナノインジェクターはレールシステムに取り付けられており、x面および/またはz面で移動できます。針の角度は、 インジェクトアングル ホイールで調整できます。(K, L)針先(白い矢印)は、超音波(L)で最も明るく見えるときにACと位置合わせされます。(m)注射工程を示す超音波画像で、針先がACにあり、よく整列している(白矢印)。略語:A =アムニオン;AC =羊膜腔;ExC =外脳腔;EC =外胎盤円錐。 この図の拡大版を表示するには、ここをクリックしてください。
- ステージを次の胚に移動し、他の2つの胚が適切なACサイズを持っている場合は、手順7.22〜7.26を繰り返します。
- マイクロマニピュレーターを使用して、超音波プローブと針をPBSから持ち上げます。損傷や怪我を避けるために、針をオペレーターから遠ざけてください。
- 鉗子を使用して、1番目 と2番目の 胚を弾性体にそっと押して、女性の腹部に戻します。3番目の 胚に隣接する組織をそっとつかみ、子宮を弾性切開の上端に向かって引っ張ります。4番目から6番目の 胚を鉗子で静かに引き上げ、3番目の 胚が腹部に再び入るようにします。
注意: この手順は、PBSを変更したり、ペトリ皿を取り外したりせずに実行できます。 - 最適なACを持つすべての胚が注入されるか、制限時間に達するまで、必要に応じて繰り返します。
- 胚/子宮を女性の腹部にそっと押し戻します。
- PBSを吸引し、ペトリ皿を取り外します。ウイルスが使用されている場合は、感染性廃棄物として処理してください。
- 筋肉層をVicryl(USP 6-0、針の長さ13 mm、3/8円)で単純な連続または中断された縫合糸で縫い合わせ、1〜2個のクリップで皮膚を閉じます( 材料の表を参照)。
- イソフルランポンプのスイッチを切ります。
- サージカルテープをはがし、40°Cの加熱プレート上の清潔なケージに女性を腹臥位(腹を下にして)に置きます。
注:女性は意識を取り戻し、10分以内に移動することが期待されています。手順が30分以内に完了することを確認してください。女性の遺伝的背景、年齢、体重は、麻酔に対する感受性に影響を与える可能性があります。手術中にマウスを監視して、呼吸が遅い(呼吸が遅いとは麻酔が深すぎることを意味します)または動き(麻酔が軽すぎる)の兆候がないか確認します。ブプレノルフィン(0.05-0.1 mg / kg体重)またはフルニキシン(2.5 mg / kg)または同様のものは、地域の動物福祉規制に従って、必要に応じて最初の注射の8時間後に提供できます。. - 別の女性が注射される場合は、最初の女性の目覚めを監視しながら手術領域を準備します。
- 手術器具を70%エタノールで拭いて、残っている血液や組織を取り除き、予熱したガラスビーズ滅菌器で10秒間滅菌します。綿棒と使用済みのティッシュペーパーは廃棄してください。シャーレと粘土片をティッシュペーパーで拭いて乾かします。
- すべての女性が注射されるまで、手順7.1〜7.35を繰り返します。
- 針を空にして捨てます。
- 針にウイルスまたは注射液が残っている場合は、ナノインジェクターの [ 空]を押し、ティッシュペーパーの針の内容物を空にします。
- コントローラからビープ音が 2 回鳴り、プランジャが完全に引っ込められたことを示すまで Fill を押して、金属製プランジャを完全に引っ込めます。
- コレットを緩め、針を金属製プランジャーからスライドさせます。針を鋭利な廃棄物容器に捨てます。
- BSL-2ベンチを清掃します。
- ウイルスを使用した場合は、手術野全体に消毒剤をスプレーします( 材料表を参照)。15分後、消毒液を拭き取り、70%エタノールで手術野全体を洗浄します。ウイルスを使用しない場合は、70%エタノールですべての表面を洗浄します。
- 超音波プローブから残っているPBSを、乾いた柔らかく、糸くずの出ないティッシュペーパーで拭き取ります。
- バイオセーフティガイドラインに従って廃棄物を廃棄します。
- 超音波装置、加熱台、BSL2ベンチ、およびO2 電源の電源を切ります。
結果
hPGK-H2B-GFPレンチウイルス11,12をE7.5で注射した胚をE13.5で採取し、蛍光解剖顕微鏡で調べた(図5A)。神経板の形質導入が成功すると、主に脳および他の外胚葉由来組織、例えば皮膚において蛍光レポーターが強く発現する胚が生じる(図5A、B)。過度に高い容量(ここで推奨される容量よりも大きい、たとえば≥500 nL)を注入すると、AC内の圧力が上昇し、完全な吸収(データは示されていません)または脳症などの神経管欠損を引き起こす可能性があります(図5A)。E7.5での注射が成功すると、前脳から後脳への均一な形質導入が得られます(図5C-J)。
レンチウイルス力価は約2 × 1010感染単位(IFU)で95%以上のターゲティングを達成し、1~1 ×10 9 IFUの力価は15%のターゲティング効率を達成します15。さらに、脈絡叢17,18など、これまでエレクトロポレーションを使用して標的とすることが困難であった構造も標的としています(図5 E、F)。形質導入の有効性は、ACに送達されるウイルス力価を調整することによって変更することができる。 低力価の注射は単一細胞クローンの形質導入をもたらし(図5C、図5E、および図5G、H)、高力価ウイルスの使用は脳全体のほぼ100%の形質導入をもたらします(図5D、図5F、図5H、および図5J).したがって、NEPTUNEは、クローン形質導入、系統追跡、および遺伝子スクリーニングアプローチのいずれか、または脳全体における遺伝子過剰発現またはダウンレギュレーションの全体的な影響の研究に使用できます。
哺乳類の眼の発達は、胚性外胚葉の3つの派生物間のよく組織化されたコミュニケーションの結果です:神経網膜(NR)と網膜色素上皮(RPE)は腹側前脳の神経上皮に由来し、表面外胚葉は将来の水晶体と角膜上皮を生じさせます。しかしながら、中枢間質および後内皮、角膜の他の2つの層は、眼周囲間葉の神経堤細胞に由来する19、20。E13.5胚を通した冠状切片に高力価レンチウイルスをE7.5で注射したところ、脳と同様に、眼の神経組織、ならびに水晶体、角膜、間葉樹の高度で均一な形質導入が示されました(図5K)。神経形成が進行するにつれて、E8.5およびE9.5での注射は、水晶体および角膜上皮の継続的な標的化をもたらし(図5Lおよび図5N)、眼の神経外胚葉由来組織の形質導入は、E8.5(図5L、M)またはE9.5を標的としない(図5N)で効率が低下する。
ほとんどのウイルス粒子は注射時に露出した組織に感染しますが、一部の粒子は後に発生する非外胚葉由来の組織を形質導入します(図6A)。唾液腺と唾液管は、口腔上皮21からE11.5 の周りに発生し、ネプチューンを標的としています(図6B)。E9.5での注射後、舌の舌上皮はよく形質導入されます。しかしながら、根底にある間葉は陰性である(図6C;括弧は形質導入された細胞を示し、アスタリスクは形質導入されていない細胞を示す。さらに、舌上皮内には陰性のセクションで区切られた陽性のクラスターがあり(図6C、白い矢印)、乳頭表面の形質導入を示唆しています。神経堤細胞は、下にある舌間葉および舌上皮内で説明されており、そこでは味乳頭および味蕾の発生に関与している22。実際、E7.5での注射は、E13.5での舌間葉の広範な形質導入をもたらし(図6D)、早期注射が神経堤細胞を標的とし、舌の間葉に寄与することを示唆しています。
脊椎動物では、後根神経節(DRG)は末梢神経系(PNS)の中心的な構成要素であり、体の末梢からのすべての体性感覚入力(温度、痛み、圧力)はDRGニューロン23の活性化を介して脳に伝達されます。DRGのニューロンおよびグリア細胞の両方が、体幹神経堤細胞24に由来する。ユビキタスhPGKプロモーターが蛍光レポーターの発現を制御するレンチウイルス注射は、中枢神経系および末梢神経系(図7A)の広範な標的化をもたらし、脊髄のニューロンと前駆細胞の両方(図7B)、およびDRG(図7C)を形質導入します。ダブルコルチン25にミニプロモーターを使用すると、GFP発現をニューロンのみに制限することができます(図15および図7D、E)。
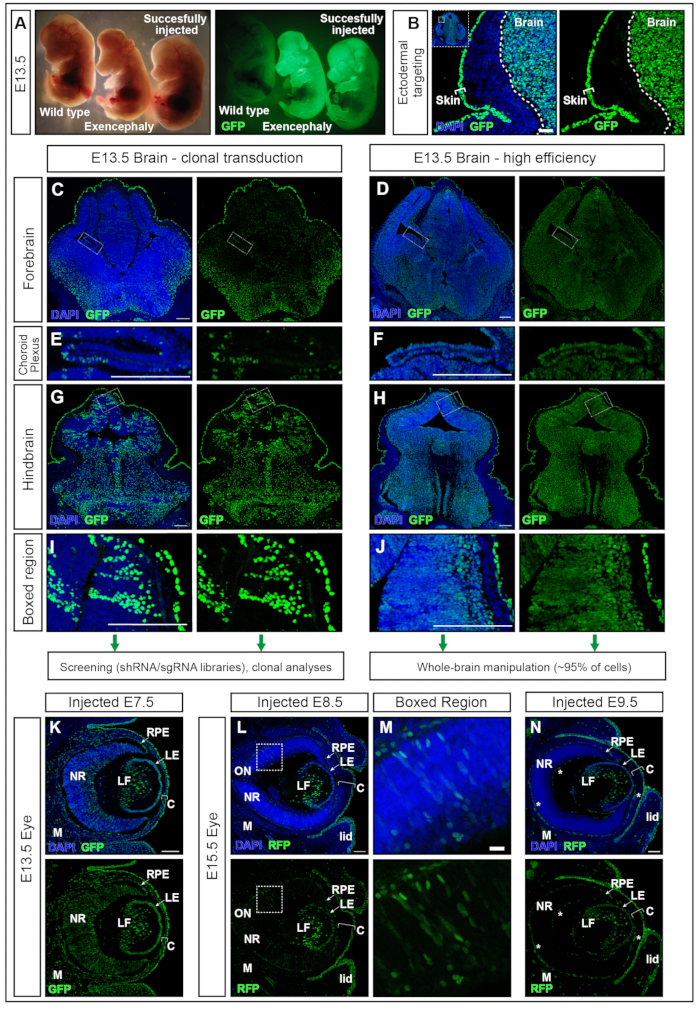
図5:ネプチューンによる高効率またはクローン形質導入。 (A)標準照明で照らされた解剖顕微鏡下のE13.5胚(左パネル)とGFPで照らされた同じ胚(右パネル)。左端に未注入胚、右端に胚の注入に成功し、脳内で陽性のシグナルを生じる(右端の胚)。過剰量の注入による外脳胚(中胚)。(B)E7.5注射による皮膚と脳の標的化。スケールバー= 50 μm。 (C、D)低クローン形質導入(C)または高効率形質導入(D)の前脳のE13.5共焦点画像。(C, E, G, I)脳内の異なる領域のクローン形質導入。(D, F, H, J)脳内の異なる領域の高効率トランスダクション。スケールバー= 200μm。異なる形質導入有効性は、CNSの他の領域を代表するものである。(E, F)脈絡叢を標的とする、クローン的(E)または高効率(F)。スケールバー = 200 μm。 (G, H) 後脳のクローンターゲティング(G)および高効率(H)ターゲティング、(I、J)で拡大。スケールバー = 200 μm。 (K)E7.5での子宮内注射後のE13.5での眼におけるGFPレポーター発現(L、M)E8.5(L)での子宮内注射後のE15.5での眼におけるGFPレポーター発現(M)、またはE9.5(N)で拡大されたボックス化された領域。自己蛍光血管は白い星でマークされています。スケールバー= 100μm。略語:海王星=子宮内では、子宮内では遅くなります。 C =角膜;LE =水晶体上皮;LF =レンズファイバー;M =間葉;NR =神経網膜;ON =視神経;RPE =網膜色素上皮;GFP = 緑色蛍光タンパク質;中枢神経系=中枢神経系。この図の拡大版を表示するには、ここをクリックしてください。
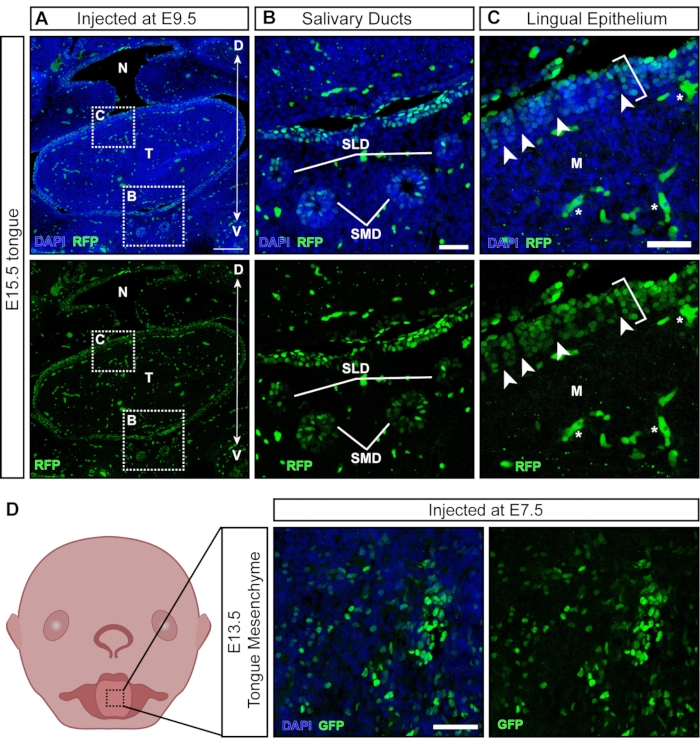
図6:非神経組織の子宮内導入。 (A)E15.5口腔の共焦点画像。胚に蛍光レポーターレンチウイルスをE9.5で注射した。スケールバー = 200 μm。 (B, C) (B) はめ込みパネルの倍率;ウイルスで形質導入された唾液管上皮。(C)はめ込みパネルの倍率。GFPレポーターウイルスで形質導入された背側舌上皮(白括弧)。神経堤細胞に由来する根底にある間葉系は陰性です。白い矢印は、ウイルス形質導入上皮細胞に囲まれた陰性の神経堤細胞を持つ乳頭を示しています(自己蛍光性血液細胞/血管は白い星でマークされています)。スケールバー = 50 μm。 (D)E7.5に蛍光レポーターウイルスを注射した後のE13.5舌間葉の概略図および共焦点画像。スケールバー= 50μm。 略語:D =背側;M =間葉;N =鼻咽頭;SLD =舌下管;SMD =顎下管;T =舌;V =腹側;GFP = 緑色蛍光タンパク質。この図の拡大版を表示するには、ここをクリックしてください。
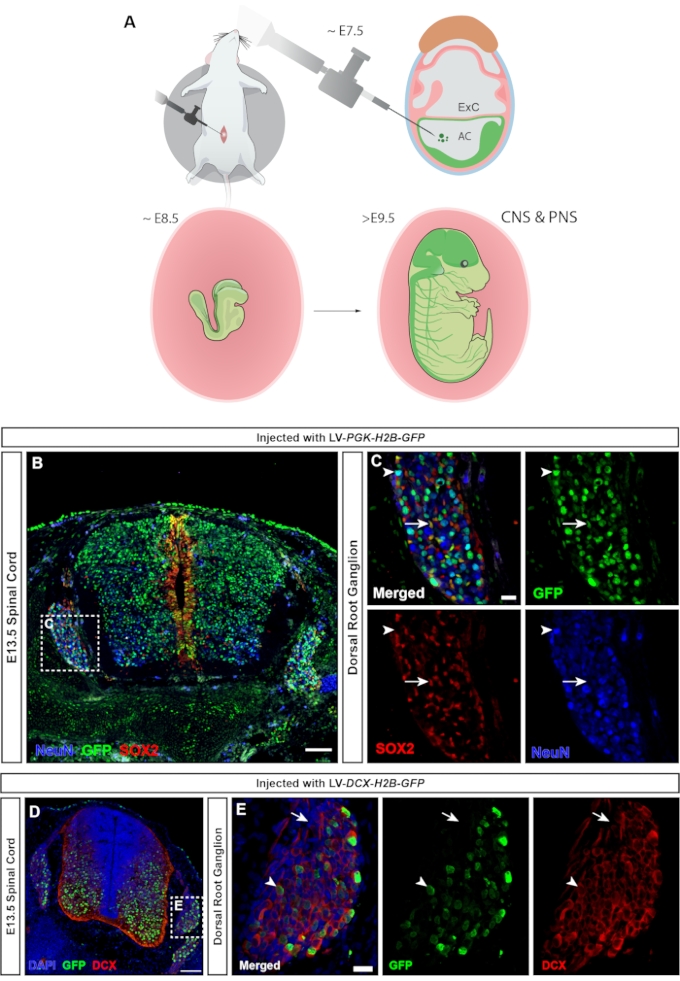
図7:神経堤由来後根神経節細胞の形質導入。 (A)E7.5でのネプチューンターゲティングは、CNSとPNSの両方のターゲティングを可能にします。(B)E13.5脊髄とE7.5でhPGK-H2B-GFPレポーターレンチウイルスを注射したDRGの共焦点画像は、SOX2+神経前駆細胞とNeuN+ニューロンの両方の形質導入を示しています。スケールバー = 100 μm。 (C)SOX2+(白矢印)およびNeuN+(白矢印)細胞集団におけるGFP発現を有するDRGを示すBの四角形領域。スケールバー= 20μm。 (D)E13.5脊髄と、DCX+細胞のみを標的としたE7.5でDCX-H2B-GFPレンチウイルスを注射したDRGの共焦点画像。スケールバー= 100μm。 (E)DCX+ニューロンに限定されたGFP発現を有するDRGを示すDのボックス領域(白い矢印)。DCX−細胞はGFPに対して陰性である(白い矢印)。スケールバー= 20μm。略語:海王星=子宮内では、子宮内では遅くなります。 CNS =中枢神経系;PNS =末梢神経系;DRG =後根神経節;GFP = 緑色蛍光タンパク質。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このプロトコルには、胚の生存、注射の質、および読み出しに影響を与えるいくつかのステップがあります。胚の妊娠期間は、一晩交配した後の膣栓の日の正午にE0.5と定義される。午後遅く/夕方にE6.5で妊娠の超音波検査を行うことで、胚が超音波で識別されるのに十分なほど発達していることが保証されます。このチェックにより、(1)プラグ陽性マウスが実際に妊娠している数の事前スクリーニングが可能になり、(2)プラグ陽性マウスが妊娠していない場合にウイルスが不必要に解凍されて無駄にならないようにし、(3)マウスへの不必要な介入を減らします(妊娠していない女性への手術を回避します)。
E7.5では、胚は外力に敏感であり、注意して取り扱う必要があります。例えば、子宮角を引っ張ったり、脱落膜を絞ったりすると、胚の吸収につながる可能性があります。子宮組織は、組織が乾燥するのを防ぐために、女性の腹部の外側にあるときは常に湿った状態に保つ必要があります。落膜の大部分は女性の腹部の内側に留まり、注射のために露出するのは3〜4個だけです。針の鋭さは、注射を成功させるためのもう一つの重要な決定要因です。針先が鈍くなったり折れたりすると、ACに入る前に脱落膜が繰り返し突かれたり、モデリング粘土に圧縮されたりして、吸収率を高めることができます。したがって、よく挽いた鋭利な針は常に安全に保管し、最大2匹の女性の後に交換する必要があります。
このプロトコルは、レンチウイルスの1回の単回注射で神経板を標的にする方法を説明しています。さらに、形質導入の有効性を単一細胞クローンから脳全体にどのように適応させることができるかを示しています。ただし、皮膚や口腔上皮を含む他の非神経組織も標的としています。さらに、すべての細胞型(前駆細胞および分化細胞)が形質導入されるため、このアプローチは効率的ですが非特異的です。ウイルス構築物におけるMiniPropatorsの使用は、ニューロンまたは星状細胞における導入遺伝子の特異的発現をもたらす15。これは、専用のトランスジェニックCre動物の使用を回避し、したがって労力(株の維持およびジェノタイピング)およびコストを削減するという利点を有する。
NEPTUNEの限界には、その技術的な難しさ、予測可能で一貫した速度で妊娠中の女性を取得することの課題、および特殊な機器を取得するためのコストが含まれます。さらに、レンチウイルスによる細胞の非選択的標的化は、この技術の利点と制限の両方と見なすことができます。ACにより大きなボリュームを注入すると、脳奇形と外脳症はここで説明するボリュームで回避されますが、13はexencephalyをもたらします15。したがって、脳の発達への悪影響は、胚期とACサイズに適合した正しい量を注入することによって慎重に回避しなければならない 子宮内 ナノ注射のリスクです。
この技術の将来の適応は、ウイルスの向性に焦点を当てる可能性があります。アデノ随伴ウイルス(AAV)は異なる血清型を有し、CNSの異なる細胞型を頑健に標的とすることが示されている17,26。ただし、AAVは宿主細胞ゲノムに組み込まれないため、分裂率の高い細胞では失われる可能性があります。ネプチューンの特異性を高める方法はいくつかありますが、生体内での遺伝子操作に関しては、トランスジェニック動物が依然としてゴールドスタンダードです。Cas9マウスおよびsgRNAコードレンチウイルスは、胚性表皮27における遺伝子スクリーニングに使用されており、また、発生中のCNSに適合し得る。
E7.5のACへの注射は、神経形成の開始前に神経外胚葉の細胞を効率的に標的とし、 子宮 内エレクトロポレーションよりも効率的に発達中の脳を標的とする。これにより、脳の発達に重要な遺伝的手がかりを早い時点から研究することができます。古典的な遺伝子マウスモデルとは対照的に、NEPTUNEは機能的遺伝子解析を実行するための柔軟なアプローチを提供します。過剰発現または遺伝子欠失後の表現型は、数ヶ月または数年と比較して数日から数週間以内に研究することができる。複数のウイルス構築物の注射は、1つの胚内のいくつかの遺伝子の操作を可能にし、二重または三重ノックアウト動物の生成を回避する。したがって、NEPTUNEは時間を節約するだけでなく、研究に使用される動物の数を減らすこともできます。
開示事項
著者は競合する利益を宣言しません。
謝辞
マウスの専門家によるケアをしてくれたベッティーナ・セムシュとジア・サン(インフィニジーン)に感謝します。Biomedicum Imaging Core(BIC)のFlorian Salomons氏とGöran Månsson氏が画像取得と相談を支援。資金:このプロジェクトを支援してくれた次の資金提供者に感謝します:スウェーデン研究評議会、カロリンスカ研究所(KI財団、キャリア開発助成金、博士課程の学生KID資金、SFOストラトニューロ資金、革新的医学センター)、オリーとエロフエリクソン財団、トルンスピラン財団、ジャンソン財団、スヴェンとエバクリスティーナハグバーグ賞と研究助成金、 Knut and Alice Wallenberg Project Grant、Fredrik and Ingrid Thurings Foundation、Lars Hiertas Minne、The Childhood Cancer Foundation (Barncancerfonden)、The Åhlen Foundation、Åke Wibergs Foundation、Torre Nilssons Foundation、Swedish Foundations Starting Grant to ERA。図4D,Eは BioRender.com で作成した。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | BD Bioscience | 309628 | |
| 27 G Needle | BD Bioscience | 300635 | |
| 3.5 inches capillaries | Drummond Scientific | 3000203G/X | Were used to pull in house needles |
| 70 MHz MS Series transducer | Visual Sonics | MS700 | |
| Aquasonic clear ultrasound gel | Parker Laboratories | Mar-50 | |
| Autoclip Applier 9 mm | Angthos | 12020-09 | |
| CD1 mice | Charles River, Germany | Crl:CD1(ICR) | Females: from age of 8 weeks old Males: from the age of 12 weeks old |
| Cotton Swab | OneMed Sverige AB | 120788 | |
| DPBS | Gibco | 14190094 | |
| Dressing forceps delicate straight 13 cm | Agnthos | 08-032-130 | |
| EG-400 Narishige Micropipette Grinder | Narishige | NA | |
| EZ clips 9 mm | Angthos | 59027 | clips |
| Iris Scissors, Super Cut, straight, 9 cm | Agnthos | 307-336-090 | |
| Isofluorane | Baxter Medical AB | EAN: 50085412586613 | Purchased from Swedish Pharmacy |
| Kimwipes | Kimberly Clarke | 7557 | |
| Membrane Tape | Visual Sonics | SA-11053 | |
| Micropipette Puller | Sutter Instrument | P-97 | |
| Modeling Clay | Sense AB | 10209 | |
| Mouse Handling Table | Visual Sonics | 50249 | |
| Nanoject II Auto Injector Kit | Drummond | 3-000-205A | |
| Parafilm | Bemis | HS234526C | |
| Petri dish with central opening (low wall) | Visual Sonics | SA-11620 | |
| Petri dish, (ØxH): 92 x 16 mm | Sarstedt | 82.1472.001 | |
| Rely+On Virkon | DuPont | 130000132037 | disinfectant |
| Silicone membrane | Visual Sonics | SA-11054 | |
| Steri 250, hot bead sterilizer | Angthos | 31100 | |
| Surgical Tape (1.25 cm x 9.14 m) | Medicarrier | 67034 | |
| Vevo Compact Dual (Med. Air & O2) Anesthesia System | Visual Sonics | VS-12055 | |
| Vevo Imaging Station 2 | Visual Sonics | VS-11983 | |
| Vevo2100 | Visual Sonics | VS-20047 | |
| Vicryl 6-0; C-3 needle, 45 cm purple filament | Agnthos | J384H |
参考文献
- Theiler, K. . The House mouse. Atlas of embryonic development. , (1989).
- Barresi, M. J. F., Gilbert, S. F. . Developmental biology. , (2016).
- Taylor, J. C., et al. Factors influencing success of clinical genome sequencing across a broad spectrum of disorders. Nature Genetics. 47 (7), 717-726 (2015).
- Pizzo, L., et al. Rare variants in the genetic background modulate cognitive and developmental phenotypes in individuals carrying disease-associated variants. Genetics in Medicine. 21 (4), 816-825 (2019).
- Sakai, Y. Neurulation in the mouse: Manner and timing of neural tube closure. The Anatomical Record. 223 (2), 194-203 (1989).
- Schoenwolf, G. C. Shaping and bending of the avian neuroepithelium: Morphometric analyses. Developmental Biology. 109 (1), 127-139 (1985).
- Smith, J. L., Schoenwolf, G. C., Quan, J. Quantitative analyses of neuroepithelial cell shapes during bending of the mouse neural plate. Journal of Comparative Neurology. 342 (1), 144-151 (1994).
- Katahira, T., Nakamura, H. Gene silencing in chick embryos with a vector-based small interfering RNA system. Development Growth and Differentiation. 45 (4), 361-367 (2003).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. I. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochemical and Biophysical Research Communications. 230 (2), 376-380 (1997).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Beronja, S., Livshits, G., Williams, S., Fuchs, E. Rapid functional dissection of genetic networks via tissue-specific transduction and RNAi in mouse embryos. Nature Medicine. 16 (7), 821-827 (2010).
- Pierfelice, T. J., Gaiano, N. Ultrasound-guided microinjection into the mouse forebrain in utero at E9.5. Journal of Visualized Experiments JoVE. (45), e2047 (2010).
- Gaiano, N., Kohtz, J. D., Turnbull, D. H., Fishell, G. A method for rapid gain-of-function studies in the mouse embryonic nervous system. Nature Neuroscience. 2 (9), 812-819 (1999).
- Slevin, J. C., et al. High resolution ultrasound-guided microinjection for interventional studies of early embryonic and placental development in vivo in mice. BMC Developmental Biology. 6, 10 (2006).
- Mangold, K., et al. Highly efficient manipulation of nervous system gene expression with NEPTUNE. Cell Reports Methods. 1, 100043 (2021).
- Kameneva, P., et al. Single-cell transcriptomics of human embryos identifies multiple sympathoblast lineages with potential implications for neuroblastoma origin. Nature Genetics. 53 (5), 694-706 (2021).
- Kaiser, K., et al. MEIS-WNT5A axis regulates development of fourth ventricle choroid plexus. Development. 148 (10), (2021).
- Haddad, M. R., Donsante, A., Zerfas, P., Kaler, S. G. Fetal brain-directed AAV gene therapy results in rapid, robust, and persistent transduction of mouse choroid plexus epithelia. Molecular Therapy. Nucleic Acids. 2 (6), 101 (2013).
- Heavner, W., Pevny, L. Eye development and retinogenesis. Cold Spring Harbor Perspectives in Biology. 4 (12), 008391 (2012).
- Swamynathan, S. K. Ocular surface development and gene expression. Journal of Ophthalmology. 2013, 103947 (2013).
- Amano, O., Mizobe, K., Bando, Y., Sakiyama, K. Anatomy and histology of rodent and human major salivary glands: -overview of the Japan Salivary Gland Society-sponsored workshop. Acta Histochemica et Cytochemica. 45 (5), 241-250 (2012).
- Liu, H. X., Komatsu, Y., Mishina, Y., Mistretta, C. M. Neural crest contribution to lingual mesenchyme, epithelium and developing taste papillae and taste buds. Developmental Biology. 368 (2), 294-303 (2012).
- Marmigère, F., Ernfors, P. Specification and connectivity of neuronal subtypes in the sensory lineage. Nature Reviews. Neuroscience. 8 (2), 114-127 (2007).
- Zirlinger, M., Lo, L., McMahon, J., McMahon, A. P., Anderson, D. J. Transient expression of the bHLH factor neurogenin-2 marks a subpopulation of neural crest cells biased for a sensory but not a neuronal fate. Proceedings of the National Academy of Sciences of the United States of America. 99 (12), 8084-8089 (2002).
- Portales-Casamar, E., et al. A regulatory toolbox of MiniPromoters to drive selective expression in the brain. Proceedings of the National Academy of Sciences of the United States of America. 107 (38), 16589-16594 (2010).
- Tervo, D. G. R., et al. A designer AAV variant permits efficient retrograde access to projection neurons. Neuron. 92 (2), 372-382 (2016).
- Loganathan, S. K., et al. Rare driver mutations in head and neck squamous cell carcinomas converge on NOTCH signaling. Science. 367 (6483), 1264-1269 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved