Method Article
Ciblage de la plaque neurale murine par nano-injection in utero (NEPTUNE) au jour embryonnaire 7,5
Dans cet article
Résumé
Dans ce protocole, nous décrivons comment injecter le lentivirus à la cavité amniotique de la souris à E7.5, conduisant à une transduction uniforme de toute la plaque neurale, avec des effets néfastes minimes sur la survie ou le développement embryonnaire.
Résumé
La manipulation de l’expression génique dans le cerveau de souris en développement in utero présente un grand potentiel pour les études de génétique fonctionnelle. Cependant, il était auparavant largement limité à la manipulation des stades embryonnaires post-neurulation. Un protocole a été développé pour injecter la cavité amniotique au jour embryonnaire (E)7,5 et délivrer le lentivirus, codant pour l’ADNc ou shRNA, ciblant >95% de la plaque neurale et des cellules de la crête neurale, contribuant au futur cerveau, à la moelle épinière et au système nerveux périphérique. Ce protocole décrit les étapes nécessaires pour réussir la transduction, y compris le broyage des aiguilles capillaires en verre, la vérification de la grossesse, la stadification du développement à l’aide de l’imagerie échographique et les volumes d’injection optimaux adaptés aux stades embryonnaires.
En suivant ce protocole, il est possible d’obtenir la transduction de >95% du cerveau en développement avec un lentivirus à titre élevé et d’effectuer ainsi une manipulation génétique du cerveau entier. En revanche, il est possible d’obtenir une transduction en mosaïque en utilisant des titres viraux inférieurs, ce qui permet un dépistage génétique ou un traçage de la lignée. L’injection à E7.5 cible également l’ectoderme et la crête neurale contribuant à des compartiments distincts de l’œil, de la langue et du système nerveux périphérique. Cette technique offre ainsi la possibilité de manipuler l’expression génique dans les tissus dérivés de la plaque neurale et de l’ectoderme de souris à partir des stades de preneurulation, avec l’avantage de réduire le nombre de souris utilisées dans les expériences.
Introduction
Le cerveau et la moelle épinière sont parmi les premiers organes à initier la formation au cours de l’embryogenèse 1,2. Bien que les gènes associés aux troubles neurodéveloppementaux soient en cours d’identification, l’interrogation fonctionnelle des variantes génétiques a pris du retard par rapport à 3,4. Comme la génération de souris knockout conditionnelles peut prendre des mois ou des années, une technique alternative pour étudier rapidement la fonction des gènes dans le cerveau en développement est intéressante. Chez les embryons de souris, la neurulation - le processus morphogénétique par lequel la plaque neurale se transforme en tube neural pour donner naissance au système nerveux central (SNC) - se produit entre les jours 8 et 10 après la conception5. Avant le début de la neurulation, la plaque neurale, en tant que partie de l’ectoderme, est constituée d’une seule couche de cellules cylindriques qui vont proliférer et se différencier en nombreux types de cellules neuronales et gliales dans le SNC 6,7. Par conséquent, pour induire expérimentalement des altérations durables de l’expression génique dans le SNC, cibler la plaque neurale offre des avantages évidents, y compris l’accessibilité de toutes les cellules progénitrices.
En neurosciences, l’électroporation in ovo 8,9 et la transduction virale d’embryons de souris ont été utilisées pour manipuler l’expression génique embryonnaire du SNC. L’embryon de poussin en développement a été un modèle de choix pour l’étude de la fonction des gènes au cours du développement de la moelle épinière en raison de l’accessibilité de l’embryon de poussin dans l’œuf et de la facilité de manipulation de l’expression génique qui en résulte. En particulier, l’électroporation plasmidique in ovo génère des conditions expérimentales et de contrôle dans la moelle épinière de chaque poussin. L’électroporation provoque la perméabilisation de la membrane cellulaire et dirige l’ADN chargé négativement loin de la cathode (négative) vers l’anode (positive) en appliquant une impulsion électrique via deux électrodes à l’embryon. Chez la souris, l’électroporation in utero a généralement été limitée aux stades embryonnaires auxquels la neurulation est terminée, et le cerveau ou la moelle épinière est déjà constitué de plusieurs couches cellulaires, ce qui entraîne une faible efficacité d’électroporation10. L’électroporation plasmidique entraîne une expression transitoire des gènes et cible généralement quelques cellules.
La microinjection in utero guidée par ultrasons a été utilisée pour manipuler différentes structures embryonnaires telles que la peau et le cerveau11,12,13,14. Cependant, les injections ciblant le SNC murin en développement se sont révélées peu efficaces ou ont eu un impact négatif sur la survie embryonnaire12,13,14. Par conséquent, un protocole amélioré a été développé pour l’administration de lentivirus à titre élevé dans la cavité amniotique (AC) à E7.5, qui a été surnommé NEPTUNE pour neural plate targeting with in uteronano-injection15. Les injections ont entraîné une efficacité de ciblage durable de >95% de l’ensemble du cerveau à E13.5. De plus, une étape de stadification a été introduite lors de la vérification échographique de la grossesse pour trier les femelles et les grossesses par stade de développement afin de minimiser les procédures inutiles sur les animaux de recherche et de maximiser le succès de l’injection. L’efficacité et la survie de l’injection sont étroitement liées à l’augmentation de la taille du climatiseur. Par conséquent, cet article décrit comment mesurer la taille du courant alternatif avant l’injection pour délivrer un volume approprié au courant alternatif qui ne provoquera pas de résorption de l’embryon. NEPTUNE est une alternative robuste aux approches in utero actuelles et peut être adapté à plusieurs utilisations, y compris, mais sans s’y limiter, les études de gain et de perte de fonction, le traçage de la lignée ou le dépistage15,16.
Protocole
Les souris CD1 de type sauvage ont été logées conformément à la réglementation européenne, avec un cycle jour et nuit standard avec de la nourriture et de l’eau ad libitum. Les femelles CD1 ont été accouplées avec des mâles CD1 pendant la nuit, et les bouchons vaginaux ont été vérifiés le matin (E0,3). Seules des femelles gravides ont été utilisées pour l’injection. L’approbation éthique de toutes les expériences décrites ici a été accordée par le Conseil suédois de l’agriculture (Jordbruksverket).
1. Préparation des aiguilles en verre: extraction et meulage des aiguilles
REMARQUE: Bien que les aiguilles pré-rectifiées puissent être achetées, le fait de tirer des aiguilles à l’interne permet d’ajuster facilement la longueur de l’aiguille, l’alésage et l’angle conique.
- Montez un capillaire en verre dans la micropipette/extracteur capillaire. Utilisez les paramètres suivants à l’aide de l’équipement spécifié (voir le tableau des matières) : chauffer 580 unités; vitesse 140 unités; temps 200 unités; pression 500-800 unités.
NOTE: Les unités des différents paramètres sont définies par l’extracteur capillaire. Les unités peuvent varier pour différents équipements. - Appuyez sur Pull pour séparer le capillaire en produisant deux capillaires en verre aux extrémités effilées.
REMARQUE: Après tirage, les extrémités des deux capillaires en verre sont fusionnées en raison de la température élevée de l’extracteur de micropipettes. - Coupez la pointe avec des ciseaux chirurgicaux pour obtenir une longueur d’aiguille de ~7 mm (mesurée à partir de l’endroit où l’aiguille commence à diminuer) (Figure 1A).
REMARQUE: Pour les injections E7.5, une aiguille longue et fine est essentielle car la région d’injection est très petite et délicate. Les aiguilles courtes et larges entraîneront la mort embryonnaire. - Broyez l’extrémité de l’aiguille coupée pour créer un biseau pointu (Figure 1C-F).
- Broyer l’aiguille à un angle de 20° à la vitesse maximale pendant au moins 30-45 min.
REMARQUE : De l’eau ultrapure est ajoutée à la plaque de broyage pour agir comme lubrifiant, réduire la friction/température et éliminer les particules de verre (Figure 1B). Cependant, un excès de liquide peut ralentir le broyeur. - Assurez-vous que l’extrémité de l’aiguille (figure 1C) touche la surface de la plaque de meulage (figure 1D) mais ne se plie pas (figure 1E).
REMARQUE: Le broyage plié donne une extrémité d’aiguille longue et fragile d’un angle de biseau incorrect, qui peut facilement se briser pendant l’injection. Les aiguilles cassées peuvent nuire à l’embryon et doivent être remplacées par une aiguille intacte. Une pointe correctement rectifiée est illustrée à la figure 1F,G. Après broyage, l’alésage de l’aiguille résultant devrait avoir un diamètre intérieur (ID) de ~15 μm et un diamètre extérieur (OD) de ~35 μm (figure 1G).
- Broyer l’aiguille à un angle de 20° à la vitesse maximale pendant au moins 30-45 min.
- Remplissez une seringue de 1 ml avec de l’huile minérale et fixez une aiguille de 27 g.
- Retirez le capuchon de l’aiguille et insérez l’aiguille de la seringue dans le capillaire en verre nouvellement moulu. Injectez de l’huile minérale jusqu’à ce que l’huile s’égoutte de la pointe capillaire. Continuez à injecter tout en retirant l’aiguille de 27 G jusqu’à ce que l’aiguille capillaire soit remplie d’huile minérale, après quoi l’aiguille de la seringue peut être retirée.
- Entreposez les aiguilles moulues et remplies d’huile minérale dans un environnement fermé pour éviter les dommages et l’accumulation de poussière. Pour le stockage, insérer deux rouleaux de pâte à modeler dans une boîte de Petri ordinaire pour servir de supports (figure 1H). Perchez doucement les aiguilles sur l’argile et espacez-les loin pour faciliter la récupération des aiguilles.
REMARQUE: Comme la préparation des aiguilles prend beaucoup de temps, il est préférable de préparer les aiguilles au moins un jour avant les injections. Jetez les aiguilles après deux portées maximum car elles deviendront émoussées. Préparez toujours des aiguilles de secours en cas de dommages à l’aiguille pendant la préparation ou l’injection.
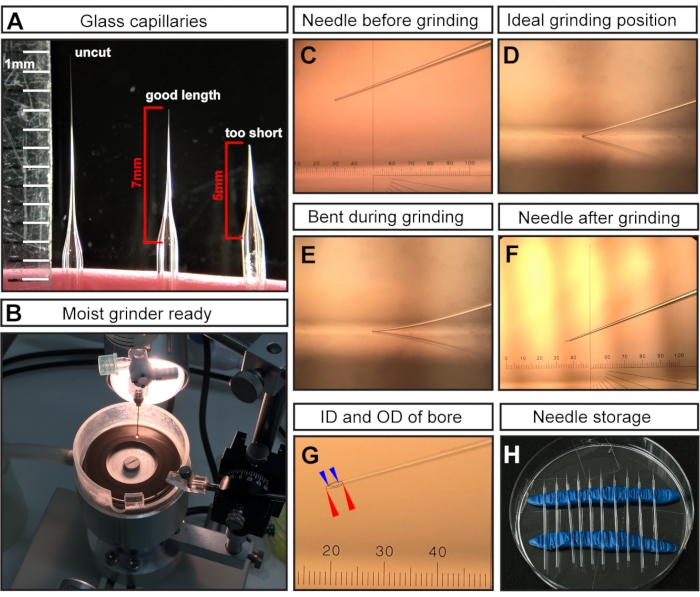
Figure 1 : Préparation de l’aiguille pour les injections de cavité amniotique E7.5. (A) Exemples représentatifs d’une aiguille capillaire en verre tirée mais non coupée (à gauche), d’une aiguille capillaire coupée à la longueur optimale pour les injections E7.5 (au milieu) et d’une coupure capillaire trop courte (à droite). (B) Le broyeur avec une couverture uniforme d’eau, qui est prêt pour le broyage à l’aiguille. (C-F) Exemples représentatifs de différentes pointes d’aiguille. C) Pointe d’aiguille coupée mais non rectifiée, montée dans un broyeur; (D) position de broyage idéale avec la pointe de l’aiguille qui touche juste le broyeur; E) aiguille trop abaissée et se pliant pendant le processus de broyage; (F) une pointe d’aiguille de mise à la terre idéale pour les injections E7.5 AC. (G) Une pointe d’aiguille de mise à la terre montrant l’alésage avec un diamètre intérieur de ~15 μm et un diamètre extérieur de ~35 μm, qui convient à l’injection E7.5 AC. L’alésage de l’aiguille est représenté par des lignes pointillées. Diamètre extérieur indiqué par des pointes de flèches rouges; diamètre intérieur indiqué par des pointes de flèches bleues. (H) Stockage des aiguilles: boîte de Petri remplie d’aiguilles tirées et moulues. Deux rangées de pâte à modeler servent de supports. NOTE: Pour le micromètre oculaire en C, F, G, 1 cm est divisé en 100 pas; L’objectif est 3x; Par conséquent, 1 pas = 10 000 μm/(100 × 3) ≈ 33,4 μm. Abréviations : AC = cavité amniotique; ID = diamètre intérieur; DO = diamètre extérieur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Jour avant l’injection: préparer le banc pour l’échographie de vérification de la grossesse
REMARQUE : Tous les travaux doivent être effectués dans un banc ventilé de niveau de biosécurité 2 (BSL 2) lorsque vous travaillez avec un lentivirus. La vérification échographique de la grossesse peut être effectuée sur un banc ventilé.
- Allumez l’appareil à ultrasons, la table chauffante et l’alimentation O2 de la pompe à isoflurane (peut varier d’un équipement à l’autre).
REMARQUE : Vérifiez le système d’isoflurane pour vous assurer qu’il n’y a pas de fuite d’isoflurane dans l’air. - Placez un sac à déchets vide (collé au mur intérieur pour un accès facile), une crème dépilatoire, des cotons-tiges emballés stériles, de l’eau, du papier de soie et du ruban chirurgical à l’intérieur du banc BSL 2.
- Préparez quatre morceaux de ruban chirurgical (~7 cm de long) pour sécuriser les membres de la souris pendant l’échographie de la grossesse.
3. Échographie pour confirmer la grossesse
REMARQUE: Cette étape peut être effectuée la veille des injections E7.5, à E6.5. Voir la discussion pour plus de détails sur la vérification de l’âge gestationnel.
- Placez la souris femelle couplée dans la chambre à induction.
- Activer le débit de gaz avec un débit d’oxygène de ~2,1 LPM et une dose initiale d’isoflurane à 3-4% pour induire l’anesthésie.
- Vérifiez que la femelle est complètement anesthésiée en vérifiant le réflexe de la patte. Si le réflexe de la patte est absent, abaisser l’isoflurane à 1,5-2%.
NOTE: Il faut environ 3 min pour induire l’anesthésie. - Basculez le débit de gaz de la chambre d’induction vers le cône de nez de la table chauffante.
- Placez la femelle anesthésiée en décubitus dorsal (abdomen vers le haut) sur la table chauffante et placez le museau dans le cône nasal attaché pour assurer le maintien de l’anesthésie pendant l’échographie de la grossesse.
- Attachez les quatre pattes à la table avec les morceaux de ruban chirurgical préparés sans étirer le corps de la femelle ni piéger les moustaches.
- Appliquez une quantité de crème épilatoire de la taille d’un pois sur le bas-ventre. À l’aide d’un coton-tige, répartir la crème sur le bas-ventre (un carré ~ 3 x 3 cm) et masser doucement en roulant le coton-tige d’avant en arrière.
- Une fois que la fourrure commence à se détacher de la peau, humidifiez un papier de soie et retirez la crème et la fourrure. Nettoyez la zone dépoilue avec du papier de soie humide jusqu’à ce que toute la crème et les cheveux aient disparu. Sécher la peau.
- Appliquez une quantité de gel à ultrasons de la taille d’une prune sur la zone rasée et procédez à l’identification de l’utérus à l’aide d’ultrasons par l’une des trois approches suivantes.
- Pour ce faire manuellement, tenez la sonde à ultrasons dans le gel à ultrasons et déplacez la sonde pour trouver l’utérus.
- Pour l’approche semi-manuelle #1, placez la sonde à ultrasons (fixée au système de garde-corps) au-dessus de l’abdomen féminin en desserrant et en déplaçant une partie du rail le long du plan X. Abaissez la sonde à ultrasons dans le gel (plan z) et balayez à travers le bas-ventre (plan y) (Figure 2A).
- Pour l’approche semi-manuelle #2, abaissez la sonde à ultrasons (fixée au système de garde-corps) dans le gel pour imager le bas-ventre. Maintenez la sonde à ultrasons immobile pendant le processus et déplacez la table chauffante avec les roues attachées le long des plans x et/ou y (Figure 2B).
REMARQUE: À ces stades embryonnaires précoces, les organes internes, par exemple l’intestin, peuvent ressembler à l’utérus en imagerie échographique. Cependant, alors que les embryons et les décidua apparaissent comme une séquence de sphères (semblables à des perles le long d’un collier), l’intestin a l’apparence d’un tube continu. La connectivité des espaces luminaux (sphères séparées vs tube continu) peut être évaluée en balayant d’avant en arrière la structure d’intérêt pour déterminer si la structure est une sphère discrète (embryon / décidue) (Figure 2C) ou un tube continu (intestin) (Figure 2D). À ce stade, il n’est pas nécessaire d’enregistrer le nombre d’embryons; il suffit de confirmer leur présence ou leur absence.
- Une fois l’état de grossesse déterminé, soulevez la sonde à ultrasons loin de l’abdomen et essuyez le bas-ventre avec du papier de soie humide pour retirer le gel à ultrasons.
- Éteignez la pompe à isoflurane et retirez le ruban chirurgical pour libérer les pattes.
- Placer la femelle en position couchée (ventre vers le bas) dans une cage propre sur une plaque chauffante à 40 °C. Gardez la femelle sous observation étroite jusqu’à ce qu’elle reprenne conscience, ce qui prend 2 à 6 minutes.
REMARQUE : Assurez-vous que l’échographie d’une femme dure 10 minutes < afin de minimiser l’exposition à l’isoflurane. - Enlevez tous les matériaux et les déchets et nettoyez toutes les surfaces avec de l’éthanol à 70%. Essuyez tout reste de gel à ultrasons de la sonde à ultrasons avec un mouchoir en papier sec, doux et non pelucheux. Éteignez l’appareil à ultrasons, le banc ventilé / banc BSL2, la table chauffante et l’alimentation O2 .
4. Contrôle échographique pour la stadification embryonnaire
REMARQUE: Cette étape est effectuée avant la chirurgie et sert à stratifier les femelles enceintes en fonction de leur taille AC. Cette étape est cruciale à E7.5 lorsque l’objectif est de cibler le SNC en développement. À ce stade précoce du développement, une différence de quelques heures dans le développement influence de manière significative la taille du courant alternatif et la progression de la neurulation.
- Anesthésiez la première souris femelle gravide en suivant les étapes 3.1-3.5.
- Placer et fixer la femelle sur la table comme décrit à l’étape 3.6.
- Appliquez une quantité de gel à ultrasons de la taille d’une prune sur l’abdomen rasé et abaissez la sonde à ultrasons pour imager le bas-ventre de la femelle.
REMARQUE : Cette étape suppose que la femelle a été inspectée par échographie la veille pour la grossesse et qu’on lui a déjà enlevé la fourrure sur l’abdomen. Si ce n’est pas le cas, la fourrure doit être retirée avant l’ajout de gel à ultrasons en suivant les étapes 3.7-3.8. À E7.5, l’utérus et les déciduas sont plus grands et plus faciles à distinguer des organes internes. De plus, le courant alternatif est plus grand et peut être distingué de la cavité exocélomique (ExC). - Scannez les cornes utérines gauche et droite aussi complètement que possible.
REMARQUE: Certains embryons se trouvent plus profondément à l’intérieur du corps de la femelle et peuvent être manqués. - Notez le nombre et les stades des embryons. Notez le nombre de cavités amniotiques de taille idéale, de cavités acceptables et de déciduas sans cavité (Figure 2E-G).
- Mettez en scène toutes les grossesses et classez-les en conséquence.
- Injectez aux femelles la majorité des climatiseurs de taille idéale immédiatement après la vérification échographique (étape 4.4) en suivant les instructions des étapes 4.5 à 4.7.
- Pour les femelles ayant une majorité de cavités acceptables (dans lesquelles les cavités exocélomique et amniotique ne sont pas encore clairement divisées en deux cavités) ou absentes, reportez l’injection et recommencez-les après quelques heures. Si la plupart des cavités sont encore trop petites, reportez les injections de 10-12 h.
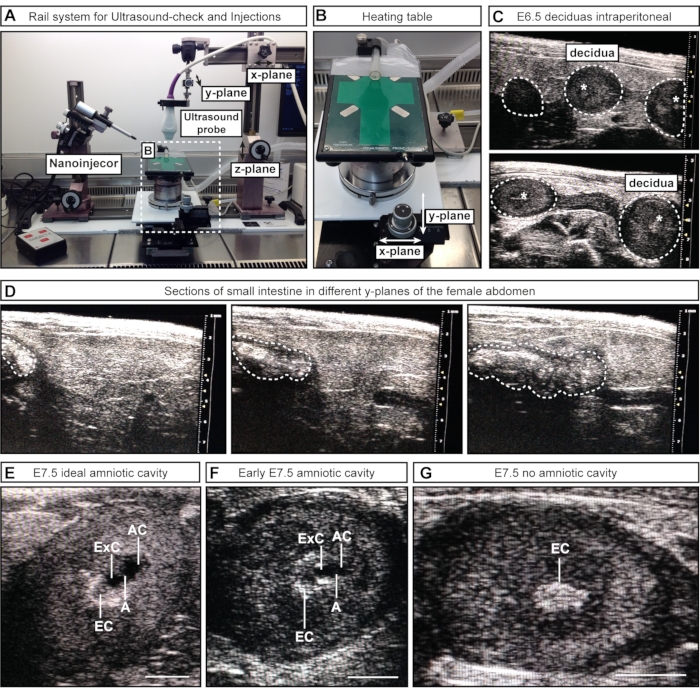
Figure 2 : Inspection et mise en scène des cavités amniotiques pendant la vérification échographique. (A) Vue d’ensemble du système de rails avec sonde à ultrasons, nanoinjecteur et table chauffante. La sonde à ultrasons peut être déplacée dans les plans x, y et z pour obtenir un alignement optimal avec l’abdomen féminin ou les climatiseurs. (B) La table chauffante peut être déplacée via deux roues dans les plans x et / ou y pour permettre un balayage et une évaluation précis des climatiseurs, tandis que la sonde à ultrasons peut rester statique. (C) Images échographiques représentatives des déciduas E6.5 à l’intérieur de l’abdomen féminin lors de l’échographie pour confirmer la grossesse (contours pointillés blancs). Aucune cavité ne s’est formée à ce stade; Cependant, parfois, le cône ectoplacentaire (astérisques blancs) est visible. Les déciduas peuvent être reconnus par leur forme sphérique et distingués de l’intestin, qui apparaît comme un tube continu. (D) Séquence d’images représentative de l’intestin grêle (contours pointillés blanchis), qui est continue dans le balayage à travers le bas-ventre. (E-G) Images échographiques représentatives pendant la stadification de la cavité avant les injections d’E7.5. Les cavités amniotique et exocélomique se sont formées et sont séparées par l’amnion. Le cône ectoplacentaire sert d’approvisionnement sanguin principal et apparaît comme un point lumineux dans l’échographie. Le courant alternatif est le plus distal du cône ectoplacentaire. (E) Les CA de taille idéale semblent plus grands que la cavité exocélomique, tandis que les cavités de taille moyenne semblent plus petits (F). Si aucune cavité n’est visible (G), cela signifie que l’embryon est résorbé ou n’a pas encore atteint E7.5. Barres d’échelle = 1 mm. Abréviations: A = Amnion; AC = cavité amniotique; ExC = cavité exocélomique; EC = cône ectoplacentaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Jour de l’injection : préparer le banc BSL2 à la chirurgie
- Collez un morceau de membrane élastique à l’ouverture centrale ronde d’une boîte de Pétri modifiée disponible dans le commerce. Assurez-vous que la membrane est bien fixée à la boîte de Petri pour éviter les fuites.
REMARQUE: Si le plat fuit ou n’est pas bien collé, les bords de la membrane élastique peuvent être fixés davantage avec du ruban adhésif. - Faites une incision de 1 à 1,5 cm de long au centre de la membrane élastique.
- Allumez l’appareil à ultrasons, le banc BSL2, la plaque chauffante, l’alimentation en O2 de la pompe à isoflurane et le stérilisateur à billes de verre (réglé à 300 °C).
- À l’intérieur du banc BSL2, placez un sac à déchets vide (collé au mur intérieur pour un accès facile); cotons-tiges emballés stériles (en utiliser un nouveau pour chaque chirurgie/chaque femme); outils chirurgicaux (ciseaux, pincettes, pinces, suture) et ruban chirurgical; une bouteille pleine de solution saline tamponnée au phosphate (PBS) à température ambiante, une bouteille vide pour la collecte des déchets et une pipette de 25 mL; une boîte de Petri avec membrane élastique pour la chirurgie; le couvercle de la boîte de Petri avec un morceau de parafilm de 2 x 2-3 x 3 cm fixé au couvercle avec une goutte d’eau; pâte à modeler: 4 billes ou cubes plus grands (~3 x 3 x 3 cm3) et une pièce cylindrique (~4 x 1 cm); une seringue avec analgésique (p. ex. buprénorfine, 0,05-0,1 mg/kg de poids corporel) et un gel pour les yeuxNOTE: Les boules (ou cubes) de pâte à modeler serviront de « pieds » ou de supports / supports pour la boîte de Petri une fois que la boîte est placée sur le dessus de l’abdomen de la femelle. Le morceau d’argile cylindrique sécurise les embryons à l’intérieur du plat. Si plus d’une solution est injectée, ou si l’aiguille doit être remplie à nouveau pendant les injections, le même morceau de parafilm peut être utilisé si les solutions peuvent être espacées.
6. Chargement de l’aiguille
- Essuyez tout excès d’huile minérale avec du papier de soie pour une meilleure adhérence.
REMARQUE: Nettoyez toujours loin de la pointe pour éviter tout dommage ou blessure. - Assurez-vous que tous les composants (un joint torique d’étanchéité, une entretoise et un joint avant logés sous la pince, figure 3A) sont installés dans la bonne orientation (Figure 3B, pince retirée pour la visualisation) pour maintenir l’aiguille capillaire en place et créer une connexion étanche à l’air, en évitant la formation de bulles lors de l’avancement ou de la rétraction du piston métallique à l’intérieur de l’aiguille.
- Assurez-vous que le piston métallique du nanoinjecteur est complètement rétracté. Vérifiez en appuyant sur Remplir et attendez un double bip indiquant que le piston est complètement rétracté.
- Une fois la pince fixée mais légèrement desserrée (dévissée à 45-90 degrés), faites glisser l’aiguille en verre sur le piston métallique et poussez l’aiguille capillaire avec le piston métallique à travers le joint avant jusqu’à ce qu’il atteigne l’entretoise (Figure 3C, D, pince retirée pour visualisation).
REMARQUE: Une certaine résistance apparaît lorsque le piston traverse le joint et diminue lorsqu’elle atteint l’entretoise. Assurez-vous que l’aiguille capillaire est fermement insérée dans l’entretoise pour créer une connexion étanche à l’air (Figure 3D). - Fixez l’aiguille en serrant la pince du nanoinjecteur (revissez solidement).
REMARQUE: Ne pas trop serrer car cela pourrait écraser l’aiguille. - Appuyez sur Vide pour enfoncer le piston dans l’aiguille et expulser l’huile de l’extrémité de l’aiguille. Si l’aiguille en verre bouge, rétractez le piston, retirez l’aiguille et rechargez. Si cela provoque la formation de bulles d’air, retirez l’aiguille et remplissez-la d’huile minérale.
REMARQUE: Une aiguille correctement fixée ne doit pas bouger avec le piston. - Placer une goutte du virus (~ 6 μL) ou une autre solution injectable sur un morceau de parafilm1 (Figure 3E; Le colorant bleu Evans est utilisé à des fins de visualisation).
REMARQUE: Le volume maximal du nano-injecteur est de ~ 5 μL. - Appuyez sur Fill (remplissage) pour créer une bulle d’air qui servira de séparateur entre l’huile et la solution (Figure 3F).
REMARQUE: Cela sert également de marqueur de positionnement lors du remplissage ou de la vidange de l’aiguille. - Abaissez l’aiguille, immergez l’embout dans la solution et appuyez sur Fill (Figure 3F,G).
- Surveillez le niveau de fluide pendant que la solution est chargée après la bulle d’air. Appuyez sur Vide pour expulser le bouchon et rechargez en appuyant sur Remplir si la bulle d’air s’allonge sans que le fluide ne pénètre dans l’aiguille. Si cela ne résout pas le problème, changez l’aiguille.
- Lorsque l’aiguille est complètement chargée (Figure 3H), soulevez l’aiguille dans le plan z et aspirez un petit volume d’air à l’extrémité pour éviter l’évaporation de la solution à l’extrémité de l’aiguille et le colmatage de l’aiguille.
- Tournez le nano-injecteur avec l’aiguille fixée loin de l’opérateur, vers l’arrière de la banc, pour éviter tout dommage accidentel ou blessure.

Figure 3 : Fixation de l’aiguille au nanoinjecteur et chargement de la solution. (A) Position de départ avant le montage de l’aiguille sur le nanoinjecteur: piston métallique complètement rétracté et pince attachée. (B) Sous la pince, les trois composants pour maintenir et fixer l’aiguille sont montrés dans le bon ordre (de gauche à droite): joint torique d’étanchéité (mince et noir), entretoise (blanc), joint torique (noir) avec grand trou (que l’aiguille doit traverser). Pour assurer une connexion étanche à l’air, l’aiguille en verre est glissée sur le piston métallique (C) et poussée à travers l’ouverture du joint torique avant jusqu’à ce qu’elle atteigne l’entretoise (D). (E-H) Chargement de la solution dans l’aiguille. (E) Une goutte de solution est placée sur un morceau de parafilm sur un couvercle de plaque. (F) Créez une bulle d’air en appuyant sur Fill avant de charger la solution et immergez la pointe de l’aiguille dans la solution. (G) La solution se charge dans l’aiguille. (H) La solution est chargée dans l’aiguille. REMARQUE : Le composant de collet a été retiré dans (B-D) pour la visualisation, mais doit rester attaché pendant les expériences. La dernière étape de la fixation de l’aiguille consiste à serrer le collet. Le colorant bleu Evans est utilisé pour la visualisation dans E-H. Veuillez cliquer ici pour voir une version agrandie de cette figure.
7. Injections
REMARQUE: Tous les instruments utilisés dans cette procédure sont stérilisés avant la chirurgie et entre chaque souris.
- Anesthésier la première femelle présentant des caries de taille idéale (voir rubrique 4).
- Placez et fixez la femelle sur la table, comme décrit aux étapes 3.1-3.6.
- Appliquez du gel pour les yeux sur les yeux pour prévenir la dessiccation cornéenne et injectez un analgésique par voie sous-cutanée.
NOTE: Analgésiques recommandés: Buprénorphine (0,05-0,1 mg / kg de poids corporel) ou Flunixin (2,5 mg / kg) ou similaire conformément aux réglementations locales en matière de bien-être animal. L’analgésie périopératoire multimodale est maintenue avec des analgésiques injectés et de l’isoflurane. - Préparer de manière aseptique le bas-ventre en essuyant avec un chiffon imbibé de solution de chlorhexidine à 0,5 mg / mL (ou similaire) et sécher la peau. Utilisez des ciseaux chirurgicaux pour faire une incision cutanée verticale médiane de 1,5 à 2,0 cm dans le bas-ventre.
REMARQUE : Préparez la zone chirurgicale en suivant les routines de désinfection approuvées localement. - Soulevez doucement la peau et libérez-la de la couche musculaire sous-jacente, environ 1 cm autour du point d’incision, pour faciliter la suture après la chirurgie.
- Faites une incision verticale médiane de 1 cm dans la couche musculaire.
- Avec une paire de forceps, soulevez un côté de la peau et de la couche musculaire et avec l’autre paire, recherchez les cornes utérines.
REMARQUE : Les déciduas sont disposées comme des perles sur un collier, tandis que l’intestin est un long tube continu (Figure 4A). - Avec une pince, retirez soigneusement les deux cornes utérines de l’abdomen. Tenir le tissu entre les embryons; ne les pressez pas directement (figure 4B).
REMARQUE: L’utérus est attaché au corps au niveau du col de l’utérus et les deux ovaires / oviductes sont attachés par des ligaments. Ne tirez pas / détachez pas l’utérus de ces points d’ancrage. - Comptez et notez le nombre d’embryons sur les côtés gauche et droit.
- Numéroter les embryons de l’ovaire au col de l’utérus ou du col de l’utérus à l’ovaire.
REMARQUE: Ceci est particulièrement important si les embryons injectés seront prélevés à des stades embryonnaires. - Avec un coton-tige humide, repoussez doucement tous les embryons dans la cavité abdominale, sauf les trois premiers à injecter.
- Placez une goutte de PBS sur l’élastique dans la boîte de Petri et maintenez-la immédiatement au-dessus des embryons.
- Insérez une pince fermée dans l’incision de l’élastique et relâchez la pince pour ouvrir l’incision élastique afin que le liquide tombe sur les embryons.
REMARQUE: Cela garantit la réhydratation des embryons et que la membrane élastique adhère à la peau humide de la femelle, empêchant ainsi les fuites de PBS dans les étapes suivantes. - Tirez une section de l’utérus, correspondant à trois embryons, à travers l’élastique avec une pince, et perchez doucement la boîte de Petri sur l’abdomen de la femelle.
- Avec la pince et un coton-tige humide, ajustez le positionnement de l’utérus et de l’élastique pour vous assurer que l’élastique est scellé à la peau de la femelle pour éviter les fuites de PBS.
- Utilisez les quatre pieds d’argile pour fixer et fixer la boîte de Petri immédiatement au-dessus de l’abdomen, réduisant ainsi la pression sur la femelle et la sensibilité de l’imagerie à la respiration et au rythme cardiaque de la femelle.
- Appuyez sur le cylindre de pâte à modeler vers le bas à droite des embryons/utérus pour fixer l’utérus (Figure 4C).
NOTE: Cette instruction d’orientation suppose que l’aiguille est à gauche de la femelle et que les embryons de la corne utérine gauche de la femelle sont exposés. Le côté de l’utérus (corne utérine gauche ou droite) est crucial car le courant alternatif fait face à l’aiguille (corne gauche; Figure 4D) ou fait face au cylindre d’argile stabilisateur (corne droite; Figure 4E). - Pour injecter des embryons à partir de la corne utérine droite, placez le cylindre d’argile sur le côté gauche des embryons (Figure 4F) et tournez la table chauffante à 180° (Figure 4G) pour obtenir la bonne orientation. Si l’aiguille peut être déplacée à la place, adaptez-la en fonction de la configuration concernée.
- Ajouter PBS à la boîte de Petri jusqu’à ce que les embryons et l’utérus soient recouverts de PBS.
- Abaissez la sonde à ultrasons dans le PBS et ajustez la souris / table chirurgicale de sorte que le premier embryon soit aligné avec la sonde à ultrasons pour faciliter l’enregistrement des injections.
REMARQUE : « Premier » fait référence à la numérotation des embryons de l’ovaire au col de l’utérus. - Scannez les trois embryons et inspectez les climatiseurs. Déterminez le volume d’injection comme suit :
- Mesurez le diamètre du climatiseur avec l’appareil à ultrasons. Injecter 69 nL si le diamètre du courant alternatif est de ≤0,2 mm; injecter 2 x 69 nL (= 138 nL) si le diamètre du courant alternatif est de >0,2 mm et ≤0,29 mm; et injecter 3 x 69 nL (= 207 nL) si le diamètre du courant alternatif > 0,29 mm (figure 4H).
NOTE: Des expériences antérieures ont montré que jusqu’à 207 volumes d’injection de nL sont bien tolérés à E7.515. Des injections réussies avec un impact minimal sur la survie sont obtenues lorsque l’augmentation du volume relatif du courant alternatif ne dépasse pas 90%15. La variation de la taille du courant alternatif entre les compagnons de portée ou les souches de souris est courante et peut nécessiter une optimisation supplémentaire.
- Mesurez le diamètre du climatiseur avec l’appareil à ultrasons. Injecter 69 nL si le diamètre du courant alternatif est de ≤0,2 mm; injecter 2 x 69 nL (= 138 nL) si le diamètre du courant alternatif est de >0,2 mm et ≤0,29 mm; et injecter 3 x 69 nL (= 207 nL) si le diamètre du courant alternatif > 0,29 mm (figure 4H).
- Réglez les volumes d’injection avec le contrôleur d’injection.
- Réglez la vitesse d’injection sur ralentir avec un débit d’injection de 23 nL/s.
REMARQUE: Différents modèles d’équipement peuvent entraîner des forces d’injection différentes. - Abaissez l’aiguille dans le PBS à l’aide des roues principales du système de rail (plans x et z, Figure 4I) et appuyez sur Empty (Vide ) du contrôleur du nanoinjecteur jusqu’à ce que le liquide atteigne l’extrémité de l’aiguille.
REMARQUE: Si l’aiguille s’est bouchée, appuyer sur Vide peut dissoudre le bouchon et / ou expulser le sabot. - Retirez l’aiguille du PBS et appuyez sur Injecter. Vérifiez qu’une goutte du volume approximatif désiré est déchargée.
- Abaissez l’aiguille dans le PBS et alignez-la avec la sonde à ultrasons et l’embryon en déplaçant le nano-injecteur avec la roue du plan Y sur le micromanipulateur (Figure 4J).
REMARQUE : L’extrémité de l’aiguille est parfaitement alignée lorsqu’elle apparaît comme un point lumineux sur l’image échographique (Figure 4K,L). L’aiguille peut être déplacée dans les trois plans de direction avec le micromanipulateur. - Ajustez l’angle de l’aiguille avec la molette d’injection pour assurer un angle d’injection presque perpendiculaire par rapport à la paroi utérine. Insérez l’aiguille dans le courant alternatif en un seul mouvement à l’aide de la roue d’injection du micromanipulateur (Figure 4J-M). Gardez un œil sur la luminosité de la pointe de l’aiguille. Si la pointe de l’aiguille disparaît de l’image échographique, déplacez la sonde à ultrasons vers l’avant ou vers l’arrière pour ramener l’aiguille au point.
REMARQUE: Une fois que l’aiguille est à l’intérieur du climatiseur, des modifications mineures de la position et de la mise au point de l’aiguille peuvent être apportées sans nuire à l’embryon (ajustements à ~0,3 mm). N’ajustez pas la position de l’aiguille plus que cela. - Appuyez sur Injecter (pour 207 nL, réglez le volume à 69 nL et injectez trois fois). Après l’injection, attendez 5 à 10 secondes supplémentaires avant de rétracter l’aiguille en un seul mouvement doux.
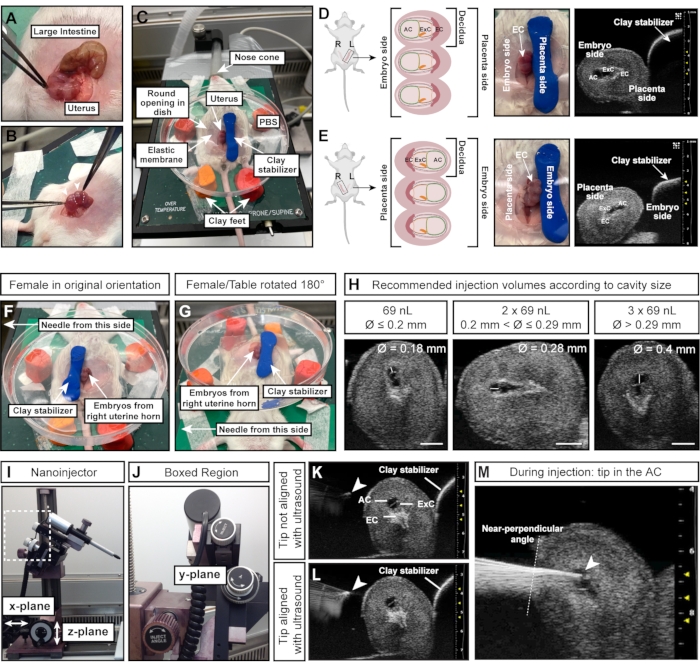
Figure 4 : Taille et orientation optimales de la cavité amniotique pour des injections réussies. (A) Corne utérine avec plusieurs déciduas E7.5, en forme de chaîne de sphères (en bas) par rapport au gros intestin (en haut). (B) Saisir le tissu utérin (lignes pointillées blanches) entre les déciduas. Évitez de presser les déciduas (pointes de flèches blanches) directement avec une pince, car les déciduas et les embryons en développement sont fragiles à ce stade précoce et sujets à la résorption en cas de force externe excessive. (C) Femelle en décubitus dorsal avec des déciduas exposés dans une boîte de Petri remplie de PBS et montée sur quatre pieds de pâte à modeler. Les déciduas sont stabilisées par un morceau supplémentaire de pâte à modeler, en forme de cylindre. (D, E) L’orientation du courant alternatif est influencée par le côté de la corne utérine exposé. Si des déciduas de la corne utérine gauche sont utilisés, le climatiseur sera orienté loin du stabilisateur d’argile et sera facilement accessible à l’aiguille de gauche (D). Cependant, si la corne utérine droite est utilisée, le cône ectoplacentaire fera plutôt face à l’aiguille, ce qui rendra plus difficile l’accès au CA (E). Par conséquent, lors de l’injection dans la corne utérine droite, le stabilisateur d’argile est placé vers le côté faisant face à l’aiguille (F) et toute la table chauffante est tournée de 180 ° (G). (H) Volumes d’injection recommandés en fonction des tailles de climatiseur. En général, les cavités d’un diamètre ≤ 0,2 mm peuvent être injectées avec un maximum de 69 nL. Les diamètres > 0,2 mm et ≤ 0,29 mm tolèrent des volumes jusqu’à 2 x 69 nL (138 nL) et des cavités > 0,29 mm peuvent être injectées avec 3 x 69 nL (207 nL). Barres d’échelle = 1 mm. (I, J) Le nanoinjecteur est fixé au système de rail et peut être déplacé dans les plans x et/ou z. L’angle de l’aiguille peut être ajusté avec la molette d’angle d’injection. (K, L) La pointe de l’aiguille (pointe de flèche blanche) est alignée avec le courant alternatif lorsqu’elle apparaît la plus brillante à l’échographie (L). (M) Image échographique montrant le processus d’injection, dans lequel la pointe de l’aiguille est dans le courant alternatif et bien alignée (pointe de flèche blanche). Abréviations : A = Amnion; AC = cavité amniotique; ExC = cavité exocélomique; EC = cône ectoplacentaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Déplacez l’étape vers l’embryon suivant et répétez les étapes 7.22-7.26 pour les deux autres embryons s’ils ont des tailles de courant alternatif appropriées.
- Soulevez la sonde à ultrasons et l’aiguille hors du PBS à l’aide du micromanipulateur. Éloignez l’aiguille de l’opérateur pour éviter les dommages et les blessures.
- Avec une pince, dirigez les 1et 2e embryons dans l’abdomen de la femelle en les poussant doucement à travers l’élastique. Saisissez doucement le tissu adjacent au 3èmeembryon et tirez l’utérus vers l’extrémité supérieure de l’incision élastique. Tirez doucement les 4e à 6e embryons avec une pince et laissez le 3eembryon rentrer à nouveau dans l’abdomen.
REMARQUE: Cette étape peut être effectuée sans changer le PBS ou retirer la boîte de Poutri. - Répétez au besoin jusqu’à ce que tous les embryons avec des CA optimaux aient été injectés ou que la limite de temps ait été atteinte.
- Repoussez doucement les embryons/utérus dans l’abdomen de la femelle.
- Aspirez le PBS et retirez la boîte de Pétri. Si un virus a été utilisé, manipulez-le comme un déchet infectieux.
- Coudre ensemble la couche musculaire avec du Vicryl (USP 6-0, longueur de l’aiguille 13 mm, cercle 3/8) en sutures simples continues ou interrompues et fermer la peau avec 1-2 clips (voir le tableau des matériaux).
- Éteignez la pompe à isoflurane.
- Retirez le ruban chirurgical et placez la femelle en position couchée (ventre vers le bas) dans une cage propre sur une plaque chauffante à 40 °C.
REMARQUE : On s’attend à ce que la femelle reprenne conscience et soit mobile dans les 10 minutes. Assurez-vous que la procédure est terminée dans les 30 minutes. Le bagage génétique, l’âge et le poids de la femme peuvent influencer la sensibilité à l’anesthésie. Surveillez les souris pendant la chirurgie pour détecter les signes de respiration lente (respiration lente signifie que l’anesthésie est trop profonde) ou de mouvement (l’anesthésie est trop légère). La buprénorphine (0,05-0,1 mg/kg de poids corporel) ou la flunixine (2,5 mg/kg) ou similaire conformément aux réglementations locales en matière de bien-être animal peuvent être administrées 8 heures après la première injection si nécessaire. - Si une autre femelle doit être injectée, préparez la zone chirurgicale tout en surveillant le réveil de la première.
- Essuyez les outils chirurgicaux avec de l’éthanol à 70% pour éliminer tout résidu de sang ou de tissu et stérilisez-les dans le stérilisateur de billes de verre préchauffé pendant 10 s. Jetez les cotons-tiges et le papier de soie usagé. Essuyez la boîte de Petri et les morceaux d’argile avec du papier de soie.
- Répétez les étapes 7.1-7.35 jusqu’à ce que toutes les femelles aient reçu une injection.
- Vider et jeter l’aiguille.
- S’il reste un virus ou une solution injectable dans l’aiguille, appuyez sur Vide sur le nano-injecteur et videz le contenu de l’aiguille sur du papier de soie.
- Rétractez complètement le piston métallique en appuyant sur Fill jusqu’à ce qu’un double bip du contrôleur s’émette pour indiquer que le piston est complètement rétracté.
- Desserrez la pince et faites glisser l’aiguille hors du piston métallique. Jetez l’aiguille dans le récipient à déchets pour objets tranchants.
- Nettoyez le banc BSL-2.
- Si un virus a été utilisé, pulvériser tout le champ chirurgical avec du désinfectant (voir le tableau des matériaux). Après 15 min, essuyez le désinfectant et nettoyez tout le champ chirurgical avec de l’éthanol à 70%. Si aucun virus n’a été utilisé, nettoyez toutes les surfaces avec de l’éthanol à 70 %.
- Essuyez tout PBS restant de la sonde à ultrasons avec du papier de soie sec, doux et non pelucheux.
- Jeter les déchets conformément aux directives de biosécurité.
- Éteignez l’appareil à ultrasons, la table chauffante, le banc BSL2 et l’alimentation O2 .
Résultats
Des embryons injectés à E7.5 avec le lentivirus hPGK-H2B-GFP11,12 ont été prélevés à E13.5 et examinés au microscope à dissection fluorescente (figure 5A). Une transduction réussie de la plaque neurale donne des embryons avec une forte expression d’un rapporteur fluorescent dans le cerveau principalement et dans d’autres tissus dérivés de l’ectoderme, par exemple la peau (Figure 5A, B). L’injection d’un volume excessivement élevé (supérieur aux volumes recommandés ici, par exemple ≥500 nL) augmente la pression dans le courant alternatif et peut entraîner une résorption complète (données non présentées) ou des anomalies du tube neural telles que l’exencéphalie (Figure 5A). Des injections réussies à E7.5 entraînent une transduction uniforme du cerveau antérieur au cerveau postérieur (Figure 5C-J).
Les titres lentiviraux autour de 2 × 1010 unités infectieuses (IFU) atteignent un ciblage de plus de 95%, tandis que les titres de ~1 × 109 IFU atteignent une efficacité de ciblage de 15%15. De plus, des structures auparavant difficiles à cibler par électroporation, comme le plexus choroïde17,18, sont également ciblées (Figure 5 E,F). L’efficacité de la transduction peut être modifiée en ajustant le titre viral délivré dans le CA. Les injections de faible titre entraînent la transduction de clones unicellulaires (Figure 5C, Figure 5E et Figure 5G,H) tandis que l’utilisation de virus à titre élevé transduit près de 100% de l’ensemble du cerveau (Figure 5D, Figure 5F, Figure 5H et Figure 5J ). Par conséquent, NEPTUNE peut être utilisé pour la transduction clonale, le traçage de la lignée et les approches de dépistage génétique ou pour étudier les effets globaux de la surexpression ou de la régulation négative des gènes dans l’ensemble du cerveau.
Le développement de l’œil des mammifères est le résultat d’une communication bien organisée entre trois dérivés de l’ectoderme embryonnaire : la rétine neurale (NR) et l’épithélium pigmentaire rétinien (EPR) sont dérivés du neuroépithélium du cerveau antérieur ventral, tandis que l’ectoderme de surface donne naissance au futur cristallin et à l’épithélium cornéen. Cependant, le stroma central et l’endothélium postérieur, les deux autres couches de la cornée, sont dérivés des cellules de la crête neurale du mésenchyme périoculaire19,20. Les coupes coronales à travers des embryons E13.5, injectées à E7.5 avec un lentivirus à titre élevé, ont montré, comme dans le cerveau, une transduction élevée et uniforme du tissu neural de l’œil, ainsi que du cristallin, de la cornée et du mésenchyme (Figure 5K). Au fur et à mesure que la neurulation progresse, les injections à E8.5 et E9.5 entraînent le ciblage continu du cristallin et de l’épithélium cornéen (Figure 5L et Figure 5N), tandis que la transduction des tissus oculaires dérivés du neuroectoderme est moins efficace à E8.5 (Figure 5L,M) ou non ciblée à E9.5 (Figure 5N).
Alors que la plupart des particules virales infectent les tissus exposés lors de l’injection, certaines particules transduisent des tissus non ectodermiques dérivés qui se développent plus tard (Figure 6A). Les glandes et les canaux salivaires se développent autour de E11,5 à partir de l’épithéliumoral 21 et sont ciblés par NEPTUNE (Figure 6B). Après les injections à E9.5, l’épithélium lingual de la langue est bien transduit ; cependant, le mésenchyme sous-jacent est négatif (Figure 6C; les parenthèses indiquent les cellules transdudues; les astérisques indiquent le signal d’autofluorescence et non les cellules transdudues). De plus, il existe des grappes positives dans l’épithélium lingual, séparées par des sections négatives (Figure 6C, pointes de flèches blanches), suggérant une transduction de la surface de la papille. Les cellules de la crête neurale ont été décrites dans le mésenchyme langagier sous-jacent et dans l’épithélium lingual, où elles sont impliquées dans le développement des papilles gustatives et des papilles gustatives22. En effet, les injections à E7.5 entraînent une transduction généralisée du mésenchyme de la langue à E13.5 (Figure 6D), suggérant que les injections précoces ciblent les cellules de la crête neurale, contribuant au mésenchyme dans la langue.
Chez les vertébrés, les ganglions de la racine dorsale (DRG) sont une composante centrale du système nerveux périphérique (SNP), car toutes les entrées somatosensorielles de la périphérie du corps (température, douleur, pression) sont transmises au cerveau via l’activation des neurones DRG23. Les neurones et les cellules gliales du DRG sont dérivés des cellules de la crête neurale du tronc24. L’injection lentivirale, dans laquelle le promoteur hPGK omniprésent contrôle l’expression du rapporteur fluorescent, conduit à un ciblage généralisé du système nerveux central et périphérique (Figure 7A), transduisant à la fois les neurones et les progéniteurs de la moelle épinière (Figure 7B), ainsi que le DRG (Figure 7C). L’utilisation d’un MiniPromoter pour la doublecortine25 permet de limiter l’expression de la GFP aux seuls neurones (15 et Figure 7D,E).
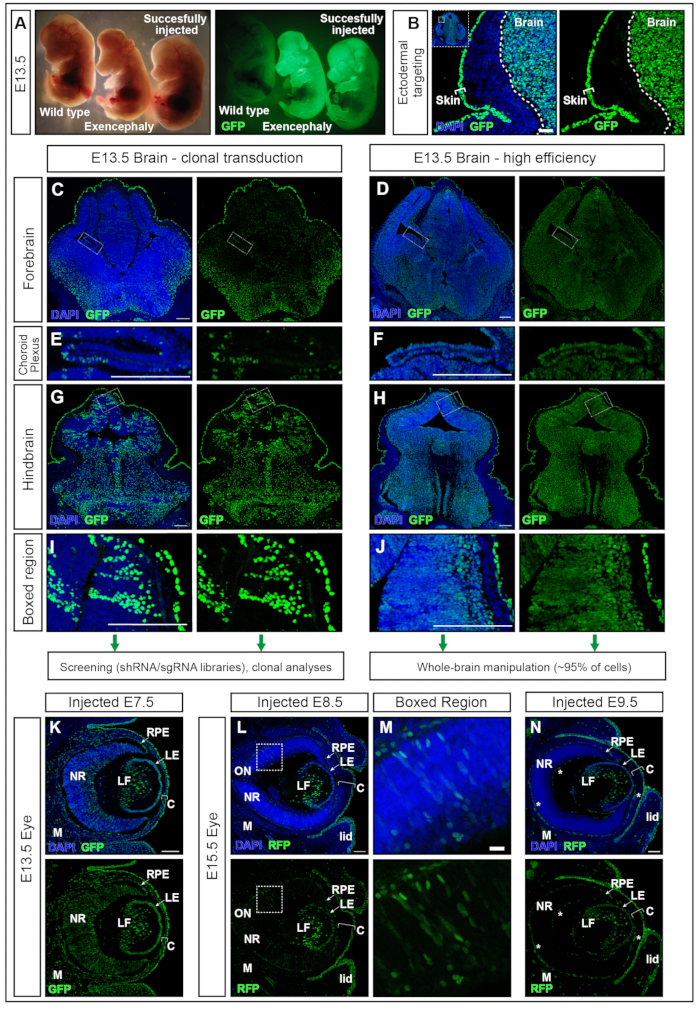
Figure 5 : Haute efficacité ou transduction clonale avec NEPTUNE. (A) Embryons E13.5 sous un microscope à dissection éclairé avec un éclairage standard (panneau de gauche) et mêmes embryons éclairés pour la GFP (panneau de droite). Embryon non injecté à l’extrême gauche, embryon injecté avec succès à l’extrême droite, produisant un signal positif dans le cerveau (embryon le plus à droite). Embryon exencéphalique dû à un excès de volume injecté (embryon intermédiaire). (B) Ciblage cutané et cérébral avec injection d’E7.5. Barre d’échelle = 50 μm. (C, D) E13.5 images confocales du cerveau antérieur avec une faible transduction clonale (C) ou une transduction à haute efficacité (D). (C, E, G, I) Transduction clonale de différentes régions du cerveau. (D, F, H, J) Transduction à haute efficacité de différentes régions du cerveau. Barres d’échelle = 200 μm. Différentes efficacités de transduction sont représentatives d’autres zones du SNC. (E, F) Ciblage du plexus choroïde, clonalement (E) ou avec une efficacité élevée (F). Barres d’échelle = 200 μm. (G, H) Ciblage clonal (G) et ciblage à haute efficacité (H) du cerveau postérieur, amplifié en (I, J). Barres d’échelle = 200 μm. (K) Expression du rapporteur de la GFP dans l’œil à E13,5 après injection in utero à E7,5 (L, M) Expression du rapporteur de la GFP dans l’œil à E15,5 après injection in utero à E8,5 (L), région en boîte amplifiée dans (M) ou à E9,5 (N). Les vaisseaux sanguins autofluorescents sont marqués d’étoiles blanches. Barres d’échelle = 100 μm. Abréviations: NEPTUNE = neural plate targeting with in uteronano-injection; C = cornée; LE = épithélium du cristallin; LF = Fibres de lentille; M = Mésenchyme; NR = Rétine neurale; ON = nerf optique; EPR = épithélium pigmentaire rétinien; GFP = protéine fluorescente verte; SNC = système nerveux central. Veuillez cliquer ici pour voir une version agrandie de cette figure.
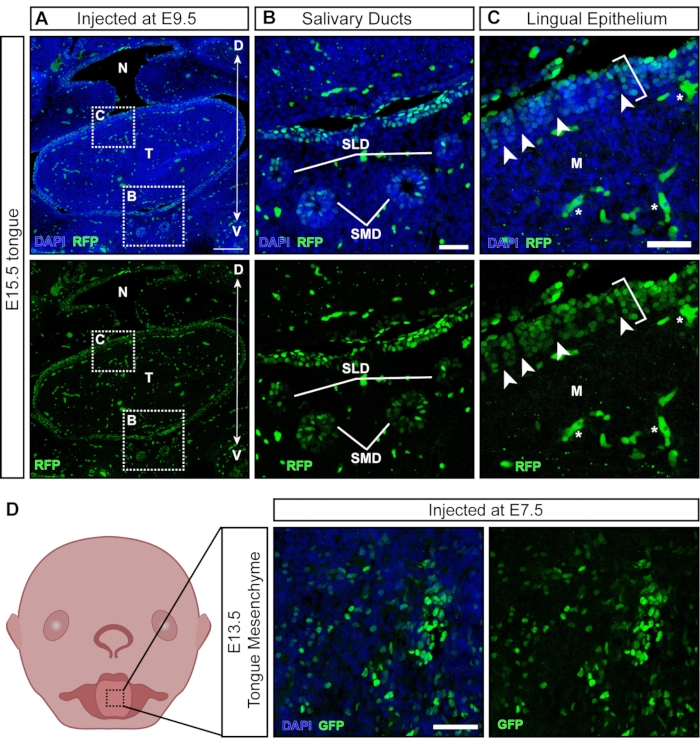
Figure 6 : Transduction in utero de tissus non neuraux. (A) Image confocale de la cavité buccale E15.5. L’embryon a été injecté avec un lentivirus rapporteur fluorescent à E9.5. Barre d’échelle = 200 μm. (B, C) (B) Grossissement du panneau encastré; épithélium des canaux salivaires transduits avec le virus. C) Grossissement du panneau encastré; épithélium lingual dorsal transduit avec le virus rapporteur GFP (crochet blanc). Le mésenchyme sous-jacent dérivé des cellules de la crête neurale est négatif. Les pointes de flèches blanches indiquent des papilles avec des cellules de crête neurale négatives entourées de cellules épithéliales transduites par virus (les cellules / vaisseaux sanguins autofluorescents sont marqués d’étoiles blanches). Barres d’échelle = 50 μm. (D) Image schématique et confocale du mésenchyme de la langue E13.5 après injections avec le virus rapporteur fluorescent à E7.5. Barre d’échelle = 50 μm. Abréviations : D = Dorsale; M = Mésenchyme; N = Nasopharynx; SLD = canal sublingual; DMS = canal sous-maxillaire; T = Langue; V = Ventral; GFP = protéine fluorescente verte. Veuillez cliquer ici pour voir une version agrandie de cette figure.
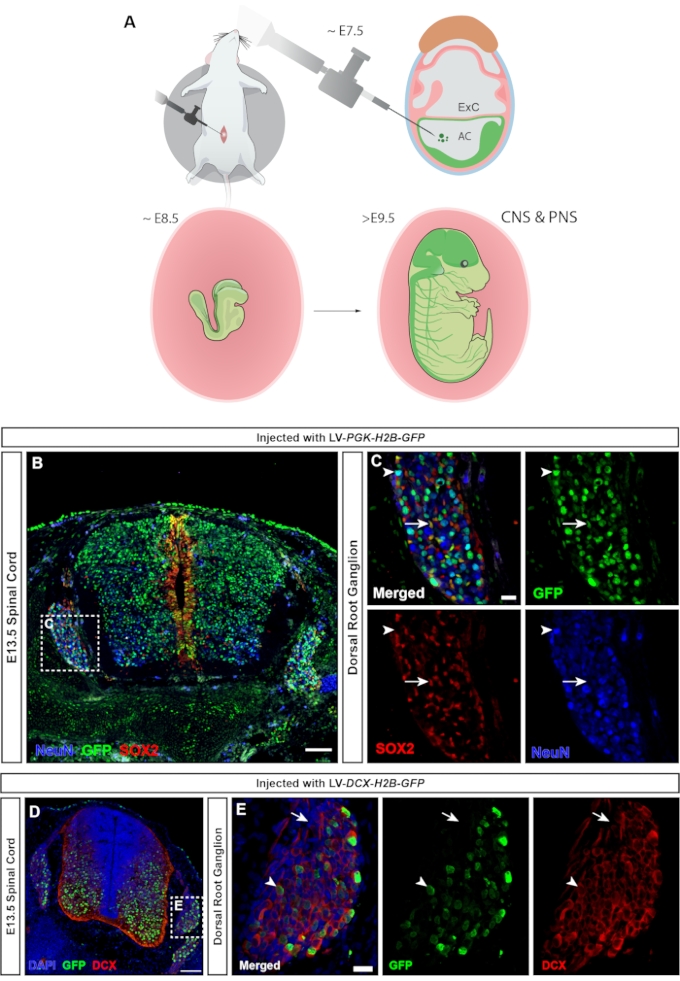
Figure 7 : Transduction des cellules ganglionnaires de la racine dorsale dérivées de la crête neurale. (A) Le ciblage NEPTUNE à E7.5 permet de cibler à la fois le SNC et le SNP. (B) L’image confocale de la moelle épinière E13.5 et des DRG injectés avec le lentivirus rapporteur hPGK-H2B-GFP à E7.5 montre la transduction des progéniteurs neuronaux SOX2+ et des neurones NeuN+. Barre d’échelle = 100 μm. (C) Région encadrée de B montrant le DRG avec expression de GFP dans les populations cellulaires SOX2+ (flèches blanches) et NeuN+ (pointes de flèches blanches). Barre d’échelle = 20 μm. (D) Image confocale de la moelle épinière E13.5 et DRG injectés avec le lentivirus DCX-H2B-GFP à E7.5, ciblant uniquement les cellules DCX+. Barre d’échelle = 100 μm. (E) Région encadrée de D montrant DRG avec expression GFP limitée aux neurones DCX+ (pointes de flèches blanches). Les cellules DCX- sont négatives pour la GFP (flèches blanches). Barre d’échelle = 20 μm. Abréviations: NEPTUNE = neural plate targeting with in utero nano-injection; SNC = système nerveux central; SNP = système nerveux périphérique; DRG = ganglions de la racine dorsale; GFP = protéine fluorescente verte. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Il y a plusieurs étapes dans ce protocole qui influencent la survie embryonnaire, la qualité des injections et la lecture. L’âge gestationnel des embryons est défini comme E0,5 à midi le jour du bouchon vaginal après l’accouplement nocturne. L’exécution de l’échographie pour la grossesse à E6.5 en fin d’après-midi / soir garantit que les embryons sont suffisamment développés pour être identifiés par échographie. La vérification (1) permet de présélectionner le nombre de souris plug-positives qui sont réellement gestantes, (2) garantit qu’aucun virus n’est décongelé inutilement et gaspillé dans le cas où les souris plug-positives ne sont pas gestantes, et (3) réduit les interventions inutiles sur les souris (évite la chirurgie sur les femelles non gravides).
À E7.5, les embryons sont sensibles aux forces externes et doivent être manipulés avec précaution. Par exemple, tirer sur les cornes utérines ou presser les déciduas peut entraîner une résorption embryonnaire. Le tissu utérin doit toujours être maintenu humide à l’extérieur de l’abdomen féminin pour empêcher le tissu de sécher. La majorité des déciduas doivent rester à l’intérieur de l’abdomen féminin, avec seulement 3-4 exposés pour les injections. La netteté de l’aiguille est un autre déterminant crucial pour le succès des injections. Les pointes d’aiguille émoussées ou cassées entraînent des piqûres répétées de déciduas ou une compression contre la pâte à modeler avant d’entrer dans le climatiseur, ce qui peut augmenter le taux de résorption. Par conséquent, les aiguilles bien moulues et pointues doivent toujours être stockées en toute sécurité et remplacées après un maximum de 2 femelles.
Ce protocole décrit comment cibler la plaque neurale avec une seule injection de lentivirus. En outre, il montre comment l’efficacité de la transduction peut être adaptée à partir de clones unicellulaires à l’ensemble du cerveau. Cependant, d’autres tissus non neuraux, y compris la peau et l’épithélium buccal, sont également ciblés. De plus, tous les types de cellules (progéniteurs et cellules différenciées) sont transduits, ce qui rend cette approche efficace mais non spécifique. L’utilisation de MiniPromoters dans la construction virale conduit à l’expression spécifique du transgène dans les neurones ou les astrocytes15. Cela a l’avantage d’éviter l’utilisation d’animaux Cre transgéniques dédiés et donc de réduire la quantité de travail (maintenance des souches et génotypage) et les coûts.
Les limites de NEPTUNE comprennent sa difficulté technique, les défis à obtenir des femelles enceintes à un rythme prévisible et constant, et les coûts d’acquisition d’instruments spécialisés. De plus, le ciblage non sélectif des cellules par lentivirus peut être considéré à la fois comme un avantage et une limitation de la technique. L’injection de plus grands volumes dans le courant alternatif entraîne une exencéphalie13, bien que les malformations cérébrales et l’exencéphalie soient évitées avec les volumes décrits ici15. Un impact négatif sur le développement cérébral est donc un risque avec les nano-injections in utero qui doivent être soigneusement évitées en injectant des volumes corrects adaptés au stade embryonnaire et à la taille du CA.
Les adaptations futures de la technique pourraient se concentrer sur le tropisme viral. Les virus adéno-associés (AAV) ont différents sérotypes, dont il a été démontré qu’ils ciblent de manière robuste différents types de cellules dans le SNC17,26. Cependant, les AAV ne s’intègrent pas dans le génome de la cellule hôte et peuvent donc être perdus dans les cellules à taux de division élevé. Bien qu’il existe plusieurs façons d’accroître la spécificité de NEPTUNE, les animaux transgéniques restent l’étalon-or en matière de manipulation génétique in vivo. Des souris Cas9 et un lentivirus codant pour l’ARNg ont été utilisés pour le dépistage génétique dans l’épiderme embryonnaire27 et peuvent également être adaptés au SNC en développement.
Les injections dans le courant alternatif à E7.5 ciblent efficacement les cellules du neuroectoderme avant le début de la neurulation et ciblent le cerveau en développement plus efficacement que l’électroporation in utero . Cela permet d’étudier les indices génétiques importants pour le développement du cerveau à partir d’un point temporel antérieur. Contrairement aux modèles génétiques classiques de souris, NEPTUNE offre une approche flexible pour effectuer une analyse génétique fonctionnelle. Les phénotypes après surexpression ou suppression de gènes peuvent être étudiés en quelques jours à quelques semaines par rapport à des mois ou des années. Les injections de constructions virales multiples permettent la manipulation de plusieurs gènes au sein d’un embryon et évitent la génération d’animaux knock-out doubles ou triples. Par conséquent, NEPTUNE permet non seulement de gagner du temps, mais aussi de réduire le nombre d’animaux utilisés dans la recherche.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Nous remercions Bettina Semsch et Jia Sun (Infinigene) pour les soins experts des souris; Florian Salomons et Göran Månsson de Biomedicum Imaging Core (BIC) pour l’aide à l’acquisition d’images et à la consultation. Financement : Nous remercions les bailleurs de fonds suivants pour leur soutien à ce projet : le Conseil suédois de la recherche, le Karolinska Institutet (KI Foundations, Career Development Grant, Ph.D. student KID funding et SFO StratNeuro funding, le Center of Innovative Medicine), la Fondation Ollie and Elof Ericssons, la Fondation Tornspiran, la Fondation Jeansssons, le Prix Sven et Ebba-Christina Hagbergs et la bourse de recherche, Knut and Alice Wallenberg Project Grant, Fredrik and Ingrid Thurings Foundation, Lars Hiertas Minne, The Childhood Cancer Foundation (Barncancerfonden), The Åhlen Foundation, Åke Wibergs Foundation, Tore Nilssons Foundation, and the Swedish Foundations Starting Grant to ERA. Les figures 4D,E ont été créées avec BioRender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | BD Bioscience | 309628 | |
| 27 G Needle | BD Bioscience | 300635 | |
| 3.5 inches capillaries | Drummond Scientific | 3000203G/X | Were used to pull in house needles |
| 70 MHz MS Series transducer | Visual Sonics | MS700 | |
| Aquasonic clear ultrasound gel | Parker Laboratories | Mar-50 | |
| Autoclip Applier 9 mm | Angthos | 12020-09 | |
| CD1 mice | Charles River, Germany | Crl:CD1(ICR) | Females: from age of 8 weeks old Males: from the age of 12 weeks old |
| Cotton Swab | OneMed Sverige AB | 120788 | |
| DPBS | Gibco | 14190094 | |
| Dressing forceps delicate straight 13 cm | Agnthos | 08-032-130 | |
| EG-400 Narishige Micropipette Grinder | Narishige | NA | |
| EZ clips 9 mm | Angthos | 59027 | clips |
| Iris Scissors, Super Cut, straight, 9 cm | Agnthos | 307-336-090 | |
| Isofluorane | Baxter Medical AB | EAN: 50085412586613 | Purchased from Swedish Pharmacy |
| Kimwipes | Kimberly Clarke | 7557 | |
| Membrane Tape | Visual Sonics | SA-11053 | |
| Micropipette Puller | Sutter Instrument | P-97 | |
| Modeling Clay | Sense AB | 10209 | |
| Mouse Handling Table | Visual Sonics | 50249 | |
| Nanoject II Auto Injector Kit | Drummond | 3-000-205A | |
| Parafilm | Bemis | HS234526C | |
| Petri dish with central opening (low wall) | Visual Sonics | SA-11620 | |
| Petri dish, (ØxH): 92 x 16 mm | Sarstedt | 82.1472.001 | |
| Rely+On Virkon | DuPont | 130000132037 | disinfectant |
| Silicone membrane | Visual Sonics | SA-11054 | |
| Steri 250, hot bead sterilizer | Angthos | 31100 | |
| Surgical Tape (1.25 cm x 9.14 m) | Medicarrier | 67034 | |
| Vevo Compact Dual (Med. Air & O2) Anesthesia System | Visual Sonics | VS-12055 | |
| Vevo Imaging Station 2 | Visual Sonics | VS-11983 | |
| Vevo2100 | Visual Sonics | VS-20047 | |
| Vicryl 6-0; C-3 needle, 45 cm purple filament | Agnthos | J384H |
Références
- Theiler, K. . The House mouse. Atlas of embryonic development. , (1989).
- Barresi, M. J. F., Gilbert, S. F. . Developmental biology. , (2016).
- Taylor, J. C., et al. Factors influencing success of clinical genome sequencing across a broad spectrum of disorders. Nature Genetics. 47 (7), 717-726 (2015).
- Pizzo, L., et al. Rare variants in the genetic background modulate cognitive and developmental phenotypes in individuals carrying disease-associated variants. Genetics in Medicine. 21 (4), 816-825 (2019).
- Sakai, Y. Neurulation in the mouse: Manner and timing of neural tube closure. The Anatomical Record. 223 (2), 194-203 (1989).
- Schoenwolf, G. C. Shaping and bending of the avian neuroepithelium: Morphometric analyses. Developmental Biology. 109 (1), 127-139 (1985).
- Smith, J. L., Schoenwolf, G. C., Quan, J. Quantitative analyses of neuroepithelial cell shapes during bending of the mouse neural plate. Journal of Comparative Neurology. 342 (1), 144-151 (1994).
- Katahira, T., Nakamura, H. Gene silencing in chick embryos with a vector-based small interfering RNA system. Development Growth and Differentiation. 45 (4), 361-367 (2003).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. I. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochemical and Biophysical Research Communications. 230 (2), 376-380 (1997).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Beronja, S., Livshits, G., Williams, S., Fuchs, E. Rapid functional dissection of genetic networks via tissue-specific transduction and RNAi in mouse embryos. Nature Medicine. 16 (7), 821-827 (2010).
- Pierfelice, T. J., Gaiano, N. Ultrasound-guided microinjection into the mouse forebrain in utero at E9.5. Journal of Visualized Experiments JoVE. (45), e2047 (2010).
- Gaiano, N., Kohtz, J. D., Turnbull, D. H., Fishell, G. A method for rapid gain-of-function studies in the mouse embryonic nervous system. Nature Neuroscience. 2 (9), 812-819 (1999).
- Slevin, J. C., et al. High resolution ultrasound-guided microinjection for interventional studies of early embryonic and placental development in vivo in mice. BMC Developmental Biology. 6, 10 (2006).
- Mangold, K., et al. Highly efficient manipulation of nervous system gene expression with NEPTUNE. Cell Reports Methods. 1, 100043 (2021).
- Kameneva, P., et al. Single-cell transcriptomics of human embryos identifies multiple sympathoblast lineages with potential implications for neuroblastoma origin. Nature Genetics. 53 (5), 694-706 (2021).
- Kaiser, K., et al. MEIS-WNT5A axis regulates development of fourth ventricle choroid plexus. Development. 148 (10), (2021).
- Haddad, M. R., Donsante, A., Zerfas, P., Kaler, S. G. Fetal brain-directed AAV gene therapy results in rapid, robust, and persistent transduction of mouse choroid plexus epithelia. Molecular Therapy. Nucleic Acids. 2 (6), 101 (2013).
- Heavner, W., Pevny, L. Eye development and retinogenesis. Cold Spring Harbor Perspectives in Biology. 4 (12), 008391 (2012).
- Swamynathan, S. K. Ocular surface development and gene expression. Journal of Ophthalmology. 2013, 103947 (2013).
- Amano, O., Mizobe, K., Bando, Y., Sakiyama, K. Anatomy and histology of rodent and human major salivary glands: -overview of the Japan Salivary Gland Society-sponsored workshop. Acta Histochemica et Cytochemica. 45 (5), 241-250 (2012).
- Liu, H. X., Komatsu, Y., Mishina, Y., Mistretta, C. M. Neural crest contribution to lingual mesenchyme, epithelium and developing taste papillae and taste buds. Developmental Biology. 368 (2), 294-303 (2012).
- Marmigère, F., Ernfors, P. Specification and connectivity of neuronal subtypes in the sensory lineage. Nature Reviews. Neuroscience. 8 (2), 114-127 (2007).
- Zirlinger, M., Lo, L., McMahon, J., McMahon, A. P., Anderson, D. J. Transient expression of the bHLH factor neurogenin-2 marks a subpopulation of neural crest cells biased for a sensory but not a neuronal fate. Proceedings of the National Academy of Sciences of the United States of America. 99 (12), 8084-8089 (2002).
- Portales-Casamar, E., et al. A regulatory toolbox of MiniPromoters to drive selective expression in the brain. Proceedings of the National Academy of Sciences of the United States of America. 107 (38), 16589-16594 (2010).
- Tervo, D. G. R., et al. A designer AAV variant permits efficient retrograde access to projection neurons. Neuron. 92 (2), 372-382 (2016).
- Loganathan, S. K., et al. Rare driver mutations in head and neck squamous cell carcinomas converge on NOTCH signaling. Science. 367 (6483), 1264-1269 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon