Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Herramientas para el tratamiento superficial de microelectrodos intracorticales planos de silicio
En este artículo
Resumen
El presente protocolo describe herramientas para el manejo de microelectrodos intracorticales planos de silicio durante los tratamientos para la modificación de la superficie a través de la deposición de gas y las reacciones de solución acuosa. El ensamblaje de los componentes utilizados para manejar los dispositivos a lo largo del procedimiento se explica en detalle.
Resumen
Los microelectrodos intracorticales tienen un gran potencial terapéutico. Pero se enfrentan al desafío de una reducción significativa del rendimiento después de duraciones de implantación modestas. Un contribuyente sustancial a la disminución observada es el daño al tejido neural proximal al implante y la posterior respuesta neuroinflamatoria. Los esfuerzos para mejorar la longevidad del dispositivo incluyen modificaciones químicas o aplicaciones de recubrimiento en la superficie del dispositivo para mejorar la respuesta del tejido. El desarrollo de tales tratamientos superficiales generalmente se completa utilizando sondas "ficticias" no funcionales que carecen de los componentes eléctricos necesarios para la aplicación prevista. La traducción a dispositivos funcionales requiere una consideración adicional dada la fragilidad de las matrices de microelectrodos intracorticales. Las herramientas de manipulación facilitan en gran medida los tratamientos superficiales de los dispositivos ensamblados, especialmente para las modificaciones que requieren largos tiempos de procedimiento. Las herramientas de manipulación descritas aquí se utilizan para tratamientos superficiales aplicados a través de la deposición en fase gaseosa y la exposición a la solución acuosa. La caracterización del recubrimiento se realiza mediante elipsometría y espectroscopia de fotoelectrones de rayos X. Una comparación de los registros de espectroscopia de impedancia eléctrica antes y después del procedimiento de recubrimiento en dispositivos funcionales confirmó la integridad del dispositivo después de la modificación. Las herramientas descritas se pueden adaptar fácilmente para dispositivos de electrodos alternativos y métodos de tratamiento que mantienen la compatibilidad química.
Introducción
Los dispositivos neuroprotésicos tienen como objetivo restaurar las capacidades sensoriales y motoras deterioradas o ausentes en una amplia gama de poblaciones de pacientes, incluidos aquellos con lesión de la médula espinal, esclerosis lateral amiotrófica (ELA), parálisis cerebral y amputaciones 1,2,3. Los microelectrodos intracorticales (IME) pueden establecer una vía de comunicación entre las neuronas corticales y los dispositivos utilizados para controlar las neuroprótesis. Una clara ventaja de los microelectrodos intracorticales es su capacidad para registrar señales neuronales a una alta resolución espacial y temporal, que se prefiere para el posterior procesamiento de señales y el control de las interfaces cerebro-computadora 4,5. Desafortunadamente, el rendimiento de los microelectrodos intracorticales se reduce drásticamente en cuestión de meses a un año después de la implantación 2,6,7,8. La pérdida de calidad y estabilidad de la señal afecta negativamente la aplicación de la tecnología.
Un contribuyente significativo a la disminución del rendimiento observada es la respuesta biótica al daño tisular asociado a la implantación y la neuroinflamación crónica 9,10,11. La implantación de IME inflige daño en el tejido cerebral, lo que resulta en la liberación de moléculas de señalización que inician cascadas de procesos reaccionarios de defensa celular. La interfaz crónica exacerba la respuesta de cuerpos extraños, lo que lleva a una neuroinflamación sostenida que daña el tejido proximal al dispositivo; a menudo reconocidos como síntomas de neuroinflamación, cicatrización y neurodegeneración local que contribuyen a la disminución del registro de la calidad de la señal 12,13,14,15. Comprendiendo un denso conglomerado de astrocitos con microglía y macrófagos activados arrastrados, la cicatriz que encapsula el electrodo crea un ambiente local desfavorable con transporte de material reducido y acumulación local de factores inflamatorios 16,15,16,17,18.
Muchos estudios han descrito la respuesta del cerebro a los microelectrodos intracorticales o enfoques para mitigar la respuesta7. La investigación y el desarrollo para mejorar la respuesta del tejido han implicado una serie de estrategias, incluidas modificaciones en la estructura general, la topología de la superficie, los materiales y la aplicación de recubrimientos. Estos esfuerzos pretenden minimizar el daño sufrido por el evento de implantación, introducir una interfaz más favorable entre el dispositivo y las células proximales, o reducir la tensión tisular después de que los dispositivos se implantan7. Los métodos dirigidos específicamente a la respuesta biológica crónica han llevado a varios recubrimientos bioactivos que tienen como objetivo estabilizar el sitio de implantación y promover químicamente la salud celular. Los ejemplos incluyen polímeros conductores como el poli(etileno dioxitiofeno) (PEDOT)19,20, los nanotubosde carbono 21, los hidrogeles22 y la adición de moléculas bioactivas y medicamentos para atacar procesos celulares específicos 23,24,25. Nuestro grupo de investigación, en particular, ha explorado muchos mecanismos para promover una reducción de la respuesta inflamatoria a los microelectrodos implantados, incluyendo, pero no limitado a, minimizar el trauma asociado con la implantación del dispositivo26, minimizar el desajuste de rigidez del dispositivo / tejido 27,28,29,30,31,32,33, optimizar la esterilización procedimientos34,35, reducción del estrés/daño oxidativo 28,36,37,38,39,40,41,42, exploración de materiales de electrodos alternativos43 e imitación de la nanoarquitectura de la matriz extracelular natural 44,45,46 . El interés reciente es el desarrollo de recubrimientos superficiales biomiméticos para mitigar la respuesta neuroinflamatoria en la interfaz del tejido microelectrodo directamente39.
La modificación de la interfaz ofrece el beneficio único de apuntar directamente a la herida y al tejido proximal necesarios para el registro de señales. Un tratamiento de superficie que promueva la curación sin exacerbar la respuesta inmune puede beneficiar la vida útil del registro de calidad y eliminar las limitaciones en la realización del potencial terapéutico y de investigación de los microelectrodos intracorticales. El trabajo presentado detalla los métodos para aplicar tratamientos superficiales a matrices de microelectrodos que requieren tiempos de reacción prolongados al tiempo que se adaptan a la fragilidad de los dispositivos. La técnica presentada está destinada a compartir métodos de modificación de superficie con dispositivos funcionales donde el dispositivo no se puede manejar durante toda la aplicación de tratamiento. Las herramientas se presentan para el manejo de sondas ficticias no funcionales y matrices de microelectrodos planos de silicio funcionales.
El enfoque presentado para modificar la superficie del electrodo permite la suspensión segura de sondas ficticias no funcionales o matrices de electrodos planos de silicio funcional para la deposición en fase gaseosa y la reacción con soluciones acuosas. Se utilizan varias piezas impresas en 3D para manejar estos frágiles dispositivos (Figura 1 y Figura 2). Se proporciona un ejemplo de un procedimiento que utiliza pasos de fase de gas y solución para la modificación de la superficie con un recubrimiento antioxidante que implica la inmovilización de Mn(III)tetrakis (ácido 4-benzoico) porfirina (MnTBAP). MnTBAP es una metaloporfirina sintética que posee propiedades antioxidantes con mediación demostrada de inflamación47,48. El ejemplo proporcionado sobre matrices de electrodos planos de silicio funcional valida una actualización de un protocolo previamente informado para dispositivos no funcionales40. La adaptación de una técnica de deposición en fase gaseosa de Munief et al. apoya la compatibilidad del protocolo con electrodos funcionales49. La deposición en fase gaseosa se utiliza para funcionalizar la superficie con aminas en preparación para la reacción acuosa que involucra la química del reticulador de carbodiimida para inmovilizar el MnTBAP activo. La metodología de manejo desarrollada aquí se proporciona como una plataforma que se puede modificar para acomodar otros recubrimientos y dispositivos similares.
El protocolo ilustra el enfoque utilizando sondas ficticias no funcionales que comprenden un vástago de silicio y una pestaña impresa en 3D con dimensiones similares a las matrices de electrodos planos de silicio funcional. El embalaje del conector del dispositivo se considera análogo a la pestaña impresa en 3D de la sonda ficticia no funcional en la instrucción proporcionada.
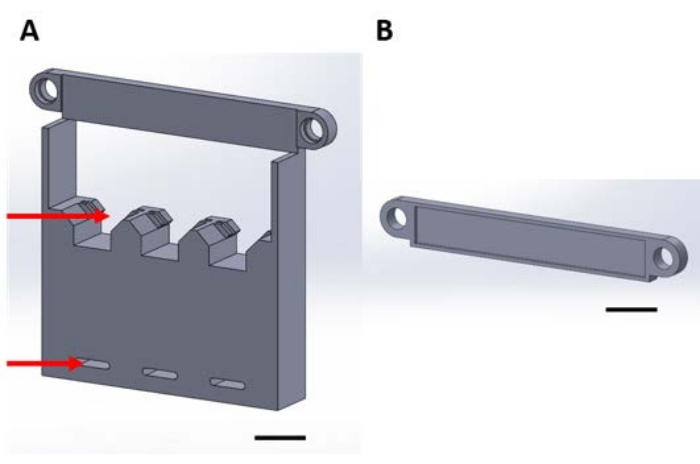
Figura 1: Piezas impresas en 3D para manipular dispositivos funcionales durante la deposición en fase gaseosa en un desecador al vacío. (A) La base de la estructura incluye soportes para cuadrados de silicio de muestra de 1 cm x 1 cm (flecha superior) y orificios para asegurar la placa desecadora (flecha inferior). (B) La placa se utiliza para asegurar la suspensión de los dispositivos. A partir de aquí, cada pieza de esta figura se denominará pieza 1A o 1B. Barra de escala = 1 cm. Haga clic aquí para ver una versión más grande de esta figura.
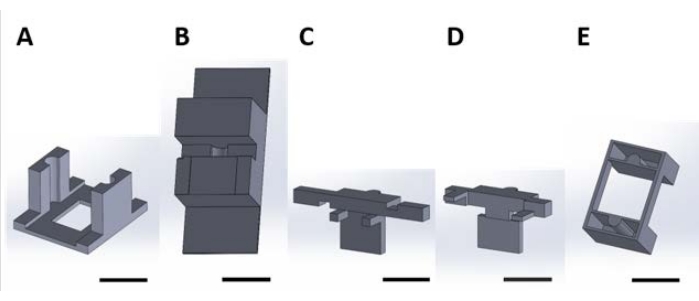
Figura 2: Piezas impresas en 3D para la manipulación de dispositivos funcionales para la reacción superficial que se produce en la solución acuosa. (A) Pieza guía a pegar a la tapa de la placa de cultivo. (B) Piezas de sobremesa utilizadas para estabilizar piezas (C) y (D) durante el montaje. (C) y (D) juntos aseguran la suspensión de los dispositivos para su colocación en la placa del pozo, y (E) aseguran aún más las piezas (C) y (D) a la tapa de la placa del pozo. A partir de aquí, las piezas individuales en cada panel de esta figura se denominarán números de pieza correspondientes al número de panel de esta figura. Barra de escala = 1 cm. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Todos los archivos de codificación para impresión 3D se proporcionan en Archivos de codificación suplementarios 1-16. El análisis proporcionado en los resultados representativos se describe utilizando matrices de electrodos planos de silicio funcional adquiridos comercialmente (véase la Tabla de materiales).
1. Montaje de manipulación para deposición en fase gaseosa en un desecador al vacío
NOTA: El aparato ensamblado para manipular y mantener dispositivos durante la deposición en fase gaseosa se muestra en la Figura 3. Los pasos 1.1-1.8 describen el procedimiento requerido para colocar los dispositivos en el aparato para su deposición (Figura 4A).

Figura 3: Montaje de piezas impresas en 3D para el manejo de dispositivos funcionales durante la deposición en fase gaseosa. El conjunto se representa sin muestras que recubrir. Los tornillos y las tuercas de las alas se utilizan para sujetar las piezas 1A y 2B juntas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Imagen de montaje y colocación de muestras a recubrir. Este esquema describe el manejo de dispositivos funcionales durante la deposición en fase gaseosa asegurada dentro de un desecador de vacío. (A) Cinta de poliimida de doble cara colocada en la pieza 1A y cinta de espuma colocada en 1B. (B) Dispositivos asegurados a la cinta. (C) Los tornillos y las tuercas de las alas se utilizan para sujetar las piezas 1B a 1A, y el conjunto se une a la bandeja del desecador mediante bridas de cable con cremallera (flechas rojas). (D) Las muestras cuadradas de silicio de 1 cm x 1 cm se colocan en los soportes respectivos. (E) El plato de pesaje de aluminio y el manómetro se colocan en el desecador en la orientación mostrada. Haga clic aquí para ver una versión más grande de esta figura.
- Para el tratamiento de superficies, adquiera muestras cuadradas de 1 cm x 1 cm del material de sustrato de los dispositivos.
- Para las muestras de silicio (seleccionadas para este protocolo), corte la oblea de silicio en cuadrados de 1 cm x 1 cm utilizando una máquina de corte de obleas (consulte la Tabla de materiales).
- Imprima o adquiera las piezas 1A (Figura 1A, Archivo de codificación suplementaria 1, Archivo de codificación suplementaria 2) y 1B (Figura 1B, Archivo de codificación suplementaria 3, Archivo de codificación suplementaria 4).
- Conecte la cinta de poliimida de doble cara a la pieza 1A y conecte una tira de espuma de 1/8 "de espesor con adhesivo de un lado a la pieza 1B.
- Adhiera el embalaje del conector del dispositivo a la cinta de la pieza 1A.
NOTA: La orientación ideal del conector en la cinta dejará el vástago suspendido sobre el borde, como se muestra en la Figura 4B. - Asegure la pieza 1A y la pieza 1B juntas (Figura 4C). Alinee los orificios y asegúrelos con tornillos de acero inoxidable y tuercas de ala (consulte la Tabla de materiales).
- Usando lazos de cremallera, sujete el conjunto a la bandeja desecadora de vacío utilizando los orificios en la parte inferior de la pieza 1A como se muestra en la Figura 4C.
- Si corresponde, coloque muestras de material cuadrado en las rendijas en la parte inferior del marco (Figura 4D). Aquí, se utilizan muestras en cubitos de oblea de silicio cuadrada de 1 cm x 1 cm como ejemplo.
NOTA: El material exacto deberá coincidir con el sustrato del dispositivo tratado, que variará según el dispositivo. - Complete la deposición en fase gaseosa colocando la solución en un receptáculo apropiado dentro del desecador de vacío opuesto y en línea con el conjunto asegurado.
NOTA: Los platos de pesaje de aluminio se utilizaron como recipientes para la deposición de (3-aminopropil)trietoxisilano (APTES), como ejemplo aquí.- Coloque un medidor de vacío (consulte la Tabla de materiales) dentro del desecador para registrar la presión exacta. Coloque el puerto de la tapa del desecador cerca del conjunto asegurado y en línea con la solución (Figura 4E).
NOTA: Más detalles sobre este método de deposición en fase gaseosa se describen en una Referencia49 publicada anteriormente.
- Coloque un medidor de vacío (consulte la Tabla de materiales) dentro del desecador para registrar la presión exacta. Coloque el puerto de la tapa del desecador cerca del conjunto asegurado y en línea con la solución (Figura 4E).
2. Manejo del conjunto para la reacción superficial a través de una solución acuosa
NOTA: Los componentes y aparatos ensamblados para manipular y sujetar dispositivos durante la deposición en fase acuosa y el tratamiento de superficies se ilustran en las Figuras 5-7. Los siguientes pasos detallarán el procedimiento requerido para colocar los dispositivos en el aparato para su deposición y tratamiento.

Figura 5: Montaje de piezas impresas en 3D para el manejo de dispositivos funcionales para la reacción superficial que se produce en solución acuosa. (A) Pieza guía a pegar a la tapa de la placa de cultivo. (B) La pieza de sobremesa se utilizó para estabilizar las piezas (C) y (D) durante el montaje. (C) y (D) juntos aseguran la suspensión de los dispositivos para su colocación en la placa del pozo. (E) asegura además las piezas (C) y (D) a la tapa de la placa del pozo. Se colocó cinta de poliimida de doble cara en la parte inferior de (C), y cinta de espuma en la parte inferior de (D) (ambas en caja en rojo). Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Tapa de la placa de cultivo celular construida con 6 guías (pieza 2A). Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Secuencia para asegurar y cargar sondas para la reacción de la solución. El color de las piezas se cambió en esta figura para mayor claridad dentro de la imagen. Estas son las mismas partes que la Figura 5 y la Figura 6. (A) La pieza 2C se coloca en la pieza 2B, y el dispositivo se fija a la parte pegada de 2C. (B) La pieza 2D encaja en la pieza 2C para crear un conjunto que suspende el vástago del dispositivo. (C) El ensamblaje de 2C, 2D y el dispositivo se colocan cuidadosamente en la tapa de la placa del pozo utilizando la guía. (D) La pieza 2E se ajusta en la parte superior del conjunto para asegurar aún más la tapa. Haga clic aquí para ver una versión más grande de esta figura.
- Construya una tapa para la placa del pozo para suspender la matriz de electrodos del dispositivo en solución (Figura 6). Este protocolo describe el uso de una placa de 24 pocillos.
- Corte agujeros rectangulares de 19 mm x 10,5 mm en la tapa de la placa del pozo con un cortador láser o manualmente con un cortador de caja. Haga coincidir el número de orificios con el número de dispositivos deseados para el tratamiento.
NOTA: Para facilitar el montaje, se recomienda tratar seis dispositivos por placa de pozo, o como mínimo, colocar agujeros sobre pozos no adyacentes (Figura 6). - Imprima o adquiera el número apropiado de guías (pieza 2A (Figura 2A), Archivo de codificación suplementaria 5, Archivo de codificación suplementaria 6).
- Use adhesivo de cianoacrilato para asegurar las guías a la tapa. Alinee los orificios rectangulares en las guías y tapas mientras pega para asegurarse de que el orificio rectangular de la guía no esté obstruido, como se muestra en la Figura 6.
- Corte agujeros rectangulares de 19 mm x 10,5 mm en la tapa de la placa del pozo con un cortador láser o manualmente con un cortador de caja. Haga coincidir el número de orificios con el número de dispositivos deseados para el tratamiento.
- Llene la placa del pozo con la solución deseada en los lugares donde se realizará el tratamiento. Para fines de ejemplo, la solución comprende EDC y Sulfo-NHS (consulte la Tabla de materiales) en el búfer MES.
NOTA: El volumen de la solución dependerá de las dimensiones del dispositivo de electrodo. Para matrices de microelectrodos de estilo Michigan (consulte la Tabla de materiales) con conectores de bajo perfil de 8,6 mm y longitud de vástago de 3 mm, hay una holgura de ~ 9 mm50. El uso de 2 ml de solución permitirá que el vástago del dispositivo se sumerja completamente mientras mantiene el resto del dispositivo fuera de la solución de reacción.- Si se utilizan muestras de sustrato para confirmar el tratamiento de la superficie, coloque muestras de material cuadradas en un pozo de la placa y sumérjalas en la solución de reacción.
- Suspenda de forma segura los dispositivos (consulte la Tabla de materiales) en una placa de pozo. La secuencia se muestra en la Figura 7.
- Pieza de cinta 2B (Figura 2B, Archivo de codificación suplementaria 7, Archivo de codificación suplementaria 8) a una mesa de trabajo (Figura 7A).
- Coloque la cinta de poliimida de doble cara para cubrir la base de la pieza 2C (Figura 2C, Archivo de codificación suplementaria 9, Archivo de codificación suplementaria 10).
- Coloque la cinta de espuma de 1/8" con adhesivo de un solo lado para cubrir la base de la pieza 2D (Figura 2D, Archivo de codificación suplementario 11, Archivo de codificación suplementaria 12).
- Encaje la pieza 2C en la ranura de la pieza 2B (Figura 7A).
- Adhiera el embalaje del conector del dispositivo a la cinta, orientado, de modo que se suspenda la longitud del vástago del dispositivo (Figura 7B).
- Asegure el dispositivo deslizando la pieza 2D (que se muestra en naranja en la Figura 7) en la pieza 2C. Este conjunto asegura eficazmente el dispositivo entre las piezas de herramienta (Figura 7B).
- Sosteniendo los bordes del conjunto, levante con cuidado para retirar de la pieza 2A.
- Ajuste el conjunto en la tapa alineando los semicírculos orientados hacia el exterior en las piezas 2C y 2D con las guías correspondientes en la pieza 2A (que se muestran en verde en la Figura 7C).
- Colocación segura del conjunto mediante la pieza de ajuste a presión 2E (Figura 2E) sobre las guías (que se muestra en verde en la Figura 7D, Archivo de codificación suplementaria 13, Archivo de codificación suplementaria 14).
- Para las reacciones que se benefician de la mezcla continua de la solución, agite la placa del pozo. Transfiera la placa de pozo ensamblada a una mesa agitadora y funcione a velocidades inferiores a 100 rpm.
- Si se desean múltiples reacciones basadas en la solución o pasos de lavado, transfiera cuidadosamente la tapa a una nueva placa de pozo con las soluciones deseadas distribuidas a los pozos apropiados.
NOTA: El paso 2.4 es opcional. - Retire los dispositivos de la placa del pozo.
- Pieza de cinta 2B a una mesa de trabajo.
- Retire la pieza 2E de la tapa.
- Retire con cuidado el conjunto que sujeta el dispositivo de la placa del pozo.
- Oriente el conjunto, de modo que la pieza 2C mire hacia el sobremesa y la pieza 2D mire hacia arriba. El vástago del dispositivo debe ser paralelo a la mesa de trabajo. Ajuste la pieza 2C del conjunto en la pieza 2B como se completó anteriormente (paso 2.3.4) al encajar el conjunto.
- Separe la pieza 2D de la pieza 2C separándolas cuidadosamente. Aplique una ligera presión sobre las pestañas de la pieza 2C en el banco para proporcionar estabilidad para esta tarea.
NOTA: Las pestañas de 2C son más largas que las de 2D para facilitar este manejo. - Use fórceps para sujetar el embalaje del conector del dispositivo para retirarlo de la cinta y transferirlo al contenedor de almacenamiento deseado.
Resultados
Para demostrar el uso de los componentes de manipulación, se implementó la metodología descrita para adaptar la inmovilización de un mediador oxidante al silicio activado. La aplicación de esta química a los IME para reducir el estrés oxidativo fue ideada por Potter-Baker et al. y demostrada en sondas ficticias de silicio no funcionales40. Este tratamiento superficial inmoviliza el antioxidante, MnTBAP, a la superficie de silicio activado por UV / ozono a través de la funcionalización...
Discusión
El protocolo descrito fue diseñado para el tratamiento superficial de matrices de microelectrodos planos de silicio. Las herramientas impresas en 3D se personalizan para matrices de microelectrodos al estilo de Michigan con conectores de bajo perfil50. Las sondas no funcionales se ensamblaron mediante la adhesión de una sonda de silicio a pestañas impresas en 3D utilizando un adhesivo biocompatible. Las pestañas impresas en 3D fueron diseñadas con dimensiones similares a los conectores incorp...
Divulgaciones
El contenido no representa las opiniones del Departamento de Asuntos de Veteranos de los Estados Unidos, los Institutos Nacionales de Salud o el Gobierno de los Estados Unidos.
Agradecimientos
Este estudio fue apoyado en parte por el Premio de Revisión al Mérito IRX002611 (Capadona) y el Premio al Científico de Carrera de Investigación IK6RX003077 (Capadona) del Servicio de Investigación y Desarrollo de Rehabilitación del Departamento de Asuntos de Veteranos de los Estados Unidos (EE. UU.). Además, este trabajo también fue apoyado en parte por el Instituto Nacional de Salud, el Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares R01NS110823 (Capadona / Pancrazio) y el Programa de Becas de Investigación para Graduados de la Fundación Nacional de Ciencias (Krebs).
Materiales
| Name | Company | Catalog Number | Comments |
| 1-[3-(Dimethylamino)propyl]-3-ethylcarbodiimide methiodide (EDC) | Sigma-Aldrich | 165344-1G | Solid, stored desiccated at -20 °C |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| 18 Pound Solid Nylon Cable/Zip Ties | Cole-Parmer | EW-06830-66 | Length 4 inches |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Sigma-Aldrich | 4432-31-9 | Solid |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 440140-100ML | Liquid, container with Sure/Seal |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Aluminum foil | Fisher Scientific | 01-213-103 | |
| Aluminum weighing dishes | Fisher Scientific | 08-732-102 | Diameter 66 mm |
| Bel-Art Vacuum Desiccator | Fisher Scientific | 08-594-15B | |
| Corning Costar TC-Treated Multiple Well Plates | Millipore Sigma | CLS3527-100EA | 24-well plate, polystyrene |
| Cyanoacrylate Adhesive | LocTite | N/A | |
| Digital Microscope | Keyence | VHX-S750E | |
| Disco DAD3350 Dicing Saw | Disco | DAD3350 | Used to cut silicon wafer into 1 cm x 1 cm samples |
| Double-Sided Polyimide Tape | Kapton Tape | PPTDE-1/4 | ¼” x 36 yds. |
| EP21LVMed – low viscosity, two component epoxy compound | Masterbond | EP21LVMed | Meets USP Class VI certification, Passes ISO 10993-5 for cytotoxicity |
| Epilog Fusion Pro 48 Laser Machine | Epilog | N/A | CO2 laser |
| Foam tape | XFasten | N/A | 1/8" Thick |
| Gamry Interface 1010E Potentiostat | Gamry | 992-00129 | |
| High precision 45° curved tapered very fine point tweezers/forceps | Fisher Scientific | 12-000-131 | |
| Lab tape | Fisher Scientific | 15-901-10L | |
| Mn(III)tetrakis (4-benzoic acid) porphyrin (MnTBAP) | EMD Millipore | 475870-25MG | Solid, stored at -20 °C |
| N-Hydroxysulfosuccinimide sodium salt, ≥98% (HPLC) | Sigma-Aldrich | 56485-250MG | Solid, stored desiccated at 4°C |
| Platinum clad niobium mesh anode | Technic | N/A | Clad with 125μ” of platinum on one side, framed in titanium with (1) 1” x 6” titanium strap centered on one 6” dimension |
| Silicon Planar Microelectrode Array, 16 Channel | NeuroNexus | A1x16-3mm-100-177-CM16LP | Electrode site material is iridium, shank thickness is 15 μm |
| Silicon Wafer | University Wafer | 1575 | Diameter 100 mm, p-type, boron-doped, 100 oriented, resistivity 0.01-0.02 Ohm-cm, thickness 525 um, single side polished, prime grade |
| Silver/silver Chloride reference electrode | Gamry Instruments | 930-00015 | |
| Solidworks | N/A | ||
| Stainless Steel Phillips Flat Head Screws | McMaster Carr | 96877A629 | #8-32, 1 1/2", fully threaded |
| Type I deionized water | ChemWorld | CW-DI1-20 | |
| Ultimaker 3 3D printer | Ultimaker | N/A | |
| Ultimaker Cura | Ultimaker | N/A | 3D printing software |
| Ultimaker NFC ABS Filament | Dynamism, Inc. | 1621 | 2.85 mm |
| Ultimaker NFC PLA Filament | Dynamism, Inc. | 1609 | 2.85 mm |
| Vacuum Gauge Vacuum Gauge | Measureman Direct | N/A | Glycerin Filled, 2-1/2” Dial Size, ¼”NPT, -30” Hg/-100kpa-0 |
| Wing nuts | Everbilt | 934917 | #8-32, zinc plated |
Referencias
- Donoghue, J. Bridging the brain to the world: A perspective on neural interface systems. Neuron. 60 (3), 511-521 (2008).
- Ajiboye, A. B., et al. Restoration of reaching and grasping movements through brain-controlled muscle stimulation in a person with tetraplegia: a proof-of-concept demonstration. The Lancet. 398 (10081), 1821-1830 (2017).
- Ereifej, E. S., et al. Neural engineering: the process, applications, and its role in the future of medicine. Journal of Neural Engineering. 16 (6), 063002 (2019).
- Nicolas-Alonso, L. F., Gomez-Gil, J. Brain computer interfaces, a review. Sensors (Basel). 12 (2), 1211-1279 (2012).
- Leuthardt, E. C., Schalk, G., Moran, D., Ojemann, J. G. The emerging world of motor neuroprosthetics: a neurosurgical perspective. Neurosurgery. 59 (1), 1-14 (2006).
- Barrese, J. C., et al. Failure mode analysis of silicon-based intracortical microelectrode arrays in non-human primates. Journal of Neural Engineering. 10 (6), 066014 (2013).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Prasad, A., et al. Comprehensive characterization and failure modes of tungsten microwire arrays in chronic neural implants. Journal of Neural Engineering. 9 (5), 056015 (2012).
- Hermann, J. K., Capadona, J. R. Understanding the role of innate immunity in the response to intracortical microelectrodes. Critical Reviews in Biomedical Engineering. 46 (4), 341-367 (2018).
- Ravikumar, M., et al. The roles of blood-derived macrophages and resident microglia in the neuroinflammatory response to implanted intracortical microelectrodes. Biomaterials. 35 (28), 8049-8064 (2014).
- Sawyer, A. J., et al. The effect of inflammatory cell-derived MCP-1 loss on neuronal survival during chronic neuroinflammation. Biomaterials. 35 (25), 6698-6706 (2014).
- Prasad, A., Sanchez, J. C. Quantifying long-term microelectrode array functionality using chronic in vivo impedance testing. Journal of Neural Engineering. 9 (2), 026028 (2012).
- Salatino, J. W., Ludwig, K. A., Kozai, T. D. Y., Purcell, E. K. Glial responses to implanted electrodes in the brain. Nature Biomedical Engineering. 1 (11), 862-877 (2017).
- McConnell, G. C., et al. Implanted neural electrodes cause chronic, local inflammation that is correlated with local neurodegeneration. Journal of Neural Engineering. 6 (5), 056003 (2009).
- Rennaker, R. L., Miller, J., Tang, H., Wilson, D. A. Minocycline increases quality and longevity of chronic neural recordings. Journal of Neural Engineering. 4 (2), 1-5 (2007).
- Carnicer-Lombarte, A., Chen, S. T., Malliaras, G. G., Barone, D. G. Foreign body reaction to implanted biomaterials and its impact in nerve neuroprosthetics. Frontiers in Bioengineering and Biotechnology. 9, 622524 (2021).
- Roitbak, T., Sykova, E. Diffusion barriers evoked in the rat cortex by reactive astrogliosis. Glia. 28 (1), 40-48 (1999).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Cui, X., Martin, D. C. Electrochemical deposition and characterization of poly(3,4-ethylenedioxythiophene) on neural microelectrode arrays. Sensors and Actuators B: Chemical. 89 (1), 92-102 (2003).
- Ludwig, K. A., Uram, J. D., Yang, J., Martin, D. C., Kipke, D. R. Chronic neural recordings using silicon microelectrode arrays electrochemically deposited with a poly(3,4-ethylenedioxythiophene) (PEDOT) film. Journal of Neural Engineering. 3 (1), 59-70 (2006).
- Keefer, E. W., Botterman, B. R., Romero, M. I., Rossi, A. F., Gross, G. W. Carbon nanotube coating improves neuronal recordings. Nature Nanotechnology. 3 (7), 434-439 (2008).
- Kim, D. -. H., Wiler, J. A., Anderson, D. J., Kipke, D. R., Martin, D. C. Conducting polymers on hydrogel-coated neural electrode provide sensitive neural recordings in auditory cortex. Acta Biomaterialia. 6 (1), 57-62 (2010).
- He, W., McConnell, G. C., Bellamkonda, R. V. Nanoscale laminin coating modulates cortical scarring response around implanted silicon microelectrode arrays. Journal of Neural Engineering. 3 (4), 316-326 (2006).
- Azemi, E., Lagenaur, C. F., Cui, X. T. The surface immobilization of the neural adhesion molecule L1 on neural probes and its effect on neuronal density and gliosis at the probe/tissue interface. Biomaterials. 32 (3), 681-692 (2011).
- Zhong, Y., Bellamkonda, R. V. Controlled release of anti-inflammatory agent alpha-MSH from neural implants. Journal of Controlled Release. 106 (3), 309-318 (2005).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Bedell, H. W., et al. Understanding the effects of both CD14-meditated innate immunity and device/tissue mechanical mismatch in the neuroinflammatory response to intracortical microelectrodes. Frontiers in Neuroscience. 12, 772 (2018).
- Nguyen, J. K., et al. Influence of resveratrol release on the tissue response to mechanically adaptive cortical implants. Acta Biomaterialia. 29, 81-93 (2016).
- Sridharan, A., Nguyen, J. K., Capadona, J. R., Muthuswamy, J. Compliant intracortical implants reduce strains and strain rates in brain tissue in vivo. Journal of Neural Engineering. 12 (3), 036002 (2015).
- Nguyen, J. K., et al. Mechanically-compliant intracortical implants reduce the neuroinflammatory response. Journal of Neural Engineering. 11, 056014 (2014).
- Harris, J. P., et al. In vivo deployment of mechanically adaptive nanocomposites for intracortical microelectrodes. Journal of Neural Engineering. 8 (4), 046010 (2011).
- Shoffstall, A. J., et al. Characterization of the neuroinflammatory response to Thiol-ene/Acrylate shape memory polymer coated intracortical microelectrodes. Micromachines. 10, 486 (2018).
- Simon, D. M., et al. Design and demonstration of an intracortical probe technology with tunable modulus. Journal of Biomedical Materials Research. Part A. 105 (1), 159-168 (2017).
- Ravikumar, M., et al. The effect of residual endotoxin contamination on the neuroinflammatory response to sterilized intracortical microelectrodes. Journal of Materials Chemistry. B. 2 (17), 2517-2529 (2014).
- Ecker, M., et al. Sterilization of thiol-ene/acrylate based shape memory polymers for biomedical applications. Macromolecular Materials and Engineering. 302 (2), 160331 (2017).
- Ereifej, E. S., et al. Implantation of neural probes in the brain elicits oxidative stress. Frontiers in Bioengineering and Biotechnology. 6 (9), 1-12 (2018).
- Potter, K. A., et al. The effect of resveratrol on neurodegeneration and blood brain barrier stability surrounding intracortical microelectrodes. Biomaterials. 34 (29), 7001-7015 (2013).
- Potter, K. A., et al. Curcumin-releasing mechanically adaptive intracortical implants improve the proximal neuronal density and blood-brain barrier stability. Acta Biomaterialia. 10 (5), 2209-2222 (2014).
- Potter-Baker, K. A., Capadona, J. R. Reducing the "stress": Antioxidative therapeutic and material approaches may prevent intracortical microelectrode failure. ACS Macro Letters. 4 (3), 275-279 (2015).
- Potter-Baker, K. A., et al. Development of superoxide dismutase mimetic surfaces to reduce accumulation of reactive oxygen species for neural interfacing applications. Journal of Materials Chemistry B. 2 (16), 2248-2258 (2014).
- Potter-Baker, K. A., et al. Implications of chronic daily antioxidant administration on the inflammatory response to intracortical microelectrodes. Journal of Neural Engineering. 12 (4), 046002 (2015).
- Kim, Y., et al. Ventricular delivery of resveratrol improves microelectrode recording performance and reduces oxidative stress. Micromachines. 12, 1446 (2021).
- Deku, F., et al. Amorphous silicon carbide ultramicroelectrode arrays for neural stimulation and recording. Journal of Neural Engineering. 15 (1), 016007 (2018).
- Ereifej, E. S., et al. The neuroinflammatory response to nanopatterning parallel grooves into the surface structure of intracortical microelectrodes. Advanced Functional Materials. 28 (12), 1704420 (2018).
- Kim, Y., et al. Nano-architectural approaches for improved intracortical interface technologies. Frontiers in Neuroscience. 12, 456 (2018).
- Mahajan, S., et al. Towards standardization of electrophysiology and computational tissue strain in rodent intracortical microelectrode models. Frontiers in Bioengineering and Biotechnology. 8, 416 (2020).
- Suresh, M. V., et al. The protective role of MnTBAP in oxidant-mediated injury and inflammation in a rat model of lung contusion. Surgery. 154 (5), 980-990 (2013).
- Liu, D., Shan, Y., Valluru, L., Bao, F. Mn (III) tetrakis (4-benzoic acid) porphyrin scavenges reactive species, reduces oxidative stress, and improves functional recovery after experimental spinal cord injury in rats: comparison with methylprednisolone. BMC Neuroscience. 14 (1), 23 (2013).
- Munief, W. M., et al. Silane deposition via gas-phase evaporation and high-resolution surface characterization of the ultrathin siloxane coatings. Langmuir. 34 (35), 10217-10229 (2018).
- Hoogerwerf, A. C., Wise, K. D. A three-dimensional microelectrode array for chronic neural recording. IEEE Transactions on Biomedical Engineering. 41 (12), 1136-1146 (1994).
- Staros, J. V., Wright, R. W., Swingle, D. M. Enhancement by N-hydroxysulfosuccinimide of water-soluble carbodiimide-mediated coupling reactions. Analalytical Biochemistry. 156 (1), 220-222 (1986).
- Yuan, X., Wolf, N., Mayer, D., Offenhausser, A., Wordenweber, R. Vapor-phase deposition and electronic characterization of 3-Aminopropyltriethoxysilane self-assembled monolayers on silicon dioxide. Langmuir. 35 (25), 8183-8190 (2019).
- Montgomery, D. C. . Design and Analysis of Experiments. Eighth edition. , (2013).
- Shoffstall, A. J., Capadona, J. R. Bio-inspired materials and systems for neural interfacing. Current Opinions in Biomedical Engineering. 6, 110-119 (2018).
- Skousen, J. L., Tresco, P. A. . Neuroprosthetics. Theory and Practice 2nd Edition. , 259-299 (2017).
- Michelson, N. J., et al. multi-modal analysis uncovers complex relationship at the brain tissue-implant neural interface: new emphasis on the biological interface. Journal of Neural Engineering. 15 (3), 033001 (2018).
- Hofmann, U. G., Capadona, J. R. Editorial: Bridging the gap in neuroelectronic interfaces. Frontiers in Neuroscience. 14, 457 (2020).
- Usoro, J., Sturgill, B., Musselman, K., Capadona, J. R., Pancrazio, J. J. On the definition of 'chronic' for intracortical microelectrode array applications. Micromachines. 12 (8), 972 (2021).
- Thompson, C. H., Saxena, A., Heelan, N., Salatino, J., Purcell, E. K. Spatiotemporal patterns of gene expression around implanted silicon electrode arrays. Journal of Neural Engineering. 18 (4), 1741 (2021).
- Golabchi, A., Woeppel, K. M., Li, X., Lagenaur, C. F., Cui, X. T. Neuroadhesive protein coating improves the chronic performance of neuroelectronics in mouse brain. Biosensors and Bioelectronics. 155, 112096 (2020).
- Zheng, X. S., et al. A superoxide scavenging coating for improving tissue response to neural implants. Acta Biomaterialia. 99, 72-83 (2019).
- Lee, H. C., et al. Foreign body response to intracortical microelectrodes is not altered with dip-coating of Polyethylene Glycol (PEG). Frontiers in Neuroscience. 11, 513 (2017).
- Boehler, C., et al. Actively controlled release of Dexamethasone from neural microelectrodes in a chronic in vivo study. Biomaterials. 129, 176-187 (2017).
- Hess, A. E., et al. Development of a stimuli-responsive polymer nanocomposite toward biologically optimized, MEMS-based neural probes. Journal of Micromechanics and Microengineering. 21 (5), 054009 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados