A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
أدوات للمعالجة السطحية للأقطاب الكهربائية الدقيقة داخل قشرة السيليكون المستوية
In This Article
Summary
يصف هذا البروتوكول أدوات للتعامل مع الأقطاب الكهربائية الدقيقة داخل القشرة المستوية من السيليكون أثناء معالجات تعديل السطح عن طريق ترسب الغاز وتفاعلات المحلول المائي. يتم شرح تجميع المكونات المستخدمة للتعامل مع الأجهزة طوال الإجراء بالتفصيل.
Abstract
الأقطاب الكهربائية الدقيقة داخل القشرة تحمل إمكانات علاجية كبيرة. لكنهم يواجهون تحديا مع انخفاض كبير في الأداء بعد فترات زرع متواضعة. أحد المساهمين الرئيسيين في الانخفاض الملحوظ هو الضرر الذي يلحق بالأنسجة العصبية القريبة من الزرع والاستجابة العصبية الالتهابية اللاحقة. تشمل الجهود المبذولة لتحسين طول عمر الجهاز التعديلات الكيميائية أو تطبيقات الطلاء على سطح الجهاز لتحسين استجابة الأنسجة. عادة ما يتم الانتهاء من تطوير مثل هذه المعالجات السطحية باستخدام مجسات "وهمية" غير وظيفية تفتقر إلى المكونات الكهربائية اللازمة للتطبيق المقصود. تتطلب الترجمة إلى الأجهزة الوظيفية مزيدا من الاعتبار نظرا لهشاشة صفائف الأقطاب الكهربائية الدقيقة داخل القشرة. تسهل أدوات المناولة إلى حد كبير المعالجات السطحية للأجهزة المجمعة ، خاصة بالنسبة للتعديلات التي تتطلب أوقاتا إجرائية طويلة. تستخدم أدوات المناولة الموضحة هنا للمعالجات السطحية المطبقة عن طريق ترسيب الطور الغازي والتعرض للمحلول المائي. يتم إجراء توصيف الطلاء باستخدام قياس القطع الناقص والتحليل الطيفي للإلكترون الضوئي بالأشعة السينية. أكدت مقارنة تسجيلات التحليل الطيفي للمعاوقة الكهربائية قبل وبعد إجراء الطلاء على الأجهزة الوظيفية سلامة الجهاز بعد التعديل. يمكن تكييف الأدوات الموصوفة بسهولة مع أجهزة الأقطاب الكهربائية البديلة وطرق المعالجة التي تحافظ على التوافق الكيميائي.
Introduction
تهدف الأجهزة العصبية الاصطناعية إلى استعادة القدرات الحسية والحركية الضعيفة أو الغائبة في مجموعة واسعة من المرضى ، بما في ذلك أولئك الذين يعانون من إصابة الحبل الشوكي ، والتصلب الجانبي الضموري (ALS) ، والشلل الدماغي ، والبتر1،2،3. يمكن للأقطاب الكهربائية الدقيقة داخل القشرة (IMEs) إنشاء مسار اتصال بين الخلايا العصبية القشرية والأجهزة المستخدمة للتحكم في الأطراف الاصطناعية العصبية. ميزة مميزة للأقطاب الكهربائية الدقيقة داخل القشرة هي قدرتها على تسجيل الإشارات العصبية بدقة مكانية وزمنية عالية ، والتي تفضل لمعالجة الإشارات اللاحقة والتحكم في واجهات الدماغ والكمبيوتر 4,5. لسوء الحظ ، فإن أداء الأقطاب الكهربائية الدقيقة داخل القشرة الدماغية ينخفض بشكل كبير في غضون أشهر إلى سنة بعد الزرع2،6،7،8. يؤثر فقدان جودة الإشارة واستقرارها سلبا على تطبيق التكنولوجيا.
أحد المساهمين الرئيسيين في انخفاض الأداء الملحوظ هو الاستجابة الحيوية لتلف الأنسجة المرتبط بالزرع والالتهاب العصبي المزمن9،10،11. زرع IMEs يلحق الضرر بأنسجة المخ ، مما يؤدي إلى إطلاق جزيئات الإشارات التي تبدأ سلسلة من عمليات الدفاع الخلوي الرجعية. يؤدي التفاعل المزمن إلى تفاقم استجابة الجسم الغريب ، مما يؤدي إلى التهاب عصبي مستمر يتلف الأنسجة القريبة من الجهاز ؛ غالبا ما يتم التعرف عليها كأعراض التهاب عصبي ، وندوب ، وتنكس عصبي موضعي يساهم في انخفاض تسجيل جودة الإشارة12،13،14،15. تتألف الندبة التي تغلف القطب الكهربائي من تكتل كثيف من الخلايا النجمية مع الخلايا الدبقية الصغيرة المنشطة والبلاعم المدربة ، وتخلق بيئة محلية غير مواتية مع انخفاض نقل المواد والتراكم المحلي للعوامل الالتهابية 16،15،16،17،18.
وصفت العديد من الدراسات استجابة الدماغ للأقطاب الكهربائية الدقيقة داخل القشرة أو النهج للتخفيف من الاستجابة7. وقد تضمن البحث والتطوير لتحسين استجابة الأنسجة مجموعة من الاستراتيجيات، بما في ذلك التعديلات على الهيكل العام، وطوبولوجيا السطح، والمواد، وتطبيق الطلاء. تهدف هذه الجهود إلى تقليل الضرر الناجم عن حدث الزرع ، أو إدخال واجهة أكثر ملاءمة بين الجهاز والخلايا القريبة ، أو تقليل إجهاد الأنسجة بعد زرع الأجهزة7. أدت الطرق التي تستهدف الاستجابة البيولوجية المزمنة على وجه التحديد إلى العديد من الطلاءات النشطة بيولوجيا التي تهدف إلى تحقيق الاستقرار في موقع الزرع وتعزيز صحة الخلايا كيميائيا. وتشمل الأمثلة البوليمرات الموصلة مثل بولي (إيثيلين ديوكسي ثيوفين) (PEDOT) 19،20 ، وأنابيب الكربون النانوية 21 ، والمواد الهلامية المائية22 ، وإضافة جزيئات وأدوية نشطة بيولوجيا لاستهداف عمليات خلوية محددة23،24،25. استكشفت مجموعتنا البحثية ، على وجه الخصوص ، العديد من الآليات لتعزيز الحد من الاستجابة الالتهابية للأقطاب الكهربائية الدقيقة المزروعة بما في ذلك ، على سبيل المثال لا الحصر ، تقليل الصدمة المرتبطة بزرع الجهاز26 ، وتقليل عدم تطابق تصلب الجهاز / الأنسجة27،28،29،30،31،32،33 ، وتحسين التعقيم الإجراءات34,35 ، والحد من الإجهاد / الضرر التأكسدي 28,36,37,38,39,40,41,42 ، واستكشاف مواد القطب الكهربائي البديلة 43 ، ومحاكاة البنية النانوية للمصفوفة الطبيعية خارج الخلية 44,45,46 . الاهتمام الأخير هو تطوير طلاءات السطح المحاكاة الحيوية للتخفيف من الاستجابة العصبية الالتهابية في واجهة الأنسجة microelectrode مباشرة39.
يوفر تعديل الواجهة فائدة فريدة تتمثل في استهداف الجرح والأنسجة القريبة اللازمة لتسجيل الإشارة مباشرة. يمكن للعلاج السطحي الذي يعزز الشفاء دون تفاقم الاستجابة المناعية أن يفيد مدى حياة التسجيل الجيد ويزيل القيود في تحقيق الإمكانات العلاجية والبحثية للأقطاب الكهربائية الدقيقة داخل القشرة. يفصل العمل المقدم طرق تطبيق المعالجات السطحية على صفائف الأقطاب الكهربائية الدقيقة التي تتطلب أوقات تفاعل ممتدة مع استيعاب هشاشة الأجهزة. تهدف التقنية المقدمة إلى مشاركة طرق تعديل السطح مع الأجهزة الوظيفية حيث لا يمكن التعامل مع الجهاز طوال تطبيق المعالجة. يتم تقديم الأدوات للتعامل مع تحقيقات وهمية غير وظيفية ومصفوفات الأقطاب الكهربائية المستوية المستوية من السيليكون.
يسمح النهج المقدم لتعديل سطح القطب الكهربائي بالتعليق الآمن للمجسات الوهمية غير الوظيفية أو صفائف الأقطاب الكهربائية المستوية المصنوعة من السيليكون الوظيفي لترسيب الطور الغازي والتفاعل مع المحاليل المائية. يتم استخدام العديد من القطع المطبوعة ثلاثية الأبعاد للتعامل مع هذه الأجهزة الهشة (الشكل 1 والشكل 2). يتم تقديم مثال على إجراء يستخدم كل من خطوات مرحلة الغاز والمحلول لتعديل السطح باستخدام طلاء مضاد للأكسدة ينطوي على تجميد Mn(III)tetrakis (4-benzoic acid) porphyrin (MnTBAP). MnTBAP هو ميتالوبورفيرين اصطناعي يمتلك خصائص مضادة للأكسدة مع وساطة مثبتة للالتهابات47,48. المثال المقدم على صفائف قطب السيليكون المستوي الوظيفي يتحقق من صحة تحديث لبروتوكول تم الإبلاغ عنه مسبقا للأجهزة غير الوظيفية40. يدعم تكييف تقنية ترسيب الطور الغازي من Munief et al. توافق البروتوكول مع الأقطاب الكهربائية الوظيفية49. ويستخدم ترسيب الطور الغازي لإضفاء الطابع الوظيفي على السطح استعدادا للتفاعل المائي الذي ينطوي على كيمياء الوصلة المتقاطعة للكاربوديميد لشل حركة MnTBAP النشطة. يتم توفير منهجية المناولة التي تم تطويرها هنا كمنصة يمكن تعديلها لاستيعاب الطلاء الأخرى والأجهزة المماثلة.
يوضح البروتوكول النهج باستخدام مجسات وهمية غير وظيفية تتكون من ساق سيليكون وعلامة تبويب مطبوعة 3D بأبعاد مماثلة لمصفوفات أقطاب السيليكون المستوية الوظيفية. تعتبر عبوة الموصل الخاصة بالجهاز مماثلة لعلامة التبويب المطبوعة 3D الخاصة بمسبار الدمية غير الوظيفي في التعليمات المقدمة.
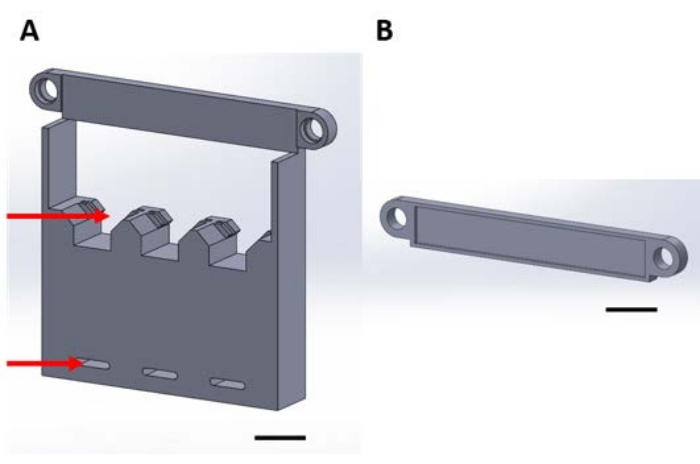
الشكل 1: القطع المطبوعة ثلاثية الأبعاد للتعامل مع الأجهزة الوظيفية أثناء ترسيب الطور الغازي في مجفف فراغ. (أ) تتضمن قاعدة الهيكل حاملات لمربعات السيليكون النموذجية مقاس 1 سم × 1 سم (السهم العلوي) وثقوب للتأمين إلى لوحة التجفيف (السهم السفلي). (ب) تستخدم اللوحة لتأمين تعليق الأجهزة. من هنا فصاعدا ، سيتم الإشارة إلى كل قطعة في هذا الشكل إما بالقطعة 1A أو 1B. شريط المقياس = 1 سم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
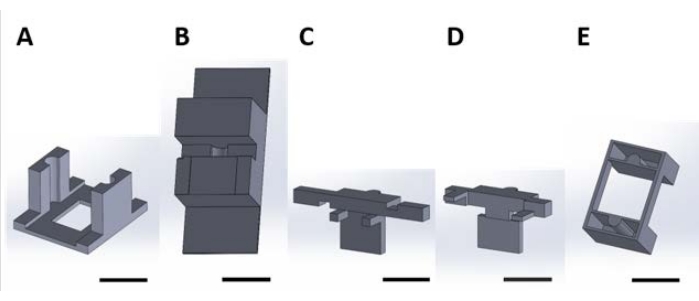
الشكل 2: القطع المطبوعة ثلاثية الأبعاد للتعامل مع الأجهزة الوظيفية للتفاعل السطحي الذي يحدث في المحلول المائي. (أ) قطعة الدليل المراد لصقها على غطاء لوحة الثقافة. (ب) قطع الطاولة المستخدمة لتثبيت القطع (C) و (D) أثناء التجميع. (C) و (D) يؤمنان معا تعليق الأجهزة لوضعها في لوحة البئر ، و (E) يثبتان القطع (C) و (D) على غطاء لوحة البئر. من هنا فصاعدا ، سيشار إلى القطع الفردية في كل لوحة من هذا الشكل على أنها أرقام القطع المقابلة لرقم لوحة هذا الرقم. شريط المقياس = 1 سم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
يتم توفير جميع ملفات الترميز للطباعة ثلاثية الأبعاد في ملفات الترميز التكميلية 1-16. يتم وصف التحليل المقدم في النتائج التمثيلية باستخدام صفائف قطب السيليكون المستوي الوظيفية المكتسبة تجاريا (انظر جدول المواد).
1. التعامل مع التجمع لترسيب الطور الغازي في مجفف فراغ
ملاحظة: يوضح الشكل 3 الجهاز المجمع لمناولة الأجهزة والاحتفاظ بها أثناء ترسيب الطور الغازي. تصف الخطوات 1.1-1.8 الإجراء المطلوب لوضع الأجهزة في الجهاز للترسب (الشكل 4A).

الشكل 3: تجميع القطع المطبوعة ثلاثية الأبعاد للتعامل مع الأجهزة الوظيفية أثناء ترسيب الطور الغازي. يتم تصوير التجميع بدون عينات ليتم طلاؤها. تستخدم البراغي والمكسرات المجنحة لربط القطع 1A و 2B معا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: صورة تجميع ووضع العينات المراد طلاؤها. يصف هذا المخطط التعامل مع الأجهزة الوظيفية أثناء ترسيب الطور الغازي المضمون داخل مجفف فراغ. (أ) شريط بوليميد على الوجهين يوضع على القطعة 1A وشريط رغوي يوضع على 1B. (B) أجهزة مثبتة على الشريط. (ج) تستخدم البراغي وصواميل الجناح لربط القطع من 1B إلى 1A ، ويتم توصيل التجميع بصينية المجفف باستخدام روابط كابل الرمز البريدي (الأسهم الحمراء). (D) يتم وضع عينات مربعة من السيليكون مقاس 1 سم × 1 سم في حاملات كل منها. (ه) يتم وضع طبق وزن الألومنيوم ومقياس الضغط في المجفف في الاتجاه الموضح. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- للمعالجة السطحية ، احصل على عينات مربعة بحجم 1 سم × 1 سم من مواد الركيزة الخاصة بالأجهزة.
- بالنسبة لعينات السيليكون (المحددة لهذا البروتوكول) ، قم بقطع رقاقة السيليكون إلى مربعات 1 سم × 1 سم باستخدام آلة تقطيع الرقائق (انظر جدول المواد).
- طباعة أو اقتناء القطع 1A (الشكل 1A ، ملف الترميز التكميلي 1 ، ملف الترميز التكميلي 2) و 1B (الشكل 1B ، ملف الترميز التكميلي 3 ، ملف الترميز التكميلي 4).
- قم بتوصيل شريط البوليميد على الوجهين بالقطعة 1A وقم بتوصيل شريط رغوة سميك 1/8 بوصة مع مادة لاصقة من جانب واحد بالقطعة 1B.
- قم بلصق عبوة الموصل الخاصة بالجهاز بالشريط الموجود على القطعة 1A.
ملاحظة: الاتجاه المثالي للموصل على الشريط سيترك الساق معلقة فوق الحافة، كما هو موضح في الشكل 4B. - قم بتأمين القطعة 1A والقطعة 1B معا (الشكل 4C). قم بمحاذاة الثقوب وتأمينها باستخدام مسامير الفولاذ المقاوم للصدأ وصواميل الأجنحة (انظر جدول المواد).
- باستخدام روابط سحابية، اربط التجميع بصينية التجفيف الفراغي باستخدام الثقوب الموجودة في الجزء السفلي من القطعة 1A كما هو موضح في الشكل 4C.
- إذا كان ذلك ممكنا ، ضع عينات من المواد المربعة في الشقوق الموجودة أسفل الإطار (الشكل 4D). هنا ، يتم استخدام عينات مكعبات رقاقة السيليكون المربعة 1 سم × 1 سم كمثال.
ملاحظة: ستحتاج المادة الدقيقة إلى مطابقة ركيزة الجهاز المعالج ، والتي ستختلف حسب الجهاز. - أكمل ترسيب الطور الغازي عن طريق وضع المحلول في وعاء مناسب داخل المجفف الفراغي المقابل وتمشيا مع المجموعة الآمنة.
ملاحظة: تم استخدام أطباق وزن الألومنيوم كأوعية لترسيب ثلاثي إيثوكسي سيلان (3-Aminopropyl) (APTES) ، كمثال هنا.- ضع مقياسا فراغيا (انظر جدول المواد) داخل المجفف لتسجيل الضغط الدقيق. ضع منفذ غطاء المجفف بالقرب من المجموعة الآمنة وبما يتماشى مع الحل (الشكل 4E).
ملاحظة: يرد وصف لمزيد من التفاصيل بشأن هذه الطريقة لترسيب الطور الغازي في المرجع49 المنشور سابقا.
- ضع مقياسا فراغيا (انظر جدول المواد) داخل المجفف لتسجيل الضغط الدقيق. ضع منفذ غطاء المجفف بالقرب من المجموعة الآمنة وبما يتماشى مع الحل (الشكل 4E).
2. التعامل مع التجميع للتفاعل السطحي عبر محلول مائي
ملاحظة: توضح الأشكال 5-7 المكونات والأجهزة المجمعة لمناولة الأجهزة والاحتفاظ بها أثناء ترسيب الطور المائي والمعالجة السطحية. ستفصل الخطوات التالية الإجراء المطلوب لوضع الأجهزة في الجهاز للترسب والعلاج.

الشكل 5: تجميع القطع المطبوعة ثلاثية الأبعاد للتعامل مع الأجهزة الوظيفية للتفاعل السطحي الذي يحدث في محلول مائي . (أ) قطعة دليل ليتم لصقها على غطاء لوحة الثقافة. (ب) تم استخدام قطعة الطاولة لتثبيت القطع (C) و (D) أثناء التجميع. (C) و (D) معا تأمين تعليق الأجهزة لوضعها في لوحة البئر. (E) يثبت القطع (C) و (D) على غطاء لوحة البئر. تم وضع شريط بوليميد على الوجهين على الجزء السفلي من (C) ، وتم وضع شريط رغوي على الجزء السفلي من (D) (كلاهما معبأ باللون الأحمر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: غطاء لوحة زراعة الخلايا المصنوع من 6 أدلة (القطعة 2A). يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 7: تسلسل لتأمين وتحميل المجسات لتفاعل الحل. تم تغيير لون الأجزاء في هذا الشكل للوضوح داخل الصورة. هذه هي نفس الأجزاء مثل الشكل 5 والشكل 6. (أ) يتم وضع القطعة 2C في القطعة 2B ، ويتم تأمين الجهاز إلى الجزء المسجل من 2C. (B) تتناسب القطعة 2D مع القطعة 2C لإنشاء مجموعة تعلق ساق الجهاز. (ج) يتم وضع تجميع 2C و 2D والجهاز بعناية على غطاء لوحة البئر باستخدام الدليل. (D) تتناسب القطعة 2E أعلى المجموعة لزيادة تأمين الغطاء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- قم ببناء غطاء للوحة البئر لتعليق مصفوفة القطب الكهربائي للجهاز في المحلول (الشكل 6). يصف هذا البروتوكول استخدام لوحة من 24 بئرا.
- قطع ثقوب مستطيلة 19 مم × 10.5 مم في غطاء لوحة البئر باستخدام قاطع ليزر أو يدويا باستخدام قاطع صندوق. قم بمطابقة عدد الثقوب مع عدد الأجهزة المطلوبة للعلاج.
ملاحظة: لسهولة التجميع، يوصى بمعالجة ستة أجهزة لكل صفيحة بئر، أو على الأقل، وضع ثقوب فوق الآبار غير المجاورة (الشكل 6). - طباعة أو الحصول على العدد المناسب من الأدلة (القطعة 2A (الشكل 2A) ، ملف الترميز التكميلي 5 ، ملف الترميز التكميلي 6).
- استخدم لاصق سيانو أكريليت لتأمين الأدلة على الغطاء. قم بمحاذاة الثقوب المستطيلة في الأدلة والأغطية أثناء لصقها لضمان عدم إعاقة الثقب المستطيل للدليل، كما هو موضح في الشكل 6.
- قطع ثقوب مستطيلة 19 مم × 10.5 مم في غطاء لوحة البئر باستخدام قاطع ليزر أو يدويا باستخدام قاطع صندوق. قم بمطابقة عدد الثقوب مع عدد الأجهزة المطلوبة للعلاج.
- املأ لوحة البئر بالمحلول المطلوب في المواقع التي سيحدث فيها العلاج. على سبيل المثال ، يشمل الحل EDC و Sulfo-NHS (انظر جدول المواد) في المخزن المؤقت MES.
ملاحظة: يعتمد حجم المحلول على أبعاد جهاز القطب الكهربائي. بالنسبة لصفائف الأقطاب الكهربائية الدقيقة على غرار ميشيغان (انظر جدول المواد) مع موصلات منخفضة المستوى تبلغ 8.6 مم وطول ساق يبلغ 3 مم ، هناك إزالة ~ 9 مم50. سيسمح استخدام 2 مل من المحلول بغمر ساق الجهاز بالكامل مع الحفاظ على ما تبقى من الجهاز خارج محلول التفاعل.- إذا تم استخدام عينات الركيزة لتأكيد المعالجة السطحية ، فضع عينات من المواد المربعة في بئر من اللوحة واغمرها في محلول التفاعل.
- قم بتعليق الأجهزة بشكل آمن (انظر جدول المواد) في لوحة بئر. يظهر التسلسل في الشكل 7.
- قطعة الشريط 2B (الشكل 2B ، ملف الترميز التكميلي 7 ، ملف الترميز التكميلي 8) إلى سطح الطاولة (الشكل 7A).
- ضع شريط بوليميد على الوجهين لتغطية قاعدة القطعة 2C (الشكل 2C ، ملف الترميز التكميلي 9 ، ملف الترميز التكميلي 10).
- ضع شريط رغوة مقاس 1/8 بوصة مع مادة لاصقة أحادية الجانب لتغطية قاعدة القطعة 2D (الشكل 2D ، ملف الترميز التكميلي 11 ، ملف الترميز التكميلي 12).
- ضع القطعة 2C في أخدود القطعة 2B (الشكل 7A).
- قم بلصق عبوة الموصل الخاصة بالجهاز على الشريط ، موجهة ، بحيث يتم تعليق طول ساق الجهاز (الشكل 7B).
- قم بتأمين الجهاز عن طريق تحريك القطعة 2D (الموضحة باللون البرتقالي في الشكل 7) إلى قطعة 2C. يقوم هذا التجميع بتأمين الجهاز بشكل فعال بين قطع الأدوات (الشكل 7B).
- عقد حواف التجميع ، ورفع بعناية لإزالتها من القطعة 2A.
- قم بتركيب المجموعة في الغطاء عن طريق محاذاة أنصاف الدوائر المواجهة للخارج على القطع 2C و 2D مع الأدلة المقابلة على القطعة 2A (الموضحة باللون الأخضر في الشكل 7C).
- وضع التجميع الآمن بواسطة القطعة 2E (الشكل 2E) فوق الأدلة (كما هو موضح باللون الأخضر في الشكل 7D ، ملف الترميز التكميلي 13 ، ملف الترميز التكميلي 14).
- بالنسبة للتفاعلات التي تستفيد من الخلط المستمر للمحلول ، قم بتحريك لوحة البئر. انقل لوحة البئر المجمعة إلى طاولة اهتزاز واركض بسرعات أقل من 100 دورة في الدقيقة.
- إذا رغبت في تفاعلات متعددة قائمة على المحلول أو خطوات غسيل ، فقم بنقل الغطاء بعناية إلى صفيحة بئر جديدة مع توزيع المحلول (المحلولات) المطلوبة على الآبار المناسبة.
ملاحظة: الخطوة 2.4 اختيارية. - قم بإزالة الأجهزة من لوحة البئر.
- قطعة الشريط 2B إلى سطح الطاولة.
- أزل القطعة 2E من الغطاء.
- قم بإزالة المجموعة التي تحمل الجهاز بعناية من لوحة البئر.
- قم بتوجيه التجميع ، بحيث تواجه القطعة 2C سطح الطاولة وتواجه القطعة 2D لأعلى. يجب أن يكون ساق الجهاز موازيا لسطح الطاولة. قم بتركيب القطعة 2C من التجميع في القطعة 2B كما تم الانتهاء منها سابقا (الخطوة 2.3.4) عند تركيب التجميع معا.
- افصل القطعة 2D عن القطعة 2C عن طريق سحبها بعناية. ضع ضغطا طفيفا على علامات تبويب القطعة 2C في المقعد لتوفير الاستقرار لهذه المهمة.
ملاحظة: علامات التبويب 2C أطول من علامات التبويب 2D لتسهيل هذا المعالجة. - استخدم الملقط للتمسك بعبوة موصل الجهاز لإزالته من الشريط ونقل الجهاز إلى حاوية التخزين المطلوبة.
النتائج
لإثبات استخدام مكونات المناولة ، تم تنفيذ المنهجية الموصوفة لتكييف تجميد وسيط مؤكسد مع السيليكون المنشط. تم تصميم تطبيق هذه الكيمياء على IMEs للحد من الإجهاد التأكسدي من قبل Potter-Baker et al. وتم إثباته في تحقيقات وهمية السيليكون غير الوظيفية40. تعمل هذه المعالجة السطحية على شل حركة م...
Discussion
تم تصميم البروتوكول الموصوف للمعالجة السطحية لمصفوفات الأقطاب الكهربائية الدقيقة المستوية من السيليكون. يتم تخصيص الأدوات المطبوعة 3D لصفائف microelectrode على غرار ميشيغان مع موصلات منخفضة المستوى50. تم تجميع المجسات غير الوظيفية عن طريق لصق مسبار السيليكون بعلامات التبويب المطب?...
Disclosures
لا تمثل المحتويات وجهات نظر وزارة شؤون المحاربين القدامى الأمريكية أو المعاهد الوطنية للصحة أو حكومة الولايات المتحدة.
Acknowledgements
تم دعم هذه الدراسة جزئيا من قبل جائزة Merit Review Award IRX002611 (Capadona) وجائزة عالم البحث الوظيفي IK6RX003077 (Capadona) من وزارة شؤون المحاربين القدامى في الولايات المتحدة (الولايات المتحدة) خدمة أبحاث وتطوير إعادة التأهيل وإعادة التأهيل. بالإضافة إلى ذلك ، تم دعم هذا العمل جزئيا من قبل المعهد الوطني للصحة ، والمعهد الوطني للاضطرابات العصبية والسكتة الدماغية R01NS110823 (Capadona / Pancrazio) ، وبرنامج زمالة أبحاث الدراسات العليا التابع للمؤسسة الوطنية للعلوم (Krebs).
Materials
| Name | Company | Catalog Number | Comments |
| 1-[3-(Dimethylamino)propyl]-3-ethylcarbodiimide methiodide (EDC) | Sigma-Aldrich | 165344-1G | Solid, stored desiccated at -20 °C |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| 18 Pound Solid Nylon Cable/Zip Ties | Cole-Parmer | EW-06830-66 | Length 4 inches |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Sigma-Aldrich | 4432-31-9 | Solid |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 440140-100ML | Liquid, container with Sure/Seal |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Aluminum foil | Fisher Scientific | 01-213-103 | |
| Aluminum weighing dishes | Fisher Scientific | 08-732-102 | Diameter 66 mm |
| Bel-Art Vacuum Desiccator | Fisher Scientific | 08-594-15B | |
| Corning Costar TC-Treated Multiple Well Plates | Millipore Sigma | CLS3527-100EA | 24-well plate, polystyrene |
| Cyanoacrylate Adhesive | LocTite | N/A | |
| Digital Microscope | Keyence | VHX-S750E | |
| Disco DAD3350 Dicing Saw | Disco | DAD3350 | Used to cut silicon wafer into 1 cm x 1 cm samples |
| Double-Sided Polyimide Tape | Kapton Tape | PPTDE-1/4 | ¼” x 36 yds. |
| EP21LVMed – low viscosity, two component epoxy compound | Masterbond | EP21LVMed | Meets USP Class VI certification, Passes ISO 10993-5 for cytotoxicity |
| Epilog Fusion Pro 48 Laser Machine | Epilog | N/A | CO2 laser |
| Foam tape | XFasten | N/A | 1/8" Thick |
| Gamry Interface 1010E Potentiostat | Gamry | 992-00129 | |
| High precision 45° curved tapered very fine point tweezers/forceps | Fisher Scientific | 12-000-131 | |
| Lab tape | Fisher Scientific | 15-901-10L | |
| Mn(III)tetrakis (4-benzoic acid) porphyrin (MnTBAP) | EMD Millipore | 475870-25MG | Solid, stored at -20 °C |
| N-Hydroxysulfosuccinimide sodium salt, ≥98% (HPLC) | Sigma-Aldrich | 56485-250MG | Solid, stored desiccated at 4°C |
| Platinum clad niobium mesh anode | Technic | N/A | Clad with 125μ” of platinum on one side, framed in titanium with (1) 1” x 6” titanium strap centered on one 6” dimension |
| Silicon Planar Microelectrode Array, 16 Channel | NeuroNexus | A1x16-3mm-100-177-CM16LP | Electrode site material is iridium, shank thickness is 15 μm |
| Silicon Wafer | University Wafer | 1575 | Diameter 100 mm, p-type, boron-doped, 100 oriented, resistivity 0.01-0.02 Ohm-cm, thickness 525 um, single side polished, prime grade |
| Silver/silver Chloride reference electrode | Gamry Instruments | 930-00015 | |
| Solidworks | N/A | ||
| Stainless Steel Phillips Flat Head Screws | McMaster Carr | 96877A629 | #8-32, 1 1/2", fully threaded |
| Type I deionized water | ChemWorld | CW-DI1-20 | |
| Ultimaker 3 3D printer | Ultimaker | N/A | |
| Ultimaker Cura | Ultimaker | N/A | 3D printing software |
| Ultimaker NFC ABS Filament | Dynamism, Inc. | 1621 | 2.85 mm |
| Ultimaker NFC PLA Filament | Dynamism, Inc. | 1609 | 2.85 mm |
| Vacuum Gauge Vacuum Gauge | Measureman Direct | N/A | Glycerin Filled, 2-1/2” Dial Size, ¼”NPT, -30” Hg/-100kpa-0 |
| Wing nuts | Everbilt | 934917 | #8-32, zinc plated |
References
- Donoghue, J. Bridging the brain to the world: A perspective on neural interface systems. Neuron. 60 (3), 511-521 (2008).
- Ajiboye, A. B., et al. Restoration of reaching and grasping movements through brain-controlled muscle stimulation in a person with tetraplegia: a proof-of-concept demonstration. The Lancet. 398 (10081), 1821-1830 (2017).
- Ereifej, E. S., et al. Neural engineering: the process, applications, and its role in the future of medicine. Journal of Neural Engineering. 16 (6), 063002 (2019).
- Nicolas-Alonso, L. F., Gomez-Gil, J. Brain computer interfaces, a review. Sensors (Basel). 12 (2), 1211-1279 (2012).
- Leuthardt, E. C., Schalk, G., Moran, D., Ojemann, J. G. The emerging world of motor neuroprosthetics: a neurosurgical perspective. Neurosurgery. 59 (1), 1-14 (2006).
- Barrese, J. C., et al. Failure mode analysis of silicon-based intracortical microelectrode arrays in non-human primates. Journal of Neural Engineering. 10 (6), 066014 (2013).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Prasad, A., et al. Comprehensive characterization and failure modes of tungsten microwire arrays in chronic neural implants. Journal of Neural Engineering. 9 (5), 056015 (2012).
- Hermann, J. K., Capadona, J. R. Understanding the role of innate immunity in the response to intracortical microelectrodes. Critical Reviews in Biomedical Engineering. 46 (4), 341-367 (2018).
- Ravikumar, M., et al. The roles of blood-derived macrophages and resident microglia in the neuroinflammatory response to implanted intracortical microelectrodes. Biomaterials. 35 (28), 8049-8064 (2014).
- Sawyer, A. J., et al. The effect of inflammatory cell-derived MCP-1 loss on neuronal survival during chronic neuroinflammation. Biomaterials. 35 (25), 6698-6706 (2014).
- Prasad, A., Sanchez, J. C. Quantifying long-term microelectrode array functionality using chronic in vivo impedance testing. Journal of Neural Engineering. 9 (2), 026028 (2012).
- Salatino, J. W., Ludwig, K. A., Kozai, T. D. Y., Purcell, E. K. Glial responses to implanted electrodes in the brain. Nature Biomedical Engineering. 1 (11), 862-877 (2017).
- McConnell, G. C., et al. Implanted neural electrodes cause chronic, local inflammation that is correlated with local neurodegeneration. Journal of Neural Engineering. 6 (5), 056003 (2009).
- Rennaker, R. L., Miller, J., Tang, H., Wilson, D. A. Minocycline increases quality and longevity of chronic neural recordings. Journal of Neural Engineering. 4 (2), 1-5 (2007).
- Carnicer-Lombarte, A., Chen, S. T., Malliaras, G. G., Barone, D. G. Foreign body reaction to implanted biomaterials and its impact in nerve neuroprosthetics. Frontiers in Bioengineering and Biotechnology. 9, 622524 (2021).
- Roitbak, T., Sykova, E. Diffusion barriers evoked in the rat cortex by reactive astrogliosis. Glia. 28 (1), 40-48 (1999).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Cui, X., Martin, D. C. Electrochemical deposition and characterization of poly(3,4-ethylenedioxythiophene) on neural microelectrode arrays. Sensors and Actuators B: Chemical. 89 (1), 92-102 (2003).
- Ludwig, K. A., Uram, J. D., Yang, J., Martin, D. C., Kipke, D. R. Chronic neural recordings using silicon microelectrode arrays electrochemically deposited with a poly(3,4-ethylenedioxythiophene) (PEDOT) film. Journal of Neural Engineering. 3 (1), 59-70 (2006).
- Keefer, E. W., Botterman, B. R., Romero, M. I., Rossi, A. F., Gross, G. W. Carbon nanotube coating improves neuronal recordings. Nature Nanotechnology. 3 (7), 434-439 (2008).
- Kim, D. -. H., Wiler, J. A., Anderson, D. J., Kipke, D. R., Martin, D. C. Conducting polymers on hydrogel-coated neural electrode provide sensitive neural recordings in auditory cortex. Acta Biomaterialia. 6 (1), 57-62 (2010).
- He, W., McConnell, G. C., Bellamkonda, R. V. Nanoscale laminin coating modulates cortical scarring response around implanted silicon microelectrode arrays. Journal of Neural Engineering. 3 (4), 316-326 (2006).
- Azemi, E., Lagenaur, C. F., Cui, X. T. The surface immobilization of the neural adhesion molecule L1 on neural probes and its effect on neuronal density and gliosis at the probe/tissue interface. Biomaterials. 32 (3), 681-692 (2011).
- Zhong, Y., Bellamkonda, R. V. Controlled release of anti-inflammatory agent alpha-MSH from neural implants. Journal of Controlled Release. 106 (3), 309-318 (2005).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Bedell, H. W., et al. Understanding the effects of both CD14-meditated innate immunity and device/tissue mechanical mismatch in the neuroinflammatory response to intracortical microelectrodes. Frontiers in Neuroscience. 12, 772 (2018).
- Nguyen, J. K., et al. Influence of resveratrol release on the tissue response to mechanically adaptive cortical implants. Acta Biomaterialia. 29, 81-93 (2016).
- Sridharan, A., Nguyen, J. K., Capadona, J. R., Muthuswamy, J. Compliant intracortical implants reduce strains and strain rates in brain tissue in vivo. Journal of Neural Engineering. 12 (3), 036002 (2015).
- Nguyen, J. K., et al. Mechanically-compliant intracortical implants reduce the neuroinflammatory response. Journal of Neural Engineering. 11, 056014 (2014).
- Harris, J. P., et al. In vivo deployment of mechanically adaptive nanocomposites for intracortical microelectrodes. Journal of Neural Engineering. 8 (4), 046010 (2011).
- Shoffstall, A. J., et al. Characterization of the neuroinflammatory response to Thiol-ene/Acrylate shape memory polymer coated intracortical microelectrodes. Micromachines. 10, 486 (2018).
- Simon, D. M., et al. Design and demonstration of an intracortical probe technology with tunable modulus. Journal of Biomedical Materials Research. Part A. 105 (1), 159-168 (2017).
- Ravikumar, M., et al. The effect of residual endotoxin contamination on the neuroinflammatory response to sterilized intracortical microelectrodes. Journal of Materials Chemistry. B. 2 (17), 2517-2529 (2014).
- Ecker, M., et al. Sterilization of thiol-ene/acrylate based shape memory polymers for biomedical applications. Macromolecular Materials and Engineering. 302 (2), 160331 (2017).
- Ereifej, E. S., et al. Implantation of neural probes in the brain elicits oxidative stress. Frontiers in Bioengineering and Biotechnology. 6 (9), 1-12 (2018).
- Potter, K. A., et al. The effect of resveratrol on neurodegeneration and blood brain barrier stability surrounding intracortical microelectrodes. Biomaterials. 34 (29), 7001-7015 (2013).
- Potter, K. A., et al. Curcumin-releasing mechanically adaptive intracortical implants improve the proximal neuronal density and blood-brain barrier stability. Acta Biomaterialia. 10 (5), 2209-2222 (2014).
- Potter-Baker, K. A., Capadona, J. R. Reducing the "stress": Antioxidative therapeutic and material approaches may prevent intracortical microelectrode failure. ACS Macro Letters. 4 (3), 275-279 (2015).
- Potter-Baker, K. A., et al. Development of superoxide dismutase mimetic surfaces to reduce accumulation of reactive oxygen species for neural interfacing applications. Journal of Materials Chemistry B. 2 (16), 2248-2258 (2014).
- Potter-Baker, K. A., et al. Implications of chronic daily antioxidant administration on the inflammatory response to intracortical microelectrodes. Journal of Neural Engineering. 12 (4), 046002 (2015).
- Kim, Y., et al. Ventricular delivery of resveratrol improves microelectrode recording performance and reduces oxidative stress. Micromachines. 12, 1446 (2021).
- Deku, F., et al. Amorphous silicon carbide ultramicroelectrode arrays for neural stimulation and recording. Journal of Neural Engineering. 15 (1), 016007 (2018).
- Ereifej, E. S., et al. The neuroinflammatory response to nanopatterning parallel grooves into the surface structure of intracortical microelectrodes. Advanced Functional Materials. 28 (12), 1704420 (2018).
- Kim, Y., et al. Nano-architectural approaches for improved intracortical interface technologies. Frontiers in Neuroscience. 12, 456 (2018).
- Mahajan, S., et al. Towards standardization of electrophysiology and computational tissue strain in rodent intracortical microelectrode models. Frontiers in Bioengineering and Biotechnology. 8, 416 (2020).
- Suresh, M. V., et al. The protective role of MnTBAP in oxidant-mediated injury and inflammation in a rat model of lung contusion. Surgery. 154 (5), 980-990 (2013).
- Liu, D., Shan, Y., Valluru, L., Bao, F. Mn (III) tetrakis (4-benzoic acid) porphyrin scavenges reactive species, reduces oxidative stress, and improves functional recovery after experimental spinal cord injury in rats: comparison with methylprednisolone. BMC Neuroscience. 14 (1), 23 (2013).
- Munief, W. M., et al. Silane deposition via gas-phase evaporation and high-resolution surface characterization of the ultrathin siloxane coatings. Langmuir. 34 (35), 10217-10229 (2018).
- Hoogerwerf, A. C., Wise, K. D. A three-dimensional microelectrode array for chronic neural recording. IEEE Transactions on Biomedical Engineering. 41 (12), 1136-1146 (1994).
- Staros, J. V., Wright, R. W., Swingle, D. M. Enhancement by N-hydroxysulfosuccinimide of water-soluble carbodiimide-mediated coupling reactions. Analalytical Biochemistry. 156 (1), 220-222 (1986).
- Yuan, X., Wolf, N., Mayer, D., Offenhausser, A., Wordenweber, R. Vapor-phase deposition and electronic characterization of 3-Aminopropyltriethoxysilane self-assembled monolayers on silicon dioxide. Langmuir. 35 (25), 8183-8190 (2019).
- Montgomery, D. C. . Design and Analysis of Experiments. Eighth edition. , (2013).
- Shoffstall, A. J., Capadona, J. R. Bio-inspired materials and systems for neural interfacing. Current Opinions in Biomedical Engineering. 6, 110-119 (2018).
- Skousen, J. L., Tresco, P. A. . Neuroprosthetics. Theory and Practice 2nd Edition. , 259-299 (2017).
- Michelson, N. J., et al. multi-modal analysis uncovers complex relationship at the brain tissue-implant neural interface: new emphasis on the biological interface. Journal of Neural Engineering. 15 (3), 033001 (2018).
- Hofmann, U. G., Capadona, J. R. Editorial: Bridging the gap in neuroelectronic interfaces. Frontiers in Neuroscience. 14, 457 (2020).
- Usoro, J., Sturgill, B., Musselman, K., Capadona, J. R., Pancrazio, J. J. On the definition of 'chronic' for intracortical microelectrode array applications. Micromachines. 12 (8), 972 (2021).
- Thompson, C. H., Saxena, A., Heelan, N., Salatino, J., Purcell, E. K. Spatiotemporal patterns of gene expression around implanted silicon electrode arrays. Journal of Neural Engineering. 18 (4), 1741 (2021).
- Golabchi, A., Woeppel, K. M., Li, X., Lagenaur, C. F., Cui, X. T. Neuroadhesive protein coating improves the chronic performance of neuroelectronics in mouse brain. Biosensors and Bioelectronics. 155, 112096 (2020).
- Zheng, X. S., et al. A superoxide scavenging coating for improving tissue response to neural implants. Acta Biomaterialia. 99, 72-83 (2019).
- Lee, H. C., et al. Foreign body response to intracortical microelectrodes is not altered with dip-coating of Polyethylene Glycol (PEG). Frontiers in Neuroscience. 11, 513 (2017).
- Boehler, C., et al. Actively controlled release of Dexamethasone from neural microelectrodes in a chronic in vivo study. Biomaterials. 129, 176-187 (2017).
- Hess, A. E., et al. Development of a stimuli-responsive polymer nanocomposite toward biologically optimized, MEMS-based neural probes. Journal of Micromechanics and Microengineering. 21 (5), 054009 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved