Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Инструменты для обработки поверхности кремниевых планарных внутрикорпортических микроэлектродов
В этой статье
Резюме
Настоящий протокол описывает инструменты для обработки кремний-планарных внутрикортикальных микроэлектродов во время обработки модификации поверхности посредством газового осаждения и реакций водного раствора. Подробно объясняется сборка компонентов, используемых для обработки устройств на протяжении всей процедуры.
Аннотация
Интракортикальные микроэлектроды обладают большим терапевтическим потенциалом. Но они сталкиваются со значительным снижением производительности после скромной продолжительности имплантации. Существенным фактором наблюдаемого снижения является повреждение нервной ткани, близкой к имплантату, и последующая нейровоспалительная реакция. Усилия по улучшению долговечности устройства включают химические модификации или нанесение покрытий на поверхность устройства для улучшения реакции тканей. Разработка таких поверхностных обработок обычно завершается с использованием нефункциональных «фиктивных» зондов, в которых отсутствуют электрические компоненты, необходимые для предполагаемого применения. Перевод на функциональные устройства требует дополнительного рассмотрения, учитывая хрупкость внутрикортикальных микроэлектродных массивов. Погрузочно-разгрузочные инструменты значительно облегчают обработку поверхности собранных устройств, особенно для модификаций, требующих длительного процедурного времени. Описанные здесь погрузочно-разгрузочные средства используются для обработки поверхности путем газофазного осаждения и воздействия водного раствора. Характеризация покрытия выполняется с помощью эллипсометрии и рентгеновской фотоэлектронной спектроскопии. Сравнение записей электрической импедансной спектроскопии до и после процедуры нанесения покрытия на функциональные устройства подтвердило целостность устройства после модификации. Описанные инструменты могут быть легко адаптированы для альтернативных электродных устройств и методов обработки, которые поддерживают химическую совместимость.
Введение
Нейропротезные устройства направлены на восстановление нарушенных или отсутствующих сенсорных и двигательных способностей в широком диапазоне популяций пациентов, включая пациентов с травмой спинного мозга, боковым амиотрофическим склерозом (БАС), церебральным параличом и ампутациями 1,2,3. Интракортикальные микроэлектроды (IME) могут устанавливать коммуникационный путь между кортикальными нейронами и устройствами, используемыми для управления нейропротезированием. Явным преимуществом интракортикальных микроэлектродов является их способность записывать нейронные сигналы с высоким пространственным и временным разрешением, что предпочтительно для последующей обработки сигналов и управления интерфейсами мозг-компьютер 4,5. К сожалению, показатели внутрикортикальных микроэлектродов резко снижаются в течение нескольких месяцев до года после имплантации 2,6,7,8. Потеря качества и стабильности сигнала негативно сказывается на применении технологии.
Значительный вклад в наблюдаемое снижение производительности вносит биотическая реакция на связанное с имплантацией повреждение тканей и хроническое нейровоспаление 9,10,11. Имплантация IME наносит повреждение ткани мозга, в результате чего высвобождаются сигнальные молекулы, которые инициируют каскады реакционных клеточных защитных процессов. Хроническое сопряжение усугубляет реакцию инородного тела, что приводит к устойчивому нейровоспалению, которое повреждает ткани, расположенные проксимально к устройству; часто распознаются как симптомы нейровоспаления, рубцевания, так и местной нейродегенерации, способствующие снижению качества записи сигнала 12,13,14,15. Состоящий из плотного конгломерата астроцитов с вовлеченной активированной микроглией и макрофагами, рубец, инкапсулирующий электрод, создает неблагоприятную местную среду со сниженным транспортом материала и локальным накоплением воспалительных факторов 16,15,16,17,18.
Во многих исследованиях описывается реакция мозга на внутричерепные микроэлектроды или подходы к смягчению ответа7. Исследования и разработки по улучшению реакции тканей включали в себя ряд стратегий, включая модификации общей структуры, топологии поверхности, материалов и нанесения покрытий. Эти усилия направлены на минимизацию ущерба, полученного в результате имплантации, введение более благоприятного интерфейса между устройством и проксимальными клетками или снижение деформации тканей после имплантации устройств7. Методы, специально нацеленные на хронический биологический ответ, привели к созданию нескольких биологически активных покрытий, которые направлены на стабилизацию места имплантации и химическое укрепление здоровья клеток. Примеры включают проводящие полимеры, такие как поли(этилендиокситиофен) (PEDOT)19,20, углеродные нанотрубки21, гидрогели22 и добавление биологически активных молекул и лекарственных средств для нацеливания на специфические клеточные процессы 23,24,25. Наша исследовательская группа, в частности, изучила множество механизмов, способствующих снижению воспалительной реакции на имплантированные микроэлектроды, включая, но не ограничиваясь, минимизацией травмы, связанной с имплантацией устройства26, минимизацией несоответствия жесткости устройства / ткани 27,28,29,30,31,32,33, оптимизацией стерилизации процедуры34,35, снижение окислительного стресса/повреждения 28,36,37,38,39,40,41,42, изучение альтернативных электродных материалов43 и имитация наноархитектуры естественного внеклеточного матрикса 44,45,46 . Недавний интерес представляет разработка биомиметических поверхностных покрытий для смягчения нейровоспалительного ответа на микроэлектродном тканевом интерфейсе непосредственно39.
Модификация интерфейса обеспечивает уникальное преимущество непосредственного нацеливания на рану и проксимальную ткань, необходимую для регистрации сигнала. Поверхностная обработка, которая способствует заживлению, не усугубляя иммунный ответ, может принести пользу в течение всей жизни качественной записи и устранить ограничения в реализации терапевтического и исследовательского потенциала внутрикортикальных микроэлектродов. Представленная работа детализирует методы нанесения обработки поверхности на микроэлектродные массивы, которые требуют длительного времени реакции при одновременном приспособлении к хрупкости устройств. Представленный метод предназначен для совместного использования методов модификации поверхности с функциональными устройствами, где устройство не может быть обработано на протяжении всего применения обработки. Представлены инструменты для работы с нефункциональными фиктивными зондами и функциональными кремниевыми планарными микроэлектродными массивами.
Представленный подход к модификации поверхности электрода позволяет надежно суспендировать нефункциональные муляжи зондов или функциональные кремниевые плоские электродные решетки для газофазного осаждения и реакции с водными растворами. Несколько 3D-печатных частей используются для обработки этих хрупких устройств (рисунок 1 и рисунок 2). Приведен пример процедуры, в которой используются как газовые, так и фазовые стадии раствора для модификации поверхности с антиоксидантным покрытием, включающим иммобилизацию Mn(III)тетракиса (4-бензойной кислоты) порфирина (MnTBAP). MnTBAP - синтетический металлопорфирин, обладающий антиоксидантными свойствами с доказанным опосредованием воспаления47,48. Приведенный пример на функциональных кремниевых планарных электродных массивах подтверждает обновление ранее сообщенного протокола для нефункциональных устройств40. Адаптация метода газофазного осаждения от Munief et al. поддерживает совместимость протокола с функциональными электродами49. Газофазное осаждение используется для функциональной обработки поверхности амином при подготовке к водной реакции с участием химии карбодиимидных сшивающих веществ для иммобилизации активного MnTBAP. Разработанная здесь методология обработки предоставляется в качестве платформы, которая может быть модифицирована для размещения других покрытий и аналогичных устройств.
Протокол иллюстрирует подход с использованием нефункциональных фиктивных зондов, содержащих кремниевый хвостовик и 3D-печатную вкладку с размерами, аналогичными функциональным кремниевым планарным электродным решеткам. Упаковка разъема прибора в предоставленной инструкции считается аналогом 3D-печатной вкладки нефункционального фиктивного зонда.
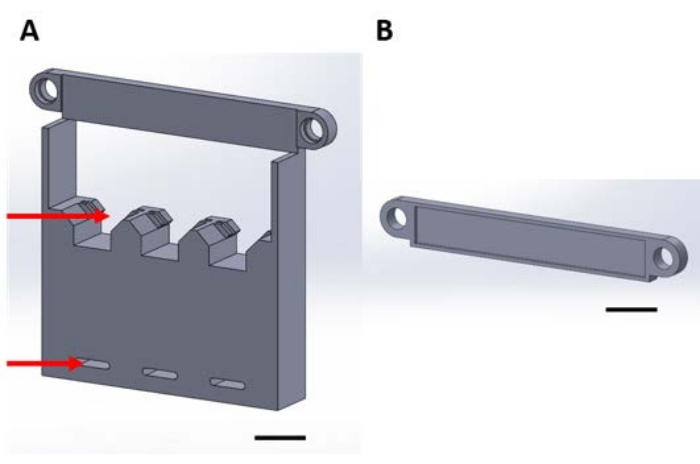
Рисунок 1: 3D-печатные образцы для работы с функциональными устройствами во время газофазного осаждения в вакуумном осушителе. (А) Основание конструкции включает держатели для 1 см х 1 см образцов кремниевых квадратов (верхняя стрелка) и отверстия для крепления к адсорбционной пластине (нижняя стрелка). (B) Табличка используется для крепления подвески устройств. С этого момента каждая часть на этом рисунке будет называться либо частью 1A, либо частью 1B. Шкала = 1 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
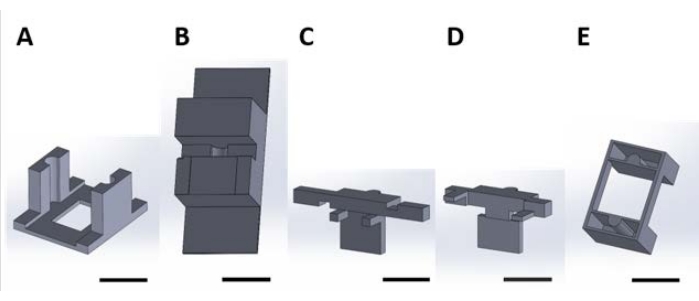
Рисунок 2: 3D-печатные куски для обработки функциональных устройств для поверхностной реакции, происходящей в водном растворе. (А) Направляющая часть должна быть приклеена к крышке культуральной пластины. (B) Настольные детали, используемые для стабилизации деталей (C) и (D) во время сборки. (C) и (D) вместе закрепляют подвеску устройств для размещения в плите скважины и (E) дополнительно крепят куски (C) и (D) к крышке плиты скважины. С этого момента отдельные части на каждой панели этого рисунка будут называться номерами деталей, соответствующими номеру панели этого рисунка. Шкала = 1 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
Все файлы кодирования для 3D-печати представлены в дополнительных файлах кодирования 1-16. Анализ, приведенный в репрезентативных результатах, описан с использованием коммерчески приобретенных функциональных кремниевых планарных электродных массивов (см. Таблицу материалов).
1. Погрузочно-разгрузочная сборка для газофазного осаждения в вакуумном осушителе
ПРИМЕЧАНИЕ: Собранное устройство для обработки и удержания устройств во время газофазного осаждения показано на рисунке 3. Этапы 1.1-1.8 описывают процедуру, необходимую для помещения устройств в устройство для осаждения (рис. 4А).

Рисунок 3: Сборка 3D-печатных деталей для обработки функциональных устройств при газофазном осаждении. Сборка изображена без образцов, подлежащих покрытию. Винты и крыльевые гайки используются для скрепления частей 1А и 2В вместе. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Изображение сборки и размещения образцов, подлежащих покрытию. Данная схема описывает обращение с функциональными устройствами при газофазном осаждении, закрепленными в вакуумном осушителе. (A) Двусторонняя полиимидная лента, помещенная на кусок 1А, и пенопластовая лента, помещенная на 1B. (B) Устройства, закрепленные на ленте. (C) Винты и крыльевые гайки используются для крепления деталей от 1B до 1A, а узел крепится к лотку осушителя с помощью стяжек-молний (красные стрелки). (D) Образцы кремниевых квадратов размером 1 см х 1 см помещаются в соответствующие держатели. (E) Алюминиевая весовая тарелка и манометр помещаются в осушитель в указанной ориентации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Для обработки поверхности приобретите квадратные образцы материала подложки приборов размером 1 см х 1 см.
- Для образцов кремния (отобранных для этого протокола) нарежьте кремниевую пластину на квадраты размером 1 см х 1 см с помощью машины для нарезки пластин (см. Таблицу материалов).
- Распечатайте или приобретите части 1A (рисунок 1A, файл дополнительного кодирования 1, файл дополнительного кодирования 2) и 1B (рисунок 1B, файл дополнительного кодирования 3, файл дополнительного кодирования 4).
- Прикрепите двухстороннюю полиимидную ленту к куску 1А и прикрепите к куску 1B полосу толщиной 1/8 дюйма с односторонним клеем.
- Приклейте разъем упаковки прибора к ленте на куске 1А.
ПРИМЕЧАНИЕ: Идеальная ориентация разъема на ленте оставит хвостовик подвешенным над краем, как показано на рисунке 4B. - Закрепите деталь 1A и деталь 1B вместе (рисунок 4C). Выровняйте отверстия и закрепите их с помощью винтов из нержавеющей стали и гаек крыла (см. Таблицу материалов).
- Используя застежки-молнии, прикрепите узел к лотку вакуумного осушителя, используя отверстия в нижней части детали 1А, как показано на рисунке 4C.
- Если применимо, поместите квадратные образцы материала в щели в нижней части рамы (рисунок 4D). Здесь в качестве примера используются образцы размером 1 см х 1 см квадратных силиконовых пластин, нарезанных кубиками.
ПРИМЕЧАНИЕ: Точный материал должен соответствовать подложке обрабатываемого устройства, который будет варьироваться в зависимости от устройства. - Завершите газофазное осаждение, поместив раствор в соответствующий сосуд внутри вакуумного осушителя напротив и в соответствии с защищенным сбором.
ПРИМЕЧАНИЕ: Алюминиевые весовые тарелки использовались в качестве сосудов для осаждения (3-аминопропил)триэтоксисилана (APTES) в качестве примера здесь.- Поместите вакуумметр (см. Таблицу материалов) в осушитель, чтобы записать точное давление. Расположите порт крышки осушителя рядом с закрепленным сбором и в соответствии с раствором (рисунок 4E).
ПРИМЕЧАНИЕ: Более подробная информация об этом методе газофазного осаждения описана в ранее опубликованном Справочнике49.
- Поместите вакуумметр (см. Таблицу материалов) в осушитель, чтобы записать точное давление. Расположите порт крышки осушителя рядом с закрепленным сбором и в соответствии с раствором (рисунок 4E).
2. Обработка сборки для поверхностной реакции через водный раствор
ПРИМЕЧАНИЕ: Компоненты и собранные устройства для обработки и удержания устройств во время водно-фазового осаждения и обработки поверхности проиллюстрированы на рисунках 5-7. На следующих шагах будет подробно описана процедура, необходимая для помещения устройств в устройство для осаждения и обработки.

Рисунок 5: Сборка 3D-печатных деталей для обработки функциональных устройств для поверхностной реакции, происходящей в водном растворе. (А) Направляющая деталь должна быть приклеена к крышке культуральной пластины. (B) Настольная деталь использовалась для стабилизации деталей (C) и (D) во время сборки. (C) и (D) вместе закрепляют подвеску устройств для размещения в плите скважины. (E) дополнительно закрепляет куски (C) и (D) к крышке пластины скважины. Двусторонняя полиимидная лента была помещена на нижнюю часть (C), а пенопластовая лента была помещена на нижнюю часть (D) (обе коробки в красном цвете). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Крышка пластины для культивирования клеток, сконструированная с 6 направляющими (часть 2A). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 7: Последовательность для крепления и загрузки зондов для реакции раствора. Цвет деталей был изменен на этом рисунке для ясности внутри изображения. Это те же части, что и на рисунках 5 и 6. (A) Кусок 2C помещается в кусок 2B, и устройство крепится к заклеенной части 2C. (B) Кусок 2D помещается в кусок 2C для создания сборки, которая подвешивает хвостовик устройства. (C) Узел 2C, 2D и устройство тщательно расположены на крышке плиты скважины с помощью направляющей. (D) Часть 2E помещается поверх узла для дальнейшего закрепления крышки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Соорудите крышку для пластины скважины, чтобы подвешивать электродный массив прибора в растворе (рисунок 6). Этот протокол описывает использование плиты из 24 скважин.
- Вырежьте прямоугольные отверстия 19 мм х 10,5 мм в крышке пластины скважины с помощью лазерного резака или вручную с помощью коробчатого резака. Сопоставьте количество отверстий с количеством устройств, необходимых для лечения.
ПРИМЕЧАНИЕ: Для удобства сборки рекомендуется обрабатывать шесть устройств на плиту скважины или, как минимум, размещать отверстия над несмежными скважинами (рисунок 6). - Распечатайте или приобретите соответствующее количество руководств (часть 2A (рисунок 2A), файл дополнительного кодирования 5, файл дополнительного кодирования 6).
- Используйте цианоакрилатный клей для крепления направляющих к крышке. Выровняйте прямоугольные отверстия в направляющих и крышках во время склеивания, чтобы обеспечить беспрепятственное прямоугольное отверстие направляющей, как показано на рисунке 6.
- Вырежьте прямоугольные отверстия 19 мм х 10,5 мм в крышке пластины скважины с помощью лазерного резака или вручную с помощью коробчатого резака. Сопоставьте количество отверстий с количеством устройств, необходимых для лечения.
- Заполните плиту лунки нужным раствором в местах, где будет происходить обработка. Например, раствор содержит EDC и Sulfo-NHS (см. Таблицу материалов) в буфере MES.
ПРИМЕЧАНИЕ: Объем раствора будет зависеть от размеров электродного устройства. Для микроэлектродных массивов мичиганского типа (см. Таблицу материалов) с низкопрофильными разъемами 8,6 мм и длиной хвостовика 3 мм имеется зазор ~9 мм50. Использование 2 мл раствора позволит полностью погрузить хвостовик устройства, сохраняя остальную часть устройства вне реакционного раствора.- Если образцы подложки используются для подтверждения обработки поверхности, поместите образцы квадратного материала в колодец пластины и погрузите их в реакционный раствор.
- Надежно подвешивайте устройства (см. Таблицу материалов) в плите колодца. Последовательность показана на рисунке 7.
- Ленточный фрагмент 2B (рисунок 2B, файл дополнительного кодирования 7, файл дополнительного кодирования 8) к столешнице (рисунок 7A).
- Поместите двухстороннюю полиимидную ленту для покрытия основания куска 2C (рисунок 2C, файл дополнительного кодирования 9, файл дополнительного кодирования 10).
- Поместите 1/8" пенопластовую ленту с односторонним клеем, чтобы покрыть основание куска 2D (Рисунок 2D, Дополнительный кодирующий файл 11, Дополнительный кодирующий файл 12).
- Поместите кусок 2C в паз куска 2B (рисунок 7A).
- Приклейте соединительную упаковку устройства к ленте, ориентированной, поэтому длина хвостовика устройства подвешена (рис. 7В).
- Закрепите устройство, сдвинув кусок 2D (показан оранжевым цветом на рисунке 7) в кусок 2C. Эта сборка эффективно закрепляет устройство между частями инструмента (рисунок 7B).
- Удерживая края узла, осторожно поднимите, чтобы снять с куска 2А.
- Установите узел в крышку, выровняв полукруги, обращенные наружу на кусках 2C и 2D с соответствующими направляющими на куске 2A (показаны зеленым цветом на рисунке 7C).
- Безопасное размещение сборки с помощью прижимной детали 2E (рисунок 2E) над направляющими (показано зеленым цветом на рисунке 7D, файл дополнительного кодирования 13, файл дополнительного кодирования 14).
- Для реакций, которые выигрывают от непрерывного перемешивания раствора, перемешайте пластину скважины. Перенесите собранную пластину колодца на шейкерный стол и работайте со скоростью до 100 об/мин.
- Если требуется несколько реакций на основе раствора или этапов промывки, осторожно перенесите крышку на новую пластину скважины с желаемым раствором (растворами), распределенным по соответствующим скважинам.
ПРИМЕЧАНИЕ: Шаг 2.4 является необязательным. - Снимите приборы с плиты колодца.
- Ленточный кусок 2B к столешнице.
- Снимите кусок 2Е с крышки.
- Аккуратно извлеките узел, удерживающий устройство, из плиты колодца.
- Ориентируйте сборку так, чтобы деталь 2C была обращена к столу, а деталь 2D — вверх. Хвостовик устройства должен быть параллельны столешнице. Установите деталь 2C сборки в деталь 2B, как это было выполнено ранее (шаг 2.3.4) при монтаже сборки.
- Отделите кусок 2D от куска 2C, тщательно раздвинув их. Приложите небольшое давление на выступы куска 2С в скамейку, чтобы обеспечить устойчивость для этой задачи.
ПРИМЕЧАНИЕ: Вкладки 2C длиннее, чем у 2D, чтобы облегчить эту обработку. - Используйте щипцы, чтобы удерживать упаковку разъема устройства, чтобы извлечь его из ленты и перенести устройство в нужный контейнер для хранения.
Результаты
Чтобы продемонстрировать использование компонентов обработки, описанная методология была реализована для адаптации иммобилизации медиатора окислителя к активированному кремнию. Применение этой химии к IME для снижения окислительного стресса было разработано Potter-Baker et al. и продемонст...
Обсуждение
Описанный протокол был разработан для обработки поверхности кремниевых планарных микроэлектродных массивов. Инструменты для 3D-печати настроены на микроэлектродные матрицы в мичиганском стиле с низкопрофильными разъемами50. Нефункциональные зонды собирались путем прик?...
Раскрытие информации
Содержание не отражает точку зрения Министерства по делам ветеранов США, Национальных институтов здравоохранения или правительства Соединенных Штатов.
Благодарности
Это исследование было частично поддержано наградой Merit Review Award IRX002611 (Capadona) и премией Research Career Scientist Award IK6RX003077 (Capadona) от Службы исследований и разработок в области реабилитации Министерства по делам ветеранов США (США). Кроме того, эта работа также была частично поддержана Национальным институтом здравоохранения, Национальным институтом неврологических расстройств и инсульта R01NS110823 (Capadona / Pancrazio) и Программой стипендий для аспирантов Национального научного фонда (Krebs).
Материалы
| Name | Company | Catalog Number | Comments |
| 1-[3-(Dimethylamino)propyl]-3-ethylcarbodiimide methiodide (EDC) | Sigma-Aldrich | 165344-1G | Solid, stored desiccated at -20 °C |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| 18 Pound Solid Nylon Cable/Zip Ties | Cole-Parmer | EW-06830-66 | Length 4 inches |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Sigma-Aldrich | 4432-31-9 | Solid |
| 3-aminopropyltriethoxysilane (APTES) | Sigma-Aldrich | 440140-100ML | Liquid, container with Sure/Seal |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Aluminum foil | Fisher Scientific | 01-213-103 | |
| Aluminum weighing dishes | Fisher Scientific | 08-732-102 | Diameter 66 mm |
| Bel-Art Vacuum Desiccator | Fisher Scientific | 08-594-15B | |
| Corning Costar TC-Treated Multiple Well Plates | Millipore Sigma | CLS3527-100EA | 24-well plate, polystyrene |
| Cyanoacrylate Adhesive | LocTite | N/A | |
| Digital Microscope | Keyence | VHX-S750E | |
| Disco DAD3350 Dicing Saw | Disco | DAD3350 | Used to cut silicon wafer into 1 cm x 1 cm samples |
| Double-Sided Polyimide Tape | Kapton Tape | PPTDE-1/4 | ¼” x 36 yds. |
| EP21LVMed – low viscosity, two component epoxy compound | Masterbond | EP21LVMed | Meets USP Class VI certification, Passes ISO 10993-5 for cytotoxicity |
| Epilog Fusion Pro 48 Laser Machine | Epilog | N/A | CO2 laser |
| Foam tape | XFasten | N/A | 1/8" Thick |
| Gamry Interface 1010E Potentiostat | Gamry | 992-00129 | |
| High precision 45° curved tapered very fine point tweezers/forceps | Fisher Scientific | 12-000-131 | |
| Lab tape | Fisher Scientific | 15-901-10L | |
| Mn(III)tetrakis (4-benzoic acid) porphyrin (MnTBAP) | EMD Millipore | 475870-25MG | Solid, stored at -20 °C |
| N-Hydroxysulfosuccinimide sodium salt, ≥98% (HPLC) | Sigma-Aldrich | 56485-250MG | Solid, stored desiccated at 4°C |
| Platinum clad niobium mesh anode | Technic | N/A | Clad with 125μ” of platinum on one side, framed in titanium with (1) 1” x 6” titanium strap centered on one 6” dimension |
| Silicon Planar Microelectrode Array, 16 Channel | NeuroNexus | A1x16-3mm-100-177-CM16LP | Electrode site material is iridium, shank thickness is 15 μm |
| Silicon Wafer | University Wafer | 1575 | Diameter 100 mm, p-type, boron-doped, 100 oriented, resistivity 0.01-0.02 Ohm-cm, thickness 525 um, single side polished, prime grade |
| Silver/silver Chloride reference electrode | Gamry Instruments | 930-00015 | |
| Solidworks | N/A | ||
| Stainless Steel Phillips Flat Head Screws | McMaster Carr | 96877A629 | #8-32, 1 1/2", fully threaded |
| Type I deionized water | ChemWorld | CW-DI1-20 | |
| Ultimaker 3 3D printer | Ultimaker | N/A | |
| Ultimaker Cura | Ultimaker | N/A | 3D printing software |
| Ultimaker NFC ABS Filament | Dynamism, Inc. | 1621 | 2.85 mm |
| Ultimaker NFC PLA Filament | Dynamism, Inc. | 1609 | 2.85 mm |
| Vacuum Gauge Vacuum Gauge | Measureman Direct | N/A | Glycerin Filled, 2-1/2” Dial Size, ¼”NPT, -30” Hg/-100kpa-0 |
| Wing nuts | Everbilt | 934917 | #8-32, zinc plated |
Ссылки
- Donoghue, J. Bridging the brain to the world: A perspective on neural interface systems. Neuron. 60 (3), 511-521 (2008).
- Ajiboye, A. B., et al. Restoration of reaching and grasping movements through brain-controlled muscle stimulation in a person with tetraplegia: a proof-of-concept demonstration. The Lancet. 398 (10081), 1821-1830 (2017).
- Ereifej, E. S., et al. Neural engineering: the process, applications, and its role in the future of medicine. Journal of Neural Engineering. 16 (6), 063002 (2019).
- Nicolas-Alonso, L. F., Gomez-Gil, J. Brain computer interfaces, a review. Sensors (Basel). 12 (2), 1211-1279 (2012).
- Leuthardt, E. C., Schalk, G., Moran, D., Ojemann, J. G. The emerging world of motor neuroprosthetics: a neurosurgical perspective. Neurosurgery. 59 (1), 1-14 (2006).
- Barrese, J. C., et al. Failure mode analysis of silicon-based intracortical microelectrode arrays in non-human primates. Journal of Neural Engineering. 10 (6), 066014 (2013).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Prasad, A., et al. Comprehensive characterization and failure modes of tungsten microwire arrays in chronic neural implants. Journal of Neural Engineering. 9 (5), 056015 (2012).
- Hermann, J. K., Capadona, J. R. Understanding the role of innate immunity in the response to intracortical microelectrodes. Critical Reviews in Biomedical Engineering. 46 (4), 341-367 (2018).
- Ravikumar, M., et al. The roles of blood-derived macrophages and resident microglia in the neuroinflammatory response to implanted intracortical microelectrodes. Biomaterials. 35 (28), 8049-8064 (2014).
- Sawyer, A. J., et al. The effect of inflammatory cell-derived MCP-1 loss on neuronal survival during chronic neuroinflammation. Biomaterials. 35 (25), 6698-6706 (2014).
- Prasad, A., Sanchez, J. C. Quantifying long-term microelectrode array functionality using chronic in vivo impedance testing. Journal of Neural Engineering. 9 (2), 026028 (2012).
- Salatino, J. W., Ludwig, K. A., Kozai, T. D. Y., Purcell, E. K. Glial responses to implanted electrodes in the brain. Nature Biomedical Engineering. 1 (11), 862-877 (2017).
- McConnell, G. C., et al. Implanted neural electrodes cause chronic, local inflammation that is correlated with local neurodegeneration. Journal of Neural Engineering. 6 (5), 056003 (2009).
- Rennaker, R. L., Miller, J., Tang, H., Wilson, D. A. Minocycline increases quality and longevity of chronic neural recordings. Journal of Neural Engineering. 4 (2), 1-5 (2007).
- Carnicer-Lombarte, A., Chen, S. T., Malliaras, G. G., Barone, D. G. Foreign body reaction to implanted biomaterials and its impact in nerve neuroprosthetics. Frontiers in Bioengineering and Biotechnology. 9, 622524 (2021).
- Roitbak, T., Sykova, E. Diffusion barriers evoked in the rat cortex by reactive astrogliosis. Glia. 28 (1), 40-48 (1999).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Cui, X., Martin, D. C. Electrochemical deposition and characterization of poly(3,4-ethylenedioxythiophene) on neural microelectrode arrays. Sensors and Actuators B: Chemical. 89 (1), 92-102 (2003).
- Ludwig, K. A., Uram, J. D., Yang, J., Martin, D. C., Kipke, D. R. Chronic neural recordings using silicon microelectrode arrays electrochemically deposited with a poly(3,4-ethylenedioxythiophene) (PEDOT) film. Journal of Neural Engineering. 3 (1), 59-70 (2006).
- Keefer, E. W., Botterman, B. R., Romero, M. I., Rossi, A. F., Gross, G. W. Carbon nanotube coating improves neuronal recordings. Nature Nanotechnology. 3 (7), 434-439 (2008).
- Kim, D. -. H., Wiler, J. A., Anderson, D. J., Kipke, D. R., Martin, D. C. Conducting polymers on hydrogel-coated neural electrode provide sensitive neural recordings in auditory cortex. Acta Biomaterialia. 6 (1), 57-62 (2010).
- He, W., McConnell, G. C., Bellamkonda, R. V. Nanoscale laminin coating modulates cortical scarring response around implanted silicon microelectrode arrays. Journal of Neural Engineering. 3 (4), 316-326 (2006).
- Azemi, E., Lagenaur, C. F., Cui, X. T. The surface immobilization of the neural adhesion molecule L1 on neural probes and its effect on neuronal density and gliosis at the probe/tissue interface. Biomaterials. 32 (3), 681-692 (2011).
- Zhong, Y., Bellamkonda, R. V. Controlled release of anti-inflammatory agent alpha-MSH from neural implants. Journal of Controlled Release. 106 (3), 309-318 (2005).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Bedell, H. W., et al. Understanding the effects of both CD14-meditated innate immunity and device/tissue mechanical mismatch in the neuroinflammatory response to intracortical microelectrodes. Frontiers in Neuroscience. 12, 772 (2018).
- Nguyen, J. K., et al. Influence of resveratrol release on the tissue response to mechanically adaptive cortical implants. Acta Biomaterialia. 29, 81-93 (2016).
- Sridharan, A., Nguyen, J. K., Capadona, J. R., Muthuswamy, J. Compliant intracortical implants reduce strains and strain rates in brain tissue in vivo. Journal of Neural Engineering. 12 (3), 036002 (2015).
- Nguyen, J. K., et al. Mechanically-compliant intracortical implants reduce the neuroinflammatory response. Journal of Neural Engineering. 11, 056014 (2014).
- Harris, J. P., et al. In vivo deployment of mechanically adaptive nanocomposites for intracortical microelectrodes. Journal of Neural Engineering. 8 (4), 046010 (2011).
- Shoffstall, A. J., et al. Characterization of the neuroinflammatory response to Thiol-ene/Acrylate shape memory polymer coated intracortical microelectrodes. Micromachines. 10, 486 (2018).
- Simon, D. M., et al. Design and demonstration of an intracortical probe technology with tunable modulus. Journal of Biomedical Materials Research. Part A. 105 (1), 159-168 (2017).
- Ravikumar, M., et al. The effect of residual endotoxin contamination on the neuroinflammatory response to sterilized intracortical microelectrodes. Journal of Materials Chemistry. B. 2 (17), 2517-2529 (2014).
- Ecker, M., et al. Sterilization of thiol-ene/acrylate based shape memory polymers for biomedical applications. Macromolecular Materials and Engineering. 302 (2), 160331 (2017).
- Ereifej, E. S., et al. Implantation of neural probes in the brain elicits oxidative stress. Frontiers in Bioengineering and Biotechnology. 6 (9), 1-12 (2018).
- Potter, K. A., et al. The effect of resveratrol on neurodegeneration and blood brain barrier stability surrounding intracortical microelectrodes. Biomaterials. 34 (29), 7001-7015 (2013).
- Potter, K. A., et al. Curcumin-releasing mechanically adaptive intracortical implants improve the proximal neuronal density and blood-brain barrier stability. Acta Biomaterialia. 10 (5), 2209-2222 (2014).
- Potter-Baker, K. A., Capadona, J. R. Reducing the "stress": Antioxidative therapeutic and material approaches may prevent intracortical microelectrode failure. ACS Macro Letters. 4 (3), 275-279 (2015).
- Potter-Baker, K. A., et al. Development of superoxide dismutase mimetic surfaces to reduce accumulation of reactive oxygen species for neural interfacing applications. Journal of Materials Chemistry B. 2 (16), 2248-2258 (2014).
- Potter-Baker, K. A., et al. Implications of chronic daily antioxidant administration on the inflammatory response to intracortical microelectrodes. Journal of Neural Engineering. 12 (4), 046002 (2015).
- Kim, Y., et al. Ventricular delivery of resveratrol improves microelectrode recording performance and reduces oxidative stress. Micromachines. 12, 1446 (2021).
- Deku, F., et al. Amorphous silicon carbide ultramicroelectrode arrays for neural stimulation and recording. Journal of Neural Engineering. 15 (1), 016007 (2018).
- Ereifej, E. S., et al. The neuroinflammatory response to nanopatterning parallel grooves into the surface structure of intracortical microelectrodes. Advanced Functional Materials. 28 (12), 1704420 (2018).
- Kim, Y., et al. Nano-architectural approaches for improved intracortical interface technologies. Frontiers in Neuroscience. 12, 456 (2018).
- Mahajan, S., et al. Towards standardization of electrophysiology and computational tissue strain in rodent intracortical microelectrode models. Frontiers in Bioengineering and Biotechnology. 8, 416 (2020).
- Suresh, M. V., et al. The protective role of MnTBAP in oxidant-mediated injury and inflammation in a rat model of lung contusion. Surgery. 154 (5), 980-990 (2013).
- Liu, D., Shan, Y., Valluru, L., Bao, F. Mn (III) tetrakis (4-benzoic acid) porphyrin scavenges reactive species, reduces oxidative stress, and improves functional recovery after experimental spinal cord injury in rats: comparison with methylprednisolone. BMC Neuroscience. 14 (1), 23 (2013).
- Munief, W. M., et al. Silane deposition via gas-phase evaporation and high-resolution surface characterization of the ultrathin siloxane coatings. Langmuir. 34 (35), 10217-10229 (2018).
- Hoogerwerf, A. C., Wise, K. D. A three-dimensional microelectrode array for chronic neural recording. IEEE Transactions on Biomedical Engineering. 41 (12), 1136-1146 (1994).
- Staros, J. V., Wright, R. W., Swingle, D. M. Enhancement by N-hydroxysulfosuccinimide of water-soluble carbodiimide-mediated coupling reactions. Analalytical Biochemistry. 156 (1), 220-222 (1986).
- Yuan, X., Wolf, N., Mayer, D., Offenhausser, A., Wordenweber, R. Vapor-phase deposition and electronic characterization of 3-Aminopropyltriethoxysilane self-assembled monolayers on silicon dioxide. Langmuir. 35 (25), 8183-8190 (2019).
- Montgomery, D. C. . Design and Analysis of Experiments. Eighth edition. , (2013).
- Shoffstall, A. J., Capadona, J. R. Bio-inspired materials and systems for neural interfacing. Current Opinions in Biomedical Engineering. 6, 110-119 (2018).
- Skousen, J. L., Tresco, P. A. . Neuroprosthetics. Theory and Practice 2nd Edition. , 259-299 (2017).
- Michelson, N. J., et al. multi-modal analysis uncovers complex relationship at the brain tissue-implant neural interface: new emphasis on the biological interface. Journal of Neural Engineering. 15 (3), 033001 (2018).
- Hofmann, U. G., Capadona, J. R. Editorial: Bridging the gap in neuroelectronic interfaces. Frontiers in Neuroscience. 14, 457 (2020).
- Usoro, J., Sturgill, B., Musselman, K., Capadona, J. R., Pancrazio, J. J. On the definition of 'chronic' for intracortical microelectrode array applications. Micromachines. 12 (8), 972 (2021).
- Thompson, C. H., Saxena, A., Heelan, N., Salatino, J., Purcell, E. K. Spatiotemporal patterns of gene expression around implanted silicon electrode arrays. Journal of Neural Engineering. 18 (4), 1741 (2021).
- Golabchi, A., Woeppel, K. M., Li, X., Lagenaur, C. F., Cui, X. T. Neuroadhesive protein coating improves the chronic performance of neuroelectronics in mouse brain. Biosensors and Bioelectronics. 155, 112096 (2020).
- Zheng, X. S., et al. A superoxide scavenging coating for improving tissue response to neural implants. Acta Biomaterialia. 99, 72-83 (2019).
- Lee, H. C., et al. Foreign body response to intracortical microelectrodes is not altered with dip-coating of Polyethylene Glycol (PEG). Frontiers in Neuroscience. 11, 513 (2017).
- Boehler, C., et al. Actively controlled release of Dexamethasone from neural microelectrodes in a chronic in vivo study. Biomaterials. 129, 176-187 (2017).
- Hess, A. E., et al. Development of a stimuli-responsive polymer nanocomposite toward biologically optimized, MEMS-based neural probes. Journal of Micromechanics and Microengineering. 21 (5), 054009 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены