Method Article
Perfusión pancreática normothermic ex vivo para la preservación de los aloinjertos pancreáticos antes del trasplante
En este artículo
Resumen
La perfusión con máquina normothermic ex vivo (NEVP) apenas se ha explorado para la preservación de los aloinjertos pancreáticos. Presentamos una técnica innovadora de preservación de aloinjertos pancreáticos antes del trasplante.
Resumen
El trasplante de páncreas (PTx) es un tratamiento curativo para las personas que viven con la carga de un diagnóstico de diabetes mellitus (DM). Sin embargo, debido a la escasez de órganos y al creciente número de pacientes que se incluyen en la lista de PTx, se necesitan nuevas estrategias para aumentar el número de injertos disponibles para el trasplante.
El almacenamiento estático en frío (SCS) se considera el estándar de oro para los órganos de criterios estándar. Sin embargo, los donantes de criterios estándar (SCD) se están volviendo escasos y se necesitan urgentemente nuevas estrategias que puedan aumentar la tasa de aceptación de órganos de los donantes de criterios ampliados (ECD).
La perfusión normothermic ex vivo (NEVP) es una de las estrategias que se ha vuelto cada vez más popular en las últimas dos décadas. Este método de preservación ya se ha utilizado con éxito en otros órganos (hígado, riñones y pulmones), pero se ha explorado mínimamente en el trasplante de páncreas. Los pocos artículos que describen el método para el páncreas muestran poco éxito, siendo el edema uno de los principales problemas. El siguiente manuscrito describe el exitoso método NEVP y la configuración desarrollada por nuestro grupo para perfundir el páncreas porcino.
Introducción
Según el Informe Nacional de Estadísticas de Diabetes, un total de 28.7 millones de personas en los Estados Unidos vivían con un diagnóstico de diabetes en 2019. Aproximadamente 1,8 millones de ellos tenían un diagnósticode diabetes tipo 1. El PTx es actualmente el tratamiento más eficaz y único curativo para la diabetes mellitus tipo 1 complicada2, y es un procedimiento que aumenta tanto la esperanza de vida como la calidad de vida de estos pacientes3.
El páncreas es el órgano desechado con mayor frecuencia después de la recuperación de donantes fallecidos4. Con la escasez continua de órganos y el aumento de los tiempos de lista de espera, los centros de trasplante están utilizando más injertos de páncreas de ECD, incluida la donación después de la muerte circulatoria (DCD)5. Se necesitan estrategias para preservar, perfundir, evaluar y reparar de manera segura los aloinjertos provenientes de donantes de criterios extendidos.
La NEVP ha demostrado ser exitosa en la preservación de pulmón6, hígado7,8 e injertosrenales 9,10. Sin embargo, el número de grupos que trabajan en la máquina de perfusión para el páncreas, tanto hipotérmico como normotérmico, y el número de publicaciones, son pocos y limitados debido al edema y lesión del injerto11,12,13,14.
El objetivo de este estudio es presentar un protocolo para la perfusión pancreática normotérmica ex vivo (NEVPP), utilizando un modelo porcino con el objetivo de eventualmente proporcionar una plataforma para la preservación prolongada, la evaluación de órganos y la reparación antes del trasplante. Esto permitirá a otros grupos de investigación establecer un modelo de perfusión para el estudio de los aloinjertos pancreáticos.
Protocolo
Todos los animales utilizados para este estudio recibieron atención humanitaria de acuerdo con los "Principios de cuidado de animales de laboratorio" formulados por la Sociedad Nacional de Investigación Médica y la "Guía para el cuidado de animales de laboratorio" publicada por los Institutos Nacionales de Salud, Ontario, Canadá. Todos los estudios fueron aprobados por el Comité de Cuidado de Animales del Instituto de Investigación General de Toronto.
NOTA: Este protocolo de estudio se basa en un modelo porcino. El injerto se almacena en el frío durante 2 h y luego se somete a perfusión normotérmica de la máquina durante 3 h antes del trasplante (Figura 1).
1. Animales
- Utilice cerdos Yorkshire machos (40-50 kg).
2. Obtención de órganos
NOTA: El procedimiento preoperatorio y parte del procedimiento quirúrgico son los mismos que los trabajos anteriores publicados por nuestro grupo15 y es el siguiente:
- Aloje a los cerdos en las instalaciones de investigación durante un mínimo de 7 días para permitir la aclimatación y reducir su nivel de estrés.
- Ayunar los cerdos durante un mínimo de 6 h antes de la inducción de la anestesia.
- Sedar al cerdo con una inyección intramuscular (IM) de midazolam (0,15 mg/kg), ketamina (25 mg/kg) y atropina (0,04 mg/kg).
NOTA: Esto se hace en la instalación de vivienda. - Transfiera al animal de la instalación de alojamiento a la sala de operaciones (OR), donde se realizará la recuperación del órgano.
- Coloque al cerdo en posición supina sobre la mesa de quirófano y coloque una mascarilla facial con 2 L de oxígeno y 5% de isoflurano hasta que la mandíbula esté relajada.
- Visualice las cuerdas vocales usando laringoscopio y rocíelas con lidocaína al 2% para prevenir el espasmo durante la intubación. Reemplace la máscara con oxígeno e isoflurano durante al menos 30 s antes de intentar la intubación.
- Introducir un tubo endotraqueal de 7 mm y bloquear el manguito con 5 mL de aire. Use capnometría para asegurarse de que el tubo esté en la posición correcta.
- Disminuya el gas isoflurano al 2,5%. Encienda el ventilador y configúrelo a 15-20 respiraciones/min y el volumen corriente a 10-15 mL/kg de peso corporal. Controle la frecuencia cardíaca y la saturación de oxígeno constantemente.
- Utilizando la técnica de Seldinger16, introducir un catéter de 8,5 Fr. x 10 cm en la vena yugular (derecha o izquierda).
- Use el catéter de vena yugular para iniciar una infusión de fentanilo (2.5 ml en 500 ml de Ringer) a 250 ml / h.
- Comprobar los reflejos musculares para determinar la profundidad de la anestesia. El tono de la mandíbula es el reflejo muscular más fiable 17.
NOTA: Si se observa la rigidez de los músculos mandibulares, aumente la infusión de isoflurano y/o fentanilo.
3. Procedimiento quirúrgico
- Desinfectar y cubrir el campo quirúrgico. Realice una incisión en la línea media desde la xifoidea hasta la sínfisis púbica. Extienda el campo quirúrgico con una incisión lateral izquierda para una mejor exposición.
- Diseccionar la vena cava inferior (VCI) de la aorta abdominal. Libera aún más la aorta del tejido circundante y liga las pequeñas ramas aórticas lumbares. Identificar y colocar ligaduras alrededor de ambas arterias renales.
NOTA: Las ligaduras no deben estar atadas en este momento. - Una vez que la parte posterior de la aorta esté libre, pase dos ligaduras a su alrededor. La ligadura inferior eventualmente se atará justo por encima de la bifurcación de la arteria ilíaca y la ligadura superior se atará 5 cm por encima de la corbata anterior.
- Diseccionar el hilio hepático. Ate todas las arterias lo más cerca posible del hígado. Identifique el conducto biliar común, coloque dos ligaduras cerca del hígado y divida la estructura.
- Diseccionar alrededor de la aorta pero no cortar en este punto temporal. Identifique y diseccione alrededor de la porción suprahepática de la aorta y coloque un lazo alrededor de ella.
NOTA: Las ligaduras no deben estar atadas en este momento. - Abra el saco menor para permitir que el hielo enfríe el páncreas. Movilice el páncreas lo menos posible antes de enjuagar.
- Administrar 500 UI de heparina por kg de peso del donante a través de la vía central. Espere 5 minutos y comience la recolección de sangre en bolsas de citrato, fosfato, dextrosa, solución salina, adenina, glucosa y manitol (CPD/SAG-M) usando el catéter yugular.
- Ate la ligadura aórtica inferior, canular la aorta con una línea de enrasamiento por encima del lazo de bifurcación ilíaca y asegurar la cánula con un lazo superior. Ligate ambas arterias renales.
- Ate la aorta suprahepática (pinza cruzada) una vez que se haya recolectado suficiente sangre (600 ml). Administrar 10 mL de cloruro de potasio para sacrificio.
- Inicie una descarga con la solución de preservación de la Universidad de Wisconsin (UW). Cortar una abertura en la vena porta (lo más alta posible) y cava para ventilar. Coloque hielo en la cavidad abdominal.
- Evalúe la cola del páncreas y el asa C del duodeno después de enjuagar 1 L de solución de UW. Si se lava adecuadamente, comience la disección, identifique y sujete los vasos mesentéricos. Reduzca la velocidad del lavado para el segundo litro de UW.
- Recuperar el injerto pancreático y un segmento de cava o vena ilíaca para la extensión de la vena porta.
NOTA: El injerto pancreático se extirpa con el bazo. - Coloque el órgano dentro de una bolsa de órganos que se coloca dentro de un recipiente lleno de hielo.
4. Preparación de la mesa posterior del injerto pancreático (Figura 2A)
- Retire la línea de lavado de la parte distal de la aorta y ciérrela con un lazo. Llene la bolsa de órganos con la solución restante de UW. Liberar el páncreas del tejido adherente, incluido el bazo.
- Realizar extensión de la vena porta utilizando cava o vena ilíaca previamente recuperada con 6-0 Prolene. Canular la vena porta y la aorta proximal con un reductor de 1/4 de pulgada x 3/8 pulgadas.
- Canular la parte distal del duodeno con catéter Malecot y lazo. Sujete el extremo del catéter para evitar derramar el contenido duodenal. Supervisó vasos mesentéricos con Prolene 4-0.
- Registre el peso del injerto. Mantenga el injerto en almacenamiento en frío estático (SCS) hasta el inicio del NEVPP.
5. Perfusión pancreática norterámica ex vivo (NEVPP)
NOTA: El circuito de perfusión está formado por un equipo de derivación cardiopulmonar neonatal (Figura 3).
- Conecte el tubo correspondiente al oxigenador y al reservorio venoso, así como la línea arterial a la salida del oxigenador y coloque el filtro de burbujas en su soporte. Conecte la línea de purga que va desde el filtro de burbujas hasta el depósito venoso. Abra la tapa del filtro de burbujas para dejar salir todo el aire.
- Conecte la línea venosa a la entrada del reservorio venoso. Conecte el filtro de diálisis y el tubo donde se infundirá el dializado. Conecte el sensor del medidor de flujo, las líneas de presión y la sonda de temperatura. Conecte las líneas de muestra arteriales y venosas a los puertos de muestra.
- Coloque la cámara del páncreas (Figura 3) en una mesa de Mayo e introduzca el tubo arterial y venoso a través de los orificios destinados a este propósito. Conecte y encienda la unidad de calefacción externa.
- Coloque el tubo de succión dentro de la bomba de rodillos y conecte un extremo en el tubo que sale de la cámara para recoger los fluidos, y el otro extremo al depósito venoso para recoger todas las pérdidas de órganos de perfusión.
- Conecte el tubo de oxígeno (verde) al tanque de gas que contiene la mezcla de carbogen (95% O 2/5% CO2) y el oxigenador. Conecte el tubo de la unidad de bomba del calentador al oxigenador.
- Pinza las líneas de salida arterial y venosa, así como la salida del reservorio venoso.
6. Preparación del perfusión y cebado del circuito
- Llenar el reservorio venoso con el perfusado (Tabla 1).
- Use una bomba de jeringa para la administración continua del vasodilatador (epoprostenol) a 8 ml/h en la vía arterial. Utilice una segunda bomba de jeringa para la administración continua del inhibidor enzimático directamente en el reservorio venoso (15 mg, 10 ml/h).
- Encienda la máquina cardiopulmonar (HLM) y encienda los paneles de presión, temperatura y temporizador. Encienda la bomba del calentador para calentar la solución de perfusión a 38 °C. Abra el suministro deO2/CO2 .
- Retire la abrazadera de tubo colocada en la salida del depósito venoso, encienda la bomba centrífuga y llévela hasta 1.500 rpm. Sujete el tubo, evitando el filtro arterial y libere aire del filtro arterial. Poner en cero las líneas de presión arterial y venosa.
7. Perfusión del injerto de páncreas (Figura 2B)
- Abra la bolsa de órganos donde se almacena el páncreas. Enjuague con 200 ml de albúmina a través de la cánula arterial. Retire el páncreas del hielo y colóquelo dentro de la cámara del órgano. Confirme que la arteria y el tubo venoso están libres de aire.
- Suelte la pinza del lado arterial y sujete el atajo entre el tubo arterial y venoso. Una vez que la sangre comience a salir del tubo arterial, conecte la línea a la cánula arterial. Ajuste la presión arterial a 20-25 mmHg, regulando la velocidad de la bomba centrífuga. Conecte el tubo venoso una vez que la sangre comience a salir de la cánula venosa.
- Administrar un vial de verapamilo (2,5 mg/ml) directamente en el lado arterial, cuando el páncreas esté completamente conectado y no se observen hemorragias importantes.
- Registre las presiones, el flujo arterial, la temperatura y la secreción de duodeno continuamente. Recolectar sangre, registrar el gasto duodenal cada hora y evaluar macroscópicamente cada hora para detectar edema. Registre los parámetros de perfusión y tome muestras para su análisis (muestras de gases en sangre venosas y arteriales, así como muestras de amilasa, lipasa y LDH).
- Desconecte el tubo arterial y venoso cuando termine la perfusión, retire el injerto de la cámara del órgano y enjuague con UW fría y pese. Guarde el injerto en hielo en una bolsa de órganos estéril hasta el momento del trasplante.
Resultados
Los próximos datos muestran los resultados representativos de siete experimentos utilizando un modelo de recuperación del páncreas de un donante que late el corazón. Después de la canulación de la aorta, el lavado con solución de UW y la recuperación del páncreas, los injertos se mantuvieron en SCS durante 2 h mientras se preparaban los glóbulos rojos. NEVPP se realizó en este modelo durante 3 h, lo que consideramos la menor cantidad de tiempo necesario para la perfusión si se pretende la evaluación y reparación del injerto en el futuro. Las muestras y las mediciones se registraron en puntos de tiempo cada hora. (0 = línea de base, justo después de conectar el órgano al circuito, 1 = 1 h, 2 = 2 h, 3 = 3 h).
Los injertos de páncreas se colocaron en una cámara de órganos que fue diseñada a medida para este propósito e incluye un calentador (Archivo Suplementario). El propósito de NEVPP es proporcionar un entorno fisiológico cercano para el órgano. Para este propósito, la presión arterial se estableció para permanecer entre 20-25 mmHg en todas las perfusiones. La presión y el flujo se midieron a lo largo de toda la perfusión y se mantuvieron estables (Figura 4). La actividad metabólica se estimó calculando el consumo de oxígeno del injerto utilizando la siguiente fórmula: [(pO2 art-pO2ven) * flujo / peso] (Figura 5). Las mediciones de pH, sodio, calcio y HCO3 estuvieron dentro de los valores fisiológicos durante toda la perfusión (Figura 6). Los niveles de lactato y potasio disminuyeron durante la perfusión, y alcanzaron valores cercanos a los normales a las 3 h (Figura 7). Dado que el circuito es un sistema cerrado, se espera que los niveles de amilasa y lipasa aumenten durante la perfusión (Figura 8). Sin embargo, el aumento en los niveles no parece correlacionarse con el daño al injerto (Figura 9). Se utilizó una escala semicuantitativa para calificar la necrosis grasa y del parénquima, así como la integridad de las células de los islotes. (0 - sin cambios, 1 - cambios leves, 2 - cambios moderados, 3 - cambios severos). Esto fue hecho por un patólogo ciego a los grupos experimentales, y no se observaron signos de pancreatitis.
Los aloinjertos pancreáticos se pesaron antes y después de la perfusión para evaluar el edema (Tabla 2).
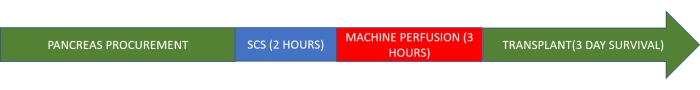
Figura 1. Protocolo de estudio. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Páncreas antes y después de la perfusión. (A) Antes de la perfusión. (B) Después de la perfusión. Haga clic aquí para ver una versión más grande de esta figura.
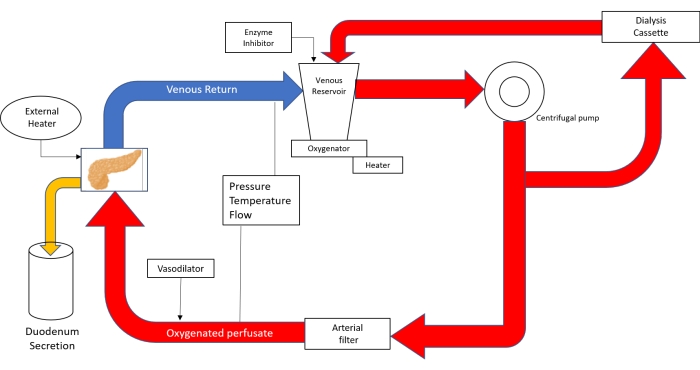
Figura 3. Dibujo esquemático del circuito de perfusión. Con el uso de la tecnología de bypass cardiopulmonar neonatal; El perfusato se vierte en el depósito venoso y luego se propulsa con la ayuda de una bomba centrífuga en el oxigenador. Después de salir del oxigenador, el circuito se divide en tubos que envían perfusto al casete de diálisis y de regreso al depósito y tubo que va al filtro arterial. Después de pasar el filtro de burbujas arterial, el perfusión se impulsa con una presión de 20-25 mmHg a través de la aorta hacia el páncreas. La salida venosa lleva a la perfusión de nuevo al reservorio venoso. (Adaptado de 18). Haga clic aquí para ver una versión más grande de esta figura.
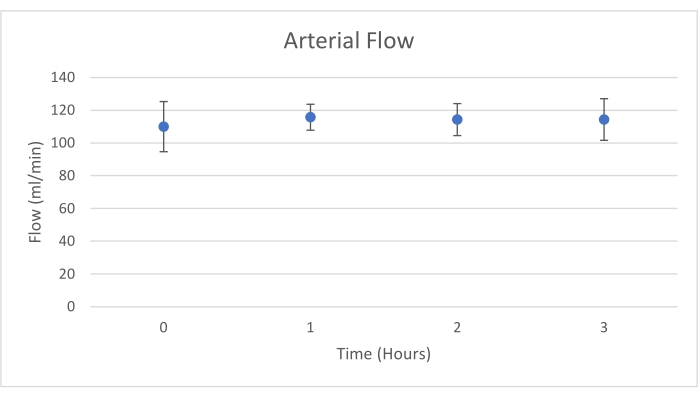
Figura 4. Flujo arterial medio con desviación estándar (ml/min). Haga clic aquí para ver una versión más grande de esta figura.
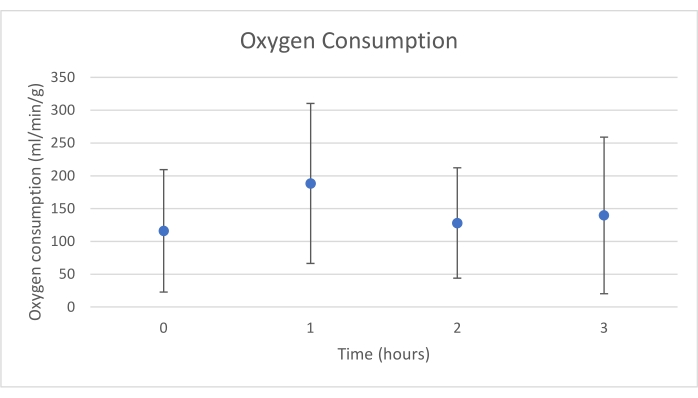
Figura 5. Consumo medio de oxígeno con desviación estándar (ml/min/g). Haga clic aquí para ver una versión más grande de esta figura.
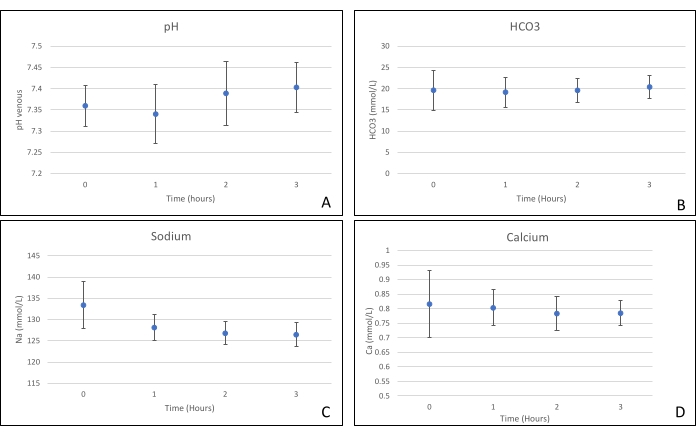
Figura 6. (A) Mediciones medias de pH, (B) HCO3, (C) sodio y (D) calcio con desviaciones estándar. Haga clic aquí para ver una versión más grande de esta figura.
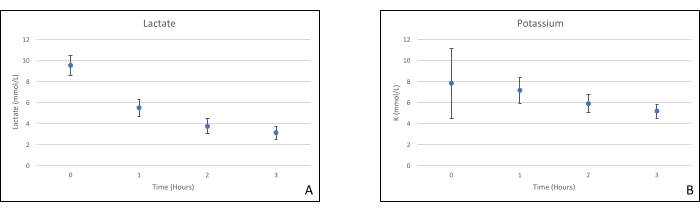
Figura 7. (A) Mediciones medias de lactato y (B) potasio con desviaciones estándar. Haga clic aquí para ver una versión más grande de esta figura.
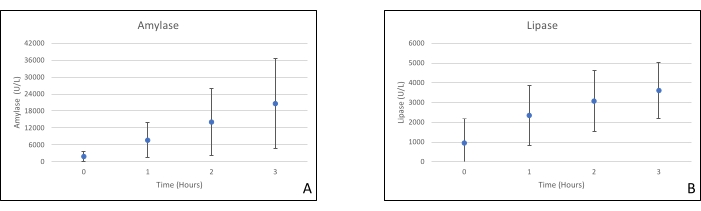
Figura 8. (A) Mediciones medias de amilasa y (B) lipasa con desviaciones estándar. Haga clic aquí para ver una versión más grande de esta figura.
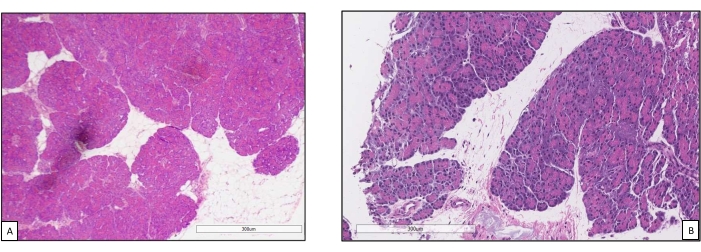
Figura 9. Biopsias básicas antes y después de la perfusión. (A) Parénquima pancreático normal antes de la perfusión de la máquina18. (B) Biopsia posterior a la perfusión con buena preservación de acinos pancreáticos y células de los islotes. Haga clic aquí para ver una versión más grande de esta figura.
| Ingrediente | Importe |
| Lactato de Ringer | 260 ml |
| Solución Steen | 195 ml |
| Eritrocitos lavados | 162.5 ml |
| Agua de ósmosis inversa doble (DRO) | 35 ml |
| Heparina (10000 UI / 10 mL) | 1,3 ml |
| Bicarbonato de sodio (8,4%) | 10,4 ml |
| Gluconato de calcio (10%) | 1,3 ml |
| Metilprednisolona (Solu-Medrol) | 325 mg |
| Aprotinina | 15 mg |
Tabla 1. Perfusar la composición.
| Peso antes | Peso después | Ganar | % de diferencia | |
| Caso 1 | 244 g | 240 g | -4 g | -1.63 |
| Caso 2 | 154 g | 164 g | 10 g | 6.49 |
| Caso 3 | 184 g | 245 g | 61 g | 33.15 |
| Caso 4 | 190 g | 226 g | 36 g | 18.94 |
| Caso 5 | 198 g | 307 g | 109 g | 55.05 |
| Caso 6 | 205 g | 315 g | 107 g | 51.44 |
| Caso 7 | 193 g | 256 g | 63 g | 32.64 |
Tabla 2. Peso antes y después de la perfusión.
Archivo suplementario: Cámara de páncreas hecha a medida para perfusión. Diseñado en colaboración con el Taller de Máquinas del Programa de Medicina de Física Médica - Medicina de Radiación en el Centro de Cáncer Princess Margaret. Haga clic aquí para descargar este archivo.
Discusión
Este estudio demuestra que se puede lograr una NEVPP estable para aloinjertos pancreáticos con daño histológico mínimo después de 3 h de perfusión con la configuración presentada anteriormente. Los parámetros de perfusión como flujo arterial, presión, pH, HCO3 y Na permanecen estables durante la perfusión, y observamos una disminución y estabilización de K y lactato.
Es de vital importancia manipular el injerto lo menos posible durante la adquisición, la preparación de la mesa posterior y la perfusión. También es muy importante mantener un control estricto de la presión arterial. Dado que el páncreas es un órgano de baja presión, un aumento en la presión puede causar daños irreversibles al órgano.
La preparación de la mesa posterior para este estudio es diferente de la preparación de injertos humanos (Figura 2A). Dado que el páncreas era el único órgano obtenido de los cerdos, pudimos tomar la porción de la aorta que incluye el tronco celíaco y la arteria mesentérica superior. En cuanto a la vena porta, se realizó una extensión con vena ilíaca. En el caso de los injertos humanos, la preparación de la mesa posterior deberá hacerse de la misma manera que se hace para el trasplante, utilizando injertos ilíacos para la reconstrucción arterial y el alargamiento portal19.
Este método puede estar limitado por la complejidad de la configuración. Decidimos agregar un casete de diálisis después de notar edema severo del injerto cuando se hizo sin él. También se construyó una cámara de órganos hecha a medida para estos experimentos que contenía una fuente de calor externa que demostró ser instrumental para la perfusión óptima de los injertos.
Hay pocos estudios que describan la perfusión pancreática normotérmica ex vivo . En la mayoría de estos estudios, el edema parece ser el principal factor limitante. Hasta donde sabemos, este método es el único informe de uso de un casete de diálisis para controlar el edema.
La perfusión normaternal ex vivo para el páncreas todavía está en su infancia en comparación con otros órganos. Los protocolos actuales se centran en donantes de criterios extendidos (DCD), mejoría de la perfusión, tiempos de perfusión más largos y biomarcadores para evaluar el daño del injerto durante la perfusión. Los niveles de amilasa y lipasa no parecen ser marcadores confiables, ya que estamos utilizando un sistema cerrado, y no parecen correlacionarse con la histopatología20. Hasta ahora, nuestro grupo también ha logrado trasplantar aloinjertos pancreáticos después de la perfusión con buenos resultados18.
Con mejoras continuas en esta tecnología, esperamos que esta tecnología sea aplicable al trasplante clínico y permita la evaluación y reparación de los aloinjertos pancreáticos. Con suerte, esto finalmente resultará en una mayor utilización del injerto, un menor tiempo de espera para los pacientes y mejores resultados para los pacientes.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Ninguno.
Materiales
| Name | Company | Catalog Number | Comments |
| Alburex 5 | CSL Behring AG | 187337 | 25 g of Albumin (human) in 500 mL of buffered diluent |
| Aprotinin from bovine lung | Sigma-Aldrich | A1153 | |
| Belzer UW Cold storage solution | Bridge to life Ltd | 4055 | |
| Calcium gluconate (10%) | Fresenius Kabi Canada Ltd (Toronto, ON) | C360019 | |
| Composelect (blood collection bags) | Fresenius Kabi Canada Ltd | PQ31555 | |
| Epoprostenol | GlaxoSmithKline Inc. | 218761 | |
| Heart lung machine, Stöckert S3 | Sorin Group Canada Inc. | Custom made | Centrifugal pump, roller pump, control panel (sensors for pressure, flow, temperature, bubbles, and level), oxygen blender, heater unit |
| Hemoflow, Fresenius Polysulfone | Fresenius Medical Care North America | 0520165A | |
| Heparin (10000 IU/10 mL) | Fresenius Kabi Canada Ltd | C504710 | |
| Lactated Ringer's solution | Baxter | JB2324 | |
| Neonatal cardiopulmonary bypass techonolgy | Sorin Group Canada Inc | Custom made | Dideco perfusion tubing systems, centrifugal blood pump (Revolution), arterial blood filter, microporous hollow fibre memebrane oxygenator), cannulas |
| Pancreas chamber | Custom made | With external heater | |
| Percutaneous Sheath Introducer Set with Integral Hemostasis Valve/side Port for use with 7-7.5 Fr Catheters | Arrow International LLC | SI-09880 | |
| Sodium bicarbonate (8.4%) | Fresenius Kabi Canada Ltd | C908950 | |
| Solu-Medrol | Pfizer Canada Inc. | 52246-14-2 | |
| Steen | XVIVO | 19004 | |
| Urethral catheter | Bard Inc | 86020 | 20 Fr, malecot model drain |
| Verapamil | Sandoz Canada Inc. | 8960 |
Referencias
- . National Diabetes Statistics Report | Diabetes | CDC Available from: https://www.cdc.gov/diabetes/data/statistics-report/index.html (2022)
- Shyr, Y. M., Wang, S. E., Chen, S. C., Shyr, B. U. Reappraisal of pancreas transplantation. Journal of the Chinese Medical Association JCMA. 82 (7), 531-534 (2019).
- Dholakia, S., et al. Pancreas transplantation: past, present, future. American Journal of Medicine. 129 (7), 667-673 (2016).
- Johnson, P., Sharples, E., Sinha, S., Friend, P. J. Pancreas and islet transplantation: pancreas and islet transplantation in diabetes mellitus. Transplantation Surgery. , 205-217 (2021).
- Kopp, W. H., et al. Pancreas transplantation with grafts from donors deceased after circulatory death: 5 years single-center experience. Transplantation. 102 (2), 333-339 (2018).
- Cypel, M., et al. Normothermic ex vivo lung perfusion in clinical lung transplantation. The New England Journal of Medicine. 364 (15), 1431-1440 (2011).
- Nasralla, D., et al. A randomized trial of normothermic preservation in liver transplantation. Nature. 557 (7703), 50-56 (2018).
- Selzner, M., et al. Normothermic ex vivo liver perfusion using steen solution as perfusate for human liver transplantation: First North American results. Liver Transplantation: Official Publication of the American Association for the Study of Liver Diseases and the International Liver Transplantation Society. 22 (11), 1501-1508 (2016).
- Hosgood, S. A., Thompson, E., Moore, T., Wilson, C. H., Nicholson, M. L. Normothermic machine perfusion for the assessment and transplantation of declined human kidneys from donation after circulatory death donors. The British Journal of Surgery. 105 (4), 388-394 (2018).
- Urbanellis, P., et al. Normothermic ex vivo kidney perfusion improves early dcd graft function compared with hypothermic machine perfusion and static cold storage. Transplantation. 104 (5), 947-955 (2020).
- Barlow, A. D., et al. Use of ex vivo normothermic perfusion for quality assessment of discarded human donor pancreases. American Journal of Transplantation: Official Journal of the American Society of Transplantation and the American Society of Transplant Surgeons. 15 (9), 2475-2482 (2015).
- Kumar, R., et al. Ex vivo normothermic porcine pancreas: A physiological model for preservation and transplant study. International journal of surgery. 54, 206-215 (2018).
- Hamaoui, K., et al. Development of pancreatic machine perfusion: translational steps from porcine to human models. The Journal of Surgical Research. 223, 263-274 (2018).
- Prudhomme, T., et al. Successful pancreas allotransplantations after hypothermic machine perfusion in a novel diabetic porcine model: a controlled study. Transplant International: Official Journal of the European Society for Organ Transplantation. 34 (2), 353-364 (2021).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for the preservation of kidney grafts prior to transplantation. Journal of Visualized Experiments: JoVE. (101), e353 (2015).
- Graham, A. S., Ozment, C., Tegtmeyer, K., Lai, S., Braner, D. A. V. Central venous catheterization. The New England Journal of Medicine. 356 (21), 21 (2009).
- Swindle, M. M. . Swine in the Laboratory Surgery, Anesthesia, Imaging, and Experimental Techniques. , (2015).
- Mazilescu, L. I., et al. Normothermic ex situ pancreas perfusion for the preservation of porcine pancreas grafts. American Journal of Transplantation. , (2022).
- Fridell, J. A., et al. Preparation of the pancreas allograft for transplantation. Clinical transplantation. 25 (2), (2011).
- Nassar, A., Liu, Q., Walsh, M., Quintini, C. Normothermic ex vivo perfusion of discarded human pancreas. Artificial Organs. 42 (3), 334-335 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados