Method Article
זילוח לבלב Normothermic Ex Vivo לשימור אלושתלי לבלב לפני השתלה
In This Article
Summary
זילוח מכונת Normothermic ex vivo (NEVP) כמעט ולא נחקר לשימור אלושתלי לבלב. אנו מציגים טכניקת שימור חדשנית לאלושתלי לבלב לפני ההשתלה.
Abstract
השתלת לבלב (PTx) היא טיפול מרפא לאנשים החיים עם הנטל של אבחנה של סוכרת (DM). עם זאת, בשל מחסור באיברים ומספר גדל והולך של חולים הרשומים עבור PTx, יש צורך באסטרטגיות חדשות כדי להגדיל את מספר השתלים הזמינים להשתלה.
אחסון קר סטטי (SCS) נחשב לתקן הזהב עבור איברים סטנדרטיים קריטריונים. עם זאת, תורמי קריטריונים סטנדרטיים (SCD) הופכים נדירים ויש צורך דחוף באסטרטגיות חדשות שיכולות להגדיל את שיעור קבלת האיברים מתורמי קריטריונים מורחבים (ECD).
זילוח Normothermic ex vivo (NEVP) היא אחת האסטרטגיות שהפכו פופולריות יותר ויותר במהלך שני העשורים האחרונים. שיטת שימור זו כבר שימשה בהצלחה באיברים אחרים (כבד, כליות וריאות) אך נחקרה באופן מינימלי בהשתלת לבלב. המאמרים המעטים המתארים את השיטה ללבלב מראים הצלחה מועטה, בצקת היא אחת הבעיות העיקריות. כתב היד הבא מתאר את שיטת NEVP המוצלחת ואת ההתקנה שפותחה על ידי הקבוצה שלנו כדי לנקב לבלב חזירים.
Introduction
על פי הדו"ח הלאומי לסטטיסטיקה של סוכרת, סך של 28.7 מיליון אנשים בארצות הברית חיו עם אבחנה של סוכרת בשנת 2019. כ-1.8 מיליון מתוכם אובחנו עם סוכרת מסוג1. PTx הוא כיום הטיפול המרפא היעיל ביותר והיחיד לסוכרת מסובכת מסוג 1 מליטוס2, והוא הליך שגם מעלה את תוחלת החיים וגם את איכות החיים של חולים אלה3.
הלבלב הוא האיבר המושלך לרוב לאחר שליפה מתורמים שנפטרו4. עם מחסור מתמשך באיברים וזמני רשימת ההמתנה המתארכים, מרכזי השתלות משתמשים ביותר שתלי לבלב מ- ECD, כולל תרומה לאחר מוות במחזור הדם (DCD)5. יש צורך באסטרטגיות לשימור, ניקוב, הערכה ותיקון בטוחים של אלושתלים המגיעים מתורמים בעלי קריטריונים מורחבים.
NEVP הוכיח הצלחה בשימור ריאות6, כבד 7,8, והשתלות כליה 9,10. עם זאת, מספר הקבוצות העובדות על זילוח מכונה ללבלב, הן היפותרמית והן נורמותרמית, ומספר הפרסומים, הם מעטים ומוגבלים עקב בצקת השתל ופציעה11,12,13,14.
מטרת מחקר זה היא להציג פרוטוקול לזילוח לבלב נורמותרמי ex vivo (NEVPP), תוך שימוש במודל חזירי במטרה לספק בסופו של דבר פלטפורמה לשימור ממושך, הערכת איברים ותיקון לפני השתלה. זה יאפשר לקבוצות מחקר אחרות להקים מודל זילוח לחקר allografts הלבלב.
Protocol
כל בעלי החיים ששימשו למחקר זה קיבלו טיפול הומני בהתאם ל"עקרונות הטיפול בחיות מעבדה" שנוסחו על ידי האגודה הלאומית למחקר רפואי ו"המדריך לטיפול בחיות מעבדה" שפורסם על ידי המכונים הלאומיים לבריאות, אונטריו, קנדה. כל המחקרים אושרו על ידי הוועדה לטיפול בבעלי חיים של מכון המחקר הכללי של טורונטו.
הערה: פרוטוקול מחקר זה מבוסס על מודל חזירי. השתל מאוחסן בקור במשך שעתיים ולאחר מכן עובר זילוח מכונה נורמותרמית במשך 3 שעות לפני ההשתלה (איור 1).
1. בעלי חיים
- השתמש חזירי יורקשייר זכר (40-50 ק"ג).
2. רכישת איברים
הערה: ההליך שלפני הניתוח וחלק מההליך הכירורגי זהים למאמרים קודמים שפורסמו על ידי קבוצה15 שלנו והוא כדלקמן:
- אחסן את החזירים במתקן המחקר למשך 7 ימים לפחות כדי לאפשר התאקלמות ולהפחית את רמת הלחץ שלהם.
- צום את החזירים במשך מינימום של 6 שעות לפני השראת ההרדמה.
- הרגיעו את החזיר בזריקה תוך שרירית (IM) של מידזולאם (0.15 מ"ג/ק"ג), קטמין (25 מ"ג/ק"ג) ואטרופין (0.04 מ"ג/ק"ג).
הערה: זה נעשה במתקן הדיור. - העבר את בעל החיים ממתקן הדיור לחדר ניתוח (OR), שם תבוצע התאוששות האיבר.
- מקמו את החזיר במצב שכיבה על שולחן OR והניחו מסכת פנים עם 2 ליטר חמצן ו-5% איזופלורן עד שהלסת רגועה.
- דמיינו את מיתרי הקול באמצעות לרינגוסקופ ורססו אותם בלידוקאין 2% כדי למנוע עווית במהלך אינטובציה. יש להחליף את המסכה בחמצן ובאיזופלורן למשך 30 שניות לפחות לפני שתנסו לבצע אינטובציה.
- הציגו צינור אנדוטרכאלי 7 מ"מ וחסמו את השרוול עם 5 מ"ל אוויר. השתמש בקנומטריה כדי להבטיח שהצינור נמצא במיקום הנכון.
- להפחית את גז isoflurane ל 2.5%. הפעל את מכונת ההנשמה והגדר אותה ל 15-20 נשימות / דקה ואת נפח הגאות ל 10-15 מ"ל / ק"ג משקל גוף. עקוב אחר קצב הלב וריווי החמצן כל הזמן.
- באמצעות טכניקת סלדינגר 16, להחדיר קטטר 8.5 Fr. x10 ס"מ לתוך וריד הצוואר (מימין או משמאל).
- השתמש בצנתר הווריד הצווארי כדי להתחיל עירוי של פנטניל (2.5 מ"ל ב 500 מ"ל של רינגר) ב 250 מ"ל / שעה.
- בדוק רפלקסים שריריים כדי לקבוע את עומק ההרדמה. טונוס הלסת הוא רפלקס השרירים האמין ביותר 17.
הערה: אם מציינים את הנוקשות של שרירי המנדיבולרית, יש להגביר את עירוי האיזופלורן ו/או פנטניל.
3. הליך כירורגי
- לחטא ולכסות את שדה הניתוח. בצע חתך קו אמצע מן xyphoid לסימפיזת הערווה. הרחבת שדה הניתוח עם חתך צדדי שמאלי לחשיפה טובה יותר.
- נתחו את הווריד הנבוב התחתון (IVC) מאבי העורקים הבטני. שחררו עוד יותר את אבי העורקים מהרקמה שמסביב וקשרו את ענפי אבי העורקים המותניים הקטנים. לזהות ולמקם ליגטורות סביב שני עורקי הכליה.
הערה: אין לקשור את הליגטורות בנקודת זמן זו. - ברגע שהחלק האחורי של אבי העורקים פנוי, העבירו שתי ליגטורות סביבו. הליגטורה התחתונה תיקשר בסופו של דבר ממש מעל הביפורקציה של העורק האיליאק והליגטורה העליונה תיקשר 5 ס"מ מעל העניבה הקודמת.
- לנתח את הילום הכבד. קשרו את כל העורקים קרוב ככל האפשר לכבד. זהה את צינור המרה המשותף, מקם שתי ליגטורות קרוב לכבד וחלק את המבנה.
- יש לנתח סביב אבי העורקים אך לא לחתוך בנקודת זמן זו. לזהות ולנתח סביב החלק העל-כבד של אבי העורקים ולהניח עניבה סביבו.
הערה: אין לקשור את הליגטורות בנקודת זמן זו. - פתחו את השק הקטן כדי לאפשר לקרח לקרר את הלבלב. גייסו את הלבלב כמה שפחות לפני השטיפה.
- יש לתת 500 IU של הפרין לכל ק"ג של משקל התורם דרך הקו המרכזי. יש להמתין 5 דקות ולהתחיל באיסוף דם בשקיות ציטראט, פוספט, דקסטרוז, מי מלח, אדנין, גלוקוז ומניטול (CPD/SAG-M) באמצעות הצנתר הצווארי.
- קשרו את ליגטורת אבי העורקים התחתונה, קשרו את אבי העורקים עם קו סומק מעל קשר הביפורקציה האיליאקית, ואבטחו את הצינורית עם עניבה עליונה. לקשור את שני עורקי הכליה.
- לקשור את אבי העורקים suprahepatic (crossclamp) לאחר מספיק דם נאסף (600 מ"ל). לנהל 10 מ"ל של אשלגן כלורי להקרבה.
- התחל סומק עם פתרון שימור אוניברסיטת ויסקונסין (UW). חותכים פתח בווריד הפורטל (גבוה ככל האפשר) וקאווה לאוורור. מניחים קרח בחלל הבטן.
- הערך את זנב הלבלב ואת לולאת C התריסריון לאחר שטיפה של 1 ליטר של תמיסת UW. אם יש צורך בשטיפה מספקת, יש להתחיל בנתיחה, לזהות ולהדק כלי דם מזנטריים. להאט את השטיפה עבור הליטר השני של UW.
- אחזר את שתל הלבלב ומקטע של קאווה או וריד iliac להרחבה של וריד פורטלי.
הערה: שתל הלבלב מוסר עם הטחול. - הניחו את האיבר בתוך שקית איברים המונחת בתוך אגן מלא קרח.
4. הכנת השולחן האחורי של שתל הלבלב (איור 2A)
- מוציאים את קו ההדחה מהחלק הדיסטלי של אבי העורקים וסוגרים עם עניבה. מלא את שקית האיברים בתמיסת UW שנותרה. שחררו את הלבלב מרקמה דבקה, כולל הטחול.
- בצע הארכת ורידים פורטליים באמצעות קאווה או וריד איליאק שהתאוששו בעבר עם 6-0 Prolene. קנטר את הווריד הפורטלי ואת אבי העורקים הפרוקסימלי עם 1/4 ב x 3/8 ב reducer.
- לערבב את החלק הדיסטלי של התריסריון עם קטטר Malecot ועניבה. הדקו את קצה הצנתר כדי למנוע שפיכה של תוכן התריסריון. פיקח על כלי mesenteric עם 4-0 Prolene.
- רשום את משקל השתל. שמור את השתל באחסון קר סטטי (SCS) עד תחילת ה- NEVPP.
5. זילוח לבלב Normothermic ex vivo (NEVPP)
הערה: מעגל הזילוח עשוי מציוד מעקף לב ריאה בילוד (איור 3).
- חבר את הצינור המתאים למחמצן ולמאגר הוורידי, כמו גם את קו העורקים ליציאת המחמצן ומקם את מסנן הבועות במחזיקו. חברו את קו הטיהור שעובר ממסנן הבועות למאגר הוורידי. פתחו את מכסה מסנן הבועות כדי לאפשר לכל האוויר לצאת.
- חבר את הקו הוורידי לכניסת המאגר הוורידי. חברו את מסנן הדיאליזה והצנרת שבה יוחדר הדיאליזה. חבר את חיישן מד הזרימה, קווי הלחץ ובדיקת הטמפרטורה. חבר את קווי הדגימה העורקיים והוורידיים ליציאות הדגימה.
- הניחו את תא הלבלב (איור 3) על שולחן מאיו והכניסו את הצינורית העורקית והוורידית דרך החורים המיועדים למטרה זו. חבר והפעל את יחידת החימום החיצונית.
- הניחו את צינור היניקה בתוך משאבת הגלילה וחברו קצה אחד לצינור היוצא מהחדר כדי לאסוף את הנוזלים, ואת הקצה השני למאגר הוורידי כדי לאסוף את כל איברי הפרבוסט.
- חבר את צינור החמצן (ירוק) למיכל הגז המכיל את תערובת הקרבוגן (95% O 2/5% CO2) ולמחמצן. חבר את צינור יחידת משאבת החימום למחמצן.
- מהדק קווי זרימה עורקיים וורידיים, כמו גם את זרימת המאגר הוורידי.
6. הכנת הפרבוסט והפריימינג של המעגל
- מלאו את המכל הוורידי בפרבוסט (טבלה 1).
- השתמש משאבת מזרק אחת לניהול רציף של מרחיב כלי הדם (epoprostenol) ב 8 מ"ל / שעה לתוך קו העורק. השתמש במשאבת מזרק שנייה לניהול רציף של מעכב האנזים ישירות לתוך המאגר הוורידי (15 מ"ג, 10 מ"ל / שעה).
- הפעל את מכונת הלב ריאה (HLM) והפעל את לוחות הלחץ, הטמפרטורה והטיימר. הפעל את משאבת החימום כדי לחמם את תמיסת הזילוח ל -38 מעלות צלזיוס. פתח את אספקת O 2/CO2.
- הסר את מהדק הצינור שהונח על זרימת המאגר הוורידי, הפעל את המשאבה הצנטריפוגלית וקח אותה עד 1,500 סל"ד. מהדקים את הצינור, עוקפים את מסנן העורקים ומשחררים אוויר מהמסנן העורקי. אפס את קווי הלחץ העורקי והוורידי.
7. זילוח שתל לבלב (איור 2B)
- פתח את שקית האיברים שבה מאוחסן הלבלב. סומק עם 200 מ"ל של אלבומין דרך צינורית העורק. הסר את הלבלב מן הקרח ומיקום בתוך תא האיברים. יש לוודא שהעורקי והצנרת הוורידית נטולי אוויר.
- שחררו מהדק מהצד העורקי ומהדקים את קיצור הדרך בין הצינור העורקי לווריד. ברגע שהדם מתחיל לצאת מצינורית העורקים, חברו את הקו לצינורית העורקית. הגדר את לחץ העורקים ל 20-25 מ"מ כספית, על ידי ויסות מהירות המשאבה הצנטריפוגלית. חברו את הצינורית הוורידית ברגע שהדם מתחיל לצאת מהצינורית הוורידית.
- יש לתת בקבוקון אחד של וראפמיל (2.5 מ"ג/מ"ל) ישירות בצד העורקי, כאשר הלבלב מחובר לחלוטין ולא נצפים דימומים משמעותיים.
- רישום לחצים, זרימת עורקים, טמפרטורה והפרשת תריסריון באופן רציף. לאסוף דם, לרשום תפוקת התריסריון כל שעה, ולהעריך מדי שעה מקרוסקופית בצקת. רשום את פרמטרי הזילוח וקח דגימות לניתוח (דגימות גז דם ורידי ועורקי, כמו גם דגימות לעמילאז, ליפאז ו- LDH).
- נתקו את צינורות העורקים והוורידים עם סיום הזילוח, הסירו את השתל מחדר האיברים, שטפו בקור ושקילו. אחסנו את השתל על קרח בשקית איברים סטרילית עד לרגע ההשתלה.
תוצאות
הנתונים הקרובים מציגים את התוצאות המייצגות של שבעה ניסויים באמצעות מודל של שאיבת לבלב תורם פועם. לאחר קנולציה של אבי העורקים, סומק עם תמיסת UW, ושליפת הלבלב, השתלים נשמרו על SCS במשך 2 שעות בזמן שתאי הדם האדומים היו מוכנים. NEVPP בוצע במודל זה במשך 3 שעות, מה שחשבנו כפרק הזמן הנמוך ביותר הדרוש לזילוח אם הערכה ותיקון השתל מיועדים בעתיד. דגימות ומדידות נרשמו בנקודות זמן לפי שעה. (0 = קו בסיס, מיד לאחר חיבור האיבר למעגל, 1 = 1 שעות, 2 = 2 שעות, 3 = 3 שעות).
שתלי לבלב הונחו על תא איבר שתוכנן במיוחד למטרה זו וכולל תנור חימום (קובץ משלים). מטרת NEVPP היא לספק סביבה פיזיולוגית קרובה לאיבר. לשם כך, לחץ העורקים נקבע להישאר בין 20-25 מ"מ כספית בכל הזילוח. הלחץ והזרימה נמדדו לאורך כל הזילוח ונשארו יציבים (איור 4). הפעילות המטבולית הוערכה על ידי חישוב צריכת החמצן של השתל באמצעות הנוסחה הבאה: [(pO 2 art-pO2ven) *זרימה / משקל] (איור 5). מדידות של pH, נתרן, סידן ו-HCO3 היו בתוך ערכים פיזיולוגיים במהלך כל הזילוח (איור 6). רמות הלקטט והאשלגן ירדו במהלך הזילוח, והשיגו ערכים קרובים לנורמליים לאחר 3 שעות (איור 7). מאחר שהמעגל הוא מערכת סגורה, רמות העמילאז והליפאז צפויות לעלות במהלך הזילוח (איור 8). עם זאת, נראה כי העלייה ברמות אינה מתואמת עם הנזק לשתל (איור 9). סולם כמותי למחצה שימש לציון נמק שומן ופרנכימה וכן לשלמות תאי איון. (0 - אין שינויים, 1 - שינויים קלים, 2 - שינויים מתונים, 3 - שינויים חמורים). זה נעשה על ידי פתולוג עיוור לקבוצות הניסוי, ולא נצפו סימנים של דלקת הלבלב.
אלושתלי לבלב נשקלו לפני ואחרי זילוח כדי להעריך בצקת (טבלה 2).
איור 1. פרוטוקול המחקר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2. לבלב לפני ואחרי זילוח. (א) לפני הזילוח. (ב) לאחר זילוח. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
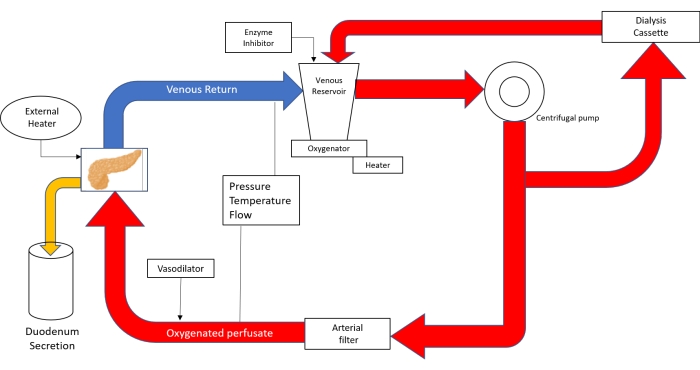
איור 3. שרטוט סכמטי של מעגל הזלוף. עם שימוש בטכנולוגיית מעקף לב ריאה בילוד; את הפרפוזט שופכים לתוך המאגר הוורידי ואז מונעים בעזרת משאבה צנטריפוגלית לתוך המחמצן. לאחר עזיבת המחמצן, המעגל מתחלק לצינורות ששולחים פרבוסט לקלטת הדיאליזה ובחזרה למאגר ולצינורות שהולכים לפילטר העורקי. לאחר שעבר את מסנן הבועות העורקי, הפרפוזט מונע בלחץ של 20-25 מ"מ כספית דרך אבי העורקים לתוך הלבלב. הזרימה הוורידית מובילה את הפרבוסט חזרה למאגר הוורידי. (מעובד מ-18). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
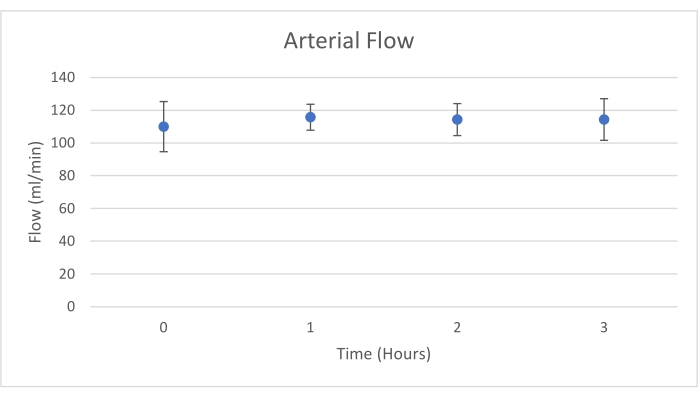
איור 4. זרימה עורקית ממוצעת עם סטיית תקן (מ"ל/דקה). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
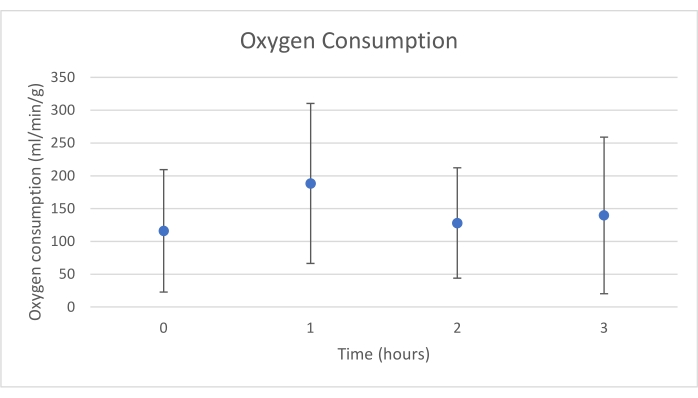
איור 5. צריכת חמצן ממוצעת עם סטיית תקן (מ"ל/דקה/גרם). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
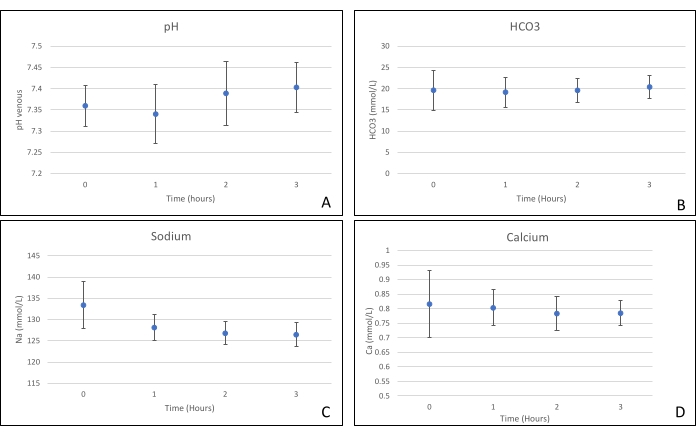
איור 6. (A) ממוצע pH, (b) hco3, (C) נתרן, ו-(D) מדידות סידן עם סטיות תקן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
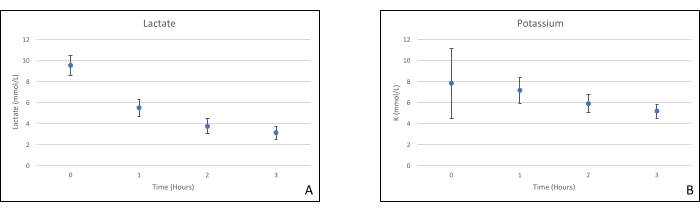
איור 7. (A) ממוצע לקטט ו-(B) מדידות אשלגן עם סטיות תקן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
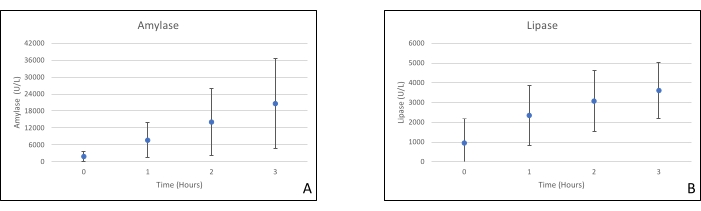
איור 8. (A) ממוצע עמילאז ו-(B) מדידות ליפאז עם סטיות תקן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
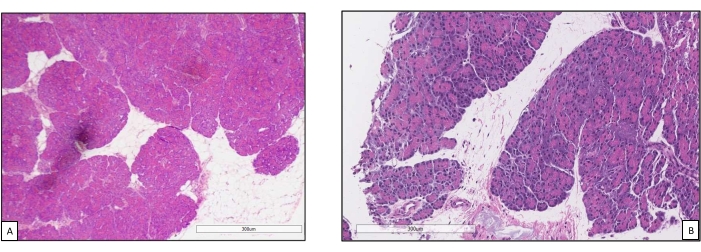
איור 9. ביופסיות ליבה לפני ואחרי זילוח. (A) פרנכימה תקינה של הלבלב לפני זילוח המכונה18. (B) ביופסיה לאחר זילוח עם שימור טוב של אסיני הלבלב ותאי איון. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| מרכיב | כמות |
| לקטט של רינגר | 260 מ"ל |
| פתרון Steen | 195 מ"ל |
| אריתרוציטים שטופים | 162.5 מ"ל |
| מי אוסמוזה הפוכה כפולה (DRO) | 35 מ"ל |
| הפרין (10000 יחב"ל / 10 מ"ל) | 1.3 מ"ל |
| סודיום ביקרבונט (8.4%) | 10.4 מ"ל |
| סידן גלוקונאט (10%) | 1.3 מ"ל |
| מטילפרדניזולון (סולו-מדרול) | 325 מ"ג |
| אפרוטינין | 15 מ"ג |
טבלה 1. הרכב פרפשט.
| משקל לפני | משקל אחרי | לקבל | % הבדל | |
| מקרה 1 | 244 גרם | 240 גרם | -4 גרם | -1.63 |
| מקרה 2 | 154 גרם | 164 גרם | 10 גרם | 6.49 |
| מקרה 3 | 184 גרם | 245 גרם | 61 גרם | 33.15 |
| מקרה 4 | 190 גרם | 226 גרם | 36 גרם | 18.94 |
| מקרה 5 | 198 גרם | 307 גרם | 109 גרם | 55.05 |
| מקרה 6 | 205 גרם | 315 גרם | 107 גרם | 51.44 |
| מקרה 7 | 193 גרם | 256 גרם | 63 גרם | 32.64 |
טבלה 2. משקל לפני ואחרי זילוח.
קובץ משלים: תא לבלב בהתאמה אישית לזילוח. תוכנן בשיתוף פעולה עם חנות המכונות של התוכנית לפיזיקה רפואית - רפואת קרינה במרכז הסרטן על שם הנסיכה מרגרט. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
מחקר זה מדגים כי ניתן להשיג NEVPP יציב עבור אלושתלי לבלב עם נזק היסטולוגי מינימלי לאחר 3 שעות של זילוח עם ההתקנה שהוצגה קודם לכן. פרמטרים של זילוח כמו זרימת עורקים, לחץ, pH, HCO3 ו-Na נשארים יציבים במהלך הזילוח, וראינו ירידה וייצוב של K ולקטט.
יש חשיבות קריטית לתפעל את השתל כמה שפחות במהלך הרכש, הכנת השולחן האחורי והזילוח. כמו כן, חשוב מאוד לשמור על שליטה הדוקה של לחץ העורק. מכיוון שהלבלב הוא איבר בלחץ נמוך, עלייה בלחץ עלולה לגרום נזק בלתי הפיך לאיבר.
הכנת שולחן אחורי למחקר זה שונה מהכנת שתלים אנושיים (איור 2A). מכיוון שהלבלב היה האיבר היחיד שנרכש מהחזירים, יכולנו לקחת את החלק של אבי העורקים הכולל את גזע הצליאק ואת העורק המזנטרי העליון. באשר לווריד הפורטל, בוצעה הרחבה באמצעות וריד iliac. במקרה של שתלים אנושיים, הכנת השולחן האחורי תצטרך להיעשות באותו אופן שבו היא נעשית להשתלה, באמצעות שתלים איליאקים לשחזור עורקים והארכת שער19.
שיטה זו עשויה להיות מוגבלת על-ידי מורכבות ההתקנה. החלטנו להוסיף קלטת דיאליזה לאחר ששמנו לב לבצקת קשה של השתל כאשר נעשה בלעדיו. עבור ניסויים אלה נבנה גם תא עוגב בהתאמה אישית, שהכיל מקור חימום חיצוני שהוכח כחיוני לזילוח אופטימלי של השתלים.
ישנם מעט מחקרים המתארים זילוח לבלב נורמותרמי ex vivo . ברוב המחקרים הללו, בצקת נראית כגורם המגביל העיקרי. למיטב ידיעתנו, שיטה זו היא הדיווח היחיד על שימוש בקלטת דיאליזה להדברת בצקת.
זילוח Normothermic ex vivo ללבלב עדיין בחיתוליו בהשוואה לאיברים אחרים. הפרוטוקולים הנוכחיים מתמקדים בתורמי קריטריונים מורחבים (DCD), שיפור פרפוזטים, זמני זילוח ארוכים יותר וסמנים ביולוגיים להערכת נזק לשתל במהלך זילוח. רמות עמילאז וליפאז אינן נראות כסמנים אמינים, שכן אנו משתמשים במערכת סגורה, ולא נראה שהן מתואמות להיסטופתולוגיה20. עד כה, הקבוצה שלנו הצליחה גם להשתיל allografts לבלב לאחר זילוח עם תוצאות טובות18.
עם שיפורים מתמשכים בטכנולוגיה זו, אנו מקווים שטכנולוגיה זו תהיה ישימה להשתלות קליניות ותאפשר הערכה ותיקון של אלושתלי לבלב. יש לקוות שהתוצאה תהיה בסופו של דבר ניצול רב יותר של השתלים, קיצור זמן ההמתנה לחולים ותוצאות טובות יותר למטופלים
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ללא.
Materials
| Name | Company | Catalog Number | Comments |
| Alburex 5 | CSL Behring AG | 187337 | 25 g of Albumin (human) in 500 mL of buffered diluent |
| Aprotinin from bovine lung | Sigma-Aldrich | A1153 | |
| Belzer UW Cold storage solution | Bridge to life Ltd | 4055 | |
| Calcium gluconate (10%) | Fresenius Kabi Canada Ltd (Toronto, ON) | C360019 | |
| Composelect (blood collection bags) | Fresenius Kabi Canada Ltd | PQ31555 | |
| Epoprostenol | GlaxoSmithKline Inc. | 218761 | |
| Heart lung machine, Stöckert S3 | Sorin Group Canada Inc. | Custom made | Centrifugal pump, roller pump, control panel (sensors for pressure, flow, temperature, bubbles, and level), oxygen blender, heater unit |
| Hemoflow, Fresenius Polysulfone | Fresenius Medical Care North America | 0520165A | |
| Heparin (10000 IU/10 mL) | Fresenius Kabi Canada Ltd | C504710 | |
| Lactated Ringer's solution | Baxter | JB2324 | |
| Neonatal cardiopulmonary bypass techonolgy | Sorin Group Canada Inc | Custom made | Dideco perfusion tubing systems, centrifugal blood pump (Revolution), arterial blood filter, microporous hollow fibre memebrane oxygenator), cannulas |
| Pancreas chamber | Custom made | With external heater | |
| Percutaneous Sheath Introducer Set with Integral Hemostasis Valve/side Port for use with 7-7.5 Fr Catheters | Arrow International LLC | SI-09880 | |
| Sodium bicarbonate (8.4%) | Fresenius Kabi Canada Ltd | C908950 | |
| Solu-Medrol | Pfizer Canada Inc. | 52246-14-2 | |
| Steen | XVIVO | 19004 | |
| Urethral catheter | Bard Inc | 86020 | 20 Fr, malecot model drain |
| Verapamil | Sandoz Canada Inc. | 8960 |
References
- . National Diabetes Statistics Report | Diabetes | CDC Available from: https://www.cdc.gov/diabetes/data/statistics-report/index.html (2022)
- Shyr, Y. M., Wang, S. E., Chen, S. C., Shyr, B. U. Reappraisal of pancreas transplantation. Journal of the Chinese Medical Association JCMA. 82 (7), 531-534 (2019).
- Dholakia, S., et al. Pancreas transplantation: past, present, future. American Journal of Medicine. 129 (7), 667-673 (2016).
- Johnson, P., Sharples, E., Sinha, S., Friend, P. J. Pancreas and islet transplantation: pancreas and islet transplantation in diabetes mellitus. Transplantation Surgery. , 205-217 (2021).
- Kopp, W. H., et al. Pancreas transplantation with grafts from donors deceased after circulatory death: 5 years single-center experience. Transplantation. 102 (2), 333-339 (2018).
- Cypel, M., et al. Normothermic ex vivo lung perfusion in clinical lung transplantation. The New England Journal of Medicine. 364 (15), 1431-1440 (2011).
- Nasralla, D., et al. A randomized trial of normothermic preservation in liver transplantation. Nature. 557 (7703), 50-56 (2018).
- Selzner, M., et al. Normothermic ex vivo liver perfusion using steen solution as perfusate for human liver transplantation: First North American results. Liver Transplantation: Official Publication of the American Association for the Study of Liver Diseases and the International Liver Transplantation Society. 22 (11), 1501-1508 (2016).
- Hosgood, S. A., Thompson, E., Moore, T., Wilson, C. H., Nicholson, M. L. Normothermic machine perfusion for the assessment and transplantation of declined human kidneys from donation after circulatory death donors. The British Journal of Surgery. 105 (4), 388-394 (2018).
- Urbanellis, P., et al. Normothermic ex vivo kidney perfusion improves early dcd graft function compared with hypothermic machine perfusion and static cold storage. Transplantation. 104 (5), 947-955 (2020).
- Barlow, A. D., et al. Use of ex vivo normothermic perfusion for quality assessment of discarded human donor pancreases. American Journal of Transplantation: Official Journal of the American Society of Transplantation and the American Society of Transplant Surgeons. 15 (9), 2475-2482 (2015).
- Kumar, R., et al. Ex vivo normothermic porcine pancreas: A physiological model for preservation and transplant study. International journal of surgery. 54, 206-215 (2018).
- Hamaoui, K., et al. Development of pancreatic machine perfusion: translational steps from porcine to human models. The Journal of Surgical Research. 223, 263-274 (2018).
- Prudhomme, T., et al. Successful pancreas allotransplantations after hypothermic machine perfusion in a novel diabetic porcine model: a controlled study. Transplant International: Official Journal of the European Society for Organ Transplantation. 34 (2), 353-364 (2021).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for the preservation of kidney grafts prior to transplantation. Journal of Visualized Experiments: JoVE. (101), e353 (2015).
- Graham, A. S., Ozment, C., Tegtmeyer, K., Lai, S., Braner, D. A. V. Central venous catheterization. The New England Journal of Medicine. 356 (21), 21 (2009).
- Swindle, M. M. . Swine in the Laboratory Surgery, Anesthesia, Imaging, and Experimental Techniques. , (2015).
- Mazilescu, L. I., et al. Normothermic ex situ pancreas perfusion for the preservation of porcine pancreas grafts. American Journal of Transplantation. , (2022).
- Fridell, J. A., et al. Preparation of the pancreas allograft for transplantation. Clinical transplantation. 25 (2), (2011).
- Nassar, A., Liu, Q., Walsh, M., Quintini, C. Normothermic ex vivo perfusion of discarded human pancreas. Artificial Organs. 42 (3), 334-335 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved