Method Article
Perfusion pancréatique ex vivo normamère pour la conservation des allogreffes de pancréas avant transplantation
Dans cet article
Résumé
La perfusion machine ex vivo normamère (NEVP) n’a guère été explorée pour la préservation des allogreffes du pancréas. Nous présentons une technique innovante de conservation des allogreffes de pancréas avant transplantation.
Résumé
La transplantation du pancréas (PTx) est un traitement curatif pour les personnes qui vivent avec le fardeau d’un diagnostic de diabète sucré (DM). Cependant, en raison de la pénurie d’organes et du nombre croissant de patients inscrits pour PTx, de nouvelles stratégies sont nécessaires pour augmenter le nombre de greffons disponibles pour la transplantation.
L’entreposage frigorifique statique (SCS) est considéré comme l’étalon-or pour les organes à critères standard. Cependant, les donneurs à critères standard (SCD) se font rares et de nouvelles stratégies susceptibles d’augmenter le taux d’acceptation d’organes par des donneurs à critères étendus (DPE) sont nécessaires de toute urgence.
La perfusion ex vivo normamère (NEVP) est l’une des stratégies qui est devenue de plus en plus populaire au cours des deux dernières décennies. Cette méthode de conservation a déjà été utilisée avec succès dans d’autres organes (foie, reins et poumons), mais a été peu explorée dans la transplantation du pancréas. Les quelques articles qui décrivent la méthode pour le pancréas montrent peu de succès, l’œdème étant l’un des problèmes majeurs. Le manuscrit suivant décrit la méthode et la configuration NEVP réussies développées par notre groupe pour perfuser le pancréas porcin.
Introduction
Selon le National Diabetes Statistics Report, un total de 28,7 millions de personnes aux États-Unis vivaient avec un diagnostic de diabète en 2019. Environ 1,8 million d’entre eux avaient reçu un diagnostic de diabète de type 11. PTx est actuellement le traitement curatif le plus efficace et le seul pour le diabète sucré compliqué de type 12, et est une procédure qui augmente à la fois l’espérance de vie et la qualité de vie de ces patients3.
Le pancréas est l’organe le plus souvent jeté après prélèvement sur des donneurs décédés4. Avec les pénuries persistantes d’organes et l’augmentation des temps d’attente, les centres de transplantation utilisent davantage de greffes de pancréas provenant de DPE, y compris le don après une mort circulatoire (DCD)5. Des stratégies pour préserver, perfuser, évaluer et réparer en toute sécurité les allogreffes provenant de donneurs à critères étendus sont nécessaires.
NEVP s’est avéré efficace dans la préservation des poumons6, du foie7,8 et des greffes rénales 9,10. Cependant, le nombre de groupes travaillant sur la perfusion mécanique du pancréas, hypothermique ou normotherme, et le nombre de publications, sont peu nombreux et limités en raison de l’œdème du greffon et des blessures11,12,13,14.
L’objectif de cette étude est de présenter un protocole pour la perfusion normothermique ex vivo du pancréas (NEVPP), en utilisant un modèle porcin dans le but de fournir éventuellement une plate-forme pour la préservation prolongée, l’évaluation des organes et la réparation avant la transplantation. Cela permettra à d’autres groupes de recherche d’établir un modèle de perfusion pour l’étude des allogreffes de pancréas.
Protocole
Tous les animaux utilisés pour cette étude ont reçu des soins sans cruauté conformément aux « Principes de soin des animaux de laboratoire » formulés par la Société nationale pour la recherche médicale et au « Guide pour le soin des animaux de laboratoire » publié par les National Institutes of Health, Ontario, Canada. Toutes les études ont été approuvées par le Comité de protection des animaux du Toronto General Research Institute.
REMARQUE : Ce protocole d’étude est basé sur un modèle porcin. Le greffon est conservé au froid pendant 2 h puis subit une perfusion machine normotherme pendant 3 h avant la transplantation (Figure 1).
1. Animaux
- Utilisez des porcs Yorkshire mâles (40-50 kg).
2. Prélèvement d’organes
NOTE: La procédure préopératoire et une partie de l’intervention chirurgicale sont les mêmes que les articles précédents publiés par notre groupe15 et sont les suivantes:
- Hébergez les porcs dans l’installation de recherche pendant au moins 7 jours pour permettre l’acclimatation et réduire leur niveau de stress.
- Jeûner les porcs pendant au moins 6 heures avant l’induction de l’anesthésie.
- Sédater le porc par injection intramusculaire (IM) de midazolam (0,15 mg/kg), de kétamine (25 mg/kg) et d’atropine (0,04 mg/kg).
REMARQUE: Cela se fait dans l’établissement de logement. - Transférez l’animal de l’installation de logement à la salle d’opération, où la récupération de l’organe sera effectuée.
- Placez le porc en décubitus dorsal sur la table d’opération et placez un masque facial avec 2 L d’oxygène et 5 % d’isoflurane jusqu’à ce que la mâchoire soit détendue.
- Visualisez les cordes vocales à l’aide d’un laryngoscope et vaporisez-les avec 2% de lidocaïne pour prévenir les spasmes pendant l’intubation. Remplacez le masque par de l’oxygène et de l’isoflurane pendant au moins 30 s avant de tenter l’intubation.
- Introduisez un tube endotrachéal de 7 mm et bloquez le brassard avec 5 ml d’air. Utilisez la capnométrie pour vous assurer que le tube est dans la bonne position.
- Diminuer le gaz isoflurane à 2,5%. Allumez le ventilateur et réglez-le à 15-20 respirations/min et le volume courant à 10-15 mL/kg de poids corporel. Surveillez constamment la fréquence cardiaque et la saturation en oxygène.
- En utilisant la technique Seldinger 16, introduire un cathéter de 8,5 Fr. x10 cm dans la veine jugulaire (droite ou gauche).
- Utilisez le cathéter de la veine jugulaire pour commencer une perfusion de fentanyl (2,5 mL dans 500 mL de Ringer) à 250 mL/h.
- Vérifiez les réflexes musculaires pour déterminer la profondeur de l’anesthésie. Le tonus de la mâchoire est le réflexe musculaire le plus fiable 17.
REMARQUE : Si la rigidité des muscles mandibulaires est notée, augmenter la perfusion d’isoflurane et/ou de fentanyl.
3. Intervention chirurgicale
- Désinfectez et couvrez le champ chirurgical. Effectuer une incision médiane de la xyphoïde à la symphyse pubienne. Étendez le champ chirurgical avec une incision latérale gauche pour une meilleure exposition.
- Disséquer la veine cave inférieure (IVC) de l’aorte abdominale. Libérez davantage l’aorte des tissus environnants et ligaturez les petites branches aortiques lombaires. Identifier et placer des ligatures autour des deux artères rénales.
REMARQUE: Les ligatures ne doivent pas être attachées à ce moment-là. - Une fois que l’arrière de l’aorte est libre, passez deux ligatures autour d’elle. La ligature inférieure sera finalement attachée juste au-dessus de la bifurcation de l’artère iliaque et la ligature supérieure sera attachée 5 cm au-dessus de la cravate précédente.
- Disséquer le hile hépatique. Attachez toutes les artères aussi près du foie que possible. Identifiez le canal cholédoque, placez deux ligatures près du foie et divisez la structure.
- Disséquer autour de l’aorte mais ne pas couper à ce moment-là. Identifier et disséquer autour de la partie suprahépatique de l’aorte et placer une attache autour d’elle.
REMARQUE: Les ligatures ne doivent pas être attachées à ce moment-là. - Ouvrez le sac inférieur pour permettre à la glace de refroidir le pancréas. Mobilisez le pancréas le moins possible avant de rincer.
- Administrer 500 UI d’héparine par kg de poids du donneur par le cathéter central. Attendez 5 minutes et commencez le prélèvement sanguin dans des poches de citrate, de phosphate, de dextrose, de solution saline, d’adénine, de glucose et de mannitol (CPD/SAG-M) à l’aide du cathéter jugulaire.
- Attachez la ligature aortique inférieure, canulez l’aorte avec une ligne affleurante au-dessus de la liaison de bifurcation iliaque et fixez la canule avec une attache supérieure. Liréger les deux artères rénales.
- Attachez l’aorte suprahépatique (pince croisée) une fois que suffisamment de sang a été recueilli (600 mL). Administrer 10 mL de chlorure de potassium pour le sacrifice.
- Initiez une solution de préservation flush avec l’Université du Wisconsin (UW). Coupez une ouverture dans la veine porte (aussi haute que possible) et du cava pour la ventilation. Placez de la glace dans la cavité abdominale.
- Évaluer la queue du pancréas et la boucle C du duodénum après avoir rincé 1 L de solution UW. Si le rinçage est adéquat, commencer la dissection, identifier et serrer les vaisseaux mésentériques. Ralentissez le rinçage pour le deuxième litre d’UW.
- Récupérer le greffon pancréatique et un segment de cava ou de veine iliaque pour l’extension de la veine porte.
NOTE: La greffe pancréatique est enlevée avec la rate. - Placez l’orgue dans un sac d’orgue qui est placé à l’intérieur d’une bassine remplie de glace.
4. Préparation de la greffe pancréatique (Figure 2A)
- Retirez la ligne de chasse de la partie distale de l’aorte et fermez avec une attache. Remplissez la poche d’organe avec le reste de la solution UW. Libérez le pancréas du tissu adhérent, y compris la rate.
- Effectuer une extension de la veine porte en utilisant le cava ou la veine iliaque précédemment récupérés avec 6-0 Prolene. Canuler la veine porte et l’aorte proximale avec un réducteur de 1/4 po x 3/8 po.
- Canuler la partie distale du duodénum avec le cathéter Malecot et attacher. Serrez l’extrémité du cathéter pour éviter le déversement du contenu duodénal. Supervision des vaisseaux mésentériques avec 4-0 Prolene.
- Enregistrer le poids du greffon. Conservez le greffon dans un entrepôt frigorifique statique (SCS) jusqu’au début du NEVPP.
5. Perfusion du pancréas ex vivo normamère (NEVPP)
REMARQUE : Le circuit de perfusion est constitué d’un appareil de pontage cardiopulmonaire néonatal (Figure 3).
- Fixez le tube correspondant à l’oxygénateur et au réservoir veineux, ainsi que la ligne artérielle à la sortie de l’oxygénateur et placez le filtre à bulles dans son support. Connectez la ligne de purge qui va du filtre à bulles au réservoir veineux. Ouvrez le bouchon du filtre à bulles pour laisser sortir tout l’air.
- Connectez la conduite veineuse à l’entrée du réservoir veineux. Connectez le filtre de dialyse et le tuyau où le dialysat sera perfusé. Connectez le capteur de débitmètre, les conduites de pression et la sonde de température. Connectez les conduites d’échantillonnage artérielles et veineuses aux orifices d’échantillonnage.
- Placer la chambre pancréatique (Figure 3) sur une table Mayo et introduire le tube artériel et veineux à travers les trous prévus à cet effet. Connectez et allumez l’unité de chauffage externe.
- Placez le tuyau d’aspiration à l’intérieur de la pompe à rouleaux et connectez une extrémité dans le tube qui sort de la chambre pour recueillir les fluides, et l’autre extrémité au réservoir veineux pour recueillir toutes les pertes de perfusat d’organes.
- Raccordez le tube d’oxygène (vert) au réservoir de gaz contenant le mélange de carbogènes (95% O 2/5% CO2) et l’oxygénateur. Connectez le tube de la pompe chauffante à l’oxygénateur.
- Collier de serrage des conduites d’écoulement artériel et veineux, ainsi que l’écoulement du réservoir veineux.
6. Préparation du perfusat et amorçage du circuit
- Remplir le réservoir veineux avec le perfusat (tableau 1).
- Utiliser une pompe à seringue pour l’administration continue du vasodilatateur (époprosténol) à 8 mL/h dans le cathéter artériel. Utiliser une deuxième pompe à seringue pour l’administration continue de l’inhibiteur enzymatique directement dans le réservoir veineux (15 mg, 10 mL/h).
- Allumez l’appareil cardiaque pulmonaire (HLM) et démarrez les panneaux de pression, de température et de minuterie. Allumez la pompe chauffante pour chauffer la solution de perfusion à 38 °C. Ouvrez l’alimentation O 2/CO2.
- Retirez la pince de tuyauterie placée sur le débit sortant du réservoir veineux, démarrez la pompe centrifuge et portez-la jusqu’à 1 500 tr/min. Serrez le tube, en contournant le filtre artériel et libérez l’air du filtre artériel. Zéro les conduites de pression artérielle et veineuse.
7. Perfusion du greffon pancréatique (figure 2B)
- Ouvrez le sac d’organes où le pancréas est stocké. Rincer avec 200 ml d’albumine par la canule artérielle. Retirez le pancréas de la glace et placez-le à l’intérieur de la chambre de l’organe. Confirmer que l’artère et la tubulure veineuse sont exemptes d’air.
- Relâchez la pince du côté artériel et serrez le raccourci entre le tube artériel et veineux. Une fois que le sang commence à sortir de la tubulure artérielle, connectez-vous à la canule artérielle. Réglez la pression artérielle à 20-25 mmHg, en régulant la vitesse de la pompe centrifuge. Connectez la tubulure veineuse une fois que le sang commence à sortir de la canule veineuse.
- Administrer un flacon de vérapamil (2,5 mg/mL) directement du côté artériel, lorsque le pancréas est complètement connecté et qu’aucun saignement majeur n’est observé.
- Enregistrer les pressions, le débit artériel, la température et la sécrétion du duodénum en continu. Prélever du sang, enregistrer le débit duodénal toutes les heures et évaluer macroscopiquement l’œdème toutes les heures. Enregistrer les paramètres de perfusion et prélever des échantillons pour analyse (échantillons de gaz du sang veineux et artériel, ainsi que des échantillons d’amylase, de lipase et de LDH).
- Débranchez les tubes artériels et veineux lorsque la perfusion est terminée, retirez le greffon de la chambre de l’organe et rincez avec de l’UW froid et pesez. Conservez le greffon sur de la glace dans un sac d’organe stérile jusqu’au moment de la transplantation.
Résultats
Les données à venir montrent les résultats représentatifs de sept expériences utilisant un modèle de prélèvement du pancréas du donneur battant le cœur. Après canulation de l’aorte, rinçage avec une solution UW et récupération du pancréas, les greffons ont été conservés sur SCS pendant 2 h pendant que les globules rouges étaient préparés. Le NEVPP a été réalisé dans ce modèle pendant 3 heures, ce que nous considérions comme le moins de temps nécessaire pour la perfusion si l’évaluation et la réparation du greffon sont prévues à l’avenir. Les échantillons et les mesures ont été enregistrés à des points horaires horaires. (0 = ligne de base, juste après que l’organe est connecté au circuit, 1 = 1 h, 2 = 2 h, 3 = 3 h).
Les greffes de pancréas ont été placées sur une chambre d’organe conçue sur mesure à cet effet et comprenant un appareil de chauffage (dossier supplémentaire). Le but du NEVPP est de fournir un environnement quasi physiologique pour l’organe. À cette fin, la pression artérielle a été réglée pour rester entre 20-25 mmHg dans toutes les perfusions. La pression et le débit ont été mesurés tout au long de la perfusion et sont restés stables (figure 4). L’activité métabolique a été estimée en calculant la consommation d’oxygène du greffon à l’aide de la formule suivante : [(pO2art-pO2ven)*débit/poids] (Figure 5). Les mesures du pH, du sodium, du calcium et du HCO3 se situaient dans les valeurs physiologiques pendant toute la perfusion (figure 6). Les taux de lactate et de potassium ont diminué pendant la perfusion et ont atteint des valeurs proches de la normale à 3 h (figure 7). Comme le circuit est un système fermé, les niveaux d’amylase et de lipase devraient augmenter pendant la perfusion (figure 8). Cependant, l’augmentation des niveaux ne semble pas corrélée avec les dommages causés au greffon (Figure 9). Une échelle semi-quantitative a été utilisée pour évaluer la nécrose graisseuse et parenchymateuse ainsi que l’intégrité des cellules des îlots pancréatiques. (0 - aucun changement, 1 - changements légers, 2 - changements modérés, 3 - changements graves). Cela a été fait par un pathologiste aveugle aux groupes expérimentaux, et aucun signe de pancréatite n’a été observé.
Les allogreffes de pancréas ont été pesées avant et après la perfusion pour évaluer l’œdème (tableau 2).
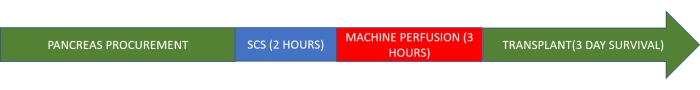
Graphique 1. Protocole de l’étude. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 2. Pancréas avant et après perfusion. (A) Avant perfusion. (B) Après perfusion. Veuillez cliquer ici pour voir une version agrandie de cette figure.
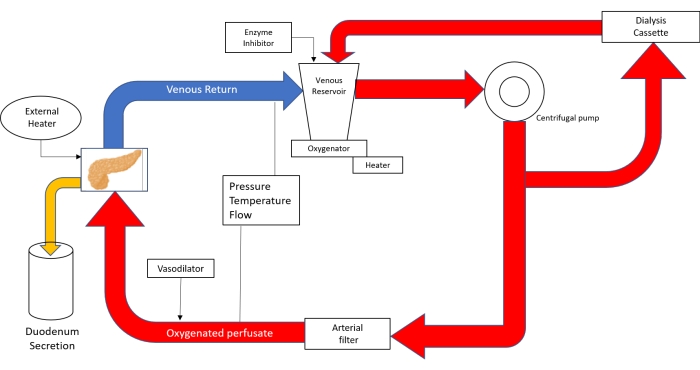
Graphique 3. Dessin schématique du circuit de perfusion. Avec l’utilisation de la technologie de dérivation cardiopulmonaire néonatale; Le perfusat est versé dans le réservoir veineux, puis propulsé à l’aide d’une pompe centrifuge dans l’oxygénateur. Après avoir quitté l’oxygénateur, le circuit se divise en tubes qui envoient le perfusate à la cassette de dialyse et de retour au réservoir et au tube qui va au filtre artériel. Après avoir passé le filtre à bulles artériel, le perfusat est entraîné avec une pression de 20-25 mmHg à travers l’aorte dans le pancréas. L’écoulement veineux ramène le perfusat dans le réservoir veineux. (Adapté de 18). Veuillez cliquer ici pour voir une version agrandie de cette figure.
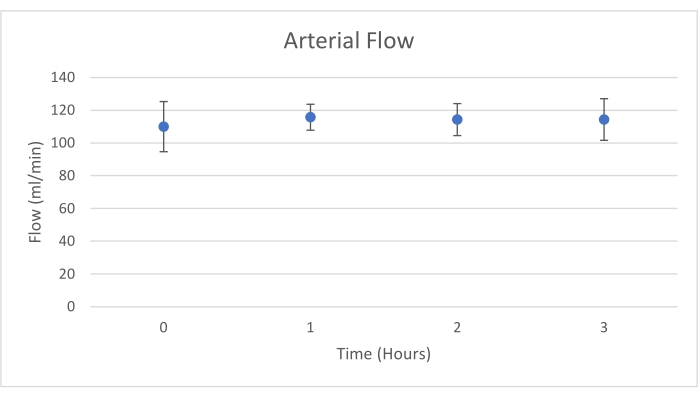
Graphique 4. Débit artériel moyen avec écart-type (mL/min). Veuillez cliquer ici pour voir une version agrandie de cette figure.
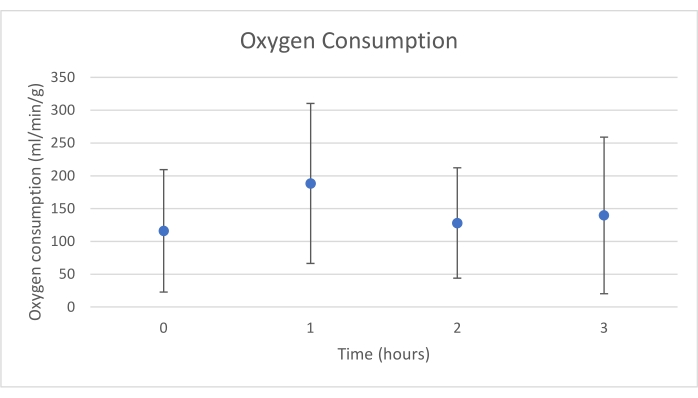
Graphique 5. Consommation moyenne d’oxygène avec écart type (mL/min/g). Veuillez cliquer ici pour voir une version agrandie de cette figure.
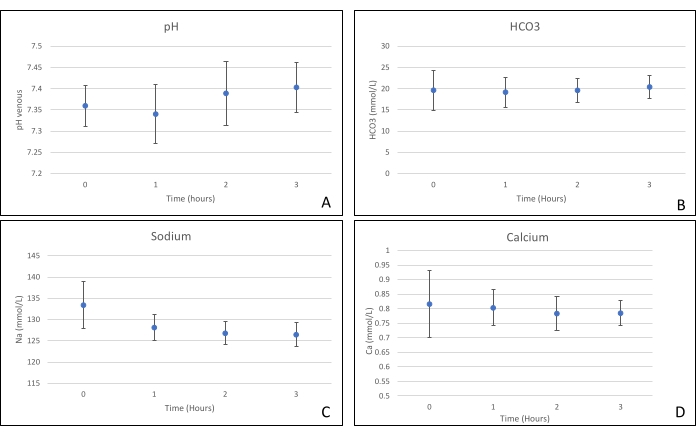
Graphique 6. (A) pH moyen, (b) hco3, (C) sodium et (D) mesures de calcium avec écarts-types. Veuillez cliquer ici pour voir une version agrandie de cette figure.
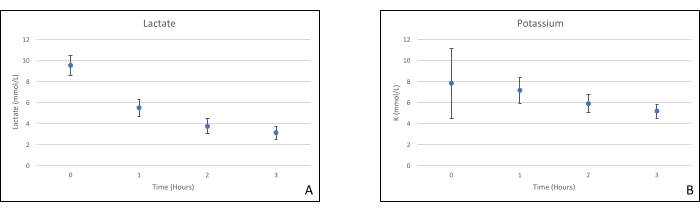
Graphique 7. (A) Mesures moyennes du lactate et (B) du potassium avec écarts-types. Veuillez cliquer ici pour voir une version agrandie de cette figure.
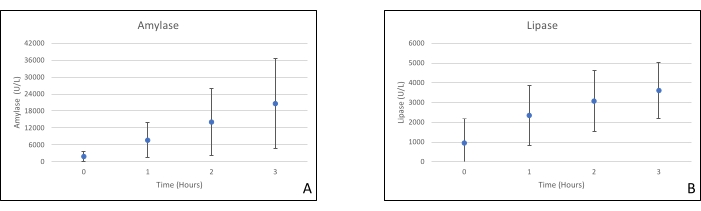
Graphique 8. (A) Mesures moyennes de l’amylase et (B) de la lipase avec écarts types. Veuillez cliquer ici pour voir une version agrandie de cette figure.
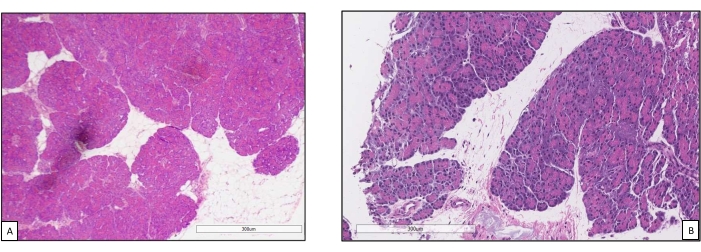
Graphique 9. Biopsies par forage avant et après perfusion. (A) Parenchyme pancréatique normal avant perfusion machine18. (B) Biopsie post-perfusion avec bonne conservation des cellules d’acini pancréatiques et des îlots pancréatiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Ingrédient | Quantité |
| Lactate de Ringer | 260 mL |
| Steen Solution | 195 ml |
| Érythrocytes lavés | 162,5 mL |
| Eau à double osmose inverse (DRO) | 35 mL |
| Héparine (10000 UI / 10 mL) | 1,3 mL |
| Bicarbonate de sodium (8,4 %) | 10,4 mL |
| Gluconate de calcium (10%) | 1,3 mL |
| Métylprednisolone (Solu-Medrol) | 325 mg |
| Aprotinine | 15 mg |
Tableau 1. Composition perfusée.
| Poids avant | Poids après | Gagner | Différence en % | |
| Cas 1 | 244 g | 240 g | -4 g | -1.63 |
| Cas 2 | 154 g | 164 g | 10 g | 6.49 |
| Cas 3 | 184 g | 245 g | 61 g | 33.15 |
| Cas 4 | 190 g | 226 g | 36 g | 18.94 |
| Cas 5 | 198 g | 307 g | 109 g | 55.05 |
| Cas 6 | 205 g | 315 g | 107 g | 51.44 |
| Cas 7 | 193 g | 256 g | 63 g | 32.64 |
Tableau 2. Poids avant et après perfusion.
Fichier supplémentaire: Chambre pancréatique sur mesure pour la perfusion. Conçu en collaboration avec l’atelier d’usinage du programme de physique médicale - radiothérapie du Princess Margaret Cancer Centre. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Cette étude démontre qu’une NEVPP stable peut être obtenue pour les allogreffes de pancréas avec des dommages histologiques minimes après 3 h de perfusion avec la configuration précédemment présentée. Les paramètres de perfusion tels que le débit artériel, la pression, le pH, le HCO3 et le Na restent stables pendant la perfusion, et nous avons observé une diminution et une stabilisation du K et du lactate.
Il est d’une importance cruciale de manipuler le greffon le moins possible lors de l’approvisionnement, de la préparation de la table arrière et de la perfusion. Il est également très important de garder un contrôle étroit de la pression artérielle. Étant donné que le pancréas est un organe à basse pression, une augmentation de la pression peut causer des dommages irréversibles à l’organe.
La préparation en back-table pour cette étude est différente de la préparation des greffons humains (figure 2A). Comme le pancréas était le seul organe provenant des porcs, nous avons pu prendre la partie de l’aorte qui comprend le tronc cœliaque et l’artère mésentérique supérieure. En ce qui concerne la veine porte, une extension à l’aide de la veine iliaque a été réalisée. Dans le cas de greffes humaines, la préparation de la table arrière devra être effectuée de la même manière que pour la transplantation, en utilisant des greffons iliaques pour la reconstruction artérielle et l’allongement porte19.
Cette méthode peut être limitée par la complexité de l’installation. Nous avons décidé d’ajouter une cassette de dialyse après avoir remarqué un œdème sévère de la greffe lorsqu’elle était faite sans elle. Une chambre d’orgue sur mesure a également été construite pour ces expériences qui contenait une source de chauffage externe qui s’est avérée essentielle pour la perfusion optimale des greffons.
Il existe peu d’études décrivant la perfusion normothermique ex vivo du pancréas. Dans la plupart de ces études, l’œdème semble être le principal facteur limitant. À notre connaissance, cette méthode est le seul rapport d’utilisation d’une cassette de dialyse pour contrôler l’œdème.
La perfusion ex vivo normamère pour le pancréas en est encore à ses balbutiements par rapport à d’autres organes. Les protocoles actuels se concentrent sur les donneurs à critères étendus (DCD), l’amélioration du perfusat, les temps de perfusion plus longs et les biomarqueurs pour évaluer les dommages du greffon pendant la perfusion. Les niveaux d’amylase et de lipase ne semblent pas être des marqueurs fiables, car nous utilisons un système fermé, et ne semblent pas corrélés avec l’histopathologie20. Jusqu’à présent, notre groupe a également réussi à transplanter des allogreffes de pancréas après perfusion avec de bons résultats18.
Avec les améliorations continues de cette technologie, nous espérons que cette technologie sera applicable à la transplantation clinique et permettra l’évaluation et la réparation des allogreffes du pancréas. Nous espérons que cela se traduira en fin de compte par une plus grande utilisation des greffons, une réduction du temps d’attente pour les patients et de meilleurs résultats pour les patients.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Aucun.
matériels
| Name | Company | Catalog Number | Comments |
| Alburex 5 | CSL Behring AG | 187337 | 25 g of Albumin (human) in 500 mL of buffered diluent |
| Aprotinin from bovine lung | Sigma-Aldrich | A1153 | |
| Belzer UW Cold storage solution | Bridge to life Ltd | 4055 | |
| Calcium gluconate (10%) | Fresenius Kabi Canada Ltd (Toronto, ON) | C360019 | |
| Composelect (blood collection bags) | Fresenius Kabi Canada Ltd | PQ31555 | |
| Epoprostenol | GlaxoSmithKline Inc. | 218761 | |
| Heart lung machine, Stöckert S3 | Sorin Group Canada Inc. | Custom made | Centrifugal pump, roller pump, control panel (sensors for pressure, flow, temperature, bubbles, and level), oxygen blender, heater unit |
| Hemoflow, Fresenius Polysulfone | Fresenius Medical Care North America | 0520165A | |
| Heparin (10000 IU/10 mL) | Fresenius Kabi Canada Ltd | C504710 | |
| Lactated Ringer's solution | Baxter | JB2324 | |
| Neonatal cardiopulmonary bypass techonolgy | Sorin Group Canada Inc | Custom made | Dideco perfusion tubing systems, centrifugal blood pump (Revolution), arterial blood filter, microporous hollow fibre memebrane oxygenator), cannulas |
| Pancreas chamber | Custom made | With external heater | |
| Percutaneous Sheath Introducer Set with Integral Hemostasis Valve/side Port for use with 7-7.5 Fr Catheters | Arrow International LLC | SI-09880 | |
| Sodium bicarbonate (8.4%) | Fresenius Kabi Canada Ltd | C908950 | |
| Solu-Medrol | Pfizer Canada Inc. | 52246-14-2 | |
| Steen | XVIVO | 19004 | |
| Urethral catheter | Bard Inc | 86020 | 20 Fr, malecot model drain |
| Verapamil | Sandoz Canada Inc. | 8960 |
Références
- . National Diabetes Statistics Report | Diabetes | CDC Available from: https://www.cdc.gov/diabetes/data/statistics-report/index.html (2022)
- Shyr, Y. M., Wang, S. E., Chen, S. C., Shyr, B. U. Reappraisal of pancreas transplantation. Journal of the Chinese Medical Association JCMA. 82 (7), 531-534 (2019).
- Dholakia, S., et al. Pancreas transplantation: past, present, future. American Journal of Medicine. 129 (7), 667-673 (2016).
- Johnson, P., Sharples, E., Sinha, S., Friend, P. J. Pancreas and islet transplantation: pancreas and islet transplantation in diabetes mellitus. Transplantation Surgery. , 205-217 (2021).
- Kopp, W. H., et al. Pancreas transplantation with grafts from donors deceased after circulatory death: 5 years single-center experience. Transplantation. 102 (2), 333-339 (2018).
- Cypel, M., et al. Normothermic ex vivo lung perfusion in clinical lung transplantation. The New England Journal of Medicine. 364 (15), 1431-1440 (2011).
- Nasralla, D., et al. A randomized trial of normothermic preservation in liver transplantation. Nature. 557 (7703), 50-56 (2018).
- Selzner, M., et al. Normothermic ex vivo liver perfusion using steen solution as perfusate for human liver transplantation: First North American results. Liver Transplantation: Official Publication of the American Association for the Study of Liver Diseases and the International Liver Transplantation Society. 22 (11), 1501-1508 (2016).
- Hosgood, S. A., Thompson, E., Moore, T., Wilson, C. H., Nicholson, M. L. Normothermic machine perfusion for the assessment and transplantation of declined human kidneys from donation after circulatory death donors. The British Journal of Surgery. 105 (4), 388-394 (2018).
- Urbanellis, P., et al. Normothermic ex vivo kidney perfusion improves early dcd graft function compared with hypothermic machine perfusion and static cold storage. Transplantation. 104 (5), 947-955 (2020).
- Barlow, A. D., et al. Use of ex vivo normothermic perfusion for quality assessment of discarded human donor pancreases. American Journal of Transplantation: Official Journal of the American Society of Transplantation and the American Society of Transplant Surgeons. 15 (9), 2475-2482 (2015).
- Kumar, R., et al. Ex vivo normothermic porcine pancreas: A physiological model for preservation and transplant study. International journal of surgery. 54, 206-215 (2018).
- Hamaoui, K., et al. Development of pancreatic machine perfusion: translational steps from porcine to human models. The Journal of Surgical Research. 223, 263-274 (2018).
- Prudhomme, T., et al. Successful pancreas allotransplantations after hypothermic machine perfusion in a novel diabetic porcine model: a controlled study. Transplant International: Official Journal of the European Society for Organ Transplantation. 34 (2), 353-364 (2021).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for the preservation of kidney grafts prior to transplantation. Journal of Visualized Experiments: JoVE. (101), e353 (2015).
- Graham, A. S., Ozment, C., Tegtmeyer, K., Lai, S., Braner, D. A. V. Central venous catheterization. The New England Journal of Medicine. 356 (21), 21 (2009).
- Swindle, M. M. . Swine in the Laboratory Surgery, Anesthesia, Imaging, and Experimental Techniques. , (2015).
- Mazilescu, L. I., et al. Normothermic ex situ pancreas perfusion for the preservation of porcine pancreas grafts. American Journal of Transplantation. , (2022).
- Fridell, J. A., et al. Preparation of the pancreas allograft for transplantation. Clinical transplantation. 25 (2), (2011).
- Nassar, A., Liu, Q., Walsh, M., Quintini, C. Normothermic ex vivo perfusion of discarded human pancreas. Artificial Organs. 42 (3), 334-335 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon