Method Article
Visualización de rayos X del tratamiento ablativo intraductal a base de etanol para la prevención del cáncer de mama en modelos de rata
En este artículo
Resumen
Se describe un procedimiento para la administración de una solución ablativa química al árbol ductal mamario de rata para el tratamiento preventivo guiado por imágenes del cáncer de mama. Las células epiteliales mamarias pueden ser atacadas con un daño tisular colateral mínimo a través de la canulación directamente en la abertura del pezón y la infusión intraductal de una solución ablativa a base de etanol al 70%.
Resumen
Todavía hay un número limitado de intervenciones primarias para la prevención del cáncer de mama. Para las mujeres con alto riesgo de desarrollar cáncer de mama, la intervención más efectiva es la mastectomía profiláctica. Este es un procedimiento quirúrgico drástico en el que las células epiteliales mamarias que pueden dar lugar al cáncer de mama se eliminan por completo junto con el tejido circundante. El objetivo de este protocolo es demostrar la viabilidad de un procedimiento intraductal mínimamente invasivo que podría convertirse en una nueva intervención primaria para la prevención del cáncer de mama. Este procedimiento local preferentemente ablacionaría las células epiteliales mamarias antes de que puedan volverse malignas. Los métodos intraductales para administrar soluciones directamente a estas células epiteliales en modelos de roedores de cáncer de mama se han desarrollado en la Universidad Estatal de Michigan y en otros lugares. La glándula mamaria de rata consiste en un solo árbol ductal que tiene una arquitectura más simple y lineal en comparación con el pecho humano. Sin embargo, los modelos de cáncer de mama en ratas inducidos químicamente ofrecen herramientas valiosas para estudios de prueba de concepto de nuevas intervenciones preventivas y escalabilidad de modelos de ratón a humanos. Aquí, se describe un procedimiento para la administración intraductal de una solución ablativa a base de etanol que contiene nanopartículas de óxido de tantalio como agente de contraste de rayos X y etilcelulosa como agente gelificante en el árbol ductal mamario de rata. La administración de reactivos acuosos (por ejemplo, compuestos citotóxicos, siRNAs, AdCre) por inyección intraductal se ha descrito previamente en modelos de ratón y rata. Esta descripción del protocolo enfatiza los cambios metodológicos y los pasos que pertenecen exclusivamente a la entrega de una solución ablativa, la consideración de la formulación para minimizar los efectos secundarios locales y sistémicos de la solución ablativa y las imágenes de rayos X para la evaluación in vivo del relleno ductal del árbol. Las técnicas de fluoroscopia y micro-TC permiten determinar el éxito de la administración de solución ablativa y el grado de llenado del árbol ductal gracias a la compatibilidad con el agente de contraste que contiene tantalio.
Introducción
Para las mujeres en los EE.UU.1, el cáncer de mama (BC) sigue siendo el tipo de cáncer más diagnosticado y causa más muertes que cualquier otro tipo de cáncer, excepto el cáncer de pulmón. Las proyecciones para 2022 estiman que 51,400 mujeres serán diagnosticadas con carcinoma in situ y 287,850 mujeres serán diagnosticadas con carcinoma invasivo, y que 43,600 mujeres morirán de BC1. A pesar de la prevalencia y mortalidad asociadas con el CB, hay pocas opciones disponibles para la prevención primaria y la investigación traslacional sobre intervenciones novedosas, ya que la prevención primaria no es priorizada por las agencias federales2. La mastectomía profiláctica es la intervención más efectiva para la prevención primaria. Sin embargo, este procedimiento solo se recomienda para personas de alto riesgo porque es una cirugía mayor con consecuencias que cambian la vida3. Esta cirugía implica la extirpación completa de las células epiteliales mamarias a partir de las cuales se desarrolla la carcinogénesis, así como el tejido circundante normal. Los individuos a menudo son disuadidos de usar este procedimiento como su primera opción de intervención primaria debido al impacto negativo del estrés físico, psicológico y social. Por estas razones, incluso algunos individuos de alto riesgo optan por no someterse a este procedimiento y optan por la espera vigilante o estrategias de vigilancia similares3. En publicaciones anteriores, la administración de etanol al 70% (EtOH) directamente en el árbol ductal de modelos de ratón fue efectiva para ablacionar químicamente las células epiteliales mamarias con daño limitado al tejido normal adyacente y para prevenir la formación de tumores de mama4. El EtOH se utiliza en múltiples aplicaciones clínicas como agente ablativo para el tratamiento local de algunos cánceres o agente esclerosante para el tratamiento local de la inflamación arteriovenosa y las malformaciones 5,6,7,8,9,10,11,12,13,14 . El bajo perfil de toxicidad y seguridad de EtOH está bien establecido, ya que en algunos procedimientos se pueden administrar hasta 50 mL de EtOH al 95% por sesión 5,10.
La extirpación completa de las células epiteliales mamarias a partir de las cuales se desarrolla la BC es el componente más crucial tanto de la mastectomía profiláctica como de la administración local de una solución ablativa. Por lo tanto, la confirmación del llenado completo del árbol ductal es necesaria para garantizar que la solución ablativa ha entrado en contacto directo con todas las células epiteliales mamarias. La entrega de una solución dentro del árbol ductal y su visualización por fluoroscopia guiada por imágenes o ductografía son posibles a través de procedimientos clínicos que ya existen15,16,17. Por lo tanto, será factible implementar y evaluar fácilmente este procedimiento en ensayos clínicos. Un paso clave para establecer la eficacia y la viabilidad traslacional de la ablación intraductal (DI) como una nueva intervención para la prevención primaria será demostrar la viabilidad de este enfoque de visualización de rayos X en modelos animales de tamaño y complejidad crecientes de su arquitectura de árbol ductal 4,18,19. Aquí se describe un protocolo que escala este procedimiento ablativo de modelos de ratón20 a rata. Mientras que los árboles ductales de ratón y rata tienen una estructura lineal y un patrón de ramificación similares, el árbol ductal de rata es proporcionalmente más grande y está rodeado por un estroma mucho más denso. Hemos implementado un método en el laboratorio para inyectar con éxito cada glándula mamaria en una rata durante una serie de sesiones semanales con una solución ablativa que contiene un agente de contraste. El espaciamiento de las sesiones es necesario para garantizar que los animales tengan efectos secundarios mínimos de EtOH (Figura 1 y Figura 2). El procedimiento consiste en la inyección de la solución ablativa directamente en la abertura del pezón de una rata anestesiada con isoflurano con una aguja de 33 G. Algunas mejoras clave del procedimiento incluyen el uso de un tratamiento antiinflamatorio prolongado, la inyección de volúmenes más altos por árbol ductal que los21 sugeridos y jeringas herméticas a los gases para líquidos y gases. La duración del tratamiento con 5 mg/kg de carprofeno (un AINE) desde 48 h antes hasta 1 semana después de las inyecciones de ID es comparable al protocolo antiinflamatorio utilizado para la terapia esclerosante de la malformación venosa en la clínica. El tratamiento se realiza en pacientes bajo anestesia sistémica seguido de 2 días de medicamentos antiinflamatorios como los AINE. El tratamiento antiinflamatorio puede extenderse por unos días más para reducir la inflamación local y cualquier dolor potencial13. Al igual que en ratones20, la inyección intraperitoneal de una solución de sacarosa al 5% mitiga el efecto a corto plazo de la intoxicación por alcohol en ratas. Las ratas pueden ser inyectadas con hasta 1 ml de EtOH al 70% (hasta 4 conductos; 0,2 g/dL de contenido de EtOH en sangre) en una sola sesión cuando se administra con esta solución de sacarosa; los animales se recuperan completamente dentro de las 4 h después de las inyecciones de identificación. Realizamos sesiones secuenciales para permitir suficiente tiempo de recuperación al inyectar más de 4 glándulas y/o concentraciones más altas de EtOH. La intoxicación por alcohol en las mujeres será mucho menos probable ya que la inyección de ID de todos los árboles ductales en ambos senos, suponiendo 16 conductos principales16,17 y 2 mL por conducto22,23, con 70% de EtOH resultaría en menos de 0.1 g / dL de contenido de EtOH en sangre y puede causar deterioro leve.
Las imágenes de rayos X permiten determinar qué tan exitoso es el parto intraductal en cada glándula individual y si todo el árbol ductal está lleno (Figura 1, Figura 2, Figura 3). Las imágenes de fluoroscopia en tiempo real en preparación para la micro-tomografía computarizada y / o la reconstrucción 3D de los datos del archivo DICOM se pueden usar para evaluar el alcance de la administración de la solución en el árbol ductal y cualquier fuga en el estroma. El uso de fluoroscopia puede ayudar a limitar la dosis total de radiación impuesta al animal. La técnica de fluoroscopia se aproxima más a la aplicación clínica prevista para la guía por imágenes de este tratamiento ablativo. Se ha realizado una comparación de Isovue que contiene yodo aprobado por la FDA con nanopartículas de óxido de tantalio (TaOx) para refinar aún más la utilidad de la solución ablativa 4,19. Se ha encontrado que TaOx es un agente de contraste micro-CT superior a Isovue para la visualización del llenado inicial del árbol ductal en ratones 4,19. Aquí, demostramos que TaOx es un agente de contraste adecuado para visualizar el llenado inicial del árbol ductal de rata (Figura 2 y Figura 3). Tanto en la investigación traslacional como en las aplicaciones de la práctica clínica, el agente gelificante etilcelulosa (EC) se ha agregado a la solución de EtOH para minimizar la difusión de las regiones objetivo previstas 13,14,24,25,26,27,28,29. Los estudios han demostrado que la adición de hasta un 1,5% de EC a las soluciones ablativas que contienen EtOH es compatible con las imágenes basadas en TaOx (Figura 3). Estos, así como otros refinamientos de la solución ablativa, pueden ayudar a traducir fácilmente este procedimiento guiado por imágenes a la clínica.
Protocolo
Todos los experimentos que se describen se llevaron a cabo bajo protocolos aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Estatal de Michigan.
1. Tratamiento antiinflamatorio prolongado
- Prepare copas de gel de sucralosa como dosis oral de carprofeno. Proporcione a las ratas este tratamiento antiinflamatorio desde 2 días antes de recibir la inyección de ID de EtOH al 70% hasta 7 días después del procedimiento.
- Diluir una solución de trabajo de carprofeno en PBS estéril para inyección en la taza. A partir de una solución madre de 50 mg/ml, prepare una solución diluida de 2 mg/ml coloreada con colorante alimentario azul estéril al 1% v/v e inyecte 500 μL en cada taza. La adición del tinte ayuda en la visualización de la mezcla completa de la droga dentro de la sucralosa de la copa.
- Siga las recomendaciones del fabricante para preparar la taza para la adición de carprofeno. A menos que el vendedor indique lo contrario, caliente la taza en un baño maría a 60 °C durante 15 minutos y séquela al retirarla para reducir el riesgo de contaminación.
- Limpie la tapa de la copa de sucralosa con EtOH al 70% en el área e introduzca la aguja de la jeringa que contiene la solución de trabajo de carprofeno. Dispensar el volumen adecuado (500 μL).
- Cubra el pinchazo con una pegatina. Agite la taza enérgicamente durante 15 s y luego coloque esa taza en un vórtice durante 15 s adicionales. Evalúe visualmente la mezcla homogénea y completa antes de almacenarla para su uso posterior. Busque la presencia de un color azul oscuro.
NOTA: Deje que las tazas alcancen la temperatura ambiente. Guarde las tazas a temperatura ambiente si lo desea, pero preste atención a la guía de eficacia del medicamento del fabricante. Alternativamente, almacenar las tazas a 4 °C y usar dentro de un mes. Fechar la pegatina es una buena práctica para realizar un seguimiento de la fecha de inyección sin el riesgo de que un bolígrafo o un marcador afilado perforen la tapa.
- Justo antes de usar, limpie el exterior de la taza con 70% de EtOH. Retire la tapa antes de colocar la taza en la jaula del animal. Reemplace las tazas cada dos días o cuando estén vacías. Verifique el nivel de gel diariamente para asegurar una dosificación adecuada. Una taza puede suministrar carprofeno para hasta dos ratas por hasta 2 días; Sin embargo, las ratas pueden consumir taza entera antes.
2. Preparación preoperatoria
NOTA: Asegúrese de que el paso de preparación del animal preceda al procedimiento de inyección de ID por 2-3 días.
- Encienda el vaporizador de isoflurano (2% -3% isoflurano, 1,5 L/min de oxígeno) para anestesiar a la rata. Mueva al animal a un cono nasal en una almohadilla de calentamiento. Aplique lubricante para los ojos a la rata y luego coloque al animal en su espalda. Controle cuidadosamente la respiración del animal para asegurarse de que el plano anestésico se mantenga al 1% -3% de isoflurano.
NOTA: Se puede usar una máquina de afeitar eléctrica para eliminar el exceso de piel antes de la depilación. Se debe tener extremo cuidado de no dañar ningún pezón con la maquinilla de afeitar. Por esta razón, este paso se puede omitir. Las ratas son más sensibles a la crema depilatoria que los ratones, por lo que la eliminación del exceso de crema es muy importante. Evite inyectar una solución que contenga etanol en un área que ya tenga una abrasión presente por la depilación. Algunas cremas han agregado compuestos como aloe y lanolina que pueden ayudar a minimizar la probabilidad de abrasiones. - Use un aplicador de punta de algodón para extender la crema depilatoria de venta libre sobre el área del pezón. Use el aplicador para frotar la crema en el área durante 10-30 s. Compruebe si el pelaje se ha aflojado rápidamente.
- Deje la crema en la rata durante el intervalo más corto posible y retire por completo para evitar quemaduras en la piel. Las ratas son aún más sensibles a este procedimiento que los ratones.
- Después de 10-30 s de aplicación, humedezca la gasa con agua tibia y úsela para enjuagar la crema y el pelaje suelto del animal. Realice al menos tres enjuagues del área con una gasa fresca humedecida y seque con una gasa seca después del enjuague final. Confirme la buena visibilidad y el acceso al área del pezón de donde se retira el pelaje. Repita el procedimiento depilatorio si es necesario.
- Coloque a la rata en una jaula limpia en una almohadilla térmica y permita que se recupere. Revise a la rata para asegurarse de que esté completamente recuperada de la anestesia antes de llevarla de vuelta a su jaula permanente.
- Coloque una taza de gel de sucralosa dosificada con carprofeno (1 mg / taza) en la jaula para el tratamiento antiinflamatorio. Verifique el consumo diario de gel y reemplácelo con una taza fresca según corresponda. No deje la taza por más de 2 días. Por lo general, las tazas deberán reemplazarse después de 1 día.
3. Inyección intraductal
- Preparar la solución madre de TaOx a 333,3 mM como se describe19 utilizando solución salina tamponada con fosfato estéril (PBS). Caliente la solución si el polvo no se disuelve completamente. Revuelva suavemente. No haga vórtice ni agite vigorosamente para evitar la formación de burbujas.
- Mezcle tres partes de 333.3 mM TaO x con siete partes de EtOH al 100% para obtener una solución final de EtOH al 70% 100 mM/TaOx. Opcionalmente, agregue una cantidad adecuada de 0.5% -1.5% de etilcelulosa (CE) como agente gelificante para maximizar la retención local de la solución ablativa. Agregue colorante alimentario azul al 1% v/v a la solución ablativa para el examen visual de la administración en el árbol ductal durante la infusión.
- Preparar un volumen apropiado para las necesidades experimentales. Los pares de glándulas 1 (cervical) y 6 (inguinal) se pueden llenar con hasta 100 μL de la solución, mientras que todos los demás pares se pueden llenar con hasta 300 μL.
- Anestesiar a la rata como en el paso 2.1 y mover la rata al cono de la nariz una vez completamente anestesiada. Aplique lubricante para los ojos en ambos ojos y luego coloque al animal boca arriba. Asegure la rata debajo del estereoscopio con cinta adhesiva cerca de los pezones que se inyectarán, si lo desea. El peso de la rata es generalmente suficiente para evitar que se mueva sustancialmente sin cinta adhesiva.
- Para preparar los pezones para la inyección, retire cualquier piel muerta que cubra la abertura del pezón con pinzas puntiagudas finas, si es posible. Las ratas a menudo tienen un tapón que sobresale de la abertura del pezón que puede evitar la canulación exitosa del pezón si no se retira.
NOTA: Es importante tener en cuenta que es más probable que los volúmenes de inyección más grandes de soluciones ablativas que se utilizan en ratas produzcan heridas superficiales en la piel cerca del (los) sitio (s) de inyección. Por esta razón, inyectar cada dos pezones en una sola sesión es menos dañino e irritante para el animal que inyectar pezones adyacentes. El monitoreo de las ratas para detectar abrasiones durante 7 días después de la inyección ayuda a garantizar que no haya efectos graves para la salud por el rascado del animal e introduce la posibilidad de infección por contaminación con restos del piso de la jaula. Se puede usar ungüento antibiótico triple o lavados con solución de clorhexidina para tratar cualquier signo de infección por lesión que pueda ocurrir (Tabla 1). - Use una jeringa de 500 μL con una aguja de 33 G para aspirar 101-301 μL de solución ablativa. Aspirar 1 μL extra de la solución para una posible fuga menor al retirar la aguja canulada.
NOTA: Estas son recomendaciones para volúmenes destinados a llenar completamente el árbol ductal: hasta 100 μL en las glándulas cervicales e inguinales, y hasta 300 μL en las otras glándulas. Para otras aplicaciones, puede ser apropiado utilizar volúmenes más pequeños o más grandes. - Use una pinza para sostener suavemente el pezón y canulación de la aguja en la abertura del pezón. Continúe insertando suavemente la aguja hasta que el bisel esté completamente dentro del pezón. Para acomodar la aguja en el pezón, lleve el pezón hacia la aguja en lugar de empujar la aguja hacia abajo en el pezón. (Tabla 1). Tenga cuidado de seguir el camino de la abertura del pezón.
NOTA: Los pezones de rata son generalmente mucho más fáciles de manipular y canular con éxito que los de los ratones debido a su mayor tamaño. Sin embargo, el aumento de la cantidad de grasa que rodea la abertura del pezón también hace que sea más probable inyectar por error la almohadilla de grasa si la aguja se desvía del conducto principal. - Una vez que el bisel de la aguja esté completamente insertado, infundir lentamente la solución a una velocidad constante de aproximadamente 100 μL/min en ratas. Los cambios bruscos en la velocidad de infusión pueden estallar o dañar el árbol ductal. Espere 30 s después del final de la infusión antes de retirar la aguja del árbol canulado con ayuda usando fórceps; esto asegura que el volumen inyectado permanezca dentro del árbol ductal (Figura 2) y reduce la probabilidad de fuga.
- Limpie cualquier solución derramada con una gasa humedecida o una toallita EtOH para evitar una solución de contraste extraña en las imágenes.
- Inyecte PBS que contenga 5% de sacarosa (10 ml / kg) por vía intraperitoneal para mitigar los efectos de la intoxicación por alcohol si el etanol está contenido dentro de las soluciones de inyección de ID. Esta dosis se puede administrar al principio y al final del procedimiento.
4. Imágenes de micro-TC
- Después de que se hayan inyectado todas las glándulas deseadas, mueva al animal rápidamente al sistema micro-CT y continúe manteniendo la anestesia utilizando el vaporizador de isoflurano incorporado.
- Enderezar la columna vertebral del animal y pegar con cinta adhesiva cada pata trasera en una posición extendida, de modo que los huesos de las patas del animal estén más alejados de las glándulas inferiores de interés y no se superpongan con la región de interés en la imagen escaneada.
- Coloque cinta adhesiva a través del abdomen para minimizar los artefactos respiratorios si escanea las glándulas inferiores.
NOTA: Se pueden obtener imágenes de animales con diferentes parámetros de escaneo (por ejemplo, escaneos longitudinales de alta resolución) si se tiene cuidado de determinar una dosis aceptable apropiada de radiación de por vida para ratas y garantizar que la dosis acumulada no exceda este nivel. La exposición a la radiación puede reducirse aún más mediante la adquisición de imágenes fijas y videos de fluoroscopia sin realizar exploraciones (Figura 2). - Realice imágenes TaOx del árbol ductal de rata con buena resolución y oportunidad para escaneos de adquisición estándar repetidos (2 min) utilizando los siguientes parámetros de escaneo: 90 kVp / 88 μA; campo de visión (FOV), 72 mm; número de rebanadas, 512; espesor del corte, 72 μm; Resolución de vóxel, 72 μm3. Las exploraciones de alta resolución durante períodos de tiempo más largos (4-14 min) también se pueden adquirir en animales que no se escanearán longitudinalmente utilizando los mismos parámetros.
- Después de la adquisición de datos, retire cuidadosamente a la rata del cono de anestesia y colóquela en una nueva jaula limpia en una almohadilla térmica. Revise a la rata para asegurarse de que se haya recuperado completamente de la anestesia antes de llevarla de vuelta a su jaula permanente. Coloque la copa de sucralosa que contiene carprofeno y reemplácela adecuadamente como se describe en el paso 2.5 para asegurarse de que los animales continúen recibiendo tratamiento antiinflamatorio durante los próximos 7 días.
- Procese las imágenes escaneadas en representaciones rápidas dentro del software micro-CT para apreciar mejor cualquier fuga de contraste, solo llenado parcial o sobrellenado (Figura 2).
- Continúe con la siguiente sección para realizar el procesamiento formal de imágenes para su publicación o análisis detallado de escaneos si lo desea (Figura 3).
5. Análisis de imágenes
- Utilice paquetes de software especializados para producir representaciones del árbol ductal lleno.
NOTA: Es mejor segmentar la almohadilla de grasa mamaria para obtener la mejor interpretación del árbol ductal inyectado. Spline traza los límites oscuros de la almohadilla de grasa a lo largo del grosor completo del animal para lograr esta segmentación. - Para segmentar la almohadilla de grasa (a diferencia de los ratones, los límites de este compartimento no son tan fácilmente distinguibles de la cavidad peritoneal, los músculos femorales y la piel debido a unidades Hounsfield similares) dentro de la cual se encuentra el árbol ductal de interés, seleccionar la opción "traza de spline" en el menú manual es el primer paso para crear una representación.
- Spline traza el contorno de la almohadilla de grasa en cada tercera rebanada. Haga clic en la opción Propagar objetos del menú semiautomático. Esto propagará y conectará todas las rebanadas en un solo objeto segmentado de interés.
NOTA: Cambiar el umbral dentro de la región segmentada permite la visualización de la señal solo dentro de un cierto rango de unidades Hounsfield (HU); Para otros agentes de contraste o parámetros de imagen, es posible que sea necesario ajustar este rango. Se puede usar un paquete de software o un análisis de Inteligencia Artificial para realizar otras mediciones e imágenes para mostrar cuánto se llenó el árbol ductal. - Establezca los valores de HU en un punto bajo de 300 y un punto alto de 3.000 en el menú semiautomático en la pestaña de volumen de umbral. Esto permite la creación de una representación que sólo muestre el contraste (TaOx) dentro del árbol ductal.
- Defina la representación como principal mediante el botón "ver". Esto cambiará la visualización para mostrar solo la representación 3D del árbol ductal.
NOTA: Realice la reconstrucción del árbol ductal para su posterior análisis.
Resultados
Cada una de las 12 glándulas mamarias de una rata hembra contiene un solo árbol ductal que se abre en el orificio del pezón. A pesar de las diferencias de tamaño entre el ratón y la rata, el momento de desarrollo de las glándulas mamarias y el tiempo que estos animales alcanzan la edad adulta es muy similar30,31. Se proporciona una breve descripción de las etapas clave del desarrollo de la glándula mamaria en ratas como representativas de ambas especies de roedores. Las yemas terminales terminales (TEB) son las estructuras altamente proliferativas en las puntas del árbol ductal alargado que dirigen la ramificación ductal30,31. El pico de proliferación y densidad de los TEBs ocurre a las 3-4 semanas de edad durante la fase de alargamiento del árbol ductal en el desarrollo puberal30. A las 9-10 semanas de edad, quedan pocos TEB ya que el árbol ductal ha crecido hasta ocupar toda la longitud de la almohadilla de grasa30. Después de eso, el crecimiento y la expansión del árbol ductal es proporcional a la de la almohadilla de grasa y del animal32. Las unidades lobulares ductales terminales (TDLU) en la mama humana desempeñan un papel similar al de los TEB en roedores. Las TDLU son la principal fuente de inicio de carcinogénesis y progresión a BC33,34. Podemos inyectar hasta 300 μL de solución de EtOH al 70% para llenar todo el árbol ductal de las glándulas mamarias torácicas y abdominales de la rata Sprague-Dawley de 9 semanas de edad (Figura 1, Figura 2, Figura 3). A diferencia de los ratones 20, los pezones de las glándulas cervicales e inguinales de las ratas Sprague-Dawley son típicamente adecuados para inyección en más del 80% de los animales, y se requieren hasta 100 μL de solución de EtOH al70% para llenar todo el árbol ductal (Figura 2). Inyectamos rutinariamente hasta 10 glándulas mamarias con la solución ablativa en estudio. Un diseño experimental típico consiste en dos sesiones semanales independientes de inyección de ID, en las que se infunden cinco glándulas alternas con la solución ablativa que contiene agente de contraste de rayos X y / o EC como agente gelificante (Figura 2). Para la solución ablativa que contiene TaOx (50-200 mM), se realiza fluoroscopia y/o micro-TC después del final de cada sesión para determinar y registrar el éxito individual de la infusión de cada árbol ductal con cantidad parcial o total de solución infundida (Figura 2). Las imágenes inmediatas y longitudinales después de la inyección permiten evaluar cómo los cambios en la formulación, especialmente la concentración del agente gelificante CE, afectan y limitan la difusión hacia el exterior de la solución ablativa en función del volumen inyectado (Figura 3). Este análisis por imágenes proporciona información para comprender los parámetros óptimos para lograr la máxima ablación con un daño tisular colateral mínimo.
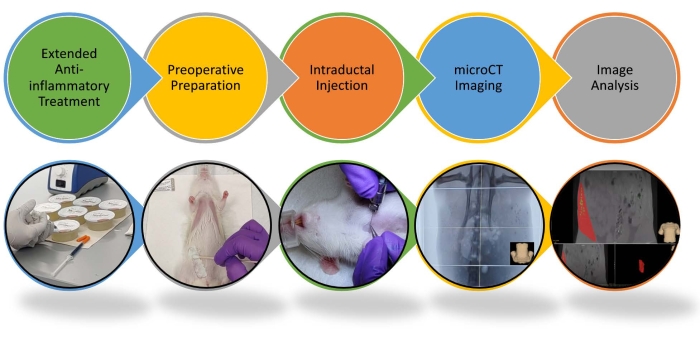
Figura 1: Esquemas del procedimiento para inyección intraductal y análisis de imágenes en ratas. Se destaca el procedimiento paso a paso para la inyección intraductal y el análisis de imágenes. Por favor, vea el video para más detalles. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Ejemplos de canulación del pezón y resultado de la administración de la solución ablativa en múltiples glándulas mamarias . (A) Presentación típica de las formas del pezón en la cepa de ratas Sprague-Dawley. La longitud del pezón se correlaciona con la probabilidad de una canulación exitosa. Los pezones más largos son más fáciles de canular que los pezones cortos, mientras que los pezones excesivamente cortos o vestigiales no se pueden canular. Una vez canulados, tanto los pezones largos como los cortos se pueden infundir con la solución y lograr tasas de éxito similares de entrega. El colorante alimentario azul en la solución inyectada se puede usar como evidencia in vivo del llenado del árbol ductal y el éxito de la entrega (lo más evidente, la formación de domos, para una inyección fallida de almohadilla de grasa). La fluoroscopia (B) en tiempo real y las representaciones micro-CT 3D generadas después de la adquisición de imágenes (C) proporcionan evidencia in vivo del éxito de la entrega y una evaluación más cuantitativa de la solución que llega a los TEB. (B) Cada glándula mamaria abdominal del primer par (#4, #10) recibió solución ablativa con 1% EC (contorno naranja) o sin ella (contorno verde) (C) Entrega exitosa (contorno azul) de la solución ablativa en el # 7 cervical derecho, segundo par de glándulas mamarias torácicas (# 3, # 9) y primer par de glándulas mamarias abdominales (# 4, # 10), e inyección fallida (contorno blanco discontinuo) en la glándula torácica izquierda . Las barras de escala corresponden a 1 mm en las imágenes con diferentes aumentos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Reconstrucción 3D y evaluación del llenado y difusión de la solución ablativa . 70% EtOH/100 mM Las nanopartículasTaO x con 1% EC (arriba) o sin EC (abajo) se inyectaron intraducalmente en el segundo par de glándulas mamarias abdominales (# 4 y # 10) e inmediatamente se obtuvieron imágenes mediante micro-TC. Cada rata Sprague-Dawley recibió un volumen creciente de cualquiera de las soluciones. Los árboles ductales individuales se reconstruyeron utilizando un paquete de software de análisis de imágenes (traza spline + objeto de propagación + representación de umbral). Con 1% EC, la solución se puede ver llegando a los extremos terminales. A medida que aumenta el volumen entregado, el número de TEB llenos es más evidente. La barra de escala corresponde a 10 mm en todas las representaciones. Haga clic aquí para ver una versión más grande de esta figura.
| Emitir | Apariencia | Solución | |||
| Pezón corto (Fig. 2) | El pezón tiene un perfil bajo, difícil de agarrar | A veces es más fácil sostener la piel cerca del pezón y apuntar al centro del pezón con la aguja. Es probable que la aguja se sumerja debajo de la piel. Tirar hacia arriba lentamente puede revelar que el pezón está ligeramente sobre la punta de la aguja y dar espacio para agarrarlo y tirar de él el resto del camino hacia la aguja. Tenga mucho cuidado al bucear debajo de la piel sobre el ángulo de la aguja. Es fácil obtener inadvertidamente una inyección de almohadilla de grasa apuñalando en el ángulo equivocado. | |||
| Inyección de almohadilla de grasa (Fig. 2) | Hinchazón alrededor del pezón y posiblemente en el pezón mismo: es más fácil ver si se agrega color a la solución inyectable | Si el pezón se hincha con los primeros se inyectan, retire la aguja e intente insertarla nuevamente con más cuidado del ángulo. Comience la inyección nuevamente y esté atento a una mayor hinchazón. Si la hinchazón continúa, abandone el intento. Es muy raro inyectar con éxito un pezón que ha comenzado como una inyección de almohadilla de grasa. | |||
| Heridas/costras | Herida abierta o costras cerca del lugar de inyección de la solución de EtOH | Las ratas son más propensas que los ratones a desarrollar heridas o costras cerca del área de inyección. Si se encuentran heridas, aplique ungüento antibiótico triple a las heridas abiertas, pero deje las heridas con costras. La aplicación de ungüento a las costras puede aumentar la probabilidad de que el animal moleste la costra y la elimine. Verifique cada 1-2 días hasta que cicatrice dependiendo de la gravedad de la herida. El carprofeno debe administrarse hasta que sane, incluso si está más allá de la ventana normal. | |||
| Inyectar glándulas alternas | N/A | Los volúmenes de inyección más grandes en ratas hacen que sea más probable que cause abrasiones en la piel si se inyectan glándulas consecutivas. Para la menor probabilidad de traumatismo en el área de inyección, se inyectan glándulas alternativas dentro de una sola sesión (es decir, inyecte # 1, 3, 4 y 6 en lugar de # 1-4). El espaciamiento entre el tercer (#3 y #9) y cuarto (#4 y #10) pares de glándulas permite la inyección de ambas glándulas en una sola sesión. | |||
Tabla 1: Consejos útiles y solución de problemas
Discusión
Como se muestra aquí, la administración de ID de EtOH al 70% disminuye preferentemente las células epiteliales mamarias con daño colateral limitado al estroma y la vasculatura circundantes en ratones4. La ablación local del árbol ductal es eficaz para prevenir la formación de tumores en modelos de ratón4. Aquí, demostramos que este procedimiento ablativo se puede ampliar a ratas.
Este es el siguiente paso en el camino hacia la traducción de este procedimiento ablativo como una intervención alternativa a la mastectomía profiláctica para la prevención primaria del cáncer de mama en individuos de alto riesgo. La adición de nanopartículasTaO x como agente de contraste de rayos X a la solución ablativa permite evaluar la efectividad de la solución para prevenir la formación de tumores, ya que se puede determinar si el procedimiento fue exitoso o no para llenar completamente el árbol ductal. El uso de fluoroscopia para visualizar la glándula mamaria inyectada refleja lo que probablemente se hará en la clínica para guiar este procedimiento de identificación. La guía de imagen de cuánto ha llenado la solución el árbol ductal y cuándo detener la infusión será un aspecto clave de la implementación clínica para garantizar el máximo llenado de cada árbol ductal. Las soluciones de problemas y consejos útiles se enumeran en la Tabla 1. La efectividad de este procedimiento ablativo requiere que la solución infundida haga contacto directo con todas las células epiteliales para maximizar la tasa de destrucción celular. Las células epiteliales de repuesto dentro de uno o más árboles podrían eventualmente servir como fuente para el desarrollo de BC. Los otros grupos informaron la entrega de ID de partículas virales (por ejemplo, componentes de los sistemas Cre / LoxP y / o Cas9 / CRISPR), hormonas y antagonistas hormonales (por ejemplo, prolactina, fulvestrant), agentes quimioterapéuticos (por ejemplo, cisplatino), ARNip y / o anticuerpos u otros agentes dirigidos en ratones 4,19,21,35,36,37,38,39,40, 41,42,43,44,45, ratas 21,33,46,47,48 y/o conejos 18,49,50,51,52,53 . La canulación exitosa de hasta ocho árboles ductales por mama humana para la administración local de quimioterapia ha sido reportada en estudios clínicos independientes 47,54,55. La guía de imagen para la infusión de estas otras soluciones dirigidas a la prevención tumoral o orientadas al tratamiento local maximizaría de manera similar su efectividad.
La escalabilidad y el refinamiento de este procedimiento de ratón a árbol ductal de rata se demuestra aquí. La nanopartícula TaOx en el árbol ductal murino 4,19 y rata (datos no publicados) proporciona imágenes de alta resolución que superan los agentes de contraste de rayos X que contienen yodo aprobados por la FDA. Del mismo modo, desconocemos otros enfoques de imágenes de árboles ductales en ratones40,41 u otros modelos animales18 que puedan proporcionar una resolución comparable a TaOx. Relevante para la traducción clínica es el hecho de que el efecto gelificante de la EC en estos modelos de ratas de tamaño intermedio es un refinamiento de la formulación que permite minimizar el daño tisular colateral. A medida que continuamos evaluando este procedimiento de identificación ablativa por su capacidad para prevenir BC, podremos determinar, con mayor precisión, a partir de qué glándulas BC se desarrolla a través de la información adicional proporcionada por imágenes después de la entrega de ID en modelos de BC inducidos químicamente y otros modelos de rata. Estos datos determinarán la seguridad de este procedimiento e identificarán cualquier preocupación o deficiencia de si los árboles ductales tratados parcial o no con éxito podrían ser más propensos a desarrollar BC en una mujer de alto riesgo.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado, en parte, por las subvenciones R21 CA226579 y R01 CA258314 del Instituto Nacional del Cáncer a LFS y por la subvención del Instituto Nacional de Imágenes Biomédicas y Bioingeniería R01 EB029418 a EMS. Agradecemos a las instalaciones del MSU Institute for Quantitative (IQ) Health Science and Engineering Imaging Core por el uso de sus sistemas de imágenes y experiencia técnica. Danielle Ferguson por revisar el contenido del video y las cifras de cumplimiento de las pautas de bienestar animal.
Materiales
| Name | Company | Catalog Number | Comments |
| AnalyzeDirect v12.0 | Caliper | n/a | For micro-CT image processing |
| Carprieve, Carprofen 50 mg/mL | Allivet | 50647 | For anti-inflammatory treatment |
| Ethyl cellulose | Acros Organics | 9004-57-3 | For intraductal injection |
| Evans blue | Sigma | E2129-50G | For injection visualization |
| Hot water bath | Toolots | Yidu_HH-S2 | For preparing carprofen cups |
| MediGel Sucralose Cups | ClearH2O | 74-02-5022 | For delivery of carprofen |
| Model 1750 TTL, PTFE Luer Lock Syringe, 500μL | Hamilton | 81220 | For intraductal injection |
| Photoshop 2021 | Adobe | n/a | For image processing |
| Quantum GX2 microCT Imaging System | Perkin Elmer | CLS149276 | For micro-CT image acquisition |
| Metal Hub Needle, 33 gauge, custom (30° bevel angle, 0.4 in, point style 4) | Hamilton | 7747-01 | For intraductal injection |
| Stereo Microscope SZM Series | AmScope | SM-4TPZ-144 | For intraductal injection |
| Sterile blue food dye | McCormick | 930641 | For injection visualization |
| Sterile phosphate buffered saline (PBS) | ThermoFisher | 14190250 | For solution preparation |
| Stickers | DOT Scientific | DOTSCI-C50 | For preparing carprofen cups |
| Sucrose | Calbiochem | 8550-5KG | For intraductal injection |
| Syringes | Fisher | 14-826-79 | For preparing carprofen cups |
| Vortex | VWR | 10153-834 | For preparing carprofen cups |
| Warming pump/pad(s) | Braintree Scientific | HTP-1500 120V; AP-R 26E | For intraductal injection/preoperative preparation |
Referencias
- Siegel, R. L., Miller, K. D., Fuchs, H. E., Jemal, A. Cancer statistics, 2022. A Cancer Journal for Clinicians. 72 (1), 7-33 (2022).
- Wild, C. P. The global cancer burden: necessity is the mother of prevention. Nature Reviews. Cancer. 19 (3), 123-124 (2019).
- Padamsee, T. J., Wills, C. E., Yee, L. D., Paskett, E. D. Decision making for breast cancer prevention among women at elevated risk. Breast Cancer Research. 19 (1), 34 (2017).
- Kenyon, E., et al. Ductal tree ablation by local delivery of ethanol prevents tumor formation in an aggressive mouse model of breast cancer. Breast Cancer Research. 21 (1), 129 (2019).
- Kuang, M., et al. Ethanol ablation of hepatocellular carcinoma Up to 5.0 cm by using a multipronged injection needle with high-dose strategy. Radiology. 253 (2), 552-561 (2009).
- Ansari, D., Andersson, R. Radiofrequency ablation or percutaneous ethanol injection for the treatment of liver tumors. World Journal of Gastroenterology. 18 (10), 1003-1008 (2012).
- Zhang, W. Y., Li, Z. S., Jin, Z. D. Endoscopic ultrasound-guided ethanol ablation therapy for tumors. World Journal of Gastroenterology. 19 (22), 3397-3403 (2013).
- Chin, M., Chen, C. L., Chang, K., Lee, J., Samarasena, J. Ethanol ablation of a peripheral nerve sheath tumor presenting as a small bowel obstruction. ACG Case Reports Journal. 3 (1), 31-32 (2015).
- Gueng, M. -. K., Chou, Y. -. H., Tiu, C. -. M., Chiou, S. -. Y., Cheng, Y. -. F. Pseudoaneurysm of the breast treated with percutaneous ethanol injection. Journal of Medical Ultrasound. 22 (2), 114-116 (2014).
- Zhang, J., et al. Comparison between absolute ethanol and bleomycin for the treatment of venous malformation in children. Experimental and Therapeutic Medicine. 6 (2), 305-309 (2013).
- Wohlgemuth, W. A., et al. Ethanolgel sclerotherapy of venous malformations improves health-related quality-of-life in adults and children - results of a prospective study. European Radiology. 27 (6), 2482-2488 (2017).
- Steiner, F., FitzJohn, T., Tan, S. T. Ethanol sclerotherapy for venous malformation. ANZ Journal of Surgery. 86 (10), 790-795 (2016).
- Sannier, K., et al. A new sclerosing agent in the treatment of venous malformations. Study on 23 cases. Interventional Neuroradiology. 10 (2), 113-127 (2004).
- Dompmartin, A., et al. Radio-opaque ethylcellulose-ethanol is a safe and efficient sclerosing agent for venous malformations. European Radiology. 21 (12), 2647-2656 (2011).
- Faguy, K. Ductography: When, how, and why. Radiologic Technology. 92 (5), 487-503 (2021).
- Slawson, S. H., Johnson, B. A. Ductography: how to and what if. Radiographics. 21 (1), 133-150 (2001).
- Sheiman, L. S., Levesque, P. H. The in's and out's of ductography: A comprehensive review. Current Problems in Diagnostic Radiology. 45 (1), 61-70 (2016).
- Clark, A., Bird, N. K., Brock, A. Intraductal delivery to the rabbit mammary gland. Journal of Visualized Experiments. (121), e55209 (2017).
- Chakravarty, S., et al. Tantalum oxide nanoparticles as versatile contrast agents for X-ray computed tomography. Nanoscale. 12 (14), 7720-7734 (2020).
- Kenyon, E., et al. Intraductal delivery and x-ray visualization of ethanol-based ablative solution for prevention and local treatment of breast cancer in mouse models. Journal of Visualized Experiments. (182), e63457 (2022).
- Murata, S., et al. Ductal access for prevention and therapy of mammary tumors. Cancer Research. 66 (2), 638-645 (2006).
- King, B. L., Love, S. M. The intraductal approach to the breast: raison d'etre. Breast Cancer Research. 8 (2), 206 (2006).
- Love, S. M., Barsky, S. H. Anatomy of the nipple and breast ducts revisited. Cancer. 101 (9), 1947-1957 (2004).
- Lai, Y. E., Morhard, R., Ramanujam, N., Nolan, M. W. Minimally invasive ethyl cellulose ethanol ablation in domesticated cats with naturally occurring head and neck cancers: Six cats. Veterinary and Comparative Oncology. 19 (3), 492-500 (2021).
- Mueller, J. L., et al. Optimizing ethyl cellulose-ethanol delivery towards enabling ablation of cervical dysplasia. Scientific Reports. 11 (1), 16869 (2021).
- Nief, C., et al. Polymer-assisted intratumoral delivery of ethanol: Preclinical investigation of safety and efficacy in a murine breast cancer model. PLoS One. 16 (1), 0234535 (2021).
- Chelales, E., et al. Radiologic-pathologic analysis of increased ethanol localization and ablative extent achieved by ethyl cellulose. Scientific Reports. 11 (1), 20700 (2021).
- Morhard, R., et al. Understanding factors governing distribution volume of ethyl cellulose-ethanol to optimize ablative therapy in the liver. IEEE Trans Biomedical Engineering. 67 (8), 2337-2348 (2020).
- Morhard, R., et al. Development of enhanced ethanol ablation as an alternative to surgery in treatment of superficial solid tumors. Scientific Reports. 7 (1), 8750 (2017).
- Russo, I. H., Russo, J. Developmental stage of the rat mammary gland as determinant of its susceptibility to 7,12-dimethylbenz[a]anthracene. Journal of the National Cancer Institute. 61 (6), 1439-1449 (1978).
- Paine, I. S., Lewis, M. T. The terminal end bud: The little engine that could. Journal of Mammary Gland Biology Neoplasia. 22 (2), 93-108 (2017).
- Hinck, L., Silberstein, G. B. Key stages in mammary gland development: the mammary end bud as a motile organ. Breast Cancer Research. 7 (6), 245-251 (2005).
- Sivaraman, L., et al. Effect of selective ablation of proliferating mammary epithelial cells on MNU induced rat mammary tumorigenesis. Breast Cancer Research Treatment. 73 (1), 75-83 (2002).
- Cardiff, R. D., Wellings, S. R. The comparative pathology of human and mouse mammary glands. Journal of Mammary Gland Biology Neoplasia. 4 (1), 105-122 (1999).
- Brock, A., et al. Silencing HoxA1 by intraductal injection of siRNA lipidoid nanoparticles prevents mammary tumor progression in mice. Scientific Translational Medicine. 6 (217), (2014).
- de Groot, J. S., et al. Intraductal cisplatin treatment in a BRCA-associated breast cancer mouse model attenuates tumor development but leads to systemic tumors in aged female mice. Oncotarget. 8 (37), 60750-60763 (2017).
- Wang, G., et al. Intraductal fulvestrant for therapy of ERalpha-positive Ductal Carcinoma in Situ (DCIS) of the breast - A preclinical study. Carcinogenesis. 40 (7), 907-913 (2019).
- Yoshida, T., et al. Effective treatment of ductal carcinoma in situ with a HER-2- targeted alpha-particle emitting radionuclide in a preclinical model of human breast cancer. Oncotarget. 7 (22), 33306-33315 (2016).
- Chun, Y. S., et al. Intraductally administered pegylated liposomal doxorubicin reduces mammary stem cell function in the mammary gland but in the long term, induces malignant tumors. Breast Cancer Research Treatment. 135 (1), 201-208 (2012).
- Markiewicz, E., et al. High resolution 3D MRI of mouse mammary glands with intra-ductal injection of contrast media. Magnetic Resonance Imaging. 33 (1), 161-165 (2015).
- Markiewicz, E., et al. MRI ductography of contrast agent distribution and leakage in normal mouse mammary ducts and ducts with in situ cancer. Magnetic Resonance Imaging. 40, 48-52 (2017).
- Annunziato, S., et al. Comparative oncogenomics identifies combinations of driver genes and drug targets in BRCA1-mutated breast cancer. Nature Communications. 10 (1), 397 (2019).
- Rutkowski, M. R., et al. Initiation of metastatic breast carcinoma by targeting of the ductal epithelium with adenovirus-cre: a novel transgenic mouse model of breast cancer. Journal of Visualized Experiments. (85), e51171 (2014).
- Xiang, D., Tao, L., Li, Z. Modeling breast cancer via an intraductal injection of cre-expressing adenovirus into the mouse mammary gland. Journal of Visualized Experiments. (148), e59502 (2019).
- Barham, W., Sherrill, T., Connelly, L., Blackwell, T. S., Yull, F. E. Intraductal injection of LPS as a mouse model of mastitis: signaling visualized via an NF-kappaB reporter transgenic. Journal of Visualized Experiments. (67), e4030 (2012).
- Chun, Y. S., et al. Intraductal administration of a polymeric nanoparticle formulation of curcumin (NanoCurc) significantly attenuates incidence of mammary tumors in a rodent chemical carcinogenesis model: Implications for breast cancer chemoprevention in at-risk populations. Carcinogenesis. 33 (11), 2242-2249 (2012).
- Stearns, V., et al. Preclinical and clinical evaluation of intraductally administered agents in early breast cancer. Science Translational Medicine. 3 (106), (2011).
- Okugawa, H., et al. Effect of perductal paclitaxel exposure on the development of MNU-induced mammary carcinoma in female S-D rats. Breast Cancer Research Treatment. 91 (1), 29-34 (2005).
- Falconer, I. R. The distribution of 131 I- or 125 I-labelled prolactin in rabbit mammary tissue after intravenous or intraductal injection. Journal of Endocrinology. 53 (3), 58-59 (1972).
- Fiddler, T. J., Birkinshaw, M., Falconer, I. R. Effects of intraductal prolactin on some aspects of the ultrastructure and biochemistry of mammary tissue in the pseudopregnant rabbit. Journal of Endocrinology. 49 (3), 459-469 (1971).
- Fiddler, T. J., Falconer, I. R. The effect of intraductal prolactin on protein and nucleic acid biosynthesis in the rabbit mammary gland. The Biochemical Journal. 115 (5), 58 (1969).
- Bourne, R. A., Bryant, J. A., Falconer, I. R. Stimulation of DNA synthesis by prolactin in rabbit mammary tissue. Journal of Cell Science. 14 (1), 105-111 (1974).
- Chadwick, A. Detection and assay of prolactin by the local lactogenic response in the rabbit. The Journal of Endocrinology. 27, 253-263 (1963).
- Mahoney, M. E., et al. Intraductal therapy of ductal carcinoma in situ: a presurgery study. Clinical Breast Cancer. 13 (4), 280-286 (2013).
- Love, S. M., et al. A feasibility study of the intraductal administration of chemotherapy. Cancer Preview Research (Phila). 6 (1), 51-58 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados