Method Article
Рентгеновская визуализация абляционного лечения на основе этанола для профилактики рака молочной железы на крысиных моделях
В этой статье
Резюме
Описана процедура доставки химического абляционного раствора к дереву протоков молочной железы крысы для визуализационного профилактического лечения рака молочной железы. Эпителиальные клетки молочной железы могут быть нацелены с минимальным повреждением коллатеральной ткани путем канюляции непосредственно в отверстие соска и внутрипротоковой инфузии 70% абляционного раствора на основе этанола.
Аннотация
По-прежнему существует ограниченное число первичных вмешательств для профилактики рака молочной железы. Для женщин с высоким риском развития рака молочной железы наиболее эффективным вмешательством является профилактическая мастэктомия. Это радикальная хирургическая процедура, при которой эпителиальные клетки молочной железы, которые могут вызвать рак молочной железы, полностью удаляются вместе с окружающими тканями. Целью этого протокола является демонстрация осуществимости минимально инвазивной внутрипродукционной процедуры, которая может стать новым первичным вмешательством для профилактики рака молочной железы. Эта местная процедура предпочтительно удаляет эпителиальные клетки молочной железы, прежде чем они могут стать злокачественными. Внутрипротоковые методы доставки растворов непосредственно к этим эпителиальным клеткам в моделях рака молочной железы грызунов были разработаны в Мичиганском государственном университете и в других местах. Молочная железа крысы состоит из одного протокового дерева, которое имеет более простую и линейную архитектуру по сравнению с человеческой грудью. Тем не менее, химически индуцированные крысиные модели рака молочной железы предлагают ценные инструменты для экспериментальных исследований новых профилактических вмешательств и масштабируемости от мышиных моделей до людей. Здесь описана процедура внутрипротоковой доставки абляционного раствора на основе этанола, содержащего наночастицы оксида тантала в качестве рентгеноконтрастного вещества и этилцеллюлозу в качестве гелеобразующего агента в дерево протоков молочной железы крысы. Доставка водных реагентов (например, цитотоксических соединений, siRNAs, AdCre) путем внутрипротоковой инъекции была описана ранее на моделях мышей и крыс. В этом описании протокола подчеркиваются методологические изменения и шаги, которые относятся исключительно к доставке абляционного раствора, рассмотрению формулировки для минимизации местных и системных побочных эффектов абляционного раствора и рентгеновской визуализации для оценки in vivo заполнения протокового дерева. Методы рентгеноскопии и микроКТ позволяют определить успешность доставки аблятивного раствора и степень заполнения протокового дерева благодаря совместимости с танталсодержащим контрастным веществом.
Введение
Для женщин в США1 рак молочной железы (BC) продолжает оставаться наиболее диагностируемым типом рака и вызывает больше смертей, чем любой другой тип рака, кроме рака легких. Прогнозы на 2022 год оценивают, что 51 400 женщин будут диагностированы с карциномой in situ и 287 850 женщин будут диагностированы с инвазивной карциномой, и что 43 600 женщин умрут от BC1. Несмотря на распространенность и смертность, связанные с БК, существует мало вариантов первичной профилактики и трансляционных исследований новых вмешательств, поскольку первичная профилактика не является приоритетной для федеральных агентств2. Профилактическая мастэктомия является наиболее эффективным вмешательством для первичной профилактики. Тем не менее, эта процедура рекомендуется только для лиц с высоким риском, потому что это серьезная операция с последствиями, изменяющими жизнь3. Эта операция включает в себя полное удаление эпителиальных клеток молочной железы, из которых развивается канцерогенез, а также нормальных окружающих тканей. Людей часто отговаривают от использования этой процедуры в качестве первого варианта первичного вмешательства из-за негативного воздействия физического, психологического и социального стресса. По этим причинам даже некоторые лица с высоким риском предпочитают не проходить эту процедуру и вместо этого выбирают бдительное ожидание или аналогичные стратегии наблюдения3. В предыдущей публикации доставка 70% этанола (EtOH) непосредственно в протоковое дерево мышиных моделей была эффективна при химическом абляции эпителиальных клеток молочной железы с ограниченным повреждением соседних нормальных тканей и при предотвращении образования опухоли молочной железы4. EtOH используется в нескольких клинических применениях в качестве абляционного агента для местного лечения некоторых видов рака или склерозирующего агента для местного лечения артериовенозного отека и пороков развития 5,6,7,8,9,10,11,12,13,14 . Низкий профиль токсичности и безопасности EtOH хорошо известен, так как в некоторых процедурах до 50 мл 95% EtOH может быть введено за сеанс 5,10.
Полное удаление эпителиальных клеток молочной железы, из которых развивается БК, является важнейшим компонентом как профилактической мастэктомии, так и местной доставки абляционного раствора. Поэтому подтверждение полного заполнения протокового дерева необходимо, чтобы гарантировать, что абляционный раствор вступил в непосредственный контакт со всеми эпителиальными клетками молочной железы. Доставка раствора в протоковом дереве (деревьях) и его визуализация с помощью рентгеноскопии или дуктографии с визуальным контролем возможны с помощью клинических процедур, которые уже существуют 15,16,17. Таким образом, будет возможно легко внедрить и оценить эту процедуру в клинических испытаниях. Ключевым шагом в установлении эффективности и трансляционной осуществимости интрапродукционной (ID) абляции в качестве нового вмешательства для первичной профилактики будет демонстрация осуществимости этого подхода к рентгеновской визуализации на животных моделях с возрастающим размером и сложностью их архитектуры протокового дерева 4,18,19. Здесь описан протокол, который масштабирует эту абляционную процедуру от мыши20 до моделей крыс. В то время как мышиные и крысиные проточные деревья имеют сходную линейную структуру и ветвящийся рисунок, дерево протоков крысы пропорционально больше и окружено гораздо более плотной стромой. Мы внедрили в лаборатории метод успешного введения каждой молочной железы крысе в течение серии еженедельных сеансов абляционным раствором, содержащим контрастное вещество. Интервал между сессиями необходим для обеспечения минимальных побочных эффектов EtOH у животных (рисунок 1 и рисунок 2). Процедура включает в себя инъекцию абляционного раствора непосредственно в отверстие соска изофлуран-анестезированной крысы иглой 33 G. Некоторые ключевые улучшения процедуры включают использование расширенного противовоспалительного лечения, инъекции более высоких объемов на протоковое дерево, чем предложено21, и газонепроницаемые шприцы для жидкости и газов. Продолжительность лечения 5 мг/кг карпрофена (НПВП) от 48 ч до до 1 недели после инъекций ИД сопоставима с противовоспалительным протоколом, применяемым для склерозирующей терапии венозного порока развития в клинике. Лечение проводится пациентам под системной анестезией с последующим 2-дневным приемом противовоспалительных препаратов, таких как НПВП. Противовоспалительное лечение может быть продлено еще на несколько дней, чтобы уменьшить местное воспаление и любую потенциальную боль13. Как и у мышей20, внутрибрюшинное введение 5% раствора сахарозы смягчает кратковременный эффект алкогольной интоксикации у крыс. Крысам можно вводить до 1 мл 70% EtOH (до 4 протоков; 0,2 г/дл содержания EtOH в крови) за один сеанс при введении с этим раствором сахарозы; животные полностью восстанавливаются в течение 4 ч после инъекций ИД. Мы проводим последовательные сеансы, чтобы обеспечить достаточное время восстановления при инъекции более 4 желез и / или более высоких концентраций EtOH. Алкогольная интоксикация у женщин будет гораздо менее вероятной, так как инъекция ID всех протоков в обеих грудях, предполагая, что16 основных протоков 16,17и 2 мл на проток 22,23, при этом 70% EtOH приведет к менее чем 0,1 г / дл содержания EtOH в крови и может вызвать легкое ухудшение.
Рентгеновская визуализация позволяет определить, насколько успешна внутрипротоковая доставка в каждой отдельной железе и заполнено ли все протоковое дерево (рисунок 1, рисунок 2, рисунок 3). Рентгеноскопическая визуализация в режиме реального времени в рамках подготовки к микро-КТ и/или 3D-реконструкции данных файла DICOM может быть использована для оценки степени доставки раствора в проточное дерево и любой утечки в строму. Использование рентгеноскопии может помочь ограничить общую дозу облучения, налагаемую на животное. Метод рентгеноскопии более приближен к предполагаемому клиническому применению для визуализации этого абляционного лечения. Сравнение одобренных FDA наночастиц йодсодержащего Isovue с наночастицами оксида тантала (TaOx) с целью дальнейшего уточнения полезности абляционного раствора 4,19. Было обнаружено, что TaOx является превосходным контрастным веществом микро-КТ, чем Isovue для визуализации начального заполнения протокового дерева у мышей 4,19. Здесь мы демонстрируем, что TaOx является подходящим контрастным веществом для визуализации первоначального заполнения дерева протоков крыс (рисунок 2 и рисунок 3). Как в трансляционных исследованиях, так и в клинической практике гелеобразующий агент этилцеллюлоза (ЕС) был добавлен в раствор EtOH для минимизации диффузии из намеченных целевыхобластей 13,14,24,25,26,27,28,29. Исследования показали, что добавление до 1,5% EC к EtOH-содержащим абляционным растворам совместимо с визуализацией на основе TaOx (рисунок 3). Это, а также дальнейшие усовершенствования абляционного раствора могут помочь в готовом переводе этой процедуры с визуальным контролем в клинику.
протокол
Все эксперименты, которые описаны, были проведены в соответствии с протоколами, одобренными Институциональным комитетом по уходу за животными и их использованию в Мичиганском государственном университете.
1. Расширенное противовоспалительное лечение
- Приготовьте чашки с сукралозным гелем в виде перорального дозирования карпрофена. Обеспечьте крысам это противовоспалительное лечение от 2 дней до получения инъекции ID 70% EtOH до 7 дней после процедуры.
- Развести рабочий раствор карпрофена в стерильном ПБС для инъекций в чашку. Из исходного раствора 50 мг/мл готовят разбавленный раствор 2 мг/мл, окрашенный 1% v/v стерильным синим пищевым красителем, и вводят по 500 мкл в каждый стакан. Добавление красителя помогает в визуализации полного перемешивания препарата внутри сукралозы чашки.
- Следуйте рекомендации производителя по подготовке чашки для добавления карпрофена. Если иное не указано продавцом, нагрейте чашку на водяной бане при 60 °C в течение 15 минут и высушите после удаления, чтобы снизить риск загрязнения.
- Протрите крышку стаканчика сукралозы с 70% EtOH в области и введите иглу шприца, содержащую рабочий раствор карпрофена. Дозировать в соответствующем объеме (500 мкл).
- Накройте прокол наклейкой. Энергично встряхните чашку в течение 15 с, а затем поместите ее в вихрь еще на 15 с. Визуально оцените однородное и полное смешивание перед хранением для последующего использования. Обратите внимание на наличие темно-синего цвета.
ПРИМЕЧАНИЕ: Дайте чашкам достичь комнатной температуры. При желании храните чашки при комнатной температуре, но обратите внимание на рекомендации по эффективности препарата от производителя. Кроме того, храните чашки при температуре 4 °C и используйте в течение месяца. Датировка наклейки является хорошей практикой для отслеживания даты инъекции без риска прокола крышки ручкой или острым маркером.
- Непосредственно перед использованием протрите внешнюю часть чашки 70% EtOH. Снимите крышку, прежде чем поместить чашку в клетку для животных. Заменяйте чашки через день или когда они пусты. Проверяйте уровень геля ежедневно, чтобы обеспечить адекватное дозирование. Одна чашка может поставлять карпрофен для двух крыс на срок до 2 дней; однако крысы могут съесть целую чашку раньше.
2. Предоперационная подготовка
ПРИМЕЧАНИЕ: Убедитесь, что этап подготовки животного предшествует процедуре инъекции ID на 2-3 дня.
- Включите испаритель изофлурана (2%-3% изофлурана, 1,5 л/мин кислорода) для обезболивания крысы. Переместите животное к носовому конусу на согревающей подушке. Нанесите глазную смазку на крысу, а затем расположите животное к спине. Тщательно следите за дыханием животного, чтобы убедиться, что анестезирующая плоскость поддерживается на уровне 1%-3% изофлурана.
ПРИМЕЧАНИЕ: Электрическая бритва может быть использована для удаления лишнего меха перед депиляцией. Необходимо проявлять крайнюю осторожность, чтобы не повредить соски бритвой. По этой причине этот шаг можно пропустить. Крысы более чувствительны к крему для депиляции, чем мыши, поэтому удаление лишнего крема очень важно. Избегайте введения раствора, содержащего этанол, в область, в которой уже есть истирание, присутствующее при депиляции. Некоторые кремы содержат такие соединения, как алоэ и ланолин, которые могут помочь свести к минимуму вероятность ссадин. - Используйте аппликатор с хлопковым наконечником, чтобы нанести безрецептурный крем для депиляции на область соска. Используйте аппликатор, чтобы втереть крем в область в течение 10-30 с. Проверьте, быстро ли ослаб мех.
- Оставьте крем на крысе на кратчайший интервал и снимите полностью, чтобы избежать ожога кожи. Крысы даже более чувствительны к этой процедуре, чем мыши.
- После 10-30 с применения смочите марлю теплой водой и используйте ее для смывания крема и разрыхленного меха с животного. Выполните не менее трех полосканий участка свежей смоченной марлей и высушите сухой марлей после окончательного ополаскивания. Подтвердите хорошую видимость и доступ к области соска, откуда удаляется мех. При необходимости повторите процедуру депиляции.
- Поместите крысу в чистую клетку на грелку и дайте ей восстановиться. Проверьте крысу, чтобы убедиться, что она полностью восстановилась после анестезии, прежде чем вернуть ее в постоянную клетку.
- Поместите одну дозированную карпрофеном (1 мг / чашку) чашку геля сукралозы в клетку для противовоспалительного лечения. Проверьте потребление геля ежедневно и замените его свежей чашкой по мере необходимости. Не оставляйте чашку более чем на 2 дня. Как правило, чашки нужно будет заменить через 1 день.
3. Внутрипротоковые инъекции
- Приготовьте раствор TaOx при 333,3 мМ, как описано19 , используя стерильный фосфатный буферизованный физиологический раствор (PBS). Нагрейте раствор, если порошок не растворится полностью. Осторожно перемешать. Не вращайтесь и не встряхивайте энергично, чтобы избежать образования пузырьков.
- Смешайте три части 333,3 мМ TaOx с семью частями 100% EtOH для получения окончательного 70% раствора EtOH 100 мМ/TaOx . Необязательно добавляют соответствующее количество 0,5%-1,5% этилцеллюлозы (ЕС) в качестве гелеобразующего агента для максимизации местного удержания абляционного раствора. Добавляют 1% v/v синего пищевого красителя в абляционный раствор для визуального осмотра доставки в протоковое дерево во время инфузии.
- Подготовьте том, подходящий для экспериментальных нужд. Пары желез 1 (шейная) и 6 (паховая) могут быть заполнены до 100 мкл раствора, в то время как все остальные пары могут быть заполнены до 300 мкл.
- Обезболить крысу, как на шаге 2.1, и переместить крысу к носовому конусу после полного обезболивания. Нанесите смазку для глаз на оба глаза, а затем положите животное на спину. Закрепите крысу под стереоскопом с помощью ленты возле сосков, которые будут вводиться при желании. Вес крысы, как правило, достаточен, чтобы удержать ее от существенного движения без заклеивания.
- Чтобы подготовить соски к инъекции, удалите все омертвевшие участки кожи, которые закрывают отверстие соска тонкими заостренными щипцами, если это возможно. У крыс часто есть пробка, выступающая из отверстия соска, которая может предотвратить успешную канюляцию соска, если ее не удалить.
ПРИМЕЧАНИЕ: Важно отметить, что большие объемы инъекций абляционных растворов, используемых у крыс, могут с большей вероятностью привести к поверхностным ранам кожи вблизи места (мест) инъекции. По этой причине инъекция каждого второго соска за один сеанс менее вредна и раздражает животное, чем инъекция соседних сосков. Наблюдение за крысами на предмет любых ссадин в течение 7 дней после инъекции помогает обеспечить отсутствие серьезных последствий для здоровья от царапин животного и введения возможности заражения от загрязнения обломками пола клетки. Тройная антибиотическая мазь или промывки раствором хлоргексидина могут быть использованы для лечения любых признаков травмированной инфекции, которые могут возникнуть (таблица 1). - Используйте шприц 500 мкл с иглой 33 г для аспирации 101-301 мкл абляционного раствора. Аспирировать дополнительно 1 мкл раствора для возможной незначительной утечки при удалении канюлированной иглы.
ПРИМЕЧАНИЕ: Это рекомендации для объемов, направленных на полное заполнение протокового дерева (деревьев): до 100 мкл в цервикальных и паховых железах и до 300 мкл в других железах. Для других применений может быть целесообразно использовать меньшие или большие объемы. - Используйте пинцет, чтобы осторожно удерживать сосок и каннюлировать иглу в отверстие соска. Осторожно продолжайте вводить иглу до тех пор, пока скос не окажется полностью внутри соска. Чтобы поместить иглу в сосок, поднесите сосок вверх к игле, а не проталкивайте иглу вниз в сосок. (Таблица 1). Следите за тем, чтобы следовать по пути отверстия соска.
ПРИМЕЧАНИЕ: Крысиные соски, как правило, гораздо легче манипулировать и успешно консервировать, чем у мышей из-за большего размера. Тем не менее, повышенное количество жира, окружающего отверстие соска, также повышает вероятность ошибочного введения жировой прокладки, если игла отклоняется от основного протока. - После того, как игольчатый скос будет полностью вставлен, медленно настаивайте раствор с постоянной скоростью приблизительно 100 мкл / мин у крыс. Резкие изменения скорости инфузии могут лопнуть или повредить проточное дерево. Подождите 30 с после окончания настоя, прежде чем снимать иглу с консервированного дерева с помощью щипцов; это гарантирует, что впрыскиваемый объем остается внутри протокового дерева (рисунок 2) и снижает вероятность утечки.
- Очистите любой пролитый раствор смоченной марлей или салфеткой EtOH, чтобы избежать постороннего контрастного раствора на изображениях.
- Вводят PBS, содержащий 5% сахарозу (10 мл/кг) внутрибрюшинно, чтобы смягчить последствия алкогольной интоксикации, если этанол содержится в растворах для инъекций ID. Эта доза может быть дана в начале и в конце процедуры.
4. Микро-КТ визуализация
- После того, как все желаемые железы были введены, быстро переместите животное в систему микро-КТ и продолжайте поддерживать анестезию с помощью встроенного испарителя изофлурана.
- Выпрямите позвоночник животного и заклейте каждую заднюю ногу в вытянутом положении, чтобы кости ног животного находились дальше от интересующих нижних желез и не пересекались с областью интереса на сканируемом изображении.
- Лентой поперек живота, чтобы свести к минимуму дыхательные артефакты при сканировании нижних желез.
ПРИМЕЧАНИЕ: Животные могут быть сфотографированы с различными параметрами сканирования (например, высокое разрешение, продольное сканирование), если принять меры для определения соответствующей приемлемой дозы радиации в течение жизни для крыс и обеспечения того, чтобы кумулятивная доза не превышала этот уровень. Радиационное облучение может быть дополнительно уменьшено путем получения рентгеноскопических фотографий и видео без выполнения сканирования (рисунок 2). - Выполнить TaOx визуализацию дерева протоков крыс с хорошим разрешением и возможностью повторного стандартного (2 мин) сканирования с использованием следующих параметров сканирования: 90 кВp/88 мкА; поле зрения (FOV), 72 мм; количество срезов, 512; толщина среза, 72 мкм; воксельное разрешение, 72 мкм3. Сканирование с высоким разрешением в течение более длительных периодов времени (4-14 мин) также может быть получено у животных, которые не будут сканироваться продольно с использованием тех же параметров.
- После сбора данных осторожно отведите крысу от анестезиологического конуса и поместите в новую чистую клетку на грелку. Проверьте крысу, чтобы убедиться, что она полностью оправилась от анестезии, прежде чем вернуть ее в постоянную клетку. Поместите чашку сукралозы, содержащую карпрофен, и соответствующим образом замените, как описано на этапе 2.5, чтобы гарантировать, что животные продолжают получать противовоспалительное лечение в течение следующих 7 дней.
- Обрабатывайте отсканированные изображения в быстрые представления в программном обеспечении micro-CT, чтобы лучше оценить любые утечки контраста, только частичное заполнение или переполнение (рисунок 2).
- Перейдите к следующему разделу, чтобы выполнить формальную обработку изображений для публикации или подробный анализ сканов, если это необходимо (рисунок 3).
5. Анализ изображений
- Используйте специализированные программные пакеты для создания визуализаций заполненного протокового дерева.
ПРИМЕЧАНИЕ: Лучше всего сегментировать жировую прокладку молочной железы, чтобы получить наилучшее представление о введенном протоковом дереве. Сплайн прослеживает темные границы жировой подушки по всей толщине животного, чтобы достичь этой сегментации. - Чтобы сегментировать жировую подушку (в отличие от мышей, границы этого отсека не так легко отличить от брюшной полости, бедренных мышц и кожи из-за аналогичных единиц Хаунсфилда), в которой содержится интересующее протоковое дерево, выбор опции «след сплайна» из ручного меню является первым шагом в создании рендеринга.
- Сплайн прослеживает контур жировой прокладки в каждом третьем срезе. Нажмите на опцию Распространить объекты в полуавтоматическом меню. Это распространит и соединит все срезы в один сегментированный объект, представляющий интерес.
ПРИМЕЧАНИЕ: Изменение порога в пределах сегментированной области позволяет визуализировать сигнал только в пределах определенного диапазона единиц Хаунсфилда (HU); для других контрастных веществ или параметров визуализации этот диапазон, возможно, потребуется скорректировать. Программный пакет или анализ искусственного интеллекта могут быть использованы для проведения других измерений и изображений, чтобы показать, насколько было заполнено проточное дерево. - Установите значения HU в нижнюю точку 300 и максимальную точку 3000 в полуавтоматическом меню на вкладке пороговой громкости. Это позволяет создавать представление, отображающее только контрастность (TaOx) в канальном дереве.
- Установите представление в качестве основного с помощью кнопки «Просмотр». Это изменит дисплей, чтобы отображать только 3D-представление дерева протоков.
ПРИМЕЧАНИЕ: Выполните реконструкцию протокового дерева для дальнейшего анализа.
Результаты
Каждая из 12 молочных желез самки крысы содержит одно проточное дерево, которое открывается в отверстии соска. Несмотря на различия в размерах между мышью и крысой, сроки развития молочных желез и время, в течение которого эти животные достигают зрелого возраста, очень похожи30,31. Дана краткая характеристика ключевых этапов развития молочной железы у крыс как представителя обоих видов грызунов. Концевые концевые почки (ТЕБ) представляют собой высокопролиферативные структуры на кончиках удлиняющегося протокового дерева, которые направляют ветвление протоков30,31. Пик пролиферации и плотности ТЕБ приходится на 3-4 недели возраста во время фазы удлинения протокового дерева в пубертатном развитии30. К 9-10-недельному возрасту остается мало TEB, так как протоковое дерево выросло, чтобы занять всю длину жировой подушки30. После этого рост и расширение протокового дерева пропорциональны росту жировой подушечки и животного32. Концевые проточные дольковые единицы (TDLUs) в груди человека выполняют аналогичную роль с TЭБ у грызунов. TDLUs являются основным источником для инициации канцерогенеза и прогрессирования до BC33,34. Мы можем ввести до 300 мкл 70% раствора EtOH для заполнения всего протокового дерева грудной и брюшной молочных желез 9-недельной крысы Sprague-Dawley (Рисунок 1, Рисунок 2, Рисунок 3). В отличие от мышей20, соски шейных и паховых желез крыс Sprague-Dawley обычно пригодны для инъекций более чем 80% животных, и для заполнения всего протокового дерева требуется до 100 мкл 70% раствора EtOH (рисунок 2). Мы регулярно вводим до 10 молочных желез исследуемым абляционным раствором. Типичная экспериментальная конструкция состоит из двух независимых еженедельных сеансов инъекции ID, в которых пять чередующихся желез наполняются абляционным раствором, содержащим рентгеновский контрастный агент и/или EC в качестве гелеобразующего агента (рисунок 2). Для TaOx-содержащего (50-200 мМ) абляционного раствора после окончания каждого сеанса проводится рентгеноскопия и/или микро-КТ-сканирование для определения и регистрации индивидуального успеха наполнения каждого протокового дерева частичным или полным количеством инфузионного раствора (рисунок 2). Немедленная и продольная визуализация после инъекции позволяет оценить, как изменения в рецептуре, особенно концентрация гелеобразующего агента ЕС, влияют и ограничивают диффузию абляционного раствора наружу в зависимости от вводимого объема (рисунок 3). Этот анализ изображений предоставляет информацию для понимания оптимальных параметров для достижения максимальной абляции с минимальным повреждением коллатеральной ткани.
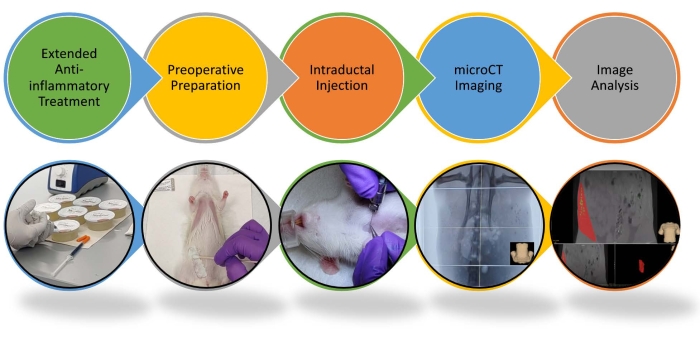
Рисунок 1: Схема процедуры внутрипротоковой инъекции и анализа изображений у крыс. Выделена пошаговая процедура внутрипротоковой инъекции и анализа изображений. Пожалуйста, смотрите видео для получения более подробной информации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Примеры канюляции сосков и результат доставки абляционного раствора в несколько молочных желез. (А) Типичное представление форм сосков у крысиного штамма Sprague-Dawley. Длина соска коррелирует с вероятностью успешной канюляции. Более длинные соски легче канюлировать, чем короткие, тогда как чрезмерно короткие или рудиментарные соски не могут быть канюлятированы. После канюляции как длинные, так и короткие соски могут быть наполнены раствором и достичь одинаковых показателей успеха родов. Синий пищевой краситель в вводимом растворе может быть использован в качестве in vivo доказательства успешности заполнения и доставки протокового дерева (наиболее очевидно, формирование купола, для неудачной инъекции жировой подушки). Рентгеноскопия в реальном времени (B) и 3D-микро-КТ-представления, генерируемые после получения изображения (C), обеспечивают in vivo доказательства успеха доставки и более количественную оценку решения, достигающего TEB. (B) Каждая брюшная молочная железа первой пары (#4, #10) получала абляционный раствор с 1% EC (оранжевый контур) или без него (зеленый контур) (C) Успешная доставка (синий контур) абляционного раствора в правую шейную (#7), вторую пару грудной (#3, #9) и первую пару брюшных (#4, #10) молочных желез и неудачную инъекцию (пунктирный белый контур) в левую грудную (#1) железу. Шкалы соответствуют 1 мм на изображениях при разном увеличении. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: 3D-реконструкция и оценка заполнения и диффузии абляционного раствора. 70% EtOH/100 мМ TaOx наночастицы с 1% EC (сверху) или без EC (снизу) вводили внутрипродукционно во вторую пару брюшных молочных желез (#4 и #10) и сразу же визуализировали с помощью микро-КТ. Каждая крыса Спрэга-Доули получала увеличивающийся объем любого раствора. Отдельные канальные деревья были реконструированы с использованием программного пакета для анализа изображений (трассировка сплайна + распространение объекта + пороговое представление). При 1% EC можно увидеть, что раствор достигает концевых концов. По мере увеличения поставляемого объема количество заполненных TEB становится все более очевидным. Шкала соответствует 10 мм во всех представлениях. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Выпуск | Внешность | Решение | |||
| Короткий сосок (рис. 2) | Сосок имеет низкий профиль - трудно схватить | Иногда легче удерживать кожу возле соска и нацеливать иглу на центр соска. Игла, скорее всего, будет погружаться под кожу. Медленное подтягивание может привести к тому, что сосок будет немного выше кончика иглы и даст место, чтобы схватить и потянуть его оставшуюся часть пути на иглу. Будьте очень осторожны при погружении под кожу относительно угла иглы. Легко непреднамеренно получить инъекцию жировой подушки, ударив под неправильным углом. | |||
| Инъекция жировой прокладки (рис. 2) | Опухает вокруг соска и, возможно, в самом соске - легче всего увидеть, добавляется ли цвет в раствор для инъекций | Если сосок отекает с первыми несколькими инъекциями, удалите иглу и попытайтесь вставить снова с большей осторожностью угла. Начните инъекцию еще раз и следите за дальнейшим отеком. Если отек продолжается, откажитесь от попытки. Очень редко можно успешно ввести сосок, который начинался как инъекция жировой подушки. | |||
| Раны/ссадины | Открытая рана или ссадина вблизи места инъекции раствора EtOH | Крысы чаще, чем мыши, развивают раны или ссадины вблизи области инъекции. При обнаружении ран нанесите тройную антибиотическую мазь на открытые раны, но оставьте в покое нанесенные раны. Нанесение мази на струпья может увеличить вероятность того, что животное будет беспокоить струп и удалять его. Проверяйте каждые 1-2 дня до заживления в зависимости от тяжести раны. Карпрофен следует давать до тех пор, пока он не заживет, даже если он находится за пределами нормального окна. | |||
| Инъекционные чередующиеся железы | Н/Д | Большие объемы инъекций у крыс повышают вероятность возникновения ссадин кожи при инъекции последовательных желез. Для наименьшей вероятности травмы области инъекции, альтернативные железы вводят в течение одного сеанса (т.е. инъекция No 1, 3, 4 и 6, а не No 1-4). Расстояние между парами третьей (#3 и #9) и четвертой (#4 и #10) желез позволяет вводить обе эти железы за один сеанс. | |||
Таблица 1: Полезные советы и устранение неполадок
Обсуждение
Как показано здесь, ДОСТАВКА ID 70% EtOH предпочтительно удаляет эпителиальные клетки молочной железы с ограниченным побочным повреждением окружающей стромы и сосудистой системы у мышей4. Локальная абляция протокового дерева эффективна для предотвращения образования опухолей у мышиных моделей4. Здесь мы демонстрируем, что эта абляционная процедура может быть расширена до крыс.
Это следующий шаг на пути к переводу этой абляционной процедуры в качестве альтернативы профилактической мастэктомии для первичной профилактики рака молочной железы у лиц с высоким риском. Добавление наночастиц TaOx в качестве рентгеноконтрастного вещества к абляционному раствору позволяет оценить эффективность раствора в предотвращении образования опухоли, так как можно определить, была ли процедура успешной или нет при полном заполнении протокового дерева. Использование рентгеноскопии для визуализации введенной молочной железы отражает то, что, вероятно, будет сделано в клинике для руководства этой процедурой идентификации. Руководство по изображению того, насколько раствор заполнил проточное дерево и когда прекратить инфузию, будет ключевым аспектом клинической реализации для обеспечения максимального заполнения каждого протокового дерева. Способы устранения неполадок и полезные советы приведены в таблице 1. Эффективность этой абляционной процедуры требует, чтобы инфузионный раствор вступал в прямой контакт со всеми эпителиальными клетками, чтобы максимизировать скорость уничтожения клеток. Запасные эпителиальные клетки в пределах одного или нескольких деревьев могут в конечном итоге служить источником для развития BC. Другие группы сообщили о доставке вирусных частиц (например, компонентов систем Cre/LoxP и/или Cas9/CRISPR), гормонов и антагонистов гормонов (например, пролактина, фульвестранта), химиотерапевтических агентов (например, цисплатина), siRNAs и/или антител или других целевых агентов у мышей 4,19,21,35,36,37,38,39,40, 41,42,43,44,45, крысы 21,33,46,47,48 и/или кролики 18,49,50,51,52,53 . Успешная каннуляция до восьми протоков на грудь человека для местной доставки химиотерапии была зарегистрирована в независимых клинических исследованиях 47,54,55. Руководство по изображениям для инфузии этих других решений, направленных на профилактику опухолей или ориентированных на местное лечение, также максимизирует их эффективность.
Масштабируемость и усовершенствование этой процедуры от мышиного до крысиного протокового дерева демонстрируется здесь. Наночастицы TaOx в мышиномдереве протоков 4,19 и крыс (неопубликованные данные) обеспечивают визуализацию с высоким разрешением, которая превосходит одобренные FDA йодсодержащие рентгеновские контрастные вещества. Точно так же мы не знаем о других подходах к визуализации протокового дерева у мышей40,41 или других животных моделей18, которые могут обеспечить сопоставимое разрешение с TaOx. Актуальным для клинического перевода является тот факт, что гелеобразующий эффект ЭК в моделях крыс этого промежуточного размера является позволяющим усовершенствованием состава для минимизации повреждения коллатеральной ткани. По мере того, как мы продолжаем оценивать эту абляционную процедуру идентификации на предмет ее способности предотвращать БК, мы сможем более точно определить, из каких желез развивается БК с помощью дополнительной информации, предоставляемой визуализацией после доставки идентификатора в химически индуцированных и других крысиных моделях БК. Эти данные определят безопасность этой процедуры и выявят любые проблемы или недостатки того, могут ли частичные или неудачные обработанные проточные деревья быть более склонными к развитию БК у женщин с высоким риском.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана, в частности, грантами Национального института рака R21 CA226579 и R01 CA258314 для LFS и грантом Национального института биомедицинской визуализации и биоинженерии R01 EB029418 для EMS. Мы благодарны Институту количественной (IQ) медицины и инженерии МГУ за использование их систем визуализации и технических знаний. Мы благодарим д-ра Даниэль Фергюсон за обзор содержания видео и цифр на предмет соблюдения рекомендаций по благополучию животных.
Материалы
| Name | Company | Catalog Number | Comments |
| AnalyzeDirect v12.0 | Caliper | n/a | For micro-CT image processing |
| Carprieve, Carprofen 50 mg/mL | Allivet | 50647 | For anti-inflammatory treatment |
| Ethyl cellulose | Acros Organics | 9004-57-3 | For intraductal injection |
| Evans blue | Sigma | E2129-50G | For injection visualization |
| Hot water bath | Toolots | Yidu_HH-S2 | For preparing carprofen cups |
| MediGel Sucralose Cups | ClearH2O | 74-02-5022 | For delivery of carprofen |
| Model 1750 TTL, PTFE Luer Lock Syringe, 500μL | Hamilton | 81220 | For intraductal injection |
| Photoshop 2021 | Adobe | n/a | For image processing |
| Quantum GX2 microCT Imaging System | Perkin Elmer | CLS149276 | For micro-CT image acquisition |
| Metal Hub Needle, 33 gauge, custom (30° bevel angle, 0.4 in, point style 4) | Hamilton | 7747-01 | For intraductal injection |
| Stereo Microscope SZM Series | AmScope | SM-4TPZ-144 | For intraductal injection |
| Sterile blue food dye | McCormick | 930641 | For injection visualization |
| Sterile phosphate buffered saline (PBS) | ThermoFisher | 14190250 | For solution preparation |
| Stickers | DOT Scientific | DOTSCI-C50 | For preparing carprofen cups |
| Sucrose | Calbiochem | 8550-5KG | For intraductal injection |
| Syringes | Fisher | 14-826-79 | For preparing carprofen cups |
| Vortex | VWR | 10153-834 | For preparing carprofen cups |
| Warming pump/pad(s) | Braintree Scientific | HTP-1500 120V; AP-R 26E | For intraductal injection/preoperative preparation |
Ссылки
- Siegel, R. L., Miller, K. D., Fuchs, H. E., Jemal, A. Cancer statistics, 2022. A Cancer Journal for Clinicians. 72 (1), 7-33 (2022).
- Wild, C. P. The global cancer burden: necessity is the mother of prevention. Nature Reviews. Cancer. 19 (3), 123-124 (2019).
- Padamsee, T. J., Wills, C. E., Yee, L. D., Paskett, E. D. Decision making for breast cancer prevention among women at elevated risk. Breast Cancer Research. 19 (1), 34 (2017).
- Kenyon, E., et al. Ductal tree ablation by local delivery of ethanol prevents tumor formation in an aggressive mouse model of breast cancer. Breast Cancer Research. 21 (1), 129 (2019).
- Kuang, M., et al. Ethanol ablation of hepatocellular carcinoma Up to 5.0 cm by using a multipronged injection needle with high-dose strategy. Radiology. 253 (2), 552-561 (2009).
- Ansari, D., Andersson, R. Radiofrequency ablation or percutaneous ethanol injection for the treatment of liver tumors. World Journal of Gastroenterology. 18 (10), 1003-1008 (2012).
- Zhang, W. Y., Li, Z. S., Jin, Z. D. Endoscopic ultrasound-guided ethanol ablation therapy for tumors. World Journal of Gastroenterology. 19 (22), 3397-3403 (2013).
- Chin, M., Chen, C. L., Chang, K., Lee, J., Samarasena, J. Ethanol ablation of a peripheral nerve sheath tumor presenting as a small bowel obstruction. ACG Case Reports Journal. 3 (1), 31-32 (2015).
- Gueng, M. -. K., Chou, Y. -. H., Tiu, C. -. M., Chiou, S. -. Y., Cheng, Y. -. F. Pseudoaneurysm of the breast treated with percutaneous ethanol injection. Journal of Medical Ultrasound. 22 (2), 114-116 (2014).
- Zhang, J., et al. Comparison between absolute ethanol and bleomycin for the treatment of venous malformation in children. Experimental and Therapeutic Medicine. 6 (2), 305-309 (2013).
- Wohlgemuth, W. A., et al. Ethanolgel sclerotherapy of venous malformations improves health-related quality-of-life in adults and children - results of a prospective study. European Radiology. 27 (6), 2482-2488 (2017).
- Steiner, F., FitzJohn, T., Tan, S. T. Ethanol sclerotherapy for venous malformation. ANZ Journal of Surgery. 86 (10), 790-795 (2016).
- Sannier, K., et al. A new sclerosing agent in the treatment of venous malformations. Study on 23 cases. Interventional Neuroradiology. 10 (2), 113-127 (2004).
- Dompmartin, A., et al. Radio-opaque ethylcellulose-ethanol is a safe and efficient sclerosing agent for venous malformations. European Radiology. 21 (12), 2647-2656 (2011).
- Faguy, K. Ductography: When, how, and why. Radiologic Technology. 92 (5), 487-503 (2021).
- Slawson, S. H., Johnson, B. A. Ductography: how to and what if. Radiographics. 21 (1), 133-150 (2001).
- Sheiman, L. S., Levesque, P. H. The in's and out's of ductography: A comprehensive review. Current Problems in Diagnostic Radiology. 45 (1), 61-70 (2016).
- Clark, A., Bird, N. K., Brock, A. Intraductal delivery to the rabbit mammary gland. Journal of Visualized Experiments. (121), e55209 (2017).
- Chakravarty, S., et al. Tantalum oxide nanoparticles as versatile contrast agents for X-ray computed tomography. Nanoscale. 12 (14), 7720-7734 (2020).
- Kenyon, E., et al. Intraductal delivery and x-ray visualization of ethanol-based ablative solution for prevention and local treatment of breast cancer in mouse models. Journal of Visualized Experiments. (182), e63457 (2022).
- Murata, S., et al. Ductal access for prevention and therapy of mammary tumors. Cancer Research. 66 (2), 638-645 (2006).
- King, B. L., Love, S. M. The intraductal approach to the breast: raison d'etre. Breast Cancer Research. 8 (2), 206 (2006).
- Love, S. M., Barsky, S. H. Anatomy of the nipple and breast ducts revisited. Cancer. 101 (9), 1947-1957 (2004).
- Lai, Y. E., Morhard, R., Ramanujam, N., Nolan, M. W. Minimally invasive ethyl cellulose ethanol ablation in domesticated cats with naturally occurring head and neck cancers: Six cats. Veterinary and Comparative Oncology. 19 (3), 492-500 (2021).
- Mueller, J. L., et al. Optimizing ethyl cellulose-ethanol delivery towards enabling ablation of cervical dysplasia. Scientific Reports. 11 (1), 16869 (2021).
- Nief, C., et al. Polymer-assisted intratumoral delivery of ethanol: Preclinical investigation of safety and efficacy in a murine breast cancer model. PLoS One. 16 (1), 0234535 (2021).
- Chelales, E., et al. Radiologic-pathologic analysis of increased ethanol localization and ablative extent achieved by ethyl cellulose. Scientific Reports. 11 (1), 20700 (2021).
- Morhard, R., et al. Understanding factors governing distribution volume of ethyl cellulose-ethanol to optimize ablative therapy in the liver. IEEE Trans Biomedical Engineering. 67 (8), 2337-2348 (2020).
- Morhard, R., et al. Development of enhanced ethanol ablation as an alternative to surgery in treatment of superficial solid tumors. Scientific Reports. 7 (1), 8750 (2017).
- Russo, I. H., Russo, J. Developmental stage of the rat mammary gland as determinant of its susceptibility to 7,12-dimethylbenz[a]anthracene. Journal of the National Cancer Institute. 61 (6), 1439-1449 (1978).
- Paine, I. S., Lewis, M. T. The terminal end bud: The little engine that could. Journal of Mammary Gland Biology Neoplasia. 22 (2), 93-108 (2017).
- Hinck, L., Silberstein, G. B. Key stages in mammary gland development: the mammary end bud as a motile organ. Breast Cancer Research. 7 (6), 245-251 (2005).
- Sivaraman, L., et al. Effect of selective ablation of proliferating mammary epithelial cells on MNU induced rat mammary tumorigenesis. Breast Cancer Research Treatment. 73 (1), 75-83 (2002).
- Cardiff, R. D., Wellings, S. R. The comparative pathology of human and mouse mammary glands. Journal of Mammary Gland Biology Neoplasia. 4 (1), 105-122 (1999).
- Brock, A., et al. Silencing HoxA1 by intraductal injection of siRNA lipidoid nanoparticles prevents mammary tumor progression in mice. Scientific Translational Medicine. 6 (217), (2014).
- de Groot, J. S., et al. Intraductal cisplatin treatment in a BRCA-associated breast cancer mouse model attenuates tumor development but leads to systemic tumors in aged female mice. Oncotarget. 8 (37), 60750-60763 (2017).
- Wang, G., et al. Intraductal fulvestrant for therapy of ERalpha-positive Ductal Carcinoma in Situ (DCIS) of the breast - A preclinical study. Carcinogenesis. 40 (7), 907-913 (2019).
- Yoshida, T., et al. Effective treatment of ductal carcinoma in situ with a HER-2- targeted alpha-particle emitting radionuclide in a preclinical model of human breast cancer. Oncotarget. 7 (22), 33306-33315 (2016).
- Chun, Y. S., et al. Intraductally administered pegylated liposomal doxorubicin reduces mammary stem cell function in the mammary gland but in the long term, induces malignant tumors. Breast Cancer Research Treatment. 135 (1), 201-208 (2012).
- Markiewicz, E., et al. High resolution 3D MRI of mouse mammary glands with intra-ductal injection of contrast media. Magnetic Resonance Imaging. 33 (1), 161-165 (2015).
- Markiewicz, E., et al. MRI ductography of contrast agent distribution and leakage in normal mouse mammary ducts and ducts with in situ cancer. Magnetic Resonance Imaging. 40, 48-52 (2017).
- Annunziato, S., et al. Comparative oncogenomics identifies combinations of driver genes and drug targets in BRCA1-mutated breast cancer. Nature Communications. 10 (1), 397 (2019).
- Rutkowski, M. R., et al. Initiation of metastatic breast carcinoma by targeting of the ductal epithelium with adenovirus-cre: a novel transgenic mouse model of breast cancer. Journal of Visualized Experiments. (85), e51171 (2014).
- Xiang, D., Tao, L., Li, Z. Modeling breast cancer via an intraductal injection of cre-expressing adenovirus into the mouse mammary gland. Journal of Visualized Experiments. (148), e59502 (2019).
- Barham, W., Sherrill, T., Connelly, L., Blackwell, T. S., Yull, F. E. Intraductal injection of LPS as a mouse model of mastitis: signaling visualized via an NF-kappaB reporter transgenic. Journal of Visualized Experiments. (67), e4030 (2012).
- Chun, Y. S., et al. Intraductal administration of a polymeric nanoparticle formulation of curcumin (NanoCurc) significantly attenuates incidence of mammary tumors in a rodent chemical carcinogenesis model: Implications for breast cancer chemoprevention in at-risk populations. Carcinogenesis. 33 (11), 2242-2249 (2012).
- Stearns, V., et al. Preclinical and clinical evaluation of intraductally administered agents in early breast cancer. Science Translational Medicine. 3 (106), (2011).
- Okugawa, H., et al. Effect of perductal paclitaxel exposure on the development of MNU-induced mammary carcinoma in female S-D rats. Breast Cancer Research Treatment. 91 (1), 29-34 (2005).
- Falconer, I. R. The distribution of 131 I- or 125 I-labelled prolactin in rabbit mammary tissue after intravenous or intraductal injection. Journal of Endocrinology. 53 (3), 58-59 (1972).
- Fiddler, T. J., Birkinshaw, M., Falconer, I. R. Effects of intraductal prolactin on some aspects of the ultrastructure and biochemistry of mammary tissue in the pseudopregnant rabbit. Journal of Endocrinology. 49 (3), 459-469 (1971).
- Fiddler, T. J., Falconer, I. R. The effect of intraductal prolactin on protein and nucleic acid biosynthesis in the rabbit mammary gland. The Biochemical Journal. 115 (5), 58 (1969).
- Bourne, R. A., Bryant, J. A., Falconer, I. R. Stimulation of DNA synthesis by prolactin in rabbit mammary tissue. Journal of Cell Science. 14 (1), 105-111 (1974).
- Chadwick, A. Detection and assay of prolactin by the local lactogenic response in the rabbit. The Journal of Endocrinology. 27, 253-263 (1963).
- Mahoney, M. E., et al. Intraductal therapy of ductal carcinoma in situ: a presurgery study. Clinical Breast Cancer. 13 (4), 280-286 (2013).
- Love, S. M., et al. A feasibility study of the intraductal administration of chemotherapy. Cancer Preview Research (Phila). 6 (1), 51-58 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены