Method Article
쥐 모델에서 유방암 예방을 위한 관내 에탄올 기반 절제 치료의 X선 시각화
요약
유방암의 영상 유도 예방 치료를 위해 쥐 유방 유관 나무에 화학적 절제 용액을 전달하는 절차가 설명됩니다. 유방 상피 세포는 유두 개구부에 직접 캐뉼레이션과 70 % 에탄올 기반 절제 용액의 덕트 내 주입을 통해 최소한의 부수적 인 조직 손상으로 표적화 될 수 있습니다.
초록
유방암 예방을위한 1 차 중재는 여전히 제한되어 있습니다. 유방암 발병 위험이 높은 여성의 경우 가장 효과적인 개입은 예방 적 유방 절제술입니다. 이것은 유방암을 유발할 수있는 유방 상피 세포가 주변 조직과 함께 완전히 제거되는 과감한 수술 절차입니다. 이 프로토콜의 목표는 유방암 예방을위한 새로운 1 차 개입이 될 수있는 최소 침습적 관내 절차의 타당성을 입증하는 것입니다. 이 국소 절차는 유방 상피 세포가 악성이되기 전에 우선적으로 제거합니다. 유방암의 설치류 모델에서 이러한 상피 세포에 직접 용액을 전달하는 덕트 내 방법은 미시간 주립 대학 및 다른 곳에서 개발되었습니다. 쥐 유선은 인간의 유방에 비해 더 단순하고 선형적인 구조를 가진 단일 덕트 나무로 구성됩니다. 그러나 화학적으로 유도 된 유방암 쥐 모델은 마우스 모델에서 인간으로의 새로운 예방 개입 및 확장 성에 대한 개념 증명 연구에 유용한 도구를 제공합니다. 여기서, X선 조영제로서 산화탄탈륨 나노입자와 겔화제로서 에틸셀룰로오스를 함유하는 에탄올계 절제 용액을 래트 유관 트리로 덕트 내 전달하는 절차가 설명된다. 관내 주사에 의한 수성 시약 (예를 들어, 세포독성 화합물, siRNAs, AdCres)의 전달은 마우스 및 래트 모델에서 이전에 기술되었다. 이 프로토콜 설명은 절제 용액 전달, 절제 용액의 국소 및 전신 부작용을 최소화하기 위한 제형 고려, 덕트 트리 충전의 생체 내 평가를 위한 X선 이미징과 고유하게 관련된 방법론적 변화 및 단계를 강조합니다. 형광투시 및 micro-CT 기술을 사용하면 탄탈륨 함유 조영제와의 호환성 덕분에 절제 용액 전달의 성공 여부와 덕트 트리 충전 정도를 결정할 수 있습니다.
서문
미국 여성의 경우1, 유방암(BC)은 계속해서 가장 많이 진단된 암 유형이며 폐암을 제외한 다른 암 유형보다 더 많은 사망을 초래합니다. 2022년 예측에 따르면 51,400명의 여성이 제자리 암종 진단을 받고 287,850명의 여성이 침윤성 암종으로 진단되며 43,600명의 여성이 BC1로 사망할 것으로 추정됩니다. BC 주와 관련된 유병률과 사망률에도 불구하고, 1 차 예방이 연방 기관에 의해 우선 순위가 지정되지 않기 때문에 새로운 개입에 대한 1 차 예방 및 번역 연구에 사용할 수있는 옵션이 거의 없습니다2. 예방 적 유방 절제술은 1 차 예방을위한 가장 효과적인 개입입니다. 그러나 이 절차는 삶을 변화시키는 결과를 초래하는 대수술이기 때문에 고위험군에게만 권장됩니다3. 이 수술은 발암이 발생하는 유방 상피 세포와 정상적인 주변 조직을 완전히 제거하는 것을 포함합니다. 개인은 종종 신체적, 심리적, 사회적 스트레스의 부정적인 영향으로 인해이 절차를 1 차 개입의 첫 번째 옵션으로 사용하지 못하게합니다. 이러한 이유로 일부 고위험군조차도이 절차를 거치지 않고 대신 조심스러운 대기 또는 유사한 감시 전략을 선택합니다3. 이전 간행물에서, 70% 에탄올(EtOH)을 마우스 모델의 덕트 트리로 직접 전달하는 것은 인접한 정상 조직에 대한 제한된 손상으로 유방 상피 세포를 화학적으로 절제하고 유방종양 형성을 예방하는 데 효과적이었습니다4. EtOH는 일부 암의 국소 치료를위한 절제제 또는 동정맥 부종 및 기형의 국소 치료를위한 경화제로 여러 임상 응용 분야에서 사용됩니다 5,6,7,8,9,10,11,12,13,14 . EtOH의 낮은 독성 및 안전성 프로파일은 일부 절차에서 세션 당 최대 50mL의 95 % EtOH를 투여 할 수 있기 때문에 잘 확립되어 있습니다 5,10.
BC가 발생하는 유방 상피 세포의 완전한 제거는 예방 적 유방 절제술과 절제 용액의 국소 전달의 가장 중요한 구성 요소입니다. 따라서 절제 용액이 모든 유방 상피 세포와 직접 접촉했음을 보장하기 위해 완전한 덕트 트리 충전의 확인이 필요합니다. 덕트 트리 내에서 솔루션을 제공하고 이미지 유도 형광 투시 또는 덕트 조영술에 의한 시각화는 이미 존재하는 임상 절차를 통해 가능합니다15,16,17. 따라서 임상 시험에서이 절차를 쉽게 구현하고 평가할 수 있습니다. 1차 예방을 위한 새로운 중재로서 관내(ID) 절제의 효능 및 번역 타당성을 확립하는 핵심 단계는 관내트리 아키텍처의 크기와 복잡성이 증가하는 동물 모델에서 이 X선 시각화 접근법의 타당성을 입증하는 것입니다4,18,19. 이 절제 절차를 마우스20에서 래트 모델로 확장하는 프로토콜이 여기에 설명되어 있습니다. 마우스와 쥐 덕트 나무는 유사한 선형 구조와 분기 패턴을 가지고 있지만 쥐 덕트 나무는 비례 적으로 더 크고 훨씬 더 조밀 한 간질로 둘러싸여 있습니다. 우리는 실험실에서 조영제가 포함 된 절제 용액으로 일련의 주간 세션에 걸쳐 쥐의 모든 유선을 성공적으로 주입하는 방법을 구현했습니다. 동물이 EtOH의 부작용을 최소화하도록 하기 위해 세션 간격이 필요합니다(그림 1 및 그림 2). 이 절차는 33G 바늘로 이소 플루 란 마취 된 쥐의 젖꼭지 개구부에 절제 용액을 직접 주입하는 것을 포함합니다. 절차의 몇 가지 주요 개선 사항에는 연장된 항염증 치료의 사용, 제안된21개보다 더 많은 양의 덕트 트리당 더 많은 양의 주입, 액체 및 가스용 기밀 주사기가 포함됩니다. ID 주사 전 48 시간부터 1 주일까지 5mg / kg의 카프로 펜 (NSAID)으로 치료하는 기간은 클리닉에서 정맥 기형의 경화 치료에 사용되는 항 염증 프로토콜과 유사합니다. 치료는 전신 마취하에 환자에게 수행 한 후 NSAID와 같은 항염증제를 2 일간 복용합니다. 항염증 치료는 국소 염증 및 잠재적인 통증을 줄이기 위해 며칠 더 연장될 수 있습니다13. 마우스20에서와 같이, 5 % 슈 크로스 용액의 복강 내 주사는 래트에서 알코올 중독의 단기 효과를 완화시킨다. 쥐는 이 자당 용액과 함께 투여할 때 단일 세션에서 최대 1mL의 70% EtOH(최대 4개의 덕트, 혈액 내 0.2g/dL의 EtOH 함량)를 주사할 수 있습니다. 동물은 ID 주사 후 4 시간 이내에 완전히 회복됩니다. 우리는 4 개 이상의 땀샘 및 / 또는 더 높은 EtOH 농도를 주사 할 때 충분한 회복 시간을 허용하기 위해 순차적 세션을 수행합니다. 여성의 알코올 중독은 16 개의 주 덕트16,17 및 덕트22,23 당 2 mL를 가정하고 70 % EtOH로 양쪽 유방의 모든 덕트 나무의 ID 주사로 훨씬 적습니다 혈액 내 EtOH 함량이 0.1g/ dL 미만이며 경미한 손상을 유발할 수 있습니다.
X선 이미징을 통해 각 개별 샘에서 관내 전달이 얼마나 성공적인지, 전체 관나무가 채워졌는지 여부를 결정할 수 있습니다(그림 1, 그림 2, 그림 3). DICOM 파일 데이터의 마이크로 CT 스캔 및/또는 3D 재구성을 준비하기 위한 실시간 형광투시 이미징을 사용하여 덕트 트리로의 용액 전달 범위와 기질로의 누출을 평가할 수 있습니다. 형광 투시법을 사용하면 동물에게 부과되는 전체 방사선 량을 제한하는 데 도움이 될 수 있습니다. 형광 투시 기술은 이 절제 치료의 이미지 유도를 위한 의도된 임상 적용에 더 가깝습니다. FDA 승인 요오드 함유 Isovue와 산화 탄탈륨 (TaOx) 나노 입자의 비교는 절제 용액 4,19의 유용성을 더욱 정제하기 위해 수행되었습니다. TaOx는 마우스 4,19에서 덕트 나무의 초기 충전을 시각화하기 위해 Isovue보다 우수한 마이크로 CT 조영제임이 밝혀졌습니다. 여기서 우리는 TaOx가 쥐 덕트 나무의 초기 충전을 시각화하는 데 적합한 조영제임을 보여줍니다 (그림 2 및 그림 3). 중개 연구 및 임상 실습 응용 분야 모두에서 겔화제 에틸 셀룰로오스 (EC)를 EtOH 용액에 첨가하여 의도 된 표적 영역 13,14,24,25,26,27,28,29로부터의 확산을 최소화했습니다. 연구에 따르면 EtOH 함유 절제 용액에 최대 1.5% EC를 첨가하면TaOx 기반 이미징과 호환되는 것으로 나타났습니다(그림 3). 이러한 절제 용액에 대한 추가 개선은 이 이미지 유도 절차를 클리닉으로 즉시 번역하는 데 도움이 될 수 있습니다.
프로토콜
설명 된 모든 실험은 미시간 주립 대학의 기관 동물 관리 및 사용위원회에서 승인 한 프로토콜에 따라 수행되었습니다.
1. 연장 된 항 염증 치료
- 카프로 펜의 경구 투여로 수크랄로스 젤 컵을 준비하십시오. 쥐에게 70% EtOH의 ID 주사를 받기 2일 전부터 시술 후 7일까지 이러한 항염증 치료제를 제공한다.
- 컵에 주사하기 위해 멸균 PBS에서 carprofen의 작업 용액을 희석하십시오. 50 mg / mL 원액에서 1 % v / v 멸균 청색 식용 염료로 착색 된 희석 된 2 mg / mL 용액을 준비하고 각 컵에 500 μL를 주입합니다. 염료의 첨가는 컵의 수크랄로스 내에서 약물의 완전한 혼합을 시각화하는 데 도움이됩니다.
- 제조업체의 권장 사항에 따라 carprofen 추가를 위해 컵을 준비하십시오. 공급업체에서 달리 명시하지 않는 한, 60°C의 수조에서 컵을 15분 동안 데우고 제거 시 건조시켜 오염 위험을 줄이십시오.
- 해당 부위의 70 % EtOH로 수크랄로스 컵의 뚜껑을 닦고 카프로 펜 작업 용액이 들어있는 주사기의 바늘을 삽입하십시오. 적절한 용량(500μL)을 분주합니다.
- 스티커로 구멍을 덮으십시오. 컵을 15초 동안 힘차게 흔든 다음 그 컵을 추가로 15초 동안 소용돌이에 넣습니다. 나중에 사용하기 위해 저장하기 전에 균일하고 완전한 혼합을 시각적으로 평가하십시오. 진한 파란색이 있는지 확인하십시오.
알림: 컵을 실온에 두십시오. 원하는 경우 컵을 실온에 보관하되 제조업체의 약물 효능 지침에 주의하십시오. 또는 컵을 4 ° C에서 보관하고 한 달 이내에 사용하십시오. 스티커의 날짜를 측정하는 것은 펜이나 날카로운 마커가 뚜껑에 구멍을 뚫을 위험 없이 주사 날짜를 추적하는 좋은 습관입니다.
- 사용 직전에 70% EtOH로 컵 외부를 닦으십시오. 컵을 동물 케이지에 넣기 전에 뚜껑을 제거하십시오. 격일로 또는 비어있을 때 컵을 교체하십시오. 적절한 투여를 위해 매일 젤 수준을 확인하십시오. 한 컵은 최대 2 일 동안 최대 2 마리의 쥐에게 카프로 펜을 공급할 수 있습니다. 그러나 쥐는 컵 전체를 더 빨리 섭취할 수 있습니다.
2. 수술 전 준비
알림: 동물 준비 단계가 ID 주입 절차보다 2-3 일 앞서 있는지 확인하십시오.
- 쥐를 마취하기 위해 이소플루란 기화기(2%-3% 이소플루란, 산소 1.5L/분)를 켭니다. 동물을 온난화 패드의 코 콘으로 옮깁니다. 쥐에게 눈 윤활제를 바르고 동물을 등 뒤로 놓습니다. 마취 평면이 이소플루란의 1%-3%로 유지되도록 동물의 호흡을 주의 깊게 모니터링합니다.
알림: 전기 면도기를 사용하여 탈모 전에 과도한 털을 제거 할 수 있습니다. 면도기로 젖꼭지가 손상되지 않도록 각별히주의해야합니다. 따라서 이 단계를 건너뛸 수 있습니다. 쥐는 생쥐보다 탈모 크림에 더 민감하므로 과도한 크림을 제거하는 것이 매우 중요합니다. 탈모로 인해 이미 마모가있는 부위에 에탄올 함유 용액을 주입하지 마십시오. 일부 크림에는 찰과상의 가능성을 최소화하는 데 도움이 될 수 있는 알로에 및 라놀린과 같은 화합물이 추가되었습니다. - 면 끝 애플리케이터를 사용하여 처방전 없이 살 수 있는 제모 크림을 젖꼭지 부위에 바릅니다. 애플리케이터를 사용하여 크림을 10-30 초 동안 해당 부위에 문지릅니다. 모피가 빨리 풀렸는지 확인하십시오.
- 가능한 한 가장 짧은 간격으로 쥐에게 크림을 남겨두고 피부가 타는 것을 피하기 위해 완전히 제거하십시오. 쥐는 생쥐보다이 절차에 훨씬 더 민감합니다.
- 10-30 초의 적용 후 따뜻한 물로 거즈를 적셔 크림과 느슨한 모피를 동물의 헹구십시오. 신선한 축축한 거즈로 해당 부위를 세 번 이상 헹구고 최종 헹굼 후 마른 거즈로 말리십시오. 모피가 제거 된 젖꼭지 영역에 대한 가시성과 접근이 좋은지 확인하십시오. 필요한 경우 탈모 절차를 반복하십시오.
- 쥐를 가열 패드의 깨끗한 케이지에 넣고 회복되도록하십시오. 쥐를 영구 케이지로 가져 오기 전에 마취에서 완전히 회복되었는지 확인하십시오.
- 항염증 치료를 위해 카프로펜 용량(1mg/컵) 수크랄로스 젤 컵 1개를 케이지에 넣습니다. 매일 젤 섭취량을 확인하고 적절한 경우 새 컵으로 교체하십시오. 컵을 2 일 이상 방치하지 마십시오. 일반적으로 컵은 1일 후에 교체해야 합니다.
3. 관내 주사
- 멸균 포스페이트 완충 염수 (PBS)를 사용하여 도19에 기재된 바와 같이 333.3 mM에서TaOx 스톡 용액을 제조한다. 분말이 완전히 녹지 않으면 용액을 따뜻하게하십시오. 부드럽게 저어주세요. 거품 형성을 피하기 위해 소용돌이 치거나 세게 흔들지 마십시오.
- 최종 70% EtOH 100mM/TaOx 용액에 대해 333.3mMTaOx의 3개 부분을 100% EtOH의 7개 부분과 혼합합니다. 선택적으로 겔화제로 적절한 양의 0.5%-1.5% 에틸셀룰로오스(EC)를 추가하여 절제 용액의 국소 체류를 최대화합니다. 주입 중 덕트 나무로의 전달을 육안으로 검사하기 위해 절제 용액에 1% v/v 청색 식용 염료를 추가합니다.
- 실험 요구에 적합한 볼륨을 준비하십시오. 글 랜드 쌍 1 (자궁 경부)과 6 (사타구니)은 최대 100 μL의 용액으로 채울 수 있으며 다른 모든 쌍은 최대 300 μL로 채울 수 있습니다.
- 단계 2.1에서와 같이 쥐를 마취시키고 완전히 마취되면 쥐를 코뿔로 옮깁니다. 양쪽 눈에 눈 윤활제를 바르고 동물을 등 뒤로 눕히십시오. 원하는 경우 주입 할 젖꼭지 근처의 테이프를 사용하여 입체경 아래에 쥐를 고정하십시오. 쥐의 무게는 일반적으로 테이핑없이 실질적으로 움직이지 않기에 충분합니다.
- 주입을 위해 젖꼭지를 준비하려면 가능하면 미세한 뾰족한 집게로 젖꼭지 입구를 덮는 죽은 피부를 제거하십시오. 쥐는 종종 젖꼭지 개구부에서 튀어 나온 플러그가있어 제거하지 않으면 젖꼭지의 성공적인 캐뉼러를 막을 수 있습니다.
알림: 쥐에게 사용되는 절제 용액의 더 많은 양의 주입은 주사 부위 근처의 표재성 피부 상처를 초래할 가능성이 더 높다는 점에 유의하는 것이 중요합니다. 이러한 이유로 한 번의 세션으로 다른 모든 젖꼭지를 주사하는 것은 인접한 젖꼭지를 주사하는 것보다 동물에게 덜 손상되고 자극적입니다. 주사 후 7 일 동안 쥐의 찰과상을 모니터링하면 동물이 긁히거나 케이지 바닥 파편으로 인한 감염으로 인한 감염 가능성을 도입하여 심각한 건강 영향을 미치지 않도록 할 수 있습니다. 삼중 항생제 연고 또는 클로르헥시딘 용액으로 세척하여 발생할 수있는 부상 감염의 징후를 치료할 수 있습니다 (표 1). - 33g 바늘이 있는 500μL 주사기를 사용하여 101-301μL의 절제 용액을 흡인합니다. 캐뉼레이트 바늘을 제거할 때 약간의 누출 가능성을 위해 1μL의 추가 용액을 흡입합니다.
알림: 다음은 덕트 나무를 완전히 채우는 것을 목표로하는 볼륨에 대한 권장 사항입니다 : 자궁 경부 및 사타구니 땀샘에서 최대 100 μL, 다른 땀샘에서 최대 300 μL. 다른 응용 프로그램의 경우 더 작거나 더 큰 볼륨을 사용하는 것이 적절할 수 있습니다. - 핀셋을 사용하여 젖꼭지를 부드럽게 잡고 바늘을 젖꼭지 구멍에 캐뉼러합니다. 경사가 젖꼭지 안에 완전히 들어갈 때까지 바늘을 부드럽게 계속 삽입하십시오. 바늘을 젖꼭지에 수용하려면 바늘을 젖꼭지로 밀어 넣는 대신 바늘을 바늘쪽으로 가져옵니다. (표 1). 젖꼭지 입구의 경로를 따르도록주의하십시오.
알림: 쥐 젖꼭지는 일반적으로 크기가 크기 때문에 쥐의 젖꼭지보다 조작하고 성공적으로 캐뉼러링하기가 훨씬 쉽습니다. 그러나 젖꼭지 개구부를 둘러싼 지방의 양이 증가하면 바늘이 주 덕트에서 벗어나면 지방 패드를 실수로 주입 할 가능성이 높아집니다. - 바늘 경사가 완전히 삽입되면 쥐에게 약 100μL/min의 일정한 속도로 용액을 천천히 주입합니다. 주입 속도의 급격한 변화는 덕트 나무를 파열 시키거나 손상시킬 수 있습니다. 주입이 끝난 후 30 초 동안 기다렸다가 집게를 사용하여 통조림 나무에서 바늘을 제거하십시오. 이렇게 하면 주입된 볼륨이 덕트 트리(그림 2) 내에 남아 있고 누출 가능성이 줄어듭니다.
- 엎질러진 용액을 젖은 거즈나 EtOH 물티슈로 닦아내어 이미지에 외부 조영제가 생기지 않도록 하십시오.
- 5% 자당(10mL/kg)을 함유한 PBS를 복강내 주사하여 ID 주사 용액에 에탄올이 포함된 경우 알코올 중독의 영향을 완화합니다. 이 용량은 절차의 시작과 끝에서 주어질 수 있습니다.
4. 마이크로 CT 영상
- 원하는 모든 땀샘을 주입 한 후 동물을 마이크로 CT 시스템으로 신속하게 옮기고 통합 된 이소 플루 란 기화기를 사용하여 마취를 계속 유지하십시오.
- 동물의 척추를 곧게 펴고 각 뒷다리를 확장 된 위치에 테이프로 붙여서 동물의 다리 뼈가 관심있는 아래쪽 땀샘에서 멀어지고 스캔 한 이미지의 관심 영역과 겹치지 않도록합니다.
- 하부 땀샘을 스캔하는 경우 호흡 인공물을 최소화하기 위해 복부를 가로질러 테이프를 붙입니다.
참고: 쥐에 대해 허용되는 적절한 평생 방사선 선량을 결정하고 누적 선량이 이 수준을 초과하지 않도록 주의를 기울이면 다른 스캐닝 매개변수(예: 고해상도, 종단 스캔)로 동물을 이미지화할 수 있습니다. 방사선 노출은 스캔을 수행하지 않고 형광투시 스틸 및 비디오를 획득하여 더욱 줄일 수 있습니다(그림 2). - 다음 스캔 파라미터를 사용하여 반복적인 표준(2분) 획득 스캔을 위한 좋은 해상도와 기회로 쥐관 나무의TaOx 이미징을 수행합니다: 90kVp/88μA; 시야 (시야) (시야), 72 mm; 슬라이스 수, 512; 슬라이스 두께, 72 μm; 복셀 분해능, 72 μm3. 더 긴 시간 (4-14 분)에 대한 고해상도 스캔은 동일한 매개 변수를 사용하여 세로로 스캔되지 않는 동물에서도 획득 할 수 있습니다.
- 데이터 수집 후, 조심스럽게 마취 콘에서 쥐를 꺼내 가열 패드의 새로운 깨끗한 케이지에 넣으십시오. 쥐를 영구 케이지로 다시 가져 오기 전에 마취에서 완전히 회복되었는지 확인하십시오. 카프로펜 함유 수크랄로스 컵을 놓고 2.5단계에 설명된 대로 적절하게 교체하여 동물이 다음 7일 동안 항염증 치료를 계속 받을 수 있도록 합니다.
- 스캔한 이미지를 micro-CT 소프트웨어 내에서 빠른 변환으로 처리하여 대비 누출, 부분 충진 또는 과충진을 더 잘 인식합니다(그림 2).
- 다음 섹션으로 진행하여 게시를 위한 공식 이미지 처리 또는 원하는 경우 스캔의 세부 분석을 수행합니다(그림 3).
5. 이미지 분석
- 특수 소프트웨어 패키지를 사용하여 채워진 덕트 트리의 렌더링을 생성합니다.
알림: 주입된 덕트 트리의 최상의 표현을 얻으려면 유방 지방 패드를 분할하는 것이 가장 좋습니다. 스플라인은 이러한 분할을 달성하기 위해 동물의 전체 두께에 걸쳐 지방 패드의 어두운 경계를 추적합니다. - 관심 있는 덕트 트리가 포함된 지방 패드(마우스와 달리 이 구획의 경계는 유사한 Hounsfield 단위로 인해 복강, 대퇴근 및 피부와 쉽게 구별되지 않음)를 분할하려면 수동 메뉴에서 "스플라인 추적" 옵션을 선택하는 것이 렌더링을 만드는 첫 번째 단계입니다.
- 스플라인은 세 번째 슬라이스마다 팻 패드 윤곽선을 추적합니다. 반자동 메뉴에서 개체 전파 옵션을 클릭합니다. 이렇게 하면 모든 슬라이스가 관심 있는 단일 세그먼트 객체로 전파되고 연결됩니다.
참고: 분할된 영역 내에서 임계값을 변경하면 특정 범위의 Hounsfield 단위(HU) 내에서만 신호를 시각화할 수 있습니다. 다른 조영제 또는 이미징 매개변수의 경우 이 범위를 조정해야 할 수 있습니다. 소프트웨어 패키지 또는 인공 지능 분석을 사용하여 덕트 트리가 얼마나 채워졌는지 보여주는 다른 측정 및 이미지를 만들 수 있습니다. - 임계값 볼륨 탭 아래의 반자동 메뉴에서 HU 값을 낮은 지점 300과 높은 지점 3,000으로 설정합니다. 이렇게 하면 덕트 트리 내의 대비(TaOx)만 표시하는 변환을 만들 수 있습니다.
- "보기"버튼을 사용하여 변환을 기본으로 설정하십시오. 이렇게 하면 덕트 트리의 3D 변환만 표시하도록 디스플레이가 변경됩니다.
참고: 추가 분석을 위해 덕트 트리의 재구성을 수행합니다.
결과
암컷 쥐의 12 개의 유선에는 각각 젖꼭지 구멍에서 열리는 단일 덕트 나무가 있습니다. 마우스와 쥐의 크기 차이에도 불구하고 유선의 발달시기와이 동물이 성인이되는 시간은 매우 유사합니다30,31. 두 설치류 종을 대표하는 쥐의 유선 발달의 주요 단계에 대한 간략한 설명이 제공됩니다. 말단 끝 새싹 (TEB)은 덕트 분기(30,31)를 지시하는 연축된 덕트 나무의 끝에있는 고도로 증식 된 구조입니다. TEBs의 증식 및 밀도의 피크는 사춘기 발달에서 덕트 나무의 연장 단계 동안 3-4 주령에 발생합니다30. 9-10주령까지, 덕트 나무가 지방 패드(30)의 전체 길이를 차지하도록 성장함에 따라 TEB가 거의 남아 있지 않다. 그 후, 덕트 나무의 성장과 확장은 지방 패드와 동물32의 성장과 확장에 비례합니다. 인간 유방의 말단 덕트 소엽 단위 (TDLU)는 설치류의 TEB와 유사한 역할을 수행합니다. TDLU는 발암 개시 및 BC33,34로의 진행의 주요 공급원입니다. 우리는 300 주 된 Sprague-Dawley 쥐의 흉부 및 복부 유선의 전체 덕트 트리를 채우기 위해 최대 70 % EtOH 용액을 주입 할 수 있습니다 (그림 1, 그림 2, 그림 3). 마우스 20과 달리 Sprague-Dawley 쥐의 자궁 경부 및 사타구니 땀샘의 젖꼭지는 일반적으로 동물의 80 % 이상에서 주사하기에 적합하며 전체 덕트 트리를 채우려면 최대 100 μL의70 % EtOH 용액이 필요합니다 (그림 2). 우리는 정기적으로 연구중인 절제 용액으로 최대 10 개의 유선을 주사합니다. 일반적인 실험 설계는 두 번의 독립적인 주간 ID 주입 세션으로 구성되며, 이 세션에서는 5개의 교대 땀샘에 X선 조영제 및/또는 EC를 겔화제로 포함하는 절제 용액을 주입합니다(그림 2). TaOx 함유 (50-200 mM) 절제 용액의 경우, 각 세션이 끝난 후 형광 투시 및 / 또는 마이크로 CT 스캔을 수행하여 각 덕트 트리에 주입 된 용액의 일부 또는 전체 양을 주입 한 개별 성공을 결정하고 기록합니다 (그림 2). 주입 후 즉각적이고 종단적 이미징을 통해 제형의 변화, 특히 EC 겔화제의 농도가 주입된 부피의 함수로서 절제 용액의 외부 확산에 어떻게 영향을 미치고 제한하는지 평가할 수 있습니다(그림 3). 이 영상 분석은 최소한의 부수적 인 조직 손상으로 최대 절제를 달성하기위한 최적의 매개 변수를 이해하기위한 정보를 제공합니다.
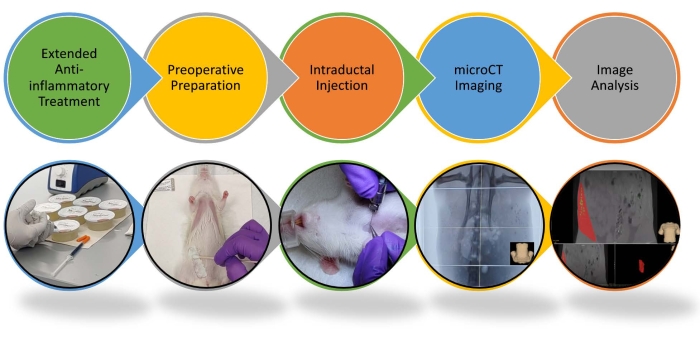
그림 1 : 쥐의 관내 주사 및 이미지 분석 절차의 개략도. 관내 주입 및 이미지 분석을 위한 단계별 절차가 강조 표시됩니다. 자세한 내용은 비디오를 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 유두 캐뉼레이션의 예와 절제 용액을 여러 유선으로 전달한 결과. (A) Sprague-Dawley 쥐 균주에서 젖꼭지 모양의 전형적인 표현. 젖꼭지 길이는 성공적인 캐뉼러의 가능성과 관련이 있습니다. 긴 젖꼭지는 짧은 젖꼭지보다 캐뉼러하기 쉬운 반면 지나치게 짧거나 흔적이있는 젖꼭지는 캐뉼러가 될 수 없습니다. 일단 캐뉼러되면 길고 짧은 젖꼭지에 용액을 주입하여 유사한 전달 성공률을 얻을 수 있습니다. 주입된 용액 중의 청색 식용 염료는 덕트 트리 충전 및 전달 성공의 생체내 증거로서 사용될 수 있다(가장 명백하게, 돔 형성, 실패한 지방 패드 주입에 대해). 이미지 획득(C) 후 생성된 실시간 형광투시(B) 및 3D micro-CT 표현물은 전달 성공에 대한 생체 내 증거와 TEB에 도달하는 용액의 정량적 평가를 제공합니다. (B) 첫 번째 쌍 (# 4, # 10)의 각 복부 유선은 1 % EC (주황색 윤곽선) 또는 그것이없는 (녹색 윤곽선)으로 절제 용액을 받았다. (C) 오른쪽 자궁 경부 , 두 번째 흉부 쌍 (# 3, # 9) 및 복부 (# 4, # 10) 유선의 첫 번째 쌍에서 절제 용액의 성공적인 전달 (파란색 윤곽선) 및 왼쪽 흉부 샘에 실패한 주사 (파선 흰색 윤곽선). 스케일 바는 다른 배율의 이미지에서 1mm에 해당합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 절제 용액 충전 및 확산의 3D 재구성 및 평가 . 1% EC(상단) 또는 EC(하단)가 없는 70% EtOH/100mMTaOx 나노입자를 제2복부 유선쌍(#4 및 #10)에 덕트내 주입하고 즉시 micro-CT로 이미지화하였다. 각 Sprague-Dawley 쥐는 두 용액 중 하나의 양을 증가 시켰습니다. 개별 덕트 트리는 이미지 분석 소프트웨어 패키지(스플라인 추적 + 객체 전파 + 임계값 변환)를 사용하여 재구성되었습니다. 1 % EC를 사용하면 용액이 말단 끝에 도달하는 것을 볼 수 있습니다. 전달량이 증가함에 따라 채워진 TEB의 수가 더 명확해집니다. 스케일 바는 모든 변환에서 10mm에 해당합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 출판하다 | 외관 | 용액 | |||
| 짧은 젖꼭지 (그림 2) | 젖꼭지는 낮은 프로파일이 있습니다 – 잡기 어려움 | 때로는 젖꼭지 근처의 피부를 잡고 바늘로 젖꼭지 중앙을 겨냥하는 것이 더 쉽습니다. 바늘은 피부 아래로 잠수할 가능성이 높습니다. 천천히 당기면 젖꼭지가 바늘 끝보다 약간 위에 있고 바늘 위로 나머지 부분을 잡고 당길 수 있는 공간이 생길 수 있습니다. 바늘의 각도에 대해 피부 아래로 다이빙 할 때 매우주의하십시오. 잘못된 각도로 찌르면 실수로 지방 패드 주사를 받기 쉽습니다. | |||
| 지방 패드 주입(그림 2) | 젖꼭지 주위와 아마도 젖꼭지 자체에 부어 오름 – 주사액에 색상이 추가되었는지 확인하는 것이 가장 쉽습니다. | 처음 몇 ul을 주사한 상태에서 젖꼭지가 부어오르면 바늘을 제거하고 각도에 더 주의하여 다시 삽입을 시도하십시오. 주사를 다시 시작하고 더 부어 오르는 것을 관찰하십시오. 붓기가 계속되면 시도를 포기하십시오. 지방 패드 주사로 시작된 젖꼭지를 성공적으로 주입하는 것은 매우 드뭅니다. | |||
| 상처/딱지 | EtOH 용액의 주사 부위 근처에서 열린 상처 또는 딱지 | 쥐는 쥐보다 주사 부위 근처에서 상처나 딱지가 생길 가능성이 더 큽니다. 상처가 발견되면 삼중 항생제 연고를 바르고 상처를 열되 딱지가 있는 상처는 그대로 두십시오. 딱지에 연고를 바르면 동물이 딱지를 귀찮게하고 제거 할 가능성이 높아질 수 있습니다. 상처의 정도에 따라 치유 될 때까지 1-2 일마다 확인하십시오. Carprofen은 정상적인 창을 넘어서더라도 치유 될 때까지 투여해야합니다. | |||
| 교대 땀샘 주입 | 해당 없음 | 쥐의 주사량이 많을수록 연속적인 땀샘을 주사하는 경우 피부 찰과상을 유발할 가능성이 높아집니다. 주사 부위에 대한 외상의 가능성을 최소화하기 위해 단일 세션 내에 대체 땀샘을 주입합니다(즉, #1-4가 아닌 #1, 3, 4 및 6 주사). 세 번째(#3 및 #9)와 네 번째(#4 및 #10) 샘 쌍 사이의 간격을 통해 이 두 샘을 한 세션에 모두 주사할 수 있습니다. | |||
표 1: 유용한 팁 및 문제 해결
토론
여기에 나타낸 바와 같이, 70% EtOH의 ID 전달은 마우스4에서 주변 기질 및 혈관구조에 대한 제한된 부수적 손상으로 유방 상피 세포를 우선적으로 제거합니다. 유관 나무의 국소 절제는 마우스 모델4에서 종양 형성을 예방하는 데 효과적입니다. 여기에서 우리는 이 절제 절차가 쥐까지 확장될 수 있음을 보여줍니다.
이것은 고위험군의 유방암 예방을위한 예방 적 유방 절제술에 대한 대체 개입으로이 절제 절차를 번역하는 경로의 다음 단계입니다. 절제 용액에 X 선 조영제로서TaOx 나노 입자를 첨가하면 절차가 덕트 트리를 완전히 채우는 데 성공했는지 여부를 결정할 수 있으므로 종양 형성을 예방하는 데 용액의 효과를 평가할 수 있습니다. 형광 투시법을 사용하여 주입된 유선을 시각화하면 이 ID 절차를 안내하기 위해 클리닉에서 수행될 가능성이 있는 작업을 반영합니다. 용액이 덕트 트리를 얼마나 채우고 주입을 중단해야하는지에 대한 이미지 안내는 각 덕트 트리의 최대 충전을 보장하기위한 임상 구현의 핵심 측면이 될 것입니다. 문제 해결 및 유용한 팁은 표 1에 나열되어 있습니다. 이 절제 절차의 효과는 주입 된 용액이 세포 사멸 속도를 최대화하기 위해 모든 상피 세포와 직접 접촉해야합니다. 하나 이상의 나무 내의 여분의 상피 세포는 결국 BC 발달의 원천이 될 수 있습니다. 다른 그룹은 바이러스 입자 (예를 들어, Cre/LoxP 및/또는 Cas9/CRISPR 시스템의 성분), 호르몬 및 호르몬 길항제 (예를 들어, 프로락틴, 풀베스트란트), 화학요법제 (예를 들어, 시스플라틴), siRNA 및/또는 항체 또는 마우스의 다른 표적화제의 ID 전달을 보고하였다 4,19,21,35,36,37,38,39,40, 41,42,43,44,45, 래트 21,33,46,47,48 및/또는 토끼 18,49,50,51,52,53 . 화학 요법의 국소 전달을 위해 인간 유방 당 최대 8 개의 덕트 트리의 성공적인 캐뉼레이션이 독립적 인 임상 연구47,54,55에서보고되었습니다. 종양 예방을 목표로 하거나 국소 치료를 목표로 하는 이러한 다른 용액의 주입을 위한 이미지 안내는 유사하게 그 효과를 극대화할 것입니다.
마우스에서 쥐관 나무까지이 절차의 확장 성과 개선이 여기에서 입증됩니다. 쥐 4,19 및 쥐 (미공개 데이터) 유관 나무의TaOx 나노 입자는 FDA 승인 요오드 함유 X 선 조영제를 능가하는 고해상도 이미징을 제공합니다. 유사하게, 우리는 마우스(40,41) 또는 다른 동물 모델(18)에서TaOx에 필적하는 해상도를 제공할 수 있는 다른 덕트 트리 이미징 접근법을 알지 못한다. 임상 번역과 관련된 것은 이 중간 크기의 쥐 모델에서 EC의 겔화 효과가 부수적 조직 손상을 최소화하기 위한 제형 정제를 가능하게 한다는 사실입니다. BC를 예방하는 능력에 대해 이 절제 ID 절차를 계속 평가함에 따라, 화학적으로 유도된 BC 및 기타 쥐 모델에서 ID 전달 후 영상에 의해 제공된 추가 정보를 통해 BC가 발달하는 땀샘을 보다 정확하게 결정할 수 있을 것입니다. 이 데이터는이 절차의 안전성을 결정하고 부분 또는 실패한 치료 된 덕트 나무가 고위험 여성에서 BC 주에 걸릴 가능성이 더 높은지에 대한 우려 사항이나 단점을 정확히 지적합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작업은 LFS에 대한 국립 암 연구소 R21 CA226579 및 R01 CA258314 보조금과 EMS에 대한 국립 생물 의학 이미징 및 생명 공학 연구소 R01 EB029418 보조금에 의해 부분적으로 지원되었습니다. 우리는 이미징 시스템과 기술 전문 지식을 사용하기 위해 MSU 정량적 (IQ) 건강 과학 및 엔지니어링 이미징 코어 시설에 감사드립니다. 동물 복지 지침을 준수하기 위해 비디오의 내용과 수치를 검토해 주신 Danielle Ferguson 박사에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| AnalyzeDirect v12.0 | Caliper | n/a | For micro-CT image processing |
| Carprieve, Carprofen 50 mg/mL | Allivet | 50647 | For anti-inflammatory treatment |
| Ethyl cellulose | Acros Organics | 9004-57-3 | For intraductal injection |
| Evans blue | Sigma | E2129-50G | For injection visualization |
| Hot water bath | Toolots | Yidu_HH-S2 | For preparing carprofen cups |
| MediGel Sucralose Cups | ClearH2O | 74-02-5022 | For delivery of carprofen |
| Model 1750 TTL, PTFE Luer Lock Syringe, 500μL | Hamilton | 81220 | For intraductal injection |
| Photoshop 2021 | Adobe | n/a | For image processing |
| Quantum GX2 microCT Imaging System | Perkin Elmer | CLS149276 | For micro-CT image acquisition |
| Metal Hub Needle, 33 gauge, custom (30° bevel angle, 0.4 in, point style 4) | Hamilton | 7747-01 | For intraductal injection |
| Stereo Microscope SZM Series | AmScope | SM-4TPZ-144 | For intraductal injection |
| Sterile blue food dye | McCormick | 930641 | For injection visualization |
| Sterile phosphate buffered saline (PBS) | ThermoFisher | 14190250 | For solution preparation |
| Stickers | DOT Scientific | DOTSCI-C50 | For preparing carprofen cups |
| Sucrose | Calbiochem | 8550-5KG | For intraductal injection |
| Syringes | Fisher | 14-826-79 | For preparing carprofen cups |
| Vortex | VWR | 10153-834 | For preparing carprofen cups |
| Warming pump/pad(s) | Braintree Scientific | HTP-1500 120V; AP-R 26E | For intraductal injection/preoperative preparation |
참고문헌
- Siegel, R. L., Miller, K. D., Fuchs, H. E., Jemal, A. Cancer statistics, 2022. A Cancer Journal for Clinicians. 72 (1), 7-33 (2022).
- Wild, C. P. The global cancer burden: necessity is the mother of prevention. Nature Reviews. Cancer. 19 (3), 123-124 (2019).
- Padamsee, T. J., Wills, C. E., Yee, L. D., Paskett, E. D. Decision making for breast cancer prevention among women at elevated risk. Breast Cancer Research. 19 (1), 34 (2017).
- Kenyon, E., et al. Ductal tree ablation by local delivery of ethanol prevents tumor formation in an aggressive mouse model of breast cancer. Breast Cancer Research. 21 (1), 129 (2019).
- Kuang, M., et al. Ethanol ablation of hepatocellular carcinoma Up to 5.0 cm by using a multipronged injection needle with high-dose strategy. Radiology. 253 (2), 552-561 (2009).
- Ansari, D., Andersson, R. Radiofrequency ablation or percutaneous ethanol injection for the treatment of liver tumors. World Journal of Gastroenterology. 18 (10), 1003-1008 (2012).
- Zhang, W. Y., Li, Z. S., Jin, Z. D. Endoscopic ultrasound-guided ethanol ablation therapy for tumors. World Journal of Gastroenterology. 19 (22), 3397-3403 (2013).
- Chin, M., Chen, C. L., Chang, K., Lee, J., Samarasena, J. Ethanol ablation of a peripheral nerve sheath tumor presenting as a small bowel obstruction. ACG Case Reports Journal. 3 (1), 31-32 (2015).
- Gueng, M. -. K., Chou, Y. -. H., Tiu, C. -. M., Chiou, S. -. Y., Cheng, Y. -. F. Pseudoaneurysm of the breast treated with percutaneous ethanol injection. Journal of Medical Ultrasound. 22 (2), 114-116 (2014).
- Zhang, J., et al. Comparison between absolute ethanol and bleomycin for the treatment of venous malformation in children. Experimental and Therapeutic Medicine. 6 (2), 305-309 (2013).
- Wohlgemuth, W. A., et al. Ethanolgel sclerotherapy of venous malformations improves health-related quality-of-life in adults and children - results of a prospective study. European Radiology. 27 (6), 2482-2488 (2017).
- Steiner, F., FitzJohn, T., Tan, S. T. Ethanol sclerotherapy for venous malformation. ANZ Journal of Surgery. 86 (10), 790-795 (2016).
- Sannier, K., et al. A new sclerosing agent in the treatment of venous malformations. Study on 23 cases. Interventional Neuroradiology. 10 (2), 113-127 (2004).
- Dompmartin, A., et al. Radio-opaque ethylcellulose-ethanol is a safe and efficient sclerosing agent for venous malformations. European Radiology. 21 (12), 2647-2656 (2011).
- Faguy, K. Ductography: When, how, and why. Radiologic Technology. 92 (5), 487-503 (2021).
- Slawson, S. H., Johnson, B. A. Ductography: how to and what if. Radiographics. 21 (1), 133-150 (2001).
- Sheiman, L. S., Levesque, P. H. The in's and out's of ductography: A comprehensive review. Current Problems in Diagnostic Radiology. 45 (1), 61-70 (2016).
- Clark, A., Bird, N. K., Brock, A. Intraductal delivery to the rabbit mammary gland. Journal of Visualized Experiments. (121), e55209 (2017).
- Chakravarty, S., et al. Tantalum oxide nanoparticles as versatile contrast agents for X-ray computed tomography. Nanoscale. 12 (14), 7720-7734 (2020).
- Kenyon, E., et al. Intraductal delivery and x-ray visualization of ethanol-based ablative solution for prevention and local treatment of breast cancer in mouse models. Journal of Visualized Experiments. (182), e63457 (2022).
- Murata, S., et al. Ductal access for prevention and therapy of mammary tumors. Cancer Research. 66 (2), 638-645 (2006).
- King, B. L., Love, S. M. The intraductal approach to the breast: raison d'etre. Breast Cancer Research. 8 (2), 206 (2006).
- Love, S. M., Barsky, S. H. Anatomy of the nipple and breast ducts revisited. Cancer. 101 (9), 1947-1957 (2004).
- Lai, Y. E., Morhard, R., Ramanujam, N., Nolan, M. W. Minimally invasive ethyl cellulose ethanol ablation in domesticated cats with naturally occurring head and neck cancers: Six cats. Veterinary and Comparative Oncology. 19 (3), 492-500 (2021).
- Mueller, J. L., et al. Optimizing ethyl cellulose-ethanol delivery towards enabling ablation of cervical dysplasia. Scientific Reports. 11 (1), 16869 (2021).
- Nief, C., et al. Polymer-assisted intratumoral delivery of ethanol: Preclinical investigation of safety and efficacy in a murine breast cancer model. PLoS One. 16 (1), 0234535 (2021).
- Chelales, E., et al. Radiologic-pathologic analysis of increased ethanol localization and ablative extent achieved by ethyl cellulose. Scientific Reports. 11 (1), 20700 (2021).
- Morhard, R., et al. Understanding factors governing distribution volume of ethyl cellulose-ethanol to optimize ablative therapy in the liver. IEEE Trans Biomedical Engineering. 67 (8), 2337-2348 (2020).
- Morhard, R., et al. Development of enhanced ethanol ablation as an alternative to surgery in treatment of superficial solid tumors. Scientific Reports. 7 (1), 8750 (2017).
- Russo, I. H., Russo, J. Developmental stage of the rat mammary gland as determinant of its susceptibility to 7,12-dimethylbenz[a]anthracene. Journal of the National Cancer Institute. 61 (6), 1439-1449 (1978).
- Paine, I. S., Lewis, M. T. The terminal end bud: The little engine that could. Journal of Mammary Gland Biology Neoplasia. 22 (2), 93-108 (2017).
- Hinck, L., Silberstein, G. B. Key stages in mammary gland development: the mammary end bud as a motile organ. Breast Cancer Research. 7 (6), 245-251 (2005).
- Sivaraman, L., et al. Effect of selective ablation of proliferating mammary epithelial cells on MNU induced rat mammary tumorigenesis. Breast Cancer Research Treatment. 73 (1), 75-83 (2002).
- Cardiff, R. D., Wellings, S. R. The comparative pathology of human and mouse mammary glands. Journal of Mammary Gland Biology Neoplasia. 4 (1), 105-122 (1999).
- Brock, A., et al. Silencing HoxA1 by intraductal injection of siRNA lipidoid nanoparticles prevents mammary tumor progression in mice. Scientific Translational Medicine. 6 (217), (2014).
- de Groot, J. S., et al. Intraductal cisplatin treatment in a BRCA-associated breast cancer mouse model attenuates tumor development but leads to systemic tumors in aged female mice. Oncotarget. 8 (37), 60750-60763 (2017).
- Wang, G., et al. Intraductal fulvestrant for therapy of ERalpha-positive Ductal Carcinoma in Situ (DCIS) of the breast - A preclinical study. Carcinogenesis. 40 (7), 907-913 (2019).
- Yoshida, T., et al. Effective treatment of ductal carcinoma in situ with a HER-2- targeted alpha-particle emitting radionuclide in a preclinical model of human breast cancer. Oncotarget. 7 (22), 33306-33315 (2016).
- Chun, Y. S., et al. Intraductally administered pegylated liposomal doxorubicin reduces mammary stem cell function in the mammary gland but in the long term, induces malignant tumors. Breast Cancer Research Treatment. 135 (1), 201-208 (2012).
- Markiewicz, E., et al. High resolution 3D MRI of mouse mammary glands with intra-ductal injection of contrast media. Magnetic Resonance Imaging. 33 (1), 161-165 (2015).
- Markiewicz, E., et al. MRI ductography of contrast agent distribution and leakage in normal mouse mammary ducts and ducts with in situ cancer. Magnetic Resonance Imaging. 40, 48-52 (2017).
- Annunziato, S., et al. Comparative oncogenomics identifies combinations of driver genes and drug targets in BRCA1-mutated breast cancer. Nature Communications. 10 (1), 397 (2019).
- Rutkowski, M. R., et al. Initiation of metastatic breast carcinoma by targeting of the ductal epithelium with adenovirus-cre: a novel transgenic mouse model of breast cancer. Journal of Visualized Experiments. (85), e51171 (2014).
- Xiang, D., Tao, L., Li, Z. Modeling breast cancer via an intraductal injection of cre-expressing adenovirus into the mouse mammary gland. Journal of Visualized Experiments. (148), e59502 (2019).
- Barham, W., Sherrill, T., Connelly, L., Blackwell, T. S., Yull, F. E. Intraductal injection of LPS as a mouse model of mastitis: signaling visualized via an NF-kappaB reporter transgenic. Journal of Visualized Experiments. (67), e4030 (2012).
- Chun, Y. S., et al. Intraductal administration of a polymeric nanoparticle formulation of curcumin (NanoCurc) significantly attenuates incidence of mammary tumors in a rodent chemical carcinogenesis model: Implications for breast cancer chemoprevention in at-risk populations. Carcinogenesis. 33 (11), 2242-2249 (2012).
- Stearns, V., et al. Preclinical and clinical evaluation of intraductally administered agents in early breast cancer. Science Translational Medicine. 3 (106), (2011).
- Okugawa, H., et al. Effect of perductal paclitaxel exposure on the development of MNU-induced mammary carcinoma in female S-D rats. Breast Cancer Research Treatment. 91 (1), 29-34 (2005).
- Falconer, I. R. The distribution of 131 I- or 125 I-labelled prolactin in rabbit mammary tissue after intravenous or intraductal injection. Journal of Endocrinology. 53 (3), 58-59 (1972).
- Fiddler, T. J., Birkinshaw, M., Falconer, I. R. Effects of intraductal prolactin on some aspects of the ultrastructure and biochemistry of mammary tissue in the pseudopregnant rabbit. Journal of Endocrinology. 49 (3), 459-469 (1971).
- Fiddler, T. J., Falconer, I. R. The effect of intraductal prolactin on protein and nucleic acid biosynthesis in the rabbit mammary gland. The Biochemical Journal. 115 (5), 58 (1969).
- Bourne, R. A., Bryant, J. A., Falconer, I. R. Stimulation of DNA synthesis by prolactin in rabbit mammary tissue. Journal of Cell Science. 14 (1), 105-111 (1974).
- Chadwick, A. Detection and assay of prolactin by the local lactogenic response in the rabbit. The Journal of Endocrinology. 27, 253-263 (1963).
- Mahoney, M. E., et al. Intraductal therapy of ductal carcinoma in situ: a presurgery study. Clinical Breast Cancer. 13 (4), 280-286 (2013).
- Love, S. M., et al. A feasibility study of the intraductal administration of chemotherapy. Cancer Preview Research (Phila). 6 (1), 51-58 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유