Method Article
导管内乙醇消融治疗在大鼠模型中预防乳腺癌的X射线可视化
摘要
描述了将化学烧蚀溶液输送到大鼠乳腺导管树以进行乳腺癌图像引导预防治疗的程序。通过直接插管到开口和导管内输注 70% 乙醇基消融液,可以靶向乳腺上皮细胞,从而以最小的侧支组织损伤。
摘要
预防乳腺癌的主要干预措施数量仍然有限。对于患乳腺癌风险高的女性,最有效的干预措施是预防性乳房切除术。这是一种剧烈的外科手术,其中可引起乳腺癌的乳腺上皮细胞与周围组织一起被完全去除。该协议的目标是证明微创导管内手术的可行性,该手术可能成为乳腺癌预防的新主要干预措施。这种局部手术将优先消融乳腺上皮细胞,以免它们变成恶性。密歇根州立大学和其他地方已经开发了将溶液直接输送到乳腺癌啮齿动物模型中这些上皮细胞的导管内方法。大鼠乳腺由一棵导管树组成,与人类乳房相比,其结构更简单、更线性。然而,化学诱导的乳腺癌大鼠模型为新的预防性干预措施的概念验证研究以及从小鼠模型到人类的可扩展性提供了有价值的工具。这里描述了将含有氧化钽纳米颗粒作为X射线造影剂和乙基纤维素作为胶凝剂的乙醇基烧蚀溶液输送到大鼠乳腺导管树中的程序。通过导管内注射递送水性试剂(例如,细胞毒性化合物、siRNA、AdCre)之前已在小鼠和大鼠模型中描述过。该协议描述强调了与提供消融性解决方案有关的方法学变化和步骤,配方考虑以最大程度地减少烧蚀性溶液的局部和全身副作用, 以及用于体内 评估导管树填充物的X射线成像。透视和显微CT技术能够确定烧蚀溶液输送的成功以及导管树的填充程度,这要归功于与含钽造影剂的相容性。
引言
对于美国的女性1,乳腺癌(BC)仍然是最常被诊断的癌症类型,并且比除肺癌以外的任何其他癌症类型导致更多的死亡。对 2022 年的预测估计,将有 51,400 名妇女被诊断出患有原位癌,287,850 名妇女将被诊断患有浸润性癌,43,600 名妇女将死于 BC1。尽管BC的患病率和死亡率很高,但由于联邦机构没有优先考虑一级预防,因此对于新型干预措施的一级预防和转化研究的选择很少2.预防性乳房切除术是一级预防最有效的干预措施。但是,此手术仅推荐用于高风险人群,因为它是一项具有改变生活后果的大手术3。该手术涉及完全去除发生癌变的乳腺上皮细胞以及正常的周围组织。由于身体、心理和社会压力的负面影响,个人经常被劝阻不要使用此程序作为主要干预的首选。由于这些原因,即使是一些高风险个体也选择不接受此程序,而是选择观察等待或类似的监测策略3。在之前的出版物中,将70%乙醇(EtOH)直接输送到小鼠模型的导管树中可有效化学消融乳腺上皮细胞,对邻近正常组织的损伤有限,并可防止乳腺肿瘤形成4。EtOH在多种临床应用中用作局部治疗某些癌症的消融剂或局部治疗动静脉肿胀和畸形的硬化剂5,6,7,8,9,10,11,12,13,14.EtOH的低毒性和安全性已得到充分证实,因为在某些程序中,每疗程可施用高达50mL的95%EtOH。
完全切除发生BC的乳腺上皮细胞是预防性乳房切除术和局部输送消融溶液的最关键组成部分。因此,确认完全的导管树填充是必要的,以保证消融溶液与所有乳腺上皮细胞直接接触。通过已经存在的临床程序,可以在导管树内提供解决方案并通过图像引导的荧光透视或导管造影将其可视化15,16,17。因此,在临床试验中容易地实施和评估该程序将是可行的。确定导管内(ID)消融术作为一级预防的新干预措施的有效性和转化可行性的关键步骤将是证明这种X射线可视化方法在导管树结构的大小和复杂性不断增加的动物模型中的可行性4,18,19。这里描述了将这种消融过程从小鼠20扩展到大鼠模型的协议。虽然小鼠和大鼠导管树具有相似的线性结构和分支模式,但大鼠导管树成比例地更大,并且被更密集的基质包围。我们在实验室中实施了一种方法,通过一系列每周的疗程成功地将大鼠的每个乳腺注射到含有造影剂的烧蚀溶液中。会话间隔是必要的,以确保动物具有最小的EtOH副作用(图1和图2)。该过程涉及用33G针将消融溶液直接注射到异氟醚麻醉大鼠的开口中。该程序的一些关键改进包括使用扩展的抗炎治疗,每根导管树注射比建议的21更高的体积,以及用于液体和气体的气密注射器。从ID注射前48小时到1周用5mg / kg卡洛芬(NSAID)治疗的持续时间与临床中用于静脉畸形硬化治疗的抗炎方案相当。治疗是在全身麻醉下对患者进行的,然后使用2天的抗炎药物,如非甾体抗炎药。抗炎治疗可以再延长几天,以减少局部炎症和任何潜在的疼痛13。与小鼠20一样,腹膜内注射5%蔗糖溶液可减轻大鼠酒精中毒的短期影响。当与该蔗糖溶液一起给药时,大鼠可以在单次会话中注射多达 1 mL 的 70% EtOH(最多 4 个导管;血液中的 0.2 g/dL EtOH 含量);动物在注射ID后4小时内完全恢复。我们进行连续的治疗,以便在注射超过4个腺体和/或更高的EtOH浓度时有足够的恢复时间。假设 16 个主导管16,17和每个导管 2 mL 22,23,70% EtOH 会导致血液中的 EtOH 含量低于 0.1 g/dL,并可能导致轻度损害,女性酒精中毒的可能性要小得多,因为腺的所有导管树 ID 注射。
X射线成像能够确定每个腺体的导管内分娩成功程度以及整个导管树是否被填充(图1,图2,图3)。 为显微CT扫描和/或DICOM文件数据的3D重建做准备的实时荧光成像可用于评估溶液输送到导管树中的程度以及任何渗漏到基质的程度。使用透视可以帮助限制施加在动物身上的总辐射剂量。透视技术更接近于这种消融治疗的图像引导的预期临床应用。已经将FDA批准的含碘Isovue与氧化钽(TaOx)纳米颗粒进行了比较,以进一步完善烧蚀溶液4,19的效用。已经发现TaOx是一种优于Isovue的显微CT造影剂,用于可视化小鼠导管树的初始填充4,19。在这里,我们证明TaOx是一种合适的造影剂,用于可视化大鼠导管树的初始填充(图2和图3)。在转化研究和临床实践应用中,胶凝剂乙基纤维素(EC)已被添加到EtOH溶液中,以最大限度地减少从预定目标区域13,14,24,25,26,27,28,29的扩散。研究表明,在含EtOH的烧蚀溶液中添加高达1.5%的EC与基于TaOx的成像兼容(图3)。这些以及对消融解决方案的进一步改进可能有助于将这种图像引导程序随时转化为临床。
研究方案
所描述的所有实验都是在密歇根州立大学机构动物护理和使用委员会批准的协议下进行的。
1. 延长抗炎治疗
- 准备三氯蔗糖凝胶杯作为卡洛芬的口服剂量。从接受70%EtOH的ID注射前2天到手术后7天为大鼠提供这种抗炎治疗。
- 在无菌PBS中稀释卡洛芬的工作溶液以注射到杯子中。从 50 mg/mL 储备溶液中,制备用 1% v/v 无菌蓝色食用染料着色的稀释的 2 mg/mL 溶液,并向每个杯中注入 500 μL。添加染料有助于可视化杯子三氯蔗糖内药物的完全混合。
- 按照制造商的建议准备杯子以添加卡洛芬。除非供应商另有说明,否则将杯子在60°C的水浴中加热15分钟,并在取出时干燥以降低污染风险。
- 用70%EtOH擦拭该区域的三氯蔗糖杯盖,并引入含有卡洛芬工作溶液的注射器的针头。分配适当的体积(500μL)。
- 用贴纸盖住穿刺。用力摇晃杯子 15 秒,然后将杯子放在漩涡中再摇晃 15 秒。目视评估均匀和完整的混合,然后储存以供以后使用。寻找深蓝色的存在。
注意:让杯子达到室温。如果需要,将杯子存放在室温下,但请注意制造商的药物疗效指南。或者,将杯子储存在4°C并在一个月内使用。对贴纸进行日期测定是跟踪注射日期的好方法,而不会有钢笔或锋利记号笔刺穿盖子的风险。
- 使用前,用 70% 的 EtOH 擦拭杯子的外部。在将杯子放入动物笼子之前,请取下盖子。每隔一天或空时更换杯子。每天检查凝胶水平以确保足够的剂量。一杯最多可以为两只大鼠提供卡洛芬长达 2 天;然而,老鼠可能会更快地消耗整杯。
2.术前准备
注意:确保动物准备步骤比ID注射程序早2-3天。
- 打开异氟醚蒸发器(2%-3%异氟烷,1.5L / min氧气)麻醉大鼠。将动物移到加热垫上的鼻锥上。在大鼠身上涂抹眼睛润滑剂,然后将动物放在背部。仔细监测动物的呼吸,确保麻醉平面保持在异氟醚的1%-3%。
注意:脱毛前可以使用电动剃须刀去除多余的毛皮。必须格外小心,不要用剃须刀损坏任何。因此,可以跳过此步骤。大鼠对脱毛膏比小鼠更敏感,因此去除多余的乳膏非常重要。避免将含乙醇的溶液注入已经存在脱毛磨损的区域。一些面霜添加了芦荟和羊毛脂等化合物,可以帮助最大限度地减少擦伤的可能性。 - 使用棉尖涂抹器将非处方脱毛膏涂抹在区域。使用涂抹器将奶油擦入该区域 10-30 秒。检查皮毛是否迅速松动。
- 将乳膏留在大鼠上尽可能短的间隔,并完全去除以避免皮肤灼伤。大鼠对这一过程甚至比小鼠更敏感。
- 使用10-30秒后,用温水弄湿纱布,并用它来冲洗动物的奶油和松动的皮毛。用新鲜湿润的纱布冲洗该区域至少三次,并在最后一次冲洗后用干纱布擦干。确认良好的能见度和进入去除毛皮的区域。如有必要,重复脱毛程序。
- 将大鼠放在加热垫上的干净笼子中,让它恢复。检查大鼠以确保它从麻醉中完全恢复,然后再将其带回永久笼子。
- 将一个卡洛芬剂量(1毫克/杯)的三氯蔗糖凝胶杯放入笼子中进行抗炎治疗。每天检查凝胶消耗量,并酌情更换新鲜杯子。不要将杯子放置超过2天。通常,杯子需要在 1 天后更换。
3.导管内注射
- 使用无菌磷酸盐缓冲盐水(PBS)如333.3mM制备TaOx 储备溶液,如19 所述。如果粉末没有完全溶解,请加热溶液。轻轻搅拌。不要剧烈涡旋或摇晃,以免形成气泡。
- 将三份 333.3 mM TaO x 与七份 100% 乙基醇混合,制成最终的 70% 乙基醇 100 mM/TaOx 溶液。任选地,加入适量的0.5%-1.5%乙基纤维素(EC)作为胶凝剂,以最大限度地局部保留烧蚀溶液。在消融溶液中加入 1% v/v 蓝色食用染料,以便在输注过程中目视检查输送到导管树中的情况。
- 准备适合实验需要的体积。腺体对 1(宫颈)和 6(腹股沟)最多可填充 100 μL 溶液,而所有其他对可填充高达 300 μL。
- 如步骤2.1所示麻醉大鼠,并在完全麻醉后将大鼠移至鼻锥。在双眼上涂抹眼睛润滑剂,然后将动物放在背上。如果需要,使用胶带将要注射的附近的胶带将大鼠固定在立体镜下方。老鼠的重量通常足以防止它在没有胶带的情况下大幅移动。
- 要准备注射,如果可能的话,用细尖的镊子去除覆盖开口的任何死皮。大鼠通常有一个从开口突出的塞子,如果不移除,可以防止成功插管。
注意:重要的是要注意,大鼠使用的较大消融溶液的注射量可能更可能导致注射部位附近的浅表皮肤伤口。出于这个原因,在一次会话中注射每隔一个对动物的伤害和刺激性比注射相邻的要小。在注射后7天内监测大鼠的任何擦伤有助于确保动物抓挠不会对健康造成严重影响,并引入笼子地板碎片污染感染的可能性。三联抗生素软膏或洗必泰溶液洗涤可用于治疗可能发生的任何损伤感染迹象(表 1)。 - 使用带有 33 G 针头的 500 μL 注射器吸出 101-301 μL 消融溶液。取出空心针时,再吸出 1 μL 溶液,以免出现轻微泄漏。
注意:这些是针对旨在完全填充导管树的体积的建议:宫颈和腹股沟腺最多 100 μL,其他腺体最多 300 μL。对于其他应用程序,可能适合使用更小或更大的卷。 - 用镊子轻轻握住,然后将针头插入开口。轻轻地继续插入针头,直到斜面完全进入内。为了将针头容纳在中,请将朝向针头,而不是将针头向下推入。(表1)。注意遵循开口的路径。
注意:由于较大的尺寸,大鼠通常比小鼠更容易操作和成功套管。然而,开口周围的脂肪量增加也使得如果针头偏离主导管,更有可能错误地注射脂肪垫。 - 一旦针头斜面完全插入,在大鼠中以约100μL / min的恒定速率缓慢注入溶液。输注速率的突然变化可能会破裂或损坏导管树。在输注结束后等待30秒,然后使用镊子从空心树上取下针头;这可确保注入的体积保持在导管树内(图2)并降低泄漏的可能性。
- 用湿纱布或EtOH擦拭清洁任何溢出的溶液,以避免图像中出现无关的对比溶液。
- 如果ID注射溶液中含有乙醇,则腹腔注射含有5%蔗糖(10mL / kg)的PBS,以减轻酒精中毒的影响。该剂量可以在手术开始和结束时给予。
4. 显微CT成像
- 注射所有所需的腺体后,迅速将动物移至显微CT系统,并使用掺入的异氟醚蒸发器继续维持麻醉。
- 拉直动物的脊柱并将每条后腿贴在伸展位置,使动物的腿骨远离感兴趣的下腺体,并且不会与扫描图像中的兴趣区域重叠。
- 在腹部贴上胶带,以尽量减少扫描下腺体时的呼吸伪影。
注意:如果注意确定大鼠可接受的终身辐射剂量并确保累积剂量不超过该水平,则可以使用不同的扫描参数(例如,高分辨率,纵向扫描)对动物进行成像。通过获取荧光透视静止图像和视频而不进行扫描,可以进一步减少辐射暴露(图2)。 - 使用以下扫描参数以良好的分辨率对大鼠导管树进行TaOx 成像,并有机会重复标准(2分钟)采集扫描:90 kVp / 88μA;视场角,72 毫米;切片数,512;切片厚度,72 μm;体素分辨率,72 μm3。也可以在不会使用相同的参数进行纵向扫描的动物中获取更长时间段(4-14分钟)的高分辨率扫描。
- 数据采集后,小心地将大鼠从麻醉锥上取下,并放置在加热垫上的新干净笼中。检查大鼠以确保它已从麻醉中完全恢复,然后再将其带回永久笼子。放置含有卡洛芬的三氯蔗糖杯并按照步骤2.5中所述适当更换,以确保动物在接下来的7天内继续接受抗炎治疗。
- 在micro-CT软件中将扫描的图像处理成快速再现,以更好地理解任何对比度泄漏,仅部分填充或过度填充(图2)。
- 如果需要,请继续下一部分以执行正式的图像处理,以便发布或对扫描进行详细分析(图3)。
5. 图像分析
- 使用专门的软件包生成填充的风管树的渲染图。
注意:最好将乳腺脂肪垫分割开来,以便获得最佳注射的导管树的再现。样条在动物的整个厚度上跟踪脂肪垫的黑暗边界,以实现这种分割。 - 要分割脂肪垫(与小鼠不同,由于类似的Hounsfield单位,该隔间的边界不容易与腹膜腔,股骨肌肉和皮肤区分开来),其中包含感兴趣的导管树,从手动菜单中选择"样条曲线"选项是创建渲染的第一步。
- 样条曲线每三个切片中描摹脂肪垫轮廓。单击半自动菜单中的" 传播对象 "选项。这将传播并将所有切片连接到一个感兴趣的分段对象中。
注意:在分段区域内更改阈值仅允许在Hounsfield单位(HU)的特定范围内可视化信号;对于其他造影剂或成像参数,可能需要调整此范围。软件包或人工智能分析可用于进行其他测量和图像,以显示管道树被填充了多少。 - 在阈值音量选项卡下的半自动菜单上将 HU 值设置为低点 300,高点 3,000。这允许创建仅显示导管树内的对比度 (TaOx) 的再现。
- 使用"查看"按钮将格式副本设置为主要格式副本。这会将显示更改为仅显示风管树的 3D 呈现。
注意:对导管树进行重建以进行进一步分析。
结果
雌性大鼠的12个乳腺中的每一个都包含一个在孔处打开的导管树。尽管小鼠和大鼠之间的大小不同,但乳腺的发育时间和这些动物成年的时间非常相似30,31。简要描述了代表两种啮齿动物的大鼠乳腺发育的关键阶段。末端芽(TEBs)是细长导管树顶端的高度增殖结构,可直接分支导管30,31。TEB的增殖和密度峰值出现在青春期发育30中导管树伸长阶段的3-4周龄。到9-10周龄时,由于导管树已经生长到占据脂肪垫的整个长度30,因此剩余的TEB很少。之后,导管树的生长和扩张与脂肪垫和动物的生长和扩张成正比32.人类乳房中的末端导管小叶单位(TDLU)的作用与啮齿动物中的TEB相似。TDLU是开始致癌和进展到BC33,34的主要来源。我们可以注入多达 300 μL 的 70% EtOH 溶液来填充 9 周龄 Sprague-Dawley 大鼠胸腺和腹部乳腺的整个导管树(图 1、图 2、图 3)。与小鼠20不同,Sprague-Dawley大鼠的宫颈和腹股沟腺的通常适用于80%以上的动物注射,并且需要高达100μL的70%EtOH溶液来填充整个导管树(图2)。我们常规地用正在研究的消融溶液注射多达10个乳腺。典型的实验设计包括两个独立的每周ID注射疗程,其中五个交替的腺体注入含有X射线造影剂和/或EC作为胶凝剂的烧蚀溶液(图2)。对于含TaOx(50-200mM)的烧蚀溶液,在每个疗程结束后进行透视和/或显微CT扫描,以确定并记录向每个导管树注入部分或全部注入溶液的个体成功(图2)。注射后的即时和纵向成像可以评估配方的变化,特别是EC胶凝剂的浓度,如何影响和限制烧蚀溶液的向外扩散,作为注射体积的函数(图3)。该成像分析提供信息以了解最佳参数,以实现最大的消融和最小的侧支组织损伤。
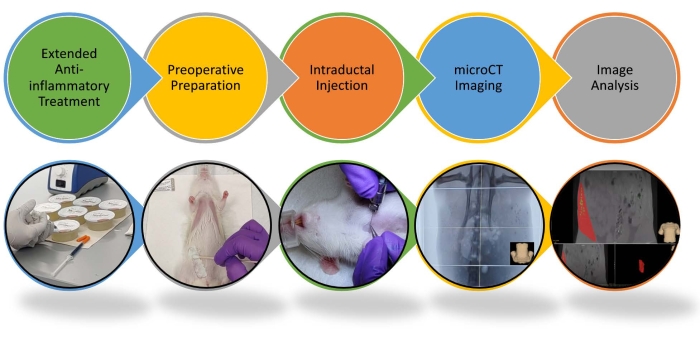
图1:大鼠导管内注射和图像分析程序的示意图。 重点介绍了导管内注射和图像分析的分步程序。有关更多详细信息,请参阅视频。 请点击此处查看此图的大图。

图 2:插管的示例以及消融溶液进入多个乳腺的递送结果。 (A)Sprague-Dawley大鼠品系中形状的典型表现。长度与成功插管的可能性相关。较长的比短的更容易插管,而过短或退化的则不能插管。一旦插管,长和短都可以注入溶液,并达到相似的分娩成功率。注射溶液中的蓝色食用染料可用作导管树填充和输送成功的体内证据(最明显的是圆顶形成,用于不成功的脂肪垫注射)。图像采集后生成的实时荧光透视(B)和3D显微CT再现(C)提供了递送成功的体内证据,并对到达TEB的溶液进行了更定量的评估。(B)第一对(#4,#10)的每个腹部乳腺接受1%EC(橙色轮廓)或没有1%EC(绿色轮廓)的消融溶液(C)成功输送(蓝色轮廓)右颈,第二对胸(#3,#9)和第一对腹部(#4,#10)乳腺的消融溶液,并在左胸腺腺中注射失败(虚线白色轮廓)。比例尺对应于不同放大倍率下图像中的 1 mm。请点击此处查看此图的大图。

图 3:烧蚀溶液填充和扩散的 3D 重建和评估 。 将70%EtOH/100 mM TaOx 纳米颗粒与1%EC(顶部)或不具有EC(底部)注射到第二个腹部乳腺对(#4和#10)中,并立即通过显微CT成像。每只Sprague-Dawley大鼠接受增加的任一溶液。使用图像分析软件包(样条轨迹 + 传播对象 + 阈值再现)重建单个导管树。使用1%的EC时,可以看到溶液到达终端末端。随着交付量的增加,填充的TEB数量更加明显。比例尺对应于所有演绎版中的 10 毫米。 请点击此处查看此图的大图。
| 问题 | 外观 | 溶液 | |||
| 短(图 2) | 低调 – 难以抓住 | 有时更容易将皮肤固定在附近,并用针瞄准的中心。针头可能会潜入皮肤下。慢慢向上拉可能会发现略高于针尖,并留出空间抓住并将其拉到针头的其余部分。在皮肤以下潜水时要非常小心针的角度。很容易通过以错误的角度刺伤而无意中注射脂肪垫。 | |||
| 脂肪垫注射(图2) | 周围肿胀,可能还有本身肿胀 – 最容易看到注射液中是否添加了颜色 | 如果前几次注射后肿胀,请取下针头,并尝试再次插入,并更加注意角度。再次开始注射,注意是否有进一步肿胀。如果肿胀持续,请放弃尝试。成功注射最初作为脂肪垫注射的是非常罕见的。 | |||
| 伤口/结痂 | EtOH溶液注射部位附近的开放性伤口或结痂 | 大鼠比小鼠更容易在注射区域附近出现伤口或结痂。如果发现伤口,在开放性伤口上涂抹三重抗生素软膏,但不要管结痂的伤口。在结痂上涂抹软膏会增加动物打扰结痂并将其去除的可能性。每1-2天检查一次,直到愈合,具体取决于伤口的严重程度。卡洛芬应给予直至愈合,即使超出正常窗口。 | |||
| 注入交替腺体 | 不适用 | 大鼠的注射量较大,如果注射连续腺体,则更有可能引起皮肤擦伤。为了尽量减少对注射区域造成创伤的可能性,在一次治疗中注射交替腺体(即注射#1,3,4和6而不是#1-4)。第三(#3和#9)和第四(#4和#10)腺体对之间的间距允许在一个会话中注射这两个腺体。 | |||
表 1: 有用的提示和故障排除
讨论
如图所示,70%EtOH的ID递送优先消融乳腺上皮细胞,对小鼠周围基质和脉管系统的附带损害有限4。导管树的局部消融可有效防止小鼠模型中的肿瘤形成4。在这里,我们证明了这种消融程序可以扩大到大鼠。
这是将这种消融手术转化为预防性乳房切除术的替代干预措施以对高危人群进行乳腺癌一级预防的下一步。将TaOx纳米颗粒作为X射线造影剂添加到消融溶液中可以评估溶液在防止肿瘤形成方面的有效性,因为可以确定该过程在完全填充导管树时是否成功。使用透视来可视化注射的乳腺反映了诊所可能做的事情,以指导此ID程序。图像引导溶液填充了多少导管树以及何时停止输注将是临床实施的关键方面,以确保每个导管树的最大填充。表 1 中列出了故障排除和有用的提示。这种消融手术的有效性要求输注的溶液与所有上皮细胞直接接触,以最大限度地提高细胞杀伤率。一棵或多棵树内的备用上皮细胞最终可以作为BC发育的来源。其他组报告了小鼠4,19,21,35,36,37,38,39,40的病毒颗粒(例如Cre / LoxP和/或Cas9 / CRISPR系统的成分),激素和激素拮抗剂(例如催乳素,氟维司群),化疗剂(例如顺铂),siRNA和/或抗体或其他靶向剂的ID递送, 41,42,43,44,45,大鼠21,33,46,47,48和/或兔18,49,50,51,52,53.独立临床研究报道了每个人类乳房最多 8 棵导管树用于局部化疗的成功插管47,54,55。输注这些旨在预防肿瘤或面向局部治疗的其他溶液的图像引导同样可以最大限度地提高其有效性。
这里演示了该过程从小鼠到大鼠导管树的可扩展性和改进性。小鼠4,19和大鼠(未发表的数据)导管树中的TaOx纳米颗粒提供了超越FDA批准的含碘X射线造影剂的高分辨率成像。同样,我们不知道在小鼠40,41或其他动物模型18中可以提供与TaOx相当的分辨率的其他导管树成像方法。与临床转化相关的事实是,EC在这种中等大小的大鼠模型中的胶凝效应是一种使配方改进,以最大限度地减少附带组织损伤。随着我们继续评估这种消融性ID程序预防BC的能力,我们将能够更准确地确定腺体BC通过化学诱导和其他BC大鼠模型中ID递送后成像提供的附加信息而发展。这些数据将确定该手术的安全性,并查明部分或未成功治疗的导管树是否更容易在高危女性中发生BC的任何担忧或缺点。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了国家癌症研究所R21 CA226579和R01 CA258314对LFS的资助以及国家生物医学成像和生物工程研究所R01 EB029418对EMS的资助的部分支持。我们感谢MSU定量(IQ)健康科学与工程成像核心研究所使用他们的成像系统和技术专长。我们感谢丹妮尔·弗格森博士审查了视频的内容和遵守动物福利准则的数字。
材料
| Name | Company | Catalog Number | Comments |
| AnalyzeDirect v12.0 | Caliper | n/a | For micro-CT image processing |
| Carprieve, Carprofen 50 mg/mL | Allivet | 50647 | For anti-inflammatory treatment |
| Ethyl cellulose | Acros Organics | 9004-57-3 | For intraductal injection |
| Evans blue | Sigma | E2129-50G | For injection visualization |
| Hot water bath | Toolots | Yidu_HH-S2 | For preparing carprofen cups |
| MediGel Sucralose Cups | ClearH2O | 74-02-5022 | For delivery of carprofen |
| Model 1750 TTL, PTFE Luer Lock Syringe, 500μL | Hamilton | 81220 | For intraductal injection |
| Photoshop 2021 | Adobe | n/a | For image processing |
| Quantum GX2 microCT Imaging System | Perkin Elmer | CLS149276 | For micro-CT image acquisition |
| Metal Hub Needle, 33 gauge, custom (30° bevel angle, 0.4 in, point style 4) | Hamilton | 7747-01 | For intraductal injection |
| Stereo Microscope SZM Series | AmScope | SM-4TPZ-144 | For intraductal injection |
| Sterile blue food dye | McCormick | 930641 | For injection visualization |
| Sterile phosphate buffered saline (PBS) | ThermoFisher | 14190250 | For solution preparation |
| Stickers | DOT Scientific | DOTSCI-C50 | For preparing carprofen cups |
| Sucrose | Calbiochem | 8550-5KG | For intraductal injection |
| Syringes | Fisher | 14-826-79 | For preparing carprofen cups |
| Vortex | VWR | 10153-834 | For preparing carprofen cups |
| Warming pump/pad(s) | Braintree Scientific | HTP-1500 120V; AP-R 26E | For intraductal injection/preoperative preparation |
参考文献
- Siegel, R. L., Miller, K. D., Fuchs, H. E., Jemal, A. Cancer statistics, 2022. A Cancer Journal for Clinicians. 72 (1), 7-33 (2022).
- Wild, C. P. The global cancer burden: necessity is the mother of prevention. Nature Reviews. Cancer. 19 (3), 123-124 (2019).
- Padamsee, T. J., Wills, C. E., Yee, L. D., Paskett, E. D. Decision making for breast cancer prevention among women at elevated risk. Breast Cancer Research. 19 (1), 34 (2017).
- Kenyon, E., et al. Ductal tree ablation by local delivery of ethanol prevents tumor formation in an aggressive mouse model of breast cancer. Breast Cancer Research. 21 (1), 129 (2019).
- Kuang, M., et al. Ethanol ablation of hepatocellular carcinoma Up to 5.0 cm by using a multipronged injection needle with high-dose strategy. Radiology. 253 (2), 552-561 (2009).
- Ansari, D., Andersson, R. Radiofrequency ablation or percutaneous ethanol injection for the treatment of liver tumors. World Journal of Gastroenterology. 18 (10), 1003-1008 (2012).
- Zhang, W. Y., Li, Z. S., Jin, Z. D. Endoscopic ultrasound-guided ethanol ablation therapy for tumors. World Journal of Gastroenterology. 19 (22), 3397-3403 (2013).
- Chin, M., Chen, C. L., Chang, K., Lee, J., Samarasena, J. Ethanol ablation of a peripheral nerve sheath tumor presenting as a small bowel obstruction. ACG Case Reports Journal. 3 (1), 31-32 (2015).
- Gueng, M. -. K., Chou, Y. -. H., Tiu, C. -. M., Chiou, S. -. Y., Cheng, Y. -. F. Pseudoaneurysm of the breast treated with percutaneous ethanol injection. Journal of Medical Ultrasound. 22 (2), 114-116 (2014).
- Zhang, J., et al. Comparison between absolute ethanol and bleomycin for the treatment of venous malformation in children. Experimental and Therapeutic Medicine. 6 (2), 305-309 (2013).
- Wohlgemuth, W. A., et al. Ethanolgel sclerotherapy of venous malformations improves health-related quality-of-life in adults and children - results of a prospective study. European Radiology. 27 (6), 2482-2488 (2017).
- Steiner, F., FitzJohn, T., Tan, S. T. Ethanol sclerotherapy for venous malformation. ANZ Journal of Surgery. 86 (10), 790-795 (2016).
- Sannier, K., et al. A new sclerosing agent in the treatment of venous malformations. Study on 23 cases. Interventional Neuroradiology. 10 (2), 113-127 (2004).
- Dompmartin, A., et al. Radio-opaque ethylcellulose-ethanol is a safe and efficient sclerosing agent for venous malformations. European Radiology. 21 (12), 2647-2656 (2011).
- Faguy, K. Ductography: When, how, and why. Radiologic Technology. 92 (5), 487-503 (2021).
- Slawson, S. H., Johnson, B. A. Ductography: how to and what if. Radiographics. 21 (1), 133-150 (2001).
- Sheiman, L. S., Levesque, P. H. The in's and out's of ductography: A comprehensive review. Current Problems in Diagnostic Radiology. 45 (1), 61-70 (2016).
- Clark, A., Bird, N. K., Brock, A. Intraductal delivery to the rabbit mammary gland. Journal of Visualized Experiments. (121), e55209 (2017).
- Chakravarty, S., et al. Tantalum oxide nanoparticles as versatile contrast agents for X-ray computed tomography. Nanoscale. 12 (14), 7720-7734 (2020).
- Kenyon, E., et al. Intraductal delivery and x-ray visualization of ethanol-based ablative solution for prevention and local treatment of breast cancer in mouse models. Journal of Visualized Experiments. (182), e63457 (2022).
- Murata, S., et al. Ductal access for prevention and therapy of mammary tumors. Cancer Research. 66 (2), 638-645 (2006).
- King, B. L., Love, S. M. The intraductal approach to the breast: raison d'etre. Breast Cancer Research. 8 (2), 206 (2006).
- Love, S. M., Barsky, S. H. Anatomy of the nipple and breast ducts revisited. Cancer. 101 (9), 1947-1957 (2004).
- Lai, Y. E., Morhard, R., Ramanujam, N., Nolan, M. W. Minimally invasive ethyl cellulose ethanol ablation in domesticated cats with naturally occurring head and neck cancers: Six cats. Veterinary and Comparative Oncology. 19 (3), 492-500 (2021).
- Mueller, J. L., et al. Optimizing ethyl cellulose-ethanol delivery towards enabling ablation of cervical dysplasia. Scientific Reports. 11 (1), 16869 (2021).
- Nief, C., et al. Polymer-assisted intratumoral delivery of ethanol: Preclinical investigation of safety and efficacy in a murine breast cancer model. PLoS One. 16 (1), 0234535 (2021).
- Chelales, E., et al. Radiologic-pathologic analysis of increased ethanol localization and ablative extent achieved by ethyl cellulose. Scientific Reports. 11 (1), 20700 (2021).
- Morhard, R., et al. Understanding factors governing distribution volume of ethyl cellulose-ethanol to optimize ablative therapy in the liver. IEEE Trans Biomedical Engineering. 67 (8), 2337-2348 (2020).
- Morhard, R., et al. Development of enhanced ethanol ablation as an alternative to surgery in treatment of superficial solid tumors. Scientific Reports. 7 (1), 8750 (2017).
- Russo, I. H., Russo, J. Developmental stage of the rat mammary gland as determinant of its susceptibility to 7,12-dimethylbenz[a]anthracene. Journal of the National Cancer Institute. 61 (6), 1439-1449 (1978).
- Paine, I. S., Lewis, M. T. The terminal end bud: The little engine that could. Journal of Mammary Gland Biology Neoplasia. 22 (2), 93-108 (2017).
- Hinck, L., Silberstein, G. B. Key stages in mammary gland development: the mammary end bud as a motile organ. Breast Cancer Research. 7 (6), 245-251 (2005).
- Sivaraman, L., et al. Effect of selective ablation of proliferating mammary epithelial cells on MNU induced rat mammary tumorigenesis. Breast Cancer Research Treatment. 73 (1), 75-83 (2002).
- Cardiff, R. D., Wellings, S. R. The comparative pathology of human and mouse mammary glands. Journal of Mammary Gland Biology Neoplasia. 4 (1), 105-122 (1999).
- Brock, A., et al. Silencing HoxA1 by intraductal injection of siRNA lipidoid nanoparticles prevents mammary tumor progression in mice. Scientific Translational Medicine. 6 (217), (2014).
- de Groot, J. S., et al. Intraductal cisplatin treatment in a BRCA-associated breast cancer mouse model attenuates tumor development but leads to systemic tumors in aged female mice. Oncotarget. 8 (37), 60750-60763 (2017).
- Wang, G., et al. Intraductal fulvestrant for therapy of ERalpha-positive Ductal Carcinoma in Situ (DCIS) of the breast - A preclinical study. Carcinogenesis. 40 (7), 907-913 (2019).
- Yoshida, T., et al. Effective treatment of ductal carcinoma in situ with a HER-2- targeted alpha-particle emitting radionuclide in a preclinical model of human breast cancer. Oncotarget. 7 (22), 33306-33315 (2016).
- Chun, Y. S., et al. Intraductally administered pegylated liposomal doxorubicin reduces mammary stem cell function in the mammary gland but in the long term, induces malignant tumors. Breast Cancer Research Treatment. 135 (1), 201-208 (2012).
- Markiewicz, E., et al. High resolution 3D MRI of mouse mammary glands with intra-ductal injection of contrast media. Magnetic Resonance Imaging. 33 (1), 161-165 (2015).
- Markiewicz, E., et al. MRI ductography of contrast agent distribution and leakage in normal mouse mammary ducts and ducts with in situ cancer. Magnetic Resonance Imaging. 40, 48-52 (2017).
- Annunziato, S., et al. Comparative oncogenomics identifies combinations of driver genes and drug targets in BRCA1-mutated breast cancer. Nature Communications. 10 (1), 397 (2019).
- Rutkowski, M. R., et al. Initiation of metastatic breast carcinoma by targeting of the ductal epithelium with adenovirus-cre: a novel transgenic mouse model of breast cancer. Journal of Visualized Experiments. (85), e51171 (2014).
- Xiang, D., Tao, L., Li, Z. Modeling breast cancer via an intraductal injection of cre-expressing adenovirus into the mouse mammary gland. Journal of Visualized Experiments. (148), e59502 (2019).
- Barham, W., Sherrill, T., Connelly, L., Blackwell, T. S., Yull, F. E. Intraductal injection of LPS as a mouse model of mastitis: signaling visualized via an NF-kappaB reporter transgenic. Journal of Visualized Experiments. (67), e4030 (2012).
- Chun, Y. S., et al. Intraductal administration of a polymeric nanoparticle formulation of curcumin (NanoCurc) significantly attenuates incidence of mammary tumors in a rodent chemical carcinogenesis model: Implications for breast cancer chemoprevention in at-risk populations. Carcinogenesis. 33 (11), 2242-2249 (2012).
- Stearns, V., et al. Preclinical and clinical evaluation of intraductally administered agents in early breast cancer. Science Translational Medicine. 3 (106), (2011).
- Okugawa, H., et al. Effect of perductal paclitaxel exposure on the development of MNU-induced mammary carcinoma in female S-D rats. Breast Cancer Research Treatment. 91 (1), 29-34 (2005).
- Falconer, I. R. The distribution of 131 I- or 125 I-labelled prolactin in rabbit mammary tissue after intravenous or intraductal injection. Journal of Endocrinology. 53 (3), 58-59 (1972).
- Fiddler, T. J., Birkinshaw, M., Falconer, I. R. Effects of intraductal prolactin on some aspects of the ultrastructure and biochemistry of mammary tissue in the pseudopregnant rabbit. Journal of Endocrinology. 49 (3), 459-469 (1971).
- Fiddler, T. J., Falconer, I. R. The effect of intraductal prolactin on protein and nucleic acid biosynthesis in the rabbit mammary gland. The Biochemical Journal. 115 (5), 58 (1969).
- Bourne, R. A., Bryant, J. A., Falconer, I. R. Stimulation of DNA synthesis by prolactin in rabbit mammary tissue. Journal of Cell Science. 14 (1), 105-111 (1974).
- Chadwick, A. Detection and assay of prolactin by the local lactogenic response in the rabbit. The Journal of Endocrinology. 27, 253-263 (1963).
- Mahoney, M. E., et al. Intraductal therapy of ductal carcinoma in situ: a presurgery study. Clinical Breast Cancer. 13 (4), 280-286 (2013).
- Love, S. M., et al. A feasibility study of the intraductal administration of chemotherapy. Cancer Preview Research (Phila). 6 (1), 51-58 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。