Method Article
Röntgenvisualisierung einer intraduktalen ethanolbasierten ablativen Behandlung zur Prävention von Brustkrebs in Rattenmodellen
In diesem Artikel
Zusammenfassung
Es wird ein Verfahren zur Abgabe einer chemischen ablativen Lösung an den Brustduktalbaum der Ratte zur bildgeführten präventiven Behandlung von Brustkrebs beschrieben. Brustepithelzellen können mit minimalen Kollateralgewebeschäden durch Kanülierung direkt in die Brustwarzenöffnung und intraduktale Infusion einer 70% Ethanol-basierten ablativen Lösung gezielt angegriffen werden.
Zusammenfassung
Es gibt immer noch eine begrenzte Anzahl von primären Interventionen zur Prävention von Brustkrebs. Für Frauen mit einem hohen Risiko, an Brustkrebs zu erkranken, ist die prophylaktische Mastektomie die effektivste Intervention. Dies ist ein drastischer chirurgischer Eingriff, bei dem die Brustepithelzellen, die Brustkrebs verursachen können, zusammen mit dem umgebenden Gewebe vollständig entfernt werden. Ziel dieses Protokolls ist es, die Machbarkeit eines minimalinvasiven intraduktalen Verfahrens zu demonstrieren, das zu einer neuen primären Intervention für die Brustkrebsprävention werden könnte. Dieses lokale Verfahren würde Brustepithelzellen bevorzugt abtragen, bevor sie bösartig werden können. Intraduktale Methoden, um Lösungen direkt an diese Epithelzellen in Nagetiermodellen von Brustkrebs zu liefern, wurden an der Michigan State University und anderswo entwickelt. Die Rattenbrustdrüse besteht aus einem einzigen duktalen Baum, der im Vergleich zur menschlichen Brust eine einfachere und linearere Architektur aufweist. Chemisch induzierte Rattenmodelle für Brustkrebs bieten jedoch wertvolle Werkzeuge für Proof-of-Concept-Studien zu neuen präventiven Interventionen und Skalierbarkeit von Mausmodellen auf den Menschen. Hier wird ein Verfahren zur intraduktalen Abgabe einer ethanolbasierten ablativen Lösung, die Tantaloxid-Nanopartikel als Röntgenkontrastmittel und Ethylcellulose als Geliermittel enthält, in den Milchduktalbaum der Ratte beschrieben. Die Abgabe von wässrigen Reagenzien (z. B. zytotoxische Verbindungen, siRNAs, AdCre) durch intraduktale Injektion wurde bereits in Maus- und Rattenmodellen beschrieben. Diese Protokollbeschreibung betont methodische Änderungen und Schritte, die sich ausschließlich auf die Bereitstellung einer ablativen Lösung, die Berücksichtigung der Formulierung zur Minimierung lokaler und systemischer Nebenwirkungen der ablativen Lösung und die Röntgenbildgebung zur In-vivo-Beurteilung der duktalen Baumfüllung beziehen. Durchleuchtungs- und Mikro-CT-Techniken ermöglichen es, den Erfolg der ablativen Lösungsabgabe und das Ausmaß der duktalen Baumfüllung dank der Kompatibilität mit dem tantalhaltigen Kontrastmittel zu bestimmen.
Einleitung
Für Frauen in den USA1 ist Brustkrebs (BC) nach wie vor die am häufigsten diagnostizierte Krebsart und verursacht mehr Todesfälle als jede andere Krebsart außer Lungenkrebs. Prognosen für 2022 schätzen, dass 51.400 Frauen mit Karzinom in situ diagnostiziert werden und 287.850 Frauen mit invasivem Karzinom diagnostiziert werden, und dass 43.600 Frauen an BC1 sterben werden. Trotz der Prävalenz und Mortalität im Zusammenhang mit BC gibt es nur wenige Optionen für die Primärprävention und translationale Forschung zu neuartigen Interventionen, da die Primärprävention von den Bundesbehörden nicht priorisiert wird2. Die prophylaktische Mastektomie ist die wirksamste Maßnahme zur Primärprävention. Dieses Verfahren wird jedoch nur für Personen mit hohem Risiko empfohlen, da es sich um eine große Operation mit lebensverändernden Folgen handelt3. Diese Operation beinhaltet die vollständige Entfernung der Brustepithelzellen, aus denen sich die Karzinogenese entwickelt, sowie des normalen umgebenden Gewebes. Einzelpersonen werden oft davon abgehalten, dieses Verfahren als erste Option der primären Intervention aufgrund der negativen Auswirkungen von körperlichem, psychischem und sozialem Stress zu verwenden. Aus diesen Gründen entscheiden sich sogar einige Personen mit hohem Risiko dafür, sich diesem Verfahren nicht zu unterziehen und stattdessen wachsames Warten oder ähnliche Überwachungsstrategien zu wählen3. In früheren Veröffentlichungen war die Abgabe von 70% Ethanol (EtOH) direkt in den duktalen Baum von Mausmodellen wirksam bei der chemischen Ablation von Brustepithelzellen mit begrenzter Schädigung des angrenzenden normalen Gewebes und bei der Verhinderung der Brusttumorbildung4. EtOH wird in mehreren klinischen Anwendungen entweder als Ablativ zur lokalen Behandlung einiger Krebsarten oder als Sklerosierungsmittel zur lokalen Behandlung von arteriovenösen Schwellungen und Fehlbildungen verwendet 5,6,7,8,9,10,11,12,13,14 . Das niedrige Toxizitäts- und Sicherheitsprofil von EtOH ist gut belegt, da bei einigen Verfahren bis zu 50 ml 95% EtOH pro Sitzung 5,10 verabreicht werden können.
Die vollständige Entfernung von Brustepithelzellen, aus denen sich BC entwickelt, ist die wichtigste Komponente sowohl der prophylaktischen Mastektomie als auch der lokalen Verabreichung einer ablativen Lösung. Daher ist eine Bestätigung der vollständigen duktalen Baumfüllung notwendig, um sicherzustellen, dass die ablative Lösung in direkten Kontakt mit allen Brustepithelzellen gekommen ist. Die Bereitstellung einer Lösung innerhalb des/der duktalen Baumes/e und deren Visualisierung durch bildgeführte Durchleuchtung oder Duktographie sind durch klinische Verfahren möglich, die bereits existieren15,16,17. Somit wird es möglich sein, dieses Verfahren problemlos in klinischen Studien zu implementieren und zu evaluieren. Ein wichtiger Schritt zur Etablierung der Wirksamkeit und translationalen Machbarkeit der intraduktalen (ID) Ablation als neue Intervention für die Primärprävention wird darin bestehen, die Machbarkeit dieses Röntgenvisualisierungsansatzes in Tiermodellen zunehmender Größe und Komplexität ihrer duktalen Baumarchitektur zu demonstrieren 4,18,19. Ein Protokoll, das dieses ablative Verfahren von Maus20 auf Rattenmodelle hochskaliert, wird hier beschrieben. Während Maus- und Rattenduktbäume eine ähnliche lineare Struktur und Verzweigungsmuster aufweisen, ist der Rattenduktalbaum proportional größer und von einem viel dichteren Stroma umgeben. Wir haben eine Methode im Labor implementiert, um jede Brustdrüse einer Ratte über eine Reihe von wöchentlichen Sitzungen erfolgreich mit einer ablativen Lösung zu injizieren, die ein Kontrastmittel enthält. Der Sitzungsabstand ist notwendig, um sicherzustellen, dass die Tiere minimale Nebenwirkungen von EtOH haben (Abbildung 1 und Abbildung 2). Das Verfahren beinhaltet die Injektion der ablativen Lösung direkt in die Brustwarzenöffnung einer isofluran-anästhesierten Ratte mit einer 33 G-Nadel. Einige wichtige Verbesserungen des Verfahrens umfassen die Verwendung einer erweiterten entzündungshemmenden Behandlung, die Injektion höherer Volumina pro duktalem Baum als vorgeschlagen21 und gasdichte Spritzen für Flüssigkeiten und Gase. Die Behandlungsdauer mit 5 mg/kg Carprofen (ein NSAID) von 48 h vor bis 1 Woche nach ID-Injektionen ist vergleichbar mit dem entzündungshemmenden Protokoll, das für die sklerosierende Therapie venöser Fehlbildungen in der Klinik verwendet wird. Die Behandlung wird bei Patienten unter systemischer Anästhesie durchgeführt, gefolgt von 2 Tagen entzündungshemmender Medikamente wie NSAIDs. Die entzündungshemmende Behandlung kann um einige weitere Tage verlängert werden, um lokale Entzündungen und mögliche Schmerzen zu reduzieren13. Wie bei Mäusen20 mildert die intraperitoneale Injektion einer 5%igen Saccharoselösung die kurzfristige Wirkung einer Alkoholintoxikation bei Ratten. Ratten können bis zu 1 ml 70% EtOH (bis zu 4 Kanäle; 0,2 g / dl EtOH-Gehalt im Blut) in einer einzigen Sitzung injiziert werden, wenn sie mit dieser Saccharoselösung verabreicht werden; Die Tiere erholen sich innerhalb von 4 Stunden nach ID-Injektionen vollständig. Wir führen sequentielle Sitzungen durch, um genügend Erholungszeit zu haben, wenn mehr als 4 Drüsen und / oder höhere EtOH-Konzentrationen injiziert werden. Eine Alkoholintoxikation bei Frauen ist viel unwahrscheinlicher, da die ID-Injektion aller duktalen Bäume in beide Brüste unter der Annahme von 16 Hauptkanälen16,17 und 2 ml pro Duct22,23 mit 70% EtOH zu weniger als 0,1 g / dl EtOH-Gehalt im Blut führen würde und eine leichte Beeinträchtigung verursachen kann.
Mit der Röntgenbildgebung lässt sich feststellen, wie erfolgreich die intraduktale Verabreichung in jeder einzelnen Drüse ist und ob der gesamte duktale Baum gefüllt ist (Abbildung 1, Abbildung 2, Abbildung 3). Echtzeit-Fluoroskopie-Bildgebung in Vorbereitung auf Mikro-CT-Scan und/oder 3D-Rekonstruktion von DICOM-Dateidaten kann verwendet werden, um das Ausmaß der Lösungsabgabe in den duktalen Baum und jede Leckage in das Stroma zu beurteilen. Die Verwendung der Durchleuchtung kann dazu beitragen, die Gesamtstrahlendosis des Tieres zu begrenzen. Die Durchleuchtungstechnik kommt der beabsichtigten klinischen Anwendung zur Bildführung dieser ablativen Behandlung näher. Der Vergleich von von der FDA zugelassenen jodhaltigen Isovue mit Tantaloxid (TaOx) Nanopartikeln wurde durchgeführt, um den Nutzen der ablativen Lösung 4,19 weiter zu verfeinern. Es wurde festgestellt, dassTaOx ein überlegenes Mikro-CT-Kontrastmittel als Isovue zur Visualisierung der anfänglichen Füllung des duktalen Baumes in Mäusen 4,19 ist. Hier zeigen wir, dass TaOx ein geeignetes Kontrastmittel ist, um die anfängliche Füllung des Rattenduktalbaums sichtbar zu machen (Abbildung 2 und Abbildung 3). Sowohl in der translationalen Forschung als auch in der klinischen Praxis wurde der EtOH-Lösung das Gelbildner Ethylcellulose (EC) zugesetzt, um die Diffusion aus den beabsichtigten Zielregionen 13,14,24,25,26,27,28,29 zu minimieren. Studien haben gezeigt, dass die Zugabe von bis zu 1,5% EC zu EtOH-haltigen ablativen Lösungen mit TaO-x-basierter Bildgebung kompatibel ist (Abbildung 3). Diese und weitere Verfeinerungen der ablativen Lösung können dazu beitragen, dieses bildgeführte Verfahren in die Klinik zu übersetzen.
Protokoll
Alle beschriebenen Experimente wurden nach Protokollen durchgeführt, die vom Institutional Animal Care and Use Committee der Michigan State University genehmigt wurden.
1. Erweiterte entzündungshemmende Behandlung
- Bereiten Sie Sucralose-Gelbecher als orale Dosierung von Carprofen vor. Verabreichen Sie Ratten diese entzündungshemmende Behandlung von 2 Tagen vor der ID-Injektion von 70% EtOH bis 7 Tage nach dem Eingriff.
- Verdünnen Sie eine Arbeitslösung von Carprofen in sterilem PBS zur Injektion in den Becher. Bereiten Sie aus 50 mg/ml Stammlösung eine verdünnte 2 mg/ml Lösung vor, die mit 1% v/v sterilem blauem Lebensmittelfarbstoff gefärbt ist, und injizieren Sie 500 μL in jede Tasse. Die Zugabe des Farbstoffs hilft bei der Visualisierung der vollständigen Vermischung des Arzneimittels innerhalb der Sucralose des Bechers.
- Befolgen Sie die Empfehlung des Herstellers, um den Becher für die Zugabe von Carprofen vorzubereiten. Sofern vom Verkäufer nicht anders angegeben, erwärmen Sie den Becher 15 min in einem Wasserbad bei 60 °C und trocknen Sie ihn nach dem Entfernen ab, um das Kontaminationsrisiko zu verringern.
- Wischen Sie den Deckel des Sucralose-Bechers mit 70% EtOH in den Bereich und führen Sie die Nadel der Spritze mit der Carprofen-Arbeitslösung ein. Geben Sie das entsprechende Volumen (500 μL) ab.
- Decken Sie den Einstich mit einem Aufkleber ab. Schütteln Sie die Tasse energisch für 15 s und legen Sie diese Tasse dann für weitere 15 s in einen Strudel. Beurteilen Sie die homogene und vollständige Mischung visuell, bevor Sie sie für die spätere Verwendung einlagern. Suchen Sie nach dem Vorhandensein einer dunkelblauen Farbe.
HINWEIS: Lassen Sie die Tassen auf Raumtemperatur kommen. Lagern Sie die Becher bei Raumtemperatur, wenn gewünscht, aber achten Sie auf die Richtlinien des Herstellers zur Wirksamkeit des Arzneimittels. Alternativ lagern Sie die Becher bei 4 °C und verbrauchen sie innerhalb eines Monats. Die Datierung des Aufklebers ist eine gute Praxis, um das Injektionsdatum zu verfolgen, ohne dass das Risiko besteht, dass ein Stift oder ein scharfer Marker den Deckel durchsticht.
- Wischen Sie kurz vor Gebrauch die Außenseite des Bechers mit 70% EtOH ab. Entfernen Sie den Deckel, bevor Sie den Becher in den Tierkäfig stellen. Ersetzen Sie die Tassen jeden zweiten Tag oder wenn sie leer sind. Überprüfen Sie den Gelspiegel täglich, um eine angemessene Dosierung sicherzustellen. Eine Tasse kann Carprofen für bis zu zwei Ratten für bis zu 2 Tage liefern; Ratten können jedoch die ganze Tasse früher verzehren.
2. Präoperative Vorbereitung
HINWEIS: Stellen Sie sicher, dass der Schritt der Tierzubereitung dem ID-Injektionsverfahren um 2-3 Tage vorausgeht.
- Schalten Sie den Isofluran-Vaporizer (2%-3% Isofluran, 1,5 l/min Sauerstoff) ein, um die Ratte zu betäuben. Bewegen Sie das Tier zu einem Nasenkegel auf einem Wärmekissen. Tragen Sie Augengleitmittel auf die Ratte auf und positionieren Sie das Tier dann auf dem Rücken. Überwachen Sie sorgfältig die Atmung des Tieres, um sicherzustellen, dass die Anästhesieebene bei 1% -3% des Isoflurans gehalten wird.
HINWEIS: Ein Elektrorasierer kann verwendet werden, um überschüssiges Fell vor der Enthaarung zu entfernen. Es muss äußerst darauf geachtet werden, dass keine Brustwarzen mit dem Rasierer beschädigt werden. Aus diesem Grund kann dieser Schritt übersprungen werden. Ratten reagieren empfindlicher auf Enthaarungscreme als Mäuse, daher ist die Entfernung von überschüssiger Creme sehr wichtig. Vermeiden Sie es, eine ethanolhaltige Lösung in einen Bereich zu injizieren, in dem bereits ein Abrieb durch Enthaarung vorhanden ist. Einige Cremes haben Verbindungen wie Aloe und Lanolin hinzugefügt, die helfen können, die Wahrscheinlichkeit von Abschürfungen zu minimieren. - Verwenden Sie einen Baumwollapplikator, um die rezeptfreie Enthaarungscreme auf den Brustwarzenbereich zu verteilen. Verwenden Sie den Applikator, um die Creme für 10-30 s in den Bereich zu reiben. Überprüfen Sie, ob sich das Fell schnell gelockert hat.
- Lassen Sie die Creme so kurz wie möglich auf der Ratte und entfernen Sie sie vollständig, um ein Verbrennen der Haut zu vermeiden. Ratten reagieren noch empfindlicher auf dieses Verfahren als Mäuse.
- Nach 10-30 s Anwendung Gaze mit warmem Wasser befeuchten und damit die Creme und das gelöste Fell vom Tier abspülen. Führen Sie mindestens drei Spülungen des Bereichs mit frisch angefeuchteter Gaze durch und trocknen Sie ihn nach der letzten Spülung mit trockener Gaze. Bestätigen Sie gute Sicht und Zugang zu dem Bereich der Brustwarze, von dem das Fell entfernt wird. Wiederholen Sie den Enthaarungsvorgang, falls erforderlich.
- Legen Sie die Ratte in einen sauberen Käfig auf einem Heizkissen und lassen Sie sie sich erholen. Überprüfen Sie die Ratte, um sicherzustellen, dass sie vollständig von der Narkose erholt ist, bevor Sie sie in ihren permanenten Käfig zurückbringen.
- Legen Sie einen Carprofen-dosierten (1 mg / Tasse) Sucralose-Gelbecher zur entzündungshemmenden Behandlung in den Käfig. Überprüfen Sie den Gelverbrauch täglich und ersetzen Sie ihn gegebenenfalls durch eine frische Tasse. Lassen Sie die Tasse nicht länger als 2 Tage stehen. In der Regel müssen Tassen nach 1 Tag ausgetauscht werden.
3. Intraduktale Injektion
- DieTaO-x-Stammlösung wird bei 333,3 mM wie19 beschrieben unter Verwendung steriler phosphatgepufferter Kochsalzlösung (PBS) hergestellt. Erwärmen Sie die Lösung, wenn sich das Pulver nicht vollständig auflöst. Vorsichtig umrühren. Wirbeln oder schütteln Sie nicht kräftig, um Blasenbildung zu vermeiden.
- Mischen Sie drei Teile 333,3 mM TaO x mit sieben Teilen 100% EtOH für eine endgültige 70% EtOH 100 mM/TaOx Lösung. Gegebenenfalls wird eine geeignete Menge von 0,5%-1,5% Ethylcellulose (EC) als Geliermittel hinzugefügt, um die lokale Retention der ablativen Lösung zu maximieren. Fügen Sie der ablativen Lösung 1% v/v blauen Lebensmittelfarbstoff hinzu, um die Abgabe in den duktalen Baum während der Infusion visuell zu untersuchen.
- Bereiten Sie ein Volume vor, das für die experimentellen Anforderungen geeignet ist. Die Drüsenpaare 1 (zervikal) und 6 (inguinal) können mit bis zu 100 μL der Lösung gefüllt werden, während alle anderen Paare mit bis zu 300 μL gefüllt werden können.
- Betäuben Sie die Ratte wie in Schritt 2.1 und bewegen Sie die Ratte nach vollständiger Betäubung zum Nasenkegel. Tragen Sie Augengleitmittel auf beide Augen auf und legen Sie das Tier dann auf den Rücken. Befestigen Sie die Ratte unter dem Stereoskop mit Klebeband in der Nähe der Brustwarzen, die auf Wunsch injiziert werden. Das Gewicht der Ratte reicht im Allgemeinen aus, um zu verhindern, dass sie sich ohne Taping wesentlich bewegt.
- Um die Brustwarzen für die Injektion vorzubereiten, entfernen Sie, wenn möglich, die abgestorbene Haut, die die Brustwarzenöffnung bedeckt, mit einer feinen spitzen Pinzette. Ratten haben oft einen Pfropfen, der aus der Brustwarzenöffnung herausragt, der eine erfolgreiche Kanülierung der Brustwarze verhindern kann, wenn er nicht entfernt wird.
HINWEIS: Es ist wichtig zu beachten, dass größere Injektionsvolumina von ablativen Lösungen, die bei Ratten verwendet werden, eher zu oberflächlichen Hautwunden in der Nähe der Injektionsstelle(n) führen können. Aus diesem Grund ist die Injektion jeder zweiten Brustwarze in einer einzigen Sitzung weniger schädlich und irritierend für das Tier als die Injektion benachbarter Brustwarzen. Die Überwachung der Ratten auf Abschürfungen für 7 Tage nach der Injektion hilft, sicherzustellen, dass keine ernsthaften gesundheitlichen Auswirkungen durch das Kratzen des Tieres und die Möglichkeit einer Infektion durch Kontamination mit Käfigbodenschutt entstehen. Dreifache antibiotische Salbe oder Waschungen mit Chlorhexidinlösung können verwendet werden, um Anzeichen einer Verletzungsinfektion zu behandeln, die auftreten können (Tabelle 1). - Verwenden Sie eine 500-μL-Spritze mit einer 33-G-Nadel, um 101-301 μL ablative Lösung abzusaugen. Saugen Sie ein zusätzliches 1 μL der Lösung für mögliche geringfügige Leckagen ab, wenn Sie die Kanülennadel entfernen.
HINWEIS: Dies sind Empfehlungen für Volumina, die darauf abzielen, den duktalen Baum (die duktalen Bäume) vollständig zu füllen: bis zu 100 μL in den Hals- und Leistendrüsen und bis zu 300 μL in den anderen Drüsen. Für andere Anwendungen kann es sinnvoll sein, kleinere oder größere Volumina zu verwenden. - Verwenden Sie eine Pinzette, um die Brustwarze vorsichtig zu halten und die Nadel in die Nippelöffnung zu kannulieren. Führen Sie die Nadel vorsichtig weiter ein, bis sich die Fase vollständig im Inneren des Nippels befindet. Um die Nadel in der Brustwarze unterzubringen, bringen Sie die Brustwarze in Richtung Nadel, anstatt die Nadel in die Brustwarze zu drücken. (Tabelle 1). Achten Sie darauf, dem Weg der Brustwarzenöffnung zu folgen.
HINWEIS: Rattennippel sind aufgrund der größeren Größe im Allgemeinen viel einfacher zu manipulieren und zu kanülieren als die bei Mäusen. Die erhöhte Menge an Fett, die die Brustwarzenöffnung umgibt, macht es jedoch auch wahrscheinlicher, dass das Fettpolster versehentlich injiziert wird, wenn die Nadel vom Hauptkanal abweicht. - Sobald die Nadelfase vollständig eingeführt ist, wird die Lösung langsam mit einer konstanten Rate von etwa 100 μL/min bei Ratten infundiert. Abrupte Änderungen der Infusionsgeschwindigkeit können platzen oder den duktalen Baum beschädigen. Warten Sie 30 s nach dem Ende der Infusion, bevor Sie die Nadel mit Hilfe einer Pinzette vom kanülierten Baum entfernen. Dadurch wird sichergestellt, dass das injizierte Volumen im duktalen Baum verbleibt (Abbildung 2) und die Wahrscheinlichkeit einer Leckage verringert.
- Reinigen Sie verschüttete Lösung mit angefeuchteter Gaze oder einem EtOH-Tuch, um überflüssige Kontrastlösung in den Bildern zu vermeiden.
- Injizieren Sie PBS mit 5% Saccharose (10 ml/kg) intraperitoneal, um die Auswirkungen einer Alkoholintoxikation zu mildern, wenn Ethanol in den ID-Injektionslösungen enthalten ist. Diese Dosis kann zu Beginn und am Ende des Verfahrens verabreicht werden.
4. Mikro-CT-Bildgebung
- Nachdem alle gewünschten Drüsen injiziert wurden, bewegen Sie das Tier schnell in das Mikro-CT-System und setzen Sie die Anästhesie mit dem eingebauten Isofluran-Vaporizer fort.
- Begradigen Sie die Wirbelsäule des Tieres und kleben Sie jedes Hinterbein in einer verlängerten Position, so dass die Beinknochen des Tieres weiter von den unteren Drüsen von Interesse entfernt sind und sich nicht mit dem interessierenden Bereich im gescannten Bild überlappen.
- Kleben Sie über den Bauch, um Atemartefakte zu minimieren, wenn Sie die unteren Drüsen scannen.
HINWEIS: Tiere können mit verschiedenen Scanparametern (z. B. hohe Auflösung, Längsschnittscans) abgebildet werden, wenn darauf geachtet wird, eine geeignete akzeptable Lebenszeitdosis der Strahlung für Ratten zu bestimmen und sicherzustellen, dass die kumulative Dosis diesen Wert nicht überschreitet. Die Strahlenbelastung kann weiter reduziert werden, indem Fluoroskopie-Standbilder und Videos ohne Scans erfasst werden (Abbildung 2). - Führen Sie eineTaO-x-Bildgebung des duktalen Baums der Ratte mit guter Auflösung und Möglichkeit für wiederholte Standard-Erfassungsscans (2 Minuten) mit den folgenden Scanparametern durch: 90 kVp/88 μA; Sichtfeld (FOV), 72 mm; Anzahl der Scheiben, 512; Schichtdicke, 72 μm; Voxelauflösung, 72 μm3. Hochauflösende Scans für längere Zeiträume (4-14 min) können auch bei Tieren aufgenommen werden, die nicht longitudinal mit den gleichen Parametern gescannt werden.
- Nehmen Sie die Ratte nach der Datenerfassung vorsichtig vom Anästhesiekegel weg und legen Sie sie in einen neuen sauberen Käfig auf einem Heizkissen. Überprüfen Sie die Ratte, um sicherzustellen, dass sie sich vollständig von der Anästhesie erholt hat, bevor Sie sie in ihren permanenten Käfig zurückbringen. Stellen Sie den Carprofen-haltigen Sucralose-Becher auf und ersetzen Sie ihn entsprechend wie in Schritt 2.5 beschrieben, um sicherzustellen, dass die Tiere in den nächsten 7 Tagen weiterhin entzündungshemmend behandelt werden.
- Verarbeiten Sie die gescannten Bilder zu schnellen Wiedergaben innerhalb der Mikro-CT-Software, um Kontrastlecks, nur teilweise Füllungen oder Überfüllungen besser zu erkennen (Abbildung 2).
- Fahren Sie mit dem nächsten Abschnitt fort, um eine formale Bildverarbeitung für die Veröffentlichung oder detaillierte Analyse von Scans durchzuführen, falls gewünscht (Abbildung 3).
5. Bildanalyse
- Verwenden Sie spezielle Softwarepakete, um Renderings des gefüllten duktalen Baums zu erstellen.
HINWEIS: Es ist am besten, das Brustfettpolster zu segmentieren, um die beste Wiedergabe des injizierten duktalen Baumes zu erhalten. Spline verfolgen die dunklen Grenzen des Fettpolsters über die gesamte Dicke des Tieres, um diese Segmentierung zu erreichen. - Um das Fettpolster zu segmentieren (im Gegensatz zu Mäusen sind die Grenzen dieses Kompartiments aufgrund ähnlicher Hounsfield-Einheiten nicht so leicht von der Peritonealhöhle, den Oberschenkelmuskeln und der Haut zu unterscheiden), in dem sich der duktale Baum von Interesse befindet, ist die Auswahl der Option "Spline-Spur" aus dem manuellen Menü der erste Schritt zum Erstellen eines Renderings.
- Spline zeichnet den Fettpolsterumriss in jeder dritten Scheibe nach. Klicken Sie im halbautomatischen Menü auf die Option Objekte propagieren . Dadurch werden alle Segmente zu einem einzigen segmentierten Objekt von Interesse weitergegeben und verbunden.
HINWEIS: Das Ändern des Schwellenwerts innerhalb des segmentierten Bereichs ermöglicht die Visualisierung des Signals nur innerhalb eines bestimmten Bereichs von Hounsfield-Einheiten (HU); Für andere Kontrastmittel oder Bildgebungsparameter muss dieser Bereich möglicherweise angepasst werden. Ein Softwarepaket oder eine Analyse der künstlichen Intelligenz kann verwendet werden, um andere Messungen und Bilder durchzuführen, um zu zeigen, wie stark der duktale Baum gefüllt wurde. - Stellen Sie die HU-Werte im halbautomatischen Menü unter der Registerkarte Schwellenwertlautstärke auf einen niedrigen Punkt von 300 und einen hohen Punkt von 3.000 ein. Dies ermöglicht die Erstellung einer Formatvariante, die nur den Kontrast (TaOx) innerhalb des duktalen Baums anzeigt.
- Legen Sie die Formatvariante über die Schaltfläche "Ansicht" als primär fest. Dadurch wird die Anzeige so geändert, dass nur die 3D-Darstellung des duktalen Baums angezeigt wird.
HINWEIS: Führen Sie eine Rekonstruktion des duktalen Baumes zur weiteren Analyse durch.
Ergebnisse
Jede der 12 Brustdrüsen einer weiblichen Ratte enthält einen einzelnen duktalen Baum, der sich an der Brustwarzenöffnung öffnet. Trotz der Größenunterschiede zwischen Maus und Ratte ist der Entwicklungszeitpunkt der Brustdrüsen und die Zeit, in der diese Tiere das Erwachsenenalter erreichen, sehr ähnlich30,31. Eine kurze Beschreibung der wichtigsten Stadien der Brustdrüsenentwicklung bei Ratten als repräsentativ für beide Nagetierarten wird gegeben. Endknospen (TEBs) sind die stark proliferativen Strukturen an den Spitzen des länglichen duktalen Baumes, die die duktale Verzweigung30,31 steuern. Der Höhepunkt der Proliferation und Dichte der TEBs tritt im Alter von 3-4 Wochen während der Dehnungsphase des duktalen Baumes in der Pubertätsentwicklungauf 30. Im Alter von 9-10 Wochen sind nur noch wenige TEBs übrig, da der duktale Baum gewachsen ist, um die gesamte Länge des Fettpolsters30 einzunehmen. Danach ist das Wachstum und die Ausdehnung des duktalen Baumes proportional zu dem des Fettpolsters und des Tieres32. Terminale duktale lobuläre Einheiten (TDLUs) in der menschlichen Brust spielen eine ähnliche Rolle wie die TEBs bei Nagetieren. TDLUs sind die Hauptquelle für die Einleitung der Karzinogenese und des Fortschreitens bis33,34 v. Chr. Wir können bis zu 300 μL 70% ige EtOH-Lösung injizieren, um den gesamten duktalen Baum der Brust- und Bauchdrüsen der 9 Wochen alten Sprague-Dawley-Ratte zu füllen (Abbildung 1, Abbildung 2, Abbildung 3). Im Gegensatz zu Mäusen 20 sind die Brustwarzen der Gebärmutterhals- und Leistendrüsen der Sprague-Dawley-Ratten typischerweise für die Injektion bei mehr als 80% der Tiere geeignet, und bis zu 100 μL70% EtOH-Lösung sind erforderlich, um den gesamten duktalen Baum zu füllen (Abbildung 2). Wir injizieren routinemäßig bis zu 10 Brustdrüsen mit der untersuchten ablativen Lösung. Ein typisches experimentelles Design besteht aus zwei unabhängigen wöchentlichen ID-Injektionssitzungen, bei denen fünf alternierende Drüsen mit der ablativen Lösung infundiert werden, die Röntgenkontrastmittel und/oder EC als Gelbildner enthält (Abbildung 2). FürTaO-haltige (50-200 mM) ablative Lösung wird nach dem Ende jeder Sitzung eine Durchleuchtung und/oder Mikro-CT-Untersuchung durchgeführt, um den individuellen Erfolg der Infusion jedes duktalen Baumes mit einer teilweisen oder vollständigen Menge infundierter Lösung zu bestimmen und aufzuzeichnen (Abbildung 2). Die sofortige und longitudinale Bildgebung nach der Injektion ermöglicht die Beurteilung, wie Veränderungen in der Formulierung, insbesondere die Konzentration des EC-Geliermittels, die Ausbreitung der ablativen Lösung in Abhängigkeit vom injizierten Volumen beeinflussen und begrenzen (Abbildung 3). Diese bildgebende Analyse liefert Informationen, um die optimalen Parameter zu verstehen, um eine maximale Ablation bei minimalen Kollateralschäden des Gewebes zu erreichen.
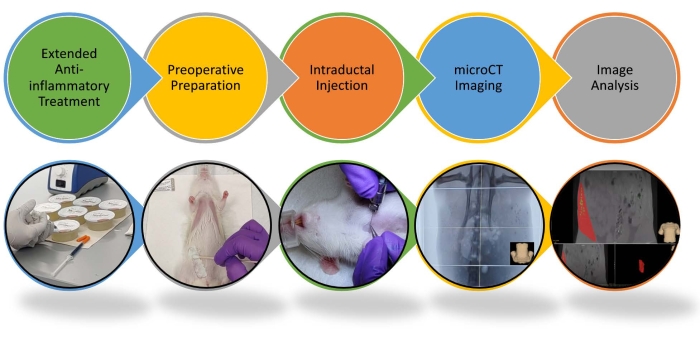
Abbildung 1: Schematische Darstellung des Verfahrens zur intraduktalen Injektion und Bildanalyse bei Ratten. Das Schritt-für-Schritt-Verfahren zur intraduktalen Injektion und Bildanalyse wird beleuchtet. Weitere Informationen finden Sie im Video. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Beispiele für die Brustwarzenkanülierung und das Abgabeergebnis der ablativen Lösung in mehrere Brustdrüsen . (A) Typische Darstellung von Brustwarzenformen im Sprague-Dawley-Rattenstamm. Die Brustwarzenlänge korreliert mit der Wahrscheinlichkeit einer erfolgreichen Kanülierung. Längere Brustwarzen sind leichter zu kanülieren als kurze Brustwarzen, während übermäßig kurze oder verkümmerte Brustwarzen nicht kanüliert werden können. Nach der Kanülierung können sowohl lange als auch kurze Brustwarzen mit der Lösung infundiert werden und ähnliche Erfolgsraten bei der Abgabe erzielen. Blauer Lebensmittelfarbstoff in der injizierten Lösung kann als In-vivo-Nachweis für duktale Baumfüllung und Liefererfolg verwendet werden (am offensichtlichsten, Dombildung, für eine erfolglose Fettpolsterinjektion). Echtzeit-Fluoroskopie (B) und 3D-Mikro-CT-Wiedergaben, die nach der Bildaufnahme (C) generiert werden, liefern In-vivo-Beweise für den Liefererfolg und eine quantitativere Bewertung der Lösung, die die TEBs erreicht. (B) Jede abdominale Brustdrüse des ersten Paares (#4, #10) erhielt ablative Lösung mit 1% EC (orangefarbener Umriss) oder ohne EC (grüner Umriss) (C) Erfolgreiche Verabreichung (blauer Umriss) der ablativen Lösung im rechten Gebärmutterhals-, zweiten Paar Thorax- (#3, #9) und erstes Paar abdominaler (#4, #10) Brustdrüsen und erfolglose Injektion (gestrichelter weißer Umriss) in die linke Brustdrüse . Maßstabsbalken entsprechen 1 mm in den Bildern bei unterschiedlicher Vergrößerung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: 3D-Rekonstruktion und Bewertung der ablativen Lösungsfüllung und -diffusion . 70% EtOH/100 mM TaOx Nanopartikel mit 1% EC (oben) oder ohne EC (unten) wurden intraduktal in das zweite Bauchdrüsenpaar (#4 und #10) injiziert und sofort mittels Mikro-CT abgebildet. Jede Sprague-Dawley-Ratte erhielt ein zunehmendes Volumen beider Lösungen. Einzelne duktale Bäume wurden mit Hilfe einer Bildanalyse-Software (Spline-Trace + propagate object + threshold rendition) rekonstruiert. Mit 1% EC ist zu sehen, wie die Lösung die Klemmenenden erreicht. Wenn das gelieferte Volumen erhöht wird, wird die Anzahl der gefüllten TEBs deutlicher. Der Maßstabsbalken entspricht in allen Formatvarianten 10 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Ausstellen | Aussehen | Lösung | |||
| Kurze Brustwarze (Abb. 2) | Nippel hat ein niedriges Profil – schwer zu greifen | Es ist manchmal einfacher, die Haut in der Nähe der Brustwarze zu halten und mit der Nadel auf die Mitte der Brustwarze zu zielen. Die Nadel wird wahrscheinlich unter die Haut tauchen. Wenn Sie langsam nach oben ziehen, kann sich die Brustwarze leicht über der Nadelspitze befinden und Platz geben, um sie zu greifen und den Rest des Weges auf die Nadel zu ziehen. Seien Sie sehr vorsichtig, wenn Sie unter die Haut über den Winkel der Nadel tauchen. Es ist leicht, versehentlich eine Fettpolsterinjektion zu erhalten, indem man im falschen Winkel sticht. | |||
| Fettpolster-Injektion (Abb. 2) | Geschwollen um die Brustwarze und möglicherweise in der Brustwarze selbst - am einfachsten zu sehen, ob der Injektionslösung Farbe hinzugefügt wird | Wenn die Brustwarze mit den ersten ul injiziert anschwillt, entfernen Sie die Nadel und versuchen Sie, sie mit mehr Sorgfalt im Winkel erneut einzuführen. Beginnen Sie erneut mit der Injektion und achten Sie auf weitere Schwellungen. Wenn die Schwellung anhält, brechen Sie den Versuch ab. Es ist sehr selten, eine Brustwarze, die als Fettpolsterinjektion begonnen hat, erfolgreich zu injizieren. | |||
| Wunden/Schorf | Offene Wunde oder Schorf in der Nähe der Injektionsstelle der EtOH-Lösung | Ratten entwickeln häufiger als Mäuse Wunden oder Schorf in der Nähe des Injektionsbereichs. Wenn Wunden gefunden werden, tragen Sie eine dreifache antibiotische Salbe auf offene Wunden auf, aber lassen Sie die schorfigen Wunden in Ruhe. Das Auftragen von Salbe auf Schorf kann die Wahrscheinlichkeit erhöhen, dass das Tier den Schorf stört und entfernt. Überprüfen Sie alle 1-2 Tage, bis sie je nach Schwere der Wunde verheilt sind. Carprofen sollte bis zur Heilung verabreicht werden, auch wenn es über das normale Fenster hinausgeht. | |||
| Alternierende Drüsen injizieren | N/A | Größere Injektionsvolumina bei Ratten machen es wahrscheinlicher, Hautabschürfungen zu verursachen, wenn aufeinanderfolgende Drüsen injiziert werden. Für die geringste Wahrscheinlichkeit eines Traumas in den Injektionsbereich werden alternative Drüsen innerhalb einer einzigen Sitzung injiziert (dh # 1, 3, 4 und 6 anstelle von # 1-4). Der Abstand zwischen dritten (#3 und #9) und vierten (#4 und #10) Drüsenpaaren ermöglicht die Injektion dieser beiden Drüsen in einer Sitzung. | |||
Tabelle 1: Hilfreiche Tipps und Fehlerbehebung
Diskussion
Wie hier gezeigt, abträgt die ID-Abgabe von 70% EtOH bevorzugt die Brustepithelzellen mit begrenzten Kollateralschäden am umgebenden Stroma und Gefäßsystem bei Mäusenab 4. Die lokale Ablation des duktalen Baumes verhindert wirksam die Tumorbildung inMausmodellen 4. Hier zeigen wir, dass dieses ablative Verfahren auf Ratten skaliert werden kann.
Dies ist der nächste Schritt auf dem Weg zur Translation dieses ablativen Verfahrens als alternative Intervention zur prophylaktischen Mastektomie zur Primärprävention von Brustkrebs bei Hochrisikopersonen. Die Zugabe von TaO-x-Nanopartikeln als Röntgenkontrastmittel zur ablativen Lösung ermöglicht es, die Wirksamkeit der Lösung bei der Verhinderung der Tumorbildung zu beurteilen, da festgestellt werden kann, ob das Verfahren erfolgreich war oder nicht, um den duktalen Baum vollständig zu füllen. Die Verwendung der Durchleuchtung zur Visualisierung der injizierten Brustdrüse spiegelt wider, was wahrscheinlich in der Klinik getan wird, um dieses ID-Verfahren zu steuern. Eine Bildanleitung, wie stark die Lösung den duktalen Baum gefüllt hat und wann die Infusion abgebrochen werden muss, wird ein Schlüsselaspekt der klinischen Implementierung sein, um eine maximale Füllung jedes duktalen Baumes sicherzustellen. Problembehandlungen und hilfreiche Tipps sind in Tabelle 1 aufgeführt. Die Wirksamkeit dieses ablativen Verfahrens erfordert, dass die infundierte Lösung direkten Kontakt mit allen Epithelzellen aufnimmt, um die Zellabtötungsrate zu maximieren. Ersatzepithelzellen in einem oder mehreren Bäumen könnten schließlich als Quelle für die BC-Entwicklung dienen. Die anderen Gruppen berichteten über die ID-Abgabe von Viruspartikeln (z. B. Komponenten von Cre/LoxP- und/oder Cas9/CRISPR-Systemen), Hormonen und Hormonantagonisten (z. B. Prolaktin, Fulvestrant), Chemotherapeutika (z. B. Cisplatin), siRNAs und/oder Antikörpern oder anderen Zielmitteln bei Mäusen 4,19,21,35,36,37,38,39,40, 41,42,43,44,45, Ratten 21,33,46,47,48 und/oder Kaninchen 18,49,50,51,52,53 . Die erfolgreiche Kanülierung von bis zu acht duktalen Bäumen pro menschlicher Brust zur lokalen Verabreichung einer Chemotherapie wurde in unabhängigen klinischen Studien berichtet 47,54,55. Bildberatung für die Infusion dieser anderen Lösungen, die auf die Tumorprävention abzielen oder auf eine lokale Behandlung ausgerichtet sind, würde in ähnlicher Weise ihre Wirksamkeit maximieren.
Die Skalierbarkeit und Verfeinerung dieses Verfahrens von der Maus bis zum Ratten-duktalen Baum wird hier demonstriert. TaO-Nanopartikel im duktalen Baum von 4,19 und Ratte (unveröffentlichte Daten) liefern eine hochauflösende Bildgebung, die die von der FDA zugelassenen jodhaltigen Röntgenkontrastmittel übertrifft. Ebenso sind uns keine anderen duktalen Baumbildgebungsansätze bei Mäusen40,41 oder anderen Tiermodellen18 bekannt, die eine mit TaOx vergleichbare Auflösung bieten können. Relevant für die klinische Translation ist die Tatsache, dass der Geliereffekt von EC in diesen Rattenmodellen mittlerer Größe eine Formulierungsverfeinerung zur Minimierung von Kollateralgewebeschäden ermöglicht. Während wir dieses ablative ID-Verfahren weiterhin auf seine Fähigkeit zur Verhinderung von BC untersuchen, werden wir in der Lage sein, genauer zu bestimmen, aus welchen Drüsen sich BC durch die zusätzlichen Informationen entwickelt, die durch die Bildgebung nach der ID-Verabreichung in chemisch induzierten und anderen Rattenmodellen von BC bereitgestellt werden. Diese Daten bestimmen die Sicherheit dieses Verfahrens und zeigen Bedenken oder Mängel auf, ob teilweise oder erfolglos behandelte duktale Bäume anfälliger für die Entwicklung von BC bei einer Hochrisikofrau sein könnten.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde teilweise durch die Zuschüsse des National Cancer Institute R21 CA226579 und R01 CA258314 an LFS und durch den Zuschuss des National Institute of Biomedical Imaging and Bioengineering R01 EB029418 an EMS unterstützt. Wir danken dem MSU Institute for Quantitative (IQ) Health Science and Engineering Imaging Core Facility für die Nutzung seiner Bildgebungssysteme und technischen Expertise. Wir danken Dr. Danielle Ferguson für die Durchsicht des Inhalts des Videos und der Zahlen zur Einhaltung der Tierschutzrichtlinien.
Materialien
| Name | Company | Catalog Number | Comments |
| AnalyzeDirect v12.0 | Caliper | n/a | For micro-CT image processing |
| Carprieve, Carprofen 50 mg/mL | Allivet | 50647 | For anti-inflammatory treatment |
| Ethyl cellulose | Acros Organics | 9004-57-3 | For intraductal injection |
| Evans blue | Sigma | E2129-50G | For injection visualization |
| Hot water bath | Toolots | Yidu_HH-S2 | For preparing carprofen cups |
| MediGel Sucralose Cups | ClearH2O | 74-02-5022 | For delivery of carprofen |
| Model 1750 TTL, PTFE Luer Lock Syringe, 500μL | Hamilton | 81220 | For intraductal injection |
| Photoshop 2021 | Adobe | n/a | For image processing |
| Quantum GX2 microCT Imaging System | Perkin Elmer | CLS149276 | For micro-CT image acquisition |
| Metal Hub Needle, 33 gauge, custom (30° bevel angle, 0.4 in, point style 4) | Hamilton | 7747-01 | For intraductal injection |
| Stereo Microscope SZM Series | AmScope | SM-4TPZ-144 | For intraductal injection |
| Sterile blue food dye | McCormick | 930641 | For injection visualization |
| Sterile phosphate buffered saline (PBS) | ThermoFisher | 14190250 | For solution preparation |
| Stickers | DOT Scientific | DOTSCI-C50 | For preparing carprofen cups |
| Sucrose | Calbiochem | 8550-5KG | For intraductal injection |
| Syringes | Fisher | 14-826-79 | For preparing carprofen cups |
| Vortex | VWR | 10153-834 | For preparing carprofen cups |
| Warming pump/pad(s) | Braintree Scientific | HTP-1500 120V; AP-R 26E | For intraductal injection/preoperative preparation |
Referenzen
- Siegel, R. L., Miller, K. D., Fuchs, H. E., Jemal, A. Cancer statistics, 2022. A Cancer Journal for Clinicians. 72 (1), 7-33 (2022).
- Wild, C. P. The global cancer burden: necessity is the mother of prevention. Nature Reviews. Cancer. 19 (3), 123-124 (2019).
- Padamsee, T. J., Wills, C. E., Yee, L. D., Paskett, E. D. Decision making for breast cancer prevention among women at elevated risk. Breast Cancer Research. 19 (1), 34 (2017).
- Kenyon, E., et al. Ductal tree ablation by local delivery of ethanol prevents tumor formation in an aggressive mouse model of breast cancer. Breast Cancer Research. 21 (1), 129 (2019).
- Kuang, M., et al. Ethanol ablation of hepatocellular carcinoma Up to 5.0 cm by using a multipronged injection needle with high-dose strategy. Radiology. 253 (2), 552-561 (2009).
- Ansari, D., Andersson, R. Radiofrequency ablation or percutaneous ethanol injection for the treatment of liver tumors. World Journal of Gastroenterology. 18 (10), 1003-1008 (2012).
- Zhang, W. Y., Li, Z. S., Jin, Z. D. Endoscopic ultrasound-guided ethanol ablation therapy for tumors. World Journal of Gastroenterology. 19 (22), 3397-3403 (2013).
- Chin, M., Chen, C. L., Chang, K., Lee, J., Samarasena, J. Ethanol ablation of a peripheral nerve sheath tumor presenting as a small bowel obstruction. ACG Case Reports Journal. 3 (1), 31-32 (2015).
- Gueng, M. -. K., Chou, Y. -. H., Tiu, C. -. M., Chiou, S. -. Y., Cheng, Y. -. F. Pseudoaneurysm of the breast treated with percutaneous ethanol injection. Journal of Medical Ultrasound. 22 (2), 114-116 (2014).
- Zhang, J., et al. Comparison between absolute ethanol and bleomycin for the treatment of venous malformation in children. Experimental and Therapeutic Medicine. 6 (2), 305-309 (2013).
- Wohlgemuth, W. A., et al. Ethanolgel sclerotherapy of venous malformations improves health-related quality-of-life in adults and children - results of a prospective study. European Radiology. 27 (6), 2482-2488 (2017).
- Steiner, F., FitzJohn, T., Tan, S. T. Ethanol sclerotherapy for venous malformation. ANZ Journal of Surgery. 86 (10), 790-795 (2016).
- Sannier, K., et al. A new sclerosing agent in the treatment of venous malformations. Study on 23 cases. Interventional Neuroradiology. 10 (2), 113-127 (2004).
- Dompmartin, A., et al. Radio-opaque ethylcellulose-ethanol is a safe and efficient sclerosing agent for venous malformations. European Radiology. 21 (12), 2647-2656 (2011).
- Faguy, K. Ductography: When, how, and why. Radiologic Technology. 92 (5), 487-503 (2021).
- Slawson, S. H., Johnson, B. A. Ductography: how to and what if. Radiographics. 21 (1), 133-150 (2001).
- Sheiman, L. S., Levesque, P. H. The in's and out's of ductography: A comprehensive review. Current Problems in Diagnostic Radiology. 45 (1), 61-70 (2016).
- Clark, A., Bird, N. K., Brock, A. Intraductal delivery to the rabbit mammary gland. Journal of Visualized Experiments. (121), e55209 (2017).
- Chakravarty, S., et al. Tantalum oxide nanoparticles as versatile contrast agents for X-ray computed tomography. Nanoscale. 12 (14), 7720-7734 (2020).
- Kenyon, E., et al. Intraductal delivery and x-ray visualization of ethanol-based ablative solution for prevention and local treatment of breast cancer in mouse models. Journal of Visualized Experiments. (182), e63457 (2022).
- Murata, S., et al. Ductal access for prevention and therapy of mammary tumors. Cancer Research. 66 (2), 638-645 (2006).
- King, B. L., Love, S. M. The intraductal approach to the breast: raison d'etre. Breast Cancer Research. 8 (2), 206 (2006).
- Love, S. M., Barsky, S. H. Anatomy of the nipple and breast ducts revisited. Cancer. 101 (9), 1947-1957 (2004).
- Lai, Y. E., Morhard, R., Ramanujam, N., Nolan, M. W. Minimally invasive ethyl cellulose ethanol ablation in domesticated cats with naturally occurring head and neck cancers: Six cats. Veterinary and Comparative Oncology. 19 (3), 492-500 (2021).
- Mueller, J. L., et al. Optimizing ethyl cellulose-ethanol delivery towards enabling ablation of cervical dysplasia. Scientific Reports. 11 (1), 16869 (2021).
- Nief, C., et al. Polymer-assisted intratumoral delivery of ethanol: Preclinical investigation of safety and efficacy in a murine breast cancer model. PLoS One. 16 (1), 0234535 (2021).
- Chelales, E., et al. Radiologic-pathologic analysis of increased ethanol localization and ablative extent achieved by ethyl cellulose. Scientific Reports. 11 (1), 20700 (2021).
- Morhard, R., et al. Understanding factors governing distribution volume of ethyl cellulose-ethanol to optimize ablative therapy in the liver. IEEE Trans Biomedical Engineering. 67 (8), 2337-2348 (2020).
- Morhard, R., et al. Development of enhanced ethanol ablation as an alternative to surgery in treatment of superficial solid tumors. Scientific Reports. 7 (1), 8750 (2017).
- Russo, I. H., Russo, J. Developmental stage of the rat mammary gland as determinant of its susceptibility to 7,12-dimethylbenz[a]anthracene. Journal of the National Cancer Institute. 61 (6), 1439-1449 (1978).
- Paine, I. S., Lewis, M. T. The terminal end bud: The little engine that could. Journal of Mammary Gland Biology Neoplasia. 22 (2), 93-108 (2017).
- Hinck, L., Silberstein, G. B. Key stages in mammary gland development: the mammary end bud as a motile organ. Breast Cancer Research. 7 (6), 245-251 (2005).
- Sivaraman, L., et al. Effect of selective ablation of proliferating mammary epithelial cells on MNU induced rat mammary tumorigenesis. Breast Cancer Research Treatment. 73 (1), 75-83 (2002).
- Cardiff, R. D., Wellings, S. R. The comparative pathology of human and mouse mammary glands. Journal of Mammary Gland Biology Neoplasia. 4 (1), 105-122 (1999).
- Brock, A., et al. Silencing HoxA1 by intraductal injection of siRNA lipidoid nanoparticles prevents mammary tumor progression in mice. Scientific Translational Medicine. 6 (217), (2014).
- de Groot, J. S., et al. Intraductal cisplatin treatment in a BRCA-associated breast cancer mouse model attenuates tumor development but leads to systemic tumors in aged female mice. Oncotarget. 8 (37), 60750-60763 (2017).
- Wang, G., et al. Intraductal fulvestrant for therapy of ERalpha-positive Ductal Carcinoma in Situ (DCIS) of the breast - A preclinical study. Carcinogenesis. 40 (7), 907-913 (2019).
- Yoshida, T., et al. Effective treatment of ductal carcinoma in situ with a HER-2- targeted alpha-particle emitting radionuclide in a preclinical model of human breast cancer. Oncotarget. 7 (22), 33306-33315 (2016).
- Chun, Y. S., et al. Intraductally administered pegylated liposomal doxorubicin reduces mammary stem cell function in the mammary gland but in the long term, induces malignant tumors. Breast Cancer Research Treatment. 135 (1), 201-208 (2012).
- Markiewicz, E., et al. High resolution 3D MRI of mouse mammary glands with intra-ductal injection of contrast media. Magnetic Resonance Imaging. 33 (1), 161-165 (2015).
- Markiewicz, E., et al. MRI ductography of contrast agent distribution and leakage in normal mouse mammary ducts and ducts with in situ cancer. Magnetic Resonance Imaging. 40, 48-52 (2017).
- Annunziato, S., et al. Comparative oncogenomics identifies combinations of driver genes and drug targets in BRCA1-mutated breast cancer. Nature Communications. 10 (1), 397 (2019).
- Rutkowski, M. R., et al. Initiation of metastatic breast carcinoma by targeting of the ductal epithelium with adenovirus-cre: a novel transgenic mouse model of breast cancer. Journal of Visualized Experiments. (85), e51171 (2014).
- Xiang, D., Tao, L., Li, Z. Modeling breast cancer via an intraductal injection of cre-expressing adenovirus into the mouse mammary gland. Journal of Visualized Experiments. (148), e59502 (2019).
- Barham, W., Sherrill, T., Connelly, L., Blackwell, T. S., Yull, F. E. Intraductal injection of LPS as a mouse model of mastitis: signaling visualized via an NF-kappaB reporter transgenic. Journal of Visualized Experiments. (67), e4030 (2012).
- Chun, Y. S., et al. Intraductal administration of a polymeric nanoparticle formulation of curcumin (NanoCurc) significantly attenuates incidence of mammary tumors in a rodent chemical carcinogenesis model: Implications for breast cancer chemoprevention in at-risk populations. Carcinogenesis. 33 (11), 2242-2249 (2012).
- Stearns, V., et al. Preclinical and clinical evaluation of intraductally administered agents in early breast cancer. Science Translational Medicine. 3 (106), (2011).
- Okugawa, H., et al. Effect of perductal paclitaxel exposure on the development of MNU-induced mammary carcinoma in female S-D rats. Breast Cancer Research Treatment. 91 (1), 29-34 (2005).
- Falconer, I. R. The distribution of 131 I- or 125 I-labelled prolactin in rabbit mammary tissue after intravenous or intraductal injection. Journal of Endocrinology. 53 (3), 58-59 (1972).
- Fiddler, T. J., Birkinshaw, M., Falconer, I. R. Effects of intraductal prolactin on some aspects of the ultrastructure and biochemistry of mammary tissue in the pseudopregnant rabbit. Journal of Endocrinology. 49 (3), 459-469 (1971).
- Fiddler, T. J., Falconer, I. R. The effect of intraductal prolactin on protein and nucleic acid biosynthesis in the rabbit mammary gland. The Biochemical Journal. 115 (5), 58 (1969).
- Bourne, R. A., Bryant, J. A., Falconer, I. R. Stimulation of DNA synthesis by prolactin in rabbit mammary tissue. Journal of Cell Science. 14 (1), 105-111 (1974).
- Chadwick, A. Detection and assay of prolactin by the local lactogenic response in the rabbit. The Journal of Endocrinology. 27, 253-263 (1963).
- Mahoney, M. E., et al. Intraductal therapy of ductal carcinoma in situ: a presurgery study. Clinical Breast Cancer. 13 (4), 280-286 (2013).
- Love, S. M., et al. A feasibility study of the intraductal administration of chemotherapy. Cancer Preview Research (Phila). 6 (1), 51-58 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten