Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
In vitro Digestión de emulsiones en una sola gota a través del intercambio multifásico de fluidos gastrointestinales simulados
En este artículo
Resumen
Un balance colgante de película de superficie de gota implementado con un intercambio multisubfase, apodado OCTOPUS, permite imitar las condiciones digestivas mediante el intercambio secuencial de subfases de la solución a granel original con fluidos gastrointestinales simulados. La digestión in vitro simulada se monitoriza registrando in situ la tensión interfacial de la capa interfacial digerida.
Resumen
Las emulsiones se utilizan actualmente para encapsular y administrar nutrientes y medicamentos para abordar diferentes afecciones gastrointestinales como la obesidad, la fortificación de nutrientes, las alergias alimentarias y las enfermedades digestivas. La capacidad de una emulsión para proporcionar la funcionalidad deseada, es decir, alcanzar un sitio específico dentro del tracto gastrointestinal, inhibir / retrasar la lipólisis o facilitar la digestibilidad, depende en última instancia de su susceptibilidad a la degradación enzimática en el tracto gastrointestinal. En las emulsiones de aceite en agua, las gotas de lípidos están rodeadas por capas interfaciales, donde los emulsionantes estabilizan la emulsión y protegen el compuesto encapsulado. Lograr una digestibilidad adaptada de las emulsiones depende de su composición inicial, pero también requiere monitorear la evolución de esas capas interfaciales a medida que se someten a diferentes fases de la digestión gastrointestinal. Una balanza de película de superficie de gota colgante implementada con un intercambio multisubfase permite simular la digestión in vitro de emulsiones en una sola gota acuosa sumergida en aceite mediante la aplicación de un modelo de digestión estática personalizado. El tránsito a través del tracto gastrointestinal es imitado por el intercambio de subfases de la solución a granel de gotitas original con medios artificiales, imitando las condiciones fisiológicas de cada compartimento / paso del tracto gastrointestinal. La evolución dinámica de la tensión interfacial se registra in situ a lo largo de toda la digestión gastrointestinal simulada. Las propiedades mecánicas de las interfaces digeridas, como la elasticidad dilatacional interfacial y la viscosidad, se miden después de cada fase de digestión (oral, gástrico, intestino delgado). La composición de cada medio digestivo se puede ajustar para tener en cuenta las particularidades de las afecciones digestivas, incluidas las patologías gastrointestinales y los medios digestivos infantiles. Se identifican los mecanismos interfaciales específicos que afectan la proteólisis y la lipólisis, proporcionando herramientas para modular la digestión mediante la ingeniería interfacial de emulsiones. Los resultados obtenidos pueden manipularse para diseñar matrices de nuevos alimentos con funcionalidades personalizadas como baja alergenicidad, ingesta de energía controlada y disminución de la digestibilidad.
Introducción
Comprender cómo se digiere la grasa, lo que implica la digestión en emulsión, es importante para diseñar racionalmente productos con funcionalidad personalizada1. El sustrato para la digestión de grasas es una emulsión ya que la grasa se emulsiona al consumirla por acción mecánica y mezclándola con biosurfactantes en la boca y el estómago. Además, la mayor parte de la grasa consumida por los humanos ya está emulsionada (como los productos lácteos), y en el caso de los bebés o algunas personas mayores, esta es la única forma de consumo. Por lo tanto, el diseño de productos a base de emulsión con perfiles de digestión específicos es muy importante en nutrición1. Además, las emulsiones pueden encapsular y administrar nutrientes, medicamentos o bioactivos lipofílicos2 para abordar diferentes afecciones gastrointestinales como la obesidad3, la fortificación de nutrientes, las alergias alimentarias y las enfermedades digestivas. En las emulsiones de aceite en agua, las gotas de lípidos están rodeadas por capas interfaciales de emulsionantes como proteínas, surfactantes, polímeros, partículas y mezclas4. El papel de los emulsionantes es doble: estabilizar la emulsión5 y proteger/transportar el compuesto encapsulado a un sitio específico. Lograr una digestibilidad adaptada de las emulsiones depende de su composición inicial, pero también requiere monitorear la evolución continua de esta interfaz durante el tránsito a través del tracto gastrointestinal (Figura 1).
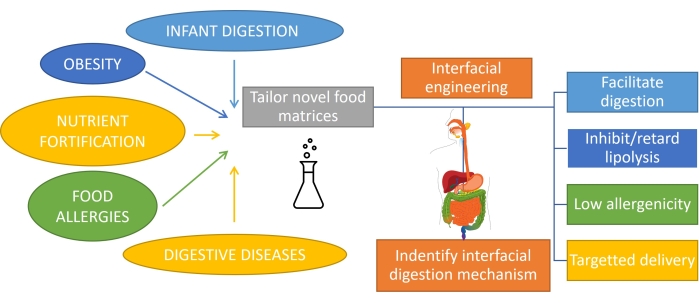
Figura 1: Aplicación de la ingeniería interfacial de emulsiones para abordar algunas de las principales afecciones gastrointestinales. Haga clic aquí para ver una versión más grande de esta figura.
La digestión de lípidos es, en última instancia, un proceso interfacial porque requiere la adsorción de lipasas (gástricas o pancreáticas) en la interfaz aceite-agua de gotitas de lípidos emulsionadas a través de la capa interfacial para alcanzar e hidrolizar los triglicéridos contenidos en el aceite en ácidos grasos libres y monoacilglicéridos6. Esto se esquematiza en la Figura 2. La lipasa gástrica compite con la pepsina y los fosfolípidos en el estómago por la interfaz aceite-agua (Figura 2, digestión gástrica). Luego, la lipasa/colipasa pancreática compite con tripsina/quimotripsina, fosfolípidos, sales biliares y productos digestivos en el intestino delgado. Las proteasas pueden alterar la cobertura interfacial, impidiendo o favoreciendo la adsorción de lipasa, mientras que las sales biliares son altamente activas en superficie y desplazan la mayor parte del emulsionante restante para promover la adsorción de lipasa (Figura 2, digestión intestinal). Eventualmente, la velocidad y el alcance de la lipólisis dependen de las propiedades interfaciales de la emulsión inicial / gástrica digerida, como el grosor, las conexiones intermoleculares / intramoleculares y las interacciones electrostáticas y estéricas. En consecuencia, el monitoreo de la evolución de la capa interfacial a medida que se digiere ofrece una plataforma experimental para identificar los mecanismos interfaciales y los eventos que afectan la adsorción de la lipasa y, por lo tanto, la digestión de los lípidos.
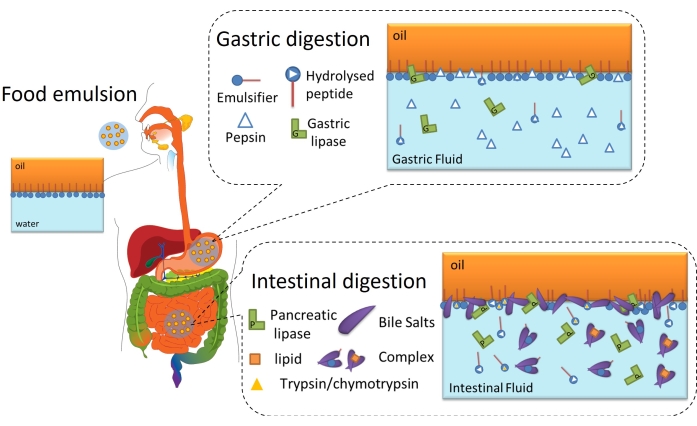
Figura 2: Diagrama esquemático que ilustra el papel de las interfaces en la digestión de lípidos gastrointestinales. La hidrólisis de pepsina altera la composición interfacial en la fase gástrica, mientras que la lipasa gástrica hidroliza los triglicéridos. En el intestino delgado, la tripsina/quimotripsina hidroliza aún más la película interfacial, mientras que la lipólisis procede por la adsorción de BS/lipasas, la hidrólisis de triglicéridos y la desorción de productos lipolíticos por solubilización en las micelas/complejo BS. Haga clic aquí para ver una versión más grande de esta figura.
El equipo de caída colgante de la Universidad de Granada (UGR) se implementa con una tecnología patentada, el doble capilar coaxial, que permite el intercambio subfásico de la solución a granel7. El capilar, que sostiene la gota colgante, consiste en una disposición de dos capilares coaxiales que están conectados independientemente a cada canal de un microinyector doble. Cada microinyector puede funcionar de forma independiente, lo que permite el intercambio del contenido caído por flujopasante 7. En consecuencia, el intercambio de subfases consiste en la inyección simultánea de la nueva solución con el capilar interno y la extracción de la solución a granel con el capilar externo utilizando el mismo caudal. Este proceso permite el reemplazo de la solución a granel sin perturbar el área interfacial o el volumen de la gota. Este procedimiento se actualizó posteriormente a un intercambio multifásico, que permite hasta ocho intercambios secuenciales de subfase de la solución masiva de gotas8. Esto permite la simulación del proceso digestivo en una sola gota acuosa suspendida en medios lipídicos mediante el intercambio secuencial de la solución a granel con medios artificiales que imitan los diferentes compartimentos (boca, estómago, intestino delgado). Toda la configuración se representa en la Figura 3, incluidos los detalles de los componentes. Las jeringas en el microinyector están conectadas a las ocho válvulas vías, cada una conectada a un tubo de microcentrífuga que contiene el líquido digestivo artificial con los componentes descritos en la Figura 2.

Figura 3: Vista general del OCTOPUS con todos los componentes. La cámara CCD, el microscopio, el microposicionador, la célula termoestabilizada y el doble capilar se conectaron independientemente a un microinyector doble con dos jeringas conectadas a ocho válvulas vías. Cada jeringa se conecta con capilar, cuatro tubos de microcentrífuga con muestra y una descarga. Haga clic aquí para ver una versión más grande de esta figura.
La Figura 4A muestra cómo cada uno de los fluidos digestivos artificiales se inyecta en la gota colgante por intercambio de subfases a través del doble capilar. Cada compuesto digestivo detallado en la Figura 2 se puede aplicar simultáneamente/secuencialmente, simulando el paso a través del tracto gastrointestinal. Los fluidos digestivos artificiales contienen diferentes enzimas y biosurfactantes, que alteran la tensión interfacial del emulsionante inicial, como se esquematiza en la Figura 4B. El software DINATEN (ver Tabla de materiales), también desarrollado en la UGR, registra la evolución de la tensión interfacial en tiempo real a medida que se digiere in vitro la capa interfacial inicial. Además, después de cada fase digestiva, la elasticidad dilatacional de la capa interfacial se calcula imponiendo oscilaciones periódicas de volumen / área interfacial sobre la capa interfacial estabilizada y registrando la respuesta de la tensión interfacial. El período/frecuencia y la amplitud de la oscilación pueden variarse, y el procesamiento de imágenes con el software CONTACTO proporciona los parámetros reológicos dilatacionales8.
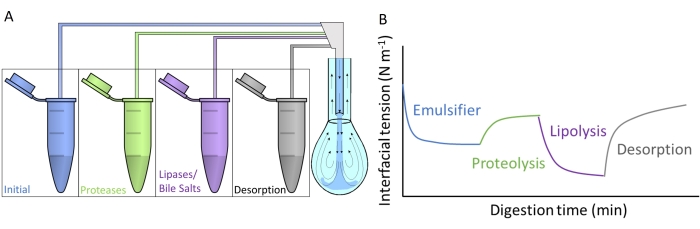
Figura 4: Ejemplos de perfiles de digestión . (A) La capa emulsionante inicial se somete a medios digestivos artificiales colocados en la microcentrífuga mediante el intercambio secuencial de subfase de las diferentes soluciones en la gota colgante. (B) La evolución general de la tensión interfacial (eje y) del emulsionante inicial en función del tiempo (eje x) a medida que es digerido in vitro por las diversas enzimas/biosurfactantes en los medios artificiales. Un intercambio final de subfases con líquido intestinal simple mide la desorción de lípidos digeridos por solubilización en micelas mixtas. Haga clic aquí para ver una versión más grande de esta figura.
Este estudio presenta el protocolo general diseñado para medir la digestión in vitro de capas interfaciales con equipo de gota colgante9. La capa interfacial inicial se somete secuencialmente a condiciones que imitan el paso a través del tracto gastrointestinal, como se muestra en la Figura 2. Estos diferentes medios digestivos se inyectan en la gota colgante mediante el intercambio de subfases de las diferentes soluciones contenidas en los tubos de microcentrífuga (Figura 4A). La composición de estos medios puede ser personalizada dependiendo de las condiciones gastrointestinales que serán evaluadas, a saber, proteólisis/lipólisis gástrica/intestinal, permitiendo medir efectos acumulativos y sinergias10. Las condiciones experimentales utilizadas para imitar el proceso de digestión en cada compartimento siguen el protocolo de consenso internacional publicado por INFOGEST que detalla el pH y las cantidades de electrolitos y enzimas11. El dispositivo experimental basado en gota colgante permite registrar la tensión interfacial in situ durante todo el proceso de digestión simulado. La reología dilatacional de la capa interfacial se calcula al final de cada paso digestivo. De esta manera, cada emulsionante ofrece un perfil de digestión que ilustra las propiedades de las interfaces digeridas, como se muestra en la Figura 4B. Esto permite extraer conclusiones sobre su susceptibilidad o resistencia a las diferentes etapas del proceso digestivo. En general, los medios digestivos artificiales contienen pH ácido/básico, electrolitos, proteasas (gástricas e intestinales), lipasas (gástricas e intestinales), sales biliares y fosfolípidos, que se disuelven en sus respectivos fluidos digestivos (gástricos o intestinales). La figura 4B muestra un perfil genérico de la evolución de la tensión interfacial de un emulsionante, primero sometida a la acción de la proteasa, seguida de las lipasas. En general, la proteólisis de la capa interfacial promueve un aumento de la tensión interfacial debido a la desorción de péptidos hidrolizados9,12, mientras que la lipólisis resulta en una reducción muy pronunciada de la tensión interfacial debido a la adsorción de sales biliares y lipasas 13. Un intercambio final de subfases con líquido intestinal agota la solución a granel de material no adsorbido / digerido y promueve la desorción de compuestos solubles y la solubilización de lípidos digeridos en micelas mixtas. Esto se cuantifica por el aumento de la tensión interfacial registrado (Figura 4B).
En resumen, el diseño experimental implementado en la gota colgante para simular la digestión in vitro en una sola gota permite medir los efectos acumulativos y las sinergias a medida que el proceso de digestión se aplica secuencialmente a la capa interfacial inicial10. La composición de cada medio digestivo puede ajustarse fácilmente para tener en cuenta las particularidades de las condiciones digestivas, incluidas las patologías gastrointestinales o los medios digestivos infantiles14. Luego, la identificación de los mecanismos interfaciales que afectan la proteólisis y la lipólisis se puede utilizar para modular la digestión mediante la ingeniería interfacial de emulsiones. Los resultados obtenidos se pueden aplicar en el diseño de matrices de nuevos alimentos con funcionalidades personalizadas como baja alergenicidad, ingesta de energía controlada y disminución de la digestibilidad 15,16,17,18,19.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Secuencia de limpieza para toda la cristalería utilizada en la experimentación científica de superficies
- Frote la cristalería con una solución de limpieza concentrada (consulte la Tabla de materiales) diluida en agua (10%).
- Enjuague bien con una secuencia de agua del grifo, propanol, agua destilada y agua ultrapura. Secar en una cabina y almacenar en un gabinete cerrado hasta su uso.
2. Preparación de la muestra
- Preparar los medios digestivos artificiales según los protocolos estandarizados INFOGEST 11,20 (ver Tabla de Materiales). Para más detalles, véase la Tabla 1 e incluir pequeñas adaptaciones a los requisitos del trabajo interfacial para evitar la contaminación tensioactiva y la dilución de muestras (1:10)10.
- Prepare la solución emulsionante siguiendo los pasos a continuación.
- Preparar 0,01 L de una solución concentrada de (1 kg· L-1) emulsionante o una mezcla de emulsionantes (ver Tabla de materiales) en un tampón inicial (Tabla 1) y mantener bajo agitación suave durante la noche.
- Diluir a 0,1 kg· L−1 (o según sea necesario) para saturar la interfaz; alcanzar una pseudo meseta en la tensión interfacial después de 1 h de adsorción en un área interfacial constante siguiendo el informe previamente publicado21.
- Mantener bajo agitación leve durante 15 minutos antes de su uso.
- Purificar la fase oleosa.
- Preparar una mezcla de aceite vegetal (girasol, oliva, trioleína, etc.) y resinas de metasilicato de magnesio (ver Tabla de materiales) en una proporción de 2:1 p/p en un vaso de precipitados grande. Mantener bajo agitación mecánica leve durante al menos 3 h.
- Centrifugar la mezcla a 8.000 x g durante 30 min a temperatura ambiente en una centrífuga comercial (ver Tabla de materiales).
- Filtrar la mezcla de aceite al vacío con un filtro de jeringa (tamaño de poro de 0,2 μm) (ver Tabla de materiales). Almacenar en botellas ámbar limpias selladas y burbujeadas con nitrógeno hasta su uso.
3. Calibración y limpieza del pulpo
- Enjuague todos los tubos con agua ultrapura estableciendo una secuencia de limpieza tanto de las jeringas como de todas las válvulas a través de un capilar (válvulas 6/4) y hasta la salida externa (válvula de color azul 8). Para ello, pulse el botón de limpieza del cuadro de diálogo de la izquierda (Figura suplementaria 1A).
- Compruebe la tensión superficial7 del agua a temperatura ambiente formando una gota de agua y midiendo en tiempo real durante 5 min (Figura suplementaria 1B, C).
- Ajuste la densidad diferencial a aire-agua (0,9982 kg· L−1) en el cuadro de diálogo de la izquierda, Figura suplementaria 1B.
- Llene la cubeta limpia (vidrio óptico) con 0,002 L de aceite vegetal limpio y colóquela en el soporte de la cubeta en la celda termostática (Figura 3).
- Ajuste el termostato y permita el equilibrio de temperatura a 37 °C.
- Compruebe la tensión interfacial del agua-aceite a temperatura ambiente7.
- Ajuste la densidad diferencial a aceite vegetal-agua (aceite de oliva: 0.800 kg· L−1) (Figura complementaria 1C).
- Inyecte 40 μL a una velocidad de 0,5 μL·s−1 y mida en tiempo real cada segundo hasta el final de la inyección. Se trata de un proceso dinámico sencillo (Figura suplementaria 1B, D).
- Trazar la tensión interfacial en función del volumen de gotas en una hoja de datos.
- Compruebe que el rango de volumen de gotas proporciona un valor para la tensión interfacial independiente del volumen de gotas. Trazar el área interfacial en función del volumen de gotas.
- Programe un proceso que contenga dos pasos (Figura suplementaria 1B y Figura complementaria 2A) siguiendo los pasos a continuación.
- Con una jeringa interior, inyecte un volumen contenido dentro de este rango de tensión interfacial constante.
- Mantener constante la zona interfacial en el valor seleccionado en el paso 3.5.4 y registrar la tensión interfacial durante 5 min7.
4. Programación de un proceso experimental en DINATEN para cada paso digestivo
NOTA: Para los parámetros de proceso, consulte la Figura suplementaria 1B.
- Realice el control inicial.
- Para la formación de gotas, inyecte 10 μL (±5 μL) de solución emulsionante en el capilar (válvula 6) (Figura complementaria 2A).
- Registrar la adsorción en un área interfacial constante21 de 20 mm 2 (±10 mm2) durante 1 h (Figura complementaria 2B).
- Registrar la reología dilatacional8 (Figura complementaria 2C).
- Ajuste la amplitud de oscilación a 1,25 μL, período 10 s.
- Registrar la adsorción en la zona interfacial seleccionada (paso 4.1.2) durante 10 s.
- Repita el paso 4.1.3 en diferentes períodos: 5 s, 20 s, 50 s y 100 s.
- Registrar la digestión gástrica.
- Registre la adsorción21 en el área interfacial seleccionada durante 10 s.
- Intercambio subfásico7 con líquido en válvula 2 (sSGF) y enzimas gástricas (Tabla 1) (Figura complementaria 2D).
- Llene la jeringa izquierda de la válvula 2. Inyectar 125 μL en la válvula 6-capilar con la jeringa izquierda a 5 μL·s−1.
- Extraer 125 μL del capilar con la jeringa derecha a 5 μL·s−1. Descargue la jeringa correcta para salir de la válvula 8. Repita los pasos 4.2.2.1-4.2.2.2 10 veces para asegurar el intercambio completo.
- Registrar la adsorción21 en el área interfacial seleccionada en el paso 4.1.2 durante 1 h (Figura complementaria 2B).
- Registrar la reología dilatacional8 (Figura complementaria 2C).
- Ajuste la amplitud de oscilación a 1,25 μL, período 10 s.
- Registrar la adsorción del área interfacial seleccionada en el paso 4.1.2 durante 10 s. Repita en diferentes períodos: 5 s, 20 s, 50 s, 100 s.
- Registrar la digestión intestinal.
- Registrar la adsorción21 en el área interfacial seleccionada en el paso 4.1.2 durante 10 s (Figura complementaria 2B).
- Intercambio subfásico7 con líquido en válvula 3 (sSIF) y enzimas intestinales/sales biliares/fosfolípidos (Tabla 1) (Figura complementaria 2D).
- Llene la jeringa izquierda de la válvula 2. Inyectar 125 μL en la válvula 6-capilar con la jeringa izquierda a 5 μL·s−1. Extraer 125 μL del capilar con la jeringa derecha a 5 μL·s−1.
- Descargue la jeringa correcta para salir de la válvula 8. Repita los pasos 4.3.2.1-4.3.2.2 10 veces para asegurar un intercambio completo.
- Registrar la adsorción21 en el área interfacial seleccionada en el paso 4.1.2 durante 1 h.
- Registrar la reología dilatacional8 (Figura complementaria 2C).
- Ajuste la amplitud de oscilación a 1,25 μL, período 10 s.
- Registrar la adsorción en la zona interfacial seleccionada en el paso 4.1.2 durante 10 s.
- Repita en diferentes períodos: 5 s, 20 s, 50 s, 100 s.
- Registre la desorción siguiendo los pasos a continuación.
- Registrar la adsorción21 en el área interfacial seleccionada en el paso 4.1.2 durante 10 s (Figura complementaria 2B).
- Intercambio de subfase7 con líquido en válvula 5 (sSIF) (Tabla 1, Figura complementaria 2D).
- Llene la jeringa izquierda de la válvula 5. Inyectar 125 μL en la válvula 5-capilar con la jeringa izquierda a 5 μL·s−1.
- Extraer 125 μL del capilar con la jeringa derecha a 5 μL·s−1. Descargue la jeringa correcta para salir de la válvula 8. Repita los pasos 4.4.2.1-4.4.2.2 10 veces para asegurar un intercambio completo.
- Registrar la adsorción21 en el área interfacial seleccionada en el paso 4.1.2 durante 1 h (Figura complementaria 2B).
- Registrar la reología dilatacional8 (Figura complementaria 2C).
- Mantener la amplitud de 1,25 μL, período 10 s.
- Registrar la adsorción en la zona interfacial seleccionada en el paso 4.1.2 durante 10 s.
- Repita el paso 4.4.4 en diferentes períodos: 5 s, 20 s, 50 s, 100 s.
5. Configuración del experimento
- Llene los tubos de microcentrífuga con los medios de digestión artificial y conecte cada uno de ellos a la válvula respectiva mediante el tubo correspondiente.
- Llene el tubo de las válvulas 2-5 limpiando desde la válvula 2, la válvula 3, la válvula 4 y la válvula 5 hasta la salida externa (válvula 8) (Figura suplementaria 1A).
- Llene el tubo en la válvula 1 limpiando de la válvula 1 a la válvula 6-capilar 5 veces.
- Coloque el capilar en la fase oleosa. Cargue la jeringa izquierda con la válvula 1 (solución inicial, Tabla 1).
- Comience a procesar secuencialmente el paso 4.1-inicial, el paso 4.2-gástrico, el paso 4.3-intestinos y el paso 4.4-desorción, guardando los datos al final de cada proceso.
6. Cálculo de los parámetros reológicos dilatacionales con el software de procesamiento de imágenes CONTACTO8
NOTA: Para más detalles, véase Maldonado-Valderrama et al.8.
- Cargue las imágenes correspondientes a la oscilación del área a una frecuencia y amplitud dadas (Figura complementaria 3A).
- Pulse Reología (Figura complementaria 3B) y obtenga los parámetros dilatacionales (Figura complementaria 3C).
- Copie y pegue los resultados en la hoja de cálculo de datos.
7. Trazar los resultados experimentales
- Recalcula la columna de tiempo en cada uno de los pasos del proceso de digestión añadiendo los últimos datos de la hora del paso anterior.
- Trazar la tensión interfacial frente al tiempo aditivo para cada uno de los pasos del proceso de digestión utilizado.
- Trazar la tensión interfacial final / elasticidad dilatacional y la viscosidad obtenida al final de cada paso frente a la fase de digestión: inicial, digestión gástrica, digestión duodenal y desorción.
Access restricted. Please log in or start a trial to view this content.
Resultados
Esta sección muestra diferentes ejemplos de perfiles de digestión medidos con el pulpo. La apariencia general de las coincidencias del perfil de digestión simulado se muestra en la Figura 4B. La tensión interfacial generalmente se representa contra el tiempo en el perfil de digestión. Las diferentes fases / pasos de digestión considerados están representados en diferentes colores. La primera fase forma la capa inicial y corresponde a la fase de adsorción del emulsionante o proteína/...
Access restricted. Please log in or start a trial to view this content.
Discusión
Este artículo describe un protocolo generalizado para medir la digestión in vitro de capas interfaciales mediante el uso de equipos de gota colgante. El protocolo se puede ajustar a los requisitos específicos del experimento ajustando la composición de los tampones digestivos, que se basan en el protocolo armonizado INFOGEST11,20 para facilitar la comparación con la literatura. Las enzimas digestivas y los biosurfactantes se pueden agregar individua...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores declaran que no tienen intereses financieros conocidos en competencia o relaciones personales que podrían haber influido en el trabajo reportado en este documento.
Agradecimientos
Esta investigación ha sido financiada por los proyectos RTI2018-101309-B-C21 y PID2020-631-116615RAI00, financiados por MCIN/AEI/10.13039/501100011033 y por "FEDER Una forma de hacer Europa". Este trabajo fue (parcialmente) apoyado por el Grupo de Biocoloide y Física de Fluidos (ref. PAI-FQM115) de la Universidad de Granada (España).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Alpha-chymotrypsin from bovine pancreas | Sigma-Aldrich | C4129 | Enzyme |
| Beta-lactoglobulin | Sigma-Aldrich | L0130 | Emulsfier |
| Bovine Serum Albumin | Sigma-Aldrich | 9048-46-8 | Emulsfier |
| CaCl2 | Sigma-Aldrich | 10043-52-4 | Electrolyte |
| Centrifuge | Kronton instruments | Centrikon T-124 | For separating oil and resins |
| Citrus pectin | Sigma-Aldrich | P9135 | Emulsfier |
| co-lipase FROM PORCINE PANCREAS | Sigma | C3028 | Enzyme |
| CONTACTO | University of Granada (UGR) | https://core.ugr.es/dinaten/, last access: 07/18/2022 | |
| DINATEN | University of Granada (UGR) | https://core.ugr.es/dinaten/, last access: 07/18/2022 | |
| Gastric lipase | Lipolytech | RGE15-1G | Enzyme |
| Human Serum Albumin | Sigma-Aldrich | 70024-90-7 | Emulsifier |
| INFOGEST | http://www.proteomics.ch/IVD/ | ||
| Lipase from porcine pancreas, type II | Sigma-Aldrich | L33126 | Enzyme |
| Magnesium metasilicate resins | Fluka | 1343-88-0 | Resins to purify oil |
| Micro 90 | International products | M-9051-04 | Cleaner |
| NaCl | Sigma | 7647-14-5 | Electrolyte |
| NaH2PO4 | Scharlau | 10049-21-5 | To prepare buffer |
| OCTOPUS | Producciones Científicas y Técnicas S.L. (Gójar, Spain) | Pendandt Drop Equipment implemented with multi subphase exchange | |
| Olive oil | Sigma-Aldrich | 1514 | oil |
| Pancreatic from porcine pancreas | Sigma | P7545-25 g | Enzyme |
| Pepsin | Sigma-Aldrich | P6887 | Enzyme |
| Pluronic F127 | Sigma | P2443 | Emulsifier |
| Pluronic F68 | Sigma | P1300 | Emulsfier |
| Sodium deoxycholate | Sigma | Bile salts | |
| Sodium glycodeoxycholate | Sigma | C9910 | Bile salts |
| Sodium taurocholate | Sigma | 86339 | Bile salts |
| Syringe Filter | Millex-DP | SLGP033R | Syringe Filter 0.22 µm pore size polyethersulfone |
| Trypsin | Sigma-Aldrich | T1426 | Enzyme |
Referencias
- McClements, D. J. The biophysics of digestion: Lipids. Current Opinion in Food Science. 21, 1-6 (2018).
- McClements, D. J., Li, Y. Structured emulsion-based delivery systems: Controlling the digestion and release of lipophilic food components. Advances in Colloid and Interface Science. 159 (2), 213-228 (2010).
- Corstens, M. N., et al. Food-grade micro-encapsulation systems that may induce satiety via delayed lipolysis: A review. Critical Reviews in Food Science and Nutrition. 57 (10), 2218-2244 (2017).
- Aguilera-Garrido, A., del Castillo-Santaella, T., Galisteo-González, F., Gálvez-Ruiz, M. J., Maldonado-Valderrama, J. Investigating the role of hyaluronic acid in improving curcumin bioaccessibility from nanoemulsions. Food Chemistry. 351, 129301(2021).
- Rodríguez Patino, J. M., Carrera Sánchez, C., Rodríguez Niño, M. R. Implications of interfacial characteristics of food foaming agents in foam formulations. Advances in Colloid and Interface Science. 140 (2), 95-113 (2008).
- Wilde, P. J., Chu, B. S. Interfacial & colloidal aspects of lipid digestion. Advances in Colloid and Interface Science. 165 (1), 14-22 (2011).
- Cabrerizo-Vílchez, M. A., Wege, H. A., Holgado-Terriza, J. A., Neumann, A. W. Axisymmetric drop shape analysis as penetration Langmuir balance. Review of Scientific Instruments. 70 (5), 2438-2444 (1999).
- Maldonado-Valderrama, J., Muros-Cobos, J. L., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Bile salts at the air-water interface: Adsorption and desorption. Colloids and surfaces B: Biointerfaces. 120, 176-183 (2014).
- Maldonado-Valderrama, J., Terriza, J. A. H., Torcello-Gómez, A., Cabrerizo-Vílchez, M. A. In vitro digestion of interfacial protein structures. Soft Matter. 9, 1043-1053 (2013).
- Maldonado-Valderrama, J. Probing in vitro digestion at oil-water interfaces. Current Opinion in Colloid and Interface Science. 39, 51-60 (2019).
- Brodkorb, A., et al. INFOGEST static in vitro simulation of gastrointestinal food digestion. Nature Protocols. 14 (4), 991-1014 (2019).
- del Castillo-Santaella, T., Maldonado-Valderrama, J., Molina-Bolivar, J. A., Galisteo-Gonzalez, F. Effect of cross-linker glutaraldehyde on gastric digestion of emulsified albumin. Colloids and Surfaces B: Biointerfaces. 145, 899-905 (2016).
- Macierzanka, A., Torcello-Gómez, A., Jungnickel, C., Maldonado-Valderrama, J. Bile salts in digestion and transport of lipids. Advances in Colloid and Interface Science. 274, 102045(2019).
- Maldonado-Valderrama, J., Torcello-Gómez, A., del Castillo-Santaella, T., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Subphase exchange experiments with the pendant drop technique. Advances in Colloid and Interface Science. 222, 488-501 (2015).
- Bellesi, F. A., Ruiz-Henestrosa, V. M. P., Maldonado-Valderrama, J., Del Castillo Santaella, T., Pilosof, A. M. R. Comparative interfacial in vitro digestion of protein and polysaccharide oil/water films. Colloids and Surfaces B: Biointerfaces. 161, 547-554 (2018).
- Del Castillo-Santaella, T., Sanmartín, E., Cabrerizo-Vílchez, M. A., Arboleya, J. C., Maldonado-Valderrama, J. Improved digestibility of β-lactoglobulin by pulsed light processing: A dilatational and shear study. Soft Matter. 10 (48), 9702-9714 (2014).
- Infantes-Garcia, M. R., et al. In vitro gastric lipid digestion of emulsions with mixed emulsifiers: Correlation between lipolysis kinetics and interfacial characteristics. Food Hydrocolloids. 128, 107576(2022).
- del Castillo-Santaella, T., Cebrián, R., Maqueda, M., Gálvez-Ruiz, M. J., Maldonado-Valderrama, J. Assessing in vitro digestibility of food biopreservative AS-48. Food Chemistry. 246, 249-257 (2018).
- Torcello-Gómez, A., Maldonado-Valderrama, J., Jódar-Reyes, A. B., Cabrerizo-Vílchez, M. A., Martín-Rodríguez, A. Pluronic-covered oil-water interfaces under simulated duodenal conditions. Food Hydrocolloids. 34, 54-61 (2014).
- Minekus, M., et al. A standardised static in vitro digestion method suitable for food - an international consensus. Food & Function. 5 (6), 1113-1124 (2014).
- Wege, H. A., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Development of a constant surface pressure penetration langmuir balance based on axisymmetric drop shape analysis. Journal of Colloid and Interface Science. 249 (2), 263-273 (2002).
- del Castillo-Santaella, T., et al. Hyaluronic acid and human/bovine serum albumin shelled nanocapsules: Interaction with mucins and in vitro digestibility of interfacial films. Food Chemistry. 383, 132330(2022).
- Aguilera-Garrido, A., et al. Applications of serum albumins in delivery systems: Differences in interfacial behaviour and interacting abilities with polysaccharides. Advances in Colloid and Interface Science. 290 (5), 102365(2021).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados