このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
インビトロ 模擬胃腸液の多相交換 による 単一液滴中のエマルジョンの消化
要約
OCTOPUSと呼ばれるマルチサブフェーズ交換で実装されたペンダントドロップサーフェスフィルムバランスは、元のバルク溶液をシミュレートされた胃腸液と順次サブフェーズ交換することにより、消化状態を模倣することができます。シミュレートされた in vitro 消化は、消化された界面層の界面張力を in situ で記録することによってモニターされる。
要約
エマルジョンは現在、肥満、栄養強化、食物アレルギー、消化器疾患などのさまざまな胃腸の状態に取り組むための栄養素や薬物をカプセル化して送達するために使用されています。所望の機能性を提供するエマルジョンの能力、すなわち、胃腸管内の特定の部位に到達する、脂肪分解を阻害/遅延させる、または消化性を促進する能力は、最終的には胃腸管における酵素分解に対する感受性に依存する。水中油型エマルジョンでは、脂肪滴は界面層に囲まれており、乳化剤がエマルションを安定化させ、カプセル化された化合物を保護します。エマルジョンのカスタマイズされた消化率を達成するには、初期組成に依存しますが、胃腸消化のさまざまな段階にさらされるにつれて、これらの界面層の進化を監視する必要もあります。マルチサブフェーズ交換で実装されたペンダントドロップサーフェスフィルムバランスにより、カスタマイズされた静的消化モデルを適用することにより、油に浸された単一の水性液滴中のエマルジョンの in vitro 消化をシミュレートできます。胃腸管を通過することは、胃腸管の各コンパートメント/ステップの生理学的条件を模倣して、人工培地との元の液滴バルク溶液のサブフェーズ交換によって模倣されます。界面張力の動的進化は、シミュレートされた胃腸消化全体を通して その場で 記録されます。界面拡張弾性や粘度などの消化界面の機械的特性は、各消化段階(経口、胃、小腸)の後に測定されます。各消化媒体の組成は、胃腸の病状および乳児の消化媒体を含む消化状態の特殊性を説明するように調整することができる。タンパク質分解と脂肪分解に影響を与える特定の界面メカニズムが特定され、エマルジョンの界面工学によって消化を調節するためのツールが提供されます。得られた結果は、低アレルゲン性、制御されたエネルギー摂取量、消化率の低下などのカスタマイズされた機能を備えた新しい食品マトリックスを設計するために操作できます。
概要
エマルジョン消化を伴う脂肪の消化方法を理解することは、カスタマイズされた機能性を備えた製品を合理的に設計するために重要です1。脂肪消化の基質は、脂肪が機械的作用によって消費され、口や胃の中でバイオサーファクタントと混合することによって乳化されるため、エマルジョンです。また、人間が消費する脂肪のほとんどはすでに乳化されており(乳製品など)、乳児や一部の高齢者の場合、これが唯一の消費形態です。したがって、特定の消化プロファイルを持つエマルジョンベースの製品の設計は、栄養において非常に重要です1。さらに、エマルジョンは、栄養素、薬物、または親油性生物活性物質2 をカプセル化して送達し、肥満3、栄養強化、食物アレルギー、消化器疾患などのさまざまな胃腸の状態に取り組むことができます。水中油型エマルションにおいて、脂肪滴は、タンパク質、界面活性剤、ポリマー、粒子、および混合物などの乳化剤の界面層によって囲まれている4。乳化剤の役割は2つあります:エマルジョン5 を安定化させ、カプセル化された化合物を特定部位に保護/輸送します。エマルジョンのカスタマイズされた消化率を達成するには、初期組成に依存しますが、胃腸管を通過する間のこの界面の継続的な進化を監視する必要もあります(図1)。
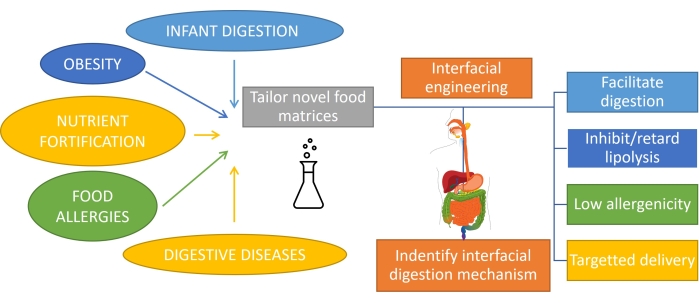
図1:エマルジョンの界面工学を適用して、主要な胃腸の状態のいくつかに取り組む。 この図の拡大版を表示するには、ここをクリックしてください。
脂質消化は、界面層を介して乳化脂肪滴の油-水界面にリパーゼ(胃または膵臓)を吸着し、油に含まれるトリグリセリドに到達して遊離脂肪酸およびモノアシルグリセリドに加水分解する必要があるため、最終的には界面プロセスです6。これを 図 2 に示します。胃リパーゼは、胃のペプシンやリン脂質と油水界面で競合します(図2、胃の消化)。次に、膵臓リパーゼ/コリパーゼは、小腸のトリプシン/キモトリプシン、リン脂質、胆汁酸塩、および消化産物と競合します。プロテアーゼは界面被覆率を変化させ、リパーゼ吸着を防止または促進することができますが、胆汁酸塩は界面活性が高く、残りの乳化剤の大部分を置換してリパーゼ吸着を促進します(図2、腸管消化)。最終的に、脂肪分解の速度と程度は、厚さ、分子間/分子内接続、静電相互作用と立体相互作用など、初期/胃消化エマルジョンの界面特性に依存します。したがって、消化される界面層の進化をモニタリングすることは、リパーゼ吸着、ひいては脂質消化に影響を与える界面メカニズムおよび事象を特定するための実験的プラットフォームを提供する。
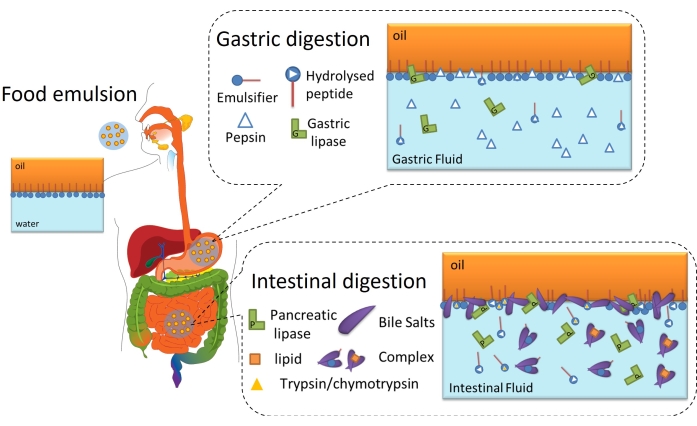
図2:胃腸脂質消化における界面の役割を示す模式図。ペプシン加水分解は胃相での界面組成を変化させ、胃リパーゼはトリグリセリドを加水分解します。小腸では、トリプシン/キモトリプシンが界面膜をさらに加水分解し、脂肪分解はBS/リパーゼの吸着、トリグリセリドの加水分解、およびBSミセル/複合体への可溶化による脂肪分解生成物の脱着によって進行します。この図の拡大版を表示するには、ここをクリックしてください。
グラナダ大学(UGR)のペンダントドロップ装置は、バルク溶液7のサブフェーズ交換を可能にする特許技術である同軸ダブルキャピラリーで実装されています。ペンダントドロップを保持するキャピラリーは、ダブルマイクロインジェクターの各チャネルに独立して接続された2つの同軸キャピラリーの配置で構成されています。各マイクロインジェクタは独立して動作することができ、スルーフロー7による滴下内容物の交換を可能にする。したがって、サブフェーズ交換は、同じ流量を使用して、内側キャピラリーを備えた新しい溶液の同時注入と、外側キャピラリーとのバルク溶液の抽出で構成されます。このプロセスにより、界面領域または液滴の体積を乱すことなくバルク溶液の交換が可能になります。この手順は後にマルチサブフェーズ交換にアップグレードされ、液滴バルク溶液8の最大8つの連続サブフェーズ交換が可能になります。これにより、バルク溶液をさまざまなコンパートメント(口、胃、小腸)を模倣した人工培地と順次交換することにより、脂質媒体に懸濁した単一の水性液滴での消化プロセスのシミュレーションが可能になります。コンポーネントの詳細を含め、セットアップ全体を 図3に示します。マイクロインジェクター内のシリンジは8つのビアバルブに接続されており、それぞれが 図2に説明されているコンポーネントを含む人工消化液を含むマイクロ遠心チューブに接続されています。

図3:すべてのコンポーネントを含むOCTOPUSの全体図。CCDカメラ、顕微鏡、マイクロポジショナー、熱安定化セル、およびダブルキャピラリーは、8つのビアバルブに接続された2つのシリンジを備えたダブルマイクロインジェクターに独立して接続されています。各シリンジは、キャピラリー、サンプルと1つの排出を含む4つのマイクロ遠心チューブに接続します。この図の拡大版を表示するには、ここをクリックしてください。
図4A は、各人工消化液が二重毛細管を介したサブフェーズ交換によってペンダントドロップに注入される方法を示しています。 図2 に詳述されている各消化化合物は、胃腸管を通過することをシミュレートして、同時/順次に適用できます。人工消化液には、図 4Bに図示されているように、初期乳化剤の界面張力を変化させるさまざまな酵素とバイオサーファクタントが含まれています。同じくUGRで開発されたソフトウェアDINATEN( 材料表を参照)は、最初の界面層が in vitroで消化されるときの界面張力の変化をリアルタイムで記録します。また、各消化相の後、安定化された界面層に体積/界面領域の周期的な振動を課し、界面張力の応答を記録することによって、界面層の拡張弾性が計算されます。振動の周期/周波数と振幅を変えることができ、ソフトウェアCONTACTOによる画像処理は拡張レオロジーパラメータを提供します8。
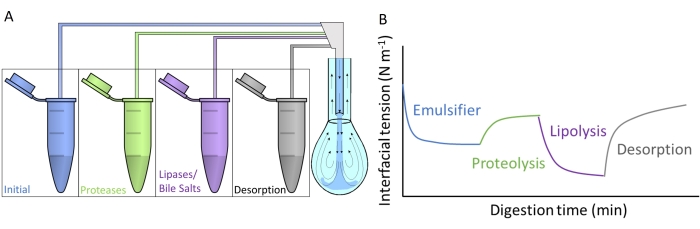
図4:消化プロファイルの例 。 (a)初期乳化剤層は、ペンダントドロップへの異なる溶液の順次サブフェーズ交換によってマイクロ遠心分離機に入れられた人工消化媒体に供される。(B)初期乳化剤の界面張力(y軸)の一般的な進化は、人工培地中のさまざまな酵素/バイオサーファクタントによって in vitro で消化されるときの時間(x軸)の関数です。普通の腸液との最終亜相交換は、混合ミセルの可溶化による消化脂質の脱着を測定します。 この図の拡大版を表示するには、ここをクリックしてください。
この研究は、ペンダントドロップ装置9を使用して界面層のin vitro消化を測定するために設計された一般的なプロトコルを提示します。最初の界面層は、図2に示すように、胃腸管を通過することを模倣する条件に順次さらされる。これらの異なる消化媒体は、マイクロ遠心チューブに含まれる異なる溶液のサブフェーズ交換によってペンダントドロップに注入されます(図4A)。これらの培地の組成は、評価される胃腸の状態、すなわち胃/腸のタンパク質分解/脂肪分解に応じてカスタマイズすることができ、累積効果と副活性を測定することができます10。各コンパートメントでの消化プロセスを模倣するために使用される実験条件は、電解質と酵素のpHと量を詳述したINFOGESTによって発行された国際的なコンセンサスプロトコルに従います11。ペンダントドロップに基づく実験装置は、シミュレートされた消化プロセス全体を通して、その場での界面張力の記録を可能にします。界面層の拡張レオロジーは、各消化ステップの最後に計算されます。このようにして、各乳化剤は、図4Bに描かれているように、消化された界面の特性を示す消化プロファイルを提供する。これにより、消化過程のさまざまな段階に対する感受性または耐性に関する結論を引き出すことができます。一般に、人工消化媒体には、酸/塩基性pH、電解質、プロテアーゼ(胃および腸)、リパーゼ(胃および腸)、胆汁酸塩、およびリン脂質が含まれており、これらはそれぞれの消化液(胃または腸)に溶解します。図4Bは、乳化剤の界面張力の進化の一般的なプロファイルを示しており、最初にプロテアーゼ作用を受け、次にリパーゼが続きます。一般に、界面層のタンパク質分解は、加水分解ペプチド9,12の脱離による界面張力の増加を促進し、一方、脂肪分解は、胆汁酸塩およびリパーゼ13の吸着による界面張力の非常に急な低下をもたらす。腸液との最終的な亜相交換は、未吸着/消化された物質のバルク溶液を枯渇させ、可溶性化合物の脱着および混合ミセル中の消化脂質の可溶化を促進する。これは、記録された界面張力の増加によって定量化されます(図4B)。
要約すると、単一の液滴におけるin vitro消化をシミュレートするためにペンダントドロップに実装された実験計画は、消化プロセスが最初の界面層10に順次適用されるときの累積効果および相乗効果を測定することを可能にする。各消化媒体の組成は、胃腸の病状または乳児の消化媒体を含む消化状態の特殊性を説明するために容易に調整することができる14。次に、タンパク質分解と脂肪分解に影響を与える界面メカニズムの同定を使用して、エマルジョンの界面工学による消化を調節することができます。得られた結果は、低アレルゲン性、制御されたエネルギー摂取量、消化率の低下などの調整された機能を備えた新しい食品マトリックスの設計に適用できます15,16,17,18,19。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1.表面科学実験で使用されるすべてのガラス製品の洗浄シーケンス
- 水(10%)で希釈した濃縮洗浄液( 材料の表を参照)でガラス器具をこすります。
- 水道水、プロパノール、蒸留水、超純水のシーケンスで十分にすすいでください。キャビンで乾燥させ、使用するまで密閉キャビネットに保管してください。
2. サンプル調製
- INFOGEST標準化プロトコル11,20に従って人工消化培地を準備します(材料の表を参照)。詳細については、表1を参照し、界面活性汚染およびサンプルの希釈(1:10)を防止するための界面作業の要件への小さな適応を含めてください10。
- 以下の手順に従って乳化剤溶液を調製します。
- 0.01 Lの濃縮溶液を調製します(1 kg·L−1)乳化剤または乳化剤の混合物( 材料の表を参照されたい)を初期緩衝液(表1)中で、一晩中穏やかな撹拌下に保つ。
- 0.1 kg·L−1 (または必要に応じて)界面を飽和させる。以前に発表された報告21に続いて、一定の界面領域での吸着の1時間後に界面張力の擬似プラトーに達する。
- 使用前に15分間軽度の攪拌下に保管してください。
- 油相を浄化します。
- 植物油(ひまわり、オリーブ、トリオレインなど)の混合物を準備します。メタケイ酸マグネシウム樹脂( 材料表を参照)を大きなビーカーに2:1 w / wの割合で。少なくとも3時間は穏やかな機械的攪拌下に保ちます。
- 市販の遠心分離機で室温で30分間、8,000 x gで混合物を遠心分離します(材料の表を参照)。
- シリンジフィルター(孔径0.2 μm)で真空下でオイル混合物をろ過します( 材料表を参照)。使用するまで密封して窒素で泡立てた清潔な琥珀色のボトルに保管してください。
3.タコの校正とクリーニング
- シリンジとすべてのバルブの両方をキャピラリー(バルブ6/4)と外部出口(バルブ8-青色)に洗浄するシーケンスを設定して、すべてのチューブを超純水ですすぎます。左側のダイアログの クリーン ボタンを押してこれを実行します(補足図1A)。
- 水滴を形成して5分間リアルタイムで測定することにより、室温における水の表面張力7 を確認する(補足図1B、C)。
- 差密度を空気-水に設定します(0.9982 kg·L−1)左側のダイアログの 補足図1B。
- 清潔なキュベット(光学ガラス)に0.002Lの清潔な植物油を入れ、サーモスタットセルのキュベットホルダーに入れます(図3)。
- サーモスタットを設定し、37°Cで温度平衡化できるようにします。
- 室温での水-油の界面張力を確認する7.
- 差密度を植物油-水(オリーブオイル:0.800kg·L−1)(補足図1C)。
- 40 μLを0.5 μL·s-1 の速度で注入し、注入が終了するまで毎秒リアルタイムで測定します。これは単純な動的プロセスです(補足図1B、D)。
- 界面張力を液滴体積の関数としてデータシートにプロットします。
- 液滴の体積範囲が、液滴の体積とは無関係の界面張力の値を提供することを確認します。界面面積を液滴体積の関数としてプロットします。
- 以下の手順に従って、2つのステップ(補足図1B と 補足図2A)を含むプロセスをプログラムします。
- インナーシリンジを使用して、この一定の界面張力の範囲内に含まれるボリュームを注入します。
- 界面面積をステップ3.5.4で選択した値で一定に保ち、界面張力を5分間記録します7。
4. DINATENで消化ステップごとに1つの実験プロセスをプログラミング
メモ: プロセスパラメータについては、 補足図1Bを参照してください。
- 初期制御を実行します。
- 液滴形成のために、10 μL(±5 μL)の乳化剤溶液をキャピラリー(バルブ6)に注入します(補足図2A)。
- 20mm2(±10mm2)の一定の界面領域21における吸着を1時間記録する(補足図2B)。
- 拡張レオロジー8 を記録します(補足図2C)。
- 発振振幅を1.25μL、周期10秒に設定します。
- 選択した界面領域(ステップ4.1.2)での吸着を10秒間記録します。
- 手順 4.1.3 を異なる期間 (5 秒、20 秒、50 秒、100 秒) で繰り返します。
- 胃の消化を記録します。
- 選択した界面領域での吸着21 を10秒間記録します。
- サブフェーズ交換7 は、バルブ2の液体(sSGF)および胃酵素(表1)(補足図2D)。
- バルブ2から左側のシリンジを満たします。左シリンジを5 μL・s−1でバルブ6キャピラリーに125 μL注入します。
- キャピラリーから125 μLを右シリンジで5 μL·s-1で抽出します。右シリンジを降ろしてバルブ8を終了します。手順 4.2.2.1-4.2.2.2 を 10 回繰り返して、完全に交換されるようにします。
- ステップ4.1.2で選択した界面領域での吸着21 を1時間記録します(補足図2B)。
- 拡張レオロジー8 を記録します(補足図2C)。
- 発振振幅を1.25μL、周期10秒に設定します。
- ステップ4.1.2で選択した界面領域の吸着を10秒間記録します。異なる周期で繰り返します:5秒、20秒、50秒、100秒。
- 腸の消化を記録します。
- ステップ4.1.2で選択した界面領域での吸着21 を10秒間記録します(補足図2B)。
- サブフェーズ交換7 とバルブ3の液体(sSIF)および腸酵素/胆汁酸塩/リン脂質(表1)(補足図2D)。
- バルブ2から左側のシリンジを満たします。左シリンジを5 μL・s−1でバルブ6キャピラリーに125 μL注入します。キャピラリーから125 μLを右シリンジで5 μL·s-1で抽出します。
- 右シリンジを降ろしてバルブ8を終了します。手順 4.3.2.1-4.3.2.2 を 10 回繰り返して、交換を完了します。
- ステップ4.1.2で選択した界面領域での吸着21 を1時間記録する。
- 拡張レオロジー8 を記録します(補足図2C)。
- 発振振幅を1.25μL、周期10秒に設定します。
- ステップ4.1.2で選択した界面領域での吸着を10秒間記録します。
- 異なる周期で繰り返します:5秒、20秒、50秒、100秒。
- 以下の手順に従って脱着を記録します。
- ステップ4.1.2で選択した界面領域での吸着21 を10秒間記録します(補足図2B)。
- サブフェーズ交換7 とバルブ5内の液体(sSIF)(表1、 補足図2D)。
- バルブ5から左側のシリンジを満たします。左シリンジで125 μLをバルブ5キャピラリーに5 μL・s-1で注入します。
- キャピラリーから125 μLを右シリンジで5 μL·s-1で抽出します。右シリンジを降ろしてバルブ8を終了します。手順 4.4.2.1-4.4.2.2 を 10 回繰り返して、交換を完了します。
- ステップ4.1.2で選択した界面領域での吸着21 を1時間記録します(補足図2B)。
- 拡張レオロジー8 を記録します(補足図2C)。
- 1.25 μL、周期10秒の振幅を維持します。
- ステップ4.1.2で選択した界面領域での吸着を10秒間記録します。
- 手順4.4.4を異なる周期(5秒、20秒、50秒、100秒)で繰り返します。
5. 実験のセットアップ
- マイクロ遠心チューブに人工消化媒体を満たし、対応するチューブでそれぞれをそれぞれのバルブに接続します。
- バルブ2、バルブ5、バルブ3、バルブ4、およびバルブ5から外部出口(バルブ8)まで清掃して、バルブ8〜8のチューブを満たします(補足図1A)。
- バルブ1からバルブ6までキャピラリーを5回洗浄して、バルブ6のチューブを満たします。
- キャピラリーを油相に配置します。左側のシリンジにバルブ1をロードします(初期溶液、 表1)。
- ステップ4.1-初期、ステップ4.2-胃、ステップ4.3-腸、およびステップ4.4-脱着を順次処理を開始し、各処理の終了時にデータを保存する。
6. 画像処理ソフトウェアCONTACTO 8による膨張レオロジーパラメータの計算
注:詳細については、Maldonado-Valderrama et al.8を参照してください。
- 所定の周波数と振幅での領域振動に対応する画像をロードします(補足図3A)。
- レオロジー(補足図3B)を押して、拡張パラメータを取得します(補足図3C)。
- 結果をコピーしてデータスプレッドシートに貼り付けます。
7. 実験結果のプロット
- 前のステップの時間の最後のデータを追加して、消化プロセスの各ステップの時間列を再計算します。
- 使用した消化プロセスの各ステップの界面張力対添加時間をプロットします。
- 消化段階に対する各ステップの終了時に得られた最終的な界面張力/拡張弾性および粘度をプロットします:初期、胃消化、十二指腸消化、および脱着。
Access restricted. Please log in or start a trial to view this content.
結果
このセクションでは、OCTOPUSで測定された消化プロファイルのさまざまな例を示します。シミュレートされた消化プロファイルの一致の一般的な外観を 図4Bに示します。界面張力は通常、消化プロファイルの時間に対して表されます。考慮されるさまざまなフェーズ/消化ステップは、さまざまな色で表されます。第1相は初期層を形成し、それぞれの場合に応じて、乳化?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
この記事では、ペンダントドロップ装置を使用して界面層のin vitro消化を測定するための一般化されたプロトコルについて説明します。プロトコルは、文献との比較を容易にするためにINFOGEST11,20調和プロトコルに基づく消化バッファーの組成を調整することにより、実験の特定の要件に合わせて調整できます。消化酵素およびバイオサーフ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、この論文で報告された研究に影響を与えた可能性のある競合する経済的利益や個人的な関係は知られていないと宣言しています。
謝辞
この研究は、プロジェクトRTI2018-101309-B-C21およびPID2020-631-116615RAI00によって資金提供され、MCIN/AEI/10.13039/501100011033および「ERDF A way of make Europe」によって資金提供されました。この研究は、グラナダ大学(スペイン)のバイオコロイドおよび流体物理学グループ(参照:PAI-FQM115)によって(部分的に)サポートされました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Alpha-chymotrypsin from bovine pancreas | Sigma-Aldrich | C4129 | Enzyme |
| Beta-lactoglobulin | Sigma-Aldrich | L0130 | Emulsfier |
| Bovine Serum Albumin | Sigma-Aldrich | 9048-46-8 | Emulsfier |
| CaCl2 | Sigma-Aldrich | 10043-52-4 | Electrolyte |
| Centrifuge | Kronton instruments | Centrikon T-124 | For separating oil and resins |
| Citrus pectin | Sigma-Aldrich | P9135 | Emulsfier |
| co-lipase FROM PORCINE PANCREAS | Sigma | C3028 | Enzyme |
| CONTACTO | University of Granada (UGR) | https://core.ugr.es/dinaten/, last access: 07/18/2022 | |
| DINATEN | University of Granada (UGR) | https://core.ugr.es/dinaten/, last access: 07/18/2022 | |
| Gastric lipase | Lipolytech | RGE15-1G | Enzyme |
| Human Serum Albumin | Sigma-Aldrich | 70024-90-7 | Emulsifier |
| INFOGEST | http://www.proteomics.ch/IVD/ | ||
| Lipase from porcine pancreas, type II | Sigma-Aldrich | L33126 | Enzyme |
| Magnesium metasilicate resins | Fluka | 1343-88-0 | Resins to purify oil |
| Micro 90 | International products | M-9051-04 | Cleaner |
| NaCl | Sigma | 7647-14-5 | Electrolyte |
| NaH2PO4 | Scharlau | 10049-21-5 | To prepare buffer |
| OCTOPUS | Producciones Científicas y Técnicas S.L. (Gójar, Spain) | Pendandt Drop Equipment implemented with multi subphase exchange | |
| Olive oil | Sigma-Aldrich | 1514 | oil |
| Pancreatic from porcine pancreas | Sigma | P7545-25 g | Enzyme |
| Pepsin | Sigma-Aldrich | P6887 | Enzyme |
| Pluronic F127 | Sigma | P2443 | Emulsifier |
| Pluronic F68 | Sigma | P1300 | Emulsfier |
| Sodium deoxycholate | Sigma | Bile salts | |
| Sodium glycodeoxycholate | Sigma | C9910 | Bile salts |
| Sodium taurocholate | Sigma | 86339 | Bile salts |
| Syringe Filter | Millex-DP | SLGP033R | Syringe Filter 0.22 µm pore size polyethersulfone |
| Trypsin | Sigma-Aldrich | T1426 | Enzyme |
参考文献
- McClements, D. J. The biophysics of digestion: Lipids. Current Opinion in Food Science. 21, 1-6 (2018).
- McClements, D. J., Li, Y. Structured emulsion-based delivery systems: Controlling the digestion and release of lipophilic food components. Advances in Colloid and Interface Science. 159 (2), 213-228 (2010).
- Corstens, M. N., et al. Food-grade micro-encapsulation systems that may induce satiety via delayed lipolysis: A review. Critical Reviews in Food Science and Nutrition. 57 (10), 2218-2244 (2017).
- Aguilera-Garrido, A., del Castillo-Santaella, T., Galisteo-González, F., Gálvez-Ruiz, M. J., Maldonado-Valderrama, J. Investigating the role of hyaluronic acid in improving curcumin bioaccessibility from nanoemulsions. Food Chemistry. 351, 129301(2021).
- Rodríguez Patino, J. M., Carrera Sánchez, C., Rodríguez Niño, M. R. Implications of interfacial characteristics of food foaming agents in foam formulations. Advances in Colloid and Interface Science. 140 (2), 95-113 (2008).
- Wilde, P. J., Chu, B. S. Interfacial & colloidal aspects of lipid digestion. Advances in Colloid and Interface Science. 165 (1), 14-22 (2011).
- Cabrerizo-Vílchez, M. A., Wege, H. A., Holgado-Terriza, J. A., Neumann, A. W. Axisymmetric drop shape analysis as penetration Langmuir balance. Review of Scientific Instruments. 70 (5), 2438-2444 (1999).
- Maldonado-Valderrama, J., Muros-Cobos, J. L., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Bile salts at the air-water interface: Adsorption and desorption. Colloids and surfaces B: Biointerfaces. 120, 176-183 (2014).
- Maldonado-Valderrama, J., Terriza, J. A. H., Torcello-Gómez, A., Cabrerizo-Vílchez, M. A. In vitro digestion of interfacial protein structures. Soft Matter. 9, 1043-1053 (2013).
- Maldonado-Valderrama, J. Probing in vitro digestion at oil-water interfaces. Current Opinion in Colloid and Interface Science. 39, 51-60 (2019).
- Brodkorb, A., et al. INFOGEST static in vitro simulation of gastrointestinal food digestion. Nature Protocols. 14 (4), 991-1014 (2019).
- del Castillo-Santaella, T., Maldonado-Valderrama, J., Molina-Bolivar, J. A., Galisteo-Gonzalez, F. Effect of cross-linker glutaraldehyde on gastric digestion of emulsified albumin. Colloids and Surfaces B: Biointerfaces. 145, 899-905 (2016).
- Macierzanka, A., Torcello-Gómez, A., Jungnickel, C., Maldonado-Valderrama, J. Bile salts in digestion and transport of lipids. Advances in Colloid and Interface Science. 274, 102045(2019).
- Maldonado-Valderrama, J., Torcello-Gómez, A., del Castillo-Santaella, T., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Subphase exchange experiments with the pendant drop technique. Advances in Colloid and Interface Science. 222, 488-501 (2015).
- Bellesi, F. A., Ruiz-Henestrosa, V. M. P., Maldonado-Valderrama, J., Del Castillo Santaella, T., Pilosof, A. M. R. Comparative interfacial in vitro digestion of protein and polysaccharide oil/water films. Colloids and Surfaces B: Biointerfaces. 161, 547-554 (2018).
- Del Castillo-Santaella, T., Sanmartín, E., Cabrerizo-Vílchez, M. A., Arboleya, J. C., Maldonado-Valderrama, J. Improved digestibility of β-lactoglobulin by pulsed light processing: A dilatational and shear study. Soft Matter. 10 (48), 9702-9714 (2014).
- Infantes-Garcia, M. R., et al. In vitro gastric lipid digestion of emulsions with mixed emulsifiers: Correlation between lipolysis kinetics and interfacial characteristics. Food Hydrocolloids. 128, 107576(2022).
- del Castillo-Santaella, T., Cebrián, R., Maqueda, M., Gálvez-Ruiz, M. J., Maldonado-Valderrama, J. Assessing in vitro digestibility of food biopreservative AS-48. Food Chemistry. 246, 249-257 (2018).
- Torcello-Gómez, A., Maldonado-Valderrama, J., Jódar-Reyes, A. B., Cabrerizo-Vílchez, M. A., Martín-Rodríguez, A. Pluronic-covered oil-water interfaces under simulated duodenal conditions. Food Hydrocolloids. 34, 54-61 (2014).
- Minekus, M., et al. A standardised static in vitro digestion method suitable for food - an international consensus. Food & Function. 5 (6), 1113-1124 (2014).
- Wege, H. A., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Development of a constant surface pressure penetration langmuir balance based on axisymmetric drop shape analysis. Journal of Colloid and Interface Science. 249 (2), 263-273 (2002).
- del Castillo-Santaella, T., et al. Hyaluronic acid and human/bovine serum albumin shelled nanocapsules: Interaction with mucins and in vitro digestibility of interfacial films. Food Chemistry. 383, 132330(2022).
- Aguilera-Garrido, A., et al. Applications of serum albumins in delivery systems: Differences in interfacial behaviour and interacting abilities with polysaccharides. Advances in Colloid and Interface Science. 290 (5), 102365(2021).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved