Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
In vitro Переваривание эмульсий в одной капле с помощью многофазного обмена моделируемых желудочно-кишечных жидкостей
В этой статье
Резюме
Подвесной баланс капельной поверхности пленки, реализованный с многофазным обменом, получившим название OCTOPUS, позволяет имитировать пищеварительные условия путем последовательного субфазного обмена исходного объемного раствора с моделируемыми желудочно-кишечными жидкостями. Моделируемое пищеварение in vitro контролируется путем регистрации in situ межфазного напряжения переваренного межфазного слоя.
Аннотация
Эмульсии в настоящее время используются для инкапсуляции и доставки питательных веществ и лекарств для лечения различных желудочно-кишечных заболеваний, таких как ожирение, обогащение питательными веществами, пищевая аллергия и заболевания пищеварительной системы. Способность эмульсии обеспечивать желаемую функциональность, а именно достигать определенного участка в желудочно-кишечном тракте, ингибировать/замедлять липолиз или облегчать усвояемость, в конечном итоге зависит от ее восприимчивости к ферментативной деградации в желудочно-кишечном тракте. В эмульсиях масло-в-воде липидные капли окружены межфазными слоями, где эмульгаторы стабилизируют эмульсию и защищают инкапсулированное соединение. Достижение индивидуальной усвояемости эмульсий зависит от их первоначального состава, но также требует мониторинга эволюции этих межфазных слоев, поскольку они подвергаются различным фазам желудочно-кишечного пищеварения. Подвесной баланс капельной поверхности, реализованный с многофазным обменом, позволяет моделировать переваривание эмульсий in vitro в одной водной капле, погруженной в масло, путем применения индивидуальной модели статического пищеварения. Транзит через желудочно-кишечный тракт имитируется субфазным обменом исходного капельного объемного раствора с искусственными средами, имитируя физиологические условия каждого отсека/стадии желудочно-кишечного тракта. Динамическая эволюция межфазного напряжения регистрируется in situ на протяжении всего моделируемого желудочно-кишечного пищеварения. Механические свойства переваренных интерфейсов, такие как межфазная дилатационная эластичность и вязкость, измеряются после каждой фазы пищеварения (пероральная, желудочная, тонкая кишка). Состав каждой пищеварительной среды может быть настроен с учетом особенностей пищеварительных состояний, включая желудочно-кишечные патологии и пищеварительные среды младенцев. Выявлены специфические межфазные механизмы, влияющие на протеолиз и липолиз, обеспечивающие инструменты для модуляции пищеварения с помощью межфазной инженерии эмульсий. Полученными результатами можно манипулировать для разработки новых пищевых матриц с индивидуальными функциональными возможностями, такими как низкая аллергенность, контролируемое потребление энергии и снижение усвояемости.
Введение
Понимание того, как переваривается жир, что включает в себя эмульсионное пищеварение, важно для рационального проектирования продуктов с индивидуальной функциональностью1. Субстратом для переваривания жира является эмульсия, так как жир эмульгируется при потреблении путем механического воздействия и смешивания с биоповерхностностями во рту и желудке. Кроме того, большая часть жира, потребляемого людьми, уже эмульгирована (например, молочные продукты), и в случае младенцев или некоторых пожилых людей это единственная форма потребления. Следовательно, дизайн продуктов на основе эмульсии с определенными профилями пищеварения очень важен в питании1. Кроме того, эмульсии могут инкапсулировать и доставлять питательные вещества, лекарства или липофильные биоактивныевещества 2 для лечения различных желудочно-кишечных заболеваний, таких как ожирение3, обогащение питательными веществами, пищевая аллергия и заболевания пищеварительной системы. В эмульсиях масло-вода липидные капли окружены межфазными слоями эмульгаторов, таких как белки, поверхностно-активные вещества, полимеры, частицы и смеси4. Роль эмульгаторов двояка: стабилизировать эмульсию5 и защитить/транспортировать инкапсулированное соединение к определенному участку. Достижение индивидуальной усвояемости эмульсий зависит от их исходного состава, но также требует мониторинга непрерывной эволюции этого интерфейса во время транзита через желудочно-кишечный тракт (рисунок 1).
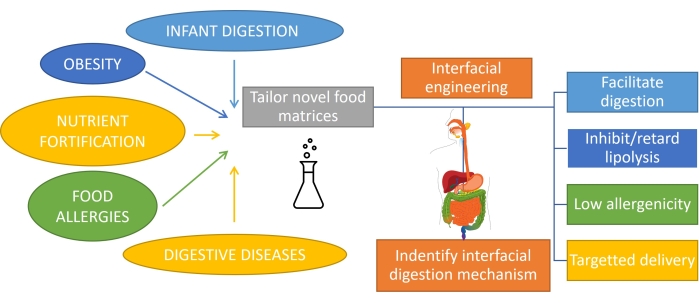
Рисунок 1: Применение межфазной инженерии эмульсий для борьбы с некоторыми из основных желудочно-кишечных заболеваний. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Переваривание липидов в конечном счете является межфазным процессом, поскольку оно требует адсорбции липаз (желудочных или панкреатических) на границе раздела масло-вода эмульгированных липидных капель через межфазный слой для достижения и гидролиза триглицеридов, содержащихся в масле, в свободные жирные кислоты и моноацилглицериды6. Схематизирована на рисунке 2. Желудочная липаза конкурирует с пепсином и фосфолипидами в желудке за границу раздела масло-вода (рисунок 2, желудочное пищеварение). Затем панкреатическая липаза / колипаза конкурируют с трипсином / химотрипсином, фосфолипидами, солями желчи и пищеварительными продуктами в тонком кишечнике. Протеазы могут изменять межфазный охват, предотвращая или способствуя адсорбции липазы, в то время как соли желчи очень активны на поверхности и вытесняют большую часть оставшегося эмульгатора для содействия адсорбции липазы (рисунок 2, кишечное пищеварение). В конце концов, скорость и степень липолиза зависят от межфазных свойств исходной/желудочной перевариваемой эмульсии, таких как толщина, межмолекулярные связи и электростатические и стерические взаимодействия. Соответственно, мониторинг эволюции межфазного слоя по мере его переваривания предлагает экспериментальную платформу для выявления межфазных механизмов и событий, влияющих на адсорбцию липазы и, следовательно, на переваривание липидов.
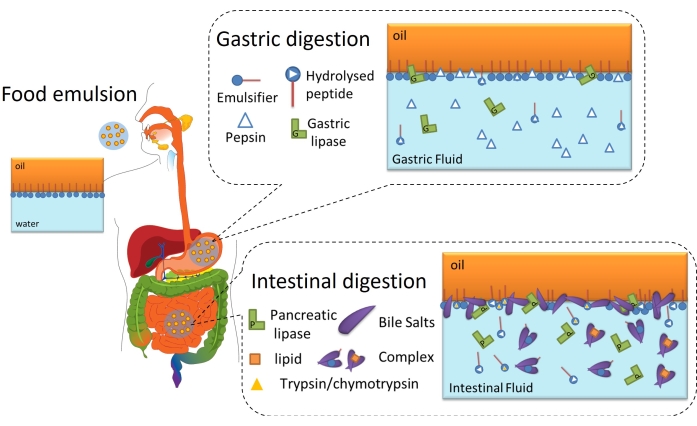
Рисунок 2: Принципиальная диаграмма, иллюстрирующая роль интерфейсов в желудочно-кишечном липидном переваривании. Гидролиз пепсина изменяет межфазный состав в желудочной фазе, в то время как желудочная липаза гидролизует триглицериды. В тонком кишечнике трипсин/химотрипсин дополнительно гидролизуют межфазную пленку, в то время как липолиз протекает путем адсорбции BS/липаз, гидролиза триглицеридов и десорбции липолитических продуктов путем солюбилизации в мицеллах/комплексе BS. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Подвесное капельное оборудование в Университете Гранады (UGR) реализовано с запатентованной технологией, коаксиальным двойным капилляром, что позволяет осуществлять субфазный обмен объемного раствора7. Капилляр, удерживающий подвесную каплю, состоит из расположения двух коаксиальных капилляров, которые независимо соединены с каждым каналом двойного микроинжектора. Каждый микроинжектор может работать независимо, что позволяет обмениваться сброшенным содержимым сквозным потоком7. Соответственно, субфазный обмен состоит из одновременного введения нового раствора с внутренним капилляром и экстракции объемного раствора с наружным капилляром с использованием той же скорости потока. Этот процесс позволяет заменить объемный раствор без нарушения межфазной области или объема капли. Позже эта процедура была модернизирована до многофазного обмена, который позволяет проводить до восьми последовательных подфазных обменов капельного объемного раствора8. Это позволяет моделировать пищеварительный процесс в одной водной капле, взвешенной в липидных средах, путем последовательного обмена объемным раствором с искусственными средами, имитирующими различные отсеки (рот, желудок, тонкая кишка). Вся установка представлена на рисунке 3, включая детали компонентов. Шприцы в микроинжекторе соединены с восемью клапанами, каждый из которых подключается к микроцентрифужной трубке, содержащей искусственную пищеварительную жидкость с компонентами, описанными на фиг.2.

Рисунок 3: Общий вид OCTOPUS со всеми компонентами. ПЗС-камера, микроскоп, микропозитор, термостабилизированная ячейка и двойной капилляр соединены независимо друг от друга с двойным микроинжектором с двумя шприцевыми шприцевыми, соединенными с восемью клапанами. Каждый шприц соединяется с капиллярами, четырьмя микроцентрифужными трубками с образцом и одним разрядом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
На рисунке 4А показано, как каждая из искусственных пищеварительных жидкостей вводится в подвесную каплю путем субфазного обмена через двойной капилляр. Каждое пищеварительное соединение, описанное на фиг.2 , может применяться одновременно/последовательно, имитируя прохождение через желудочно-кишечный тракт. Искусственные пищеварительные жидкости содержат различные ферменты и биозащищенные вещества, которые изменяют межфазное напряжение исходного эмульгатора, как схематизировано на рисунке 4B. Программное обеспечение DINATEN (см. Таблицу материалов), также разработанное в UGR, регистрирует эволюцию межфазного напряжения в режиме реального времени, когда начальный межфазный слой переваривается in vitro. Кроме того, после каждой пищеварительной фазы дилатационная эластичность межфазного слоя вычисляется путем наложения периодических колебаний объема/межфазной области на стабилизированный межфазный слой и регистрации реакции межфазного напряжения. Период/частота и амплитуда колебаний могут варьироваться, а обработка изображений с помощью программного обеспечения CONTACTO обеспечивает дилатационные реологические параметры8.
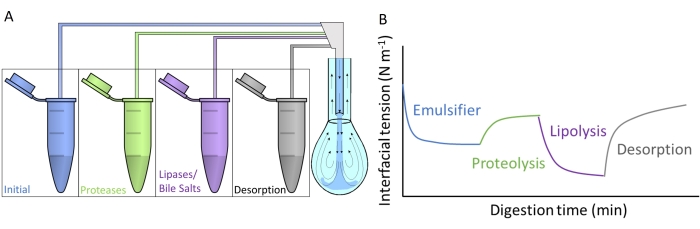
Рисунок 4: Примеры профилей пищеварения. (А) Исходный слой эмульгатора подвергают искусственной пищеварительной среде, помещенной в микроцентрифугу путем последовательного субфазного обмена различных растворов в подвесную каплю. (B) Общая эволюция межфазного напряжения (ось Y) исходного эмульгатора в зависимости от времени (ось x), когда он переваривается in vitro различными ферментами/биоповерхноводчиками в искусственных средах. Заключительный субфазный обмен с простой кишечной жидкостью измеряет десорбцию переваренного липида путем солюбилизации в смешанных мицеллах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
В данном исследовании представлен общий протокол, предназначенный для измерения in vitro переваривания межфазных слоев с помощью подвесного капельного оборудования9. Начальный межфазный слой подвергается последовательно условиям, имитирующим прохождение через желудочно-кишечный тракт, как показано на рисунке 2. Эти различные пищеварительные среды вводят в подвесную каплю путем субфазного обмена различных растворов, содержащихся в микроцентрифужных трубках (рисунок 4А). Состав этих сред может быть настроен в зависимости от желудочно-кишечных состояний, которые будут оцениваться, а именно желудочного / кишечного протеолиза / липолиза, что позволяет измерять кумулятивные эффекты и синергии10. Экспериментальные условия, используемые для имитации процесса пищеварения в каждом отсеке, соответствуют международному консенсусному протоколу, опубликованному INFOGEST, в котором подробно описывается рН и количество электролитов и ферментов11. Экспериментальное устройство на основе подвесного капли позволяет регистрировать межфазное натяжение in situ на протяжении всего моделируемого процесса пищеварения. Дилатационная реология межфазного слоя вычисляется в конце каждой пищеварительной стадии. Таким образом, каждый эмульгатор предлагает профиль пищеварения, иллюстрирующий свойства переваренных интерфейсов, как показано на рисунке 4B. Это позволяет извлекать выводы относительно его восприимчивости или устойчивости к различным стадиям пищеварительного процесса. В целом, искусственные пищеварительные среды содержат кислоту / основной рН, электролиты, протеазы (желудочные и кишечные), липазы (желудочные и кишечные), желчные соли и фосфолипиды, которые растворяются в соответствующих пищеварительных жидкостях (желудочных или кишечных). На рисунке 4B показан общий профиль эволюции межфазного напряжения эмульгатора, сначала подвергающегося протеазному действию, а затем липазы. В целом, протеолиз межфазного слоя способствует увеличению межфазного напряжения вследствие десорбции гидролизованных пептидов 9,12, в то время как липолиз приводит к очень резкому снижению межфазного напряжения за счет адсорбции желчных солей и липаз13. Заключительный субфазный обмен с кишечной жидкостью истощает объемный раствор нерассеянного/переваренного материала и способствует десорбции растворимых соединений и солюбилизации переваренных липидов в смешанных мицеллах. Это количественно определяется зарегистрированным увеличением межфазного напряжения (рисунок 4В).
Таким образом, экспериментальная конструкция, реализованная в подвесной капле для имитации переваривания in vitro в одной капле, позволяет измерять кумулятивные эффекты и синергизм, поскольку процесс пищеварения последовательно применяется к начальному межфазному слою10. Состав каждой пищеварительной среды может быть легко настроен с учетом особенностей пищеварительных состояний, включая желудочно-кишечные патологии или пищеварительные среды14 у младенцев. Затем идентификация межфазных механизмов, влияющих на протеолиз и липолиз, может быть использована для модуляции пищеварения путем межфазной инженерии эмульсий. Полученные результаты могут быть применены при разработке новых пищевых матриц с индивидуальными функциональными возможностями, такими как низкая аллергенность, контролируемое потребление энергии и снижение усвояемости 15,16,17,18,19.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Последовательность очистки всей стеклянной посуды, используемой в экспериментах по поверхностной науке
- Протрите стеклянную посуду концентрированным чистящим раствором (см. Таблицу материалов), разведенным в воде (10%).
- Тщательно промойте последовательностью водопроводной воды, пропанола, дистиллированной воды и сверхчистой воды. Высушите в кабине и храните в закрытом шкафу до использования.
2. Пробоподготовка
- Готовят искусственные пищеварительные среды в соответствии со стандартизированными протоколами INFOGEST11,20 (см. Таблицу материалов). Таблицу 1 и включить небольшие корректировки к требованиям межфазной работы по предотвращению поверхностно-активного загрязнения и разбавления образцов (1:10)10.
- Подготовьте раствор эмульгатора, выполнив следующие действия.
- Приготовить 0,01 л концентрированного раствора (1 кг· L−1) эмульгатор или смесь эмульгаторов (см. Таблицу материалов) в исходном буфере (таблица 1) и хранить при легком перемешивании в течение ночи.
- Разбавить до 0,1 кг· L−1 (или по мере необходимости) для насыщения интерфейса; достичь псевдоплановой позиции в межфазной напряженности после 1 ч адсорбции на постоянной межфазной площади вслед за ранее опубликованным докладом21.
- Хранить под легким перемешиванием в течение 15 мин перед применением.
- Очистите масляную фазу.
- Приготовить смесь растительного масла (подсолнечного, оливкового, триолеина и др.) и метасиликатные смолы магния (см. Таблицу материалов) в пропорции 2:1 w/w в большом стакане. Хранить при легком механическом перемешивании не менее 3 ч.
- Центрифугировать смесь при 8 000 х г в течение 30 мин при комнатной температуре в коммерческой центрифуге (см. Таблицу материалов).
- Фильтруйте масляную смесь под вакуумом шприцевым фильтром (размер пор 0,2 мкм) (см. Таблицу материалов). Хранить в чистых янтарных бутылках, запечатанных и пузырьков с азотом, до использования.
3. Калибровка и очистка OCTOPUS
- Промыть все трубки сверхчистой водой, установив последовательность очистки обоих шприцев и всех клапанов через капилляр (клапаны 6/4) и на внешний выход (клапан 8-синего цвета). Выполните это, нажав кнопку очистки в левом диалоговом окне (дополнительный рисунок 1A).
- Проверьте поверхностное натяжение7 воды комнатной температуры, сформировав каплю воды и измерив в режиме реального времени в течение 5 мин (Дополнительный рисунок 1В, С).
- Установка дифференциальной плотности на воздух-вода (0,9982 кг· L−1) в левом диалоговом окне, дополнительный рисунок 1B.
- Наполните чистую кювету (оптическое стекло) 0,002 л чистого растительного масла и поместите его в держатель кюветы в термостатической ячейке (рисунок 3).
- Установите термостат и обеспечьте температурное равновесие при 37 °C.
- Проверьте межфазное натяжение воды-масла при комнатной температуре7.
- Установите дифференциальную плотность на растительное масло-воду (оливковое масло: 0.800 кг· L−1) (дополнительный рисунок 1с).
- Вводят 40 мкл со скоростью 0,5 мкл·с−1 и измеряют в режиме реального времени каждую секунду до окончания инъекции. Это простой динамический процесс (дополнительный рисунок 1B, D).
- График межфазного напряжения в зависимости от объема капель в техническом паспорте.
- Убедитесь, что диапазон объема капель обеспечивает значение межфазного натяжения независимо от объема капли. График межфазной области в зависимости от объема капель.
- Запрограммируйте процесс, содержащий два этапа (дополнительный рисунок 1B и дополнительный рисунок 2A), следуя приведенным ниже шагам.
- С помощью внутреннего шприца вводите объем, содержащийся в этом диапазоне постоянного межфазного напряжения.
- Поддерживайте константу межфазной площади на значении, выбранном на шаге 3.5.4, и регистрируйте межфазное напряжение в течение 5 мин7.
4. Программирование одного экспериментального процесса в DINATEN для каждой пищеварительной стадии
ПРИМЕЧАНИЕ: Параметры процесса см. в дополнительном рисунке 1B.
- Выполните начальный элемент управления.
- Для образования капель вводят 10 мкл (±5 мкл) раствора эмульгатора в капилляр (клапан 6) (дополнительный рисунок 2А).
- Регистрируют адсорбцию на постоянной межфазной площади21 20мм2 (±10мм2) в течение 1 ч (дополнительный рисунок 2В).
- Запишите дилатационную реологию8 (Дополнительный рисунок 2С).
- Установите амплитуду колебаний на 1,25 мкл, период 10 с.
- Запишите адсорбцию в выбранной межфазной зоне (этап 4.1.2) в течение 10 с.
- Повторите шаг 4.1.3 на разных периодах: 5 с, 20 с, 50 с и 100 с.
- Запись желудочного пищеварения.
- Запись адсорбции21 на выбранной межфазной площади в течение 10 с.
- Субфазный обмен7 с жидкостью в клапане 2 (sSGF) и желудочными ферментами (таблица 1) (дополнительный рисунок 2D).
- Заполните левый шприц от клапана 2. Вводят 125 мкл в клапан 6-капиллярный с левым шприцем при 5 мкл·с−1.
- Экстрагировать 125 мкл из капилляра правым шприцем при 5 мкл·с−1. Выгрузите правый шприц к выходному клапану 8. Повторите шаги 4.2.2.1-4.2.2.2 10 раз, чтобы обеспечить полный обмен.
- Регистрировать адсорбцию21 в выбранной межфазной зоне на этапе 4.1.2 в течение 1 ч (дополнительный рисунок 2В).
- Запишите дилатационную реологию8 (Дополнительный рисунок 2С).
- Установите амплитуду колебаний на 1,25 мкл, период 10 с.
- Запишите адсорбцию выбранной межфазной области на этапе 4.1.2 в течение 10 с. Повторяют в разные периоды: 5 с, 20 с, 50 с, 100 с.
- Запись кишечного пищеварения.
- Запишите адсорбцию21 в выбранной межфазной зоне на этапе 4.1.2 в течение 10 с (дополнительный рисунок 2В).
- Субфазный обмен7 с жидкостью в клапане 3 (sSIF) и кишечными ферментами/солями желчи/фосфолипидами (таблица 1) (дополнительный рисунок 2D).
- Заполните левый шприц от клапана 2. Вводят 125 мкл в клапан 6-капиллярный с левым шприцем при 5 мкл·с−1. Экстрагировать 125 мкл из капилляра правым шприцем при 5 мкл·с−1.
- Выгрузите правый шприц к выходному клапану 8. Повторите шаги 4.3.2.1-4.3.2.2 10 раз, чтобы обеспечить полный обмен.
- Запишите адсорбцию21 в выбранной межфазной зоне на этапе 4.1.2 в течение 1 ч.
- Запишите дилатационную реологию8 (Дополнительный рисунок 2С).
- Установите амплитуду колебаний на 1,25 мкл, период 10 с.
- Запишите адсорбцию в выбранной межфазной зоне на этапе 4.1.2 в течение 10 с.
- Повторяют в разные периоды: 5 с, 20 с, 50 с, 100 с.
- Запишите описание, выполнив следующие действия.
- Запишите адсорбцию21 в выбранной межфазной зоне на этапе 4.1.2 в течение 10 с (дополнительный рисунок 2В).
- Подфазный обмен7 с жидкостью в клапане 5 (sSIF) (таблица 1, дополнительный рисунок 2D).
- Заполните левый шприц от клапана 5. Вводят 125 мкл в клапан 5-капилляр левым шприцем при 5 мкл·с−1.
- Экстрагировать 125 мкл из капилляра правым шприцем при 5 мкл·с−1. Выгрузите правый шприц к выходному клапану 8. Повторите шаги 4.4.2.1-4.4.2.2 10 раз, чтобы обеспечить полный обмен.
- Регистрировать адсорбцию21 в выбранной межфазной зоне на этапе 4.1.2 в течение 1 ч (дополнительный рисунок 2В).
- Запишите дилатационную реологию8 (Дополнительный рисунок 2С).
- Поддерживать амплитуду 1,25 мкл, период 10 с.
- Запишите адсорбцию в выбранной межфазной зоне на этапе 4.1.2 в течение 10 с.
- Повторите шаг 4.4.4 на разных периодах: 5 с, 20 с, 50 с, 100 с.
5. Настройка эксперимента
- Заполните микроцентрифужные трубки искусственной средой пищеварения и подключите каждую из них к соответствующему клапану соответствующей трубкой.
- Заполните трубку в клапанах 2-5 путем очистки от клапана 2, клапана 3, клапана 4 и клапана 5 до внешнего выхода (клапан 8) (дополнительный рисунок 1A).
- Заполните трубку в клапане 1 путем очистки от клапана 1 до клапана 6-капиллярного 5 раз.
- Поместите капилляр в масляную фазу. Нагрузите левый шприц клапаном 1 (исходный раствор, табл. 1).
- Начните последовательную обработку этапа 4.1 - начальная, стадия 4.2 - желудочная, стадия 4.3 - кишечник и стадия 4.4 - десорбция, сохраняя данные в конце каждого процесса.
6. Расчет дилатационных реологических параметров с помощью программного обеспечения для обработки изображений CONTACTO8
ПРИМЕЧАНИЕ: Для получения дополнительной информации см. Maldonado-Valderrama et al.8.
- Загрузите изображения, соответствующие площади колебаний на заданной частоте и амплитуде (дополнительный рисунок 3А).
- Нажмите «Реология» (дополнительный рисунок 3B) и получите дилатационные параметры (дополнительный рисунок 3C).
- Скопируйте и вставьте результаты в таблицу данных.
7. Построение экспериментальных результатов
- Пересчитайте столбец времени на каждом из этапов процесса пищеварения, добавив последние данные времени предыдущего шага.
- График межфазного напряжения и аддитивного времени для каждого из этапов используемого процесса пищеварения.
- График конечного межфазного напряжения/дилатационной эластичности и вязкости, полученных в конце каждой стадии, по сравнению с фазой пищеварения: начальное, желудочное сбраживание, двенадцатиперстное пищеварение и десорбция.
Access restricted. Please log in or start a trial to view this content.
Результаты
В этом разделе приведены различные примеры профилей пищеварения, измеренных с помощью OCTOPUS. Общий вид моделируемого профиля пищеварения показан на рисунке 4B. Межфазное напряжение обычно представлено со временем в профиле пищеварения. Различные рассматриваемые фазы/ст...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В этой статье описывается обобщенный протокол измерения in vitro переваривания межфазных слоев с помощью подвесного капельного оборудования. Протокол может быть адаптирован к конкретным требованиям эксперимента путем настройки состава пищеварительных буферов, которые основаны на...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют, что у них нет известных конкурирующих финансовых интересов или личных отношений, которые могли бы повлиять на работу, о которой сообщается в этой статье.
Благодарности
Это исследование финансировалось проектами RTI2018-101309-B-C21 и PID2020-631-116615RAI00, финансируемыми MCIN/AEI/10.13039/501100011033 и «ERDF Способ создания Европы». Эта работа была (частично) поддержана Группой по физике биоколлоидов и жидкостей (ref. PAI-FQM115) Университета Гранады (Испания).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Alpha-chymotrypsin from bovine pancreas | Sigma-Aldrich | C4129 | Enzyme |
| Beta-lactoglobulin | Sigma-Aldrich | L0130 | Emulsfier |
| Bovine Serum Albumin | Sigma-Aldrich | 9048-46-8 | Emulsfier |
| CaCl2 | Sigma-Aldrich | 10043-52-4 | Electrolyte |
| Centrifuge | Kronton instruments | Centrikon T-124 | For separating oil and resins |
| Citrus pectin | Sigma-Aldrich | P9135 | Emulsfier |
| co-lipase FROM PORCINE PANCREAS | Sigma | C3028 | Enzyme |
| CONTACTO | University of Granada (UGR) | https://core.ugr.es/dinaten/, last access: 07/18/2022 | |
| DINATEN | University of Granada (UGR) | https://core.ugr.es/dinaten/, last access: 07/18/2022 | |
| Gastric lipase | Lipolytech | RGE15-1G | Enzyme |
| Human Serum Albumin | Sigma-Aldrich | 70024-90-7 | Emulsifier |
| INFOGEST | http://www.proteomics.ch/IVD/ | ||
| Lipase from porcine pancreas, type II | Sigma-Aldrich | L33126 | Enzyme |
| Magnesium metasilicate resins | Fluka | 1343-88-0 | Resins to purify oil |
| Micro 90 | International products | M-9051-04 | Cleaner |
| NaCl | Sigma | 7647-14-5 | Electrolyte |
| NaH2PO4 | Scharlau | 10049-21-5 | To prepare buffer |
| OCTOPUS | Producciones Científicas y Técnicas S.L. (Gójar, Spain) | Pendandt Drop Equipment implemented with multi subphase exchange | |
| Olive oil | Sigma-Aldrich | 1514 | oil |
| Pancreatic from porcine pancreas | Sigma | P7545-25 g | Enzyme |
| Pepsin | Sigma-Aldrich | P6887 | Enzyme |
| Pluronic F127 | Sigma | P2443 | Emulsifier |
| Pluronic F68 | Sigma | P1300 | Emulsfier |
| Sodium deoxycholate | Sigma | Bile salts | |
| Sodium glycodeoxycholate | Sigma | C9910 | Bile salts |
| Sodium taurocholate | Sigma | 86339 | Bile salts |
| Syringe Filter | Millex-DP | SLGP033R | Syringe Filter 0.22 µm pore size polyethersulfone |
| Trypsin | Sigma-Aldrich | T1426 | Enzyme |
Ссылки
- McClements, D. J. The biophysics of digestion: Lipids. Current Opinion in Food Science. 21, 1-6 (2018).
- McClements, D. J., Li, Y. Structured emulsion-based delivery systems: Controlling the digestion and release of lipophilic food components. Advances in Colloid and Interface Science. 159 (2), 213-228 (2010).
- Corstens, M. N., et al. Food-grade micro-encapsulation systems that may induce satiety via delayed lipolysis: A review. Critical Reviews in Food Science and Nutrition. 57 (10), 2218-2244 (2017).
- Aguilera-Garrido, A., del Castillo-Santaella, T., Galisteo-González, F., Gálvez-Ruiz, M. J., Maldonado-Valderrama, J. Investigating the role of hyaluronic acid in improving curcumin bioaccessibility from nanoemulsions. Food Chemistry. 351, 129301(2021).
- Rodríguez Patino, J. M., Carrera Sánchez, C., Rodríguez Niño, M. R. Implications of interfacial characteristics of food foaming agents in foam formulations. Advances in Colloid and Interface Science. 140 (2), 95-113 (2008).
- Wilde, P. J., Chu, B. S. Interfacial & colloidal aspects of lipid digestion. Advances in Colloid and Interface Science. 165 (1), 14-22 (2011).
- Cabrerizo-Vílchez, M. A., Wege, H. A., Holgado-Terriza, J. A., Neumann, A. W. Axisymmetric drop shape analysis as penetration Langmuir balance. Review of Scientific Instruments. 70 (5), 2438-2444 (1999).
- Maldonado-Valderrama, J., Muros-Cobos, J. L., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Bile salts at the air-water interface: Adsorption and desorption. Colloids and surfaces B: Biointerfaces. 120, 176-183 (2014).
- Maldonado-Valderrama, J., Terriza, J. A. H., Torcello-Gómez, A., Cabrerizo-Vílchez, M. A. In vitro digestion of interfacial protein structures. Soft Matter. 9, 1043-1053 (2013).
- Maldonado-Valderrama, J. Probing in vitro digestion at oil-water interfaces. Current Opinion in Colloid and Interface Science. 39, 51-60 (2019).
- Brodkorb, A., et al. INFOGEST static in vitro simulation of gastrointestinal food digestion. Nature Protocols. 14 (4), 991-1014 (2019).
- del Castillo-Santaella, T., Maldonado-Valderrama, J., Molina-Bolivar, J. A., Galisteo-Gonzalez, F. Effect of cross-linker glutaraldehyde on gastric digestion of emulsified albumin. Colloids and Surfaces B: Biointerfaces. 145, 899-905 (2016).
- Macierzanka, A., Torcello-Gómez, A., Jungnickel, C., Maldonado-Valderrama, J. Bile salts in digestion and transport of lipids. Advances in Colloid and Interface Science. 274, 102045(2019).
- Maldonado-Valderrama, J., Torcello-Gómez, A., del Castillo-Santaella, T., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Subphase exchange experiments with the pendant drop technique. Advances in Colloid and Interface Science. 222, 488-501 (2015).
- Bellesi, F. A., Ruiz-Henestrosa, V. M. P., Maldonado-Valderrama, J., Del Castillo Santaella, T., Pilosof, A. M. R. Comparative interfacial in vitro digestion of protein and polysaccharide oil/water films. Colloids and Surfaces B: Biointerfaces. 161, 547-554 (2018).
- Del Castillo-Santaella, T., Sanmartín, E., Cabrerizo-Vílchez, M. A., Arboleya, J. C., Maldonado-Valderrama, J. Improved digestibility of β-lactoglobulin by pulsed light processing: A dilatational and shear study. Soft Matter. 10 (48), 9702-9714 (2014).
- Infantes-Garcia, M. R., et al. In vitro gastric lipid digestion of emulsions with mixed emulsifiers: Correlation between lipolysis kinetics and interfacial characteristics. Food Hydrocolloids. 128, 107576(2022).
- del Castillo-Santaella, T., Cebrián, R., Maqueda, M., Gálvez-Ruiz, M. J., Maldonado-Valderrama, J. Assessing in vitro digestibility of food biopreservative AS-48. Food Chemistry. 246, 249-257 (2018).
- Torcello-Gómez, A., Maldonado-Valderrama, J., Jódar-Reyes, A. B., Cabrerizo-Vílchez, M. A., Martín-Rodríguez, A. Pluronic-covered oil-water interfaces under simulated duodenal conditions. Food Hydrocolloids. 34, 54-61 (2014).
- Minekus, M., et al. A standardised static in vitro digestion method suitable for food - an international consensus. Food & Function. 5 (6), 1113-1124 (2014).
- Wege, H. A., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Development of a constant surface pressure penetration langmuir balance based on axisymmetric drop shape analysis. Journal of Colloid and Interface Science. 249 (2), 263-273 (2002).
- del Castillo-Santaella, T., et al. Hyaluronic acid and human/bovine serum albumin shelled nanocapsules: Interaction with mucins and in vitro digestibility of interfacial films. Food Chemistry. 383, 132330(2022).
- Aguilera-Garrido, A., et al. Applications of serum albumins in delivery systems: Differences in interfacial behaviour and interacting abilities with polysaccharides. Advances in Colloid and Interface Science. 290 (5), 102365(2021).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены