É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
In vitro Digestão de emulsões em uma única gotícula via troca multifásica de fluidos gastrointestinais simulados
Neste Artigo
Resumo
Um balanço de filme de superfície de gota pendente implementado com uma troca multi-subfase, apelidada de OCTOPUS, permite imitar condições digestivas pela troca subfásica sequencial da solução a granel original com fluidos gastrointestinais simulados. A digestão in vitro simulada é monitorada registrando in situ a tensão interfacial da camada interfacial digerida.
Resumo
As emulsões estão sendo usadas atualmente para encapsular e fornecer nutrientes e medicamentos para combater diferentes condições gastrointestinais, como obesidade, fortificação de nutrientes, alergias alimentares e doenças digestivas. A capacidade de uma emulsão de fornecer a funcionalidade desejada, ou seja, atingir um local específico dentro do trato gastrointestinal, inibir / retardar a lipólise ou facilitar a digestibilidade, depende em última análise de sua suscetibilidade à degradação enzimática no trato gastrointestinal. Em emulsões de óleo em água, as gotículas lipídicas são cercadas por camadas interfaciais, onde os emulsificantes estabilizam a emulsão e protegem o composto encapsulado. Alcançar uma digestibilidade personalizada das emulsões depende de sua composição inicial, mas também requer o monitoramento da evolução dessas camadas interfaciais, pois elas são submetidas a diferentes fases da digestão gastrointestinal. Um balanço de filme de superfície de gota pendente implementado com uma troca multi-subfásica permite simular a digestão in vitro de emulsões em uma única gota aquosa imersa em óleo, aplicando um modelo de digestão estática personalizado. O trânsito através do trato gastrointestinal é imitado pela troca subfásica da solução original em massa de gotículas com meios artificiais, imitando as condições fisiológicas de cada compartimento/etapa do trato gastrointestinal. A evolução dinâmica da tensão interfacial é registrada in situ ao longo de toda a digestão gastrointestinal simulada. As propriedades mecânicas das interfaces digeridas, como elasticidade dilatacional interfacial e viscosidade, são medidas após cada fase de digestão (oral, gástrica, intestino delgado). A composição de cada meio digestivo pode ser ajustada para explicar as particularidades das condições digestivas, incluindo patologias gastrointestinais e meios digestivos infantis. Os mecanismos interfaciais específicos que afetam a proteólise e a lipólise são identificados, fornecendo ferramentas para modular a digestão pela engenharia interfacial de emulsões. Os resultados obtidos podem ser manipulados para projetar novas matrizes alimentares com funcionalidades personalizadas, como baixa alergenicidade, ingestão controlada de energia e diminuição da digestibilidade.
Introdução
Entender como a gordura é digerida, o que envolve a digestão em emulsão, é importante para projetar racionalmente produtos com funcionalidade personalizada1. O substrato para a digestão de gordura é uma emulsão, uma vez que a gordura é emulsionada após o consumo por ação mecânica e mistura com biossurfactantes na boca e no estômago. Além disso, a maior parte da gordura consumida pelos seres humanos já é emulsionada (como produtos lácteos) e, no caso de bebês ou alguns idosos, essa é a única forma de consumo. Assim, o design de produtos à base de emulsão com perfis de digestão específicos é muito importante na nutrição1. Além disso, as emulsões podem encapsular e fornecer nutrientes, medicamentos ou bioativos lipofílicos2 para lidar com diferentes condições gastrointestinais, como obesidade3, fortificação de nutrientes, alergias alimentares e doenças digestivas. Nas emulsões de óleo em água, as gotículas lipídicas são cercadas por camadas interfaciais de emulsificantes, como proteínas, surfactantes, polímeros, partículas e misturas4. O papel dos emulsificantes é duplo: estabilizar a emulsão5 e proteger/transportar o composto encapsulado para um local específico. A obtenção de uma digestibilidade personalizada das emulsões depende de sua composição inicial, mas também requer o monitoramento da evolução contínua dessa interface durante o trânsito pelo trato gastrointestinal (Figura 1).
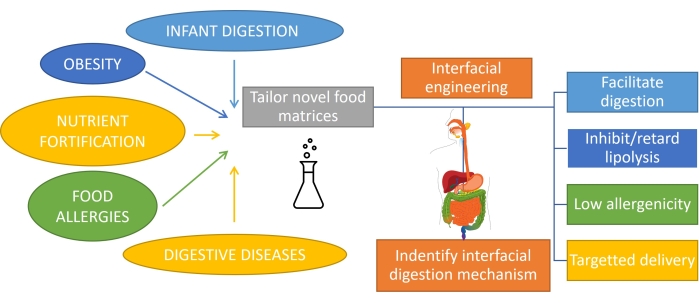
Figura 1: Aplicando engenharia interfacial de emulsões para lidar com algumas das principais condições gastrointestinais. Clique aqui para ver uma versão maior desta figura.
A digestão lipídica é, em última análise, um processo interfacial, pois requer a adsorção de lipases (gástricas ou pancreáticas) na interface óleo-água de gotículas lipídicas emulsionadas através da camada interfacial para alcançar e hidrolisar os triglicerídeos contidos no óleo em ácidos graxos livres e monoacilglicerídeos6. Isso está esquematizado na Figura 2. A lipase gástrica compete com a pepsina e os fosfolipídios no estômago pela interface óleo-água (Figura 2, digestão gástrica). Em seguida, a lipase/colipase pancreática compete com tripsina/quimotripsina, fosfolipídios, sais biliares e produtos digestivos no intestino delgado. As proteases podem alterar a cobertura interfacial, prevenindo ou favorecendo a adsorção da lipase, enquanto os sais biliares são altamente ativos superficiais e deslocam a maior parte do emulsificante restante para promover a adsorção da lipase (Figura 2, digestão intestinal). Eventualmente, a taxa e a extensão da lipólise dependem das propriedades interfaciais da emulsão digerida inicial/gástrica, como a espessura, as conexões inter/intramoleculares e as interações eletrostáticas e estéricas. Assim, o monitoramento da evolução da camada interfacial à medida que é digerida oferece uma plataforma experimental para identificar mecanismos e eventos interfaciais que afetam a adsorção da lipase e, portanto, a digestão lipídica.
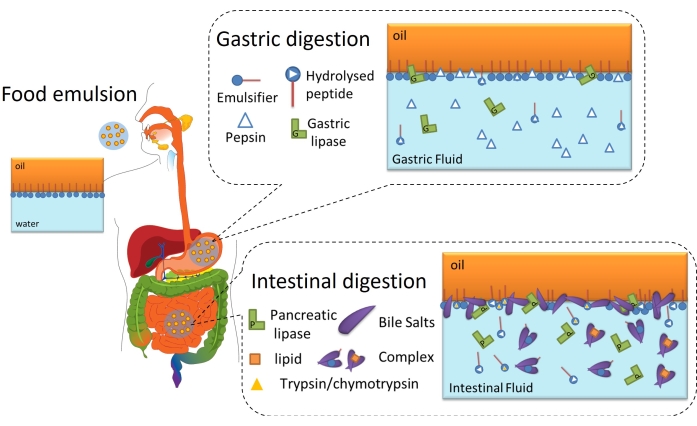
Figura 2: Diagrama esquemático ilustrando o papel das interfaces na digestão lipídica gastrointestinal. A hidrólise da pepsina altera a composição interfacial na fase gástrica, enquanto a lipase gástrica hidrolisa os triglicerídeos. No intestino delgado, a tripsina/quimotripsina hidrolisa ainda mais o filme interfacial, enquanto a lipólise prossegue pela adsorção de BS/lipases, pela hidrólise de triglicerídeos e pela dessorção de produtos lipolíticos por solubilização nas micelas/complexo BS. Por favor, clique aqui para ver uma versão maior desta figura.
O equipamento de gota de pingente da Universidade de Granada (UGR) é implementado com uma tecnologia patenteada, o duplo capilar coaxial, que permite a troca subfásica da solução a granel7. O capilar, que contém a gota do pingente, consiste em um arranjo de dois capilares coaxiais que são conectados independentemente a cada canal de um microinjetor duplo. Cada microinjetor pode operar de forma independente, permitindo a troca do conteúdo caído pelo fluxo7. Assim, a troca subfásica consiste na injeção simultânea da nova solução com o capilar interno e na extração da solução a granel com o capilar externo usando a mesma taxa de fluxo. Este processo permite a substituição da solução a granel sem perturbação da área interfacial ou do volume da gota. Este procedimento foi posteriormente atualizado para uma troca multi-subfase, que permite até oito trocas subfásicas sequenciais da solução a granel de gotículas8. Isso permite a simulação do processo digestivo em uma única gota aquosa suspensa em meio lipídico, trocando sequencialmente a solução a granel por meios artificiais imitando os diferentes compartimentos (boca, estômago, intestino delgado). Toda a configuração é representada na Figura 3, incluindo os detalhes dos componentes. As seringas do microinjetor são conectadas às oito válvulas vias, cada uma conectando-se a um tubo de microcentrífuga contendo o fluido digestivo artificial com componentes descritos na Figura 2.

Figura 3: Visão geral do OCTOPUS com todos os componentes. A câmera CCD, o microscópio, o microposicionador, a célula termoestabilizada e o capilar duplo foram conectados independentemente a um microinjetor duplo com duas seringas conectadas a oito válvulas vias. Cada seringa se conecta com capilares, quatro tubos de microcentrífuga com amostra e uma descarga. Por favor, clique aqui para ver uma versão maior desta figura.
A Figura 4A mostra como cada um dos fluidos digestivos artificiais é injetado na gota pendente por troca de subfases através do duplo capilar. Cada composto digestivo detalhado na Figura 2 pode ser aplicado simultaneamente/sequencialmente, simulando a passagem pelo trato gastrointestinal. Os fluidos digestivos artificiais contêm diferentes enzimas e biossurfactantes, que alteram a tensão interfacial do emulsificante inicial, conforme esquematizado na Figura 4B. O software DINATEN (ver Tabela de Materiais), também desenvolvido na UGR, registra a evolução da tensão interfacial em tempo real à medida que a camada interfacial inicial é digerida in vitro. Além disso, após cada fase digestiva, a elasticidade dilatacional da camada interfacial é calculada impondo oscilações periódicas de volume/área interfacial na camada interfacial estabilizada e registrando a resposta da tensão interfacial. O período/frequência e a amplitude da oscilação podem ser variados, e o processamento da imagem com o software CONTACTO fornece os parâmetros reológicos dilatacionais8.
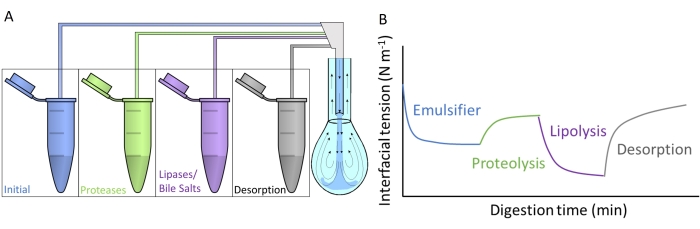
Figura 4: Exemplos de perfis de digestão . (A) A camada emulsificante inicial é submetida a meio digestivo artificial colocado na microcentrífuga por troca subfásica sequencial das diferentes soluções na gota pendente. (B) A evolução geral da tensão interfacial (eixo y) do emulsionante inicial em função do tempo (eixo x) à medida que é digerido in vitro pelas várias enzimas/biossurfactantes nos meios artificiais. Uma troca subfásica final com fluido intestinal simples mede a dessorção de lipídios digeridos por solubilização em micelas mistas. Por favor, clique aqui para ver uma versão maior desta figura.
Este estudo apresenta o protocolo geral desenhado para medir a digestão in vitro de camadas interfaciais com equipamento de gota pendente9. A camada interfacial inicial é submetida sequencialmente a condições que imitam a passagem pelo trato gastrointestinal, conforme ilustrado na Figura 2. Esses diferentes meios digestivos são injetados na gota pendente por troca subfásica das diferentes soluções contidas nos tubos de microcentrífuga (Figura 4A). A composição desses meios pode ser personalizada dependendo das condições gastrointestinais que serão avaliadas, a saber, proteólise/lipólise gástrica/intestinal, permitindo mensurar efeitos cumulativos e sinergias10. As condições experimentais utilizadas para mimetizar o processo de digestão em cada compartimento seguem o protocolo de consenso internacional publicado pelo INFOGEST detalhando o pH e as quantidades de eletrólitos e enzimas11. O dispositivo experimental baseado na gota pendente permite o registro da tensão interfacial in situ durante todo o processo de digestão simulado. A reologia dilatacional da camada interfacial é calculada no final de cada etapa digestiva. Dessa forma, cada emulsificante oferece um perfil de digestão que ilustra as propriedades das interfaces digeridas, conforme ilustrado na Figura 4B. Isso permite a extração de conclusões sobre sua suscetibilidade ou resistência às diferentes etapas do processo digestivo. Em geral, o meio digestivo artificial contém pH ácido/básico, eletrólitos, proteases (gástricas e intestinais), lipases (gástricas e intestinais), sais biliares e fosfolipídios, que são dissolvidos em seus respectivos fluidos digestivos (gástrico ou intestinal). A Figura 4B mostra um perfil genérico da evolução da tensão interfacial de um emulsificante, primeiro submetido à ação da protease, seguido pelas lipases. Em geral, a proteólise da camada interfacial promove um aumento da tensão interfacial devido à dessorção de peptídeos hidrolisados9,12, enquanto a lipólise resulta em uma redução muito acentuada da tensão interfacial devido à adsorção de sais biliares e lipases 13. Uma troca subfásica final com o fluido intestinal esgota a solução a granel de material não adsorvido/digerido e promove a dessorção de compostos solúveis e a solubilização de lipídios digeridos em micelas mistas. Isso é quantificado pelo aumento da tensão interfacial registrada (Figura 4B).
Em resumo, o delineamento experimental implementado na gota pendente para simular a digestão in vitro em uma única gota permite medir efeitos cumulativos e sinergias à medida que o processo de digestão é aplicado sequencialmente à camada interfacial inicial10. A composição de cada meio digestivo pode ser facilmente ajustada para dar conta das particularidades das condições digestivas, incluindo patologias gastrointestinais ou meios digestivos infantis14. Em seguida, a identificação dos mecanismos interfaciais que afetam a proteólise e a lipólise pode ser usada para modular a digestão pela engenharia interfacial de emulsões. Os resultados obtidos podem ser aplicados no desenho de novas matrizes alimentares com funcionalidades sob medida, como baixa alergenicidade, ingestão controlada de energia e digestibilidade diminuída 15,16,17,18,19.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Sequência de limpeza para todos os artigos de vidro utilizados na experimentação da ciência da superfície
- Esfregue os copos com uma solução de limpeza concentrada (ver Tabela de Materiais) diluída em água (10%).
- Enxágue bem com uma sequência de água da torneira, propanol, água destilada e água ultrapura. Seque em uma cabine e armazene em um armário fechado até o uso.
2. Preparação da amostra
- Preparar meios digestivos artificiais de acordo com os protocolos padronizados do INFOGEST11,20 (ver Tabela de Materiais). Para mais pormenores, ver Quadro 1 e incluir pequenas adaptações aos requisitos do trabalho interfacial para evitar a contaminação por superfície ativa e a diluição das amostras (1:10)10.
- Prepare a solução emulsificante seguindo as etapas abaixo.
- Preparar 0,01 L de uma solução concentrada de (1 kg· L−1) emulsionante ou uma mistura de emulsionantes (ver Tabela de Materiais) num tampão inicial (Tabela 1) e manter sob agitação ligeira durante a noite.
- Diluir até 0,1 kg· L−1 (ou conforme necessário) para saturar a interface; atingir um pseudoplatô na tensão interfacial após 1 h de adsorção em uma área interfacial constante seguindo o relato publicado anteriormente21.
- Mantenha sob agitação leve por 15 minutos antes do uso.
- Purificar a fase de óleo.
- Prepare uma mistura de óleo vegetal (girassol, azeitona, trioleína, etc.) e resinas de metassilicato de magnésio (ver Tabela de Materiais) numa proporção de 2:1 p/p num copo grande. Manter sob agitação mecânica suave por pelo menos 3 h.
- Centrifugar a mistura a 8.000 x g durante 30 min à temperatura ambiente numa centrífuga comercial (ver Tabela de Materiais).
- Filtrar a mistura de óleo sob vácuo com um filtro de seringa (tamanho de poro de 0,2 μm) (ver Tabela de Materiais). Armazenar em frascos de âmbar limpos selados e borbulhados com nitrogênio até o uso.
3. Calibração e limpeza do OCTOPUS
- Enxaguar toda a tubulação com água ultrapura, definindo uma sequência de limpeza de ambas as seringas e todas as válvulas através de um capilar (válvulas 6/4) e para a saída externa (válvula de cor 8-azul). Execute isso pressionando o botão limpar na caixa de diálogo à esquerda (Figura 1A Suplementar).
- Verifique a tensão superficial7 da água à temperatura ambiente, formando uma gota de água e medindo em tempo real por 5 min (Figura suplementar 1B, C).
- Ajuste a densidade diferencial para ar-água (0,9982 kg· L−1) na caixa de diálogo esquerda, Figura suplementar 1B.
- Encha a cubeta limpa (vidro óptico) com 0,002 L de óleo vegetal limpo e coloque-a no suporte da cubeta na célula termostática (Figura 3).
- Ajuste o termostato e permita o equilíbrio da temperatura a 37 °C.
- Verifique a tensão interfacial da água-óleo à temperatura ambiente7.
- Defina a densidade diferencial para óleo-água vegetal (azeite: 0.800 kg· L−1) (Figura 1C Suplementar).
- Injete 40 μL a uma taxa de 0,5 μL·s−1 e meça em tempo real a cada segundo até o final da injeção. Este é um processo dinâmico simples (Figura 1B, D suplementar).
- Plote a tensão interfacial em função do volume de gotículas em uma folha de dados.
- Verifique se a faixa de volume da gota fornece um valor para a tensão interfacial independente do volume da gota. Plote a área interfacial em função do volume das gotículas.
- Programe um processo contendo duas etapas (Figura 1B Suplementar e Figura 2A Suplementar) seguindo as etapas abaixo.
- Com uma seringa interna, injete um volume contido dentro desta faixa de tensão interfacial constante.
- Manter a área interfacial constante no valor selecionado na etapa 3.5.4 e registrar a tensão interfacial por 5 min7.
4. Programando um processo experimental em DINATEN para cada etapa digestiva
NOTA: Para obter os parâmetros do processo, consulte a Figura 1B suplementar.
- Execute o controle inicial.
- Para a formação de gotas, injectar 10 μL (±5 μL) de solução emulsionante no capilar (válvula 6) (Figura complementar 2A).
- Registrar a adsorção em uma área interfacial constante 21 de 20 mm 2 (±10 mm2) por 1 h (Figura suplementar 2B).
- Registre a reologiadilatacional 8 (Figura suplementar 2C).
- Ajuste a amplitude de oscilação para 1,25 μL, período 10 s.
- Registre a adsorção na área interfacial selecionada (etapa 4.1.2) por 10 s.
- Repita a etapa 4.1.3 em diferentes períodos: 5 s, 20 s, 50 s e 100 s.
- Registre a digestão gástrica.
- Registre a adsorção21 na área interfacial selecionada por 10 s.
- Troca subfásica7 com líquido na valva 2 (sSGF) e enzimas gástricas (Tabela 1) (Figura suplementar 2D).
- Encha a seringa esquerda a partir da válvula 2. Injete 125 μL na válvula 6-capilar com a seringa esquerda a 5 μL·s−1.
- Extrair 125 μL do capilar com a seringa direita a 5 μL·s−1. Descarregue a seringa direita para sair da válvula 8. Repita as etapas 4.2.2.1-4.2.2.2 10 vezes para garantir a troca completa.
- Registar a adsorção21 na área interfacial seleccionada no passo 4.1.2 durante 1 h (Figura 2B suplementar).
- Registre a reologiadilatacional 8 (Figura suplementar 2C).
- Ajuste a amplitude de oscilação para 1,25 μL, período 10 s.
- Registre a adsorção da área interfacial selecionada na etapa 4.1.2 por 10 s. Repita em diferentes períodos: 5 s, 20 s, 50 s, 100 s.
- Registre a digestão intestinal.
- Registar a adsorção21 na área interfacial seleccionada no passo 4.1.2 durante 10 s (Figura 2B suplementar).
- Troca subfásica7 com líquido na valva 3 (sSIF) e enzimas intestinais/sais biliares/fosfolipídios (Tabela 1) (Figura suplementar 2D).
- Encha a seringa esquerda a partir da válvula 2. Injete 125 μL na válvula 6-capilar com a seringa esquerda a 5 μL·s−1. Extrair 125 μL do capilar com a seringa direita a 5 μL·s−1.
- Descarregue a seringa direita para sair da válvula 8. Repita as etapas 4.3.2.1-4.3.2.2 10 vezes para garantir a troca completa.
- Registar a adsorção21 na área interfacial seleccionada no passo 4.1.2 durante 1 h.
- Registre a reologiadilatacional 8 (Figura suplementar 2C).
- Ajuste a amplitude de oscilação para 1,25 μL, período 10 s.
- Registre a adsorção na área interfacial selecionada na etapa 4.1.2 por 10 s.
- Repita em diferentes períodos: 5 s, 20 s, 50 s, 100 s.
- Registre a dessorção seguindo as etapas abaixo.
- Registar a adsorção21 na área interfacial seleccionada no passo 4.1.2 durante 10 s (Figura 2B suplementar).
- Trocasubfásica 7 com líquido na válvula 5 (sSIF) (Tabela 1, Figura suplementar 2D).
- Encha a seringa esquerda a partir da válvula 5. Injete 125 μL na válvula 5-capilar com a seringa esquerda a 5 μL·s−1.
- Extrair 125 μL do capilar com a seringa direita a 5 μL·s−1. Descarregue a seringa direita para sair da válvula 8. Repita as etapas 4.4.2.1-4.4.2.2 10 vezes para garantir a troca completa.
- Registar a adsorção21 na área interfacial seleccionada no passo 4.1.2 durante 1 h (Figura 2B suplementar).
- Registre a reologiadilatacional 8 (Figura suplementar 2C).
- Manter a amplitude de 1,25 μL, período 10 s.
- Registre a adsorção na área interfacial selecionada na etapa 4.1.2 por 10 s.
- Repita a etapa 4.4.4 em diferentes períodos: 5 s, 20 s, 50 s, 100 s.
5. Configurando o experimento
- Encha os tubos de microcentrífuga com o meio de digestão artificial e conecte cada um deles à respectiva válvula pela tubulação correspondente.
- Encha a tubulação nas válvulas 2-5 limpando da válvula 2, válvula 3, válvula 4 e válvula 5 até a saída externa (válvula 8) (Figura suplementar 1A).
- Encha a tubulação na válvula 1 limpando da válvula 1 para a válvula 6-capilar 5 vezes.
- Coloque o capilar na fase oleosa. Carregar a seringa esquerda com válvula 1 (solução inicial, Tabela 1).
- Comece a processar sequencialmente a etapa 4.1-inicial, a etapa 4.2-gástrica, a etapa 4.3-intestinos e a etapa 4.4-dessorção, salvando os dados no final de cada processo.
6. Cálculo dos parâmetros reológicos dilatacionais com o software de processamento de imagem CONTACTO8
NOTA: Para mais detalhes, ver Maldonado-Valderrama et al.8.
- Carregar as imagens correspondentes à oscilação da área a uma dada frequência e amplitude (Figura suplementar 3A).
- Pressione Reologia (Figura Suplementar 3B) e obtenha os parâmetros dilatacionais (Figura Suplementar 3C).
- Copie e cole os resultados na folha de distribuição de dados.
7. Plotagem dos resultados experimentais
- Recalcule a coluna de tempo em cada uma das etapas do processo de digestão adicionando os últimos dados da hora da etapa anterior.
- Plote a tensão interfacial versus o tempo aditivo para cada uma das etapas do processo de digestão utilizado.
- Plotar a tensão interfacial/elasticidade dilatacional final e viscosidade obtidas no final de cada etapa versus a fase de digestão: inicial, digestão gástrica, digestão duodenal e dessorção.
Access restricted. Please log in or start a trial to view this content.
Resultados
Esta seção mostra diferentes exemplos de perfis de digestão medidos com o OCTOPUS. A aparência geral das correspondências de perfil de digestão simuladas é mostrada na Figura 4B. A tensão interfacial é geralmente representada contra o tempo no perfil de digestão. As diferentes fases/etapas de digestão consideradas são representadas em diferentes cores. A primeira fase forma a camada inicial e corresponde à fase de adsorção do emulsionante ou proteína/surfactante/polímero, de...
Access restricted. Please log in or start a trial to view this content.
Discussão
Este artigo descreve um protocolo generalizado para medir a digestão in vitro de camadas interfaciais usando equipamentos de gota pendente. O protocolo pode ser ajustado às necessidades específicas do experimento ajustando a composição dos tampões digestivos, que são baseados no protocolo harmonizado INFOGEST11,20 para facilitar a comparação com a literatura. As enzimas digestivas e os biossurfactantes podem ser adicionados individualmente, sequ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores declaram que não têm interesses financeiros ou relações pessoais concorrentes conhecidos que possam ter influenciado o trabalho relatado neste artigo.
Agradecimentos
Esta investigação foi financiada pelos projetos RTI2018-101309-B-C21 e PID2020-631-116615RAI00, financiados pelo MCIN/AEI/10.13039/501100011033 e pelo "FEDER Uma forma de fazer a Europa". Este trabalho foi (parcialmente) apoiado pelo Grupo de Biocoloides e Física dos Fluidos (ref. PAI-FQM115) da Universidade de Granada (Espanha).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Alpha-chymotrypsin from bovine pancreas | Sigma-Aldrich | C4129 | Enzyme |
| Beta-lactoglobulin | Sigma-Aldrich | L0130 | Emulsfier |
| Bovine Serum Albumin | Sigma-Aldrich | 9048-46-8 | Emulsfier |
| CaCl2 | Sigma-Aldrich | 10043-52-4 | Electrolyte |
| Centrifuge | Kronton instruments | Centrikon T-124 | For separating oil and resins |
| Citrus pectin | Sigma-Aldrich | P9135 | Emulsfier |
| co-lipase FROM PORCINE PANCREAS | Sigma | C3028 | Enzyme |
| CONTACTO | University of Granada (UGR) | https://core.ugr.es/dinaten/, last access: 07/18/2022 | |
| DINATEN | University of Granada (UGR) | https://core.ugr.es/dinaten/, last access: 07/18/2022 | |
| Gastric lipase | Lipolytech | RGE15-1G | Enzyme |
| Human Serum Albumin | Sigma-Aldrich | 70024-90-7 | Emulsifier |
| INFOGEST | http://www.proteomics.ch/IVD/ | ||
| Lipase from porcine pancreas, type II | Sigma-Aldrich | L33126 | Enzyme |
| Magnesium metasilicate resins | Fluka | 1343-88-0 | Resins to purify oil |
| Micro 90 | International products | M-9051-04 | Cleaner |
| NaCl | Sigma | 7647-14-5 | Electrolyte |
| NaH2PO4 | Scharlau | 10049-21-5 | To prepare buffer |
| OCTOPUS | Producciones Científicas y Técnicas S.L. (Gójar, Spain) | Pendandt Drop Equipment implemented with multi subphase exchange | |
| Olive oil | Sigma-Aldrich | 1514 | oil |
| Pancreatic from porcine pancreas | Sigma | P7545-25 g | Enzyme |
| Pepsin | Sigma-Aldrich | P6887 | Enzyme |
| Pluronic F127 | Sigma | P2443 | Emulsifier |
| Pluronic F68 | Sigma | P1300 | Emulsfier |
| Sodium deoxycholate | Sigma | Bile salts | |
| Sodium glycodeoxycholate | Sigma | C9910 | Bile salts |
| Sodium taurocholate | Sigma | 86339 | Bile salts |
| Syringe Filter | Millex-DP | SLGP033R | Syringe Filter 0.22 µm pore size polyethersulfone |
| Trypsin | Sigma-Aldrich | T1426 | Enzyme |
Referências
- McClements, D. J. The biophysics of digestion: Lipids. Current Opinion in Food Science. 21, 1-6 (2018).
- McClements, D. J., Li, Y. Structured emulsion-based delivery systems: Controlling the digestion and release of lipophilic food components. Advances in Colloid and Interface Science. 159 (2), 213-228 (2010).
- Corstens, M. N., et al. Food-grade micro-encapsulation systems that may induce satiety via delayed lipolysis: A review. Critical Reviews in Food Science and Nutrition. 57 (10), 2218-2244 (2017).
- Aguilera-Garrido, A., del Castillo-Santaella, T., Galisteo-González, F., Gálvez-Ruiz, M. J., Maldonado-Valderrama, J. Investigating the role of hyaluronic acid in improving curcumin bioaccessibility from nanoemulsions. Food Chemistry. 351, 129301(2021).
- Rodríguez Patino, J. M., Carrera Sánchez, C., Rodríguez Niño, M. R. Implications of interfacial characteristics of food foaming agents in foam formulations. Advances in Colloid and Interface Science. 140 (2), 95-113 (2008).
- Wilde, P. J., Chu, B. S. Interfacial & colloidal aspects of lipid digestion. Advances in Colloid and Interface Science. 165 (1), 14-22 (2011).
- Cabrerizo-Vílchez, M. A., Wege, H. A., Holgado-Terriza, J. A., Neumann, A. W. Axisymmetric drop shape analysis as penetration Langmuir balance. Review of Scientific Instruments. 70 (5), 2438-2444 (1999).
- Maldonado-Valderrama, J., Muros-Cobos, J. L., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Bile salts at the air-water interface: Adsorption and desorption. Colloids and surfaces B: Biointerfaces. 120, 176-183 (2014).
- Maldonado-Valderrama, J., Terriza, J. A. H., Torcello-Gómez, A., Cabrerizo-Vílchez, M. A. In vitro digestion of interfacial protein structures. Soft Matter. 9, 1043-1053 (2013).
- Maldonado-Valderrama, J. Probing in vitro digestion at oil-water interfaces. Current Opinion in Colloid and Interface Science. 39, 51-60 (2019).
- Brodkorb, A., et al. INFOGEST static in vitro simulation of gastrointestinal food digestion. Nature Protocols. 14 (4), 991-1014 (2019).
- del Castillo-Santaella, T., Maldonado-Valderrama, J., Molina-Bolivar, J. A., Galisteo-Gonzalez, F. Effect of cross-linker glutaraldehyde on gastric digestion of emulsified albumin. Colloids and Surfaces B: Biointerfaces. 145, 899-905 (2016).
- Macierzanka, A., Torcello-Gómez, A., Jungnickel, C., Maldonado-Valderrama, J. Bile salts in digestion and transport of lipids. Advances in Colloid and Interface Science. 274, 102045(2019).
- Maldonado-Valderrama, J., Torcello-Gómez, A., del Castillo-Santaella, T., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Subphase exchange experiments with the pendant drop technique. Advances in Colloid and Interface Science. 222, 488-501 (2015).
- Bellesi, F. A., Ruiz-Henestrosa, V. M. P., Maldonado-Valderrama, J., Del Castillo Santaella, T., Pilosof, A. M. R. Comparative interfacial in vitro digestion of protein and polysaccharide oil/water films. Colloids and Surfaces B: Biointerfaces. 161, 547-554 (2018).
- Del Castillo-Santaella, T., Sanmartín, E., Cabrerizo-Vílchez, M. A., Arboleya, J. C., Maldonado-Valderrama, J. Improved digestibility of β-lactoglobulin by pulsed light processing: A dilatational and shear study. Soft Matter. 10 (48), 9702-9714 (2014).
- Infantes-Garcia, M. R., et al. In vitro gastric lipid digestion of emulsions with mixed emulsifiers: Correlation between lipolysis kinetics and interfacial characteristics. Food Hydrocolloids. 128, 107576(2022).
- del Castillo-Santaella, T., Cebrián, R., Maqueda, M., Gálvez-Ruiz, M. J., Maldonado-Valderrama, J. Assessing in vitro digestibility of food biopreservative AS-48. Food Chemistry. 246, 249-257 (2018).
- Torcello-Gómez, A., Maldonado-Valderrama, J., Jódar-Reyes, A. B., Cabrerizo-Vílchez, M. A., Martín-Rodríguez, A. Pluronic-covered oil-water interfaces under simulated duodenal conditions. Food Hydrocolloids. 34, 54-61 (2014).
- Minekus, M., et al. A standardised static in vitro digestion method suitable for food - an international consensus. Food & Function. 5 (6), 1113-1124 (2014).
- Wege, H. A., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Development of a constant surface pressure penetration langmuir balance based on axisymmetric drop shape analysis. Journal of Colloid and Interface Science. 249 (2), 263-273 (2002).
- del Castillo-Santaella, T., et al. Hyaluronic acid and human/bovine serum albumin shelled nanocapsules: Interaction with mucins and in vitro digestibility of interfacial films. Food Chemistry. 383, 132330(2022).
- Aguilera-Garrido, A., et al. Applications of serum albumins in delivery systems: Differences in interfacial behaviour and interacting abilities with polysaccharides. Advances in Colloid and Interface Science. 290 (5), 102365(2021).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados