Method Article
Trasplante de neuronas GABAérgicas derivadas de células madre humanas en el hipocampo de ratón postnatal temprano para mitigar los trastornos del desarrollo neurológico
En este artículo
Resumen
El trasplante de neuronas GABAérgicas derivadas de células madre pluripotentes humanas generadas por la programación neuronal podría ser un posible enfoque de tratamiento para los trastornos del desarrollo neurológico. Este protocolo describe la generación y el trasplante de precursores neuronales GABAérgicos derivados de células madre humanas en los cerebros de ratones neonatos, lo que permite la investigación a largo plazo de las neuronas injertadas y la evaluación de su potencial terapéutico.
Resumen
Un número reducido o disfunción de las interneuronas inhibitorias es un contribuyente común a los trastornos del desarrollo neurológico. Por lo tanto, la terapia celular que utiliza interneuronas para reemplazar o mitigar los efectos de los circuitos neuronales alterados es una vía terapéutica atractiva. Con este fin, se necesita más conocimiento sobre cómo las células interneuronas GABAérgicas derivadas de células madre humanas (hdIN) maduran, se integran y funcionan con el tiempo en los circuitos del huésped. De particular importancia en los trastornos del desarrollo neurológico es una mejor comprensión de si estos procesos en las células trasplantadas se ven afectados por un cerebro huésped en evolución y maduración. El presente protocolo describe una generación rápida y altamente eficiente de hdINs a partir de células madre embrionarias humanas basadas en la expresión transgénica de los factores de transcripción Ascl1 y Dlx2. Estos precursores neuronales se trasplantan unilateralmente, después de 7 días in vitro, al hipocampo de ratones neonatales de 2 días de edad. Las neuronas trasplantadas se dispersan en el hipocampo ipsi y contralateral de un modelo de ratón de síndrome de displasia cortical-epilepsia focal y sobreviven hasta 9 meses después del trasplante. Este enfoque permite investigar la identidad celular, la integración, la funcionalidad y el potencial terapéutico de las interneuronas trasplantadas durante un tiempo prolongado en el desarrollo de cerebros sanos y enfermos.
Introducción
El establecimiento, la maduración y el refinamiento de las redes neuronales ocurren durante el período perinatal y postnatal temprano y representan ventanas de tiempo cruciales para el desarrollo del cerebro1. De una exuberancia de conectividad después del nacimiento, el cerebro evoluciona a un ajuste fino de conexiones que se extienden hasta la adolescencia2. En consecuencia, las alteraciones en los genes expresados durante estos períodos, así como los factores externos o insultos, definen la predisposición de un individuo a múltiples trastornos del neurodesarrollo. Las deficiencias en la cognición y la función motora se desarrollan con el tiempo, y los tratamientos farmacológicos son limitados, la mayoría dirigidos a los síntomas con el riesgo de efectos secundarios graves.
Se ha demostrado que la disfunción en la inhibición del ácido gamma-aminobutírico (GABA) es un importante contribuyente a la causa subyacente de varios trastornos del neurodesarrollo3, como el síndrome X frágil, el síndrome de Angelman, la epilepsia, la esquizofrenia y el autismo. GABA es el principal transmisor inhibitorio del sistema nervioso central y es instrumental para mantener el equilibrio excitatorio / inhibitorio (E / I), la sincronización de la activación neuronal, y la computación. Las interneuronas GABAérgicas son una población heterogénea de neuronas, con complejidad funcional creciente en regiones cerebrales más complejas4 y con evolución 5,6. Teniendo en cuenta la limitada capacidad regenerativa endógena del cerebro humano y la implicación de la disfunción interneuronal en varios trastornos neurológicos, el trasplante de interneuronas GABAérgicas puede ser una vía terapéutica prometedora para explorar. En esta línea, las células interneuronales GABAérgicas derivadas de células madre humanas (hdIN) parecen ser la fuente más traslacional y viable para este propósito en comparación con los precursores neuronales alogénicos de roedores u otras fuentes utilizadas en otros lugares7. Los protocolos para generar neuronas GABAérgicas a partir de diversas fuentes celulares están disponibles 8,9,10,11,12,13, pero se requiere más conocimiento sobre cómo maduran, integran y funcionan los hdINs con el tiempo en un cerebro patológico en desarrollo. Varios estudios han identificado alteraciones en genes activos durante el patrón cortical, estableciendo conectividad neuronal14 y ajustando el equilibrio fisiológico E/I15. El trasplante neonatal de hdINs en modelos de ratón con las correspondientes perturbaciones genéticas nos permite seguir la interacción entre el huésped y el injerto, que es el conocimiento necesario para determinar posibles estrategias terapéuticas.
La inmunomodulación es utilizada común y exitosamente en trasplantes de xenoinjertos para evitar desencadenar una respuesta inmune del huésped y el rechazo16. Sin embargo, la administración de fármacos inmunosupresores, como la ciclosporina A, causa toxicidad renal después de la administración crónica, es laboriosa debido a la necesidad de inyecciones intraperitoneales diarias para alcanzar concentraciones sistémicas estables, causando estrés animal17, y tiene efectos fuera del objetivo que pueden interactuar con la patología18. Además, se ha demostrado que comprometer el sistema inmune cambia los fenotipos conductuales19, con alteraciones en las regiones neuroanatómicas correspondientes20. Se ha demostrado que el trasplante en la primera semana de vida permite la adaptación a las células trasplantadas21,22, mientras que otros han reportado supervivencia inicial seguida de rechazo de los injertos dentro del primer mes postnatal23,24.
Este protocolo describe procedimientos desde la generación de hdIN hasta el trasplante de células en ratones neonatos que resultan en la supervivencia del injerto a largo plazo y permiten la investigación de la especificidad neuronal, la integración sináptica, la función y el potencial terapéutico de las interneuronas humanas trasplantadas durante el desarrollo fisiológico y patológico.
Protocolo
Todos los procedimientos experimentales fueron aprobados por la Junta de Ética de Investigación Animal de Malmö / Lund, número de permiso ético 12548-19, y se llevaron a cabo de acuerdo con las regulaciones de la Agencia Sueca de Bienestar Animal y la Directiva de la UE 2010/63 / UE para experimentos con animales. C57BL6/J y ratones knock-out (KO) similares a proteínas 2 asociadas a la contactina (Cntnap2), tanto machos como hembras, se utilizaron en el día postnatal (P) 2 para el presente estudio. Se utilizaron células madre embrionarias humanas (hESCs). Los animales y las células madre se obtuvieron de fuentes comerciales (ver Tabla de materiales).
1. Generación de los precursores hdIN
NOTA: Todos los pasos de esta sección se realizan en una campana de cultivo celular. Las hESCs se mantuvieron como células libres de alimentador en placas recubiertas utilizando un medio de cultivo de células madre y se pasaron como colonias.
- Realizar la programación directa de los hESCs a precursores hdIN (Figura 1).
NOTA: El enfoque de programación hacia adelante se basa en el procedimiento descrito en González-Ramos et al.8 y Yang et al.9.- Transducir las hESCs con vectores lentivirales que contienen el sistema Tet-On en un medio de cultivo de células madre frescas que contenga 10 μM de inhibidor de ROCK (IR) (ver Tabla de materiales). Conservar a 37 °C en la incubadora.
- Cambiar el medio a un medio de cultivo de células madre frescas 16 h después de la transducción y mantener las células transducidas de la misma manera que las hESC no transducidas.
- Cuando sean confluentes, separar las hESCs como células individuales utilizando una solución de desprendimiento celular (ver Tabla de materiales) y placarlas en placas recubiertas de 6 pocillos a una densidad de 3 x 105 células/pocillo en medio de cultivo de células madre que contenga 10 μM de RI en día in vitro (DIV) −1.
- A 1 DIV, reemplace el medio de cultivo con medio N2 que contenga 2 g/L de doxiciclina (DOX, ver Tabla de materiales).
NOTA: DOX se utiliza para inducir la expresión transgénica de Ascl1 y Dlx29, de 1 DIV a 7 DIV, y luego continúa in vivo por su adición al agua potable25. - A las 2 DIV, comienza un período de selección de resistencia a los antibióticos que durará hasta 5 DIV. Agregue puromicina (puro) e higromicina (hygro) al medio fresco (consulte la Tabla de materiales). Cambie el medio en 2 DIV, 4 DIV y 5 DIV.
NOTA: Optimizar las concentraciones de puro e higro antes del protocolo de diferenciación utilizando hESCs transducidos y no transducidos para asegurar la supervivencia de sólo las células portadoras de los casetes de resistencia a antibióticos. En este protocolo, se utilizaron 0,5 μg/mL de puro y 750 μg/mL de hygro. - A las 5 DIV, finaliza el período de selección de antibióticos. Cambio a medio N2 suplementado con 2 g/L de DOX y 4 μM de citosina β-D-arabinofuranósido (Ara-C, ver Tabla de Materiales).
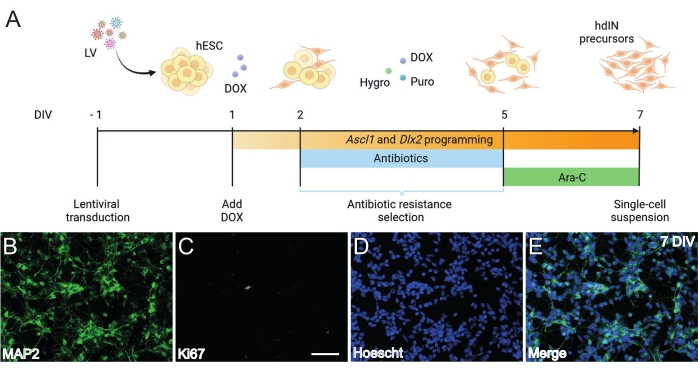
Figura 1: Generación de precursores hdIN a partir de hESCs mediante la sobreexpresión de Ascl1 y Dlx2. (A) Esquemas del protocolo de diferenciación utilizado para la generación de precursores hdIN. (B-E) Inmunocitoquímica de precursores de hdIN a 7 DIV para (B) el marcador neuronal MAP2, (C) el marcador proliferativo Ki67, (D) tinción nuclear general, y (E) una fusión de los marcadores anteriores. Barra de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
2. Preparación de la suspensión unicelular para trasplante
NOTA: Todos los pasos de esta sección se realizan en la campana de cultivo celular. En 7 DIV, los precursores de hdIN se disocian y se utilizan para trasplantes.
- Realice el desprendimiento de las células siguiendo los pasos a continuación.
- Retire el medio y enjuague cuidadosamente las células con DPBS sin calcio y magnesio.
- Agregue 400 μL de la solución de desprendimiento celular (consulte la Tabla de materiales) a cada pocillo de la placa de 6 pocillos.
NOTA: Asegurar la cobertura de toda la superficie por la solución. - Incubar durante 2-3 min a 37 °C en la incubadora hasta que el borde de las células comience a verse brillante, lo que indica la degradación enzimática de las proteínas de la superficie celular y el desprendimiento de la superficie del pozo.
NOTA: Para aumentar la supervivencia celular, no espere demasiado cuando todas las células estén completamente separadas y flotando. - Luego, agregue 600 μL de medio N2 fresco a cada pocillo de la placa de 6 pocillos para detener la enzima, y mecánicamente con la pipeta, ayude a separar las células para obtener una suspensión de una sola célula.
- Transfiera la suspensión celular a un tubo de plástico (15 ml) y centrifugar a 180 x g durante 4 min a temperatura ambiente (RT).
- Realizar la resuspensión de las células.
- Desechar el sobrenadante utilizando un sistema de vacío (con cuidado, sin alterar el pellet) y resuspender el pellet en el medio de trasplante que contiene 10 μM de RI, 1 μg/ml de DNasa y 2 μg/μL de DOX.
- Cuente el total de células en la suspensión utilizando una cámara de conteo y un contador manual de celdas y ajuste el volumen a una concentración final de 100,000 células / μL.
- Mantener la suspensión celular en un tubo cerrado sobre hielo hasta el trasplante durante un máximo de 4 h.
NOTA: El trasplante debe realizarse el mismo día que la preparación de la suspensión celular (7 DIV).
3. Trasplante de células intrahipocampales
NOTA: Todos los pasos de esta sección se realizan fuera de la campana de cultivo celular en la instalación animal. El trasplante postnatal temprano de células en el cerebro se realizó en P2, considerando P0 el día del nacimiento.
- Prepárese para el experimento de trasplante siguiendo los pasos a continuación.
- Autoclave todo el material quirúrgico o, si no es posible, esterilizar con otro método aprobado.
- Monte la jeringa de inyección en el soporte sin ningún capilar de vidrio. Enjuague la aguja con agua.
NOTA: La aguja debe ser de 33 G. - Curva 90° la punta de una aguja de insulina de 30 G.
- Cree un escenario casero similar a Play-Doh para colocar al cachorro con la cabeza plana (Figura 2A).
- Busque la jaula de los ratones con la madre y los cachorros antes de preparar cualquier cosa para la cirugía para permitirles aclimatarse al nuevo entorno.
- Prepara una bandeja con hielo húmedo y una jaula vacía con un poco de papel para el isoflurano.
- Anestesiar al cachorro de ratón.
- Empapa un pedazo de papel con isoflurano (ver Tabla de materiales) y colócalo dentro de la jaula vacía. Tome cuidadosamente un cachorro y colóquelo en la jaula con el papel empapado en isoflurano.
NOTA: Nunca deje menos de tres cachorros con la madre. No exceda los 20-30 s de anestesia con isoflurano, o el cachorro puede morir. - Verificar el efecto de la anestesia por cese del movimiento.
- Inmediatamente después de la anestesia, coloque al cachorro sobre un pañuelo húmedo en la superficie del hielo húmedo. Mantenga al animal en hielo durante 3 minutos hasta que las extremidades superiores se vuelvan blanquecinas (Figura 2B, flecha azul). Esto generalmente toma 2-3 minutos.
- Utilice este tiempo para cargar la jeringa con la suspensión celular. Resuspender las células con cuidado con una pipeta antes.
- Coloque el cachorro en el marco estereotáxico. Use las barras auriculares en la dirección opuesta (Figura 2A, flechas magenta).
NOTA: La parte posterior de las barras para los oídos es menos puntiaguda, y como los cachorros P2 no tienen orejas, use el lado más plano para evitar lastimar al animal. - Desde un lado, verifique si la cabeza está recta. La cabeza debe ser plana; usa la etapa similar a Play-Doh para ajustarte a eso.
NOTA: Los cachorros a esta edad aún no han abierto los ojos, por lo que no es necesario dar ningún paso adicional en este sentido. Los cachorros no tienen pelaje a esta edad, por lo que no se requiere afeitarse el área. No se administra ningún tratamiento específico para el dolor, ya que no es una incisión abierta en la piel y no se trata de suturas. - Mantenga al cachorro cubierto de hielo (encima del papel de seda) durante toda la cirugía.
NOTA: No coloque el hielo en contacto directo con la piel del cachorro.
- Empapa un pedazo de papel con isoflurano (ver Tabla de materiales) y colócalo dentro de la jaula vacía. Tome cuidadosamente un cachorro y colóquelo en la jaula con el papel empapado en isoflurano.
- Realice la inyección.
- Limpie la superficie de la piel con un pañuelo blando empapado en etanol.
- Identifique lambda y establezca las coordenadas en cero en la consola de visualización digital del instrumento estereotáxico (Figura 2C, línea discontinua amarilla). Las suturas sagitales y lambdoideas son fácilmente visibles por el ojo, ya que están vascularizadas, como líneas rojas.
NOTA: Si experimenta dificultades para visualizar lambda, coloque un pequeño trozo de hielo sobre la piel y espere un par de minutos para que se enfríe. Luego, retire el trozo de hielo y el blanqueamiento sutil de la piel le permitirá visualizar. - Vuelva a colocar la aguja de inyección en las coordenadas deseadas. En el protocolo descrito, la región objetivo fue el hipocampo, y las coordenadas fueron las siguientes: anterior-posterior (AP) +0,85 y mediolateral (ML) +1,35.
- Use una aguja de insulina doblada de 90 ° para penetrar en el cráneo y crear un pequeño agujero.
- Baje la aguja de inyección hasta que haya cruzado el cráneo y ponga a cero las coordenadas dorso-ventrales (DV). Baje la aguja hasta que se realicen las coordenadas DV deseadas. En el protocolo descrito, las coordenadas fueron DV −1.1.
- Inyecte de acuerdo con los intervalos de tiempo predeterminados.
NOTA: En el protocolo descrito, los tiempos exactos fueron los siguientes: (i) después de bajar a la coordenada DV, espere 3 min, (ii) inyecte 1 μL de volumen durante 5 min, y (iii) después de que se haya inyectado todo el volumen, espere 3 min. - Retraiga la aguja lentamente.
- Finalice el procedimiento.
NOTA: La cirugía no puede durar más de 15 min para asegurar la supervivencia del cachorro y evitar cualquier daño derivado de la anestesia por hipotermia.- Calienta al cachorro con las manos hasta que comience a moverse antes de devolvérselo a la madre.
- Administre DOX a una concentración de 1 mg/ml en solución de sacarosa al 0,5% como agua potable durante al menos 2 días antes y 3 semanas después del trasplante (TP) para continuar la diferenciación celular in vivo.
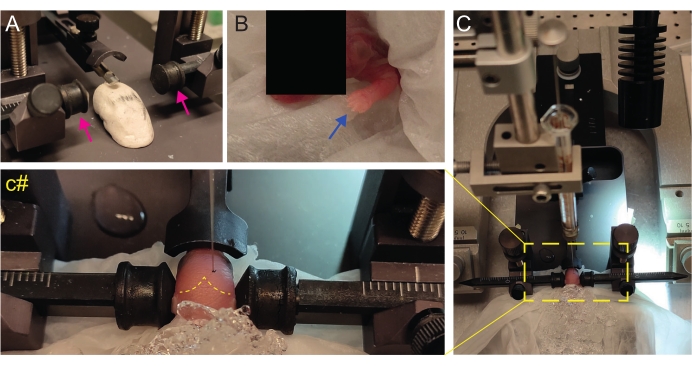
Figura 2: Trasplante estereotáxico en crías de ratones recién nacidos en P2. (A) Una etapa similar a Play-Doh para mantener el cuerpo del cachorro en posición y barras auriculares invertidas (flechas magenta). (B) Pata delantera blanca (flecha azul) indicativa de la reducción del flujo sanguíneo en esa área para que el cachorro esté experimentando anestesia por hipotermia. (C) Descripción general de la configuración con el cachorro ya cubierto por hielo sobre el papel de seda blando. (C#) Zoom cerrado de la cabeza del cachorro, con la aguja de inyección ya insertada en el cerebro (línea discontinua amarilla que indica suturas lambda y lambdoides). Esta figura está adaptada de González Ramos et al. 27. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Siguiendo el protocolo presentado aquí e ilustrado en la Figura 1A, los precursores de hdIN aún no proliferaban a 7 DIV según lo definido por (i) inmunorreactividad negativa para el marcador del ciclo celular Ki67 y (ii) marcadores neuronales que expresan como la proteína 2 asociada a microtúbulos (MAP2) (Figura 1B-E). Esta caracterización se realizó en células sobrantes rechapadas durante 24 h después de haber sido sometidas a todos los pasos del procedimiento. Además, el análisis de expresión génica publicado anteriormente indicó que una rápida transición del estado pluripotente a un fenotipo neuronal ocurre alrededor de 4 DIV y 7 DIV8. En general, estos resultados confirmaron la presencia de células postmitóticas y la ausencia de riesgo para la formación de teratomas.
A continuación, la supervivencia de los precursores de hdIN después del trasplante postnatal temprano en el hipocampo de ratones de tipo salvaje (WT) se probó mediante inmunohistoquímica contra el marcador citoplasmático humano STEM121. Los precursores de hdIN se trasplantaron en el hipocampo dorsal derecho de ratones inmunocompetentes naïve en P2, que luego se sacrificaron a P14 y 2 meses PT. Se encontraron células injertadas en todo el hipocampo dorsal, así como dispersas a través del cuerpo calloso y el hipocampo contralateral, en ambos puntos de tiempo. Además, en ambos puntos temporales, los hdINs injertados expresaron Ascl1, uno de los factores de transcripción de inducción (Figura Suplementaria 1), y no fueron proliferativos, como lo indica la ausencia de expresión de Ki67 (Figura Suplementaria 2).
Es importante destacar que no se encontró reacción inmune o inflamación local contra las células trasplantadas ni en P14 ni a los 2 meses PT, según lo evaluado por la ausencia de microglia reactiva identificada mediante Iba1, CD68 y galectina-3 (Gal3) (Figura 3), el grado de astrogliosis determinado por la proteína ácida fibrilar glial (GFAP) y citoquinas inflamatorias como la interleucina-1 (IL-1), y la ausencia de linfocitos T citotóxicos (CD8) (Figura 4).
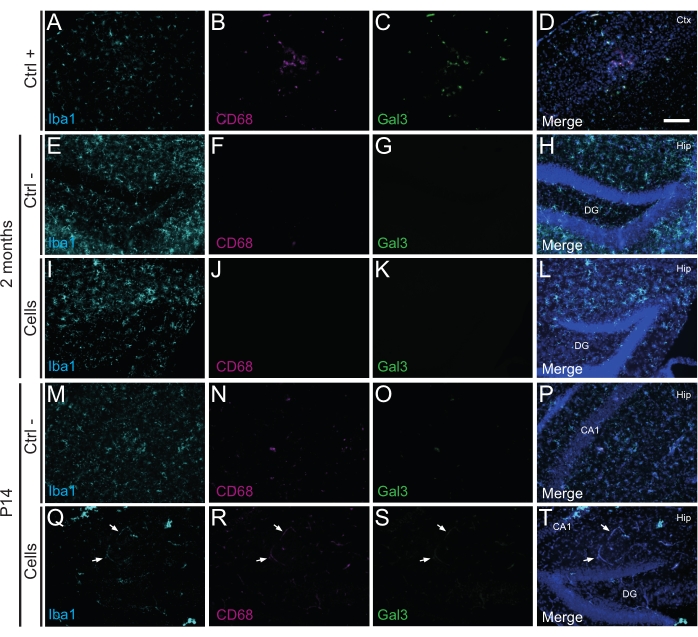
Figura 3: hdINs a los 2 meses de P14 y 2 meses PT en el hipocampo de ratones WT recién nacidos sin desencadenar el rechazo inmune del tejido huésped. Inmunofluorescencia para los marcadores Iba1, CD68 y Gal3 en el tejido cerebral de (A-D) la proximidad de un área central isquémica en un modelo de ratón con accidente cerebrovascular por electrocoagulación (control positivo, Ctrl +), animales de control negativo (Ctrl-) (E-H) a los 2 meses y (M-P) P14, y (I-L) animales que se han sometido a trasplante de células a los 2 meses y (Q-T) ) P14. Las flechas blancas indican algunos ejemplos de vasos sanguíneos visibles en todos los canales debido a la autofluorescencia. Abreviaturas: Ctx = corteza; Cadera = hipocampo; DG = giro dentado; CA1 = cornu ammonis 1. Barra de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
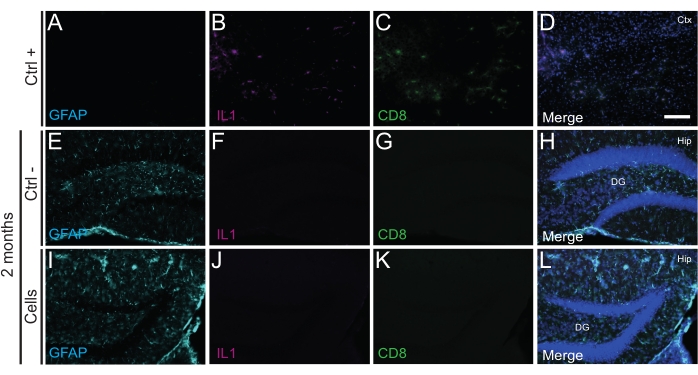
Figura 4: hdINs a los 2 meses PT en el hipocampo de ratones WT recién nacidos sin desencadenar el rechazo inmune del tejido huésped. Inmunofluorescencia para marcadores IL1, GFAP y CD8 en tejido cerebral de (A-D) la proximidad de un área central isquémica en un modelo de ratón con accidente cerebrovascular por electrocoagulación (control positivo, Ctrl +), animales de control negativo (E-H) (Ctrl-) a los 2 meses y animales (I-L) que se han sometido a trasplante celular a los 2 meses. Abreviaturas: Ctx = corteza; Cadera = hipocampo; DG = giro dentado. Barra de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
Del mismo modo, los precursores de hdIN también se trasplantaron en el hipocampo de ratones Cntnap2 KO, un modelo para el trastorno del espectro autista y el síndrome de displasia cortical-epilepsia focal. En los ratones Cntnap2 KO, de hecho, los hdINs sobrevivieron hasta 9 meses PT y se localizaron en el sitio de inyección, aunque también se dispersaron a través del hipocampo ipsilateral e incluso contralateral como se observó en los ratones WT (Figura 5). Además, la mayoría de los hdINs injertados fueron inmunorreactivos para marcadores interneuronales, como se esperaba de resultados previos in vitro 8,26 y en roedores adultos in vivo25.
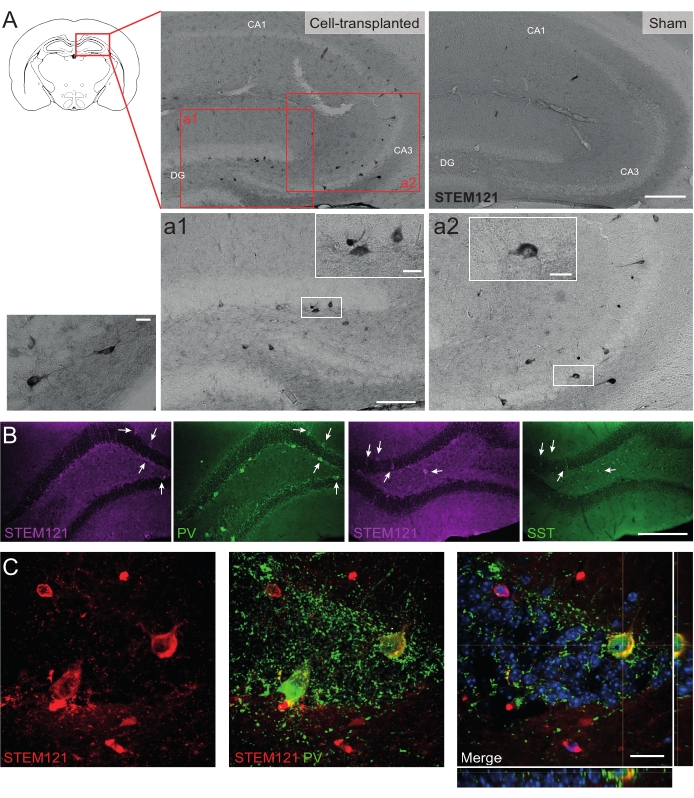
Figura 5: HDIN injertados en el hipocampo de ratones Cntnap2 KO a los 9 meses PT. (A) Inmunoquímica contra el marcador citoplasmático humano STEM121 en ratones trasplantados de células (izquierda) y simulados (derecha). (A1 y A2) Imágenes ampliadas de células positivas STEM121. (B) Inmunofluorescencia para STEM121 (magenta) y los marcadores interneuronales parvalbúmina (PV) y somatostatina (SST). Las flechas blancas indican celdas dobles positivas para STEM121 y el marcador interneuronal respectivo. (C) Vista ortogonal de un injerto de hdIN inmunorreactivo para STEM121 y PV. Barra de escala: 200 μm (A y B), 100 μm (a1 y a2), 20 μm (pequeño aumento cuadrado en a1 y a2, y C). Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: HDIN injertados a los 2 meses PT en el hipocampo de ratones WT recién nacidos que expresan Ascl1. Inmunofluorescencia contra Ascl1 y el marcador humano citoplasmático STEM121 en el (A) CA3 y (B) DG en ratones WT trasplantados con células. (a) Imagen ampliada de una celda positiva STEM121. Las flechas blancas indican celdas doblemente positivas para STEM121 y Ascl1. Barra de escala: 100 μm. Haga clic aquí para descargar este archivo.
Figura complementaria 2: HDIN injertados postmitóticos a los 2 meses PT en el hipocampo de ratones WT recién nacidos. Inmunofluorescencia contra el marcador proliferativo Ki67 y el marcador citoplasmático humano STEM121 en ratones WT (A) naïve y (B) trasplantados con células. (b) Imagen ampliada de una celda positiva STEM121. La flecha amarilla indica una celda positiva para Ki67 y negativa para STEM121. La flecha blanca indica celdas positivas para STEM121 y negativas para Ki67. El asterisco blanco señala un ventrículo lateral. Barra de escala: 100 μm. Haga clic aquí para descargar este archivo.
Discusión
El presente protocolo describe una metodología robusta, rápida, simple y ampliamente accesible para generar precursores de hdIN in vitro y su uso como terapia celular intervencionista temprana en modelos preclínicos de trastornos del neurodesarrollo.
Aunque algunos de los fenotipos característicos de los trastornos del neurodesarrollo surgen durante la adolescencia o la edad adulta, las alteraciones fisiopatológicas ya están presentes durante el desarrollo temprano. Por esta razón, la intervención temprana estaría altamente justificada para lograr efectos beneficiosos al actuar en períodos críticos de desarrollo cerebral antes de la sintomatología o manifestación clínica. En el futuro, el cribado genético y el desarrollo de biomarcadores permitirán un tratamiento profiláctico o presintomático, lo que representa un cambio de juego para esos pacientes. Por lo tanto, los precursores de hdIN se trasplantaron temprano después del nacimiento en el modelo de ratón Cntnap2 KO cuando los cambios epileptogénicos en la red neuronal podrían estar en curso28 y en un momento en el que se han descrito alteraciones celulares en este modelo animal29. Sin embargo, es importante considerar las posibles trampas de la extrapolación de la edad y el momento de ciertos procesos en el ratón frente al cerebro humano.
Centrándonos en el procedimiento en sí, el protocolo de diferenciación aquí presentado se basa en el uso de factores de transcripción, que permiten una programación rápida y altamente eficiente de las células madre en comparación con otros protocolos en otros lugares basados en moléculas pequeñas10,30. Un inconveniente potencial de este enfoque podría ser el requisito de vectores lentivirales, que conlleva un riesgo de mutagénesis insercional. Dos pasos críticos en el protocolo son la adición de los antibióticos y el agente antimitótico al medio para seleccionar las células que expresan los factores de transcripción y eliminar las células proliferativas, evitando el riesgo de formación de teratomas, respectivamente. Aunque solo se probaron precursores de hdIN en este estudio, se espera que el procedimiento sea factible con otras fuentes celulares y protocolos de programación / diferenciación. No obstante, deben validarse otros subtipos y/o modelos neuronales.
La edad del precursor hdIN para el trasplante, 7 DIV, se decidió en base a (i) la ausencia de células proliferativas, evaluada por inmunorreactividad contra Ki67, (ii) junto con la observación previamente reportada de disminuciones en la expresión de genes de pluripotencia como POU5F1 y la aparición del marcador neuronal MAP2 y el marcador interneuronal GAD1 en ese punto de tiempo8 . Sin embargo, el trabajo original que describe este protocolo realizó trasplantes a 14 DIV después de la retirada de DOX9. Esto plantea preguntas sobre si DOX en el agua potable de la madre puede alcanzar las células injertadas en los cerebros de los cachorros lactantes a través de la leche, o si 7 DIV de inducción DOX es suficiente para establecer el destino GABAérgico. Aunque Yang et al. identificaron 14 días de DOX como suficientes para generar células neuronales estables in vitro9, Gonzalez-Ramos et al.8 detectaron la expresión del gen GAD1 ya en 7 DIV, lo que indica que la activación posterior de GAD67 por Ascl1 y Dlx2 ya ha ocurrido en este punto de tiempo. Por lo tanto, el patrón ha comenzado a 7 DIV y podría ser menos dependiente del tratamiento DOX. Además, la evidencia en roedores y humanos indica la presencia de DOX en la leche materna 31,32, y los resultados presentados aquí muestran que los hdINs injertados fueron inmunorreactivos paraAscl1 a las 2 semanas y 2 meses PT y marcadores interneuronales más tarde a los 9 meses PT. Dentro de la población injertada, además de las neuronas PV y SST positivas, también se encontraron otros marcadores para subpoblaciones de interneuronas en cantidades más bajas, como la calretinina (CR) y la calbindina (CB).
Un aspecto desafiante de este procedimiento es la coordinación de los tiempos tanto para la diferenciación como para la edad de los cachorros. Por lo general, la gestación del ratón toma 21 días después de configurar la jaula de apareamiento, aunque esto puede variar a veces. Este escenario no ocurre cuando se realizan trasplantes celulares en roedores adultos cuando todo se puede planificar y organizar cuidadosamente. Sin embargo, esto se puede mitigar fácilmente configurando dos o tres jaulas de apareamiento con un intervalo de 2 días o dos o tres lotes de diferenciación con un lapso de tiempo de 2 días entre sí.
Aunque los ratones utilizados en este estudio no eran inmunodeficientes ni inmunodeprimidos, las células trasplantadas sobrevivieron hasta 9 meses in vivo, y no se observaron marcadores de reacción inmune contra células xenogénicas o inflamación local ni en P14 ni en 2 meses PT. El rechazo inmune de células xenogénicas injertadas se desencadena contra MHC / péptidos, y los mediadores celulares clave del rechazo del injerto son los linfocitos T y las células microgliales33, 34. Por lo tanto, se exploró la inmunorreactividad a los marcadores de las células T, así como la microglía reactiva. No se detectaron signos de rechazo inmune de las células injertadas en el tejido huésped ni por los niveles de microglía reactiva ni por la presencia de linfocitos T en ratones WT a los 2 meses de P14 o 2 meses. Además, no se observó inflamación local basada en los niveles evaluados de astrogliosis y citoquinas inflamatorias. Este resultado podría depender en parte de la tolerancia inmune neonatal 35,36,37, observada por otras identidades celulares, localizaciones y modelos animales35,38. Englund et al. identificaron diferencias regionales en el resultado de las células injertadas en términos de migración y maduración, incluyendo la observación de células injertadas en la sustancia blanca adyacente35.
Finalmente, se observó una mayor dispersión de las células injertadas dentro del hipocampo en comparación con otros estudios trasplantados en roedores adultos, donde los hdINs permanecieron como un núcleo injertado25. Esta dispersión también difería de los resultados observados previamente por Yang et al.9, lo que podría explicarse en este caso por la edad de las células en el momento del trasplante.
Divulgaciones
Los autores declaran que no hay intereses contrapuestos.
Agradecimientos
Este proyecto fue financiado por el Consejo Sueco de Investigación (Número de subvención: 2016-02605, MA), la Fundación Sueca del Cerebro F02021-0369 (MA), la Fundación Crafoord (MA) y el Programa Horizon 2020 de la Unión Europea (H2020-MSCA-ITN-2016) bajo el proyecto Marie Skłodowska-Curie Innovative Training Network Training4CRM No. 722779 (M.K.). Estamos muy agradecidos por la ayuda de Andrés Miguez, del laboratorio de Josep Maria Canals (Laboratorio de Células Madre y Medicina Regenerativa, Universidad de Barcelona), por enseñar el trasplante de células estereotáxicas en ratones recién nacidos P2, y Mackenzie Howard, líder del grupo en la Universidad de Texas en Austin, por los consejos y coordenadas preliminares para el trasplante de células en el hipocampo de ratones recién nacidos P2. Agradecemos a Susanne Geres por ayudar con el cuidado de los animales y a Ling Cao por la ayuda con el procesamiento de tejidos, así como a los estudiantes que han contribuido de una manera u otra al estudio y específicamente a Diana Hatamian. Finalmente, algunos de los gráficos utilizados para ilustrar este documento fueron creados con BioRender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| 30 G needle | B Braun | 4656300 | |
| 33 G needle for Hamilton syringe | Hamilton | 7762-06 | |
| 4-well plates | Thermo Scientific | 176740 | |
| Accutase | STEMCELL Technologies | 7920 | Cell detachment solution use for splitting cells (hESC and hdIN precursors) |
| Adjustable volume pipettes 10, 20, 200, 1000 µL | |||
| Alexa Fluor Plus 488/555/647 | Thermo Fisher | 1:1000 | |
| Anti-CD68 (Rat) | Bio-Rad | MCA1957 | 1:200 |
| Anti-CD8 (Rabbit) | Abcam | 203035 | 1:200 |
| Anti-Galectin 3 (Goat) | R&D systems | AF1197 | 1:500 |
| Anti-GFAP (Guiena Pig) | Synaptic systems | 173004 | 1:500 |
| Anti-Iba1 (Rabbit) | WAKO | 19119741 | 1:500 |
| Anti-IL1 (Goat) | Santa Cruz Biotech | SC-106 | 1:400 |
| Anti-Ki67 | Abcam | ab16667 | 1:250 |
| Anti-Ki67 (Rabbit) | Novocastra | NCL-Ki67p | 1:250 |
| Anti-MAP2 (Chicken) | Abcam | ab5392 | 1:2000 |
| Anti-Mash1 (Ascl1) | Abcam | ab74065 | 1:1000 |
| Anti-Parvalbumin (Rabbit) | Swant | PV 27 | 1:5000 |
| Anti-Somatostatin (Rat) | Millipore | MAB354 | 1:150 |
| Anti-STEM121 (Mouse) | Takara Bio | Y40410 | 1:400 |
| Avidin/Biotin Blocking Kit | VECTOR Laboratories | SP-2001 | |
| B6.129(Cg)-Cntnap2tm1Pele/J | Jackson Laboratory | 17482 | Animal model |
| Biotinylated Horse anti-Mouse | VECTOR Laboratories | BA-2001 | 1:200 |
| Burker Chamber | Thermo Fisher Scientific | 10628431 | |
| C57BL/6J | Janvier Labs | Animal model | |
| Centrifuge | For 15 mL tubes | ||
| Confocal microscope | Nikon | Confocal A1RHD microscope | |
| Costar 6-well Clear TC-treated | Corning | 3516 | |
| Cy3 Streptavidin | Jackson ImmunoResearch | 016-160-084 | 1:200 |
| Cytosine β-D-arabinofuranoside (AraC) | Sigma | C1768 | 4 µM |
| DAB Substrate Kit, Peroxidase (With Nickel) | VECTOR Laboratories | SK-4100 | |
| Digital Stereotax | KOPF | Model 940 | |
| DMEM/F12 | Thermo Fisher Scientific | 11320082 | Use for the N2 medium |
| DNase I Solution | STEMCELL Technologies | 7900 | 1 µg/mL |
| Doxycyclin | Sigma-Aldrich | D9891 | 2 µg/mL |
| DPBS -/- | Gibco | 14190144 | |
| Epifluorescence microscope | Olympus | BX51 Microscope | |
| Ethanol | Solveco | 70%, 95%, 99.8% | |
| FUW-rTA | Addgene | 20342 | Lentiviral vector |
| FUW-TetO-Ascl1-T2A-puromycin | Addgene | 97329 | Lentiviral vector |
| FUW-TetO-Dlx2-IRES-hygromycin | Addgene | 97330 | Lentiviral vector |
| H1 (WA01) ESC | WiCell | WA01 | Human embryonic stem cell line under a MTA agreement |
| H2O2 | Sigma-Aldrich | 18304 | |
| Hamilton Syringe | Hamilton | 7634-01 | 5 µL |
| HBSS | Gibco | 14175095 | No calcium, No magnesium - Transplantation medium |
| Hoechst 33342 | Invitrogen | H3570 | 1:1000 |
| Hygromycin B | Gibco (Invitrogen) | 10687010 | |
| Incubator | 5% CO2, 37 °C | ||
| Isoflurane Baxter | Apoteket AB | ||
| Manual cell counter | VWR | 720-1984 | |
| Matrigel hESC-Qualified Matrix, LDEV-free | Corning | 354277 | For the coating |
| Methanol | Merck Millipore | 1060091000 | |
| Microscope Coverslips 24 x 60 mm | Thermo Scientific | BBAD02400500#A113MNZ#0## | |
| Microscope Slides | VWR | 631-1551 | |
| Microscope Software | Olympus | CellSens | |
| Mounting media | Merck | 10981 | PVA-Dabco |
| Mouse adaptor to stereotax | RWD | 68030 | |
| mTeSR1 | STEMCELL Technologies | 85850 | Kit Basal Medium and 5X Supplement - Stem cell culture medium |
| N2 supplement | Gibco | 17502048 | |
| NaOH | Sigma-Aldrich | S8045 | 1M |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | |
| Pertex | HistoLab | 811 | |
| Pipet Filler | |||
| Play-Doh | |||
| Puromycin (Dihydrochloride) | Gibco | A1113803 | |
| Round cover glasses thickness No. 1.5H (tol. ± 5 μm) 13 mm Ø | Marienfeld | MARI0117530 | For immunocytochemistry |
| Serum | Thermo Fisher | Goat, Donkey, Horse | |
| Sterile pipette tips | For volumes 0.1-1000 µL | ||
| Sterile serological pipettes | 5, 10, 25 mL | ||
| Sterile water Braun | B Braun | 3626873 | |
| Sucrose | Sigma-Aldrich | S8501 | For 0.5% Sucrose solution |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Trypan Blue Solution | Gibco | 15250061 | |
| Tubes | Sarstedt | 15 ml, Eppendorf 1.5 mL | |
| Tweezer | VWR | ||
| Ultra pure water | MilliQ Water System | ||
| Xylene | VWR | 28973.363 | |
| Y-27632 (ROCK inhibitor) | STEMCELL Technologies | 72304 | 10 µM |
Referencias
- Kostović, I., Jovanov-Milošević, N. The development of cerebral connections during the first 20-45 weeks' gestation. Seminars in Fetal and Neonatal. 11 (6), 415-422 (2006).
- Innocenti, G. M., Price, D. J. Exuberance in the development of cortical networks. Nature Reviews Neuroscience. 6 (12), 955-965 (2005).
- Tang, X., Jaenisch, R., Sur, M. The role of GABAergic signalling in neurodevelopmental disorders. Nature Reviews Neuroscience. 22 (5), 290-307 (2021).
- Kepecs, A., Fishell, G. Interneuron cell types are fit to function. Nature. 505 (7483), 318-326 (2014).
- DeFelipe, J., Alonso-Nanclares, L., Arellano, J. I. Microstructure of the neocortex: Comparative aspects. Journal of Neurocytology. 31 (3-5), 299-316 (2002).
- Radonjić, N. V., et al. Diversity of cortical interneurons in primates: The role of the dorsal proliferative niche. Cell Reports. 9 (6), 2139-2151 (2014).
- Turner, D. A., Shetty, A. K. Clinical prospects for neural grafting therapy for hippocampal lesions and epilepsy. Neurosurgery. 52 (3), 632-644 (2003).
- Gonzalez-Ramos, A., et al. Human stem cell-derived GABAergic neurons functionally integrate into human neuronal networks. Scientific Reports. 11, 22050 (2021).
- Yang, N., et al. Generation of pure GABAergic neurons by transcription factor programming. Nature Methods. 14 (6), 621-628 (2017).
- Nicholas, C. R., et al. Functional maturation of hPSC-derived forebrain interneurons requires an extended timeline and mimics human neural development. Cell Stem Cell. 12 (5), 573-586 (2013).
- Yuan, F., et al. Induction of human somatostatin and parvalbumin neurons by expressing a single transcription factor LIM homeobox 6. eLife. 7, 37382 (2018).
- Fandel, T. M., et al. Transplanted human stem cell-derived interneuron precursors mitigate mouse bladder dysfunction and central neuropathic pain after spinal cord injury. Cell Stem Cell. 19 (4), 544-557 (2016).
- Noakes, Z., et al. Human pluripotent stem cell-derived striatal interneurons: Differentiation and maturation in vitro and in the rat brain. Stem Cell Reports. 12 (2), 191-200 (2019).
- Parikshak, N. N., Gandal, M. J., Geschwind, D. H. Systems biology and gene networks in neurodevelopmental and neurodegenerative disorders. Nature Reviews Genetics. 16 (8), 441-458 (2015).
- Marín, O. Interneuron dysfunction in psychiatric disorders. Nature Reviews Neuroscience. 13 (2), 107-120 (2012).
- Sloan, D. J., Wood, M. J., Charlton, H. M. The immune response to intracerebral neural grafts. Trends in Neurosciences. 14 (8), 341-346 (1991).
- Diehl, R., et al. Immunosuppression for in vivo research: State-of-the-art protocols and experimental approaches. Cellular & Molecular Immunology. 14 (2), 146-179 (2017).
- Osman, M. M., et al. Cyclosporine-A as a neuroprotective agent against stroke: Its translation from laboratory research to clinical application. Neuropeptides. 45 (6), 359-368 (2011).
- Quinnies, K. M., Cox, K. H., Rissman, E. F. Immune deficiency influences juvenile social behavior and maternal behavior. Behavioral Neuroscience. 129 (3), 331-338 (2015).
- Fernandes, D. J., et al. Mouse models of immune dysfunction: their neuroanatomical differences reflect their anxiety-behavioural phenotype. Molecular Psychiatry. 27 (7), 3047-3055 (2022).
- Lund, R. D., Rao, K., Hankin, M. H., Kunz, H. W., Gill, T. J. Transplantation of retina and visual cortex to rat brains of different ages. Maturation, connection patterns, and immunological consequences. Annals of the New York Academy of Sciences. 495, 227-241 (1987).
- Olsson, M., Bentlage, C., Wictorin, K., Campbell, K., Björklund, A. Extensive migration and target innervation by striatal precursors after grafting into the neonatal striatum. Neuroscience. 79 (1), 57-78 (1997).
- Mattis, V. B., et al. Neonatal immune-tolerance in mice does not prevent xenograft rejection. Experimental Neurology. 254, 90-98 (2014).
- Nato, G., et al. Immune-tolerance to human iPS-derived neural progenitors xenografted into the immature cerebellum is overridden by species-specific differences in differentiation timing. Scientific Reports. 11, 651 (2021).
- Allison, T., et al. Defining the nature of human pluripotent stem cell-derived interneurons via single-cell analysis. Stem Cell Reports. 16 (10), 2548-2564 (2021).
- Waloschková, E., et al. Human stem cell-derived GABAergic interneurons establish efferent synapses onto host neurons in rat epileptic hippocampus and inhibit spontaneous recurrent seizures. International Journal of Molecular Sciences. 22 (24), 13243 (2021).
- Gonzalez Ramos, A. . Enhancing neuronal inhibition by cell and gene therapy as a novel treatment for epilepsy. , (2022).
- Paterno, R., et al. Hippocampal gamma and sharp-wave ripple oscillations are altered in a Cntnap2 mouse model of autism spectrum disorder. Cell Reports. 37 (6), 109970 (2021).
- Penagarikano, O., et al. Absence of CNTNAP2 leads to epilepsy, neuronal migration abnormalities, and core autism-related deficits. Cell. 147 (1), 235-246 (2011).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Angeletti, B., et al. An in vivo doxycycline-controlled expression system for functional studies of the retina. Investigative Ophthalmology & Visual Science. 44 (2), 755-760 (2003).
- Doxycycline. Drugs and Lactation Database (LactMed) Available from: https://www.ncbi.nlm.nih.gov/books/NBK500561 (2021)
- Barker, R. A., Widner, H. Immune problems in central nervous system cell therapy. NeuroRX. 1 (4), 472-481 (2004).
- Hoornaert, C. J., et al. Concise review: Innate and adaptive immune recognition of allogeneic and xenogeneic cell transplants in the central nervous system. Stem Cells Translational Medicine. 6 (5), 1434-1441 (2017).
- Englund, U., Fricker-Gates, R. A., Lundberg, C., Bjorklund, A., Wictorin, K. Transplantation of human neural progenitor cells into the neonatal rat brain: Extensive migration and differentiation with long-distance axonal projections. Experimental Neurology. 173 (1), 1-21 (2002).
- Fainstein, N., Ben-Hur, T. Brain region-dependent rejection of neural precursor cell transplants. Frontiers in Molecular Neuroscience. 11, 136 (2018).
- Denham, M., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Frontiers in Cellular Neuroscience. 6, 11 (2012).
- Miguez, A., et al. In vivo progressive degeneration of Huntington's disease patient-derived neurons reveals human-specific pathological phenotypes. bioRxiv. , (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados