Method Article
Transplantation von GABAergen Neuronen aus humanen Stammzellen in den frühen postnatalen Maushippocampus zur Linderung neurologischer Entwicklungsstörungen
In diesem Artikel
Zusammenfassung
Die Transplantation von humanen pluripotenten Stammzellen-abgeleiteten GABAergen Neuronen, die durch neuronale Programmierung erzeugt werden, könnte ein möglicher Behandlungsansatz für neurologische Entwicklungsstörungen sein. Dieses Protokoll beschreibt die Erzeugung und Transplantation von GABAergen neuronalen Vorläufern aus menschlichen Stammzellen in das Gehirn von neonatalen Mäusen, was eine Langzeituntersuchung transplantierter Neuronen und die Bewertung ihres therapeutischen Potenzials ermöglicht.
Zusammenfassung
Eine reduzierte Anzahl oder Dysfunktion von inhibitorischen Interneuronen trägt häufig zu neurologischen Entwicklungsstörungen bei. Daher ist die Zelltherapie mit Interneuronen, um die Auswirkungen veränderter neuronaler Schaltkreise zu ersetzen oder zu mildern, ein attraktiver therapeutischer Weg. Zu diesem Zweck ist mehr Wissen darüber erforderlich, wie aus menschlichen Stammzellen gewonnene GABAerge interneuronähnliche Zellen (hdINs) im Laufe der Zeit in den Wirtsschaltkreisen reifen, sich integrieren und funktionieren. Von besonderer Bedeutung bei neurologischen Entwicklungsstörungen ist ein besseres Verständnis, ob diese Prozesse in transplantierten Zellen von einem sich entwickelnden und reifenden Wirtshirn beeinflusst werden. Das vorliegende Protokoll beschreibt eine schnelle und hocheffiziente Generierung von hdINs aus humanen embryonalen Stammzellen basierend auf der transgenen Expression der Transkriptionsfaktoren Ascl1 und Dlx2. Diese neuronalen Vorläufer werden einseitig nach 7 Tagen in vitro in den Hippocampus von neonatalen 2 Tage alten Mäusen transplantiert. Die transplantierten Neuronen verteilen sich im ipsi- und kontralateralen Hippocampus eines Mausmodells des kortikalen Dysplasie-fokalen Epilepsie-Syndroms und überleben bis zu 9 Monate nach der Transplantation. Dieser Ansatz ermöglicht es, die zelluläre Identität, Integration, Funktionalität und das therapeutische Potenzial von transplantierten Interneuronen über einen längeren Zeitraum bei der Entwicklung gesunder und kranker Gehirne zu untersuchen.
Einleitung
Die Etablierung, Reifung und Verfeinerung neuronaler Netzwerke erfolgt während der perinatalen und frühen postnatalen Phase und stellt ein entscheidendes Zeitfenster für die Entwicklung des Gehirns dar1. Von einem Überschwang der Konnektivität nach der Geburt entwickelt sich das Gehirn zu einer Feinabstimmung von Verbindungen, die sich bis zur Adoleszenzerstrecken 2. Folglich definieren Veränderungen in Genen, die während dieser Zeiträume exprimiert werden, sowie externe Faktoren oder Beleidigungen die Prädisposition eines Individuums für multiple neurologische Entwicklungsstörungen. Beeinträchtigungen der Kognition und der motorischen Funktion entfalten sich im Laufe der Zeit, und pharmakologische Behandlungen sind begrenzt, wobei die Mehrheit auf Symptome mit dem Risiko schwerer Nebenwirkungen abzielt.
Es hat sich gezeigt, dass eine Dysfunktion der Gamma-Aminobuttersäure (GABA)ergen Hemmung einen wesentlichen Beitrag zur zugrunde liegenden Ursache verschiedener neurologischer Entwicklungsstörungenleistet 3, wie z. B. Fragile-X-Syndrom, Angelman-Syndrom, Epilepsie, Schizophrenie und Autismus. GABA ist der wichtigste hemmende Transmitter des zentralen Nervensystems und ist entscheidend für die Aufrechterhaltung des exzitatorischen / inhibitorischen (E / I) Gleichgewichts, die Synchronisation des neuronalen Feuerns und die Berechnung. GABAerge Interneurone sind eine heterogene Population von Neuronen mit zunehmender funktioneller Komplexität in komplexeren Hirnregionen4 und mit Evolution 5,6. In Anbetracht der begrenzten endogenen Regenerationskapazität des menschlichen Gehirns und der Auswirkungen von Interneuron-Dysfunktion bei mehreren neurologischen Erkrankungen könnte die Transplantation von GABAergen Interneuronen ein vielversprechender therapeutischer Weg sein. In diesem Sinne scheinen aus menschlichen Stammzellen gewonnene GABAerge interneuronenähnliche Zellen (hdINs) die translationalste und praktikabelste Quelle für diesen Zweck zu sein, verglichen mit allogenen neuronalen Vorläufern von Nagetieren oder anderen Quellen, die anderswo verwendetwerden 7. Protokolle zur Erzeugung von GABAergen Neuronen aus verschiedenen Zellquellen sind verfügbar 8,9,10,11,12,13, aber es ist mehr Wissen darüber erforderlich, wie hdINs im Laufe der Zeit in einem sich entwickelnden pathologischen Gehirn reifen, sich integrieren und funktionieren. Mehrere Studien haben Veränderungen in Genen identifiziert, die während der kortikalen Musterbildung aktiv sind, die neuronale Konnektivitätherstellen 14 und die physiologische E/I-Balance15 abstimmen. Die neonatale Transplantation von hdINs in Mausmodelle mit entsprechenden genetischen Störungen ermöglicht es uns, das Zusammenspiel zwischen Wirt und Transplantat zu verfolgen, was ein Wissen ist, das notwendig ist, um mögliche therapeutische Strategien zu bestimmen.
Die Immunmodulation wird häufig und erfolgreich bei Xenograft-Transplantationen eingesetzt, um die Auslösung einer Immunantwort und Abstoßung des Wirts zu vermeiden16. Die Verabreichung von Immunsuppressiva wie Ciclosporin A verursacht jedoch Nierentoxizität nach chronischer Verabreichung, ist arbeitsintensiv, da tägliche intraperitoneale Injektionen erforderlich sind, um stabile systemische Konzentrationen zu erreichen, was Tierstress verursacht17, und hat Off-Target-Effekte, die mit der Pathologie interagieren können18. Darüber hinaus hat sich gezeigt, dass die Kompromittierung des Immunsystems Verhaltensphänotypenverändert 19, mit Veränderungen in den entsprechenden neuroanatomischen Regionen20. Es wurde gezeigt, dass die Transplantation in der ersten Lebenswoche eine Anpassung an transplantierte Zellen ermöglicht 21,22, während andere über ein anfängliches Überleben gefolgt von einer Abstoßung der Transplantate innerhalb des ersten postnatalen Monats berichteten 23,24.
Dieses Protokoll beschreibt Verfahren von der hdIN-Erzeugung bis zur Zelltransplantation bei neonatalen Mäusen, die zu einem langfristigen Überleben der Transplantate führen und die Untersuchung der neuronalen Spezifität, synaptischen Integration, Funktion und des therapeutischen Potenzials transplantierter menschlicher Interneuronen während der physiologischen und pathologischen Entwicklung ermöglichen.
Protokoll
Alle experimentellen Verfahren wurden vom Malmö/Lund Animal Research Ethics Board, Ethical Permit Nummer 12548-19, genehmigt und in Übereinstimmung mit den Vorschriften der schwedischen Tierschutzbehörde und der EU-Richtlinie 2010/63/EU für Tierversuche durchgeführt. C57BL6/J und Contactin-associated protein-like 2 (Cntnap2) knock-out (KO) Mäuse, sowohl Männchen als auch Weibchen, wurden am postnatalen Tag (P) 2 für die vorliegende Studie verwendet. Es wurden humane embryonale Stammzellen (hES-Zellen) verwendet. Die Tiere und Stammzellen wurden aus kommerziellen Quellen gewonnen (siehe Materialtabelle).
1. Generierung der hdIN-Vorstufen
HINWEIS: Alle Schritte in diesem Abschnitt werden in einer Zellkulturhaube durchgeführt. Die hES-Zellen wurden als feederfreie Zellen auf beschichteten Platten unter Verwendung eines Stammzellkulturmediums gehalten und als Kolonien durchgelassen.
- Führen Sie eine Vorwärtsprogrammierung der hESCs zu hdIN-Vorläufern durch (Abbildung 1).
ANMERKUNG: Der Ansatz der Vorwärtsprogrammierung basiert auf dem in Gonzalez-Ramos et al.8 und Yang et al.9 beschriebenen Verfahren.- Transduzieren der hES-Zellen mit lentiviralen Vektoren, die das Tet-On-System enthalten, in ein frisches Stammzellkulturmedium, das 10 μM ROCK-Inhibitor (RI) enthält (siehe Materialtabelle). Bei 37 °C im Inkubator aufbewahren.
- Wechseln Sie das Medium 16 h nach der Transduktion in ein frisches Stammzellkulturmedium und erhalten Sie die transduzierten Zellen auf die gleiche Weise wie die nicht transduzierten hES-Zellen.
- Wenn sie konfluieren, lösen Sie die hES-Zellen als Einzelzellen mit einer Zellablösungslösung (siehe Materialtabelle) und schichten sie in beschichtete 6-Well-Platten mit einer Dichte von 3 x 105 Zellen/Vertiefung in Stammzellkulturmedium, das 10 μM RI am Tag in vitro (DIV) −1 enthält.
- Bei 1 DIV wird das Kulturmedium durch N2-Medium ersetzt, das 2 g/L Doxycyclin enthält (DOX, siehe Materialtabelle).
HINWEIS: DOX wird verwendet, um die Transgenexpression von Ascl1 und Dlx29 von 1 DIV bis 7 DIV zu induzieren, und setzt sich dann in vivo durch Zugabe zum Trinkwasserfort 25. - Bei 2 DIV beginnt eine Antibiotikaresistenz-Selektionsperiode, die bis 5 DIV dauert. Geben Sie Puromycin (Puro) und Hygromycin (Hygro) zum frischen Medium hinzu (siehe Materialtabelle). Ändern Sie das Medium auf 2 DIV, 4 DIV und 5 DIV.
HINWEIS: Optimieren Sie die Konzentrationen von Puro und Hygro vor dem Differenzierungsprotokoll unter Verwendung transduzierter und nicht transduzierter hES-Zellen, um das Überleben nur der Zellen zu gewährleisten, die die Antibiotikaresistenzkassetten tragen. In diesem Protokoll wurden 0,5 μg/ml Puro und 750 μg/ml Hygro verwendet. - Bei 5 DIV endet die Antibiotika-Auswahlperiode. Wechsel zu N2-Medium, ergänzt mit 2 g/L DOX und 4 μM Cytosin β-D-Arabinofuranosid (Ara-C, siehe Materialtabelle).
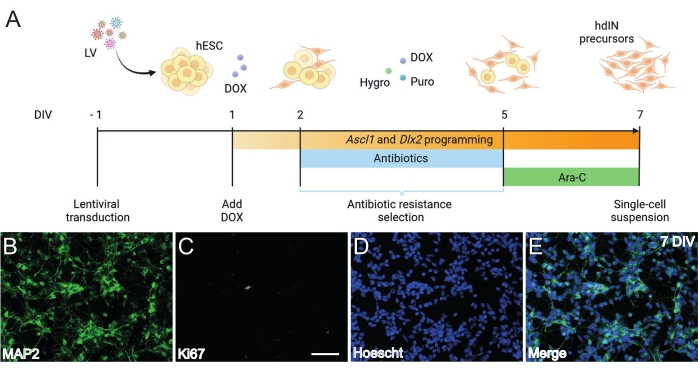
Abbildung 1: Erzeugung von hdIN-Vorläufern aus hESCs durch Überexpression von Ascl1 und Dlx2. (A) Schematische Darstellung des für die Erzeugung von hdIN-Vorläufern verwendeten Differenzierungsprotokolls. (B-E) Immunzytochemie von hdIN-Vorläufern bei 7 DIV für (B) den neuronalen Marker MAP2, (C) den proliferativen Marker Ki67, (D) allgemeine Kernfärbung und (E) eine Zusammenführung der vorherigen Marker. Maßstabsleiste: 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. Vorbereitung der einzelligen Suspension für die Transplantation
HINWEIS: Alle Schritte in diesem Abschnitt werden in der Zellkulturhaube durchgeführt. Auf 7 DIV werden hdIN-Vorläufer dissoziiert und für die Transplantation verwendet.
- Führen Sie das Trennen der Zellen aus, indem Sie die folgenden Schritte ausführen.
- Entfernen Sie das Medium und spülen Sie die Zellen vorsichtig mit DPBS ohne Kalzium und Magnesium aus.
- Fügen Sie 400 μL der Zellablösungslösung (siehe Materialtabelle) in jede Vertiefung der 6-Well-Platte hinzu.
HINWEIS: Stellen Sie sicher, dass die gesamte Oberfläche durch die Lösung abgedeckt wird. - Inkubieren Sie für 2-3 min bei 37 °C im Inkubator, bis der Rand der Zellen glänzend aussieht, was auf einen enzymatischen Abbau von Zelloberflächenproteinen und eine Ablösung von der Welloberfläche hinweist.
HINWEIS: Um das Überleben der Zellen zu erhöhen, warten Sie nicht zu lange, wenn alle Zellen vollständig abgelöst sind und herumschwimmen. - Fügen Sie dann 600 μL frisches N2-Medium zu jeder Vertiefung der 6-Well-Platte hinzu, um das Enzym zu stoppen, und helfen Sie mechanisch mit der Pipette, die Zellen zu lösen, um eine einzellige Suspension zu erhalten.
- Die Zellsuspension in ein Kunststoffröhrchen (15 ml) geben und bei 180 x g für 4 min bei Raumtemperatur (RT) zentrifugieren.
- Führen Sie eine Resuspension der Zellen durch.
- Der Überstand wird mit einem Vakuumsystem verworfen (vorsichtig, ohne das Pellet zu stören) und resuspendiert das Pellet im Transplantationsmedium, das 10 μM RI, 1 μg/ml DNase und 2 μg/μL DOX enthält.
- Zählen Sie die gesamten Zellen in der Suspension mit einer Zählkammer und einem manuellen Zellzähler und stellen Sie das Volumen auf eine Endkonzentration von 100.000 Zellen/μL ein.
- Bewahren Sie die Zellsuspension bis zur Transplantation in einem geschlossenen Röhrchen auf Eis für maximal 4 h auf.
HINWEIS: Die Transplantation muss am selben Tag wie die Herstellung der Zellsuspension (7 DIV) durchgeführt werden.
3. Intrahippocampus-Zelltransplantation
HINWEIS: Alle Schritte in diesem Abschnitt werden außerhalb der Zellkulturhaube in der Tiereinrichtung durchgeführt. Die frühe postnatale Transplantation von Zellen in das Gehirn wurde auf P2 durchgeführt, wobei P0 am Tag der Geburt berücksichtigt wurde.
- Bereiten Sie sich auf das Transplantationsexperiment vor, indem Sie die folgenden Schritte ausführen.
- Autoklavieren Sie das gesamte chirurgische Material oder, falls dies nicht möglich ist, sterilisieren Sie es mit einer anderen zugelassenen Methode.
- Montieren Sie die Injektionsspritze ohne Glaskapillare in den Halter. Spülen Sie die Nadel mit Wasser ab.
HINWEIS: Die Nadel muss 33 G groß sein. - Die Spitze einer 30 G Insulinnadel um 90° krümmen.
- Erstellen Sie eine selbstgebaute Play-Doh-ähnliche Bühne, um den Welpen mit flachem Kopf zu positionieren (Abbildung 2A).
- Holen Sie den Mäusekäfig mit der Mutter und den Welpen, bevor Sie etwas für die Operation vorbereiten, damit sie sich an die neue Umgebung gewöhnen können.
- Bereiten Sie ein Tablett mit nassem Eis und einen leeren Käfig mit etwas Papier für das Isofluran vor.
- Betäuben Sie den Mäusewelpen.
- Weichen Sie ein Stück Papier mit Isofluran ein (siehe Materialtabelle) und legen Sie es in den leeren Käfig. Nehmen Sie vorsichtig einen Welpen und legen Sie ihn in den Käfig mit dem in Isofluran getränkten Papier.
HINWEIS: Lassen Sie niemals weniger als drei Welpen bei der Mutter. Überschreiten Sie nicht 20-30 s Isofluran-Anästhesie, sonst kann der Welpe sterben. - Überprüfen Sie die Wirkung der Anästhesie durch Bewegungsbeendigung.
- Unmittelbar nach der Narkose legen Sie den Welpen auf ein feuchtes Tuch auf der Oberfläche von nassem Eis. Halten Sie das Tier 3 Minuten lang auf Eis, bis die oberen Gliedmaßen weißlich werden (Abbildung 2B, blauer Pfeil). Dies dauert in der Regel 2-3 Minuten.
- Verwenden Sie diese Zeit zum Beladen der Spritze mit der Zellsuspension. Resuspendieren Sie die Zellen vorher vorsichtig mit einer Pipette.
- Legen Sie den Welpen auf den stereotaktischen Rahmen. Verwenden Sie die Ohrbalken in entgegengesetzter Richtung (Abbildung 2A, Magentapfeile).
HINWEIS: Die Rückseite der Ohrbügel ist weniger spitz, und da P2-Welpen keine Ohren haben, verwenden Sie die flachere Seite, um das Tier nicht zu verletzen. - Überprüfen Sie von der Seite, ob der Kopf gerade ist. Der Kopf muss flach sein; Verwenden Sie die Play-Doh-ähnliche Bühne, um sich darauf einzustellen.
HINWEIS: Welpen in diesem Alter haben ihre Augen noch nicht geöffnet, so dass kein zusätzlicher Schritt in dieser Hinsicht getan werden muss. Welpen haben in diesem Alter kein Fell, daher ist keine Rasur des Bereichs erforderlich. Es wird keine spezifische Schmerzbehandlung durchgeführt, da es sich nicht um einen offenen Hautschnitt handelt und keine Naht erforderlich ist. - Halten Sie den Welpen während der gesamten Dauer der Operation auf Eis bedeckt (auf Seidenpapier).
HINWEIS: Legen Sie das Eis nicht in direkten Kontakt mit der Haut des Welpen.
- Weichen Sie ein Stück Papier mit Isofluran ein (siehe Materialtabelle) und legen Sie es in den leeren Käfig. Nehmen Sie vorsichtig einen Welpen und legen Sie ihn in den Käfig mit dem in Isofluran getränkten Papier.
- Führen Sie die Injektion durch.
- Reinigen Sie die Hautoberfläche mit einem mit Ethanol getränkten Weichgewebe.
- Identifizieren Sie Lambda und setzen Sie die Koordinaten auf der digitalen Anzeigekonsole des stereotaktischen Instruments auf Null (Abbildung 2C, gelbe gestrichelte Linie). Sagittale und lambdoide Nähte sind für das Auge leicht sichtbar, da sie vaskularisiert sind, als rote Linien.
HINWEIS: Wenn Sie Schwierigkeiten haben, Lambda zu visualisieren, legen Sie ein kleines Stück Eis auf die Haut und warten Sie einige Minuten, bis es abgekühlt ist. Entfernen Sie dann das Stück Eis, und die subtile Aufhellung der Haut ermöglicht es Ihnen, zu visualisieren. - Verschieben Sie die Injektionsnadel auf die gewünschten Koordinaten. Im beschriebenen Protokoll war die Zielregion der Hippocampus, und die Koordinaten waren wie folgt: anterior-posterior (AP) +0,85 und medio-lateral (ML) +1,35.
- Verwenden Sie eine um 90° gebogene Insulinnadel, um in den Schädel einzudringen und ein winziges Loch zu erzeugen.
- Bringen Sie die Injektionsnadel herunter, bis sie den Schädel durchquert hat, und stellen Sie die dorso-ventralen (DV) Koordinaten auf Null. Senken Sie die Nadel, bis die gewünschten DV-Koordinaten vorliegen. Im beschriebenen Protokoll waren die Koordinaten DV −1,1.
- Injizieren Sie nach den vorgegebenen Zeitintervallen.
HINWEIS: Im beschriebenen Protokoll waren die genauen Zeiten die folgenden: (i) nachdem Sie zur DV-Koordinate gegangen sind, warten Sie 3 Minuten, (ii) injizieren Sie 1 μL Volumen für 5 Minuten und (iii) nachdem das gesamte Volumen injiziert wurde, warten Sie 3 Minuten. - Ziehen Sie die Nadel langsam zurück.
- Beenden Sie den Vorgang.
HINWEIS: Die Operation darf nicht länger als 15 Minuten dauern, um das Überleben des Welpen zu sichern und Schäden durch die Anästhesie durch Unterkühlung zu vermeiden.- Wärmen Sie den Welpen mit den Händen auf, bis er sich zu bewegen beginnt, bevor Sie ihn der Mutter zurückgeben.
- Verabreichen Sie DOX in einer Konzentration von 1 mg/ml in 0,5%iger Saccharoselösung als Trinkwasser für mindestens 2 Tage vor und 3 Wochen nach der Transplantation (PT), um die Zelldifferenzierung in vivo fortzusetzen.
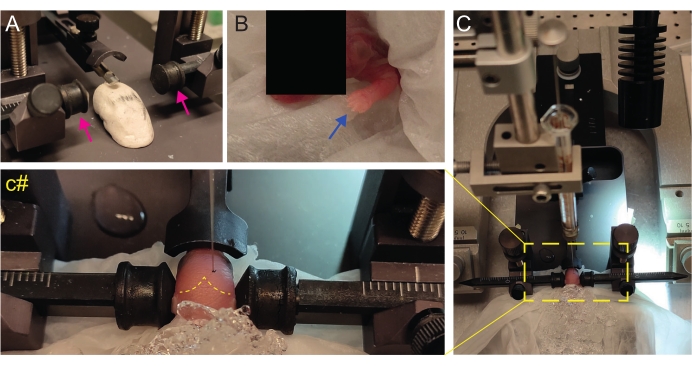
Abbildung 2: Stereotaktische Transplantation bei neugeborenen Mäusewelpen bei P2. (A) Eine Play-Doh-ähnliche Stufe zum Halten des Welpenkörpers in Position und umgekehrte Ohrbalken (Magentapfeile). (B) Weiße Vorderpfote (blauer Pfeil), die auf den verminderten Blutfluss in diesem Bereich hinweist, so dass der Welpe eine Anästhesie durch Unterkühlung erfährt. (C) Überblick über den Aufbau mit dem Welpen, der bereits mit Eis über dem weichen Seidenpapier bedeckt ist. (c#) Geschlossener Zoom des Kopfes des Welpen, wobei die Injektionsnadel bereits in das Gehirn eingeführt wurde (gelbe gestrichelte Linie, die Lambda- und Lambdoidnähte anzeigt). Diese Figur stammt von Gonzalez Ramos et al. 27. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Nach dem hier vorgestellten und in Abbildung 1A dargestellten Protokoll waren hdIN-Vorläufer bei 7 DIV noch nicht proliferativ, definiert durch (i) negative Immunreaktivität für den Zellzyklusmarker Ki67 und (ii) exprimierende neuronale Marker wie Mikrotubuli-assoziiertes Protein 2 (MAP2) (Abbildung 1B-E). Diese Charakterisierung wurde an übrig gebliebenen Zellen durchgeführt, die nach Durchführung aller Verfahrensschritte für 24 h neu plattiert wurden. Darüber hinaus zeigte die zuvor veröffentlichte Genexpressionsanalyse, dass ein schneller Übergang vom pluripotenten Zustand zu einem neuronalen Phänotyp um 4 DIV und 7 DIV8 stattfindet. Insgesamt bestätigten diese Ergebnisse das Vorhandensein postmitotischer Zellen und das Fehlen eines Risikos für die Teratombildung.
Als nächstes wurde das Überleben der hdIN-Vorläufer nach einer frühen postnatalen Transplantation in den Hippocampus von Wildtyp-Mäusen (WT) immunhistochemisch gegen den humanen zytoplasmatischen Marker STEM121 getestet. Die hdIN-Vorläufer wurden in den rechten dorsalen Hippocampus von naiven immunkompetenten Mäusen bei P2 transplantiert, die dann bei P14 und 2 Monaten PT geopfert wurden. Gepfropfte Zellen wurden zu beiden Zeitpunkten über den gesamten dorsalen Hippocampus gefunden und durch den Corpus callosum und den kontralateralen Hippocampus verteilt. Darüber hinaus exprimierten gepfropfte hdINs zu beiden Zeitpunkten Ascl1, einen der Induktionstranskriptionsfaktoren (ergänzende Abbildung 1), und waren nicht proliferativ, wie das Fehlen der Ki67-Expression zeigt (ergänzende Abbildung 2).
Wichtig ist, dass weder bei P14 noch bei 2 Monaten PT eine Immunreaktion oder lokale Entzündung gegen die transplantierten Zellen gefunden wurde, was durch das Fehlen reaktiver Mikroglia beurteilt wurde, die mit Iba1, CD68 und Galectin-3 (Gal3) identifiziert wurden (Abbildung 3), das Ausmaß der Astrogliose, das durch das saure Gliafibrillenprotein (GFAP) und entzündliche Zytokine wie Interleukin-1 (IL-1) bestimmt wird. und das Fehlen zytotoxischer T-Lymphozyten (CD8) (Abbildung 4).
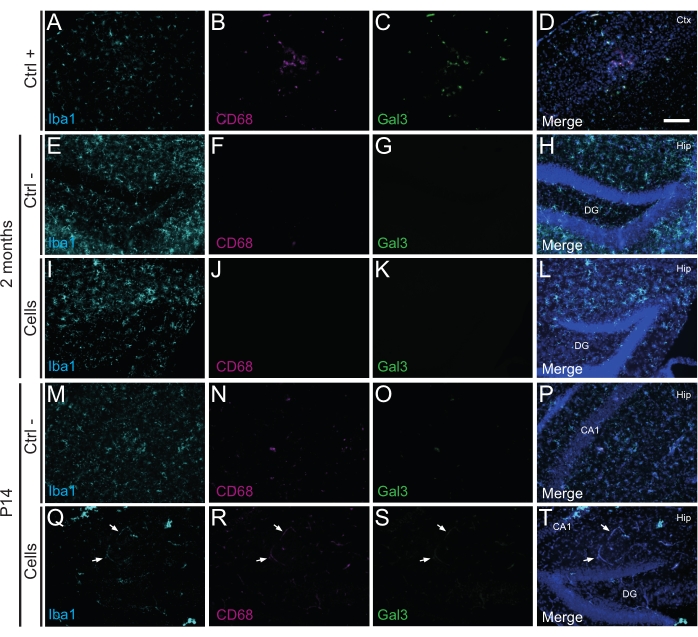
Abbildung 3: hdINs bei P14 und 2 Monaten PT in den Hippocampus neugeborener WT-Mäuse, ohne eine Immunabstoßung aus dem Wirtsgewebe auszulösen. Immunfluoreszenz für Iba1-, CD68- und Gal3-Marker im Hirngewebe aus (A-D) die Nähe eines ischämischen Kernbereichs in einem Elektrokoagulations-Schlaganfall-Mausmodell (Positivkontrolle, Strg +), (E-H) Negativkontrolltiere (Ctrl-) nach 2 Monaten und (M-P) P14 und (I-L) Tiere, die nach 2 Monaten einer Zelltransplantation unterzogen wurden und (Q-T) ) S. 14. Die weißen Pfeile zeigen einige Beispiele für Blutgefäße, die aufgrund von Autofluoreszenz an allen Kanälen sichtbar sind. Abkürzungen: Ctx = Kortex; Hüfte = Hippocampus; DG = Gyrus dentatus; CA1 = cornu ammonis 1. Maßstabsleiste: 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
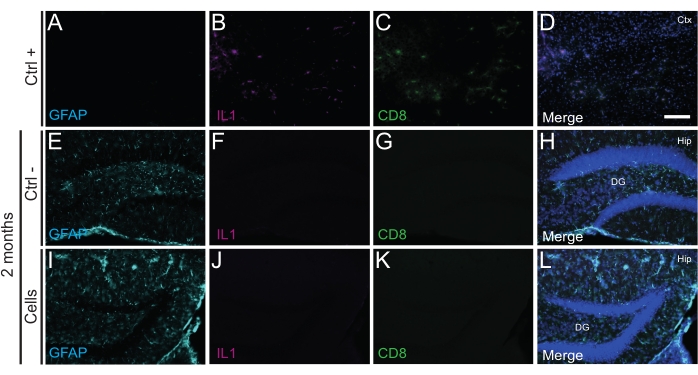
Abbildung 4: hdINs nach 2 Monaten PT in den Hippocampus neugeborener WT-Mäuse, ohne eine Immunabstoßung aus dem Wirtsgewebe auszulösen. Immunfluoreszenz für IL1-, GFAP- und CD8-Marker im Hirngewebe aus (A-D) die Nähe eines ischämischen Kernbereichs in einem Elektrokoagulations-Schlaganfall-Mausmodell (Positivkontrolle, Strg +), (E-H) Negativkontrolltiere (Strg-) nach 2 Monaten und (I-L) Tiere, die nach 2 Monaten einer Zelltransplantation unterzogen wurden. Abkürzungen: Ctx = Kortex; Hüfte = Hippocampus; DG = Gyrus dentatus. Maßstabsleiste: 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
In ähnlicher Weise wurden hdIN-Vorläufer auch in den Hippocampus von Cntnap2 KO-Mäusen transplantiert, einem Modell für Autismus-Spektrum-Störungen und kortikale Dysplasie-fokale Epilepsie-Syndrom. In den Cntnap2-KO-Mäusen überlebten die hdINs tatsächlich bis zu 9 Monate PT und waren an der Injektionsstelle lokalisiert, obwohl sie auch über den ipsilateralen und sogar den kontralateralen Hippocampus verteilt waren, wie bei den WT-Mäusen beobachtet (Abbildung 5). Darüber hinaus waren die meisten der transplantierten hdINs immunreaktiv für Interneuronmarker, wie aus früheren Ergebnissen in vitro 8,26 und bei erwachsenen Nagetieren in vivo25 zu erwarten war.
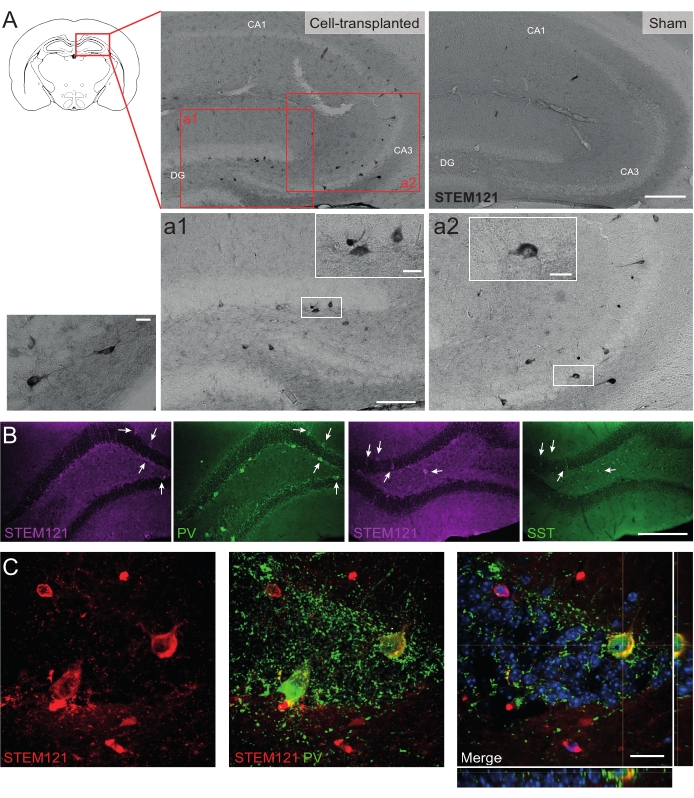
Abbildung 5: Gepfropfte hdINs im Hippocampus von Cntnap2 KO-Mäusen nach 9 Monaten PT. (A) Immunchemie gegen den zytoplasmatischen Humanmarker STEM121 in zelltransplantierten (links) und Scheinmäusen (rechts). (A1 und A2) Vergrößerte Bilder von STEM121-positiven Zellen. (B) Immunfluoreszenz für STEM121 (Magenta) und die Interneuronmarker Parvalbumin (PV) und Somatostatin (SST). Weiße Pfeile zeigen doppelt positive Zellen für STEM121 und den jeweiligen Interneuronmarker an. (C) Orthogonale Ansicht eines transplantierten hdIN-Immunreaktiven für STEM121 und PV. Maßstabsleiste: 200 μm (A und B), 100 μm (a1 und a2), 20 μm (kleine quadratische Vergrößerung in a1 und a2 und C). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Abbildung 1: Gepfropfte hdINs nach 2 Monaten PT in den Hippocampus neugeborener WT-Mäuse, die Ascl1 exprimieren. Immunfluoreszenz gegen Ascl1 und den zytoplasmatischen Humanmarker STEM121 an der (A) CA3 und (B) DG in zelltransplantierten WT-Mäusen. (a) Vergrößertes Bild einer positiven STEM121-Zelle. Die weißen Pfeile zeigen doppelpositive Zellen für STEM121 und Ascl1 an. Maßstab: 100 μm. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Postmitotische transplantierte hdINs nach 2 Monaten PT in den Hippocampus neugeborener WT-Mäuse. Immunfluoreszenz gegen den proliferativen Marker Ki67 und den zytoplasmatischen Humanmarker STEM121 in (A) naiven und (B) zelltransplantierten WT-Mäusen. (b) Vergrößertes Bild einer positiven STEM121-Zelle. Der gelbe Pfeil zeigt eine Zelle an, die positiv für Ki67 und negativ für STEM121 ist. Der weiße Pfeil zeigt Zellen an, die positiv für STEM121 und negativ für Ki67 sind. Das weiße Sternchen weist auf einen seitlichen Ventrikel hin. Maßstab: 100 μm. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Das vorliegende Protokoll beschreibt eine robuste, schnelle, einfache und allgemein zugängliche Methodik zur Erzeugung von hdIN-Vorläufern in vitro und deren Verwendung als frühe interventionelle Zelltherapie in präklinischen Modellen neurologischer Entwicklungsstörungen.
Obwohl einige der charakteristischen Phänotypen neurologischer Entwicklungsstörungen im Jugend- oder Erwachsenenalter auftreten, sind pathophysiologische Veränderungen bereits in der frühen Entwicklung vorhanden. Aus diesem Grund wäre eine frühzeitige Intervention sehr gerechtfertigt, um positive Effekte zu erzielen, indem sie in kritischen Gehirnentwicklungsphasen vor der Symptomatik oder klinischen Manifestation wirkt. In Zukunft werden genetisches Screening und die Entwicklung von Biomarkern eine prophylaktische oder präsymptomatische Behandlung ermöglichen, was für diese Patienten einen Game Changer darstellt. Daher wurden hdIN-Vorläufer früh nach der Geburt im Cntnap2 KO-Mausmodell transplantiert, wenn epileptogene Veränderungen im neuronalen Netzwerk im Gange sein könnten28 und zu einem Zeitpunkt, zu dem zelluläre Veränderungen in diesem Tiermodellbeschrieben wurden 29. Es ist jedoch wichtig, die möglichen Fallstricke der Altersextrapolation und das Timing bestimmter Prozesse in der Maus im Vergleich zum menschlichen Gehirn zu berücksichtigen.
Das hier vorgestellte Differenzierungsprotokoll konzentriert sich auf das Verfahren selbst und basiert auf der Verwendung von Transkriptionsfaktoren, die eine schnelle und hocheffiziente Programmierung von Stammzellen im Vergleich zu anderen Protokollen auf Basis kleiner Moleküleermöglichen 10,30. Ein möglicher Nachteil dieses Ansatzes könnte der Bedarf an lentiviralen Vektoren sein, der ein Risiko der Insertionsmutagenese birgt. Zwei kritische Schritte im Protokoll sind die Zugabe der Antibiotika und des Antimitotikums zum Medium, um Zellen auszuwählen, die die Transkriptionsfaktoren exprimieren, und proliferative Zellen zu eliminieren, wodurch das Risiko der Teratombildung vermieden wird. Obwohl in dieser Studie nur hdIN-Vorläufer getestet wurden, wird erwartet, dass das Verfahren mit anderen Zellquellen und Programmier-/Differenzierungsprotokollen durchführbar ist. Dennoch sollten andere neuronale Subtypen und/oder Modelle validiert werden.
Das Alter des hdIN-Vorläufers für die Transplantation, 7 DIV, wurde auf der Grundlage (i) des Fehlens proliferativer Zellen, bewertet durch Immunreaktivität gegen Ki67, (ii) zusammen mit der zuvor berichteten Beobachtung einer Abnahme der Expression von Pluripotenzgenen wie POU5F1 und dem Auftreten des neuronalen Markers MAP2 und des Interneuronmarkers GAD1 zu diesem Zeitpunktbestimmt 8 . Die ursprüngliche Arbeit, die dieses Protokoll beschreibt, führte jedoch Transplantationen bei 14 DIV nach DOX-Entzugdurch 9. Dies wirft die Frage auf, ob DOX im Trinkwasser der Mutter Zellen erreichen kann, die über die Milch in das Gehirn von stillenden Welpen gepfropft wurden, oder ob 7 DIV DOX-Induktion ausreichen, um das GABAerge Schicksal zu bestimmen. Obwohl Yang et al. 14 Tage DOX als ausreichend identifizierten, um stabile neuronale Zellen in vitro9 zu erzeugen, wiesen Gonzalez-Ramos et al.8 die GAD1-Genexpression bereits bei 7 DIV nach, was darauf hindeutet, dass die nachgeschaltete Aktivierung von GAD67 durch Ascl1 und Dlx2 zu diesem Zeitpunkt bereits stattgefunden hat. Daher hat die Musterbildung bei 7 DIV begonnen und ist möglicherweise weniger abhängig von der DOX-Behandlung. Darüber hinaus deuten Beweise bei Nagetieren und Menschen auf das Vorhandensein von DOX in der Muttermilch 31,32 hin, und die hier vorgestellten Ergebnisse zeigen, dass transplantierte hdINs fürAscl1 nach 2 Wochen und 2 Monaten PT immunreaktiv waren und Interneuronmarker später nach 9 Monaten PT. Innerhalb der transplantierten Population wurden neben PV- und SST-positiven Neuronen auch andere Marker für Subpopulationen von Interneuronen in geringeren Mengen gefunden, wie Calretinin (CR) und Calbindin (CB).
Ein herausfordernder Aspekt dieses Verfahrens ist die Koordination der Zeitpunkte sowohl für die Differenzierung als auch für das Alter der Welpen. Normalerweise dauert die Trächtigkeit der Maus 21 Tage nach dem Einrichten des Paarungskäfigs, obwohl dies manchmal variieren kann. Dieses Szenario tritt nicht auf, wenn Zelltransplantationen bei erwachsenen Nagetieren durchgeführt werden, wenn alles sorgfältig geplant und arrangiert werden kann. Dies kann jedoch leicht gemildert werden, indem zwei bis drei Steckkäfige mit einem Abstand von 2 Tagen oder zwei bis drei Differenzierungschargen mit einem Zeitraffer von 2 Tagen voneinander aufgestellt werden.
Obwohl die in dieser Studie verwendeten Mäuse weder immundefizient noch immunsupprimiert waren, überlebten die transplantierten Zellen bis zu 9 Monate in vivo, und Marker der Immunreaktion gegen xenogene Zellen oder lokale Entzündungen wurden weder bei P14 noch bei 2 Monaten PT beobachtet. Die Immunabstoßung transplantierter xenogener Zellen wird gegen MHC / Peptide ausgelöst, und die wichtigsten zellulären Mediatoren der Transplantatabstoßung sind T-Lymphozyten und Mikrogliazellen33. 34. Daher wurde die Immunreaktivität gegenüber Markern von T-Zellen sowie reaktiven Mikroglia untersucht. Es wurden keine Anzeichen einer Immunabstoßung der transplantierten Zellen im Wirtsgewebe nachgewiesen, weder durch Konzentrationen reaktiver Mikroglia noch durch das Vorhandensein von T-Lymphozyten in WT-Mäusen nach P14 oder 2 Monaten. Darüber hinaus wurde keine lokale Entzündung basierend auf den bewerteten Astrogliose- und inflammatorischen Zytokinen beobachtet. Dieses Ergebnis könnte teilweise von der neonatalen Immuntoleranz 35,36,37 abhängen, die von anderen Zellidentitäten, Orten und Tiermodellen beobachtet wird35,38. Englund et al. identifizierten regionale Unterschiede im Ergebnis der transplantierten Zellen in Bezug auf Migration und Reifung, einschließlich der Beobachtung transplantierter Zellen in der angrenzenden weißen Substanz35.
Schließlich wurde eine größere Dispersion der transplantierten Zellen innerhalb des Hippocampus beobachtet im Vergleich zu anderen Studien, die in erwachsene Nagetiere transplantiert wurden, wo hdINs als gepfropfter Kernverblieben 25. Diese Streuung unterschied sich auch von den zuvor von Yang et al.9 beobachteten Ergebnissen, was in diesem Fall durch das Alter der Zellen zum Zeitpunkt der Transplantation erklärt werden konnte.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Dieses Projekt wurde vom schwedischen Forschungsrat (Förderkennzeichen: 2016-02605, M.A.), der Swedish Brain Foundation F02021-0369 (M.A.), der Crafoord Foundation (M.A.) und dem Horizon 2020 Programme der Europäischen Union (H2020-MSCA-ITN-2016) im Rahmen des Marie Skłodowska-Curie Innovative Training Network Projekts Training4CRM No. 722779 (M.K.) finanziert. Wir sind sehr dankbar für die Hilfe von Andrés Miguez aus dem Labor von Josep Maria Canals (Labor für Stammzellen und regenerative Medizin, Universität Barcelona) für das Unterrichten stereotaktischer Zelltransplantation bei P2-Neugeborenen Mäusen und Mackenzie Howard, Gruppenleiter an der University of Texas in Austin, für die Beratung und vorläufigen Koordinaten für die Zelltransplantation in den Hippocampus von P2-Neugeborenen. Wir danken Susanne Geres für die Unterstützung bei der Tierpflege und Ling Cao für die Hilfe bei der Verarbeitung von Gewebe, sowie Studenten, die auf die eine oder andere Weise zur Studie beigetragen haben, insbesondere Diana Hatamian. Schließlich wurden einige der Grafiken, die zur Illustration dieses Papiers verwendet wurden, mit BioRender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 30 G needle | B Braun | 4656300 | |
| 33 G needle for Hamilton syringe | Hamilton | 7762-06 | |
| 4-well plates | Thermo Scientific | 176740 | |
| Accutase | STEMCELL Technologies | 7920 | Cell detachment solution use for splitting cells (hESC and hdIN precursors) |
| Adjustable volume pipettes 10, 20, 200, 1000 µL | |||
| Alexa Fluor Plus 488/555/647 | Thermo Fisher | 1:1000 | |
| Anti-CD68 (Rat) | Bio-Rad | MCA1957 | 1:200 |
| Anti-CD8 (Rabbit) | Abcam | 203035 | 1:200 |
| Anti-Galectin 3 (Goat) | R&D systems | AF1197 | 1:500 |
| Anti-GFAP (Guiena Pig) | Synaptic systems | 173004 | 1:500 |
| Anti-Iba1 (Rabbit) | WAKO | 19119741 | 1:500 |
| Anti-IL1 (Goat) | Santa Cruz Biotech | SC-106 | 1:400 |
| Anti-Ki67 | Abcam | ab16667 | 1:250 |
| Anti-Ki67 (Rabbit) | Novocastra | NCL-Ki67p | 1:250 |
| Anti-MAP2 (Chicken) | Abcam | ab5392 | 1:2000 |
| Anti-Mash1 (Ascl1) | Abcam | ab74065 | 1:1000 |
| Anti-Parvalbumin (Rabbit) | Swant | PV 27 | 1:5000 |
| Anti-Somatostatin (Rat) | Millipore | MAB354 | 1:150 |
| Anti-STEM121 (Mouse) | Takara Bio | Y40410 | 1:400 |
| Avidin/Biotin Blocking Kit | VECTOR Laboratories | SP-2001 | |
| B6.129(Cg)-Cntnap2tm1Pele/J | Jackson Laboratory | 17482 | Animal model |
| Biotinylated Horse anti-Mouse | VECTOR Laboratories | BA-2001 | 1:200 |
| Burker Chamber | Thermo Fisher Scientific | 10628431 | |
| C57BL/6J | Janvier Labs | Animal model | |
| Centrifuge | For 15 mL tubes | ||
| Confocal microscope | Nikon | Confocal A1RHD microscope | |
| Costar 6-well Clear TC-treated | Corning | 3516 | |
| Cy3 Streptavidin | Jackson ImmunoResearch | 016-160-084 | 1:200 |
| Cytosine β-D-arabinofuranoside (AraC) | Sigma | C1768 | 4 µM |
| DAB Substrate Kit, Peroxidase (With Nickel) | VECTOR Laboratories | SK-4100 | |
| Digital Stereotax | KOPF | Model 940 | |
| DMEM/F12 | Thermo Fisher Scientific | 11320082 | Use for the N2 medium |
| DNase I Solution | STEMCELL Technologies | 7900 | 1 µg/mL |
| Doxycyclin | Sigma-Aldrich | D9891 | 2 µg/mL |
| DPBS -/- | Gibco | 14190144 | |
| Epifluorescence microscope | Olympus | BX51 Microscope | |
| Ethanol | Solveco | 70%, 95%, 99.8% | |
| FUW-rTA | Addgene | 20342 | Lentiviral vector |
| FUW-TetO-Ascl1-T2A-puromycin | Addgene | 97329 | Lentiviral vector |
| FUW-TetO-Dlx2-IRES-hygromycin | Addgene | 97330 | Lentiviral vector |
| H1 (WA01) ESC | WiCell | WA01 | Human embryonic stem cell line under a MTA agreement |
| H2O2 | Sigma-Aldrich | 18304 | |
| Hamilton Syringe | Hamilton | 7634-01 | 5 µL |
| HBSS | Gibco | 14175095 | No calcium, No magnesium - Transplantation medium |
| Hoechst 33342 | Invitrogen | H3570 | 1:1000 |
| Hygromycin B | Gibco (Invitrogen) | 10687010 | |
| Incubator | 5% CO2, 37 °C | ||
| Isoflurane Baxter | Apoteket AB | ||
| Manual cell counter | VWR | 720-1984 | |
| Matrigel hESC-Qualified Matrix, LDEV-free | Corning | 354277 | For the coating |
| Methanol | Merck Millipore | 1060091000 | |
| Microscope Coverslips 24 x 60 mm | Thermo Scientific | BBAD02400500#A113MNZ#0## | |
| Microscope Slides | VWR | 631-1551 | |
| Microscope Software | Olympus | CellSens | |
| Mounting media | Merck | 10981 | PVA-Dabco |
| Mouse adaptor to stereotax | RWD | 68030 | |
| mTeSR1 | STEMCELL Technologies | 85850 | Kit Basal Medium and 5X Supplement - Stem cell culture medium |
| N2 supplement | Gibco | 17502048 | |
| NaOH | Sigma-Aldrich | S8045 | 1M |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | |
| Pertex | HistoLab | 811 | |
| Pipet Filler | |||
| Play-Doh | |||
| Puromycin (Dihydrochloride) | Gibco | A1113803 | |
| Round cover glasses thickness No. 1.5H (tol. ± 5 μm) 13 mm Ø | Marienfeld | MARI0117530 | For immunocytochemistry |
| Serum | Thermo Fisher | Goat, Donkey, Horse | |
| Sterile pipette tips | For volumes 0.1-1000 µL | ||
| Sterile serological pipettes | 5, 10, 25 mL | ||
| Sterile water Braun | B Braun | 3626873 | |
| Sucrose | Sigma-Aldrich | S8501 | For 0.5% Sucrose solution |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Trypan Blue Solution | Gibco | 15250061 | |
| Tubes | Sarstedt | 15 ml, Eppendorf 1.5 mL | |
| Tweezer | VWR | ||
| Ultra pure water | MilliQ Water System | ||
| Xylene | VWR | 28973.363 | |
| Y-27632 (ROCK inhibitor) | STEMCELL Technologies | 72304 | 10 µM |
Referenzen
- Kostović, I., Jovanov-Milošević, N. The development of cerebral connections during the first 20-45 weeks' gestation. Seminars in Fetal and Neonatal. 11 (6), 415-422 (2006).
- Innocenti, G. M., Price, D. J. Exuberance in the development of cortical networks. Nature Reviews Neuroscience. 6 (12), 955-965 (2005).
- Tang, X., Jaenisch, R., Sur, M. The role of GABAergic signalling in neurodevelopmental disorders. Nature Reviews Neuroscience. 22 (5), 290-307 (2021).
- Kepecs, A., Fishell, G. Interneuron cell types are fit to function. Nature. 505 (7483), 318-326 (2014).
- DeFelipe, J., Alonso-Nanclares, L., Arellano, J. I. Microstructure of the neocortex: Comparative aspects. Journal of Neurocytology. 31 (3-5), 299-316 (2002).
- Radonjić, N. V., et al. Diversity of cortical interneurons in primates: The role of the dorsal proliferative niche. Cell Reports. 9 (6), 2139-2151 (2014).
- Turner, D. A., Shetty, A. K. Clinical prospects for neural grafting therapy for hippocampal lesions and epilepsy. Neurosurgery. 52 (3), 632-644 (2003).
- Gonzalez-Ramos, A., et al. Human stem cell-derived GABAergic neurons functionally integrate into human neuronal networks. Scientific Reports. 11, 22050 (2021).
- Yang, N., et al. Generation of pure GABAergic neurons by transcription factor programming. Nature Methods. 14 (6), 621-628 (2017).
- Nicholas, C. R., et al. Functional maturation of hPSC-derived forebrain interneurons requires an extended timeline and mimics human neural development. Cell Stem Cell. 12 (5), 573-586 (2013).
- Yuan, F., et al. Induction of human somatostatin and parvalbumin neurons by expressing a single transcription factor LIM homeobox 6. eLife. 7, 37382 (2018).
- Fandel, T. M., et al. Transplanted human stem cell-derived interneuron precursors mitigate mouse bladder dysfunction and central neuropathic pain after spinal cord injury. Cell Stem Cell. 19 (4), 544-557 (2016).
- Noakes, Z., et al. Human pluripotent stem cell-derived striatal interneurons: Differentiation and maturation in vitro and in the rat brain. Stem Cell Reports. 12 (2), 191-200 (2019).
- Parikshak, N. N., Gandal, M. J., Geschwind, D. H. Systems biology and gene networks in neurodevelopmental and neurodegenerative disorders. Nature Reviews Genetics. 16 (8), 441-458 (2015).
- Marín, O. Interneuron dysfunction in psychiatric disorders. Nature Reviews Neuroscience. 13 (2), 107-120 (2012).
- Sloan, D. J., Wood, M. J., Charlton, H. M. The immune response to intracerebral neural grafts. Trends in Neurosciences. 14 (8), 341-346 (1991).
- Diehl, R., et al. Immunosuppression for in vivo research: State-of-the-art protocols and experimental approaches. Cellular & Molecular Immunology. 14 (2), 146-179 (2017).
- Osman, M. M., et al. Cyclosporine-A as a neuroprotective agent against stroke: Its translation from laboratory research to clinical application. Neuropeptides. 45 (6), 359-368 (2011).
- Quinnies, K. M., Cox, K. H., Rissman, E. F. Immune deficiency influences juvenile social behavior and maternal behavior. Behavioral Neuroscience. 129 (3), 331-338 (2015).
- Fernandes, D. J., et al. Mouse models of immune dysfunction: their neuroanatomical differences reflect their anxiety-behavioural phenotype. Molecular Psychiatry. 27 (7), 3047-3055 (2022).
- Lund, R. D., Rao, K., Hankin, M. H., Kunz, H. W., Gill, T. J. Transplantation of retina and visual cortex to rat brains of different ages. Maturation, connection patterns, and immunological consequences. Annals of the New York Academy of Sciences. 495, 227-241 (1987).
- Olsson, M., Bentlage, C., Wictorin, K., Campbell, K., Björklund, A. Extensive migration and target innervation by striatal precursors after grafting into the neonatal striatum. Neuroscience. 79 (1), 57-78 (1997).
- Mattis, V. B., et al. Neonatal immune-tolerance in mice does not prevent xenograft rejection. Experimental Neurology. 254, 90-98 (2014).
- Nato, G., et al. Immune-tolerance to human iPS-derived neural progenitors xenografted into the immature cerebellum is overridden by species-specific differences in differentiation timing. Scientific Reports. 11, 651 (2021).
- Allison, T., et al. Defining the nature of human pluripotent stem cell-derived interneurons via single-cell analysis. Stem Cell Reports. 16 (10), 2548-2564 (2021).
- Waloschková, E., et al. Human stem cell-derived GABAergic interneurons establish efferent synapses onto host neurons in rat epileptic hippocampus and inhibit spontaneous recurrent seizures. International Journal of Molecular Sciences. 22 (24), 13243 (2021).
- Gonzalez Ramos, A. . Enhancing neuronal inhibition by cell and gene therapy as a novel treatment for epilepsy. , (2022).
- Paterno, R., et al. Hippocampal gamma and sharp-wave ripple oscillations are altered in a Cntnap2 mouse model of autism spectrum disorder. Cell Reports. 37 (6), 109970 (2021).
- Penagarikano, O., et al. Absence of CNTNAP2 leads to epilepsy, neuronal migration abnormalities, and core autism-related deficits. Cell. 147 (1), 235-246 (2011).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Angeletti, B., et al. An in vivo doxycycline-controlled expression system for functional studies of the retina. Investigative Ophthalmology & Visual Science. 44 (2), 755-760 (2003).
- Doxycycline. Drugs and Lactation Database (LactMed) Available from: https://www.ncbi.nlm.nih.gov/books/NBK500561 (2021)
- Barker, R. A., Widner, H. Immune problems in central nervous system cell therapy. NeuroRX. 1 (4), 472-481 (2004).
- Hoornaert, C. J., et al. Concise review: Innate and adaptive immune recognition of allogeneic and xenogeneic cell transplants in the central nervous system. Stem Cells Translational Medicine. 6 (5), 1434-1441 (2017).
- Englund, U., Fricker-Gates, R. A., Lundberg, C., Bjorklund, A., Wictorin, K. Transplantation of human neural progenitor cells into the neonatal rat brain: Extensive migration and differentiation with long-distance axonal projections. Experimental Neurology. 173 (1), 1-21 (2002).
- Fainstein, N., Ben-Hur, T. Brain region-dependent rejection of neural precursor cell transplants. Frontiers in Molecular Neuroscience. 11, 136 (2018).
- Denham, M., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Frontiers in Cellular Neuroscience. 6, 11 (2012).
- Miguez, A., et al. In vivo progressive degeneration of Huntington's disease patient-derived neurons reveals human-specific pathological phenotypes. bioRxiv. , (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten