Method Article
İnsan Kök Hücre Kaynaklı GABAerjik Nöronların Nörogelişimsel Bozuklukları Hafifletmek İçin Erken Postnatal Fare Hipokampüsüne Transplantasyonu
Bu Makalede
Özet
Nöronal programlama ile üretilen insan pluripotent kök hücre kaynaklı GABAerjik nöronların transplantasyonu, nörogelişimsel bozukluklar için potansiyel bir tedavi yaklaşımı olabilir. Bu protokol, insan kök hücre kaynaklı GABAerjik nöronal öncüllerin yenidoğan farelerin beyinlerine üretilmesini ve transplantasyonunu tanımlar, aşılanmış nöronların uzun süreli araştırılmasına ve terapötik potansiyellerinin değerlendirilmesine olanak tanır.
Özet
İnhibitör internöronların sayısının azalması veya işlev bozukluğu, nörogelişimsel bozukluklara yaygın bir katkıda bulunur. Bu nedenle, değiştirilmiş nöronal devrelerin etkilerini değiştirmek veya hafifletmek için internöronları kullanan hücre terapisi çekici bir terapötik yoldur. Bu amaçla, insan kök hücre kaynaklı GABAerjik internöron benzeri hücrelerin (hdIN'ler) konakçı devresinde zaman içinde nasıl olgunlaştığı, entegre olduğu ve çalıştığı hakkında daha fazla bilgiye ihtiyaç vardır. Nörogelişimsel bozukluklarda özellikle önemli olan, nakledilen hücrelerdeki bu süreçlerin evrimleşen ve olgunlaşan bir konakçı beyinden etkilenip etkilenmediğinin daha iyi anlaşılmasıdır. Mevcut protokol, transkripsiyon faktörleri Ascl1 ve Dlx2'nin transgenik ekspresyonuna dayanan insan embriyonik kök hücrelerinden hızlı ve yüksek verimli bir hdIN üretimini tanımlamaktadır. Bu nöronal öncüller, in vitro 7 gün sonra, yenidoğan 2 günlük farelerin hipokampüsüne tek taraflı olarak nakledilir. Nakledilen nöronlar, kortikal displazi fokal epilepsi sendromunun bir fare modelinin ipsi ve kontralateral hipokampüsünde dağılır ve transplantasyondan sonra 9 aya kadar hayatta kalır. Bu yaklaşım, nakledilen internöronların hücresel kimliğini, entegrasyonunu, işlevselliğini ve terapötik potansiyelini, sağlıklı ve hastalıklı beyinlerin geliştirilmesinde uzun bir süre boyunca araştırmaya izin verir.
Giriş
Nöronal ağların kurulması, olgunlaşması ve iyileştirilmesi perinatal ve erken postnatal dönemde gerçekleşir ve beyin gelişimi için çok önemli bir zaman penceresini temsil eder1. Doğum sonrası bağlantının coşkunluğundan, beyin ergenliğe kadar uzanan bağlantıların ince ayarına dönüşür2. Sonuç olarak, bu dönemlerde ifade edilen genlerdeki değişikliklerin yanı sıra dış faktörler veya hakaretler, bireyin çoklu nörogelişimsel bozukluklara yatkınlığını tanımlar. Biliş ve motor fonksiyondaki bozukluklar zamanla ortaya çıkar ve farmakolojik tedaviler sınırlıdır, çoğunluğu ciddi yan etki riski olan semptomları hedef alır.
Gama-aminobütirik asit (GABA) erjik inhibisyonundaki disfonksiyonun, kırılgan X sendromu, Angelman sendromu, epilepsi, şizofreni ve otizm gibi çeşitli nörogelişimsel bozuklukların3 altında yatan nedene önemli bir katkıda bulunduğu gösterilmiştir. GABA, merkezi sinir sisteminin ana inhibitör vericisidir ve uyarıcı / inhibitör (E / I) dengesini korumak, nöronal ateşlemenin senkronizasyonu ve hesaplama için etkilidir. GABAerjik internöronlar, daha karmaşık beyin bölgelerinde4 ve evrim 5,6'da fonksiyonel karmaşıklığın arttığı heterojen bir nöron popülasyonudur. İnsan beyninin sınırlı endojen rejeneratif kapasitesi ve çeşitli nörolojik bozukluklarda internöron disfonksiyonunun etkisi göz önüne alındığında, GABAerjik internöronların transplantasyonu araştırılması için umut verici bir terapötik yol olabilir. Bu doğrultuda, insan kök hücre kaynaklı GABAerjik internöron benzeri hücreler (hdIN'ler), kemirgen allojenik nöronal öncüllere veya başka yerlerde kullanılan diğer kaynaklara kıyasla bu amaç için en translasyonel ve uygulanabilir kaynak gibi görünmektedir7. Farklı hücre kaynaklarından GABAerjik nöronlar üretmek için protokoller mevcuttur 8,9,10,11,12,13, ancak hdIN'lerin gelişmekte olan patolojik bir beyinde zaman içinde nasıl olgunlaştığı, bütünleştiği ve işlev gördüğü hakkında daha fazla bilgi gereklidir. Birçok çalışma, kortikal modelleme sırasında aktif olan genlerdeki değişiklikleri, nöronal bağlantı14'ü kurmayı ve fizyolojik E / I dengesini15'i ayarlamayı tanımlamıştır. HdIN'lerin karşılık gelen genetik pertürbasyonlarla fare modellerine yenidoğan transplantasyonu, potansiyel terapötik stratejileri belirlemek için gerekli olan konakçı ve greft arasındaki etkileşimi takip etmemizi sağlar.
İmmünomodülasyon, konakçı immün yanıtını tetiklemeyi ve reddetmeyi önlemek için ksenogreft transplantasyonlarında yaygın ve başarılı bir şekilde kullanılmaktadır16. Bununla birlikte, siklosporin A gibi immünosüpresif ilaçların uygulanması, kronik uygulamadan sonra renal toksisiteye neden olur, stabil sistemik konsantrasyonlara ulaşmak için günlük intraperitoneal enjeksiyonlara duyulan ihtiyaç nedeniyle emek yoğundur, hayvan stresine neden olur17 ve patoloji ile etkileşime girebilecek hedef dışı etkilere sahiptir18. Ek olarak, bağışıklık sisteminden ödün vermenin davranışsal fenotipleri değiştirdiği gösterilmiştir19, karşılık gelen nöroanatomik bölgelerdeki değişiklikler20. Yaşamın ilk haftasında transplantasyonun nakledilen hücrelere adaptasyona izin verdiği gösterilmiştir 21,22, diğerleri ise ilk sağkalımı ve ardından doğum sonrası ilk ay içinde greftlerin reddedildiğini bildirmiştir 23,24.
Bu protokol, yenidoğan farelerde hdIN üretiminden hücre transplantasyonuna kadar olan prosedürleri tanımlar ve uzun süreli greft sağkalımı ile sonuçlanır ve fizyolojik ve patolojik gelişim sırasında nakledilen insan internöronlarının nöronal özgüllüğünün, sinaptik entegrasyonunun, fonksiyonunun ve terapötik potansiyelinin araştırılmasına izin verir.
Protokol
Tüm deneysel prosedürler Malmö/Lund Hayvan Araştırmaları Etik Kurulu tarafından 12548-19 etik izin numarası ile onaylanmış ve İsveç Hayvan Refahı Ajansı düzenlemeleri ve hayvan deneyleri için AB Direktifi 2010/63/EU ile uyumlu olarak yürütülmüştür. Bu çalışmada C57BL6/J ve Kontaktin ile ilişkili protein benzeri 2 (Cntnap2) nakavt (KO) fareleri, hem erkek hem de kadınlar, doğum sonrası gün (P) 2'de kullanılmıştır. İnsan embriyonik kök hücreleri (hESC'ler) kullanıldı. Hayvanlar ve kök hücreler ticari kaynaklardan elde edilmiştir (bakınız Malzeme Tablosu).
1. hdIN öncüllerinin oluşturulması
NOT: Bu bölümdeki tüm adımlar bir hücre kültürü başlığında yapılır. hESC'ler, bir kök hücre kültürü ortamı kullanılarak kaplanmış plakalar üzerinde besleyicisiz hücreler olarak tutuldu ve koloniler olarak geçirildi.
- hESC'lerin hdIN öncüllerine doğru programlanmasını gerçekleştirin (Şekil 1).
NOT: İleriye doğru programlama yaklaşımı, Gonzalez-Ramos ve ark.8 ve Yang ve ark.9'da açıklanan prosedüre dayanmaktadır.- Tet-On sistemini içeren lentiviral vektörlerle hESC'leri, 10 μM ROCK inhibitörü (RI) içeren taze bir kök hücre kültürü ortamında dönüştürün (bkz. İnkübatörde 37 ° C'de tutun.
- Transdüksiyondan 16 saat sonra ortamı taze bir kök hücre kültürü ortamına değiştirin ve dönüştürülmüş hücreleri dönüştürülmemiş hESC'lerle aynı şekilde koruyun.
- Birleştiğinde, hESC'leri bir hücre ayırma çözeltisi kullanarak tek hücreler olarak ayırın ( Malzeme Tablosuna bakınız) ve bunları günde 10 μM RI içeren kök hücre kültürü ortamında 3 x 105 hücre / kuyu yoğunluğunda kaplanmış 6 delikli plakalar halinde plakalayın -1.
- 1 DIV'de, kültürleme ortamını 2 g / L doksisiklin içeren N2 ortamı ile değiştirin (DOX, Malzeme Tablosuna bakınız).
NOT: DOX, Ascl1 ve Dlx29'un transgen ekspresyonunu 1 DIV'den 7 DIV'ye indüklemek için kullanılır ve daha sonra içme suyu25'e eklenerek in vivo olarak devam eder. - 2 DIV'de, 5 DIV'ye kadar sürecek bir antibiyotik direnci seçim periyodu başlar. taze ortama puromisin (puro) ve higromisin (higro) ekleyin (bkz. Ortamı 2 DIV, 4 DIV ve 5 DIV'de değiştirin.
NOT: Sadece antibiyotik direnç kasetlerini taşıyan hücrelerin hayatta kalmasını sağlamak için dönüştürülmüş ve dönüştürülmemiş hESC'leri kullanarak farklılaşma protokolünden önce puro ve higro konsantrasyonlarını optimize edin. Bu protokolde 0.5 μg/mL puro ve 750 μg/mL higro kullanıldı. - 5 DIV'de antibiyotik seçim dönemi sona erer. 2 g / L DOX ve 4 μM sitozin β-D-arabinofuranosid ile desteklenmiş N2 ortamına geçin (Ara-C, bakınız Malzeme Tablosu).
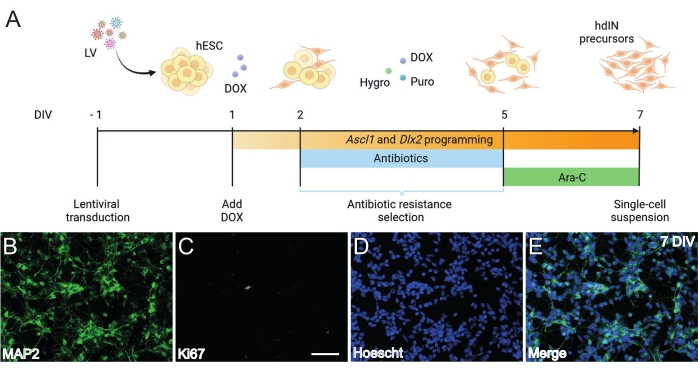
Şekil 1: Ascl1 ve Dlx2'yi aşırı ifade ederek hESC'lerden hdIN öncüllerinin oluşturulması. (A) hdIN öncüllerinin oluşturulması için kullanılan farklılaştırma protokolünün şemaları. (B-E) (B) nöronal belirteç MAP2, (C) proliferatif belirteç Ki67, (D) genel nükleer boyama ve (E) önceki belirteçlerin birleşmesi için 7 DIV'de hdIN öncüllerinin immünositokimyası. Ölçek çubuğu: 50 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
2. Transplantasyon için tek hücreli süspansiyonun hazırlanması
NOT: Bu bölümdeki tüm adımlar hücre kültürü başlığında yapılır. 7 DIV'de, hdIN öncülleri ayrışır ve transplantasyon için kullanılır.
- Aşağıdaki adımları izleyerek hücrelerin ayrılmasını gerçekleştirin.
- Ortamı çıkarın ve hücreleri kalsiyum ve magnezyum olmadan DPBS ile dikkatlice durulayın.
- 6 delikli plakanın her bir kuyucuğuna 400 μL hücre ayırma çözeltisi ekleyin (bkz.
NOT: Tüm yüzeyin çözelti tarafından kaplandığından emin olun. - Hücrelerin sınırı parlak görünmeye başlayana kadar inkübatörde 37 ° C'de 2-3 dakika boyunca inkübe edin, bu da hücre yüzey proteinlerinin enzimatik bozulmasını ve kuyu yüzeyinden ayrıldığını gösterir.
NOT: Hücre sağkalımını arttırmak için, tüm hücreler tamamen ayrıldığında ve etrafta yüzerken çok uzun süre beklemeyin. - Daha sonra, enzimi durdurmak için 6 delikli plakanın her bir kuyucuğuna 600 μL taze N2 ortamı ekleyin ve pipetle mekanik olarak, tek hücreli bir süspansiyon elde etmek için hücrelerin ayrılmasına yardımcı olun.
- Hücre süspansiyonunu plastik bir tüpe (15 mL) aktarın ve oda sıcaklığında (RT) 4 dakika boyunca 180 x g'de santrifüj yapın.
- Hücrelerin yeniden süspansiyonunu gerçekleştirin.
- Süpernatantı bir vakum sistemi kullanarak atın (peleti rahatsız etmeden, dikkatli bir şekilde) ve peleti 10 μM RI, 1 μg / mL DNaz ve 2 μg / μL DOX içeren nakil ortamında yeniden askıya alın.
- Bir sayım odası ve manuel hücre sayacı kullanarak süspansiyondaki toplam hücreleri sayın ve ses seviyesini 100.000 hücre/μL'lik son konsantrasyona ayarlayın.
- Hücre süspansiyonunu en fazla 4 saat boyunca transplantasyona kadar buz üzerinde kapalı bir tüp içinde tutun.
NOT: Transplantasyon, hücre süspansiyonunun hazırlanmasıyla aynı gün yapılmalıdır (7 DIV).
3. İntrahipokampal hücre nakli
NOT: Bu bölümdeki tüm adımlar, hayvan tesisindeki hücre kültürü davlumbazının dışında gerçekleştirilir. Hücrelerin beyne erken doğum sonrası nakli, doğum günü P0 göz önüne alındığında, P2'de gerçekleştirildi.
- Aşağıdaki adımları izleyerek transplantasyon deneyine hazırlanın.
- Tüm cerrahi malzemeyi otoklav yapın veya mümkün değilse, onaylanmış başka bir yöntemle sterilize edin.
- Enjekte eden şırıngayı tutucuya herhangi bir cam kılcal damar olmadan monte edin. İğneyi suyla durulayın.
NOT: İğne 33 G olmalıdır. - 30 G insülin iğnesinin ucu 90° eğri.
- Yavruyu başı düz olacak şekilde konumlandırmak için ev yapımı Play-Doh benzeri bir sahne oluşturun (Şekil 2A).
- Yeni ortama alışmalarını sağlamak için ameliyat için herhangi bir şey hazırlamadan önce farelerin kafesini anne ve yavrularla birlikte getirin.
- Islak buzlu bir tepsi ve izofluran için biraz kağıt içeren boş bir kafes hazırlayın.
- Fare yavrusunu uyuşturun.
- Bir parça kağıdı izofluran ile ıslatın ( bakınız Malzeme Tablosu) ve boş kafesin içine yerleştirin. Bir yavruyu dikkatlice alın ve izoflurana batırılmış kağıtla kafese yerleştirin.
NOT: Annenize asla üçten az yavru bırakmayın. 20-30 s izofluran anestezisini aşmayın, aksi takdirde yavru ölebilir. - Anestezinin etkisini hareket durdurma ile doğrulayın.
- Anesteziden hemen sonra, yavruyu ıslak buz yüzeyindeki ıslak bir doku üzerine yerleştirin. Üst ekstremiteler beyazımsı hale gelene kadar hayvanı 3 dakika buz üzerinde tutun (Şekil 2B, mavi ok). Bu genellikle 2-3 dakika sürer.
- Şırıngayı hücre süspansiyonu ile yüklemek için bu zamanı kullanın. Daha önce hücreleri bir pipetle dikkatlice yeniden askıya alın.
- Yavruyu stereotaksik çerçeveye yerleştirin. Kulak çubuklarını ters yönde kullanın (Şekil 2A, macenta oklar).
NOT: Kulak çubuklarının arka tarafı daha az sivridir ve P2 yavrularının kulakları olmadığından, hayvana zarar vermemek için daha düz tarafı kullanın. - Yandan, başın düz olup olmadığını kontrol edin. Baş düz olmalıdır; buna uyum sağlamak için Play-Doh benzeri sahneyi kullanın.
NOT: Bu yaştaki yavrular henüz gözlerini açmamışlardır, bu nedenle bu konuda ek bir adım atılmasına gerek yoktur. Yavruların bu yaşta kürkleri yoktur, bu nedenle bölgenin tıraş edilmesine gerek yoktur. Cilde açık bir kesi olmadığı için spesifik bir ağrı tedavisi verilmez ve dikiş tutulmaz. - Yavruyu ameliyat boyunca buzla (kağıt mendilin üstünde) kapalı tutun.
NOT: Buzun yavrunun derisiyle doğrudan temas etmesine izin vermeyin.
- Bir parça kağıdı izofluran ile ıslatın ( bakınız Malzeme Tablosu) ve boş kafesin içine yerleştirin. Bir yavruyu dikkatlice alın ve izoflurana batırılmış kağıtla kafese yerleştirin.
- Enjeksiyonu gerçekleştirin.
- Etanol içine batırılmış yumuşak bir doku kullanarak cildin yüzeyini temizleyin.
- Lambda'yı tanımlayın ve stereotaksik enstrümanın dijital ekran konsolunda koordinatları sıfıra ayarlayın (Şekil 2C, sarı kesikli çizgi). Sagital ve lambdoid sütürler, kırmızı çizgiler olarak vaskülarize oldukları için gözle kolayca görülebilir.
NOT: Lambda'yı görselleştirmekte zorluk yaşıyorsanız, cildin üzerine küçük bir buz parçası yerleştirin ve soğuması için birkaç dakika bekleyin. Ardından, buz parçasını çıkarın ve cildin ince beyazlaması görselleştirmenize izin verecektir. - Enjeksiyon iğnesini istenen koordinatlara taşıyın. Tanımlanan protokolde, hedeflenen bölge hipokampus idi ve koordinatlar aşağıdaki gibiydi: anterior-posterior (AP) +0.85 ve medio-lateral (ML) +1.35.
- Kafatasına nüfuz etmek ve küçük bir delik oluşturmak için 90 ° bükülmüş bir insülin iğnesi kullanın.
- Enjeksiyon iğnesini kafatasını geçene kadar indirin ve dorso-ventral (DV) koordinatlarını sıfırlayın. İstediğiniz DV koordinatlarına kadar iğneyi indirin. Tanımlanan protokolde, koordinatlar DV −1.1 idi.
- Önceden belirlenmiş zaman aralıklarına göre enjekte edin.
NOT: Açıklanan protokolde, kesin zamanlamalar şöyleydi: (i) DV koordinatına indikten sonra 3 dakika bekleyin, (ii) 5 dakika boyunca 1 μL hacim enjekte edin ve (iii) tüm hacim enjekte edildikten sonra 3 dakika bekleyin. - İğneyi yavaşça geri çekin.
- Yordamı sonlandırın.
NOT: Yavrunun hayatta kalmasını sağlamak ve hipotermi ile anesteziden kaynaklanan herhangi bir hasarı önlemek için ameliyat 15 dakikadan fazla süremez.- Anneye geri vermeden önce yavruyu hareket etmeye başlayana kadar elleriyle ısıtın.
- Hücre farklılaşmasına in vivo olarak devam etmek için DOX'u% 0.5 sakkaroz çözeltisinde 1 mg / mL'lik bir konsantrasyonda, transplantasyondan en az 2 gün önce ve 3 hafta sonra (PT) içme suyu olarak verin.
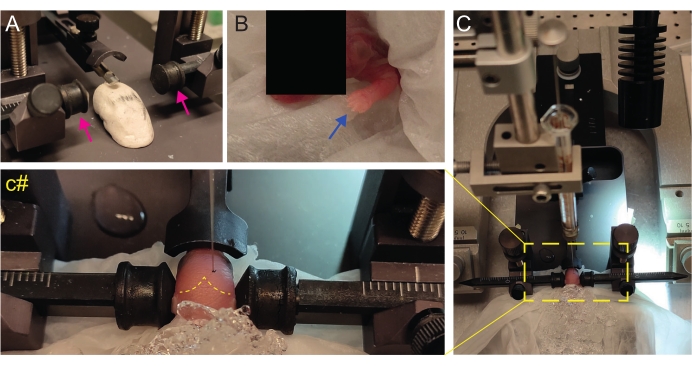
Şekil 2: P2'de yenidoğan fare yavrularında stereotaksik transplantasyon. (A) Yavrunun vücudunu pozisyonda tutmak için Play-Doh benzeri bir aşama ve ters kulak çubukları (macenta oklar). (B) Beyaz ön pençe (mavi ok), o bölgedeki kan akışının azaldığını gösterir, böylece yavru hipotermi ile anestezi görür. (C) Yumuşak doku kağıdı üzerinde zaten buzla kaplı yavru ile kuruluma genel bakış. (c#) Enjeksiyon iğnesi zaten beyne yerleştirilmiş olarak yavrunun başının kapalı yakınlaştırılması (lambda ve lambdoid sütürleri gösteren sarı kesikli çizgi). Bu rakam Gonzalez Ramos et al. 27. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Burada sunulan ve Şekil 1A'da gösterilen protokolü takiben, hdIN öncülleri (i) hücre döngüsü belirteci Ki67 için negatif immünoreaktivite ve (ii) mikrotübül ile ilişkili protein 2 (MAP2) gibi nöronal belirteçleri eksprese eden 7 DIV'de henüz proliferatif değildi (Şekil 1B-E). Bu karakterizasyon, tüm prosedür adımlarından geçtikten sonra 24 saat boyunca yeniden kaplanan artık hücreler üzerinde gerçekleştirildi. Ek olarak, daha önce yayınlanan gen ekspresyon analizi, pluripotent durumdan nöronal bir fenotipe hızlı bir geçişin 4 DIV ve 7 DIV8 civarında gerçekleştiğini göstermiştir. Genel olarak, bu sonuçlar postmitotik hücrelerin varlığını ve teratom oluşumu riskinin olmadığını doğruladı.
Daha sonra, vahşi tip (WT) farelerin hipokampüsüne erken doğum sonrası transplantasyondan sonra hdIN öncüllerinin sağkalımı, insan sitoplazmatik belirteci STEM121'e karşı immünohistokimya ile test edildi. hdIN öncülleri, P2'deki naif immünokompetan farelerin sağ dorsal hipokampüsüne nakledildi, daha sonra P14 ve 2 ay PT'de kurban edildi. aşılanmış hücreler tüm dorsal hipokampus boyunca bulundu ve her iki zaman noktasında korpus kallozum ve kontralateral hipokampus boyunca dağıldı. Ayrıca, her iki zaman noktasında da, aşılanmış hdIN'ler, indüksiyon transkripsiyon faktörlerinden biri olan Ascl1'i ifade etti (Ek Şekil 1) ve Ki67 ekspresyonunun yokluğunda belirtildiği gibi proliferatif değildi (Ek Şekil 2).
Önemli olarak, Iba1, CD68 ve galektin-3 (Gal3) kullanılarak tanımlanan reaktif mikroglianın yokluğu, glial fibriler asidik protein (GFAP) ve interlökin-1 (IL-1) gibi enflamatuar sitokinler tarafından belirlenen astrogliozun derecesi ile değerlendirildiği gibi, nakledilen hücrelere karşı hiçbir bağışıklık reaksiyonu veya lokal inflamasyon bulunmamıştır. ve sitotoksik T lenfositlerin (CD8) yokluğu (Şekil 4).
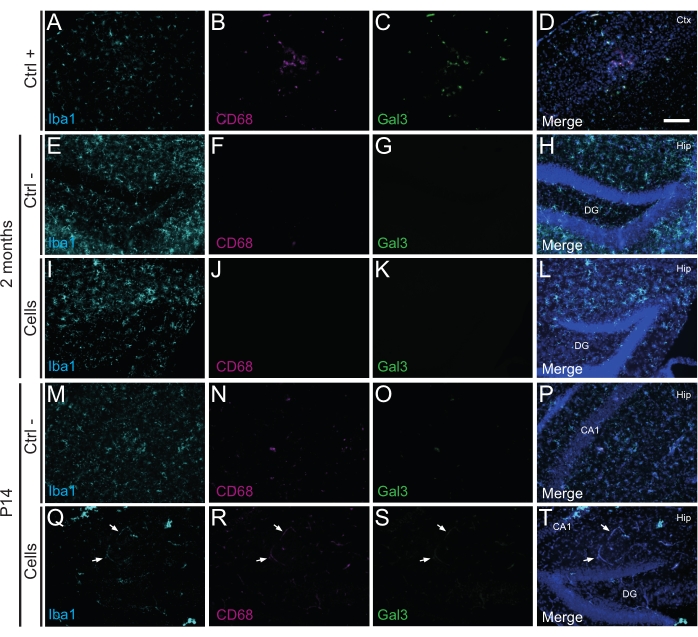
Şekil 3: P14 ve 2 aylık PT'deki hdIN'ler, konakçı dokudan immün reddi tetiklemeden yenidoğan WT farelerinin hipokampüsüne girer. Beyin dokusundaki Iba1, CD68 ve Gal3 belirteçleri için immünofloresansı (A-D) elektrokoagülasyon inme fare modelinde iskemik çekirdek alanının yakınlığı (pozitif kontrol, Ctrl +), (E-H) negatif kontrol hayvanları (Ctrl-) 2 ayda ve (M-P) P14 ve (I-L) 2 ayda hücre nakli geçirmiş hayvanlar ve (Q-T) ) P14. Beyaz oklar, otofloresan nedeniyle tüm kanallarda görülebilen bazı kan damarı örneklerini gösterir. Kısaltmalar: Ctx = korteks; Kalça = hipokampus; DG = dentat girus; CA1 = cornu ammonis 1. Ölçek çubuğu: 50 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
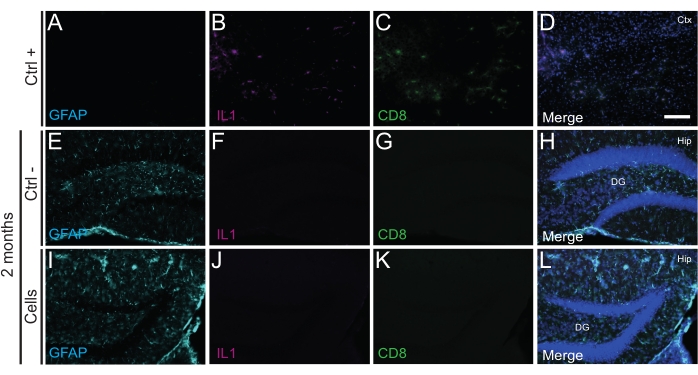
Şekil 4: 2 aylık PT'de hdIN'ler, konakçı dokudan immün reddi tetiklemeden yenidoğan WT farelerinin hipokampüsüne girer. Beyin dokusundaki IL1, GFAP ve CD8 belirteçleri için immünofloresansı, (A-D) bir elektrokoagülasyon inme fare modelinde iskemik bir çekirdek alanın yakınlığı (pozitif kontrol, Ctrl +), (E-H) negatif kontrol hayvanları (Ctrl-) 2 ayda ve (I-L) 2 ayda hücre nakli geçiren hayvanlar. Kısaltmalar: Ctx = korteks; Kalça = hipokampus; DG = dentat girus. Ölçek çubuğu: 50 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Benzer şekilde, hdIN öncülleri, otizm spektrum bozukluğu ve kortikal displazi fokal epilepsi sendromu için bir model olan Cntnap2 KO farelerinin hipokampüsüne de nakledildi. Cntnap2 KO farelerinde, aslında, hdIN'ler 9 ay PT'ye kadar hayatta kaldılar ve enjeksiyon bölgesinde lokalize oldular, ancak WT farelerinde gözlendiği gibi ipsilateral ve hatta kontralateral hipokampus boyunca dağıldılar (Şekil 5). Ayrıca, aşılanmış hdIN'lerin çoğu, önceki in vitro 8,26 ve yetişkin kemirgenlerde in vivo 25 sonuçlarından beklendiği gibi, internöron belirteçleri için immünoreaktifti.
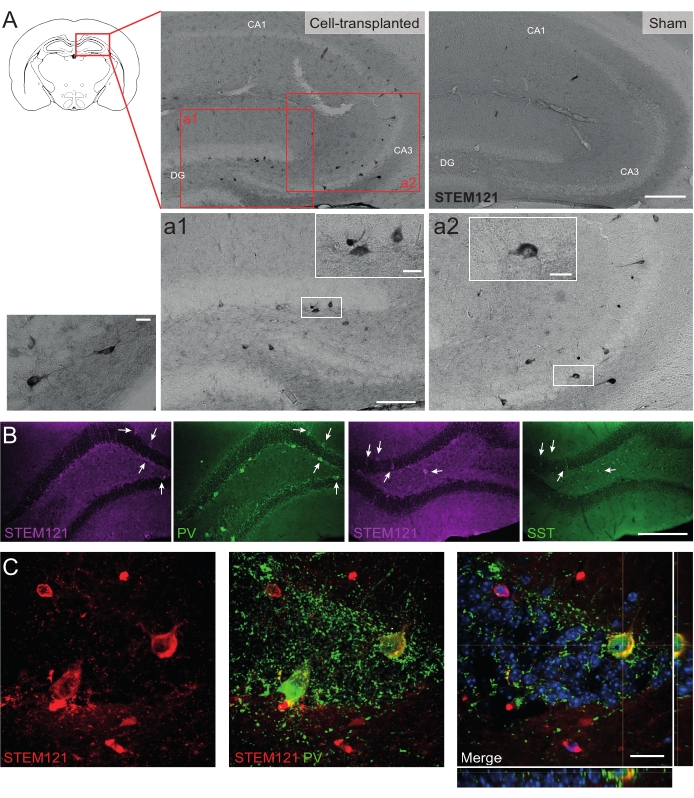
Şekil 5: 9 aylık PT'de Cntnap2 KO farelerinin hipokampüsündeki aşılanmış hdIN'ler. (A) Hücre nakli yapılan (solda) ve sahte (sağda) farelerde sitoplazmatik insan belirteci STEM121'e karşı immünokimya. (a1 ve a2) STEM121 pozitif hücrelerinin büyütülmüş görüntüleri. (B) STEM121 (macenta) ve internöron belirteçleri parvalbümin (PV) ve somatostatin (SST) için immünofloresan. Beyaz oklar, STEM121 ve ilgili internöron belirteci için çift pozitif hücreleri gösterir. (C) STEM121 ve PV için aşılanmış bir hdIN immünoreaktifinin ortogonal görünümü. Ölçek çubuğu: 200 μm (A ve B), 100 μm (a1 ve a2), 20 μm (a1 ve a2 ve C'de küçük kare büyütme). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Ascl1'i eksprese eden yenidoğan WT farelerinin hipokampüsüne 2 aylık PT'de aşılanmış hdIN'ler. Hücre nakli WT farelerinde (A) CA3 ve (B) DG'de Ascl1 ve sitoplazmatik insan belirteci STEM121'e karşı immünofloresan. (a) Bir STEM121 pozitif hücresinin büyütülmüş görüntüsü. Beyaz oklar STEM121 ve Ascl1 için çift pozitif hücreleri gösterir. Ölçek çubuğu: 100 μm. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 2: Yenidoğan WT farelerinin hipokampüsüne 2 aylık PT'de post-mitotik aşılanmış hdIN'ler. (A) naif ve (B) hücre nakli WT farelerinde proliferatif belirteç Ki67 ve sitoplazmatik insan belirteci STEM121'e karşı immünofloresan. (b) Bir STEM121 pozitif hücresinin büyütülmüş görüntüsü. Sarı ok, Ki67 için pozitif ve STEM121 için negatif bir hücreyi gösterir. Beyaz ok, STEM121 için pozitif ve Ki67 için negatif hücreleri gösterir. Beyaz yıldız işareti lateral ventrikülü işaret eder. Ölçek çubuğu: 100 μm. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, in vitro hdIN öncülleri üretmek için sağlam, hızlı, basit ve yaygın olarak erişilebilir bir metodolojiyi ve nörogelişimsel bozuklukların klinik öncesi modellerinde erken girişimsel hücre tedavisi olarak kullanımını açıklamaktadır.
Nörogelişimsel bozuklukların karakteristik fenotiplerinden bazıları ergenlik veya yetişkinlik döneminde ortaya çıksa da, erken gelişim sırasında patofizyolojik değişiklikler zaten mevcuttur. Bu nedenle, erken müdahale, semptomatoloji veya klinik tezahürden önce kritik beyin gelişim dönemlerinde hareket ederek yararlı etkiler elde etmek için oldukça garanti edilecektir. Gelecekte, genetik tarama ve biyobelirteçlerin geliştirilmesi, bu hastalar için bir oyun değiştiriciyi temsil eden profilaktik veya semptomatik öncesi tedaviyi sağlayacaktır. Bu nedenle, hdIN öncülleri, Cntnap2 KO fare modelinde doğumdan sonra erken saatlerde, nöronal ağdaki epileptojenik değişikliklerin devam edebileceği28 ve bu hayvan modelinde hücresel değişikliklerin tanımlandığı bir zaman noktasında nakledilmiştir29. Bununla birlikte, yaş ekstrapolasyonunun potansiyel tuzaklarını ve faredeki belirli işlemlerin insan beynine karşı zamanlamasını göz önünde bulundurmak önemlidir.
Prosedürün kendisine odaklanan burada sunulan farklılaşma protokolü, kök hücrelerin küçük moleküllere dayanan diğer protokollerle karşılaştırıldığında hızlı ve yüksek verimli bir şekilde programlanmasını sağlayan transkripsiyon faktörlerinin kullanımına dayanmaktadır10,30. Bu yaklaşımın potansiyel bir dezavantajı, ekleme mutagenezi riski taşıyan lentiviral vektörlerin gerekliliği olabilir. Protokoldeki iki kritik adım, transkripsiyon faktörlerini eksprese eden hücreler için seçilecek ortama antibiyotiklerin ve anti-mitotik ajanın eklenmesi ve sırasıyla teratom oluşumu riskinden kaçınılarak proliferatif hücrelerin ortadan kaldırılmasıdır. Bu çalışmada sadece hdIN öncülleri test edilmiş olmasına rağmen, prosedürün diğer hücre kaynakları ve programlama / farklılaşma protokolleri ile uygulanabilir olması beklenmektedir. Bununla birlikte, diğer nöronal alt tipler ve / veya modeller doğrulanmalıdır.
hdIN öncülünün nakil yaşı olan 7 DIV'e, (i) Ki67'ye karşı immünoreaktivite ile değerlendirilen proliferatif hücrelerin yokluğuna, (ii) POU5F1 gibi pluripotens genlerinin ekspresyonundaki azalmaların daha önce bildirilen gözlemine ve nöronal belirteç MAP2 ve internöron belirteci GAD1'in bu zaman noktasında ortaya çıkmasına dayanarak karar verildi8 . Bununla birlikte, bu protokolü tanımlayan orijinal çalışma, DOX geri çekilmesinden sonra 14 DIV'de transplantasyongerçekleştirdi 9. Bu, annenin içme suyundaki DOX'un süt yoluyla emziren yavruların beyinlerine aşılanmış hücrelere ulaşıp ulaşamayacağı veya GABAerjik kaderi belirlemek için 7 DIV DOX indüksiyonunun yeterli olup olmadığı hakkında sorular ortaya çıkarmaktadır. Her ne kadar Yang ve ark. 14 günlük DOX'u in vitro9'da stabil nöronal hücreler üretmek için yeterli olarak tanımlamış olsalar da, Gonzalez-Ramos ve ark.8, GAD1 gen ekspresyonunu zaten 7 DIV'de tespit ettiler ve bu da GAD67'nin Ascl1 ve Dlx2 tarafından aşağı akış aktivasyonunun bu zaman noktasında zaten gerçekleştiğini gösteriyor. Bu nedenle, modelleme 7 DIV'de başlamıştır ve DOX tedavisine daha az bağımlı olabilir. Ayrıca, kemirgenlerde ve insanlarda elde edilen kanıtlar anne sütünde DOX varlığını göstermektedir 31,32 ve burada sunulan sonuçlar, aşılanmış hdIN'lerin 2 hafta ve 2 ay PT'deAscl1 için immünoreaktif olduğunu ve daha sonra 9 aylık PT'de internöron belirteçleri olduğunu göstermektedir. Aşılanmış popülasyonda, PV ve SST pozitif nöronların yanı sıra, internöronların alt popülasyonları için diğer belirteçler de kalretinin (CR) ve kalbindin (CB) gibi daha düşük miktarlarda bulunmuştur.
Bu prosedürün zorlu bir yönü, hem farklılaşma hem de yavruların yaşı için zamanlamaların koordinasyonudur. Genellikle, fare gebeliği çiftleşme kafesini kurduktan sonra 21 gün sürer, ancak bu bazen değişebilir. Bu senaryo, yetişkin kemirgenlerde hücre nakli yapılırken, her şey dikkatlice planlanıp düzenlenebildiğinde ortaya çıkmaz. Bununla birlikte, bu, 2 günlük aralıklarla iki ila üç çiftleşme kafesi veya birbirinden 2 günlük bir zaman atlamalı iki ila üç farklılaşma partisi kurarak kolayca hafifletilebilir.
Bu çalışmada kullanılan fareler ne immün yetmezlikli ne de immünsüprese olmasalar da, nakledilen hücreler in vivo olarak 9 aya kadar hayatta kaldılar ve ksenojenik hücrelere veya lokal inflamasyona karşı bağışıklık reaksiyonunun belirteçleri P14 veya 2 ay PT'de gözlenmedi. Aşılanmış ksenojenik hücrelerin immün reddi MHC / peptitlere karşı tetiklenir ve greft reddinin anahtar hücresel aracıları T lenfositler ve mikroglial hücrelerdir33, 34. Bu nedenle, T hücrelerinin belirteçlerine ve reaktif mikrogliaya immünoreaktivite araştırılmıştır. Konakçı dokudaki aşılanmış hücrelerin immün rejeksiyon belirtileri ya reaktif mikroglia seviyeleri ile ya da P14 veya 2 ayda WT farelerde T lenfositlerin varlığı ile tespit edilmedi. Ayrıca, değerlendirilen astroglioz ve inflamatuar sitokin seviyelerine dayanarak lokal inflamasyon gözlenmedi. Bu sonuç kısmen yenidoğan immün toleransına bağlı olabilir 35,36,37, diğer hücre kimlikleri, lokalizasyonları ve hayvan modelleri tarafından gözlenen35,38. Englund ve ark., bitişik beyaz cevher35'teki aşılanmış hücrelerin gözlemlenmesi de dahil olmak üzere, göç ve olgunlaşma açısından aşılanmış hücrelerin sonuçlarında bölgesel farklılıklar tespit etmişlerdir.
Son olarak, hipokampus içindeki aşılanmış hücrelerin daha fazla dağılması, hdIN'lerin aşılanmış bir çekirdek25 olarak kaldığı yetişkin kemirgenlere nakledilen diğer çalışmalara kıyasla gözlenmiştir. Bu dağılım aynı zamanda daha önce Yang ve ark.9 tarafından gözlemlenen sonuçlardan da farklıydı; bu durumda nakil sırasında hücrelerin yaşı ile açıklanabilir.
Açıklamalar
Yazarlar rakip çıkarlar olmadığını beyan ederler.
Teşekkürler
Bu proje İsveç Araştırma Konseyi (Hibe Numarası: 2016-02605, MA), İsveç Beyin Vakfı F02021-0369 (MA), Crafoord Vakfı (MA) ve Avrupa Birliği Horizon 2020 Programı (H2020-MSCA-ITN-2016) tarafından Marie Skłodowska-Curie Yenilikçi Eğitim Ağı projesi Training4CRM No. 722779 (M.K.) kapsamında finanse edilmiştir. Andrés Miguez'in, Josep Maria Canals'ın laboratuvarından (Barselona Üniversitesi Kök Hücreler ve Rejeneratif Tıp Laboratuvarı), P2 yenidoğan farelerde stereotaksik hücre naklini öğretmek için ve Austin'deki Teksas Üniversitesi'nde grup lideri Mackenzie Howard'ın P2 yenidoğan farelerin hipokampüsüne hücre nakli için tavsiye ve ön koordinatlar için son derece minnettarız. Susanne Geres'e hayvan bakımına yardımcı olduğu için ve Ling Cao'ya doku işlemeye yardımcı olduğu için ve ayrıca çalışmaya bir şekilde katkıda bulunan öğrencilere ve özellikle Diana Hatamian'a teşekkür ederiz. Son olarak, bu makaleyi göstermek için kullanılan grafiklerin bazıları BioRender.com oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 30 G needle | B Braun | 4656300 | |
| 33 G needle for Hamilton syringe | Hamilton | 7762-06 | |
| 4-well plates | Thermo Scientific | 176740 | |
| Accutase | STEMCELL Technologies | 7920 | Cell detachment solution use for splitting cells (hESC and hdIN precursors) |
| Adjustable volume pipettes 10, 20, 200, 1000 µL | |||
| Alexa Fluor Plus 488/555/647 | Thermo Fisher | 1:1000 | |
| Anti-CD68 (Rat) | Bio-Rad | MCA1957 | 1:200 |
| Anti-CD8 (Rabbit) | Abcam | 203035 | 1:200 |
| Anti-Galectin 3 (Goat) | R&D systems | AF1197 | 1:500 |
| Anti-GFAP (Guiena Pig) | Synaptic systems | 173004 | 1:500 |
| Anti-Iba1 (Rabbit) | WAKO | 19119741 | 1:500 |
| Anti-IL1 (Goat) | Santa Cruz Biotech | SC-106 | 1:400 |
| Anti-Ki67 | Abcam | ab16667 | 1:250 |
| Anti-Ki67 (Rabbit) | Novocastra | NCL-Ki67p | 1:250 |
| Anti-MAP2 (Chicken) | Abcam | ab5392 | 1:2000 |
| Anti-Mash1 (Ascl1) | Abcam | ab74065 | 1:1000 |
| Anti-Parvalbumin (Rabbit) | Swant | PV 27 | 1:5000 |
| Anti-Somatostatin (Rat) | Millipore | MAB354 | 1:150 |
| Anti-STEM121 (Mouse) | Takara Bio | Y40410 | 1:400 |
| Avidin/Biotin Blocking Kit | VECTOR Laboratories | SP-2001 | |
| B6.129(Cg)-Cntnap2tm1Pele/J | Jackson Laboratory | 17482 | Animal model |
| Biotinylated Horse anti-Mouse | VECTOR Laboratories | BA-2001 | 1:200 |
| Burker Chamber | Thermo Fisher Scientific | 10628431 | |
| C57BL/6J | Janvier Labs | Animal model | |
| Centrifuge | For 15 mL tubes | ||
| Confocal microscope | Nikon | Confocal A1RHD microscope | |
| Costar 6-well Clear TC-treated | Corning | 3516 | |
| Cy3 Streptavidin | Jackson ImmunoResearch | 016-160-084 | 1:200 |
| Cytosine β-D-arabinofuranoside (AraC) | Sigma | C1768 | 4 µM |
| DAB Substrate Kit, Peroxidase (With Nickel) | VECTOR Laboratories | SK-4100 | |
| Digital Stereotax | KOPF | Model 940 | |
| DMEM/F12 | Thermo Fisher Scientific | 11320082 | Use for the N2 medium |
| DNase I Solution | STEMCELL Technologies | 7900 | 1 µg/mL |
| Doxycyclin | Sigma-Aldrich | D9891 | 2 µg/mL |
| DPBS -/- | Gibco | 14190144 | |
| Epifluorescence microscope | Olympus | BX51 Microscope | |
| Ethanol | Solveco | 70%, 95%, 99.8% | |
| FUW-rTA | Addgene | 20342 | Lentiviral vector |
| FUW-TetO-Ascl1-T2A-puromycin | Addgene | 97329 | Lentiviral vector |
| FUW-TetO-Dlx2-IRES-hygromycin | Addgene | 97330 | Lentiviral vector |
| H1 (WA01) ESC | WiCell | WA01 | Human embryonic stem cell line under a MTA agreement |
| H2O2 | Sigma-Aldrich | 18304 | |
| Hamilton Syringe | Hamilton | 7634-01 | 5 µL |
| HBSS | Gibco | 14175095 | No calcium, No magnesium - Transplantation medium |
| Hoechst 33342 | Invitrogen | H3570 | 1:1000 |
| Hygromycin B | Gibco (Invitrogen) | 10687010 | |
| Incubator | 5% CO2, 37 °C | ||
| Isoflurane Baxter | Apoteket AB | ||
| Manual cell counter | VWR | 720-1984 | |
| Matrigel hESC-Qualified Matrix, LDEV-free | Corning | 354277 | For the coating |
| Methanol | Merck Millipore | 1060091000 | |
| Microscope Coverslips 24 x 60 mm | Thermo Scientific | BBAD02400500#A113MNZ#0## | |
| Microscope Slides | VWR | 631-1551 | |
| Microscope Software | Olympus | CellSens | |
| Mounting media | Merck | 10981 | PVA-Dabco |
| Mouse adaptor to stereotax | RWD | 68030 | |
| mTeSR1 | STEMCELL Technologies | 85850 | Kit Basal Medium and 5X Supplement - Stem cell culture medium |
| N2 supplement | Gibco | 17502048 | |
| NaOH | Sigma-Aldrich | S8045 | 1M |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | |
| Pertex | HistoLab | 811 | |
| Pipet Filler | |||
| Play-Doh | |||
| Puromycin (Dihydrochloride) | Gibco | A1113803 | |
| Round cover glasses thickness No. 1.5H (tol. ± 5 μm) 13 mm Ø | Marienfeld | MARI0117530 | For immunocytochemistry |
| Serum | Thermo Fisher | Goat, Donkey, Horse | |
| Sterile pipette tips | For volumes 0.1-1000 µL | ||
| Sterile serological pipettes | 5, 10, 25 mL | ||
| Sterile water Braun | B Braun | 3626873 | |
| Sucrose | Sigma-Aldrich | S8501 | For 0.5% Sucrose solution |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Trypan Blue Solution | Gibco | 15250061 | |
| Tubes | Sarstedt | 15 ml, Eppendorf 1.5 mL | |
| Tweezer | VWR | ||
| Ultra pure water | MilliQ Water System | ||
| Xylene | VWR | 28973.363 | |
| Y-27632 (ROCK inhibitor) | STEMCELL Technologies | 72304 | 10 µM |
Referanslar
- Kostović, I., Jovanov-Milošević, N. The development of cerebral connections during the first 20-45 weeks' gestation. Seminars in Fetal and Neonatal. 11 (6), 415-422 (2006).
- Innocenti, G. M., Price, D. J. Exuberance in the development of cortical networks. Nature Reviews Neuroscience. 6 (12), 955-965 (2005).
- Tang, X., Jaenisch, R., Sur, M. The role of GABAergic signalling in neurodevelopmental disorders. Nature Reviews Neuroscience. 22 (5), 290-307 (2021).
- Kepecs, A., Fishell, G. Interneuron cell types are fit to function. Nature. 505 (7483), 318-326 (2014).
- DeFelipe, J., Alonso-Nanclares, L., Arellano, J. I. Microstructure of the neocortex: Comparative aspects. Journal of Neurocytology. 31 (3-5), 299-316 (2002).
- Radonjić, N. V., et al. Diversity of cortical interneurons in primates: The role of the dorsal proliferative niche. Cell Reports. 9 (6), 2139-2151 (2014).
- Turner, D. A., Shetty, A. K. Clinical prospects for neural grafting therapy for hippocampal lesions and epilepsy. Neurosurgery. 52 (3), 632-644 (2003).
- Gonzalez-Ramos, A., et al. Human stem cell-derived GABAergic neurons functionally integrate into human neuronal networks. Scientific Reports. 11, 22050(2021).
- Yang, N., et al. Generation of pure GABAergic neurons by transcription factor programming. Nature Methods. 14 (6), 621-628 (2017).
- Nicholas, C. R., et al. Functional maturation of hPSC-derived forebrain interneurons requires an extended timeline and mimics human neural development. Cell Stem Cell. 12 (5), 573-586 (2013).
- Yuan, F., et al. Induction of human somatostatin and parvalbumin neurons by expressing a single transcription factor LIM homeobox 6. eLife. 7, 37382(2018).
- Fandel, T. M., et al. Transplanted human stem cell-derived interneuron precursors mitigate mouse bladder dysfunction and central neuropathic pain after spinal cord injury. Cell Stem Cell. 19 (4), 544-557 (2016).
- Noakes, Z., et al. Human pluripotent stem cell-derived striatal interneurons: Differentiation and maturation in vitro and in the rat brain. Stem Cell Reports. 12 (2), 191-200 (2019).
- Parikshak, N. N., Gandal, M. J., Geschwind, D. H. Systems biology and gene networks in neurodevelopmental and neurodegenerative disorders. Nature Reviews Genetics. 16 (8), 441-458 (2015).
- Marín, O. Interneuron dysfunction in psychiatric disorders. Nature Reviews Neuroscience. 13 (2), 107-120 (2012).
- Sloan, D. J., Wood, M. J., Charlton, H. M. The immune response to intracerebral neural grafts. Trends in Neurosciences. 14 (8), 341-346 (1991).
- Diehl, R., et al. Immunosuppression for in vivo research: State-of-the-art protocols and experimental approaches. Cellular & Molecular Immunology. 14 (2), 146-179 (2017).
- Osman, M. M., et al. Cyclosporine-A as a neuroprotective agent against stroke: Its translation from laboratory research to clinical application. Neuropeptides. 45 (6), 359-368 (2011).
- Quinnies, K. M., Cox, K. H., Rissman, E. F. Immune deficiency influences juvenile social behavior and maternal behavior. Behavioral Neuroscience. 129 (3), 331-338 (2015).
- Fernandes, D. J., et al. Mouse models of immune dysfunction: their neuroanatomical differences reflect their anxiety-behavioural phenotype. Molecular Psychiatry. 27 (7), 3047-3055 (2022).
- Lund, R. D., Rao, K., Hankin, M. H., Kunz, H. W., Gill, T. J. Transplantation of retina and visual cortex to rat brains of different ages. Maturation, connection patterns, and immunological consequences. Annals of the New York Academy of Sciences. 495, 227-241 (1987).
- Olsson, M., Bentlage, C., Wictorin, K., Campbell, K., Björklund, A. Extensive migration and target innervation by striatal precursors after grafting into the neonatal striatum. Neuroscience. 79 (1), 57-78 (1997).
- Mattis, V. B., et al. Neonatal immune-tolerance in mice does not prevent xenograft rejection. Experimental Neurology. 254, 90-98 (2014).
- Nato, G., et al. Immune-tolerance to human iPS-derived neural progenitors xenografted into the immature cerebellum is overridden by species-specific differences in differentiation timing. Scientific Reports. 11, 651(2021).
- Allison, T., et al. Defining the nature of human pluripotent stem cell-derived interneurons via single-cell analysis. Stem Cell Reports. 16 (10), 2548-2564 (2021).
- Waloschková, E., et al. Human stem cell-derived GABAergic interneurons establish efferent synapses onto host neurons in rat epileptic hippocampus and inhibit spontaneous recurrent seizures. International Journal of Molecular Sciences. 22 (24), 13243(2021).
- Gonzalez Ramos, A. Enhancing neuronal inhibition by cell and gene therapy as a novel treatment for epilepsy. , Lund University, Faculty of Medicine. PhD thesis (2022).
- Paterno, R., et al. Hippocampal gamma and sharp-wave ripple oscillations are altered in a Cntnap2 mouse model of autism spectrum disorder. Cell Reports. 37 (6), 109970(2021).
- Penagarikano, O., et al. Absence of CNTNAP2 leads to epilepsy, neuronal migration abnormalities, and core autism-related deficits. Cell. 147 (1), 235-246 (2011).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Angeletti, B., et al. An in vivo doxycycline-controlled expression system for functional studies of the retina. Investigative Ophthalmology & Visual Science. 44 (2), 755-760 (2003).
- Doxycycline. Drugs and Lactation Database (LactMed). , National Library of Medicine. Bethesda, MD. Available from: https://www.ncbi.nlm.nih.gov/books/NBK500561 (2021).
- Barker, R. A., Widner, H. Immune problems in central nervous system cell therapy. NeuroRX. 1 (4), 472-481 (2004).
- Hoornaert, C. J., et al. Concise review: Innate and adaptive immune recognition of allogeneic and xenogeneic cell transplants in the central nervous system. Stem Cells Translational Medicine. 6 (5), 1434-1441 (2017).
- Englund, U., Fricker-Gates, R. A., Lundberg, C., Bjorklund, A., Wictorin, K. Transplantation of human neural progenitor cells into the neonatal rat brain: Extensive migration and differentiation with long-distance axonal projections. Experimental Neurology. 173 (1), 1-21 (2002).
- Fainstein, N., Ben-Hur, T. Brain region-dependent rejection of neural precursor cell transplants. Frontiers in Molecular Neuroscience. 11, 136(2018).
- Denham, M., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Frontiers in Cellular Neuroscience. 6, 11(2012).
- Miguez, A., et al. In vivo progressive degeneration of Huntington's disease patient-derived neurons reveals human-specific pathological phenotypes. bioRxiv. , (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır