Method Article
ヒト幹細胞由来GABA作動性ニューロンの生後早期マウス海馬への移植による神経発達障害緩和
要約
ニューロンプログラミングによって生成されたヒト多能性幹細胞由来のGABA作動性ニューロンの移植は、神経発達障害の潜在的な治療アプローチとなる可能性があります。このプロトコルは、ヒト幹細胞由来のGABA作動性ニューロン前駆体の生成と新生児マウスの脳への移植を記述しており、移植されたニューロンの長期的な調査とその治療可能性の評価を可能にします。
要約
抑制性介在ニューロンの数の減少または機能不全は、神経発達障害の一般的な原因です。したがって、変化した神経回路の影響を置換または軽減するために介在ニューロンを使用する細胞療法は、魅力的な治療手段である。この目的のために、ヒト幹細胞由来のGABA作動性介在ニューロン様細胞(hdIN)が宿主回路内で時間の経過とともに成熟、集積、および機能する方法について、より多くの知識が必要です。神経発達障害において特に重要なのは、移植細胞におけるこれらのプロセスが進化し成熟する宿主脳によって影響を受けるかどうかをよりよく理解することです。本プロトコルは、転写因子 Ascl1 および Dlx2のトランスジェニック発現に基づくヒト胚性幹細胞からのhdINの迅速かつ高効率な生成を記載する。これらの神経細胞前駆体は、 in vitroで7日後に、新生児2日齢マウスの海馬に一方的に移植される。移植されたニューロンは、皮質異形成限局性てんかん症候群のマウスモデルの同側および反対側の海馬に分散し、移植後最大9ヶ月間生存します。このアプローチにより、健康な脳と病気の脳の発達において、移植された介在ニューロンの細胞同一性、統合、機能、および治療の可能性を長期間にわたって調査することができます。
概要
神経回路網の確立、成熟、洗練は周産期と出生後初期に起こり、脳の発達にとって重要な時間枠を再び表します1。出産後の接続性の活気から、脳は青年期まで続く接続の微調整に進化します2。その結果、これらの期間中に発現される遺伝子の変化、ならびに外的要因または侮辱は、複数の神経発達障害に対する個人の素因を定義する。認知障害と運動機能の障害は時間とともに展開し、薬理学的治療は限られており、大部分は重篤な副作用のリスクを伴う症状を対象としています。
γ-アミノ酪酸(GABA)作動性阻害の機能不全は、脆弱X症候群、アンジェルマン症候群、てんかん、統合失調症、自閉症など、さまざまな神経発達障害3の根本的な原因の主な原因であることが示されています。GABAは中枢神経系の主要な抑制伝達物質であり、興奮性/抑制性(E / I)バランス、ニューロン発火の同期、および計算を維持するのに役立ちます。GABA作動性介在ニューロンは、ニューロンの不均一な集団であり、より複雑な脳領域4および進化5,6で機能の複雑さが増しています。ヒト脳の限られた内因性再生能力といくつかの神経障害における介在ニューロン機能障害の影響を考慮すると、GABA作動性介在ニューロンの移植は、探求するための有望な治療手段となる可能性があります。この方針に沿って、ヒト幹細胞由来のGABA作動性介在ニューロン様細胞(hdIN)は、げっ歯類の同種異系ニューロン前駆体または他の場所で使用される他の供給源と比較して、この目的のための最も翻訳的で実行可能な供給源であるように思われる7。多様な細胞源からGABA作動性ニューロンを生成するためのプロトコルが利用可能である8、9、10、11、12、13が利用可能ですが、発達中の病理学的脳においてhdINがどのように成熟し、統合し、機能するかについては、より多くの知識が必要です。いくつかの研究では、皮質パターニング中にアクティブな遺伝子の変化、ニューロンの接続性の確立14、および生理学的E / Iバランスの調整15が確認されています。対応する遺伝的摂動を伴うマウスモデルへのhdINの新生児移植により、潜在的な治療戦略を決定するために必要な知識である宿主と移植片の間の相互作用を追跡することができます。
免疫調節は、異種移植片移植において、宿主の免疫応答および拒絶反応の引き起こしを回避するために、一般的かつ首尾よく使用されている16。しかし、シクロスポリンAなどの免疫抑制薬の投与は、慢性投与後に腎毒性を引き起こし、安定した全身濃度を達成するために毎日の腹腔内注射が必要なため労働集約的であり、動物のストレスを引き起こし17、病理と相互作用する可能性のあるオフターゲット効果があります18。さらに、免疫系を危うくすることは、対応する神経解剖学的領域20の変化を伴う行動表現型19を変化させることが示されている。生後1週間の移植は、移植細胞への適応を可能にすることが示されています21,22が、他の人は、最初の生存とそれに続く生後最初の月以内の移植片の拒絶を報告しています23,24。
このプロトコルは、新生児マウスにおけるhdIN生成から細胞移植までの手順を説明し、長期的な移植片生存をもたらし、生理学的および病理学的発達中の移植ヒト介在ニューロンのニューロン特異性、シナプス統合、機能、および治療の可能性の調査を可能にします。
プロトコル
すべての実験手順は、マルメ/ルンド動物研究倫理委員会(倫理許可番号12548-19)によって承認され、スウェーデン動物福祉庁の規則および動物実験に関するEU指令2010/63 / EUに同意して実施されました。本研究では、C57BL6 / Jおよび コンタクチン関連タンパク質様 2(Cntnap2)ノックアウト(KO)マウスを、オスとメスの両方で、生後(P)2に使用しました。ヒト胚性幹細胞(hESC)を使用した。動物および幹細胞は市販の供給源から入手した( 材料表を参照)。
1. hdIN前駆体の生成
注:このセクションのすべての手順は、細胞培養フードで行われます。hESCは、幹細胞培養培地を使用してコーティングされたプレート上でフィーダーフリー細胞として維持され、コロニーとして継代されました。
- hESCからhdIN前駆体へのフォワードプログラミングを実行します(図1)。
注: フォワードプログラミングアプローチは、Gonzalez-Ramos et al.8 および Yang et al.9 で説明されている手順に基づいています。- 10 μMのROCK阻害剤(RI)を含む新鮮な幹細胞培養培地中で、Tet-Onシステムを含むレンチウイルスベクターでhESCを形質導入します( 材料の表を参照)。インキュベーター内で37°Cに保ちます。
- 形質導入の16時間後に培地を新鮮な幹細胞培養培地に変更し、形質導入されていないhESCと同様に形質導入細胞を維持します。
- コンフルエントになったら、細胞剥離溶液(材料の表を参照)を使用してhESCを単一細胞として分離し、in vitro(DIV)-1日に10 μMのRIを含む幹細胞培養培地中で、3 x 105細胞/ウェルの密度でコーティングされた6ウェルプレートにプレートします。
- 1 DIVで、培養培地を2 g/Lのドキシサイクリンを含むN2培地に交換します(DOX、 材料表を参照)。
注:DOXは、Ascl1およびDlx29の導入遺伝子発現を1DIVから7DIVに誘導するために使用され、その後、飲料水25に添加することによってin vivoで継続します。 - 2 DIVで、抗生物質耐性の選択期間が始まり、5 DIVまで続きます。 ピューロマイシン(ピューロ)とハイグロマイシン(ハイグロ)を新鮮な培地に追加します( 材料の表を参照)。2 DIV、4 DIV、および 5 DIV のメディアを変更します。
注:形質導入および非形質導入hESCを使用して分化プロトコルの前にピューロと湿度の濃度を最適化し、抗生物質耐性カセットを運ぶ細胞のみの生存を確保します。このプロトコルでは、0.5 μg/mLのピューロと750 μg/mLのハイグロを使用しました。 - 5 DIVで、抗生物質選択期間は終了します。2 g/LのDOXと4 μMのシトシンβ-D-アラビノフラノシドを添加したN2培地に変更してください(Ara-C、 材料表を参照)。
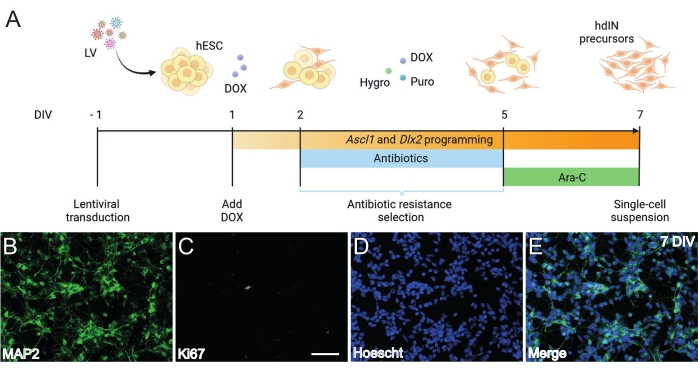
図1:Ascl1およびDlx2の過剰発現によるhESCからのhdIN前駆体の生成。(A)hdIN前駆体の生成に用いた分化プロトコルの概略図。(B-E)(B)ニューロンマーカーMAP2、(C)増殖マーカーKi67、(D)一般的な核染色、および(E)以前のマーカーのマージについての7DIVでのhdIN前駆体の免疫細胞化学。スケールバー:50μm。 この図の拡大版を表示するには、ここをクリックしてください。
2. 移植用単一細胞懸濁液の調製
注:このセクションのすべての手順は、細胞培養フードで行われます。7 DIVでは、hdIN前駆体が解離し、移植に使用されます。
- 以下の手順に従ってセルの剥離を実行します。
- 培地を取り出し、カルシウムとマグネシウムを含まないDPBSで細胞を注意深くすすぎます。
- 400 μLの細胞剥離溶液( 材料の表を参照)を6ウェルプレートの各ウェルに加えます。
注意: ソリューションによる表面全体のカバレッジを確保します。 - インキュベーター内で37°Cで2〜3分間インキュベートし、細胞の境界が光沢のあるように見え始め、細胞表面タンパク質の酵素分解とウェル表面からの剥離を示します。
注意: 細胞の生存率を高めるために、すべての細胞が完全に剥離して浮遊しているときにあまり長く待たないでください。 - 次いで、6ウェルプレートの各ウェルに600μLの新鮮なN2培地を加えて酵素を停止し、ピペットで機械的に、細胞を剥離させ、単一細胞懸濁液を得るのを助けた。
- 細胞懸濁液をプラスチックチューブ(15 mL)に移し、室温(RT)で180 x g で4分間遠心分離します。
- 細胞の再懸濁を行う。
- 真空システムを使用して上清を廃棄し(ペレットを乱さずに慎重に)、10 μMのRI、1 μg/mLのDNase、および2 μg/μLのDOXを含む移植培地にペレットを再懸濁します。
- 計数チャンバーと手動セルカウンターを使用して懸濁液中の全細胞をカウントし、容量を最終濃度100,000細胞/μLに調整します。
- 細胞懸濁液を、移植まで氷上の密閉チューブに最大4時間保持する。
注:移植は、細胞懸濁液(7 DIV)の調製と同じ日に行わなければなりません。
3.海馬内細胞移植
注:このセクションのすべての手順は、動物施設の細胞培養フードの外で実行されます。出生後の早期脳内への細胞移植は、P0を生年月日を考慮してP2で行った。
- 以下の手順で移植実験の準備をしてください。
- すべての外科用材料をオートクレーブするか、不可能な場合は、別の承認された方法で滅菌します。
- 注入シリンジをガラス毛細管なしでホルダーに取り付けます。針を水ですすいでください。
注意: 針は33Gでなければなりません。 - 30Gのインスリン針の先端を90°カーブさせます。
- 子犬を頭を平らにして配置するための自家製のPlay-Dohのようなステージを作成します(図2A)。
- 新しい環境に順応できるように、手術のために何かを準備する前に、母親と子犬と一緒にマウスケージをフェッチします。
- 湿った氷の入ったトレイと、イソフルラン用の紙を入れた空のケージを用意します。
- マウスの子犬を麻酔します。
- 一枚の紙にイソフルランを浸し( 材料の表を参照)、空のケージの中に置きます。慎重に1匹の子犬を取り、イソフルランに浸した紙でケージに入れます。
注:3匹未満の子犬をお母さんと一緒に残さないでください。イソフルラン麻酔の20〜30秒を超えないでください、さもなければ子犬は死ぬかもしれません。 - 運動停止による麻酔の効果を確認します。
- 麻酔後すぐに、湿った氷の表面の濡れたティッシュの上に子犬を置きます。上肢が白みを帯びるまで、動物を氷上に3分間置きます(図2B、青い矢印)。これには通常2〜3分かかります。
- この時間を使用して、シリンジに細胞懸濁液を装填します。前にピペットで慎重に細胞を再懸濁してください。
- 子犬を定位固定装置フレームに置きます。イヤーバーを反対方向に使用します(図2A、マゼンタの矢印)。
注意: イヤーバーの裏側はそれほど尖っておらず、P2の子犬には耳がないため、動物を傷つけないように平らな側を使用してください。 - 横から、頭がまっすぐかどうかを確認します。頭は平らでなければなりません。Play-Dohのようなステージを使用して調整します。
注:この年齢の子犬はまだ目を開いていないので、この点に関して追加の手順を実行する必要はありません。子犬はこの年齢で毛皮を持っていないので、その領域の剃毛は必要ありません。皮膚への開放切開ではなく、縫合も行われないため、特定の痛みの治療は行われません。 - 手術の全期間中、子犬を氷の上(ティッシュペーパーの上)に覆ったままにします。
注意: 氷を子犬の皮膚に直接接触させないでください。
- 一枚の紙にイソフルランを浸し( 材料の表を参照)、空のケージの中に置きます。慎重に1匹の子犬を取り、イソフルランに浸した紙でケージに入れます。
- 注射を行います。
- エタノールに浸した軟組織を使用して皮膚の表面をきれいにします。
- ラムダを識別し、定位固定装置のデジタルディスプレイコンソールで座標をゼロに設定します(図2C、黄色の破線)。矢状縫合糸とラムドイド縫合糸は、血管新生しているため、赤い線として目で簡単に見えます。
注意: ラムダの視覚化に問題がある場合は、小さな氷片を皮膚に置き、冷えるまで数分待ちます。次に、氷片を取り除くと、肌の微妙な白化により視覚化できます。 - 注射針を目的の座標に移動します。記載されたプロトコルでは、標的領域は海馬であり、座標は次の通りであった:前後(AP)+0.85および中外側(ML)+1.35。
- 90°曲がったインスリン針を使用して頭蓋骨を貫通し、小さな穴を開けます。
- 頭蓋骨を横切るまで注射針を下ろし、背腹(DV)座標をゼロにします。目的のDV座標になるまで針を下げます。記載されたプロトコルでは、座標はDV −1.1であった。
- 所定の時間間隔に従って注入する。
注:説明されているプロトコルでは、正確なタイミングは次のとおりでした:(i)DV座標に下がった後、3分間待ちます、(ii)1μLのボリュームを5分間注入し、(iii)すべてのボリュームが注入された後、3分間待ちます。 - 針をゆっくりと引っ込めます。
- 手順を終了します。
注:子犬の生存を確保し、低体温による麻酔に起因する損傷を避けるために、手術は15分以上続くことはできません。- 子犬が動き始めるまで手で温めてから、母親に返します。
- 0.5%ショ糖溶液に1mg/mLの濃度のDOXを飲料水として、移植前2日以上、3週間以上投与し、 生体内での細胞分化を継続します。
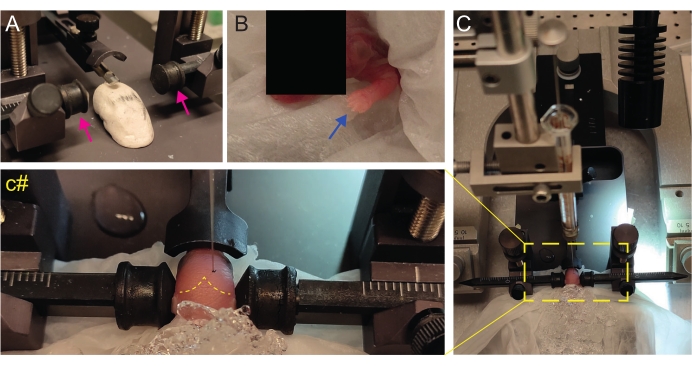
図2:P2の新生マウス仔における定位固定術移植。 (A)子犬の体を所定の位置に保持し、逆さまのイヤーバー(マゼンタの矢印)を行うためのPlay-Dohのようなステージ。(B)白い前足(青い矢印)は、子犬が低体温症によって麻酔を受けているように、その領域の血流が減少していることを示します。(C)柔らかいティッシュペーパーの上に子犬がすでに氷で覆われているセットアップの概要。(C#)注射針がすでに脳に挿入された状態で、子犬の頭のクローズドズーム(ラムダとラムドイドの縫合を示す黄色の破線)。この図はゴンザレス・ラモスらから改作されています。27. この図の拡大版を表示するには、ここをクリックしてください。
結果
ここに提示され、図1Aに図示されるプロトコルに従って、hdIN前駆体は、(i)細胞周期マーカーKi67に対する負の免疫反応性および(ii)微小管関連タンパク質2(MAP2)などのニューロンマーカーの発現によって定義されるように、7DIVでまだ増殖していなかった(図1B−E)。この特性評価は、すべての手順ステップを経た後に24時間再播種された残りの細胞に対して実行されました。さらに、以前に発表された遺伝子発現解析は、多能性状態からニューロン表現型への急速な移行が4DIVおよび7DIV8前後で起こることを示した。全体として、これらの結果は、有糸分裂後細胞の存在および奇形腫形成のリスクの欠如を確認した。
次に、野生型(WT)マウスの海馬への生後早期移植後のhdIN前駆体の生存率を、ヒト細胞質マーカーSTEM121に対する免疫組織化学によって試験した。hdIN前駆体をP2のナイーブ免疫適格マウスの右背側海馬に移植し、P14および2ヶ月PTで屠殺し、移植細胞は背海馬全体に見られ、脳梁と反対側海馬の両方に分散しました。さらに、両方の時点で、移植されたhdINは誘導転写因子の1つであるAscl1を発現し(補足図1)、Ki67発現がないことによって示されるように増殖しませんでした(補足図2)。
重要なことに、Iba1、CD68、およびガレクチン-3(Gal3)を使用して同定された反応性ミクログリアの欠如によって評価されるように、移植細胞に対する免疫反応または局所炎症はP14または2か月PTのいずれにも見られませんでした(図3)、グリア線維性酸性タンパク質(GFAP)およびインターロイキン-1(IL-1)などの炎症性サイトカインによって決定されるアストログリオーシスの程度。 細胞傷害性Tリンパ球(CD8)の不在(図4)。
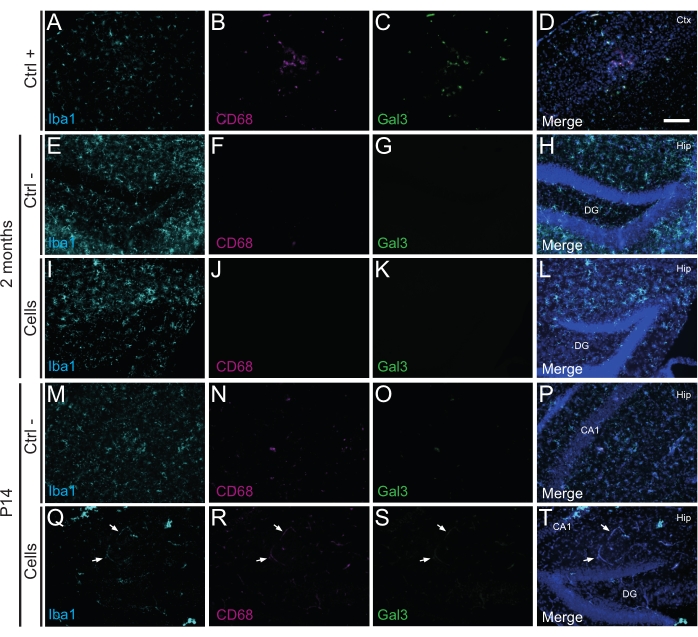
図3:宿主組織からの免疫拒絶を引き起こすことなく、新生WTマウスの海馬へのP14および2ヶ月PTでのhdIN。脳組織におけるIba1、CD68、およびGal3マーカーの免疫蛍光は、(A-D)電気凝固脳卒中マウスモデルにおける虚血性コア領域の近接(ポジティブコントロール、Ctrl+)、(E-H)陰性対照動物(Ctrl-)2ヶ月および(M-P)P14、および(I-L)2ヶ月で細胞移植を受けた動物(Q-T)P14。白い矢印は、自家蛍光のためにすべてのチャネルで見える血管のいくつかの例を示しています。略語:Ctx =皮質;ヒップ=海馬;DG =歯状回;CA1 = コルヌアンモニス1。スケールバー:50μm。 この図の拡大版を表示するには、ここをクリックしてください。
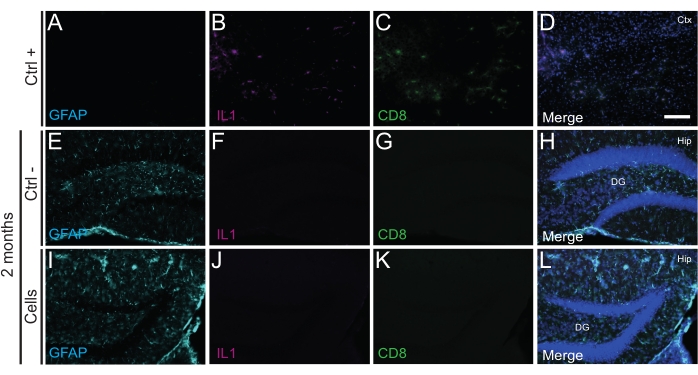
図4:宿主組織からの免疫拒絶を引き起こすことなく、新生WTマウスの海馬への2ヶ月PTでのhdIN。(A-D)電気凝固脳卒中モデルマウスにおける虚血性コア領域の近接(陽性対照、Ctrl +)、(E-H)陰性対照動物(Ctrl-)2ヶ月、および(I-L)2ヶ月で細胞移植を受けた動物からの脳組織におけるIL1、GFAP、およびCD8マーカーの免疫蛍光。略語:Ctx =皮質;ヒップ=海馬;DG =歯状回。スケールバー:50μm。 この図の拡大版を表示するには、ここをクリックしてください。
同様に、hdIN前駆体は、自閉症スペクトラム障害および皮質異形成限局性てんかん症候群のモデルであるCntnap2 KOマウスの海馬にも移植されました。実際、Cntnap2 KOマウスでは、hdINはPTで9か月まで生存し、注射部位に局在していましたが、WTマウスで観察されたように、同側および反対側の海馬にも分散していました(図5)。さらに、移植されたhdINのほとんどは、インビトロ8,26およびインビボ25の成体げっ歯類における以前の結果から予想されるように、介在ニューロンマーカーに対して免疫反応性であった。
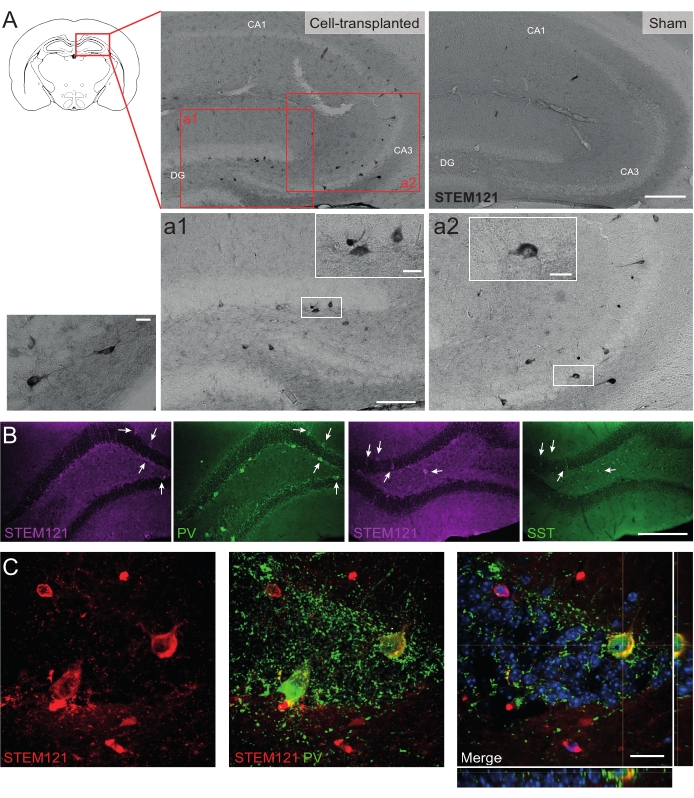
図5:9ヶ月PTでのCntnap2 KOマウスの海馬における移植hdIN。 (A)細胞移植マウス(左)および偽マウス(右)における細胞質ヒトマーカーSTEM121に対する免疫化学。(A1 および A2)STEM121陽性細胞の拡大画像。(B)STEM121(マゼンタ)および介在ニューロンマーカーのパルブアルブミン(PV)およびソマトスタチン(SST)の免疫蛍光。白い矢印は、STEM121とそれぞれの介在ニューロンマーカーのダブルポジティブ細胞を示しています。(C)STEM121およびPVに対する移植されたhdIN免疫反応性の直交図。スケールバー:200μm(AおよびB)、100μm(a1およびa2)、20μm(a1およびa2、およびCの小さな正方形倍率)。 この図の拡大版を表示するには、ここをクリックしてください。
補足図1:Ascl1を発現する新生WTマウスの海馬に2ヶ月PTでhdINを移植した。 細胞移植WTマウスにおける(A)CA3および(B)DGにおけるAscl1および細胞質ヒトマーカーSTEM121に対する免疫蛍光。(a)STEM121陽性細胞の拡大画像。白い矢印は、STEM121とAscl1のダブルポジティブ細胞を示しています。スケールバー:100μm。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:新生WTマウスの海馬への2ヶ月PTでの有糸分裂後移植hdIN。 (A)ナイーブおよび(B)細胞移植WTマウスにおける増殖性マーカーKi67および細胞質ヒトマーカーSTEM121に対する免疫蛍光。(b)STEM121陽性細胞の拡大画像。黄色の矢印は、Ki67が陽性で、STEM121が陰性の細胞を示しています。白い矢印は、STEM121陽性細胞、Ki67陽性細胞を示す。白いアスタリスクは側脳室を示しています。スケールバー:100μm。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
本プロトコルは、in vitro でhdIN前駆体を生成するための堅牢で、高速で、シンプルで、広くアクセス可能な方法論と、神経発達障害の前臨床モデルにおける早期介入細胞療法としてのその使用について説明しています。
神経発達障害の特徴的な表現型のいくつかは青年期または成人期に生じるが、病態生理学的変化は初期の発達中にすでに存在する。このため、症候学または臨床症状の前の重要な脳発達期に作用することにより、有益な効果を達成するために早期介入が強く正当化されます。将来的には、遺伝子スクリーニングとバイオマーカーの開発により、予防的または前症候性の治療が可能になり、これらの患者にとってゲームチェンジャーになります。したがって、hdIN前駆体は、ニューロンネットワークのてんかん原性の変化が進行中である可能性があり28、この動物モデル29で細胞の変化が記載されている時点で、Cntnap2 KOマウスモデルで出生後早期に移植されました。ただし、年齢外挿の潜在的な落とし穴と、マウスと人間の脳の特定のプロセスのタイミングを考慮することが重要です。
手順自体に焦点を当てると、ここで提示される分化プロトコルは、転写因子の使用に基づいており、低分子に基づく他のプロトコルと比較して、幹細胞の迅速かつ非常に効率的なプログラミングを可能にします10,30。このアプローチの潜在的な欠点は、挿入突然変異誘発のリスクを伴うレンチウイルスベクターの要件である可能性があります。プロトコルの2つの重要なステップは、抗生物質と抗有糸分裂剤を培地に追加して、転写因子を発現する細胞を選択し、増殖細胞を排除して、それぞれ奇形腫形成のリスクを回避することです。この研究ではhdIN前駆体のみがテストされましたが、この手順は他の細胞源やプログラミング/分化プロトコルでも実行可能であると予想されます。それにもかかわらず、他のニューロンサブタイプおよび/またはモデルは検証されるべきである。
hdIN前駆体の移植年齢7DIVは、(i)Ki67に対する免疫反応性によって評価された増殖細胞の不在、(ii)POU5F1などの多能性遺伝子の発現低下の既報の観察、およびその時点での神経細胞マーカーMAP2および介在ニューロンマーカーGAD1の出現に基づいて決定されました8.しかし、このプロトコルを記述した元の研究では、DOX離脱後の14DIVで移植を行いました9。これは、母親の飲料水中のDOXが、授乳中の子犬の脳に移植された細胞にミルクを介して到達できるかどうか、または7DIVのDOX誘導がGABA作動性の運命を確立するのに十分であるかどうかについての疑問を提起します。Yangらは、14日間のDOXがin vitroで安定した神経細胞を生成するのに十分であると特定したが9、Gonzalez-Ramosら8は、7DIVですでにGAD1遺伝子発現を検出し、Ascl1およびDlx2によるGAD67の下流活性化がこの時点ですでに起こっていることを示している。したがって、パターニングは7 DIVで開始され、DOX処理への依存度が低い可能性があります。さらに、げっ歯類とヒトの証拠は、母乳中のDOXの存在を示しており31,32、ここに提示された結果は、移植されたhdINが2週間と2か月のPTでAscl1に対して免疫反応性であり、その後9か月のPTで介在ニューロンマーカーであったことを示しています。移植された集団内では、PVおよびSST陽性ニューロンに加えて、カルレチニン(CR)およびカルビンジン(CB)などの介在ニューロンの亜集団の他のマーカーも少量で見出された。
この手順の困難な側面は、分化と子犬の年齢の両方のタイミングの調整です。通常、マウスの妊娠は交配ケージを設置してから21日かかりますが、これは時々異なる場合があります。このシナリオは、すべてを慎重に計画および配置できる成人げっ歯類で細胞移植を行う場合には発生しません。それにもかかわらず、これは、2日間隔で2〜3個の交配ケージを設置するか、2日間のタイムラプスで2〜3個の分化バッチを設定することで簡単に軽減できます。
この研究で使用されたマウスは免疫不全でも免疫抑制でもありませんでしたが、移植された細胞はin vivoで最大9か月生存し、異種細胞に対する免疫反応または局所炎症のマーカーはP14または2か月PTのいずれでも観察されませんでした。 移植された異種細胞の免疫拒絶はMHC /ペプチドに対して引き起こされ、移植片拒絶反応の主要な細胞メディエーターはTリンパ球とミクログリア細胞です33。34。そこで、T細胞のマーカーに対する免疫反応性、ならびに反応性ミクログリアを探索した。宿主組織における移植細胞の免疫拒絶の兆候は、反応性ミクログリアのレベルまたはP14または2ヶ月のWTマウスにおけるTリンパ球の存在のいずれによっても検出されなかった。さらに、アストログリオーシスおよび炎症性サイトカインの評価レベルに基づいて局所炎症は観察されなかった。この結果は、他の細胞同一性、位置、および動物モデル35、38によって観察された新生児免疫寛容35、36、37に部分的に依存している可能性があります。Englundらは、隣接する白質35における移植細胞の観察を含む、移動および成熟の観点から移植細胞の転帰における地域差を特定した。
最後に、hdINが移植コアとして残った成体のげっ歯類に移植した他の研究と比較して、海馬内の移植細胞のより大きな分散が観察されました25。この分散はまた、Yangらによって以前に観察された結果とも異なっていた9、この場合、移植時の細胞の年齢によって説明することができる。
開示事項
著者は競合する利益を宣言しません。
謝辞
このプロジェクトは、スウェーデン研究評議会(助成金番号:2016-02605、MA)、スウェーデン脳財団F02021-0369(MA)、クラフォード財団(MA)、および欧州連合ホライズン2020プログラム(H2020-MSCA-ITN-2016)によって、マリースクウォドフスカ-キュリー革新的トレーニングネットワークプロジェクトTraining4CRM No.722779(M.K.)の下で資金提供されました。P2新生児マウスへの定位固定装置細胞移植を教えてくださったJosep Maria Canals研究室(バルセロナ大学幹細胞・再生医学研究所)のAndrés Miguez氏と、P2新生マウスの海馬への細胞移植に関するアドバイスと予備調整をしてくださったテキサス大学オースティン校のグループリーダーであるMackenzie Howard氏のご協力に心より感謝しています。動物の世話を手伝ってくれたスザンヌ・ジェレスと組織の処理を手伝ってくれたリン・カオ、そして研究に何らかの形で貢献した学生、特にダイアナ・ハタミアンに感謝します。最後に、このホワイト ペーパーを説明するために使用されるグラフィックの一部は、BioRender.com を使用して作成されました。
資料
| Name | Company | Catalog Number | Comments |
| 30 G needle | B Braun | 4656300 | |
| 33 G needle for Hamilton syringe | Hamilton | 7762-06 | |
| 4-well plates | Thermo Scientific | 176740 | |
| Accutase | STEMCELL Technologies | 7920 | Cell detachment solution use for splitting cells (hESC and hdIN precursors) |
| Adjustable volume pipettes 10, 20, 200, 1000 µL | |||
| Alexa Fluor Plus 488/555/647 | Thermo Fisher | 1:1000 | |
| Anti-CD68 (Rat) | Bio-Rad | MCA1957 | 1:200 |
| Anti-CD8 (Rabbit) | Abcam | 203035 | 1:200 |
| Anti-Galectin 3 (Goat) | R&D systems | AF1197 | 1:500 |
| Anti-GFAP (Guiena Pig) | Synaptic systems | 173004 | 1:500 |
| Anti-Iba1 (Rabbit) | WAKO | 19119741 | 1:500 |
| Anti-IL1 (Goat) | Santa Cruz Biotech | SC-106 | 1:400 |
| Anti-Ki67 | Abcam | ab16667 | 1:250 |
| Anti-Ki67 (Rabbit) | Novocastra | NCL-Ki67p | 1:250 |
| Anti-MAP2 (Chicken) | Abcam | ab5392 | 1:2000 |
| Anti-Mash1 (Ascl1) | Abcam | ab74065 | 1:1000 |
| Anti-Parvalbumin (Rabbit) | Swant | PV 27 | 1:5000 |
| Anti-Somatostatin (Rat) | Millipore | MAB354 | 1:150 |
| Anti-STEM121 (Mouse) | Takara Bio | Y40410 | 1:400 |
| Avidin/Biotin Blocking Kit | VECTOR Laboratories | SP-2001 | |
| B6.129(Cg)-Cntnap2tm1Pele/J | Jackson Laboratory | 17482 | Animal model |
| Biotinylated Horse anti-Mouse | VECTOR Laboratories | BA-2001 | 1:200 |
| Burker Chamber | Thermo Fisher Scientific | 10628431 | |
| C57BL/6J | Janvier Labs | Animal model | |
| Centrifuge | For 15 mL tubes | ||
| Confocal microscope | Nikon | Confocal A1RHD microscope | |
| Costar 6-well Clear TC-treated | Corning | 3516 | |
| Cy3 Streptavidin | Jackson ImmunoResearch | 016-160-084 | 1:200 |
| Cytosine β-D-arabinofuranoside (AraC) | Sigma | C1768 | 4 µM |
| DAB Substrate Kit, Peroxidase (With Nickel) | VECTOR Laboratories | SK-4100 | |
| Digital Stereotax | KOPF | Model 940 | |
| DMEM/F12 | Thermo Fisher Scientific | 11320082 | Use for the N2 medium |
| DNase I Solution | STEMCELL Technologies | 7900 | 1 µg/mL |
| Doxycyclin | Sigma-Aldrich | D9891 | 2 µg/mL |
| DPBS -/- | Gibco | 14190144 | |
| Epifluorescence microscope | Olympus | BX51 Microscope | |
| Ethanol | Solveco | 70%, 95%, 99.8% | |
| FUW-rTA | Addgene | 20342 | Lentiviral vector |
| FUW-TetO-Ascl1-T2A-puromycin | Addgene | 97329 | Lentiviral vector |
| FUW-TetO-Dlx2-IRES-hygromycin | Addgene | 97330 | Lentiviral vector |
| H1 (WA01) ESC | WiCell | WA01 | Human embryonic stem cell line under a MTA agreement |
| H2O2 | Sigma-Aldrich | 18304 | |
| Hamilton Syringe | Hamilton | 7634-01 | 5 µL |
| HBSS | Gibco | 14175095 | No calcium, No magnesium - Transplantation medium |
| Hoechst 33342 | Invitrogen | H3570 | 1:1000 |
| Hygromycin B | Gibco (Invitrogen) | 10687010 | |
| Incubator | 5% CO2, 37 °C | ||
| Isoflurane Baxter | Apoteket AB | ||
| Manual cell counter | VWR | 720-1984 | |
| Matrigel hESC-Qualified Matrix, LDEV-free | Corning | 354277 | For the coating |
| Methanol | Merck Millipore | 1060091000 | |
| Microscope Coverslips 24 x 60 mm | Thermo Scientific | BBAD02400500#A113MNZ#0## | |
| Microscope Slides | VWR | 631-1551 | |
| Microscope Software | Olympus | CellSens | |
| Mounting media | Merck | 10981 | PVA-Dabco |
| Mouse adaptor to stereotax | RWD | 68030 | |
| mTeSR1 | STEMCELL Technologies | 85850 | Kit Basal Medium and 5X Supplement - Stem cell culture medium |
| N2 supplement | Gibco | 17502048 | |
| NaOH | Sigma-Aldrich | S8045 | 1M |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | |
| Pertex | HistoLab | 811 | |
| Pipet Filler | |||
| Play-Doh | |||
| Puromycin (Dihydrochloride) | Gibco | A1113803 | |
| Round cover glasses thickness No. 1.5H (tol. ± 5 μm) 13 mm Ø | Marienfeld | MARI0117530 | For immunocytochemistry |
| Serum | Thermo Fisher | Goat, Donkey, Horse | |
| Sterile pipette tips | For volumes 0.1-1000 µL | ||
| Sterile serological pipettes | 5, 10, 25 mL | ||
| Sterile water Braun | B Braun | 3626873 | |
| Sucrose | Sigma-Aldrich | S8501 | For 0.5% Sucrose solution |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Trypan Blue Solution | Gibco | 15250061 | |
| Tubes | Sarstedt | 15 ml, Eppendorf 1.5 mL | |
| Tweezer | VWR | ||
| Ultra pure water | MilliQ Water System | ||
| Xylene | VWR | 28973.363 | |
| Y-27632 (ROCK inhibitor) | STEMCELL Technologies | 72304 | 10 µM |
参考文献
- Kostović, I., Jovanov-Milošević, N. The development of cerebral connections during the first 20-45 weeks' gestation. Seminars in Fetal and Neonatal. 11 (6), 415-422 (2006).
- Innocenti, G. M., Price, D. J. Exuberance in the development of cortical networks. Nature Reviews Neuroscience. 6 (12), 955-965 (2005).
- Tang, X., Jaenisch, R., Sur, M. The role of GABAergic signalling in neurodevelopmental disorders. Nature Reviews Neuroscience. 22 (5), 290-307 (2021).
- Kepecs, A., Fishell, G. Interneuron cell types are fit to function. Nature. 505 (7483), 318-326 (2014).
- DeFelipe, J., Alonso-Nanclares, L., Arellano, J. I. Microstructure of the neocortex: Comparative aspects. Journal of Neurocytology. 31 (3-5), 299-316 (2002).
- Radonjić, N. V., et al. Diversity of cortical interneurons in primates: The role of the dorsal proliferative niche. Cell Reports. 9 (6), 2139-2151 (2014).
- Turner, D. A., Shetty, A. K. Clinical prospects for neural grafting therapy for hippocampal lesions and epilepsy. Neurosurgery. 52 (3), 632-644 (2003).
- Gonzalez-Ramos, A., et al. Human stem cell-derived GABAergic neurons functionally integrate into human neuronal networks. Scientific Reports. 11, 22050(2021).
- Yang, N., et al. Generation of pure GABAergic neurons by transcription factor programming. Nature Methods. 14 (6), 621-628 (2017).
- Nicholas, C. R., et al. Functional maturation of hPSC-derived forebrain interneurons requires an extended timeline and mimics human neural development. Cell Stem Cell. 12 (5), 573-586 (2013).
- Yuan, F., et al. Induction of human somatostatin and parvalbumin neurons by expressing a single transcription factor LIM homeobox 6. eLife. 7, 37382(2018).
- Fandel, T. M., et al. Transplanted human stem cell-derived interneuron precursors mitigate mouse bladder dysfunction and central neuropathic pain after spinal cord injury. Cell Stem Cell. 19 (4), 544-557 (2016).
- Noakes, Z., et al. Human pluripotent stem cell-derived striatal interneurons: Differentiation and maturation in vitro and in the rat brain. Stem Cell Reports. 12 (2), 191-200 (2019).
- Parikshak, N. N., Gandal, M. J., Geschwind, D. H. Systems biology and gene networks in neurodevelopmental and neurodegenerative disorders. Nature Reviews Genetics. 16 (8), 441-458 (2015).
- Marín, O. Interneuron dysfunction in psychiatric disorders. Nature Reviews Neuroscience. 13 (2), 107-120 (2012).
- Sloan, D. J., Wood, M. J., Charlton, H. M. The immune response to intracerebral neural grafts. Trends in Neurosciences. 14 (8), 341-346 (1991).
- Diehl, R., et al. Immunosuppression for in vivo research: State-of-the-art protocols and experimental approaches. Cellular & Molecular Immunology. 14 (2), 146-179 (2017).
- Osman, M. M., et al. Cyclosporine-A as a neuroprotective agent against stroke: Its translation from laboratory research to clinical application. Neuropeptides. 45 (6), 359-368 (2011).
- Quinnies, K. M., Cox, K. H., Rissman, E. F. Immune deficiency influences juvenile social behavior and maternal behavior. Behavioral Neuroscience. 129 (3), 331-338 (2015).
- Fernandes, D. J., et al. Mouse models of immune dysfunction: their neuroanatomical differences reflect their anxiety-behavioural phenotype. Molecular Psychiatry. 27 (7), 3047-3055 (2022).
- Lund, R. D., Rao, K., Hankin, M. H., Kunz, H. W., Gill, T. J. Transplantation of retina and visual cortex to rat brains of different ages. Maturation, connection patterns, and immunological consequences. Annals of the New York Academy of Sciences. 495, 227-241 (1987).
- Olsson, M., Bentlage, C., Wictorin, K., Campbell, K., Björklund, A. Extensive migration and target innervation by striatal precursors after grafting into the neonatal striatum. Neuroscience. 79 (1), 57-78 (1997).
- Mattis, V. B., et al. Neonatal immune-tolerance in mice does not prevent xenograft rejection. Experimental Neurology. 254, 90-98 (2014).
- Nato, G., et al. Immune-tolerance to human iPS-derived neural progenitors xenografted into the immature cerebellum is overridden by species-specific differences in differentiation timing. Scientific Reports. 11, 651(2021).
- Allison, T., et al. Defining the nature of human pluripotent stem cell-derived interneurons via single-cell analysis. Stem Cell Reports. 16 (10), 2548-2564 (2021).
- Waloschková, E., et al. Human stem cell-derived GABAergic interneurons establish efferent synapses onto host neurons in rat epileptic hippocampus and inhibit spontaneous recurrent seizures. International Journal of Molecular Sciences. 22 (24), 13243(2021).
- Gonzalez Ramos, A. Enhancing neuronal inhibition by cell and gene therapy as a novel treatment for epilepsy. , Lund University, Faculty of Medicine. PhD thesis (2022).
- Paterno, R., et al. Hippocampal gamma and sharp-wave ripple oscillations are altered in a Cntnap2 mouse model of autism spectrum disorder. Cell Reports. 37 (6), 109970(2021).
- Penagarikano, O., et al. Absence of CNTNAP2 leads to epilepsy, neuronal migration abnormalities, and core autism-related deficits. Cell. 147 (1), 235-246 (2011).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Angeletti, B., et al. An in vivo doxycycline-controlled expression system for functional studies of the retina. Investigative Ophthalmology & Visual Science. 44 (2), 755-760 (2003).
- Doxycycline. Drugs and Lactation Database (LactMed). , National Library of Medicine. Bethesda, MD. Available from: https://www.ncbi.nlm.nih.gov/books/NBK500561 (2021).
- Barker, R. A., Widner, H. Immune problems in central nervous system cell therapy. NeuroRX. 1 (4), 472-481 (2004).
- Hoornaert, C. J., et al. Concise review: Innate and adaptive immune recognition of allogeneic and xenogeneic cell transplants in the central nervous system. Stem Cells Translational Medicine. 6 (5), 1434-1441 (2017).
- Englund, U., Fricker-Gates, R. A., Lundberg, C., Bjorklund, A., Wictorin, K. Transplantation of human neural progenitor cells into the neonatal rat brain: Extensive migration and differentiation with long-distance axonal projections. Experimental Neurology. 173 (1), 1-21 (2002).
- Fainstein, N., Ben-Hur, T. Brain region-dependent rejection of neural precursor cell transplants. Frontiers in Molecular Neuroscience. 11, 136(2018).
- Denham, M., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Frontiers in Cellular Neuroscience. 6, 11(2012).
- Miguez, A., et al. In vivo progressive degeneration of Huntington's disease patient-derived neurons reveals human-specific pathological phenotypes. bioRxiv. , (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved