Method Article
Trapianto di neuroni GABAergici derivati da cellule staminali umane nell'ippocampo di topo postnatale precoce per mitigare i disturbi dello sviluppo neurologico
In questo articolo
Riepilogo
Il trapianto di neuroni GABAergici derivati da cellule staminali pluripotenti umane generati dalla programmazione neuronale potrebbe essere un potenziale approccio terapeutico per i disturbi dello sviluppo neurologico. Questo protocollo descrive la generazione e il trapianto di precursori neuronali GABAergici derivati da cellule staminali umane nel cervello di topi neonatali, consentendo l'indagine a lungo termine dei neuroni innestati e la valutazione del loro potenziale terapeutico.
Abstract
Un numero ridotto o una disfunzione degli interneuroni inibitori è un contributo comune ai disturbi dello sviluppo neurologico. Pertanto, la terapia cellulare che utilizza interneuroni per sostituire o mitigare gli effetti dei circuiti neuronali alterati è una strada terapeutica attraente. A tal fine, sono necessarie ulteriori conoscenze su come le cellule interneuronali GABAergiche derivate da cellule staminali umane (hdIN) maturano, si integrano e funzionano nel tempo nei circuiti ospiti. Di particolare importanza nei disturbi dello sviluppo neurologico è una migliore comprensione se questi processi nelle cellule trapiantate sono influenzati da un cervello ospite in evoluzione e maturazione. Il presente protocollo descrive una generazione rapida e altamente efficiente di hdINs da cellule staminali embrionali umane basate sull'espressione transgenica dei fattori di trascrizione Ascl1 e Dlx2. Questi precursori neuronali vengono trapiantati unilateralmente, dopo 7 giorni in vitro, nell'ippocampo di topi neonatali di 2 giorni. I neuroni trapiantati si disperdono nell'ippocampo ipsi e controlaterale di un modello murino di sindrome epilettica displasia corticale focale e sopravvivono fino a 9 mesi dopo il trapianto. Questo approccio consente di studiare l'identità cellulare, l'integrazione, la funzionalità e il potenziale terapeutico degli interneuroni trapiantati per un tempo prolungato nello sviluppo di cervelli sani e malati.
Introduzione
L'istituzione, la maturazione e il perfezionamento delle reti neuronali si verificano durante il periodo perinatale e postnatale precoce e rappresentano una finestra temporale cruciale per lo sviluppo del cervello1. Da un'esuberanza post-parto di connettività, il cervello si evolve in una messa a punto delle connessioni che si estendono fino all'adolescenza2. Di conseguenza, le alterazioni nei geni espressi durante questi periodi, così come fattori esterni o insulti, definiscono la predisposizione di un individuo a molteplici disturbi dello sviluppo neurologico. Le menomazioni nella cognizione e nella funzione motoria si sviluppano nel tempo e i trattamenti farmacologici sono limitati, la maggior parte dei quali mira ai sintomi con il rischio di gravi effetti collaterali.
La disfunzione nell'inibizione dell'acido gamma-aminobutirrico (GABA) ergica ha dimostrato di essere un importante contributo alla causa sottostante di vari disturbi dello sviluppo neurologico3, come la sindrome dell'X fragile, la sindrome di Angelman, l'epilessia, la schizofrenia e l'autismo. Il GABA è il principale trasmettitore inibitorio del sistema nervoso centrale ed è strumentale per il mantenimento dell'equilibrio eccitatorio / inibitorio (E / I), la sincronizzazione del fuoco neuronale e il calcolo. Gli interneuroni GABAergici sono una popolazione eterogenea di neuroni, con complessità funzionale crescente nelle regioni cerebrali più complesse4 e con evoluzione 5,6. Considerando la limitata capacità rigenerativa endogena del cervello umano e l'implicazione della disfunzione degli interneuroni in diversi disturbi neurologici, il trapianto di interneuroni GABAergici può essere una strada terapeutica promettente da esplorare. Lungo questa linea, le cellule interneuronali interneuronali GABAergiche derivate da cellule staminali umane (hdIN) sembrano essere la fonte più traslazionale e praticabile per questo scopo rispetto ai precursori neuronali allogenici dei roditori o ad altre fonti utilizzate altrove7. Sono disponibili protocolli per la generazione di neuroni GABAergici da diverse fonti cellulari 8,9,10,11,12,13, ma sono necessarie ulteriori conoscenze su come le hdIN maturano, si integrano e funzionano nel tempo in un cervello patologico in via di sviluppo. Diversi studi hanno identificato alterazioni nei geni attivi durante il pattern corticale, stabilendo la connettività neuronale14 e sintonizzando l'equilibrio E/I fisiologico15. Il trapianto neonatale di hdIN in modelli murini con corrispondenti perturbazioni genetiche ci permette di seguire l'interazione tra ospite e trapianto, che è la conoscenza necessaria per determinare potenziali strategie terapeutiche.
L'immunomodulazione è comunemente e con successo utilizzata nei trapianti di xenotrapianto per evitare di innescare una risposta immunitaria dell'ospite e il rigetto16. Tuttavia, la somministrazione di farmaci immunosoppressori, come la ciclosporina A, causa tossicità renale dopo somministrazione cronica, è laboriosa a causa della necessità di iniezioni intraperitoneali giornaliere per raggiungere concentrazioni sistemiche stabili, causando stress animale17 e ha effetti fuori bersaglio che possono interagire con la patologia18. Inoltre, compromettendo il sistema immunitario ha dimostrato di modificare i fenotipi comportamentali19, con alterazioni nelle corrispondenti regioni neuroanatomiche20. Il trapianto nella prima settimana di vita ha dimostrato di consentire l'adattamento alle cellule trapiantate 21,22, mentre altri hanno riportato una sopravvivenza iniziale seguita dal rigetto degli innesti entro il primo mese postnatale 23,24.
Questo protocollo descrive le procedure dalla generazione di hdIN al trapianto di cellule in topi neonatali con conseguente sopravvivenza a lungo termine del trapianto e consentendo lo studio della specificità neuronale, dell'integrazione sinaptica, della funzione e del potenziale terapeutico degli interneuroni umani trapiantati durante lo sviluppo fisiologico e patologico.
Protocollo
Tutte le procedure sperimentali sono state approvate dal Malmö/Lund Animal Research Ethics Board, permesso etico numero 12548-19, e condotte in accordo con i regolamenti dell'Agenzia svedese per il benessere degli animali e la direttiva UE 2010/63 / UE per gli esperimenti sugli animali. C57BL6/J e topi knock-out (KO) simili alla proteina 2 (Cntnap2) associati alla contattona, sia maschi che femmine, sono stati utilizzati al giorno postnatale (P) 2 per il presente studio. Sono state utilizzate cellule staminali embrionali umane (hESC). Gli animali e le cellule staminali sono stati ottenuti da fonti commerciali (vedi Tabella dei materiali).
1. Generazione dei precursori hdIN
NOTA: tutti i passaggi descritti in questa sezione vengono eseguiti in una cappa di coltura cellulare. Le hESC sono state mantenute come cellule prive di alimentatori su piastre rivestite utilizzando un terreno di coltura di cellule staminali e fatte passare come colonie.
- Eseguire la programmazione in avanti delle hESC ai precursori hdIN (Figura 1).
NOTA: L'approccio di programmazione in avanti si basa sulla procedura descritta in Gonzalez-Ramos et al.8 e Yang et al.9.- Trasdurre le hESCs con vettori lentivirali contenenti il sistema Tet-On in un terreno di coltura di cellule staminali fresche contenente 10 μM di inibitore ROCK (RI) (vedi Tabella dei materiali). Conservare a 37 °C nell'incubatore.
- Cambiare il terreno in un terreno di coltura di cellule staminali fresche 16 ore dopo la trasduzione e mantenere le cellule trasdotte allo stesso modo delle hESC non trasdotte.
- Quando sono confluenti, staccare le hESC come singole cellule usando una soluzione di distacco cellulare (vedere Tabella dei materiali) e placcarle in piastre rivestite a 6 pozzetti ad una densità di 3 x 105 cellule/pozzetto in terreno di coltura di cellule staminali contenente 10 μM di RI al giorno in vitro (DIV) -1.
- A 1 DIV, sostituire il terreno di coltura con terreno N2 contenente 2 g/L di doxiciclina (DOX, vedi Tabella dei materiali).
NOTA: DOX è usato per indurre l'espressione transgenica di Ascl1 e Dlx29, da 1 DIV a 7 DIV, e quindi continua in vivo con la sua aggiunta all'acqua potabile25. - A 2 DIV, inizia un periodo di selezione della resistenza agli antibiotici che durerà fino a 5 DIV. Aggiungere puromicina (puro) e igromicina (igro) al terreno fresco (vedi Tabella dei materiali). Cambia il supporto su 2 DIV, 4 DIV e 5 DIV.
NOTA: Ottimizzare le concentrazioni di puro e igro prima del protocollo di differenziazione utilizzando hESC trasdotte e non trasdotte per garantire la sopravvivenza delle sole cellule trasportatrici delle cassette di resistenza agli antibiotici. In questo protocollo sono stati utilizzati 0,5 μg/mL di puro e 750 μg/mL di igro. - A 5 DIV, termina il periodo di selezione degli antibiotici. Passaggio al terreno N2 integrato con 2 g/L di DOX e 4 μM di citosina β-D-arabinofuranoside (Ara-C, vedere Tabella dei materiali).
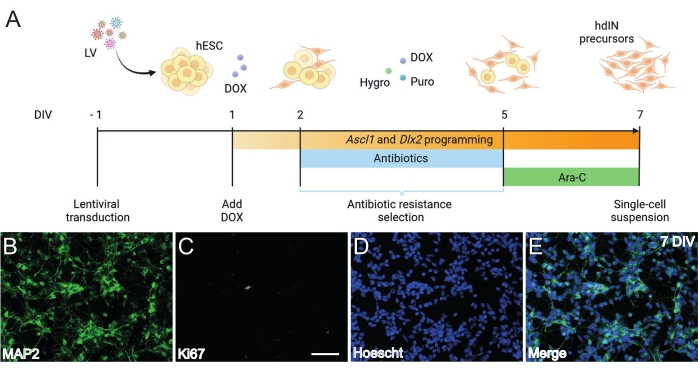
Figura 1: Generazione di precursori hdIN da hESC sovraesprimendo Ascl1 e Dlx2. (A) Schemi del protocollo di differenziazione utilizzato per la generazione di precursori hdIN. (B-E) Immunocitochimica dei precursori di hdIN a 7 DIV per (B) il marcatore neuronale MAP2, (C) il marcatore proliferativo Ki67, (D) colorazione nucleare generale e (E) una fusione dei marcatori precedenti. Barra scala: 50 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Preparazione della sospensione unicellulare per il trapianto
NOTA: tutti i passaggi descritti in questa sezione vengono eseguiti nella cappa della coltura cellulare. Su 7 DIV, i precursori hdIN sono dissociati e utilizzati per il trapianto.
- Eseguire il distacco delle celle seguendo i passaggi seguenti.
- Rimuovere il mezzo e risciacquare accuratamente le cellule con DPBS senza calcio e magnesio.
- Aggiungere 400 μL della soluzione di distacco della cella (vedere Tabella dei materiali) a ciascun pozzetto della piastra a 6 pozzetti.
NOTA: Assicurarsi della copertura dell'intera superficie da parte della soluzione. - Incubare per 2-3 minuti a 37 °C nell'incubatore fino a quando il bordo delle cellule inizia a sembrare lucido, indicando la degradazione enzimatica delle proteine della superficie cellulare e il distacco dalla superficie del pozzo.
NOTA: Per aumentare la sopravvivenza cellulare, non aspettare troppo a lungo quando tutte le cellule sono completamente staccate e fluttuanti. - Quindi, aggiungere 600 μL di terreno N2 fresco a ciascun pozzetto della piastra a 6 pozzetti per fermare l'enzima e, meccanicamente con la pipetta, aiutare a staccare le cellule per ottenere una sospensione a cella singola.
- Trasferire la sospensione cellulare in un tubo di plastica (15 ml) e centrifugare a 180 x g per 4 minuti a temperatura ambiente (RT).
- Eseguire la risospensione delle cellule.
- Scartare il surnatante usando un sistema a vuoto (con attenzione, senza disturbare il pellet) e risospendere il pellet nel mezzo di trapianto contenente 10 μM di RI, 1 μg/mL di DNasi e 2 μg/μL di DOX.
- Contare le celle totali nella sospensione utilizzando una camera di conteggio e un contatore di celle manuale e regolare il volume a una concentrazione finale di 100.000 cellule / μL.
- Tenere la sospensione cellulare in un tubo chiuso su ghiaccio fino al trapianto per un massimo di 4 ore.
NOTA: Il trapianto deve essere eseguito lo stesso giorno della preparazione della sospensione cellulare (7 DIV).
3. Trapianto di cellule intraippocampali
NOTA: Tutte le fasi di questa sezione vengono eseguite al di fuori della cappa di coltura cellulare nella struttura per animali. Il trapianto postnatale precoce di cellule nel cervello è stato eseguito su P2, considerando P0 il giorno della nascita.
- Preparati per l'esperimento di trapianto seguendo i passaggi seguenti.
- Autoclavare tutto il materiale chirurgico o, se non possibile, sterilizzare con un altro metodo approvato.
- Montare la siringa iniettiva nel supporto senza alcun capillare di vetro. Risciacquare l'ago con acqua.
NOTA: L'ago deve essere di 33 G. - Curvare di 90° la punta di un ago da insulina da 30 G.
- Crea un palcoscenico simile a Play-Doh fatto in casa per posizionare il cucciolo con la testa piatta (Figura 2A).
- Prendi la gabbia dei topi con la madre e i cuccioli prima di preparare qualsiasi cosa per l'intervento chirurgico per consentire loro di acclimatarsi al nuovo ambiente.
- Preparare un vassoio con ghiaccio bagnato e una gabbia vuota con un po 'di carta per l'isoflurano.
- Anestetizzare il cucciolo di topo.
- Immergere un pezzo di carta con isoflurano (vedi Tabella dei materiali) e metterlo all'interno della gabbia vuota. Prendi con attenzione un cucciolo e mettilo nella gabbia con la carta imbevuta di isoflurano.
NOTA: Non lasciare mai meno di tre cuccioli con la mamma. Non superare i 20-30 s di anestesia isoflurano, o il cucciolo potrebbe morire. - Verificare l'effetto dell'anestesia mediante cessazione del movimento.
- Immediatamente dopo l'anestesia, posizionare il cucciolo su un tessuto bagnato sulla superficie del ghiaccio bagnato. Tenere l'animale sul ghiaccio per 3 minuti fino a quando gli arti superiori diventano biancastri (Figura 2B, freccia blu). Questo di solito richiede 2-3 minuti.
- Utilizzare questo tempo per caricare la siringa con la sospensione cellulare. Risospendere le celle con attenzione con una pipetta prima.
- Posiziona il cucciolo sul telaio stereotassico. Utilizzare le barre auricolari nella direzione opposta (Figura 2A, frecce magenta).
NOTA: Il lato posteriore delle barre auricolari è meno appuntito e, poiché i cuccioli P2 non hanno orecchie, utilizzare il lato più piatto per evitare di ferire l'animale. - Dal lato, controlla se la testa è dritta. La testa deve essere piatta; usa il palcoscenico simile a Play-Doh per adattarti a questo.
NOTA: I cuccioli a questa età non hanno ancora aperto gli occhi, quindi non è necessario fare alcun ulteriore passo in questo senso. I cuccioli non hanno pelliccia a questa età, quindi non è richiesta la rasatura dell'area. Non viene somministrato alcun trattamento specifico del dolore in quanto non è un'incisione aperta sulla pelle e non è coinvolta alcuna sutura. - Tenere il cucciolo coperto di ghiaccio (sopra la carta velina) per tutta la durata dell'intervento.
NOTA: Non mettere il ghiaccio a diretto contatto con la pelle del cucciolo.
- Immergere un pezzo di carta con isoflurano (vedi Tabella dei materiali) e metterlo all'interno della gabbia vuota. Prendi con attenzione un cucciolo e mettilo nella gabbia con la carta imbevuta di isoflurano.
- Eseguire l'iniezione.
- Pulire la superficie della pelle utilizzando un tessuto molle imbevuto di etanolo.
- Identificare lambda e impostare le coordinate su zero sulla console di visualizzazione digitale dello strumento stereotassico (Figura 2C, linea tratteggiata gialla). Le suture sagittali e lambdoidi sono facilmente visibili dall'occhio, poiché sono vascolarizzate, come linee rosse.
NOTA: se hai difficoltà a visualizzare lambda, posiziona un piccolo pezzo di ghiaccio sulla pelle e attendi un paio di minuti affinché si raffreddi. Quindi, rimuovi il pezzo di ghiaccio e il sottile sbiancamento della pelle ti permetterà di visualizzare. - Riposizionare l'ago per iniezione sulle coordinate desiderate. Nel protocollo descritto, la regione mirata era l'ippocampo e le coordinate erano le seguenti: antero-posteriore (AP) +0,85 e medio-laterale (ML) +1,35.
- Utilizzare un ago da insulina piegato a 90° per penetrare nel cranio e creare un piccolo foro.
- Abbassare l'ago per iniezione fino a quando non ha attraversato il cranio e azzerare le coordinate dorso-ventrali (DV). Abbassare l'ago fino a quando non si ottengono le coordinate DV desiderate. Nel protocollo descritto, le coordinate erano DV −1.1.
- Iniettare secondo gli intervalli di tempo predeterminati.
NOTA: Nel protocollo descritto, i tempi esatti erano i seguenti: (i) dopo essere scesi alla coordinata DV, attendere 3 minuti, (ii) iniettare 1 μL di volume per 5 minuti e (iii) dopo che tutto il volume è stato iniettato, attendere 3 minuti. - Ritrarre lentamente l'ago.
- Terminare la procedura.
NOTA: L'intervento non può durare più di 15 minuti per garantire la sopravvivenza del cucciolo ed evitare qualsiasi danno derivato dall'anestesia da ipotermia.- Riscalda il cucciolo con le mani fino a quando non inizia a muoversi prima di restituirlo alla madre.
- Somministrare DOX ad una concentrazione di 1 mg/ml in soluzione di saccarosio allo 0,5% come acqua potabile per almeno 2 giorni prima e 3 settimane dopo il trapianto (PT) per continuare la differenziazione cellulare in vivo.
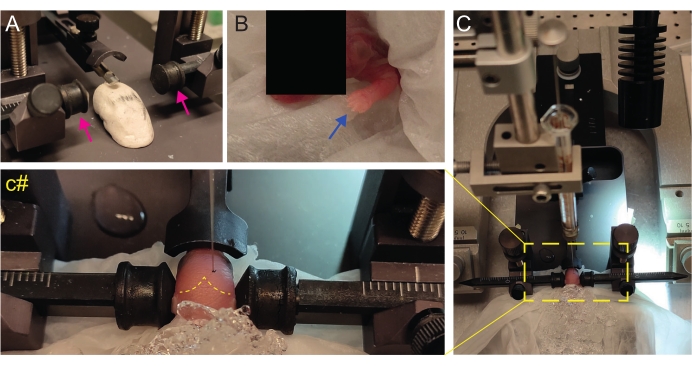
Figura 2: Trapianto stereotassico in cuccioli di topi appena nati a P2. (A) Uno stadio simile a Play-Doh per tenere il corpo del cucciolo in posizione e barre auricolari invertite (frecce magenta). (B) Zampa anteriore bianca (freccia blu) indicativa della riduzione del flusso sanguigno in quella zona in modo che il cucciolo stia vivendo l'anestesia per ipotermia. (C) Panoramica della configurazione con il cucciolo già coperto di ghiaccio sopra la carta dei tessuti molli. (C#) Zoom chiuso della testa del cucciolo, con l'ago per iniezione già inserito nel cervello (linea tratteggiata gialla che indica suture lambda e lambdoidi). Questa figura è adattata da Gonzalez Ramos et al. 27. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati
Seguendo il protocollo qui presentato e illustrato in Figura 1A, i precursori dell'hdIN non erano ancora proliferativi a 7 DIV come definito da (i) immunoreattività negativa per il marcatore del ciclo cellulare Ki67 e (ii) espressione di marcatori neuronali come la proteina 2 associata ai microtubuli (MAP2) (Figura 1B-E). Questa caratterizzazione è stata eseguita su cellule residue riplaccate per 24 ore dopo aver subito tutte le fasi della procedura. Inoltre, l'analisi dell'espressione genica pubblicata in precedenza ha indicato che una rapida transizione dallo stato pluripotente a un fenotipo neuronale si verifica intorno a 4 DIV e 7 DIV8. Nel complesso, questi risultati hanno confermato la presenza di cellule postmitotiche e l'assenza di rischio per la formazione di teratomi.
Successivamente, la sopravvivenza dei precursori hdIN dopo trapianto postnatale precoce nell'ippocampo di topi wild-type (WT) è stata testata mediante immunoistochimica contro il marcatore citoplasmatico umano STEM121. I precursori dell'hdIN sono stati trapiantati nell'ippocampo dorsale destro di topi immunocompetenti naïve a P2, che sono stati poi sacrificati a P14 e 2 mesi PT. Le cellule innestate sono state trovate in tutto l'ippocampo dorsale, così come disperse attraverso il corpo calloso e l'ippocampo controlaterale, in entrambi i punti temporali. Inoltre, in entrambi i punti temporali, gli hdIN innestati esprimevano Ascl1, uno dei fattori di trascrizione dell'induzione (Figura supplementare 1), e non erano proliferativi, come indicato dall'assenza di espressione di Ki67 (Figura supplementare 2).
È importante sottolineare che nessuna reazione immunitaria o infiammazione locale contro le cellule trapiantate è stata trovata a P14 o 2 mesi PT, come valutato dall'assenza di microglia reattiva identificata utilizzando Iba1, CD68 e galectina-3 (Gal3) (Figura 3), l'estensione dell'astrogliosi determinata dalla proteina acida fibrillare gliale (GFAP) e citochine infiammatorie come l'interleuchina-1 (IL-1), e l'assenza di linfociti T citotossici (CD8) (Figura 4).
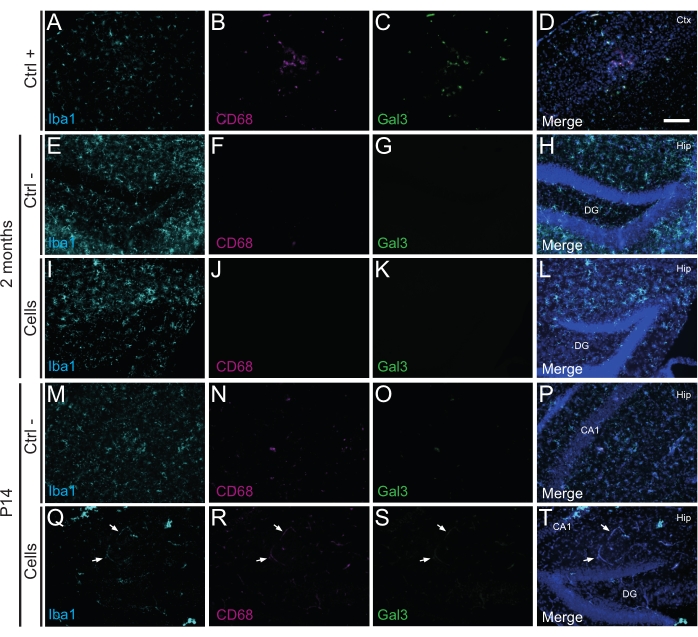
Figura 3: hdIN a P14 e 2 mesi PT nell'ippocampo di topi WT neonati senza innescare il rigetto immunitario dal tessuto ospite. Immunofluorescenza per i marcatori Iba1, CD68 e Gal3 nel tessuto cerebrale da (A-D) la vicinanza di un'area del nucleo ischemico in un modello murino di ictus elettrocoagulante (controllo positivo, Ctrl +), (E-H) animali di controllo negativo (Ctrl-) a 2 mesi e (M-P) P14, e (I-L) animali che hanno subito trapianto di cellule a 2 mesi e (Q-T ) P14. Le frecce bianche indicano alcuni esempi di vasi sanguigni visibili a tutti i canali a causa dell'autofluorescenza. Abbreviazioni: Ctx = corteccia; Anca = ippocampo; DG = giro dentato; CA1 = cornu ammonis 1. Barra scala: 50 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
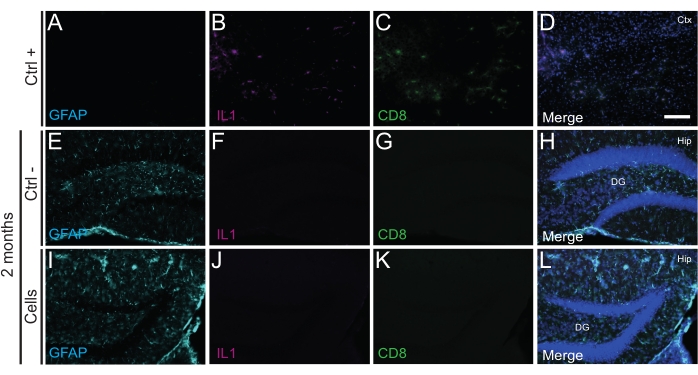
Figura 4: hdIN a 2 mesi PT nell'ippocampo di topi WT neonati senza innescare il rigetto immunitario dal tessuto ospite. Immunofluorescenza per i marcatori IL1, GFAP e CD8 nel tessuto cerebrale da (A-D) la vicinanza di un'area del nucleo ischemico in un modello murino di ictus elettrocoagulante (controllo positivo, Ctrl +), (E-H) animali di controllo negativo (Ctrl-) a 2 mesi e (I-L) animali che hanno subito trapianto di cellule a 2 mesi. Abbreviazioni: Ctx = corteccia; Anca = ippocampo; DG = giro dentato. Barra scala: 50 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Allo stesso modo, i precursori dell'hdIN sono stati trapiantati anche nell'ippocampo dei topi Cntnap2 KO, un modello per il disturbo dello spettro autistico e la sindrome epilettica focale da displasia corticale. Nei topi Cntnap2 KO, infatti, le hdIN sono sopravvissute fino a 9 mesi PT e sono state localizzate nel sito di iniezione, sebbene fossero anche disperse attraverso l'ippocampo omolaterale e persino controlaterale come osservato nei topi WT (Figura 5). Inoltre, la maggior parte delle hdIN innestate erano immunoreattive per i marcatori interneuronali, come previsto dai risultati precedenti in vitro 8,26 e nei roditori adulti in vivo25.
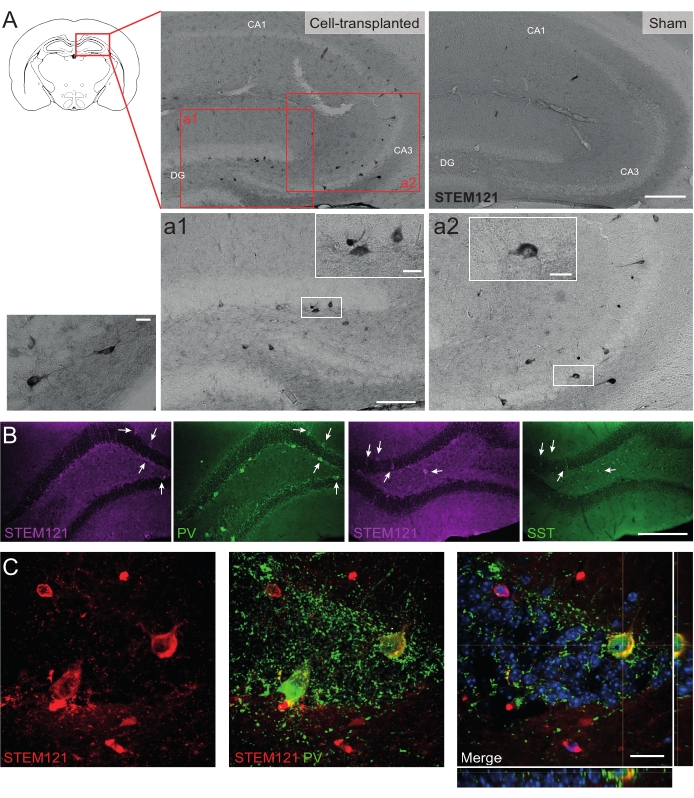
Figura 5: HDIN innestati nell'ippocampo di topi Cntnap2 KO a 9 mesi PT. (A) Immunochimica contro il marcatore citoplasmatico umano STEM121 in topi trapiantati (a sinistra) e sham (a destra). (A1 e A2) Immagini ingrandite di cellule positive STEM121. (B) Immunofluorescenza per STEM121 (magenta) e i marcatori interneuronali parvalbumina (PV) e somatostatina (SST). Le frecce bianche indicano doppie cellule positive per STEM121 e il rispettivo marcatore interneurone. (C) Vista ortogonale di un immunoreattivo hdIN innestato per STEM121 e PV. Barra della scala: 200 μm (A e B), 100 μm (a1 e a2), 20 μm (piccolo ingrandimento quadrato in a1 e a2 e C). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Figura supplementare 1: HDIN innestati a 2 mesi PT nell'ippocampo di topi WT neonati che esprimono Ascl1. Immunofluorescenza contro Ascl1 e il marcatore citoplasmatico umano STEM121 a livello di (A) CA3 e (B) DG in topi WT trapiantati da cellule. (a) Immagine ingrandita di una cellula positiva STEM121. Le frecce bianche indicano celle a doppio positivo per STEM121 e Ascl1. Barra scala: 100 μm. Clicca qui per scaricare questo file.
Figura supplementare 2: HDIN innestati post-mitotici a 2 mesi PT nell'ippocampo di topi WT appena nati. Immunofluorescenza contro il marcatore proliferativo Ki67 e il marcatore citoplasmatico umano STEM121 in topi WT (A) naïve e (B) trapiantati su cellule. (b) Immagine ingrandita di una cellula positiva STEM121. La freccia gialla indica una cella positiva per Ki67 e negativa per STEM121. La freccia bianca indica le celle positive per STEM121 e negative per Ki67. L'asterisco bianco indica un ventricolo laterale. Barra scala: 100 μm. Clicca qui per scaricare questo file.
Discussione
Il presente protocollo descrive una metodologia robusta, veloce, semplice e ampiamente accessibile per generare precursori dell'hdIN in vitro e il suo uso come terapia cellulare interventistica precoce in modelli preclinici di disturbi dello sviluppo neurologico.
Anche se alcuni dei fenotipi caratteristici dei disturbi dello sviluppo neurologico insorgono durante l'adolescenza o l'età adulta, le alterazioni fisiopatologiche sono già presenti durante lo sviluppo precoce. Per questo motivo, l'intervento precoce sarebbe altamente giustificato per ottenere effetti benefici agendo in periodi critici di sviluppo cerebrale prima della sintomatologia o della manifestazione clinica. In futuro, lo screening genetico e lo sviluppo di biomarcatori consentiranno un trattamento profilattico o pre-sintomatico, rappresentando un punto di svolta per quei pazienti. Pertanto, i precursori dell'hdIN sono stati trapiantati subito dopo la nascita nel modello murino Cntnap2 KO quando i cambiamenti epilettogeni nella rete neuronale potrebbero essere in corso28 e in un momento in cui sono state descritte alterazioni cellulari in questo modello animale29. È importante, tuttavia, considerare le potenziali insidie dell'estrapolazione dell'età e la tempistica di alcuni processi nel topo rispetto al cervello umano.
Concentrandosi sulla procedura stessa, il protocollo di differenziazione qui presentato si basa sull'uso di fattori di trascrizione, che consentono una programmazione rapida e altamente efficiente delle cellule staminali rispetto ad altri protocolli basati altrove su piccole molecole10,30. Un potenziale svantaggio di questo approccio potrebbe essere la necessità di vettori lentivirali, che comporta un rischio di mutagenesi inserzionale. Due passaggi critici nel protocollo sono l'aggiunta degli antibiotici e dell'agente antimitotico al mezzo per selezionare le cellule che esprimono i fattori di trascrizione ed eliminare le cellule proliferative, evitando rispettivamente il rischio di formazione di teratomi. Sebbene solo i precursori dell'hdIN siano stati testati in questo studio, la procedura dovrebbe essere fattibile con altre fonti cellulari e protocolli di programmazione/differenziazione. Tuttavia, altri sottotipi e/o modelli neuronali dovrebbero essere convalidati.
L'età del precursore hdIN per il trapianto, 7 DIV, è stata decisa sulla base (i) dell'assenza di cellule proliferative, valutata mediante immunoreattività contro Ki67, (ii) insieme all'osservazione precedentemente riportata di diminuzioni nell'espressione di geni di pluripotenza come POU5F1 e la comparsa del marcatore neuronale MAP2 e del marcatore interneuronale GAD1 in quel puntotemporale 8 . Tuttavia, il lavoro originale che descrive questo protocollo ha eseguito trapianti a 14 DIV dopo il ritiro DOX9. Ciò solleva domande sul fatto che DOX nell'acqua potabile della madre possa raggiungere le cellule innestate nel cervello dei cuccioli che allattano attraverso il latte, o se 7 DIV di induzione DOX siano sufficienti per stabilire il destino GABAergico. Sebbene Yang et al. abbiano identificato 14 giorni di DOX come sufficienti per generare cellule neuronali stabili in vitro9, Gonzalez-Ramos et al.8 hanno rilevato l'espressione del gene GAD1 già a 7 DIV, indicando che l'attivazione a valle di GAD67 da parte di Ascl1 e Dlx2 si è già verificata in questo momento. Quindi, il pattern è iniziato a 7 DIV e potrebbe essere meno dipendente dal trattamento DOX. Inoltre, l'evidenza nei roditori e nell'uomo indica la presenza di DOX nel latte materno 31,32, e i risultati qui presentati mostrano che le hdIN innestate erano immunoreattive perAscl1 a 2 settimane e 2 mesi PT e marcatori interneuronali più tardi a 9 mesi PT. All'interno della popolazione trapiantata, oltre ai neuroni positivi al PV e all'SST, sono stati trovati anche altri marcatori per sottopopolazioni di interneuroni in quantità inferiori, come la calretinina (CR) e la calbindina (CB).
Un aspetto impegnativo di questa procedura è il coordinamento dei tempi sia per la differenziazione che per l'età dei cuccioli. Di solito, la gestazione del topo richiede 21 giorni dopo aver installato la gabbia di accoppiamento, anche se questo può variare a volte. Questo scenario non si verifica quando si eseguono trapianti di cellule in roditori adulti quando tutto può essere attentamente pianificato e organizzato. Tuttavia, questo può essere facilmente mitigato impostando da due a tre gabbie di accoppiamento con un intervallo di 2 giorni o da due a tre lotti di differenziazione con un time-lapse di 2 giorni l'uno dall'altro.
Sebbene i topi utilizzati in questo studio non fossero né immunodeficienti né immunodepressi, le cellule trapiantate sono sopravvissute fino a 9 mesi in vivo e marcatori di reazione immunitaria contro le cellule xenogeniche o l'infiammazione locale non sono stati osservati né a P14 né a 2 mesi PT. Il rigetto immunitario delle cellule xenogeniche innestate è attivato contro MHC / peptidi e i mediatori cellulari chiave del rigetto del trapianto sono i linfociti T e le cellule microgliali33, 34. Pertanto, è stata esplorata l'immunoreattività ai marcatori delle cellule T e della microglia reattiva. Nessun segno di rigetto immunitario delle cellule innestate nel tessuto ospite è stato rilevato né dai livelli di microglia reattiva né dalla presenza di linfociti T nei topi WT a P14 o 2 mesi. Inoltre, non è stata osservata alcuna infiammazione locale sulla base dei livelli valutati di astrogliosi e citochine infiammatorie. Questo risultato potrebbe dipendere in parte dalla tolleranza immunitaria neonatale 35,36,37, osservata da altre identità cellulari, posizioni e modelli animali35,38. Englund et al. hanno identificato differenze regionali nell'esito delle cellule innestate in termini di migrazione e maturazione, compresa l'osservazione di cellule innestate nella sostanza bianca adiacente35.
Infine, è stata osservata una maggiore dispersione delle cellule innestate all'interno dell'ippocampo rispetto ad altri studi trapiantati in roditori adulti, dove gli hdIN sono rimasti come nucleo innestato25. Questa dispersione differiva anche dai risultati osservati in precedenza da Yang et al.9, che potrebbero essere spiegati in questo caso dall'età delle cellule al momento del trapianto.
Divulgazioni
Gli autori non dichiarano interessi concorrenti.
Riconoscimenti
Questo progetto è stato finanziato dal Consiglio svedese della ricerca (numero di sovvenzione: 2016-02605, M.A.), dalla Swedish Brain Foundation F02021-0369 (M.A.), dalla Fondazione Crafoord (M.A.) e dal programma Horizon 2020 dell'Unione europea (H2020-MSCA-ITN-2016) nell'ambito del progetto Marie Skłodowska-Curie Innovative Training Network Training4CRM No. 722779 (M.K.). Siamo estremamente grati per l'aiuto di Andrés Miguez, del laboratorio di Josep Maria Canals (Laboratorio di cellule staminali e medicina rigenerativa, Università di Barcellona), per aver insegnato il trapianto di cellule stereotassiche in topi neonati P2, e Mackenzie Howard, leader del gruppo presso l'Università del Texas ad Austin, per i consigli e le coordinate preliminari per il trapianto di cellule nell'ippocampo di topi neonati P2. Ringraziamo Susanne Geres per l'assistenza nella cura degli animali e Ling Cao per l'aiuto nella lavorazione dei tessuti, così come gli studenti che hanno contribuito in un modo o nell'altro allo studio e in particolare Diana Hatamian. Infine, alcuni dei grafici utilizzati per illustrare questo documento sono stati creati con BioRender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| 30 G needle | B Braun | 4656300 | |
| 33 G needle for Hamilton syringe | Hamilton | 7762-06 | |
| 4-well plates | Thermo Scientific | 176740 | |
| Accutase | STEMCELL Technologies | 7920 | Cell detachment solution use for splitting cells (hESC and hdIN precursors) |
| Adjustable volume pipettes 10, 20, 200, 1000 µL | |||
| Alexa Fluor Plus 488/555/647 | Thermo Fisher | 1:1000 | |
| Anti-CD68 (Rat) | Bio-Rad | MCA1957 | 1:200 |
| Anti-CD8 (Rabbit) | Abcam | 203035 | 1:200 |
| Anti-Galectin 3 (Goat) | R&D systems | AF1197 | 1:500 |
| Anti-GFAP (Guiena Pig) | Synaptic systems | 173004 | 1:500 |
| Anti-Iba1 (Rabbit) | WAKO | 19119741 | 1:500 |
| Anti-IL1 (Goat) | Santa Cruz Biotech | SC-106 | 1:400 |
| Anti-Ki67 | Abcam | ab16667 | 1:250 |
| Anti-Ki67 (Rabbit) | Novocastra | NCL-Ki67p | 1:250 |
| Anti-MAP2 (Chicken) | Abcam | ab5392 | 1:2000 |
| Anti-Mash1 (Ascl1) | Abcam | ab74065 | 1:1000 |
| Anti-Parvalbumin (Rabbit) | Swant | PV 27 | 1:5000 |
| Anti-Somatostatin (Rat) | Millipore | MAB354 | 1:150 |
| Anti-STEM121 (Mouse) | Takara Bio | Y40410 | 1:400 |
| Avidin/Biotin Blocking Kit | VECTOR Laboratories | SP-2001 | |
| B6.129(Cg)-Cntnap2tm1Pele/J | Jackson Laboratory | 17482 | Animal model |
| Biotinylated Horse anti-Mouse | VECTOR Laboratories | BA-2001 | 1:200 |
| Burker Chamber | Thermo Fisher Scientific | 10628431 | |
| C57BL/6J | Janvier Labs | Animal model | |
| Centrifuge | For 15 mL tubes | ||
| Confocal microscope | Nikon | Confocal A1RHD microscope | |
| Costar 6-well Clear TC-treated | Corning | 3516 | |
| Cy3 Streptavidin | Jackson ImmunoResearch | 016-160-084 | 1:200 |
| Cytosine β-D-arabinofuranoside (AraC) | Sigma | C1768 | 4 µM |
| DAB Substrate Kit, Peroxidase (With Nickel) | VECTOR Laboratories | SK-4100 | |
| Digital Stereotax | KOPF | Model 940 | |
| DMEM/F12 | Thermo Fisher Scientific | 11320082 | Use for the N2 medium |
| DNase I Solution | STEMCELL Technologies | 7900 | 1 µg/mL |
| Doxycyclin | Sigma-Aldrich | D9891 | 2 µg/mL |
| DPBS -/- | Gibco | 14190144 | |
| Epifluorescence microscope | Olympus | BX51 Microscope | |
| Ethanol | Solveco | 70%, 95%, 99.8% | |
| FUW-rTA | Addgene | 20342 | Lentiviral vector |
| FUW-TetO-Ascl1-T2A-puromycin | Addgene | 97329 | Lentiviral vector |
| FUW-TetO-Dlx2-IRES-hygromycin | Addgene | 97330 | Lentiviral vector |
| H1 (WA01) ESC | WiCell | WA01 | Human embryonic stem cell line under a MTA agreement |
| H2O2 | Sigma-Aldrich | 18304 | |
| Hamilton Syringe | Hamilton | 7634-01 | 5 µL |
| HBSS | Gibco | 14175095 | No calcium, No magnesium - Transplantation medium |
| Hoechst 33342 | Invitrogen | H3570 | 1:1000 |
| Hygromycin B | Gibco (Invitrogen) | 10687010 | |
| Incubator | 5% CO2, 37 °C | ||
| Isoflurane Baxter | Apoteket AB | ||
| Manual cell counter | VWR | 720-1984 | |
| Matrigel hESC-Qualified Matrix, LDEV-free | Corning | 354277 | For the coating |
| Methanol | Merck Millipore | 1060091000 | |
| Microscope Coverslips 24 x 60 mm | Thermo Scientific | BBAD02400500#A113MNZ#0## | |
| Microscope Slides | VWR | 631-1551 | |
| Microscope Software | Olympus | CellSens | |
| Mounting media | Merck | 10981 | PVA-Dabco |
| Mouse adaptor to stereotax | RWD | 68030 | |
| mTeSR1 | STEMCELL Technologies | 85850 | Kit Basal Medium and 5X Supplement - Stem cell culture medium |
| N2 supplement | Gibco | 17502048 | |
| NaOH | Sigma-Aldrich | S8045 | 1M |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | |
| Pertex | HistoLab | 811 | |
| Pipet Filler | |||
| Play-Doh | |||
| Puromycin (Dihydrochloride) | Gibco | A1113803 | |
| Round cover glasses thickness No. 1.5H (tol. ± 5 μm) 13 mm Ø | Marienfeld | MARI0117530 | For immunocytochemistry |
| Serum | Thermo Fisher | Goat, Donkey, Horse | |
| Sterile pipette tips | For volumes 0.1-1000 µL | ||
| Sterile serological pipettes | 5, 10, 25 mL | ||
| Sterile water Braun | B Braun | 3626873 | |
| Sucrose | Sigma-Aldrich | S8501 | For 0.5% Sucrose solution |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Trypan Blue Solution | Gibco | 15250061 | |
| Tubes | Sarstedt | 15 ml, Eppendorf 1.5 mL | |
| Tweezer | VWR | ||
| Ultra pure water | MilliQ Water System | ||
| Xylene | VWR | 28973.363 | |
| Y-27632 (ROCK inhibitor) | STEMCELL Technologies | 72304 | 10 µM |
Riferimenti
- Kostović, I., Jovanov-Milošević, N. The development of cerebral connections during the first 20-45 weeks' gestation. Seminars in Fetal and Neonatal. 11 (6), 415-422 (2006).
- Innocenti, G. M., Price, D. J. Exuberance in the development of cortical networks. Nature Reviews Neuroscience. 6 (12), 955-965 (2005).
- Tang, X., Jaenisch, R., Sur, M. The role of GABAergic signalling in neurodevelopmental disorders. Nature Reviews Neuroscience. 22 (5), 290-307 (2021).
- Kepecs, A., Fishell, G. Interneuron cell types are fit to function. Nature. 505 (7483), 318-326 (2014).
- DeFelipe, J., Alonso-Nanclares, L., Arellano, J. I. Microstructure of the neocortex: Comparative aspects. Journal of Neurocytology. 31 (3-5), 299-316 (2002).
- Radonjić, N. V., et al. Diversity of cortical interneurons in primates: The role of the dorsal proliferative niche. Cell Reports. 9 (6), 2139-2151 (2014).
- Turner, D. A., Shetty, A. K. Clinical prospects for neural grafting therapy for hippocampal lesions and epilepsy. Neurosurgery. 52 (3), 632-644 (2003).
- Gonzalez-Ramos, A., et al. Human stem cell-derived GABAergic neurons functionally integrate into human neuronal networks. Scientific Reports. 11, 22050 (2021).
- Yang, N., et al. Generation of pure GABAergic neurons by transcription factor programming. Nature Methods. 14 (6), 621-628 (2017).
- Nicholas, C. R., et al. Functional maturation of hPSC-derived forebrain interneurons requires an extended timeline and mimics human neural development. Cell Stem Cell. 12 (5), 573-586 (2013).
- Yuan, F., et al. Induction of human somatostatin and parvalbumin neurons by expressing a single transcription factor LIM homeobox 6. eLife. 7, 37382 (2018).
- Fandel, T. M., et al. Transplanted human stem cell-derived interneuron precursors mitigate mouse bladder dysfunction and central neuropathic pain after spinal cord injury. Cell Stem Cell. 19 (4), 544-557 (2016).
- Noakes, Z., et al. Human pluripotent stem cell-derived striatal interneurons: Differentiation and maturation in vitro and in the rat brain. Stem Cell Reports. 12 (2), 191-200 (2019).
- Parikshak, N. N., Gandal, M. J., Geschwind, D. H. Systems biology and gene networks in neurodevelopmental and neurodegenerative disorders. Nature Reviews Genetics. 16 (8), 441-458 (2015).
- Marín, O. Interneuron dysfunction in psychiatric disorders. Nature Reviews Neuroscience. 13 (2), 107-120 (2012).
- Sloan, D. J., Wood, M. J., Charlton, H. M. The immune response to intracerebral neural grafts. Trends in Neurosciences. 14 (8), 341-346 (1991).
- Diehl, R., et al. Immunosuppression for in vivo research: State-of-the-art protocols and experimental approaches. Cellular & Molecular Immunology. 14 (2), 146-179 (2017).
- Osman, M. M., et al. Cyclosporine-A as a neuroprotective agent against stroke: Its translation from laboratory research to clinical application. Neuropeptides. 45 (6), 359-368 (2011).
- Quinnies, K. M., Cox, K. H., Rissman, E. F. Immune deficiency influences juvenile social behavior and maternal behavior. Behavioral Neuroscience. 129 (3), 331-338 (2015).
- Fernandes, D. J., et al. Mouse models of immune dysfunction: their neuroanatomical differences reflect their anxiety-behavioural phenotype. Molecular Psychiatry. 27 (7), 3047-3055 (2022).
- Lund, R. D., Rao, K., Hankin, M. H., Kunz, H. W., Gill, T. J. Transplantation of retina and visual cortex to rat brains of different ages. Maturation, connection patterns, and immunological consequences. Annals of the New York Academy of Sciences. 495, 227-241 (1987).
- Olsson, M., Bentlage, C., Wictorin, K., Campbell, K., Björklund, A. Extensive migration and target innervation by striatal precursors after grafting into the neonatal striatum. Neuroscience. 79 (1), 57-78 (1997).
- Mattis, V. B., et al. Neonatal immune-tolerance in mice does not prevent xenograft rejection. Experimental Neurology. 254, 90-98 (2014).
- Nato, G., et al. Immune-tolerance to human iPS-derived neural progenitors xenografted into the immature cerebellum is overridden by species-specific differences in differentiation timing. Scientific Reports. 11, 651 (2021).
- Allison, T., et al. Defining the nature of human pluripotent stem cell-derived interneurons via single-cell analysis. Stem Cell Reports. 16 (10), 2548-2564 (2021).
- Waloschková, E., et al. Human stem cell-derived GABAergic interneurons establish efferent synapses onto host neurons in rat epileptic hippocampus and inhibit spontaneous recurrent seizures. International Journal of Molecular Sciences. 22 (24), 13243 (2021).
- Gonzalez Ramos, A. . Enhancing neuronal inhibition by cell and gene therapy as a novel treatment for epilepsy. , (2022).
- Paterno, R., et al. Hippocampal gamma and sharp-wave ripple oscillations are altered in a Cntnap2 mouse model of autism spectrum disorder. Cell Reports. 37 (6), 109970 (2021).
- Penagarikano, O., et al. Absence of CNTNAP2 leads to epilepsy, neuronal migration abnormalities, and core autism-related deficits. Cell. 147 (1), 235-246 (2011).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Angeletti, B., et al. An in vivo doxycycline-controlled expression system for functional studies of the retina. Investigative Ophthalmology & Visual Science. 44 (2), 755-760 (2003).
- Doxycycline. Drugs and Lactation Database (LactMed) Available from: https://www.ncbi.nlm.nih.gov/books/NBK500561 (2021)
- Barker, R. A., Widner, H. Immune problems in central nervous system cell therapy. NeuroRX. 1 (4), 472-481 (2004).
- Hoornaert, C. J., et al. Concise review: Innate and adaptive immune recognition of allogeneic and xenogeneic cell transplants in the central nervous system. Stem Cells Translational Medicine. 6 (5), 1434-1441 (2017).
- Englund, U., Fricker-Gates, R. A., Lundberg, C., Bjorklund, A., Wictorin, K. Transplantation of human neural progenitor cells into the neonatal rat brain: Extensive migration and differentiation with long-distance axonal projections. Experimental Neurology. 173 (1), 1-21 (2002).
- Fainstein, N., Ben-Hur, T. Brain region-dependent rejection of neural precursor cell transplants. Frontiers in Molecular Neuroscience. 11, 136 (2018).
- Denham, M., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Frontiers in Cellular Neuroscience. 6, 11 (2012).
- Miguez, A., et al. In vivo progressive degeneration of Huntington's disease patient-derived neurons reveals human-specific pathological phenotypes. bioRxiv. , (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon