Method Article
Transplante de neurônios gabaérgicos derivados de células-tronco humanas no hipocampo de camundongo pós-natal precoce para mitigar distúrbios do neurodesenvolvimento
Neste Artigo
Resumo
O transplante de neurônios GABAérgicos derivados de células-tronco pluripotentes humanas gerados pela programação neuronal pode ser uma abordagem de tratamento potencial para distúrbios do neurodesenvolvimento. Este protocolo descreve a geração e o transplante de precursores neuronais GABAérgicos derivados de células-tronco humanas no cérebro de camundongos neonatais, permitindo a investigação a longo prazo de neurônios enxertados e a avaliação de seu potencial terapêutico.
Resumo
Um número reduzido ou disfunção de interneurônios inibitórios é um contribuinte comum para distúrbios do neurodesenvolvimento. Portanto, a terapia celular usando interneurônios para substituir ou mitigar os efeitos de circuitos neuronais alterados é uma via terapêutica atraente. Para este fim, é necessário mais conhecimento sobre como as células GABAérgicas interneurônicas derivadas de células-tronco humanas (hdINs) amadurecem, integram e funcionam ao longo do tempo no circuito do hospedeiro. De particular importância nos distúrbios do neurodesenvolvimento é uma melhor compreensão de se esses processos em células transplantadas são afetados por um cérebro hospedeiro em evolução e amadurecendo. O presente protocolo descreve uma geração rápida e altamente eficiente de HDINs a partir de células-tronco embrionárias humanas com base na expressão transgênica dos fatores de transcrição Ascl1 e Dlx2. Estes precursores neuronais são transplantados unilateralmente, após 7 dias in vitro, para o hipocampo de ratinhos neonatais de 2 dias de idade. Os neurônios transplantados se dispersam no hipocampo ipsi- e contralateral de um modelo de camundongo de síndrome epiléptica focal de displasia cortical e sobrevivem por até 9 meses após o transplante. Essa abordagem permite investigar a identidade celular, a integração, a funcionalidade e o potencial terapêutico dos interneurônios transplantados durante um longo período de tempo no desenvolvimento de cérebros saudáveis e doentes.
Introdução
O estabelecimento, a maturação e o refinamento das redes neuronais ocorrem durante o período perinatal e pós-natal precoce e representam uma janela de tempo crucial para o desenvolvimento cerebral1. De uma exuberância de conectividade pós-nascimento, o cérebro evolui para um ajuste fino de conexões que se estendem até a adolescência2. Consequentemente, alterações nos genes expressas durante esses períodos, bem como fatores externos ou insultos, definem a predisposição de um indivíduo a múltiplos distúrbios do neurodesenvolvimento. Deficiências na cognição e na função motora se desdobram ao longo do tempo, e os tratamentos farmacológicos são limitados, a maioria visando sintomas com o risco de efeitos colaterais graves.
A disfunção na inibição do ácido gama-aminobutírico (GABA) demonstrou ser um dos principais contribuintes para a causa subjacente de vários distúrbios do neurodesenvolvimento3, como síndrome do X frágil, síndrome de Angelman, epilepsia, esquizofrenia e autismo. GABA é o principal transmissor inibitório do sistema nervoso central e é fundamental para manter o equilíbrio excitatório / inibitório (E / I), a sincronização do disparo neuronal e computação. Os interneurônios gabaérgicos são uma população heterogênea de neurônios, com complexidade funcional crescente em regiões cerebrais mais complexas4 e com evolução 5,6. Considerando a limitada capacidade regenerativa endógena do cérebro humano e a implicação da disfunção interneural em vários distúrbios neurológicos, o transplante de interneurônios gabaérgicos pode ser um caminho terapêutico promissor a ser explorado. Nessa linha, as células interneurônicas interneurônicas derivadas de células-tronco humanas (hdINs) parecem ser a fonte mais translacional e viável para esse fim em comparação com os precursores neuronais alogênicos de roedores ou outras fontes usadas em outros lugares7. Protocolos para gerar neurônios GABAérgicos a partir de diversas fontes celulares estão disponíveis 8,9,10,11,12,13, mas é necessário mais conhecimento sobre como os hdINs amadurecem, integram e funcionam ao longo do tempo em um cérebro patológico em desenvolvimento. Diversos estudos identificaram alterações em genes ativos durante a padronização cortical, estabelecendo conectividade neuronal14 e ajustando o equilíbrio fisiológico de E/I15. O transplante neonatal de HDINs em modelos de camundongos com perturbações genéticas correspondentes nos permite acompanhar a interação entre hospedeiro e enxerto, que é o conhecimento necessário para determinar potenciais estratégias terapêuticas.
A imunomodulação é comumente e com sucesso utilizada em transplantes de xenoenxerto para evitar desencadear uma resposta imune e rejeição do hospedeiro16. No entanto, a administração de drogas imunossupressoras, como a ciclosporina A, causa toxicidade renal após administração crônica, é trabalhosa devido à necessidade de injeções intraperitoneais diárias para atingir concentrações sistêmicas estáveis, causando estresse animal17, e tem efeitos fora do alvo que podem interagir com a patologia18. Além disso, o comprometimento do sistema imunológico demonstrou alterar fenótipos comportamentais19, com alterações nas regiões neuroanatômicas correspondentes20. Demonstrou-se que o transplante na primeira semana de vida permite a adaptação às células transplantadas 21,22, enquanto outros relataram sobrevida inicial seguida de rejeição dos enxertos no primeiro mês pós-natal 23,24.
Este protocolo descreve procedimentos desde a geração de hdIN até o transplante celular em camundongos neonatais, resultando em sobrevida do enxerto a longo prazo e permitindo a investigação da especificidade neuronal, integração sináptica, função e potencial terapêutico de interneurônios humanos transplantados durante o desenvolvimento fisiológico e patológico.
Protocolo
Todos os procedimentos experimentais foram aprovados pelo Conselho de Ética em Pesquisa Animal de Malmö/Lund, número de licença ética 12548-19, e conduzidos de acordo com os regulamentos da Agência Sueca de Bem-Estar Animal e a Diretiva da UE 2010/63/UE para experimentos com animais. Camundongos C57BL6/J e Contactin-associated protein-like 2 (Cntnap2) knock-out (KO), machos e fêmeas, foram utilizados no dia pós-natal (P) 2 para o presente estudo. Foram utilizadas células-tronco embrionárias humanas (hESCs). Os animais e as células estaminais foram obtidos de fontes comerciais (ver Tabela de Materiais).
1. Geração dos precursores hdIN
NOTA: Todas as etapas nesta seção são feitas em um capuz de cultura de células. As hESCs foram mantidas como células livres de alimentadores em placas revestidas usando um meio de cultura de células-tronco e passadas como colônias.
- Execute a programação direta dos hESCs para os precursores hdIN (Figura 1).
NOTA: A abordagem de programação avançada baseia-se no procedimento descrito em Gonzalez-Ramos et al.8 e Yang et al.9.- Transduzir as hESCs com vetores lentivirais contendo o sistema Tet-On num meio de cultura de células estaminais frescas contendo 10 μM de inibidor de ROCK (IR) (ver Tabela de Materiais). Manter a 37 °C na incubadora.
- Alterar o meio para um meio de cultura de células-tronco frescas 16 h após a transdução e manter as células transduzidas da mesma forma que as hESCs não transduzidas.
- Quando confluentes, desprenda as hESCs como células únicas usando uma solução de descolamento celular (ver Tabela de Materiais) e as prenda em placas revestidas de 6 poços a uma densidade de 3 x 105 células/poço em meio de cultura de células-tronco contendo 10 μM de IR no dia in vitro (DIV) −1.
- A 1 DIV, substituir o meio de cultura por um meio N2 contendo 2 g/L de doxiciclina (DOX, ver Tabela de Materiais).
NOTA: DOX é usado para induzir a expressão transgênica de Ascl1 e Dlx29, de 1 DIV a 7 DIV, e depois continua in vivo por sua adição à água potável25. - Aos 2 DIV, inicia-se um período de seleção de resistência a antibióticos que durará até 5 DIV. Adicione puromicina (puro) e higromicina (higrão) ao meio fresco (ver Tabela de Materiais). Altere a média em 2 DIV, 4 DIV e 5 DIV.
NOTA: Otimizar as concentrações de puro e higro antes do protocolo de diferenciação usando hESCs transduzidas e não transduzidas para garantir a sobrevivência apenas das células que transportam as resistentes aos antibióticos. Neste protocolo, foram utilizados 0,5 μg/mL de puro e 750 μg/mL de higro. - Aos 5 DIV, o período de seleção de antibióticos termina. Mudança para meio N2 suplementado com 2 g/L de DOX e 4 μM de citosina β-D-arabinofuranoside (Ara-C, ver Tabela de Materiais).
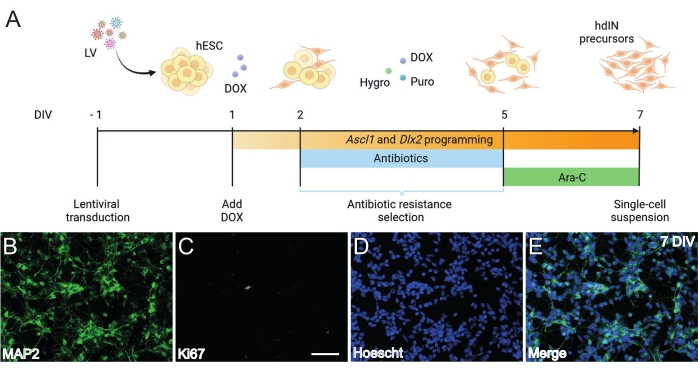
Figura 1: Geração de precursores de hdIN a partir de hESCs por superexpressão de Ascl1 e Dlx2. (A) Esquemas do protocolo de diferenciação utilizado para a geração de precursores de hdIN. (B-E) Imunocitoquímica de precursores de hdIN a 7 DIV para (B) o marcador neuronal MAP2, (C) o marcador proliferativo Ki67, (D) coloração nuclear geral e (E) uma fusão dos marcadores anteriores. Barra de escala: 50 μm. Clique aqui para ver uma versão maior desta figura.
2. Preparação da suspensão unicelular para transplante
NOTA: Todas as etapas nesta seção são feitas no capuz de cultura de células. Em 7 DIV, os precursores de hdIN são dissociados e utilizados para transplante.
- Execute o desprendimento das células seguindo as etapas abaixo.
- Retire o meio e lave cuidadosamente as células com DPBS sem cálcio e magnésio.
- Adicionar 400 μL da solução de descolamento celular (ver Tabela de Materiais) a cada poço da placa de 6 poços.
NOTA: Assegure a cobertura de toda a superfície pela solução. - Incubar por 2-3 min a 37 °C na incubadora até que a borda das células comece a parecer brilhante, indicando degradação enzimática das proteínas da superfície celular e descolamento da superfície do poço.
NOTA: Para aumentar a sobrevivência celular, não espere muito tempo quando todas as células estiverem completamente separadas e flutuando. - Em seguida, adicione 600 μL de meio N2 fresco a cada poço da placa de 6 poços para parar a enzima e, mecanicamente com a pipeta, ajude a separar as células para obter uma suspensão unicelular.
- Transferir a suspensão da célula para um tubo de plástico (15 mL) e centrifugar a 180 x g por 4 min à temperatura ambiente (RT).
- Realizar a ressuspensão das células.
- Descarte o sobrenadante usando um sistema de vácuo (cuidadosamente, sem perturbar o pellet) e ressuspenda o pellet no meio de transplante contendo 10 μM de IR, 1 μg/mL de DNase e 2 μg/μL de DOX.
- Contar o total de células na suspensão utilizando uma câmara de contagem e um contador manual de células e ajustar o volume para uma concentração final de 100.000 células/μL.
- Mantenha a suspensão celular em um tubo fechado sobre gelo até o transplante por um período máximo de 4 h.
NOTA: O transplante deve ser realizado no mesmo dia da preparação da suspensão celular (7 DIV).
3. Transplante de células intrahipocampais
NOTA: Todas as etapas desta seção são realizadas fora do exaustor de cultura de células na instalação animal. O transplante pós-natal precoce de células para o cérebro foi realizado em P2, considerando-se P0 o dia do nascimento.
- Prepare-se para o experimento de transplante seguindo as etapas abaixo.
- Autoclave todo o material cirúrgico ou, se não for possível, esterilize com outro método aprovado.
- Monte a seringa injetora no suporte sem qualquer capilar de vidro. Lave a agulha com água.
NOTA: A agulha deve ser 33 G. - Curvar 90° a ponta de uma agulha de insulina 30 G.
- Crie um palco caseiro do tipo Play-Doh para posicionar o filhote com a cabeça plana (Figura 2A).
- Procure a gaiola de ratos com a mãe e os filhotes antes de preparar qualquer coisa para a cirurgia para permitir que eles se acostumem ao novo ambiente.
- Prepare uma bandeja com gelo molhado e uma gaiola vazia com um pouco de papel para o isoflurano.
- Anestesiar o filhote de rato.
- Mergulhe um pedaço de papel com isoflurano (ver Tabela de Materiais) e coloque-o dentro da gaiola vazia. Pegue cuidadosamente um filhote e coloque-o na gaiola com o papel embebido em isoflurano.
NOTA: Nunca deixe menos de três filhotes com a mãe. Não exceda 20-30 s de anestesia com isoflurano, ou o filhote pode morrer. - Verifique o efeito da anestesia pela cessação do movimento.
- Imediatamente após a anestesia, coloque o filhote em um tecido molhado na superfície do gelo molhado. Mantenha o animal no gelo por 3 min até que os membros superiores fiquem branqueados (Figura 2B, seta azul). Isso geralmente leva de 2 a 3 minutos.
- Utilize este tempo para carregar a seringa com a suspensão celular. Ressuspenda as células cuidadosamente com uma pipeta antes.
- Coloque o filhote na moldura estereotáxica. Use as barras auriculares na direção oposta (Figura 2A, setas magenta).
NOTA: A parte de trás das barras auriculares é menos pontiaguda e, como os filhotes P2 não têm orelhas, use o lado mais plano para evitar machucar o animal. - De lado, verifique se a cabeça está reta. A cabeça deve ser plana; use o estágio Play-Doh-like para se ajustar a isso.
NOTA: Os filhotes nessa idade ainda não abriram os olhos, portanto, nenhum passo adicional a esse respeito precisa ser feito. Os filhotes não têm pelo nesta idade, por isso não é necessário barbear da área. Nenhum tratamento específico para a dor é dado, pois não é uma incisão aberta na pele e nenhuma sutura está envolvida. - Mantenha o filhote coberto de gelo (em cima de papel de seda) durante toda a duração da cirurgia.
NOTA: Não coloque o gelo em contato direto com a pele do filhote.
- Mergulhe um pedaço de papel com isoflurano (ver Tabela de Materiais) e coloque-o dentro da gaiola vazia. Pegue cuidadosamente um filhote e coloque-o na gaiola com o papel embebido em isoflurano.
- Realize a injeção.
- Limpe a superfície da pele usando um tecido mole embebido em etanol.
- Identifique lambda e defina as coordenadas como zero no console de exibição digital do instrumento estereotáxico (Figura 2C, linha tracejada amarela). As suturas sagital e lambdoide são facilmente visíveis pelo olho, uma vez que são vascularizadas, como linhas vermelhas.
NOTA: Se tiver dificuldades para visualizar o lambda, coloque um pequeno pedaço de gelo na pele e aguarde alguns minutos para que ele esfrie. Em seguida, remova o pedaço de gelo e o clareamento sutil da pele permitirá que você visualize. - Deslocar a agulha de injeção para as coordenadas desejadas. No protocolo descrito, a região alvo foi o hipocampo, e as coordenadas foram: anteroposterior (AP) +0,85 e médio-lateral (ML) +1,35.
- Use uma agulha de insulina dobrada de 90 ° para penetrar no crânio e criar um pequeno orifício.
- Derrube a agulha de injeção até que ela tenha atravessado o crânio e zere as coordenadas dorso-ventrais (DV). Abaixe a agulha até que o DV desejado coordene. No protocolo descrito, as coordenadas foram DV −1.1.
- Injetar de acordo com os intervalos de tempo predeterminados.
NOTA: No protocolo descrito, os horários exatos foram os seguintes: (i) depois de descer para a coordenada DV, aguarde 3 min, (ii) injete 1 μL de volume por 5 min e (iii) depois que todo o volume tiver sido injetado, aguarde 3 min. - Retraia a agulha lentamente.
- Encerre o procedimento.
NOTA: A cirurgia não pode durar mais de 15 minutos para garantir a sobrevivência do filhote e evitar qualquer dano derivado da anestesia por hipotermia.- Aqueça o filhote com as mãos até que ele comece a se mover antes de devolvê-lo à mãe.
- Administrar DOX a uma concentração de 1 mg/ml em solução de sacarose a 0,5% como água potável durante pelo menos 2 dias antes e 3 semanas após o transplante (TP) para continuar a diferenciação celular in vivo.
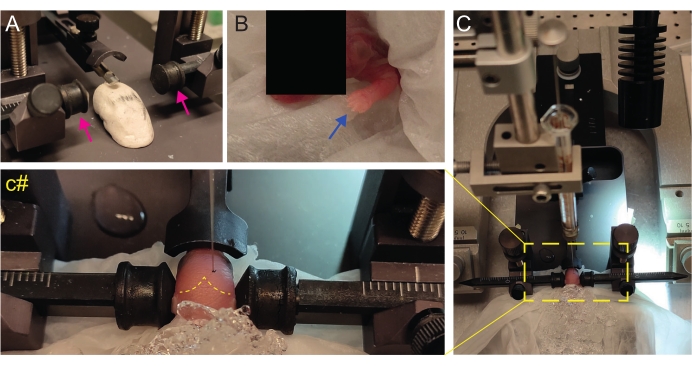
Figura 2: Transplante estereotáxico em filhotes de camundongos recém-nascidos em P2. (A) Estágio do tipo Play-Doh para manter o corpo do filhote em posição e barras auriculares invertidas (setas magenta). (B) Pata dianteira branca (seta azul) indicativa da redução do fluxo sanguíneo nessa área, de modo que o filhote está sofrendo anestesia por hipotermia. (C) Visão geral da configuração com o filhote já coberto por gelo sobre o papel de tecido mole. (c#) Zoom fechado da cabeça do filhote, com a agulha de injeção já inserida no cérebro (linha tracejada amarela indicando suturas lambda e lambdoide). Esta figura é adaptada de Gonzalez Ramos et al. 27. Clique aqui para ver uma versão maior desta figura.
Resultados
Seguindo o protocolo aqui apresentado e ilustrado na Figura 1A, os precursores de hdIN ainda não eram proliferativos a 7 DIV, conforme definido por (i) imunorreatividade negativa para o marcador de ciclo celular Ki67 e (ii) expressão de marcadores neuronais como a proteína 2 associada a microtúbulos (MAP2) (Figura 1B-E). Essa caracterização foi realizada em células remanescentes revestidas por 24 h após terem sido submetidas a todas as etapas do procedimento. Além disso, a análise de expressão gênica publicada anteriormente indicou que uma rápida transição do estado pluripotente para um fenótipo neuronal ocorre em torno de 4 DIV e 7 DIV8. No geral, esses resultados confirmaram a presença de células pós-mitóticas e a ausência de risco para a formação de teratoma.
Em seguida, a sobrevivência dos precursores de hdIN após o transplante pós-natal precoce no hipocampo de camundongos do tipo selvagem (WT) foi testada por imuno-histoquímica contra o marcador citoplasmático humano STEM121. Os precursores de hdIN foram transplantados para o hipocampo dorsal direito de camundongos imunocompetentes ingênuos em P2, que foram então sacrificados em P14 e 2 meses PT. Células enxertadas foram encontradas em todo o hipocampo dorsal, bem como dispersas através do corpo caloso e do hipocampo contralateral, em ambos os momentos. Além disso, em ambos os momentos, os hdINs enxertados expressaram Ascl1, um dos fatores de transcrição de indução (Figura 1 Suplementar), e não eram proliferativos, como indicado pela ausência de expressão de Ki67 (Figura 2 Suplementar).
É importante ressaltar que nenhuma reação imune ou inflamação local contra as células transplantadas foi encontrada em P14 ou 2 meses de TP, conforme avaliado pela ausência de micróglia reativa identificada usando Iba1, CD68 e galectina-3 (Gal3) (Figura 3), a extensão da astrogliose determinada pela proteína glial fibrilar ácida (GFAP) e citocinas inflamatórias como a interleucina-1 (IL-1), e a ausência de linfócitos T citotóxicos (CD8) (Figura 4).
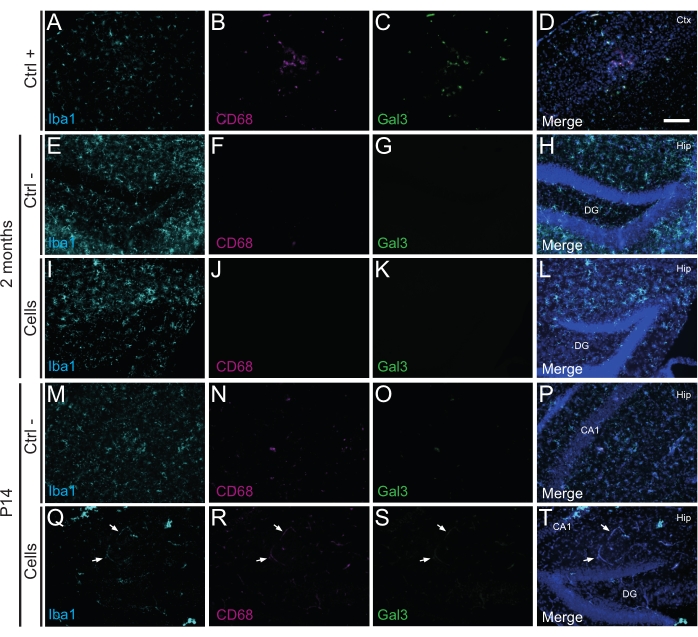
Figura 3: HDINs em P14 e 2 meses PT no hipocampo de camundongos WT recém-nascidos sem desencadear rejeição imune do tecido hospedeiro. Imunofluorescência para marcadores Iba1, CD68 e Gal3 no tecido cerebral a partir de (A-D) a proximidade de uma área central isquêmica em um modelo de camundongo com AVC de eletrocoagulação (controle positivo, Ctrl +), (E-H) animais de controle negativo (Ctrl-) aos 2 meses e (M-P) P14, e (I-L) animais que foram submetidos a transplante celular aos 2 meses e (Q-T ) P14. As setas brancas indicam alguns exemplos de vasos sanguíneos visíveis em todos os canais devido à autofluorescência. Abreviaturas: Ctx = córtex; Quadril = hipocampo; GD = giro dentado; CA1 = cornu ammonis 1. Barra de escala: 50 μm. Clique aqui para ver uma versão maior desta figura.
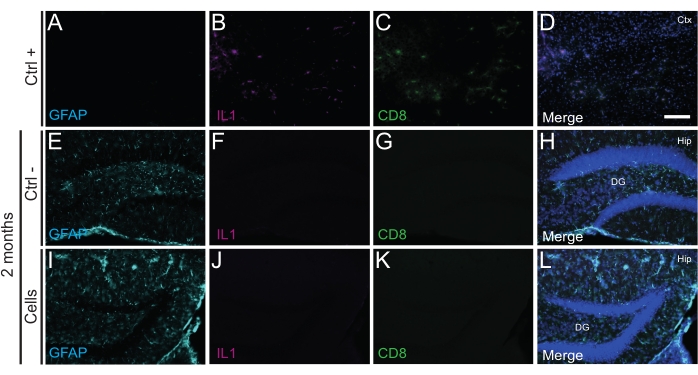
Figura 4: HDINs aos 2 meses de TP no hipocampo de camundongos WT recém-nascidos sem desencadear a rejeição imune do tecido hospedeiro. Imunofluorescência para marcadores IL1, GFAP e CD8 no tecido cerebral a partir de (A-D) a proximidade de uma área central isquêmica em um modelo de camundongo com AVC de eletrocoagulação (controle positivo, Ctrl +), (E-H) animais de controle negativo (Ctrl-) aos 2 meses e animais (I-L) submetidos a transplante celular aos 2 meses. Abreviaturas: Ctx = córtex; Quadril = hipocampo; GD = giro dentado. Barra de escala: 50 μm. Clique aqui para ver uma versão maior desta figura.
Da mesma forma, precursores de hdIN também foram transplantados para o hipocampo de camundongos Cntnap2 KO, um modelo para transtorno do espectro do autismo e síndrome epiléptica focal de displasia cortical. Nos camundongos Cntnap2 KO, de fato, os hdINs sobreviveram até 9 meses de TP e foram localizados no local da injeção, embora também estivessem dispersos pelo hipocampo ipsilateral e até contralateral, como observado nos camundongos WT (Figura 5). Além disso, a maioria dos hdINs enxertados foi imunorreativa para marcadores interneurais, como esperado de resultados anteriores in vitro 8,26 e em roedores adultos in vivo25.
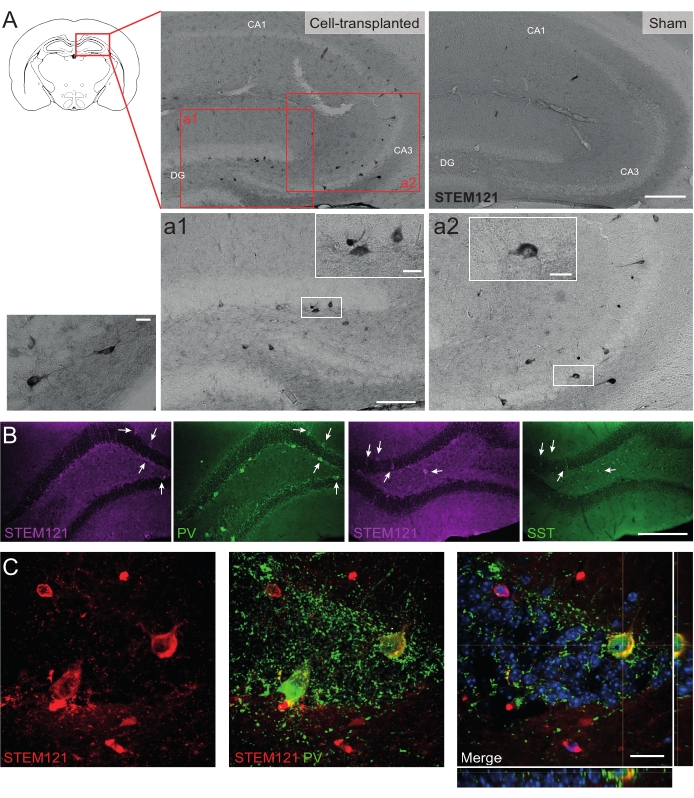
Figura 5: HDINs enxertados no hipocampo de camundongos Cntnap2 KO aos 9 meses de TP. (A) Imunoquímica contra o marcador citoplasmático humano STEM121 em camundongos transplantados de células (esquerda) e simulados (direita). (a1 e a2) Imagens ampliadas de células positivas STEM121. (B) Imunofluorescência para STEM121 (magenta) e os marcadores interneurais parvalbumina (PV) e somatostatina (SST). As setas brancas indicam células duplamente positivas para STEM121 e o respectivo marcador interneural. (C) Visão ortogonal de um imunorreativo de hdIN enxertado para STEM121 e PV. Barra de escala: 200 μm (A e B), 100 μm (a1 e a2), 20 μm (pequena ampliação quadrada em a1 e a2 e C). Por favor, clique aqui para ver uma versão maior desta figura.
Figura 1 Suplementar: HDINs enxertados aos 2 meses de TP no hipocampo de camundongos WT recém-nascidos expressando Ascl1. Imunofluorescência contra Ascl1 e o marcador citoplasmático humano STEM121 no (A) CA3 e (B) DG em camundongos WT transplantados com células. (a) Imagem ampliada de uma célula positiva STEM121. As setas brancas indicam células duplamente positivas para STEM121 e Ascl1. Barra de escala: 100 μm. Clique aqui para baixar este arquivo.
Figura 2 Suplementar: HDINs enxertados pós-mitóticos aos 2 meses de TP no hipocampo de camundongos WT recém-nascidos. Imunofluorescência contra o marcador proliferativo Ki67 e o marcador citoplasmático humano STEM121 em camundongos WT (A) ingênuos e (B) transplantados com células. (b) Imagem ampliada de uma célula positiva STEM121. A seta amarela indica uma célula positiva para Ki67 e negativa para STEM121. A seta branca indica células positivas para STEM121 e negativas para Ki67. O asterisco branco aponta um ventrículo lateral. Barra de escala: 100 μm. Clique aqui para baixar este arquivo.
Discussão
O presente protocolo descreve uma metodologia robusta, rápida, simples e amplamente acessível para gerar precursores de hdIN in vitro e seu uso como terapia celular intervencionista precoce em modelos pré-clínicos de distúrbios do neurodesenvolvimento.
Embora alguns dos fenótipos característicos dos distúrbios do neurodesenvolvimento surjam durante a adolescência ou a idade adulta, as alterações fisiopatológicas já estão presentes durante o desenvolvimento inicial. Por esta razão, a intervenção precoce seria altamente justificada para alcançar efeitos benéficos, agindo em períodos críticos de desenvolvimento cerebral antes da sintomatologia ou manifestação clínica. No futuro, a triagem genética e o desenvolvimento de biomarcadores proporcionarão tratamento profilático ou pré-sintomático, representando um divisor de águas para esses pacientes. Portanto, os precursores de hdIN foram transplantados precocemente após o nascimento no modelo de camundongo Cntnap2 KO, quando as alterações epileptogênicas na rede neuronal podem estar em curso28 e em um momento em que alterações celulares foram descritas neste modelo animal29. É importante, no entanto, considerar as possíveis armadilhas da extrapolação da idade e o tempo de certos processos no rato versus o cérebro humano.
Com foco no procedimento em si, o protocolo de diferenciação aqui apresentado baseia-se no uso de fatores de transcrição, que permitem uma programação rápida e altamente eficiente das células-tronco em comparação com outros protocolos baseados em pequenas moléculas10,30. Uma desvantagem potencial dessa abordagem poderia ser a necessidade de vetores lentivirais, o que acarreta um risco de mutagênese insercional. Duas etapas críticas no protocolo são a adição dos antibióticos e do agente antimitótico ao meio para selecionar as células que expressam os fatores de transcrição e eliminar as células proliferativas, evitando o risco de formação de teratoma, respectivamente. Embora apenas precursores de hdIN tenham sido testados neste estudo, espera-se que o procedimento seja viável com outras fontes celulares e protocolos de programação/diferenciação. No entanto, outros subtipos e/ou modelos neuronais devem ser validados.
A idade do precursor do hdIN para transplante, 7 DIV, foi decidida com base em (i) a ausência de células proliferativas, avaliada pela imunorreatividade contra Ki67, (ii) juntamente com a observação previamente relatada de diminuições na expressão de genes de pluripotência como POU5F1 e o aparecimento do marcador neuronal MAP2 e do marcador de interneurônios GAD1 naquele momento8 . No entanto, o trabalho original que descreve esse protocolo realizou transplantes aos 14 DIV após a retirada do DOX9. Isso levanta questões sobre se o DOX na água potável da mãe pode atingir células enxertadas nos cérebros de filhotes que amamentam através do leite, ou se 7 DIV de indução DOX são suficientes para estabelecer o destino GABAérgico. Embora Yang e col. tenham identificado 14 dias de DOX como suficientes para gerar células neuronais estáveis in vitro9, Gonzalez-Ramos et al.8 detectaram a expressão gênica de GAD1 já em 7 DIV, indicando que a ativação a jusante de GAD67 por Ascl1 e Dlx2 já ocorreu neste momento. Assim, a padronização começou em 7 DIV e pode ser menos dependente do tratamento DOX. Além disso, evidências em roedores e humanos indicam a presença de DOX no leite materno 31,32, e os resultados aqui apresentados mostram que os hdINs enxertados foram imunorreativos paraAscl1 em 2 semanas e 2 meses de TP e marcadores de interneurônios mais tarde, aos 9 meses de TP. Dentro da população enxertada, além de neurônios PV e SST positivos, outros marcadores para subpopulações de interneurônios também foram encontrados em quantidades menores, como calretinina (CR) e calbindina (CB).
Um aspecto desafiador deste procedimento é a coordenação dos horários tanto para a diferenciação quanto para a idade dos filhotes. Normalmente, a gestação do rato leva 21 dias após a configuração da gaiola de acasalamento, embora isso possa variar às vezes. Esse cenário não ocorre ao realizar transplantes celulares em roedores adultos, quando tudo pode ser cuidadosamente planejado e organizado. No entanto, isso pode ser facilmente mitigado pela criação de duas a três gaiolas de acasalamento com um intervalo de 2 dias ou dois a três lotes de diferenciação com um lapso de tempo de 2 dias um do outro.
Embora os camundongos utilizados neste estudo não fossem imunodeficientes nem imunossuprimidos, as células transplantadas sobreviveram até 9 meses in vivo, e os marcadores de reação imune contra células xenogênicas ou inflamação local não foram observados em P14 ou 2 meses PT. A rejeição imune de células xenogênicas enxertadas é desencadeada contra MHC / peptídeos, e os principais mediadores celulares da rejeição do enxerto são linfócitos T e células microgliais33, 34. Portanto, a imunorreatividade a marcadores de células T, bem como a micróglia reativa, foi explorada. Nenhum sinal de rejeição imune das células enxertadas no tecido hospedeiro foi detectado pelos níveis de micróglia reativa ou pela presença de linfócitos T em camundongos WT em P14 ou 2 meses. Além disso, nenhuma inflamação local foi observada com base nos níveis avaliados de astrogliose e citocinas inflamatórias. Esse desfecho pode ser parcialmente dependente da tolerância imune neonatal 35,36,37, observada por outras identidades celulares, localizações e modelos animais35,38. Englund et al. identificaram diferenças regionais no desfecho das células enxertadas em termos de migração e maturação, incluindo a observação de células enxertadas na substância branca adjacente35.
Finalmente, observou-se uma maior dispersão das células enxertadas dentro do hipocampo em comparação com outros estudos transplantados em roedores adultos, onde os hdINs permaneceram como um núcleo enxertado25. Essa dispersão também diferiu dos resultados observados anteriormente por Yang et al.9, o que poderia ser explicado, neste caso, pela idade das células no momento do transplante.
Divulgações
Os autores declaram não haver interesses concorrentes.
Agradecimentos
Este projeto foi financiado pelo Swedish Research Council (Grant Number: 2016-02605, M.A.), pela Swedish Brain Foundation F02021-0369 (M.A.), pela Crafoord Foundation (M.A.) e pelo European Union Horizon 2020 Programme (H2020-MSCA-ITN-2016) no âmbito do projeto Marie Skłodowska-Curie Innovative Training Network Training4CRM No. 722779 (M.K.). Estamos extremamente gratos pela ajuda de Andrés Miguez, do laboratório de Josep Maria Canals (Laboratório de Células-Tronco e Medicina Regenerativa, Universidade de Barcelona), por ensinar transplante de células estereotáxicas em camundongos recém-nascidos P2, e Mackenzie Howard, líder de grupo da Universidade do Texas em Austin, pelo aconselhamento e coordenadas preliminares para transplante de células no hipocampo de camundongos recém-nascidos P2. Agradecemos a Susanne Geres por ajudar com o cuidado dos animais e Ling Cao pela ajuda com o processamento de tecidos, bem como aos alunos que contribuíram de uma forma ou de outra para o estudo e, especificamente, Diana Hatamian. Finalmente, alguns dos gráficos utilizados para ilustrar este artigo foram criados com BioRender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| 30 G needle | B Braun | 4656300 | |
| 33 G needle for Hamilton syringe | Hamilton | 7762-06 | |
| 4-well plates | Thermo Scientific | 176740 | |
| Accutase | STEMCELL Technologies | 7920 | Cell detachment solution use for splitting cells (hESC and hdIN precursors) |
| Adjustable volume pipettes 10, 20, 200, 1000 µL | |||
| Alexa Fluor Plus 488/555/647 | Thermo Fisher | 1:1000 | |
| Anti-CD68 (Rat) | Bio-Rad | MCA1957 | 1:200 |
| Anti-CD8 (Rabbit) | Abcam | 203035 | 1:200 |
| Anti-Galectin 3 (Goat) | R&D systems | AF1197 | 1:500 |
| Anti-GFAP (Guiena Pig) | Synaptic systems | 173004 | 1:500 |
| Anti-Iba1 (Rabbit) | WAKO | 19119741 | 1:500 |
| Anti-IL1 (Goat) | Santa Cruz Biotech | SC-106 | 1:400 |
| Anti-Ki67 | Abcam | ab16667 | 1:250 |
| Anti-Ki67 (Rabbit) | Novocastra | NCL-Ki67p | 1:250 |
| Anti-MAP2 (Chicken) | Abcam | ab5392 | 1:2000 |
| Anti-Mash1 (Ascl1) | Abcam | ab74065 | 1:1000 |
| Anti-Parvalbumin (Rabbit) | Swant | PV 27 | 1:5000 |
| Anti-Somatostatin (Rat) | Millipore | MAB354 | 1:150 |
| Anti-STEM121 (Mouse) | Takara Bio | Y40410 | 1:400 |
| Avidin/Biotin Blocking Kit | VECTOR Laboratories | SP-2001 | |
| B6.129(Cg)-Cntnap2tm1Pele/J | Jackson Laboratory | 17482 | Animal model |
| Biotinylated Horse anti-Mouse | VECTOR Laboratories | BA-2001 | 1:200 |
| Burker Chamber | Thermo Fisher Scientific | 10628431 | |
| C57BL/6J | Janvier Labs | Animal model | |
| Centrifuge | For 15 mL tubes | ||
| Confocal microscope | Nikon | Confocal A1RHD microscope | |
| Costar 6-well Clear TC-treated | Corning | 3516 | |
| Cy3 Streptavidin | Jackson ImmunoResearch | 016-160-084 | 1:200 |
| Cytosine β-D-arabinofuranoside (AraC) | Sigma | C1768 | 4 µM |
| DAB Substrate Kit, Peroxidase (With Nickel) | VECTOR Laboratories | SK-4100 | |
| Digital Stereotax | KOPF | Model 940 | |
| DMEM/F12 | Thermo Fisher Scientific | 11320082 | Use for the N2 medium |
| DNase I Solution | STEMCELL Technologies | 7900 | 1 µg/mL |
| Doxycyclin | Sigma-Aldrich | D9891 | 2 µg/mL |
| DPBS -/- | Gibco | 14190144 | |
| Epifluorescence microscope | Olympus | BX51 Microscope | |
| Ethanol | Solveco | 70%, 95%, 99.8% | |
| FUW-rTA | Addgene | 20342 | Lentiviral vector |
| FUW-TetO-Ascl1-T2A-puromycin | Addgene | 97329 | Lentiviral vector |
| FUW-TetO-Dlx2-IRES-hygromycin | Addgene | 97330 | Lentiviral vector |
| H1 (WA01) ESC | WiCell | WA01 | Human embryonic stem cell line under a MTA agreement |
| H2O2 | Sigma-Aldrich | 18304 | |
| Hamilton Syringe | Hamilton | 7634-01 | 5 µL |
| HBSS | Gibco | 14175095 | No calcium, No magnesium - Transplantation medium |
| Hoechst 33342 | Invitrogen | H3570 | 1:1000 |
| Hygromycin B | Gibco (Invitrogen) | 10687010 | |
| Incubator | 5% CO2, 37 °C | ||
| Isoflurane Baxter | Apoteket AB | ||
| Manual cell counter | VWR | 720-1984 | |
| Matrigel hESC-Qualified Matrix, LDEV-free | Corning | 354277 | For the coating |
| Methanol | Merck Millipore | 1060091000 | |
| Microscope Coverslips 24 x 60 mm | Thermo Scientific | BBAD02400500#A113MNZ#0## | |
| Microscope Slides | VWR | 631-1551 | |
| Microscope Software | Olympus | CellSens | |
| Mounting media | Merck | 10981 | PVA-Dabco |
| Mouse adaptor to stereotax | RWD | 68030 | |
| mTeSR1 | STEMCELL Technologies | 85850 | Kit Basal Medium and 5X Supplement - Stem cell culture medium |
| N2 supplement | Gibco | 17502048 | |
| NaOH | Sigma-Aldrich | S8045 | 1M |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | |
| Pertex | HistoLab | 811 | |
| Pipet Filler | |||
| Play-Doh | |||
| Puromycin (Dihydrochloride) | Gibco | A1113803 | |
| Round cover glasses thickness No. 1.5H (tol. ± 5 μm) 13 mm Ø | Marienfeld | MARI0117530 | For immunocytochemistry |
| Serum | Thermo Fisher | Goat, Donkey, Horse | |
| Sterile pipette tips | For volumes 0.1-1000 µL | ||
| Sterile serological pipettes | 5, 10, 25 mL | ||
| Sterile water Braun | B Braun | 3626873 | |
| Sucrose | Sigma-Aldrich | S8501 | For 0.5% Sucrose solution |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Trypan Blue Solution | Gibco | 15250061 | |
| Tubes | Sarstedt | 15 ml, Eppendorf 1.5 mL | |
| Tweezer | VWR | ||
| Ultra pure water | MilliQ Water System | ||
| Xylene | VWR | 28973.363 | |
| Y-27632 (ROCK inhibitor) | STEMCELL Technologies | 72304 | 10 µM |
Referências
- Kostović, I., Jovanov-Milošević, N. The development of cerebral connections during the first 20-45 weeks' gestation. Seminars in Fetal and Neonatal. 11 (6), 415-422 (2006).
- Innocenti, G. M., Price, D. J. Exuberance in the development of cortical networks. Nature Reviews Neuroscience. 6 (12), 955-965 (2005).
- Tang, X., Jaenisch, R., Sur, M. The role of GABAergic signalling in neurodevelopmental disorders. Nature Reviews Neuroscience. 22 (5), 290-307 (2021).
- Kepecs, A., Fishell, G. Interneuron cell types are fit to function. Nature. 505 (7483), 318-326 (2014).
- DeFelipe, J., Alonso-Nanclares, L., Arellano, J. I. Microstructure of the neocortex: Comparative aspects. Journal of Neurocytology. 31 (3-5), 299-316 (2002).
- Radonjić, N. V., et al. Diversity of cortical interneurons in primates: The role of the dorsal proliferative niche. Cell Reports. 9 (6), 2139-2151 (2014).
- Turner, D. A., Shetty, A. K. Clinical prospects for neural grafting therapy for hippocampal lesions and epilepsy. Neurosurgery. 52 (3), 632-644 (2003).
- Gonzalez-Ramos, A., et al. Human stem cell-derived GABAergic neurons functionally integrate into human neuronal networks. Scientific Reports. 11, 22050 (2021).
- Yang, N., et al. Generation of pure GABAergic neurons by transcription factor programming. Nature Methods. 14 (6), 621-628 (2017).
- Nicholas, C. R., et al. Functional maturation of hPSC-derived forebrain interneurons requires an extended timeline and mimics human neural development. Cell Stem Cell. 12 (5), 573-586 (2013).
- Yuan, F., et al. Induction of human somatostatin and parvalbumin neurons by expressing a single transcription factor LIM homeobox 6. eLife. 7, 37382 (2018).
- Fandel, T. M., et al. Transplanted human stem cell-derived interneuron precursors mitigate mouse bladder dysfunction and central neuropathic pain after spinal cord injury. Cell Stem Cell. 19 (4), 544-557 (2016).
- Noakes, Z., et al. Human pluripotent stem cell-derived striatal interneurons: Differentiation and maturation in vitro and in the rat brain. Stem Cell Reports. 12 (2), 191-200 (2019).
- Parikshak, N. N., Gandal, M. J., Geschwind, D. H. Systems biology and gene networks in neurodevelopmental and neurodegenerative disorders. Nature Reviews Genetics. 16 (8), 441-458 (2015).
- Marín, O. Interneuron dysfunction in psychiatric disorders. Nature Reviews Neuroscience. 13 (2), 107-120 (2012).
- Sloan, D. J., Wood, M. J., Charlton, H. M. The immune response to intracerebral neural grafts. Trends in Neurosciences. 14 (8), 341-346 (1991).
- Diehl, R., et al. Immunosuppression for in vivo research: State-of-the-art protocols and experimental approaches. Cellular & Molecular Immunology. 14 (2), 146-179 (2017).
- Osman, M. M., et al. Cyclosporine-A as a neuroprotective agent against stroke: Its translation from laboratory research to clinical application. Neuropeptides. 45 (6), 359-368 (2011).
- Quinnies, K. M., Cox, K. H., Rissman, E. F. Immune deficiency influences juvenile social behavior and maternal behavior. Behavioral Neuroscience. 129 (3), 331-338 (2015).
- Fernandes, D. J., et al. Mouse models of immune dysfunction: their neuroanatomical differences reflect their anxiety-behavioural phenotype. Molecular Psychiatry. 27 (7), 3047-3055 (2022).
- Lund, R. D., Rao, K., Hankin, M. H., Kunz, H. W., Gill, T. J. Transplantation of retina and visual cortex to rat brains of different ages. Maturation, connection patterns, and immunological consequences. Annals of the New York Academy of Sciences. 495, 227-241 (1987).
- Olsson, M., Bentlage, C., Wictorin, K., Campbell, K., Björklund, A. Extensive migration and target innervation by striatal precursors after grafting into the neonatal striatum. Neuroscience. 79 (1), 57-78 (1997).
- Mattis, V. B., et al. Neonatal immune-tolerance in mice does not prevent xenograft rejection. Experimental Neurology. 254, 90-98 (2014).
- Nato, G., et al. Immune-tolerance to human iPS-derived neural progenitors xenografted into the immature cerebellum is overridden by species-specific differences in differentiation timing. Scientific Reports. 11, 651 (2021).
- Allison, T., et al. Defining the nature of human pluripotent stem cell-derived interneurons via single-cell analysis. Stem Cell Reports. 16 (10), 2548-2564 (2021).
- Waloschková, E., et al. Human stem cell-derived GABAergic interneurons establish efferent synapses onto host neurons in rat epileptic hippocampus and inhibit spontaneous recurrent seizures. International Journal of Molecular Sciences. 22 (24), 13243 (2021).
- Gonzalez Ramos, A. . Enhancing neuronal inhibition by cell and gene therapy as a novel treatment for epilepsy. , (2022).
- Paterno, R., et al. Hippocampal gamma and sharp-wave ripple oscillations are altered in a Cntnap2 mouse model of autism spectrum disorder. Cell Reports. 37 (6), 109970 (2021).
- Penagarikano, O., et al. Absence of CNTNAP2 leads to epilepsy, neuronal migration abnormalities, and core autism-related deficits. Cell. 147 (1), 235-246 (2011).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Angeletti, B., et al. An in vivo doxycycline-controlled expression system for functional studies of the retina. Investigative Ophthalmology & Visual Science. 44 (2), 755-760 (2003).
- Doxycycline. Drugs and Lactation Database (LactMed) Available from: https://www.ncbi.nlm.nih.gov/books/NBK500561 (2021)
- Barker, R. A., Widner, H. Immune problems in central nervous system cell therapy. NeuroRX. 1 (4), 472-481 (2004).
- Hoornaert, C. J., et al. Concise review: Innate and adaptive immune recognition of allogeneic and xenogeneic cell transplants in the central nervous system. Stem Cells Translational Medicine. 6 (5), 1434-1441 (2017).
- Englund, U., Fricker-Gates, R. A., Lundberg, C., Bjorklund, A., Wictorin, K. Transplantation of human neural progenitor cells into the neonatal rat brain: Extensive migration and differentiation with long-distance axonal projections. Experimental Neurology. 173 (1), 1-21 (2002).
- Fainstein, N., Ben-Hur, T. Brain region-dependent rejection of neural precursor cell transplants. Frontiers in Molecular Neuroscience. 11, 136 (2018).
- Denham, M., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Frontiers in Cellular Neuroscience. 6, 11 (2012).
- Miguez, A., et al. In vivo progressive degeneration of Huntington's disease patient-derived neurons reveals human-specific pathological phenotypes. bioRxiv. , (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados