Method Article
Implantación de matrices de electrocorticografía blanda subdural (ECoG) y registro cortical a largo plazo en minipigs
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, presentamos un método para la evaluación del rendimiento y la seguridad a largo plazo de las matrices de electrodos subdurales blandos en un modelo minipig, describiendo el método y las herramientas quirúrgicas, las imágenes de resonancia magnética postoperatoria, la electrofisiología de la corteza auditiva, las propiedades electroquímicas del implante y la inmunoquímica postmortem.
Resumen
Las deficiencias neurológicas y las enfermedades se pueden diagnosticar o tratar mediante matrices de electrocorticografía (ECoG). En la epilepsia resistente a los medicamentos, estos ayudan a delinear la región epiléptica que se va a resecar. En aplicaciones a largo plazo, como las interfaces cerebro-ordenador, estos electrodos epicorticales se utilizan para registrar la intención de movimiento del cerebro, para controlar las extremidades robóticas de los pacientes paralizados. Sin embargo, las rejillas de electrodos rígidas actuales no responden a la necesidad de registros cerebrales de alta resolución y biointegración a largo plazo. Recientemente, se han propuesto guías de electrodos adaptables para lograr la estabilidad del implante a largo plazo con un alto rendimiento. Sin embargo, se necesitan estudios preclínicos para estas nuevas tecnologías de implantes para validar su funcionalidad a largo plazo y su perfil de seguridad para su traslación a pacientes humanos. En este contexto, los modelos porcinos se emplean habitualmente en el desarrollo de dispositivos médicos debido a su gran tamaño de órganos y a su fácil manejo de los animales. Sin embargo, solo unas pocas aplicaciones cerebrales están descritas en la literatura, principalmente debido a las limitaciones de la cirugía y la integración del sistema de implantes en un animal vivo.
Aquí, reportamos el método para la implantación a largo plazo (6 meses) y la evaluación de matrices de ECoG blandas en el modelo minipig. El estudio presenta en primer lugar el sistema de implante, que consiste en una matriz de electrodos microfabricados blandos integrada con un puerto transdérmico polimérico compatible con imágenes de resonancia magnética (IRM) que alberga conectores de instrumentación para registros de electrofisiología. A continuación, el estudio describe el procedimiento quirúrgico, desde la implantación subdural hasta la recuperación del animal. Nos centramos en la corteza auditiva como un ejemplo de área objetivo donde los potenciales evocados son inducidos por la estimulación acústica. Finalmente describimos una secuencia de adquisición de datos que incluye resonancia magnética de todo el cerebro, caracterización electroquímica del implante, electrofisiología intraoperatoria y de movimiento libre, y tinción inmunohistoquímica de los cerebros extraídos.
Este modelo se puede utilizar para investigar la seguridad y la función del diseño novedoso de prótesis corticales; Estudio preclínico obligatorio para prever la traslación a pacientes humanos.
Introducción
Las deficiencias neurológicas y las enfermedades se pueden diagnosticar o tratar mediante matrices de electrocorticografía (ECoG). Estas rejillas de electrodos se implantan en la superficie del cerebro y permiten el registro o la estimulación de la cortezahumana. En el caso de la epilepsia farmacorresistente, por ejemplo, ayudan a delinear la región epiléptica a resecar2. En aplicaciones a largo plazo, como las interfaces cerebro-ordenador, estos electrodos epicorticales se utilizan para registrar la intención de movimiento del cerebro, para controlar las extremidades robóticasde los pacientes paralizados. Sin embargo, las rejillas de electrodos actuales están hechas de bloques metálicos rígidos incrustados en sustratos poliméricos rígidos y no responden a la necesidad de registros cerebrales de alta resolución y biointegración subdural a largo plazo (>30 días). Más bien, crean reacciones tisulares locales que conducen a la encapsulación fibrótica del dispositivo implantado, lo que conduce a un peor rendimiento con el tiempo. Recientemente, se han propuesto matrices de electrodos flexibles o estirables que utilizan sustratos poliméricos delgados fabricados mediante técnicas de microfabricación para lograr un alto rendimiento en implantes a largo plazo al limitar la reacción tisular 4,5. Sin embargo, se necesitan estudios preclínicos para estas nuevas tecnologías de implantes para validar su funcionalidad y perfil de seguridad a largo plazo, de modo que se pueda prever la traducción a pacientes humanos. En este contexto, los modelos de minicerdos y cerdos se emplean rutinariamente en el desarrollo de dispositivos en otros contextos médicos (por ejemplo, los sistemas cardiovascular, esquelético o gástrico) debido a su gran tamaño de órganos y fácil manejo de animales 6,7,8. Sin embargo, en la literatura solo se describen unas pocas aplicaciones dirigidas al cerebro para la neurofisiología, principalmente debido a las limitaciones del abordaje quirúrgico y a la integración del sistema de implantes en un animal vivo 9,10,11,12. A menudo no son compatibles con la implantación crónica en animales vivos, ya que requerirían, por ejemplo, el desarrollo de hardware complejo, como la electrónica integrada implantable. Además, no investigan la influencia del sistema implante en el tejido diana, lo cual es crucial para el aspecto de bioseguridad en los estudios traslacionales. El modelo porcino es cercano a la anatomía humana en términos de estructura cortical, hueso del cráneo y grosor de la piel13. Además, su capacidad para aprender tareas conductuales los convierte en un poderoso modelo para investigar estrategias de rehabilitación funcional o percepciones sensoriales14.
La traslación de las nuevas tecnologías y terapias a los seres humanos requiere la evaluación de la seguridad y la eficacia, tal y como exigen las autoridades médicas competentes. Por lo general, se describen en documentos técnicos y normas15, sin embargo, solo requieren la superación de estas pruebas y no investigan el efecto real de la implantación del dispositivo ni la recopilación de otros datos útiles en paralelo al estudio de seguridad. Para un estudio completo de bioseguridad y rendimiento en el cerebro, presentamos aquí una recopilación longitudinal y sistemática de datos de imágenes cerebrales, mediciones electrofisiológicas, evaluación de las propiedades electroquímicas de los electrodos implantados e histología postmortem en un modelo porcino. Para lograr esto, es necesario considerar varios aspectos, con el fin de crear un modelo experimental completo: (i) acceso quirúrgico mínimamente invasivo para la implantación del dispositivo junto con un puerto transdérmico mecánicamente estable para conectarse a los electrodos, (ii) un paradigma de registro electrofisiológico robusto que sirva como salida de rendimiento para los electrodos implantados tanto bajo anestesia como en condiciones de movimiento libre, (iii) imágenes in vivo (tomografía computarizada [TC] y/o resonancia magnética [RM]) en diferentes momentos para seguir la evolución del cerebro y del implante, así como la compatibilidad del sistema implantado con el equipo de imagen, y (iv) una tubería de preparación de tejido para extraer el cerebro para su análisis histológico.
Aquí, informamos sobre el método para la implantación a largo plazo (6 meses) y la evaluación de matrices de ECoG blandas en el modelo minipig (que se muestra esquemáticamente en la Figura 1). Las matrices de electrodos blandos se presentaron en nuestros informes anteriores y están hechas de membranas delgadas de silicona que incorporan películas delgadas elásticas de oro utilizadas como pistas eléctricas16,17. El contacto con el tejido se realiza a través de una mezcla de nanopartículas de platino incrustadas en una matriz de silicona para una interfaz electroquímica suave y eficiente con el tejido cerebral18. Los implantes se conectan a través de un cable flexible tunelizado subduralmente a través del cráneo y la piel hasta un puerto transdérmico que alberga los conectores en la cabeza del animal. El tamaño y la forma del implante se pueden personalizar según el objetivo y las necesidades del estudio. Las tiras de electrodos actuales en este estudio reflejan el tamaño real de las tiras clínicas. Se utilizaron tiras y rejillas subdurales clínicamente disponibles como comparadores utilizando el mismo enfoque. El puerto transdérmico compatible con resonancia magnética polimérica se coloca en el cráneo mediante un sistema de placa para los pies que lo ancla firmemente al cráneo. Aquí, describimos en detalle el procedimiento quirúrgico, desde la implantación subdural de ambos hemisferios hasta la recuperación del animal. Nos centramos en la corteza auditiva como área objetivo de ejemplo, donde los potenciales evocados son inducidos por la estimulación acústica tanto en condiciones de anestesia como de movimiento libre. En diferentes momentos, se obtienen imágenes del cerebro del animal en una resonancia magnética (o TC para los electrodos clínicos) bajo anestesia y se miden las propiedades electroquímicas de los electrodos. Los métodos de caracterización de electrodos se utilizan para seguir la evolución del implante y la interfaz electrodo-tejido (ver Schiavone et al.19 para más detalles). Estos incluyen cronoamperometría para sondear las capacidades de estimulación del contacto del electrodo, espectroscopia de impedancia electroquímica (EIS) que puede indicar la evolución de los componentes resistivos y capacitivos del electrodo, y mediciones de resistencia entre canales para sondear fallas de encapsulación hermética. Por último, hemos desarrollado una tubería de extracción de tejido para perfundir el cerebro después de la eutanasia, explantarlo con los electrodos colocados, seccionarlo y realizar análisis histológicos utilizando diferentes marcadores de inflamación. En general, este método permitirá realizar estudios preclínicos con una sólida recopilación de datos multimodales para la futura traslación clínica de nuevas tecnologías y terapias en el cerebro.
Protocolo
Los procedimientos quirúrgicos y conductuales fueron aprobados por el comité de ética local de acuerdo con las directrices para el cuidado y uso de animales de laboratorio y aprobados por las autoridades veterinarias locales (Cantón de Ginebra) y federales (Suiza) con el número de autorización GE11120A. En este estudio se utilizaron minicerdos hembra de Göttingen (n = 7) de 2-6 meses de edad (5-8 kg).
1. Planificación prequirúrgica
- Caracterización in vitro del sistema de implantes blandos
- Cronoamperometría: Registre la caída de voltaje tras la inyección de una evolución de pulso de corriente bifásica (es decir, el transitorio de voltaje [VT]) utilizando un osciloscopio conectado en paralelo a un generador de pulsos. Conecte el generador de impulsos secuencialmente a cada electrodo y a un contador de platino en solución salina (solución salina tamponada con fosfato [PBS] 1x). Consulte el paso 3.1 para conocer la configuración.
- Espectrograma de impedancia electroquímica: Mide la impedancia electroquímica a diferentes frecuencias utilizando un potenciómetro. Conecte el potenciómetro secuencialmente a cada electrodo utilizando el contador de platino y un electrodo de referencia Ag/AgCl en solución salina (PBS 1x). Consulte el paso 3.2 para conocer los ajustes.
- Resistencia entre canales: En estado seco, mida la resistencia de corriente continua (CC) entre canales adyacentes con un multímetro de mano.
- Selección del implante: Después de las tres mediciones citadas anteriormente, seleccione el implante junto con los siguientes criterios: impedancia a 1 kHz por debajo de 100 kΩ y sin resistencia entre canales por debajo de 1 MΩ.
- Esterilización
- Esterilización de implantes: Coloque los implantes seleccionados individualmente en bolsas de esterilización junto con un marcador de esterilización y séllelos. Emplee doble embalaje para garantizar la esterilidad durante la cirugía.
NOTA: En este caso, se utiliza la esterilización con gas peróxido de hidrógeno (H2O2) debido al corto ciclo de tiempo y a la baja temperatura (55 °C). Las alternativas son el gas óxido de etileno (ETO) o la esterilización en autoclave, pero debe garantizarse la compatibilidad con el sistema de implantes. - Esterilización de instrumentos: Coloque los instrumentos limpios en bolsas de esterilización dobles o cajas de instrumentos estériles junto con marcadores de esterilización. La esterilización en autoclave es más común para los instrumentos,pero H 2 O2 o ETO son alternativas posibles.
- Esterilización de implantes: Coloque los implantes seleccionados individualmente en bolsas de esterilización junto con un marcador de esterilización y séllelos. Emplee doble embalaje para garantizar la esterilidad durante la cirugía.
2. Implantación quirúrgica de matrices ECoG blandas
- Anestesia
- Premedicación: Aislar al animal y ayunarlo durante la noche. Inyectar una mezcla de midazolam a 0,75 mg/kg, atropina a 0,25 μg/kg y haldol a 0,1 mg/kg por vía intradérmica, y esperar hasta que el animal esté sedado. Pesa al animal antes de continuar.
- Instalación de electrodo intravenoso (IV):
- Coloque al animal en la mesa de cirugía sobre una almohadilla térmica. Inducir la anestesia colocando una mascarilla en el animal, utilizando sevoflurano al 3%-3,5%.
- Coloque electrocardiogramas en el abdomen, un sensor de saturación de sangre en la cola y un sensor de temperatura en la fosa nasal.
- Coloque un cable intravenoso en una vena del oído y confirme el acceso a la sangre con una jeringa llena de solución salina. Asegúrese de que los ojos se mantengan hidratados con un ungüento.
- Intubación: Inyectar un bolo de atracurio a 0,5 mg/kg, ketamina a 1 mg/kg y fentanilo a 1-2 μg/kg. Coloque al animal boca arriba para la intubación. Inserte un tubo de 4,5 mm.
- Medicación: Después de la intubación, suspender la anestesia con sevoflurano e instalar una infusión de propofol a 10 mg/kg/h, fentanilo a 2 μg/kg/h, atracurio a 0,2-0,5 mg/kg/h y solución salina a 4-7 mg/kg/h. Iniciar una infusión de manitol a 1 g/kg/h para reducir la inflamación cerebral durante la cirugía.
NOTA: Se puede utilizar un régimen de analgesia multimodal si lo recomienda el comité local de ética animal.
- Radiografía preoperatoria
- Coloca al animal sobre su abdomen en la posición de la esfinge. Retire temporalmente cualquier objeto metálico que se encuentre cerca del cerebro y el cráneo del animal (p. ej., la temperatura de la fosa nasal).
- Adquirir una radiografía de plano axial y sagital con contraste del hueso. Coloque un objeto metálico con dimensiones conocidas en el campo de adquisición sagital para que sirva como escala para medir el grosor del cráneo en la parte delantera y posterior del cerebro.
- Identifique la ubicación de los senos frontales (visibles por los huecos debajo del cráneo) y marque la ubicación más posterior en la cabeza del animal con un marcador permanente. Esto indicará el punto más lejano donde se puede realizar cualquier craneotomía o colocación de tornillos en el abordaje quirúrgico que se describe a continuación.
- Campo aséptico y preparación de la piel: Afeitar toda la superficie de la cabeza más allá del campo quirúrgico. Con una almohadilla estéril, frote bien la cabeza con betadine. A continuación, coloque paños estériles en la mesa de instrumentación y en el animal para revelar solo la ventana quirúrgica. Por último, vuelva a frotar la cabeza con una almohadilla estéril con betadine.
- Craneotomía y durotomía
- Corte en la piel: Incida la piel con un bisturí a lo largo de la línea media. Separe el músculo y el periostio (25 mm lateralmente del bregma en ambos lados y 40 mm anterior y posterior al bregma) del hueso con un raspador y coloque separadores para obtener un acceso óptimo para la perforación posterior.
- Medidas y marcado: Identifique bregma y lambda, y márquelos con una pluma quirúrgica estéril (Figura 2A, B). Con una regla estéril, defina el contorno del colgajo óseo centrado alrededor del objetivo de implantación en ambos hemisferios. En este caso específico, se eligió la corteza auditiva, con coordenadas de -5 mm a -15 mm del bregma y de -4 mm a -20 mm lateralmente. A continuación, ajuste la craneotomía al tamaño del implante y a los puntos de referencia anatómicos, limitando el tamaño de la abertura.
- Craneotomía:
- Con un taladro de hueso con una broca de corte redonda, taladre el contorno de la craneotomía, teniendo en cuenta el grosor del cráneo medido en el paso 2.2. Riegue el lugar de perforación con solución salina para evitar el sobrecalentamiento del hueso.
- Taladre con cuidado el contorno de manera homogénea hasta llegar a la duramadre. En el primer avance, termine de perforar el contorno hasta que se haya adelgazado lo suficiente como para casi romperse. Luego, use una espátula plana (ya sea en el lado de la línea media o en el lado lateral) para romper el colgajo óseo en una sola pieza, usando el borde de la craneotomía como palanca. Si se encuentra demasiada resistencia, continúe adelgazando el hueso.
- Coloque la pieza de hueso en solución salina estéril.
- Una vez que se retira el colgajo óseo, corte con cuidado el borde de la craneotomía, usando un Kerison para evitar que el borde afilado del hueso corte la duramadre.
- Si se encuentra un sangrado excesivo en la duramadre o en el hueso, use Gelfoam o cera para huesos, respectivamente. Coloque una compresa húmeda (almohadilla estándar en solución salina estéril) en la craneotomía y repita este paso en el otro hemisferio (Figura 2B).
- Durotomía:
- Con la aguja de un kit de sutura 6-0, perfore y levante con cuidado la duramadre en el extremo anterior o posterior de la craneotomía a medio camino entre el lado medial y lateral y cree el comienzo de una incisión con el cuchillo punzante.
- Luego, usando una pequeña espátula plana insertada en el espacio subdural que actúa como base de corte para proteger la corteza, crea una hendidura anteroposterior en la duramadre avanzando simultáneamente con ambas herramientas. Asegúrese de que la hendidura sea ligeramente más grande que el ancho del implante (Figura 2C). Si se produce algún sangrado o daño en este paso, cúbralo con espuma de gel y espere hasta que se detenga.
NOTA: La trayectoria de la hendidura debe adaptarse si hay vasos sanguíneos grandes en la duramadre para evitar el sangrado.
- Implantación
- Inserción del dispositivo:
- Irrigar el implante (Figura complementaria 1A) con solución salina en ambos lados para que se deslice más fácilmente en el espacio subdural. Coloque el implante por encima de la hendidura de la duramadre y, con pinzas pequeñas, inserte subduralmente el dispositivo deslizándolo secuencialmente en cada borde.
- Sujete con cuidado el extremo del pedestal del dispositivo y avance con el implante para no crear tensión que dificulte la inserción. Cuando el borde del conector esté ubicado en la parte superior de la ranura, detenga la inserción.
- Asegure el implante: Para asegurar el implante en su lugar, coloque un puente de titanio sobre el cable después del borde de la craneotomía o en las alas de anclaje y asegúrelo con uno o dos tornillos de titanio con el destornillador adecuado (Figura 2D).
- Colocación en el suelo: Retire con cuidado 1 cm del aislamiento de los cables de tierra e insértelo por vía epidural en el extremo posterior de la craneotomía (o en cualquier ubicación epidural lejos de la corteza de interés o de los vasos sanguíneos grandes) (alambre en la Figura 2E)
- Repita los pasos 2.4.4. y 2.5.1.-2.5.3 en el hemisferio contralateral.
- Radiografía intraoperatoria para confirmar la colocación:
- Coloque una almohadilla húmeda (almohadilla estándar en solución salina estéril) sobre el lugar de la cirugía para mantener el tejido hidratado. A continuación, coloque un paño quirúrgico estéril para cubrir la cabeza del animal.
- Tome imágenes de rayos X planos (axiales y sagitales) para asegurarse de que los implantes estén bien colocados y no estén doblados, utilizando los marcadores de rayos X como indicadores. Si no es así, retire el paño y explante el dispositivo para volver a insertarlo (siga los pasos 2.4.4. y 2.5.1.-2.5.3 nuevamente).
- Cierre de la duramadre: Sutura la duramadre con cuidado alrededor del cable del implante utilizando una sutura reabsorbible 3-0 y un pequeño portaagujas. Junte los dos bordes de la duramadre tanto como sea posible sin rasgar la membrana delgada con el alambre de sutura (Figura 2D, E).
- Colocación del colgajo óseo: Fije un puente de titanio en la parte anterior y posterior de cada colgajo óseo con un tornillo de titanio. Tenga cuidado de planificar la colocación de los puentes en Ti con respecto a la colocación de las patas del reposapiés en los siguientes pasos. Atornille el extremo de los puentes de titanio al cráneo (Figura 2F, G).
- Inserción del dispositivo:
- Colocación del pedestal y del reposapiés
- Posicionamiento: En esta configuración, el reposapiés tiene seis patas con dos orificios para tornillos cada una (Figura complementaria 1B). Planifique la colocación del reposapiés en el cráneo para optimizar la ubicación de los tornillos (evite colocarlos en el borde de la craneotomía o en el músculo temporal). Omita los agujeros en las patas si no se pueden atornillar.
- Fijación del reposapiés: Atornille los tornillos de titanio del reposapiés hasta que esté firmemente en su lugar (consulte la Figura 2H).
- Colocación del pedestal: Retire los puentes de titanio sobre los cables de conexión y voltee el pedestal para aterrizar en el reposapiés. Atornille el pedestal en el reposapiés. Verifique que el pedestal esté firmemente en su lugar (Figura 2I).
- Sutura y cierre
- Limpieza de la herida: Limpie el espacio subcutáneo de cualquier hueso u otros desechos enjuagando con solución salina. Corta un poco de piel alrededor de los bordes del pedestal para crear un borde redondo siguiendo el cilindro.
- Suturas subcutáneas: Retire los separadores y doble los colgajos de piel juntos. Cree suturas subcutáneas con un alambre de sutura 4-0 no reabsorbible, a 3 mm de distancia, utilizando suturas interrumpidas simples o suturas continuas simples. Comience alejándose del pedestal, moviéndose hacia él a ambos lados de la incisión.
- Suturas dérmicas: Suturar la piel con un alambre de sutura 6-0 no reabsorbible, con suturas separadas por 5 mm. Comience alejándose del pedestal, moviéndose hacia él a ambos lados de la incisión. Tenga cuidado de lograr una buena aposición del tejido entre los dos colgajos de piel y cerca del borde del pedestal para evitar un vacío (Figura 2J).
- Apósito para heridas: Limpie el área de la herida nuevamente con una almohadilla estéril y betadine. Aplique un vendaje estéril autoadhesivo sobre la herida.
- Mediciones in vivo: Para mediciones in vivo , siga las secciones 3, 4 y 5.
- Despertar: Después de que se hayan realizado todas las mediciones, retire al animal de todos los anestésicos, pero manténgalo bajo ventilación. Para la analgesia, aplicar un parche de buprenorfina (25 mg/h) durante 24 h. Coloque al animal en una almohadilla térmica cubierta con cortinas para acelerar la hora de despertarse. Cuando se recupere la respiración espontánea, extubar al animal y ponerlo bajo una máscara facial de oxígeno hasta que se recupere la conciencia (lo que puede tardar de 1 a 4 h).
- Cuidados postoperatorios del animal: Durante 5 días, mantenga al animal bajo estrecha vigilancia. Administre una dosis de cefalexina de 75 mg dos veces al día con alimentos, separados de otros animales. Lleve a cabo la desinfección de la herida diariamente aplicando grandes cantidades de betadine con almohadillas estériles empapadas (es mejor hacerlo durante la alimentación).
NOTA: Cuidados y alojamiento a largo plazo: El animal operado se mantiene aislado durante 24 h. Se devuelve a su grupo social original si el animal está lo suficientemente bien como para interactuar socialmente con sus compañeros. Es necesario realizar una observación diaria del pedestal y de la abertura de la piel para seguir la integración del dispositivo en la cabeza. Cuando sea apropiado, limpie la ubicación alrededor del pedestal con grandes cantidades de betadine.
3. Caracterización in vivo del implante blando
- Cronoamperometría: Registre la caída de voltaje tras la inyección de una evolución de pulso de corriente bifásica (es decir, el VT) utilizando un osciloscopio conectado en paralelo a un generador de pulsos. Conecte el generador de pulsos secuencialmente a cada electrodo y al cable de tierra. Realice el pulso de estimulación a 100 μA con un ancho de pulso de 300 μs a 100 Hz.
- Espectroscopía de impedancia electroquímica: Mide la impedancia electroquímica a diferentes frecuencias utilizando un potenciómetro. Conecte el generador de pulsos secuencialmente a cada electrodo, utilizando el cable de tierra como contraelectrodo y tierra. Ajuste el voltaje de excitación a 200 mV y el rango de frecuencia de 1 Hz a 1 MHz, con tres puntos por década.
- Mediciones cortas entre canales: Mida la resistencia de CC entre canales adyacentes con un multímetro de mano. In vivo, la resistencia de CC entre canales solo se mide para verificar que no aparezcan faltantes por debajo de 1 kΩ, lo que indica una falla total de encapsulación.
4. Registro electrofisiológico
- Actividad espontánea: Conecte el sistema de grabación inalámbrico a través del pedestal y registre la actividad de referencia durante 2-3 minutos. Estas grabaciones servirán como control para analizar los potenciales evocados auditivos.
- Potenciales evocados auditivos: Además del sistema inalámbrico, inserte altavoces en un campo cerrado en los oídos de los animales. Estimulación acústica en ráfagas de tonos de reproducción a diferentes frecuencias (que van desde 200-20.000 Hz) a un nivel de presión sonora (SPL) de alrededor de 70 dB durante 120 repeticiones. Luego, promedie las grabaciones y alinéelas durante el período de estímulo para su análisis.
- Potenciales evocados sensoriales: Coloque las agujas en el hocico en tres posiciones diferentes. Evocar potenciales sensoriales estimulando el hocico durante ~30 s con el generador de pulsos a diferentes amplitudes para obtener las curvas de reclutamiento.
5. Imágenes in vivo
- Transporte de animales: Mantener al animal bajo anestesia con propofol, como se describe en el paso 2.1. Use un carro de transporte que contenga un ventilador, una bomba de jeringa y un monitor de signos vitales para transportar al animal desde la sala de cirugía hasta las instalaciones de diagnóstico por imágenes y viceversa.
- Tomografía computarizada de rayos X: Coloque al animal en la mesa del escáner y retire cualquier objeto metálico alrededor de la cabeza (por ejemplo, el sensor de temperatura). Adquiera una tomografía computarizada con la resolución más pequeña (0,4 mm de grosor de corte) mediante la adquisición isométrica con selección automática de corriente y voltaje para el contraste óseo.
- Imágenes por resonancia magnética: Retire todo el equipo que contenga metal del animal (use cables intravenosos y tubo de intubación compatibles con resonancia magnética). Mantener al animal ventilado y anestesiado bajo sevoflurano al 3%-3,5%, utilizando un ventilador situado fuera de la cámara de resonancia magnética y conectado al animal a través de un tubo largo. Antes de la primera secuencia, inyectar un bolo de fentanilo a 1-2 μg/kg. Utilice tres secuencias isométricas con la resolución más pequeña: secuencias ponderadas por T1, T2 y eco de espín turbo (TSE) (los parámetros se muestran en el Archivo Suplementario 1).
6. Grabación de movimiento libre
- Siga el mismo procedimiento descrito en la sección 4 para registrar las señales de vigilia del cerebro. Conecte el headstage inalámbrico sosteniendo al animal en los brazos del experimentador o alimentándolo con golosinas para distraerlo. Proporcionar la estimulación acústica mediante altavoces externos colocados cerca del animal.
7. Perfusión y preparación de tejidos
- OPCIONAL: Si el animal aún no está bajo anestesia, siga el paso 2.1 para el protocolo de anestesia.
- Inserción de un catéter en la arteria carótida para perfusión (Figura complementaria 2)
- Disección de la arteria carótida y la vena yugular: corte la garganta en la línea media con un cauterizador/cortador. Cortar primero la piel y luego el músculo siguiendo la línea blanca media (sin vasos debajo) (Figura complementaria 2A).
- Ábralo más, usando los dedos para hacer espacio alrededor de la tráquea y debajo del músculo. Busca la arteria carótida (latiendo y rosada); El nervio vago a veces también está alrededor (blanco), y la vena yugular puede estar debajo o a un lado (rojo). Coloque los esparcidores (ver Figura complementaria 2B).
- Comience la disección de la arteria carótida con pinzas finas y tijeras redondas. Use tijeras para abrir el tejido conjuntivo. Si no hay vasos sanguíneos, cortar; si hay vasos sanguíneos, cauterizar y avanzar (Figura suplementaria 2C, D). Cuando esté lo suficientemente diseccionado, use una pinza para pasar por debajo de la arteria carótida para que quede completamente aislada (Figura complementaria 2E).
- Repita la misma operación con la vena yugular (Figura complementaria 2F).
- Cuando ambos vasos estén completamente diseccionados y aislados, coloque alambre de sutura alrededor de ellos. No los cierres todavía. En la Figura complementaria 2G se muestran dos suturas alrededor de la carótida, una en la base (sutura 1 del lado del corazón para la perfusión cerebral) y otra en el otro lado (sutura 2).
- Coloque una sutura alrededor de la vena yugular (sutura 3), no cerrada; Marque los cables con cinta adhesiva para seccionar la vena más tarde.
- Cierre la sutura 1 con mucha firmeza, de lo contrario sangrará (Figura complementaria 2H). Haz tres nudos. Coloque una abrazadera en el alambre para poner peso y crear tensión en la arteria carótida.
- Pinzar la arteria carótida con una pinza vascular en el lado opuesto de la disección de la arteria carótida (lado del cerebro para la perfusión cerebral; Figura complementaria 2I). La sutura 2 está en el medio, aún no está cerrada.
- Use pinzas negras para atrapar y tirar de la arteria carótida. Con unas tijeras finas, corte la mitad de la arteria carótida cerca de la base de la disección (cerca de la sutura 1, lado del corazón; véase la figura complementaria 2J). Asegúrese de que la sección esté lo más ordenada posible y llegue a la embarcación en sí, no solo a la "funda"; de lo contrario, el catéter no pasará. Inserte el catéter como se muestra en la Figura complementaria 2K.
- Enjuague y llene el catéter, primero con PBS, para que no quede aire en el catéter (recuadro de la Figura 2K suplementaria ).
- Cierre la sutura 2 con la suficiente firmeza para que no desaparezca, pero no demasiado como para que el catéter aún pueda moverse un poco (Figura complementaria 2L). Luego, retire la pinza del vaso, termine de insertar el catéter lo más lejos posible y finalice el cierre de la sutura 2 (cierre firmemente).
- Si lo desea, use alambres de sutura en la sutura 1 para unir la base del catéter a la piel a la salida de la herida como un paso de seguridad adicional. Luego, transfiera al animal a la zona de perfusión y conéctelo a PBS/heparina. Cuando comience la perfusión, tire de la sutura 3 y corte la vena yugular
- Eutanasia: Administrar pentobarbital (90 mg/kg) por vía intravenosa y enjuagar la vía con solución salina para asegurarse de que la dosis completa se administra con éxito.
- Perfusión: Con una bomba de perfusión (200 ml/min) enchufe el catéter carotídeo en PBS/heparina (1 L para un cerdo de 15 kg) y luego en PBS que contenga un 4% de paraformaldehído (PFA) (5 L para un cerdo de 15 kg). Cuando comience la perfusión, tire de la sutura 3 y corte la vena yugular.
- Recolección de tejidos
- Decapitación: Una vez terminada la perfusión, separar la cabeza del animal del cuerpo con un bisturí, cortando la piel y el músculo e insertando la cuchilla entre la primera y la segunda vértebra.
- Postfijación: Sumergir la cabeza en PFA al 4% en PBS durante otras 48 h a 4 °C y luego transferir a PBS antes de la extracción cerebral.
- Extracción de cerebro e implantes:
- Retire la piel con un bisturí y comience a cortar el hueso con cuidado con un rongeur comenzando desde las primeras vértebras, siguiendo la médula espinal hasta el cerebelo. Una vez que el cerebelo esté expuesto, retire con cuidado los huesos temporales y exponga los lóbulos parietal y frontal.
- En este punto, atornille el pedestal del reposapiés y corte los pies del reposapiés con unos alicates. Retire el hueso cerca de la entrada del cable en el cráneo para liberar el sistema de implantes del hueso, sin tirar de los implantes fuera de la salida de la duramadre.
- Si los cables del implante están incrustados en el hueso, corte el cable lo más cerca posible de la salida. Una vez que haya suficiente superficie cerebral expuesta, corte con cuidado la duramadre siguiendo la línea media con unas tijeras pequeñas.
- Libere los cables del implante de la salida de la duramadre. Tome fotografías de la colocación del implante en el cerebro. Luego, use una cuchara pequeña para separar el cerebro de los nervios craneales que se encuentran debajo. Extrae cuidadosamente el cerebro. Retirar los implantes del cerebro.
- Postfijación del cerebro: Dependiendo de la calidad de la perfusión, postfijar el cerebro extraído de nuevo durante 24 h en PFA al 4% en PBS a 4 °C. Mantener en 0,1 M PBS a 4 °C hasta que se corte el cerebro.
- Corte de cerebro: Separe los dos hemisferios con una cuchilla de afeitar. Luego, corta el cerebro ortogonalmente en cuatro piezas diferentes. Cortar la zona implantada por la mitad para obtener dos bloques que contengan la zona implantada y un área de control. Guarde los otros dos bloques si se necesitan más guías de control.
- Crioprotección y congelación cerebral: Transferir los bloques cerebrales a una solución de 15% de sacarosa primero y luego 30% de sacarosa a 4 °C hasta que el cerebro se sumerja y alcance el equilibrio. A continuación, congele el tejido en isopentano a -55 °C en un sistema de congelación de tejidos.
8. Histología
- Seccionamiento de tejidos
- Criostato: Coloque el cerebro congelado en un criostato y recorte hasta lograr secciones completas. A continuación, corte el cerebro en secciones de 40 μm y sumérjalo en grupos de tres en 0,1 M PBS en placas de pocillos. Observe cuidadosamente el orden de los platos.
- Selección de secciones: Seleccione las secciones en función de la zona a analizar (región implantada o zona de control). Saque las secciones secuencialmente de las placas de los pocillos, usando un cepillo fino para inspeccionarlas en busca de daños. Colóquelos en placas de pocillos nuevas llenas de 0,1 M de PBS para una mayor tinción.
- Inmunohistoquímica
- Preparación: Incubar las secciones en Triton X/PBS al 0,3% durante 15 min, seguido de albúmina sérica bovina (BSA)/PBS al 3% durante 1 h a temperatura ambiente (RT).
- Anticuerpos primarios: Incubar los tejidos con anticuerpos primarios durante 48 h a RT (anti-GFAP, rata, diluido a 1/300; anti Iba1, conejo, diluido a 1/400; anti-NeuN, cobayo, diluido a 1/1.000; todo en BSA/PBS al 1%). Cubra las placas de los pocillos con papel de aluminio.
- Lavado: Lavar los pocillos con 0,1 M PBS tres veces durante 5 min.
- Anticuerpos secundarios: Incubar los tejidos con anticuerpos secundarios durante 2 h en RT (Alexa Fluor 488, Alexa Fluor 647, Alexa Fluor 555; todos diluidos a 1/400 en BSA/PBS al 1%).
- DAPI (4′,6-diamidino-2-fenilindol): Incubar los tejidos con DAPI durante 15 min (1/1.000 en BSA/PBS al 1%).
- Lavado: Lavar los pocillos con 0,1 M PBS cinco veces durante 15 min.
- Montaje: Monte las guías con medios de montaje y un cubreobjetos. Mantenga las diapositivas en la oscuridad en una nevera a 4 °C.
- Imagenológico
- Imágenes de portaobjetos completos: Visualice los portaobjetos con un aumento de 10x (valor de la distancia de trabajo objetiva = 3.100 μm) utilizando un microscopio de escáner de portaobjetos en tres longitudes de onda diferentes (640 nm, 560 nm, 485 nm). Toda la información sobre potencia y ganancia se puede encontrar en el Archivo Suplementario 2.
- Imágenes microscópicas: Obtenga imágenes de la región de interés con un aumento de 20x (apocromático 20x/0,8 M27) utilizando un microscopio confocal en cuatro longitudes de onda (Alexa Fluor 647, DAPI, Cy3, EGFP). Toda la información sobre potencia y ganancia se puede encontrar en el Archivo Complementario 3.
Resultados
Con el fin de confirmar la colocación (Figura 3A) y la funcionalidad de los dispositivos, se realizan registros electrofisiológicos intraoperatorios después de la colocación del pedestal. La señal basal se adquiere primero durante 2 minutos sin estímulos como control de la actividad basal. En segundo lugar, el animal es estimulado acústicamente con una ráfaga de tono a diferentes frecuencias (500-20.000 Hz), y los datos brutos se promedian durante el período de estímulo para mapear los potenciales evocados auditivos en toda la matriz (por ejemplo, a 800 Hz en comparación con la línea de base; Figura 3B). Los datos que se muestran aquí no están procesados, pero si hay demasiado ruido, se pueden aplicar filtros de muesca y paso de banda. Las fuentes típicas de ruido en el quirófano incluyen almohadillas térmicas, taladros tapados y succión o cauterizadores (entre otros) que deben retirarse antes de la adquisición. En las grabaciones de personas despiertas, se debe evitar el movimiento de los músculos grandes alrededor de la cabeza, como la masticación, para obtener conjuntos de datos más limpios.
Este protocolo se aplicó en cada punto de tiempo de grabación, y las señales de un solo canal se pudieron comparar a lo largo del tiempo. Un ejemplo se ilustra en la Figura 3C, que muestra la robustez y evolución de la respuesta. La capacidad de registro de cada contacto a lo largo del experimento puede evaluarse calculando la desviación estándar de la señal de referencia en cada punto de tiempo (Figura 3D). En este estudio, la relación señal-ruido disminuyó y se estabilizó entre el día 0 y el mes 6, a pesar de cierta variabilidad debido a la duración limitada del período de grabación (es decir, 2 min). Esto se puede correlacionar aún más con las impedancias de los electrodos.
Las imágenes in vivo se realizan en el postoperatorio para evaluar el estado del cerebro y la posición del implante. En la primera iteración del protocolo, no se realizaron radiografías intraoperatorias, lo que resultó en un dispositivo plegado, como se puede ver en la Figura 4A en una secuencia de RM ponderada en T1 (ver además la Figura 4B). No se observó ningún cambio de comportamiento en el animal, pero con el tiempo, esto resultó en una encapsulación fibrótica alrededor del dispositivo debido a la compresión macroscópica del cerebro alrededor de la ubicación del implante (Figura 4C). Después de esta experiencia, se introdujo la radiografía intraoperatoria, como se muestra en la Figura 4D, donde los marcadores radiopacos (barras negras visibles en el implante en el recuadro de la Figura 4D) se muestran bien posicionados. La superficie del cerebro está entonces intacta, como se puede observar en la resonancia magnética postoperatoria de la Figura 4E. En general, con este sistema de implante y pedestal, es posible obtener imágenes de todo el cerebro. Diferentes secuencias en los planos coronales permiten ver estructuras anatómicas (Figura 4F,G; Secuencias de resonancia magnética T1 y T2) o la presencia de líquido y sangre alrededor del implante (Figura 4H; Secuencia de resonancia magnética ponderada por EET). El sistema de pedestal casi no crea artefactos, a excepción de algunos pequeños huecos en contraste negro alrededor de los tornillos de titanio (ver Figura 4G). Además, los electrodos clínicos se utilizan como comparadores en este estudio, pero no se pueden obtener imágenes en la resonancia magnética debido a problemas de calentamiento y seguridad. Por lo tanto, las tomografías computarizadas se adquieren en estos animales, como se muestra en la Figura 4I. Los electrodos son claramente visibles y el sistema de pedestal no influye en la calidad de la imagen.
Después del período de implantación, el animal se perfunde y se extrae el cerebro. En este estudio, el análisis de la respuesta inflamatoria se realiza en cada hemisferio de forma independiente. Cortar el cerebro por la mitad es más fácil para la preparación del tejido antes de seccionarlo, y tiene la ventaja de que las secciones se pueden montar en portaobjetos de microscopía estándar. Un ejemplo de una muestra de cerebro se muestra antes (Figura 5A) y después (Figura 5B) de cortar en bloques. El contorno del implante es claramente visible y ha creado una pequeña abolladura en el cerebro. Al cortar en planos paralelos, el tejido ya está alineado con el criostato, y las secciones se pueden cortar fácilmente sin pérdida de tejido para el recorte (Figura 5C). Después de la tinción, se obtiene una imagen de toda la sección de tejido (Figura 5D), donde, por ejemplo, la capa de neuronas es claramente visible en detalle (ver marcador NeuN). Las secciones enteras son frágiles y a veces pueden conducir a la pérdida de tejido (ver la parte inferior de la Figura 5D), pero el área de interés está intacta. En una vista más cercana, gracias a las imágenes de microscopía confocal a 40x, las células están claramente definidas y permiten una investigación precisa de marcadores inflamatorios, por ejemplo (Figura 5E). Se pueden realizar más análisis de cuantificación para comparar la inflamación entre los hemisferios control y los implantados. La Figura 6 muestra la caracterización electroquímica de los electrodos implantados. La espectroscopia de impedancia electroquímica in vitro de la guía de electrodos blandos con módulo de impedancia y fase se muestra en la Figura 6A y el módulo de impedancia a 1 kHz durante 6 meses de implantación se muestra en la Figura 6B.
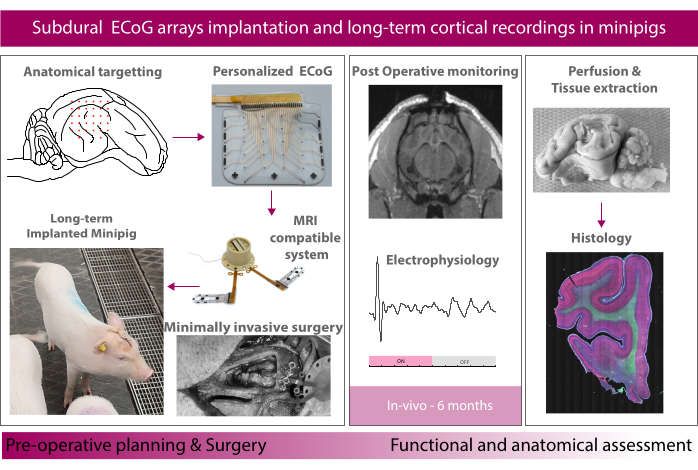
Figura 1: Esquema del experimento. Haga clic aquí para ver una versión más grande de esta figura.
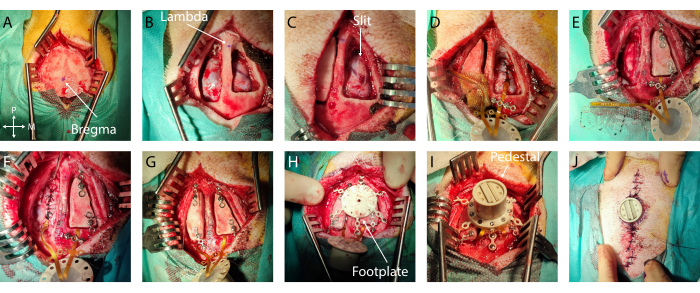
Figura 2: Implante mínimamente invasivo de ECoG blando en el cerebro . (A) Acceso quirúrgico al cráneo, con indicación de bregma. (B) Craneotomía bilateral con duramadre visible. (C) Durotomía de hendidura en el primer hemisferio. (D) Implantación subdural de ECoG blando y cierre de duramadre. (E) Durotomía de hendidura en el segundo hemisferio. Fijación del colgajo óseo en el primer hemisferio mediante puentes de titanio. (F) Implantación de ECoG blando en el segundo hemisferio y cierre de la duramadre. (G) Fijación del colgajo óseo en el segundo hemisferio. (H) Posicionamiento de la placa del pie en el cráneo. (I) Fijación del pedestal en el reposapiés. (J) Cierre de piel alrededor de la base del pedestal. Haga clic aquí para ver una versión más grande de esta figura.
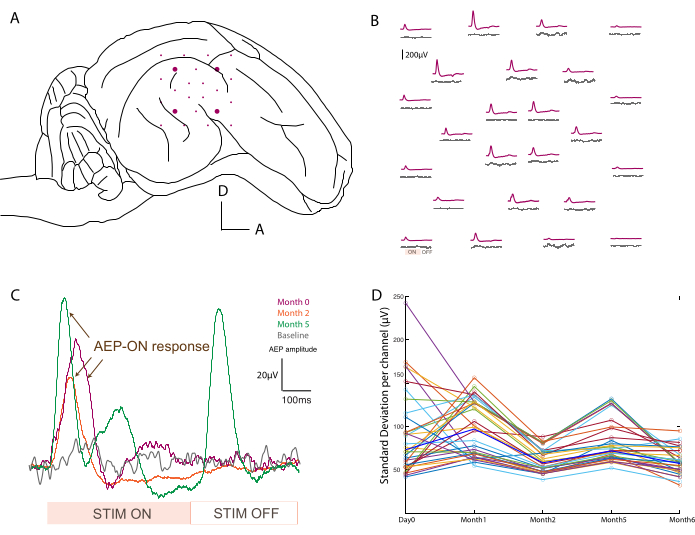
Figura 3: Registro de potenciales evocados auditivos . (A) Esquema de colocación de electrodos en la superficie del lóbulo temporal. (B) Mapeo representativo de la actividad basal (trazas grises) y potenciales evocados auditivos en respuesta a una estimulación de ráfaga tonal de 800 Hz (traza púrpura). Cada promedio corresponde a un canal en el conjunto de ECoG de software. El promedio se activa en la señal de entrada analógica de la estimulación de sonido. Los períodos de estimulación acústica "ON" y "OFF" se anotan en un canal en la parte inferior izquierda. (C) Evolución en el tiempo (día 0, mes 2 y mes 5) de una respuesta de un solo canal después de un estímulo acústico, en comparación con la señal basal cuando no se presenta ningún estímulo (gris). El promedio se activa en la señal de entrada analógica de la estimulación de sonido. Los períodos de estimulación "ON" y "OFF" se indican en la parte inferior. El potencial evocado de la estimulación "ON" está marcado con flechas. (D) Desviación estándar por canal (puntos de colores) por punto de tiempo de la grabación de la línea de base. Los valores medianos se representan en azul negrita. Haga clic aquí para ver una versión más grande de esta figura.
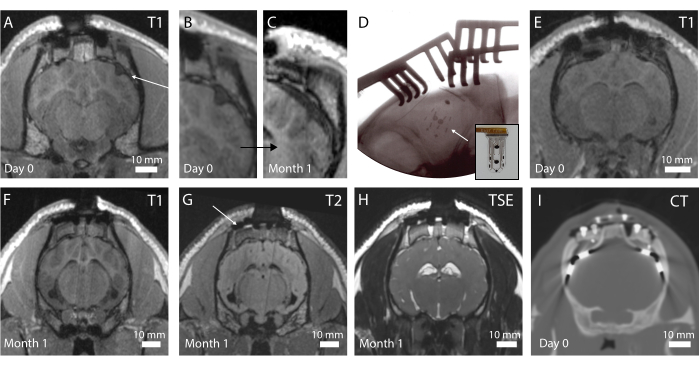
Figura 4: Imágenes in vivo del cerebro y electrodos implantados . (A) Resonancia magnética postoperatoria ponderada en T1 en el plano coronal. Una flecha indica un implante plegado. (B) Porción ampliada de A, donde el plegado del implante crea una abolladura en el cerebro. (C) Resonancia magnética ponderada en T1 a 1 mes de implantación, que muestra compresión del cerebro debido a la encapsulación fibrótica del cerebro en la misma ubicación que C. (D) Radiografía de plano intraoperatorio que verifica la colocación del implante y la ausencia de plegado, como se observa en la colocación del marcador radiopaco. Recuadro: Fotografía del implante con marcador radiopaco visible. (E) Resonancia magnética postoperatoria ponderada en T1 en el plano coronal con colocación óptima del implante. (F) Resonancia magnética ponderada en T1 a 1 mes de implantación. (G) Resonancia magnética ponderada en T2 a 1 mes de implantación. Una flecha muestra el artefacto de imagen de los tornillos de titanio que sujetan el reposapiés en su lugar en el cráneo. (H) Resonancia magnética ponderada por TSE a 1 mes de implantación. (I) Tomografía computarizada del animal implantado con los electrodos clínicos. Haga clic aquí para ver una versión más grande de esta figura.
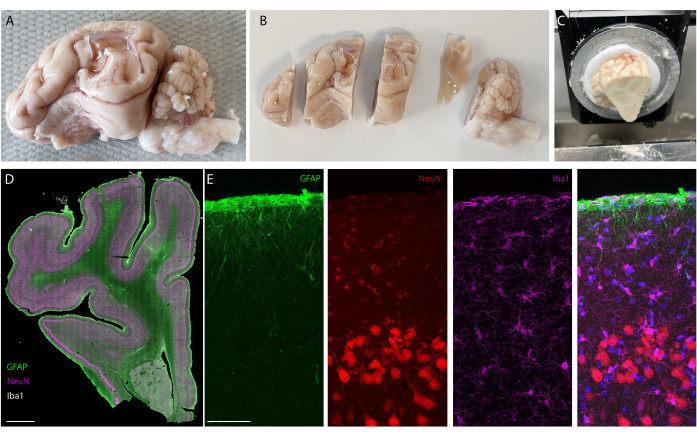
Figura 5: Análisis histológico del cerebro después de la implantación a largo plazo. (A) Fotografía de un hemisferio izquierdo cerebro-cerebro explantado y perfundido. (B) Cerebro perfundido cortado en bloques antes de la etapa de congelación. (C) Imagen de la configuración de seccionamiento de bloques completos en el criostato; Se pueden seccionar todos los "bloques precortados". (D) Inmunotinción de imágenes de todo el hemisferio (escáner de portaobjetos, objetivo de 20x) y (E) zoom en las primeras capas de la corteza (imagen confocal, objetivo de 40x) que muestra células gliales, astrocitos y neuronas. Haga clic aquí para ver una versión más grande de esta figura.
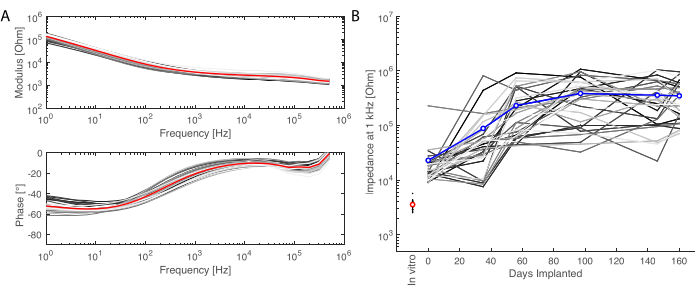
Figura 6: Caracterización electroquímica de los electrodos implantados. (A) Espectroscopía de impedancia electroquímica in vitro de la matriz de electrodos blandos (pequeñas líneas grises para cada canal, el promedio en rojo) con módulo de impedancia (arriba) y fase (abajo). (B) Evolución del módulo de impedancia a 1 kHz a lo largo de 6 meses desde el implante (media en azul; las líneas grises son los canales individuales; la medición in vitro se da como referencia en rojo). Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: Pedestal compatible con resonancia magnética. (A) Sistema de conexión transdérmica crónica compatible con RM (pedestal) para acceder a la guía de electrodos blandos. (B) Pedestal con electrodos montados en el reposapiés para el anclaje del cráneo. Recuadro: Detalles del reposapiés. Haga clic aquí para descargar este archivo.
Figura complementaria 2: Acceso quirúrgico para una perfusión óptima del cerebro. (A) Corte de piel y acceso a la ubicación de la arteria carótida y la vena yugular. (B) Disección del tejido alrededor de los vasos sanguíneos. (C,D) Identificación y disección del tejido alrededor de la arteria carótida y la vena yugular. (E) Aislamiento de la arteria carótida del tejido subyacente. (F) Aislamiento de la vena yugular del tejido inferior. (G) Colocación de alambre de sutura alrededor de la arteria carótida (sutura 1 y sutura 2) y la vena yugular (sutura 3). (H) Cierre de la sutura 3 en la base de la arteria carótida (lado del corazón) para evitar sangrado durante la apertura del vaso. (I) Pinzamiento de la arteria carótida en el lado opuesto a H. (J) Sección de la arteria carótida. (K) Se insertó un catéter en la abertura de J. Recuadro: Catéter cebado con solución salina que se enjuaga desde una jeringa hasta la punta del catéter. (L) Cierre de la sutura 2 para mantener el catéter en su lugar y a lo largo de la arteria. Haga clic aquí para descargar este archivo.
Archivo complementario 1: Parámetros para las secuencias de RM ponderadas en T1- (páginas 1-2), T2- (páginas (3-4) y ponderadas en TSE (páginas 5-6), respectivamente. Haga clic aquí para descargar este archivo.
Archivo complementario 2: Metadatos para el escáner de portaobjetos para la obtención de imágenes de portaobjetos completos de cortes de cerebro teñidos. Haga clic aquí para descargar este archivo.
Archivo suplementario 3: Metadatos para la obtención de imágenes confocales de la sección ampliada de cortes de cerebro teñidos. Haga clic aquí para descargar este archivo.
Discusión
Presentamos aquí un método para la implantación y evaluación a largo plazo de matrices ECoG blandas. En este estudio, hemos diseñado un enfoque quirúrgico consistente y mínimamente invasivo para la implantación bilateral de rejillas de electrodos funcionales sobre los lóbulos temporales (en este caso, dirigido a la corteza auditiva). En primer lugar, evaluamos la funcionalidad de la red mediante el registro exitoso de los potenciales evocados durante el transcurso del estudio (6 meses) y el seguimiento de las propiedades electroquímicas de los electrodos (ver Figura 6). En segundo lugar, evaluamos la bioseguridad de las rejillas, in vivo mediante el uso de resonancia magnética y el establecimiento de un sistema totalmente compatible con la resonancia magnética, y postmortem mediante el diseño de un protocolo para la recogida de tejidos y la inmunotinción.
Para minimizar la invasividad, optimizamos el tamaño de la ventana de craneotomía. Con el fin de llegar a la corteza auditiva situada en el lóbulo temporal y evitar la resección del músculo temporal, hemos desarrollado una técnica para deslizar el implante por debajo de la duramadre. Esta técnica permite reducir drásticamente la superficie del cerebro expuesto y aún así llegar a objetivos lejanos. Si bien este tipo de implantación puede parecer ciega, la implementación de marcadores radiopacos en los dispositivos que se visualizan en la radiografía del plano intraoperatorio permite verificar el posicionamiento y garantiza que la matriz no se pliegue debajo de la duramadre. El deslizamiento subdural ha demostrado ser seguro en la mayoría de las repeticiones que hemos realizado. Además, la durotomía en un abordaje de hendidura minimiza el abultamiento cerebral durante el tiempo que la craneotomía está abierta y facilita el cierre alrededor del implante sin requerir material adicional como duramadre artificial, que podría sesgar la respuesta inflamatoria. Finalmente, la fortaleza de este abordaje quirúrgico es su capacidad para ser transpuesto a diferentes regiones corticales. Jugar con las coordenadas, la posición de la craneotomía y el tamaño del dispositivo, que se pueden ajustar, permite que este método se dirija a la mayor parte del área de la corteza.
El método quirúrgico presentado aquí, junto con la evaluación funcional y la investigación de la biointegración a lo largo del tiempo, no se limita a la tecnología de electrodos blandos utilizada en este informe. Otros electrodos subdurales que se están desarrollando para la traslación humana podrían evaluarse con el mismo protocolo. La fuerza de este método radica en el hecho de que la mayoría de las piezas, como el cable y el pedestal, son modulares, personalizables y se pueden adaptar al dispositivo específico que se está probando. Además, también se pueden utilizar sondas intracorticales o de penetración profunda en lugar de o en combinación con los electrodos subdurales, ya que esto solo requiere ajustar la geometría de la craneotomía y la durotomía. Los resultados a largo plazo pueden compararse con sus homólogos clínicos, como hemos hecho aquí.
Una de las principales limitaciones del método presentado es la presencia de senos craneales en los minicerdos, que se desarrollan a lo largo del primer año12. En ese sentido, aspectos importantes a tener en cuenta incluyen la edad de implantación y también el tamaño del animal. La realización de craneotomías en el cráneo adulto rompe la integridad de los senos paranasales y conduce a un alto riesgo de infección importante en entornos crónicos. Dichos senos paranasales son visibles en la radiografía plana y en la tomografía computarizada antes de la operación. Por otro lado, realizar una implantación crónica demasiado pronto, en un animal demasiado pequeño, tampoco es óptimo cuando el cráneo está experimentando un crecimiento y remodelación masivos. Planteamos la hipótesis de que estos "movimientos del cráneo" después de la cirugía podrían hacer que el implante se mueva y se pliegue, lo que en última instancia es perjudicial para el experimento. Hemos comprobado aquí que los minipigs de Göttingen, de aproximadamente 5-6 meses de edad (y 8 kg) en el momento de la implantación, deberían dar los mejores resultados.
Para evaluar el rendimiento del ECoG implantado para registros electrofisiológicos, hemos establecido un protocolo rápido para el registro de potenciales evocados auditivos (AEP) que se puede utilizar en animales que se mueven libremente y bajo sedación. Consiste en presentar una serie de ráfagas de tonos acústicos a frecuencias específicas en el transcurso de unos pocos minutos. La ventaja de un protocolo de este tipo es el hecho de que se puede sintonizar a la longitud disponible de grabación reduciendo el número de frecuencias sondeadas. Uno de los retos a la hora de registrar las señales corticales bajo anestesia es que se debe tener en cuenta el nivel de conciencia del animal a la hora de analizar y comparar los datos.
El protocolo de perfusión se ajustó a lo largo del tiempo mediante la observación de la calidad del cerebro extraído. De hecho, nos resultó más fácil cateterizar solo la arteria carótida y no la vena yugular. Inicialmente, la literatura presenta métodos en los que se cateteriza la vena yugular para drenar los desechos20. En la práctica, esto limita el flujo de salida del cerebro y conduce a una extracción de sangre más pobre y a una peor calidad general de la perfusión. Al cortar la vena yugular y dejar escapar el líquido en un recipiente grande donde yace el animal, aumenta la eficiencia de la perfusión.
Hemos desarrollado un método robusto de preparación de tejidos que funciona con anticuerpos utilizados de forma rutinaria para el rastreo de la inflamación. Hemos separado los dos hemisferios por razones prácticas, ya que la mitad del cerebro del cerdo cabe en portaobjetos de microscopio estándar y, por lo tanto, es compatible con la mayoría de los equipos de imagen disponibles en los laboratorios de histología. Al cortar el cerebro en bloques, se hace posible el acceso directo a la zona de interés sin necesidad de cortar todo el cerebro o recortar partes extensas del tejido. Los cortes de cerebro a 40 μm pueden agruparse en placas de pocillos estándar y teñirse de forma flotante sin grandes cambios en el protocolo de las inmunotinciones de otras especies. También se podría prever la inmunotinción cerebral completa utilizando, por ejemplo, los métodos CLARITY21.
En general, este protocolo, que abarca desde el diseño personalizado del implante hasta la implantación, el seguimiento de la funcionalidad y la evaluación de la bioseguridad, es sólido y coherente. Demostramos aquí su viabilidad para estudiar el sistema auditivo, pero se puede transponer para probar otras funciones fisiológicas. Además, la fuerza de nuestro método reside en el hecho de que no se limita a los minicerdos, sino que es totalmente transponible a otras especies como ovejas, cabras o primates no humanos. Hasta cierto punto, también se puede adaptar fácilmente a las ratas.
Divulgaciones
F.F. y S.P.L. son cofundadores y accionistas de Neurosoft Bioelectronics SA que desarrolla matrices de electrodos blandos.
Agradecimientos
Los autores agradecen el apoyo financiero de la Fundación Bertarelli y de la CRSII5_183519 de becas SNSF Sinergia. Los autores también desean agradecer a Katia Galán de la EPFL por su ayuda en el desarrollo del protocolo de tinción para la histología, al personal de la Plataforma de Microsistemas Neuronales del Centro Wyss de Bio y Neuroingeniería en Ginebra por su ayuda con los procesos de fabricación, al personal de la plataforma de animales en el Centro Médico Universitario (CMU) de la Universidad de Ginebra (UNIGE) para el cuidado de los animales, asistencia quirúrgica y manejo postoperatorio del minipig (John Diaper, Xavier Belin, Fabienne Fontao y Walid Habré), los miembros del equipo del Centro de Imágenes Biomédicas (CIBM) de la Universidad de Ginebra (Julien Songeon, François Lazeyras y Rares Salomir), los miembros del personal del Departamento de Patología del Hospital Universitario de Ginebra (HUG) (Sami Schranz, Francesca Versili, Rubén Soto y Coraline Egger) y Blaise Yvert de la Université Grenobles-Alpes por sus aportaciones e intercambios sobre los experimentos crónicos con minicerdos. Los autores desean agradecer la ayuda de los empleados de Neurosoft Bioelectronics SA, por su ayuda en el proceso de fabricación y por su ayuda en los experimentos con minicerdos (Benoit Huguet y Margaux Roulet).
Materiales
| Name | Company | Catalog Number | Comments |
| Bone drill | BBraun | Elan 4 with GA861 handpiece | |
| Bone drill bit | BBraun | Neurocutter GP204R | |
| Bonewax | Ethicon | W31G | |
| Catheter | Venisystems | Abbocath 14G | |
| Confocal Microscope | Zeiss | LSM 880 | |
| Cryostat | Leica | CM1950 | |
| Gelfoam | Pfizer | Gelfoam | |
| Insert speakers | Etymotic | Etymotic ER2 insert Earphones | |
| Multimeter | Fluke | Fluke 1700 | |
| Oscilloscope | Tektronix | MDO3014 Mixed Domain Oscilloscope | |
| Perfusion pump | Shenzen | LabS3/UD15 | |
| Potentiostat | Gamry Instruments | Reference 600 | |
| Primary Antibody Anti-GFAP | Thermofischer | Anti-GFAP, Rat, # 13-0300 | |
| Primary Antibody Anti-Iba1 | Fujifilm | Anti Iba1, Rabbit, 019-19741 | |
| Primary Antibody Anti-NeuN | SigmaAldrich | Anti-NeuN, GuineaPig, ABN90 | |
| Pulse Generator | AM Systems | Model 2100 Isolated Pulse Stimulator | |
| Recording headstage | Multichannel systems | W2100-HS32 | |
| Recording system | Multichannel systems | W2100 | |
| Screwdriver | Medtronic | Handle: 001201, Shaft: 8001205 | |
| Secondary Antibody 488 | Thermofischer | Goat anti-Rat IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488, # A-11006 | |
| Secondary Antibody 555 | Thermofischer | Goat anti-Guinea Pig IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555, # A-21435 | |
| Secondary Antibody 647 | Thermofischer | Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 647, # A-21245 | |
| Slide Scanner | Olympus | VS120 | |
| Snapfrost | Excilone | Excilone Snapfrost | |
| Stab knife | Fine Science Tools | 10316-14 | |
| Suture wire dermal | Ethicon | Vicryl 2-0 | |
| Suture wire dura mater | Ethicon | Mersilk 5-0 | |
| Suture wire for catheter | Ethicon | Vycril 3-0 without needle | |
| Suture wire for lifting dura | Ethicon | Prolene 6-0 with BV-1 needle | |
| Suture wire subcutaneous | Ethicon | Vicryl 4-0 | |
| Titanium bridge | Medtronic | TiMesh 015-2001-4 | Cut out the required size |
| Titanium screws | Medtronic | 9001635, 9001640 | |
| X-ray system | GE | GE OEC 9800 Plus C-Arm |
Referencias
- Ritaccio, A. L., Brunner, P., Schalk, G. Electrical stimulation mapping of the brain: Basic principles and emerging alternatives. Journal of Clinical Neurophysiology. 35 (2), 86-97 (2018).
- Mullin, J. P., Sexton, D., Al-Omar, S., Bingaman, W., Gonzalez-Martinez, J. Outcomes of subdural grid electrode monitoring in the stereoelectroencephalography era. World Neurosurgery. 89, 255-258 (2016).
- Vansteensel, M. J., et al. Fully implanted brain-computer interface in a locked-in patient with ALS. The New England Journal of Medicine. 375 (21), 2060-2066 (2016).
- Lacour, S. P., Courtine, G., Guck, J. Materials and technologies for soft implantable neuroprostheses. Nature Reviews. Materilas. 1, 16063 (2016).
- Fallegger, F., Schiavone, G., Lacour, S. P. Conformable hybrid systems for implantable bioelectronic interfaces. Advanced Materials. 32 (15), 1903904 (2019).
- Pearce, A. I., Richards, R. G., Milz, S., Schneider, E., Pearce, S. G. Animal models for implant biomaterial research in bone: A review. European Cells & Materials. 13, 1-10 (2007).
- Swindle, M. M., Makin, A., Herron, A. J., Clubb, F. J., Frazier, K. S. Swine as models in biomedical research and toxicology testing. Veterinary Pathology. 49 (2), 344-356 (2012).
- Khoshnevis, M., et al. Development of induced glioblastoma by implantation of a human xenograft in Yucatan minipig as a large animal model. Journal of Neuroscience Methods. 282, 61-68 (2017).
- Borton, D., et al. Developing implantable neuroprosthetics: A new model in pig. Annual International Conference of the IEEE Engineering in Medicine & Biology Society. 2011, 3024-3030 (2011).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Gierthmuehlen, M., et al. Evaluation of mECoG electrode arrays in the minipig: Experimental procedure and neurosurgical approach. Journal of Neuroscience Methods. 202 (1), 77-86 (2011).
- Palma, M., et al. Chronic recording of cortical activity underlying vocalization in awake minipigs. Journal of Neuroscience Methods. 366, 109427 (2022).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C. H., Palomero-Gallagher, N. The telencephalon of the Göttingen minipig, cytoarchitecture and cortical surface anatomy. Brain Structure & Function. 222 (5), 2093-2114 (2017).
- Lind, N. M., et al. The use of pigs in neuroscience: Modeling brain disorders. Neuroscience and Biobehavioral Reviews. 31 (5), 728-751 (2007).
- Shepherd, R. K., Villalobos, J., Burns, O., Nayagam, D. A. X. The development of neural stimulators: A review of preclinical safety and efficacy studies. Journal of Neural Engineering. 15 (4), 041004 (2018).
- Schiavone, G., et al. Soft, implantable bioelectronic interfaces for translational research. Advanced Matererials. 32 (17), 1906512 (2020).
- Fallegger, F., et al. MRI-compatible and conformal electrocorticography grids for translational research. Advanced Science. 8 (9), 2003761 (2021).
- Minev, I. R., Wenger, N., Courtine, G., Lacour, S. P. Research update: Platinum-elastomer mesocomposite as neural electrode coating. APL Materials. 3 (1), 014701 (2015).
- Schiavone, G., et al. Guidelines to study and develop soft electrode systems for neural stimulation. Neuron. 108 (2), 238-258 (2020).
- Musigazi, G. U., De Vleeschauwer, S., Sciot, R., Verbeken, E., Depreitere, B. Brain perfusion fixation in male pigs using a safer closed system. Laboratory Animals. 52 (4), 413-417 (2018).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nature Methods. 10 (6), 508-513 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados