Method Article
Subdurale weiche Elektrokortikographie (ECoG) Array-Implantation und Langzeit-Kortikalableitung bei Minischweinen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In dieser Arbeit stellen wir eine Methode zur langfristigen Leistungs- und Sicherheitsbewertung von weichen subduralen Elektrodenarrays in einem Minipig-Modell vor, die chirurgische Methoden und Werkzeuge, postoperative Magnetresonanztomographie, Elektrophysiologie des auditorischen Kortex, elektrochemische Eigenschaften des Implantats und postmortale Immunchemie beschreibt.
Zusammenfassung
Neurologische Beeinträchtigungen und Erkrankungen können mit Hilfe der Elektrokortikographie (ECoG) diagnostiziert oder behandelt werden. Bei medikamentenresistenter Epilepsie helfen diese bei der Abgrenzung der epileptischen Region, die reseziert werden soll. In Langzeitanwendungen wie Gehirn-Computer-Schnittstellen werden diese epikortikalen Elektroden verwendet, um die Bewegungsabsicht des Gehirns aufzuzeichnen, um die Robotergliedmaßen von gelähmten Patienten zu steuern. Derzeitige steife Elektrodengitter erfüllen jedoch nicht den Bedarf an hochauflösenden Gehirnaufzeichnungen und langfristiger Biointegration. In jüngster Zeit wurden anpassungsfähige Elektrodenarrays vorgeschlagen, um eine langfristige Implantatstabilität bei hoher Leistung zu erreichen. Präklinische Studien für diese neuen Implantattechnologien sind jedoch erforderlich, um ihre langfristige Funktionalität und ihr Sicherheitsprofil für ihre Übertragung auf menschliche Patienten zu validieren. In diesem Zusammenhang werden Schweinemodelle aufgrund ihrer großen Organgröße und der einfachen Handhabung von Tieren routinemäßig bei der Entwicklung von Medizinprodukten eingesetzt. In der Literatur werden jedoch nur wenige Anwendungen für das Gehirn beschrieben, meist aufgrund von chirurgischen Einschränkungen und der Integration des Implantatsystems am lebenden Tier.
Hier berichten wir über die Methode zur Langzeitimplantation (6 Monate) und Evaluierung von weichen ECoG-Arrays im Minipig-Modell. In der Studie wird zunächst das Implantatsystem vorgestellt, das aus einem weichen, mikrofabrizierten Elektrodenarray besteht, das in einen mit Magnetresonanztomographie (MRT) kompatiblen transdermalen Polymerport integriert ist, der Instrumentierungsanschlüsse für elektrophysiologische Aufzeichnungen enthält. Anschließend beschreibt die Studie den chirurgischen Eingriff, von der subduralen Implantation bis zur Genesung des Tieres. Wir konzentrieren uns auf den auditorischen Kortex als beispielhaftes Zielgebiet, in dem evozierte Potentiale durch akustische Stimulation induziert werden. Schließlich beschreiben wir eine Datenerfassungssequenz, die MRT des gesamten Gehirns, elektrochemische Charakterisierung von Implantaten, intraoperative und sich frei bewegende Elektrophysiologie und immunhistochemische Färbung der extrahierten Gehirne umfasst.
Dieses Modell kann verwendet werden, um die Sicherheit und Funktion eines neuartigen Designs kortikaler Prothesen zu untersuchen. obligatorische präklinische Studie, um eine Translation auf menschliche Patienten zu ermöglichen.
Einleitung
Neurologische Beeinträchtigungen und Erkrankungen können mit Hilfe der Elektrokortikographie (ECoG) diagnostiziert oder behandelt werden. Diese Elektrodengitter werden an der Oberfläche des Gehirns implantiert und ermöglichen die Aufzeichnung oder Stimulation des menschlichen Kortex1. Bei medikamentenresistenter Epilepsie helfen sie beispielsweise, die epileptische Region abzugrenzen, um2 zu resezieren. In Langzeitanwendungen wie Gehirn-Computer-Schnittstellen werden diese epikortikalen Elektroden verwendet, um die Bewegungsabsicht des Gehirns aufzuzeichnen, um die Robotergliedmaßen von gelähmten Patienten zu steuern3. Derzeitige Elektrodengitter bestehen jedoch aus steifen Metallblöcken, die in starre polymere Substrate eingebettet sind, und erfüllen nicht den Bedarf an hochauflösenden Gehirnaufzeichnungen und langfristiger subduraler Biointegration (>30 Tage). Vielmehr erzeugen sie lokale Gewebereaktionen, die zu einer fibrotischen Verkapselung des implantierten Geräts führen, was im Laufe der Zeit zu einer schlechteren Leistung führt. In jüngster Zeit wurden flexible oder dehnbare Elektrodenarrays unter Verwendung dünner polymerer Substrate, die durch Mikrofabrikationstechniken hergestellt werden, vorgeschlagen, um eine hohe Leistung bei Langzeitimplantationen zu erzielen, indem sie die Gewebereaktion begrenzen 4,5. Präklinische Studien für diese neuen Implantattechnologien sind jedoch erforderlich, um ihre langfristige Funktionalität und ihr Sicherheitsprofil zu validieren, so dass eine Übertragung auf menschliche Patienten in Betracht gezogen werden kann. In diesem Zusammenhang werden Minischwein- und Schweinemodelle aufgrund ihrer großen Organgröße und der einfachen Handhabung von Tieren routinemäßig bei der Entwicklung von Geräten in anderen medizinischen Kontexten (z. B. im Herz-Kreislauf-, Skelett- oder Magensystem) eingesetzt 6,7,8. In der Literatur werden jedoch nur wenige Anwendungen beschrieben, die auf das Gehirn für die Neurophysiologie abzielen, hauptsächlich aufgrund von Einschränkungen des chirurgischen Zugangs und der Integration des Implantatsystems an einem lebenden Tier 9,10,11,12. Diese sind oft nicht mit der chronischen Implantation bei lebenden Tieren vereinbar, da sie beispielsweise die Entwicklung komplexer Hardware wie implantierbarer eingebetteter Elektronik erfordern würden. Darüber hinaus untersuchen sie nicht den Einfluss des Implantatsystems auf das Zielgewebe, der für den Aspekt der Biosicherheit in translationalen Studien entscheidend ist. Das Schweinemodell kommt der menschlichen Anatomie in Bezug auf kortikale Struktur, Schädelknochen und Hautdicke nahe13. Darüber hinaus macht ihre Fähigkeit, Verhaltensaufgaben zu erlernen, sie zu einem leistungsfähigen Modell für die Untersuchung funktioneller Rehabilitationsstrategien oder sensorischer Wahrnehmungen14.
Die Übertragung neuer Technologien und Therapien auf den Menschen erfordert eine Bewertung der Sicherheit und Wirksamkeit, wie sie von den zuständigen medizinischen Behörden gefordert wird. Diese werden in der Regel in technischen Dokumenten und Normen15 beschrieben, erfordern jedoch nur das Bestehen dieser Tests und untersuchen nicht die tatsächliche Wirkung der Implantation des Produkts oder die Erhebung anderer nützlicher Daten parallel zur Sicherheitsstudie. Für eine vollständige Biosicherheits- und Leistungsstudie am Gehirn präsentieren wir hier eine longitudinale und systematische Sammlung von Bildgebungsdaten des Gehirns, elektrophysiologische Messungen, die Beurteilung der elektrochemischen Eigenschaften der implantierten Elektroden und die postmortale Histologie in einem Schweinemodell. Um dies zu erreichen, müssen mehrere Aspekte berücksichtigt werden, um ein vollständiges experimentelles Modell zu erstellen: (i) minimalinvasiver chirurgischer Zugang für die Implantation zusammen mit einem mechanisch stabilen transdermalen Port zur Verbindung mit den Elektroden, (ii) ein robustes elektrophysiologisches Aufzeichnungsparadigma, das als Leistungsabgabe für die implantierten Elektroden sowohl unter Anästhesie als auch unter frei beweglichen Bedingungen dient, (iii) In-vivo-Bildgebung (Computertomographie [CT] und/oder Magnetresonanztomographie [MRT]) zu verschiedenen Zeitpunkten, um die Entwicklung des Gehirns und des Implantats sowie die Kompatibilität des implantierten Systems mit den Bildgebungsgeräten zu verfolgen, und (iv) eine Gewebevorbereitungspipeline zur Entnahme des Gehirns für die histologische Analyse.
Hier berichten wir über die Methode zur Langzeitimplantation (6 Monate) und Evaluierung von weichen ECoG-Arrays im Minipig-Modell (schematisch dargestellt in Abbildung 1). Die weichen Elektrodenarrays, die in unseren früheren Berichten vorgestellt wurden, bestehen aus dünnen Silikonmembranen, die elastische Golddünnschichten einbetten, die als elektrische Spuren verwendet werden16,17. Der Kontakt mit dem Gewebe erfolgt durch eine Mischung aus Platinnanopartikeln, die in eine Silikonmatrix eingebettet sind, um eine weiche und effiziente elektrochemische Schnittstelle zum Gehirngewebe zu schaffen18. Die Implantate werden über ein flexibles Kabel, das subdural durch den Schädel und die Haut getunnelt wird, mit einem transdermalen Port verbunden, der die Konnektoren am Kopf des Tieres beherbergt. Die Größe und Form des Implantats kann je nach Ziel und den Bedürfnissen der Studie angepasst werden. Die aktuellen Elektrodenstreifen in dieser Studie spiegeln die tatsächliche Größe der klinischen Streifen wider. Klinisch verfügbare subdurale Streifen und Gitter wurden mit dem gleichen Ansatz als Komparatoren verwendet. Der polymere MRT-kompatible transdermale Port wird mit einem Fußplattensystem auf dem Schädel platziert, das ihn fest im Schädel verankert. Hier beschreiben wir detailliert den chirurgischen Eingriff, von der subduralen Implantation beider Hemisphären bis zur Genesung des Tieres. Wir konzentrieren uns auf den auditorischen Kortex als beispielhaftes Zielgebiet, in dem evozierte Potentiale durch akustische Stimulation sowohl in anästhesierten als auch in frei beweglichen Bedingungen induziert werden. Zu verschiedenen Zeitpunkten wird das Gehirn des Tieres im MRT (oder CT für die klinischen Elektroden) unter Narkose abgebildet und die elektrochemischen Eigenschaften der Elektroden gemessen. Methoden zur Elektrodencharakterisierung werden verwendet, um die Entwicklung des Implantats und der Elektroden-Gewebe-Schnittstelle zu verfolgen (siehe Schiavone et al.19 für weitere Details). Dazu gehören die Chronoamperometrie zur Untersuchung der Stimulationsfähigkeiten des Elektrodenkontakts, die elektrochemische Impedanzspektroskopie (EIS), die die Entwicklung der resistiven und kapazitiven Komponenten der Elektrode anzeigen kann, und die Widerstandsmessungen zwischen den Kanälen, um hermetische Verkapselungsfehler zu untersuchen. Schließlich haben wir eine Gewebeextraktionspipeline entwickelt, um das Gehirn nach der Euthanasie zu perfundieren, es mit den Elektroden zu explantieren, es zu schneiden und eine histologische Analyse mit verschiedenen Entzündungsmarkern durchzuführen. Insgesamt wird diese Methode präklinische Studien mit robuster multimodaler Datenerfassung für die zukünftige klinische Translation neuer Technologien und Therapien im Gehirn ermöglichen.
Protokoll
Chirurgische und verhaltenstherapeutische Eingriffe wurden von der lokalen Ethikkommission in Übereinstimmung mit den Richtlinien für die Pflege und Verwendung von Versuchstieren genehmigt und von lokalen (Kanton Genf) und eidgenössischen (Schweiz) Veterinärbehörden mit der Zulassungsnummer GE11120A genehmigt. In dieser Studie wurden weibliche Göttinger Minischweine (n = 7) im Alter von 2-6 Monaten (5-8 kg) verwendet.
1. Präoperative Planung
- In-vitro-Charakterisierung des weichen Implantatsystems
- Chronoamperometrie: Aufzeichnung des Spannungsabfalls bei der Einspeisung eines zweiphasigen Stromimpulses (d. h. des Spannungstransienten [VT]) mit einem Oszilloskop, das parallel zu einem Impulsgenerator geschaltet ist. Schließen Sie den Impulsgenerator nacheinander an jede Elektrode und einen Platinzähler in Kochsalzlösung (phosphatgepufferte Kochsalzlösung [PBS] 1x) an. Die Einstellungen finden Sie in Schritt 3.1.
- Elektrochemisches Impedanzspektrogramm: Messen Sie die elektrochemische Impedanz bei verschiedenen Frequenzen mit einem Potentiometer. Schließen Sie das Potentiometer sequentiell an jede Elektrode an, indem Sie den Platinzähler und eine Ag/AgCl-Referenzelektrode in Kochsalzlösung (PBS 1x) verwenden. Die Einstellungen finden Sie in Schritt 3.2.
- Widerstand zwischen den Kanälen: Im trockenen Zustand wird der Gleichstromwiderstand (DC) zwischen benachbarten Kanälen mit einem Handmultimeter gemessen.
- Implantatauswahl: Wählen Sie nach den drei oben genannten Messungen das Implantat anhand der folgenden Kriterien aus: Impedanz bei 1 kHz unter 100 kΩ und kein Zwischenkanalwiderstand unter 1 MΩ.
- Sterilisation
- Implantat-Sterilisation: Legen Sie die ausgewählten Implantate einzeln zusammen mit einem Sterilisationsmarker in Sterilisationsbeutel und versiegeln Sie diese. Verwenden Sie eine doppelte Verpackung, um die Sterilität während der Operation zu gewährleisten.
HINWEIS: In diesem Fall wird aufgrund des kurzen Zeitzyklus und der niedrigen Temperatur (55 °C) die Wasserstoffperoxid (H2O2)-Gassterilisation verwendet. Alternativen sind Ethylenoxid (ETO)-Gas oder Autoklav-Sterilisation, aber die Kompatibilität mit dem Implantatsystem sollte sichergestellt sein. - Instrumentensterilisation: Legen Sie die gereinigten Instrumente zusammen mit den Sterilisationsmarkern in doppelte Sterilisationsbeutel oder sterile Instrumentenboxen. Die Sterilisation im Autoklaven ist für Instrumente am gebräuchlichsten, aber H2O2oder ETO sind mögliche Alternativen.
- Implantat-Sterilisation: Legen Sie die ausgewählten Implantate einzeln zusammen mit einem Sterilisationsmarker in Sterilisationsbeutel und versiegeln Sie diese. Verwenden Sie eine doppelte Verpackung, um die Sterilität während der Operation zu gewährleisten.
2. Chirurgische Implantation von weichen ECoG-Arrays
- Anästhesie
- Prämedikation: Isolieren Sie das Tier und fasten Sie es über Nacht. Injizieren Sie eine Mischung aus Midazolam mit 0,75 mg/kg, Atropin mit 0,25 μg/kg und Haldol mit 0,1 mg/kg intradermal und warten Sie, bis das Tier sediert ist. Wiegen Sie das Tier, bevor Sie fortfahren.
- Installation von intravenöser (IV) Elektrode:
- Legen Sie das Tier auf den Operationstisch auf ein Heizkissen. Induzieren Sie eine Anästhesie, indem Sie dem Tier eine Gesichtsmaske aufsetzen und Sevofluran in einer Dosierung von 3%-3,5% verwenden.
- Platzieren Sie Elektrokardiogramm-Elektroden am Bauch, einen Blutsättigungssensor am Schwanz und einen Temperatursensor am Nasenloch.
- Legen Sie eine Infusionsleitung auf eine Ohrvene und bestätigen Sie den Blutzugang mit einer mit Kochsalzlösung gefüllten Spritze. Stellen Sie sicher, dass die Augen mit Feuchtigkeit versorgt werden, indem Sie Salbe verwenden.
- Intubation: Injizieren Sie einen Bolus Atracurium mit 0,5 mg/kg, Ketamin mit 1 mg/kg und Fentanyl mit 1-2 μg/kg. Legen Sie das Tier zur Intubation auf den Rücken. Führen Sie ein 4,5-mm-Rohr ein.
- Medikation: Nach der Intubation die Sevofluran-Anästhesie abbrechen und eine Propofol-Infusion mit 10 mg/kg/h, Fentanyl mit 2 μg/kg/h, Atracurium mit 0,2-0,5 mg/kg/h und Kochsalzlösung mit 4-7 mg/kg/h installieren. Beginnen Sie mit einer Infusion von Mannitol mit 1 g/kg/h, um die Hirnschwellung während der Operation zu reduzieren.
HINWEIS: Ein multimodales Analgesie-Schema kann verwendet werden, wenn es von der örtlichen Tierethikkommission empfohlen wird.
- Präoperatives Röntgen
- Lege das Tier in der Sphinx-Position auf den Bauch. Entfernen Sie vorübergehend alle metallischen Gegenstände in der Nähe des Gehirns und des Schädels des Tieres (z. B. Temperaturblei im Nasenloch).
- Nehmen Sie eine Röntgenaufnahme der axialen und sagittalen Ebene mit einem Kontrast des Knochens auf. Platzieren Sie ein metallisches Objekt mit bekannten Abmessungen im sagittalen Erfassungsfeld, das als Skala zur Messung der Schädeldicke an der Vorder- und Rückseite des Gehirns dient.
- Identifizieren Sie die Position der Stirnhöhlen (sichtbar durch Hohlräume unter dem Schädel) und markieren Sie die hinterste Stelle am Kopf des Tieres mit einem Permanentmarker. Dies zeigt den am weitesten entfernten Punkt an, an dem eine Kraniotomie oder Schraubenplatzierung bei dem unten beschriebenen chirurgischen Ansatz durchgeführt werden kann.
- Aseptische Feld- und Hautvorbereitung: Rasieren Sie die gesamte Oberfläche des Kopfes über das Operationsfeld hinaus. Schrubben Sie den Kopf mit einem sterilen Pad gründlich mit Betadin. Als nächstes legen Sie sterile Abdecktücher auf den Instrumententisch und auf das Tier, um nur das Operationsfenster freizulegen. Zum Schluss schrubben Sie den Kopf erneut mit einem sterilen Pad mit Betadin.
- Kraniotomie und Durotomie
- Hautschnitt: Schneiden Sie die Haut mit einem Skalpellmesser entlang der Mittellinie ein. Trennen Sie den Muskel und die Knochenhaut (25 mm seitlich von der Bregma auf beiden Seiten und 40 mm anterior und posterior zum Bregma) mit einem Raspatorium vom Knochen und platzieren Sie Spreizer, um einen optimalen Zugang für spätere Bohrungen zu erhalten.
- Messungen und Markierung: Identifizieren Sie Bregma und Lambda und markieren Sie sie mit einem sterilen chirurgischen Stift (Abbildung 2A, B). Definieren Sie mit einem sterilen Lineal den Umriss des Knochenlappens, der um das Implantationsziel auf beiden Hemisphären zentriert ist. In diesem speziellen Fall wurde der auditorische Kortex gewählt, mit Koordinaten -5 mm bis -15 mm vom Bregma und -4 mm bis -20 mm lateral. Passen Sie dann die Kraniotomie an die Größe des Implantats und die anatomischen Orientierungspunkte an und begrenzen Sie die Öffnungsgröße.
- Kraniotomie:
- Bohren Sie mit einem Knochenbohrer mit einem runden Schneidmeißel den Umriss der Kraniotomie unter Berücksichtigung der in Schritt 2.2 gemessenen Dicke des Schädels. Spülen Sie die Bohrstelle mit Kochsalzlösung, um eine Überhitzung des Knochens zu vermeiden.
- Bohren Sie die Kontur vorsichtig homogen bis zur Dura mater. Beim ersten Durchbruch wird der Umriss so lange gebohrt, bis er so dünn geworden ist, dass er fast durchbricht. Verwenden Sie dann einen flachen Spatel (entweder auf der Mittellinienseite oder auf der Seitenseite), um den Knochenlappen in einem Stück wegzubrechen, wobei Sie die Kraniotomiekante als Hebel verwenden. Wenn Sie auf zu viel Widerstand stoßen, fahren Sie mit der Ausdünnung des Knochens fort.
- Legen Sie das Knochenstück in sterile Kochsalzlösung.
- Sobald der Knochenlappen entfernt ist, schlagen Sie den Rand der Kraniotomie vorsichtig mit einem Kerison ab, um zu vermeiden, dass die scharfe Knochenkante in die Dura mater schneidet.
- Wenn übermäßige Blutungen an der Dura mater oder am Knochen auftreten, verwenden Sie Gelfoam bzw. Knochenwachs. Legen Sie eine feuchte Kompresse (Standard-Pad in steriler Kochsalzlösung) in die Kraniotomie und wiederholen Sie diesen Schritt auf der anderen Hemisphäre (Abbildung 2B).
- Durotomie:
- Mit der Nadel aus einem 6-0-Nahtset die Dura mater am vorderen oder hinteren Ende der Kraniotomie vorsichtig durchstechen und anheben und mit dem Stichmesser den Beginn eines Schnitts schaffen.
- Erzeugen Sie dann mit einem kleinen flachen Spatel, der in den Subduralraum eingeführt wird und als Schneidebasis dient, um den Kortex zu schützen, einen anteroposterioren Schlitz in der Dura mater, indem Sie gleichzeitig mit beiden Werkzeugen vorrücken. Stellen Sie sicher, dass der Schlitz etwas größer als die Breite des Implantats ist (Abbildung 2C). Wenn bei diesem Schritt Blutungen oder Schäden auftreten, decken Sie es mit Gelschaum ab und warten Sie, bis es aufhört.
HINWEIS: Die Schlitztrajektorie sollte angepasst werden, wenn große Blutgefäße in der Dura mater vorhanden sind, um Blutungen zu vermeiden.
- Implantat
- Einsetzen des Geräts:
- Spülen Sie das Implantat (ergänzende Abbildung 1A) beidseitig mit Kochsalzlösung, damit es leichter in den Subduralraum gleitet. Platzieren Sie das Implantat oberhalb des Dura-Mater-Schlitzes und führen Sie das Gerät mit einer kleinen Pinzette subdural ein, indem Sie es nacheinander an jeder Kante schieben.
- Halten Sie das Sockelende des Geräts vorsichtig fest und schieben Sie das Implantat vor, um keine Spannung zu erzeugen, die das Einsetzen behindert. Wenn sich die Anschlusskante auf dem Schlitz befindet, stoppen Sie das Einsetzen.
- Befestigen Sie das Implantat: Um das Implantat zu fixieren, legen Sie eine Titanbrücke über das Kabel nach dem Rand der Kraniotomie oder in die Verankerungsflügel und befestigen Sie diese mit einer oder zwei Titanschrauben mit dem entsprechenden Schraubendreher (Abbildung 2D).
- Bodenplatzierung: Entfernen Sie vorsichtig 1 cm der Isolierung der Erdungsdrähte und führen Sie sie epidural am hinteren Ende der Kraniotomie (oder an einer anderen epiduralen Stelle, die weit vom interessierenden Kortex oder den großen Blutgefäßen entfernt ist) ein (Draht in Abbildung 2E)
- Wiederholen Sie die Schritte 2.4.4. und 2.5.1.-2.5.3 auf der kontralateralen Hemisphäre.
- Intraoperative Röntgenaufnahme zur Bestätigung der Platzierung:
- Legen Sie ein feuchtes Pad (Standard-Pad in steriler Kochsalzlösung) über die Operationsstelle, um das Gewebe mit Feuchtigkeit zu versorgen. Legen Sie als Nächstes ein steriles OP-Tuch an, um den Kopf des Tieres zu bedecken.
- Nehmen Sie ebene Röntgenbilder (axial und sagittal) an, um sicherzustellen, dass die Implantate gut platziert und nicht gefaltet sind, wobei die Röntgenmarker als Indikatoren verwendet werden. Ist dies nicht der Fall, entfernen Sie die Abdeckung und explantieren Sie das Gerät, um es wieder einzusetzen (wiederholen Sie die Schritte 2.4.4. und 2.5.1.-2.5.3).
- Dura-mater-Verschluss: Vernähen Sie die Dura mater vorsichtig um das Implantatkabel herum mit einer resorbierbaren 3-0-Naht und einem kleinen Nadelhalter. Bringen Sie die beiden Dura-Mater-Ränder so weit wie möglich zusammen, ohne die dünne Membran mit dem Nahtdraht zu durchreißen (Abbildung 2D, E).
- Platzierung des Knochenlappens: Befestigen Sie eine Titanbrücke mit einer Titanschraube am vorderen und hinteren Teil jedes Knochenlappens. Achten Sie darauf, die Positionierung der Ti-Brücken in Bezug auf die Platzierung der Fußplattenbeine in den nächsten Schritten zu planen. Schrauben Sie das Ende der Titanbrücken mit dem Schädel (Abbildung 2F, G).
- Einsetzen des Geräts:
- Platzierung des Sockels und der Fußplatte
- Positionierung: In dieser Konfiguration verfügt die Fußplatte über sechs Beine mit je zwei Schraubenlöchern (Ergänzende Abbildung 1B). Planen Sie die Platzierung der Fußplatte auf dem Schädel, um die Position der Schrauben zu optimieren (vermeiden Sie es, sie am Rand der Kraniotomie oder im Schläfenmuskel zu platzieren). Überspringen Sie die Löcher in den Beinen, wenn sie nicht eingeschraubt werden können.
- Fußplattensicherung: Schrauben Sie die Titanschrauben der Fußplatte fest, bis sie fest sitzt (siehe Abbildung 2H).
- Sockelplatzierung: Entfernen Sie die Titanbrücken über den Anschlusskabeln und drehen Sie den Sockel um, um auf der Fußplatte zu landen. Schrauben Sie den Sockel auf die Fußplatte. Prüfen Sie, ob der Sockel fest sitzt (Abbildung 2I).
- Naht und Verschluss
- Reinigung der Wunde: Reinigen Sie den Unterhautraum von Knochen oder anderen Ablagerungen, indem Sie ihn mit Kochsalzlösung spülen. Schneiden Sie etwas Haut an den Rändern des Sockels ab, um eine runde Kante zu erhalten, die dem Zylinder folgt.
- Subkutane Nähte: Entfernen Sie die Spreizer und falten Sie die Hautlappen zusammen. Erstellen Sie subkutane Nähte mit einem nicht resorbierbaren 4-0-Nahtdraht im Abstand von 3 mm mit einfachen unterbrochenen Nähten oder einfachen kontinuierlichen Nähten. Beginnen Sie vom Sockel weg und bewegen Sie sich auf beiden Seiten des Einschnitts darauf zu.
- Dermale Nähte: Naht die Haut mit einem nicht resorbierbaren 6-0-Nahtdraht mit einem Abstand von 5 mm. Beginnen Sie vom Sockel weg und bewegen Sie sich auf beiden Seiten des Einschnitts darauf zu. Achten Sie auf eine gute Gewebeanlagerung zwischen den beiden Hautlappen und in der Nähe des Podestrandes, um einen Hohlraum zu vermeiden (Abbildung 2J).
- Wundauflage: Reinigen Sie die Wundstelle erneut mit einem sterilen Pad und Betadin. Legen Sie einen selbstklebenden sterilen Verband über die Wunde.
- In-vivo-Messungen : Befolgen Sie für In-vivo-Messungen die Abschnitte 3, 4 und 5.
- Aufwachen: Nachdem alle Messungen durchgeführt wurden, nehmen Sie das Tier von allen Betäubungsmitteln ab, aber lassen Sie es unter Beatmung. Zur Analgesie ein Buprenorphin-Pflaster (25 mg/h) für 24 Stunden auftragen. Legen Sie das Tier auf ein Heizkissen, das mit Vorhängen bedeckt ist, um die Weckzeit zu beschleunigen. Wenn die spontane Atmung wiederhergestellt ist, extubieren Sie das Tier und legen Sie es unter eine Sauerstoffmaske, bis das Bewusstsein wiedererlangt ist (was 1 bis 4 Stunden dauern kann).
- Postoperative Tierpflege: Halten Sie das Tier 5 Tage lang unter strenger Beobachtung. Geben Sie eine Dosis Cephalexin in einer Dosis von 75 mg zweimal täglich mit dem Futter, getrennt von anderen Tieren. Desinfizieren Sie die Wunde täglich, indem Sie reichlich Betadin mit getränkten sterilen Pads auftragen (am besten während der Fütterung).
HINWEIS: Langzeitpflege und Unterbringung: Das operierte Tier wird 24 h isoliert gehalten. Es wird in seine ursprüngliche soziale Gruppe zurückversetzt, wenn es dem Tier gut genug geht, um sozial mit seinen Artgenossen zu interagieren. Eine tägliche Beobachtung des Sockels und der Hautöffnung muss durchgeführt werden, um die Integration des Geräts auf dem Kopf zu verfolgen. Reinigen Sie gegebenenfalls die Stelle um den Sockel herum mit reichlich Betadin.
3. In-vivo-Charakterisierung des weichen Implantats
- Chronoamperometrie: Aufzeichnung des Spannungsabfalls bei der Einspeisung einer zweiphasigen Stromimpulsentwicklung (d. h. des VT) mit einem Oszilloskop, das parallel zu einem Impulsgenerator geschaltet ist. Verbinden Sie den Impulsgenerator nacheinander mit jeder Elektrode und dem Erdungskabel. Führen Sie den Stimulationsimpuls bei 100 μA mit einer Pulsbreite von 300 μs bei 100 Hz durch.
- Elektrochemische Impedanzspektroskopie: Messen Sie die elektrochemische Impedanz bei verschiedenen Frequenzen mit einem Potentiometer. Schließen Sie den Impulsgenerator nacheinander an jede Elektrode an, wobei das Erdungskabel sowohl als Gegenelektrode als auch als Masse verwendet wird. Stellen Sie die Erregerspannung auf 200 mV und den Frequenzbereich von 1 Hz bis 1 MHz mit drei Punkten pro Dekade ein.
- Kurzmessungen zwischen den Kanälen: Messen Sie den Gleichstromwiderstand zwischen benachbarten Kanälen mit einem Handmultimeter. In vivo wird der Gleichstromwiderstand zwischen den Kanälen nur gemessen, um sicherzustellen, dass keine Engpässe unter 1 kΩ auftreten, was auf ein vollständiges Verkapselungsversagen hinweist.
4. Elektrophysiologische Aufzeichnung
- Spontane Aktivität: Schließen Sie das drahtlose Aufzeichnungssystem über den Sockel an und zeichnen Sie die Basisaktivität 2-3 Minuten lang auf. Diese Aufzeichnungen dienen als Kontrolle, um die auditiv evozierten Potentiale zu analysieren.
- Auditiv evozierte Potentiale: Zusätzlich zum drahtlosen System setzen Sie Lautsprecher in einem geschlossenen Feld in die Ohren der Tiere ein. Akustische Stimulation mit Tonstößen bei verschiedenen Frequenzen (von 200-20.000 Hz) bei ca. 70 dB Schalldruckpegel (SPL) über 120 Wiederholungen. Berechnen Sie dann den Mittelwert der Aufzeichnungen und richten Sie sie für die Analyse über den Stimuluszeitraum aus.
- Sensorisch evozierte Potenziale: Platzieren Sie die Nadeln an drei verschiedenen Stellen in der Schnauze. Rufen Sie sensorische Potentiale hervor, indem Sie die Schnauze ~30 s lang mit dem Impulsgenerator in verschiedenen Amplituden stimulieren, um die Rekrutierungskurven zu erhalten.
5. In-vivo-Bildgebung
- Tiertransport: Halten Sie das Tier unter Propofol-Narkose, wie in Schritt 2.1 beschrieben. Verwenden Sie einen Transportwagen, in dem sich ein Beatmungsgerät, eine Spritzenpumpe und ein Vitalparametermonitor befinden, um das Tier vom Operationssaal zu den Bildgebungseinrichtungen und zurück zu transportieren.
- Computertomographie-Röntgenaufnahme: Legen Sie das Tier auf den Scannertisch und entfernen Sie alle metallischen Gegenstände um den Kopf herum (z. B. den Temperatursensor). Erfassen Sie einen CT-Scan mit der kleinsten Auflösung (0,4 mm Schichtdicke) mithilfe der isometrischen Erfassung mit automatischer Strom- und Spannungsauswahl für den Knochenkontrast.
- Magnetresonanztomographie: Entfernen Sie alle metallhaltigen Geräte vom Tier (verwenden Sie MRT-kompatible Infusionselektroden und Intubationsschläuche). Halten Sie das Tier unter Sevofluran bei 3 % bis 3,5 % beatmet und betäubt, wobei ein Beatmungsgerät verwendet wird, das sich außerhalb der MRT-Kammer befindet und über einen langen Schlauch mit dem Tier verbunden ist. Vor der ersten Sequenz wird ein Bolus Fentanyl mit 1-2 μg/kg injiziert. Verwenden Sie drei isometrische Sequenzen mit der kleinsten Auflösung: T1-, T2- und Turbo-Spin-Echo (TSE)-gewichtete Sequenzen (Parameter in Ergänzungsdatei 1).
6. Frei bewegliche Aufnahme
- Befolgen Sie das gleiche Verfahren, das in Abschnitt 4 beschrieben ist, um Wachsignale aus dem Gehirn aufzuzeichnen. Schließen Sie die kabellose Kopfbühne an, indem Sie das Tier entweder in den Armen des Versuchsleiters halten oder es mit Leckerlis füttern, um es abzulenken. Sorgen Sie für die akustische Stimulation mit externen Lautsprechern, die in der Nähe des Tieres platziert sind.
7. Perfusion und Gewebevorbereitung
- OPTIONAL: Wenn das Tier noch nicht unter Narkose steht, befolgen Sie Schritt 2.1 für das Anästhesieprotokoll.
- Einführen eines Katheters in die Halsschlagader zur Perfusion (Ergänzende Abbildung 2)
- Dissektion der Halsschlagader und der Halsschlagader: Durchtrennen Sie die Kehle an der Mittellinie mit einem Kauterisator/Cutter. Schneiden Sie zuerst die Haut und dann den Muskel entlang der mittleren weißen Linie (keine Gefäße darunter) (ergänzende Abbildung 2A).
- Öffnen Sie sich weiter und schaffen Sie mit den Fingern Platz um die Luftröhre und unter dem Muskel. Suchen Sie nach der Halsschlagader (schlagend und rosafarben); Manchmal befindet sich auch der Vagusnerv (weiß), und die Halsvene kann sich darunter oder seitlich (rot) befinden. Platzieren Sie die Streuer (siehe ergänzende Abbildung 2B).
- Beginnen Sie mit der Präparation der Halsschlagader mit einer feinen Pinzette und einer runden Schere. Verwende eine Schere, um Bindegewebe zu öffnen. Wenn keine Blutgefäße vorhanden sind, schneiden Sie sie ab; wenn Blutgefäße vorhanden sind, kauterisieren und vorwärts gehen (ergänzende Abbildung 2C, D). Wenn die Halsschlagader ausreichend präpariert ist, verwenden Sie eine Klemme, um sie unter die Halsschlagader zu führen, so dass sie vollständig isoliert ist (Ergänzende Abbildung 2E).
- Wiederholen Sie den gleichen Vorgang mit der Vena jugularis (ergänzende Abbildung 2F).
- Wenn beide Gefäße vollständig präpariert und isoliert sind, legen Sie Nahtdraht um sie. Schließen Sie sie noch nicht. Zwei Nähte um die Halsschlagader herum, eine an der Basis (Naht 1 Herzseite für die Hirndurchblutung) und eine auf der anderen Seite (Naht 2), sind in der ergänzenden Abbildung 2G dargestellt.
- Legen Sie eine Naht um die Halsvene (Naht 3), nicht verschlossen; Markieren Sie die Drähte mit Klebeband, um die Vene später zu durchtrennen.
- Naht 1 sehr fest verschließen, da sie sonst blutet (ergänzende Abbildung 2H). Binde drei Knoten. Lege eine Klemme auf den Draht, um Gewicht zu verlagern und Spannung in der Halsschlagader zu erzeugen.
- Klemmen Sie die Halsschlagader mit einer Gefäßklemme auf der gegenüberliegenden Seite der Halsschlagaderdissektion (Gehirnseite für Hirnperfusion; Ergänzende Abbildung 2I). Naht 2 befindet sich in der Mitte, noch nicht geschlossen.
- Verwende eine schwarze Pinzette, um die Halsschlagader zu fangen und zu ziehen. Mit einer feinen Schere die Hälfte der Halsschlagader in der Nähe der Basis der Dissektion durchtrennen (in der Nähe von Naht 1, Herzseite; siehe ergänzende Abbildung 2J). Achten Sie darauf, dass der Abschnitt so sauber wie möglich ist und das Schiff selbst erreicht, nicht nur die "Hülle"; Andernfalls wird der Katheter nicht durchgelassen. Führen Sie den Katheter ein, wie in der ergänzenden Abbildung 2K gezeigt.
- Spülen und füllen Sie den Katheter zuerst mit PBS, damit sich keine Luft mehr im Katheter befindet (ergänzende Abbildung 2K-Einschub ).
- Schließen Sie die Naht 2 fest genug, damit sie nicht verschwindet, aber nicht zu sehr, damit sich der Katheter noch ein wenig bewegen kann (Ergänzende Abbildung 2L). Entfernen Sie dann die Gefäßklemme, beenden Sie das Einführen des Katheters so weit wie möglich und schließen Sie den Verschluss von Naht 2 ab (fest schließen).
- Falls gewünscht, verwenden Sie Nahtdrähte an Naht 1, um die Basis des Katheters als zusätzlichen Sicherheitsschritt an der Haut am Ausgang der Wunde zu befestigen. Übertragen Sie dann das Tier in die Perfusionszone und schließen Sie es an PBS/Heparin an. Wenn die Perfusion einsetzt, ziehen Sie an der Naht 3 und durchtrennen Sie die Halsvene
- Euthanasie: Pentobarbital (90 mg/kg) intravenös verabreichen und den Zugang mit Kochsalzlösung spülen, um sicherzustellen, dass die volle Dosis erfolgreich verabreicht wird.
- Perfusion: Mit einer Perfusionspumpe (200 ml/min) wird der Karotiskatheter in PBS/Heparin (1 l für ein 15 kg schweres Schwein) und dann in PBS mit 4 % Paraformaldehyd (PFA) (5 l für ein 15 kg schweres Schwein) eingesteckt. Wenn die Perfusion einsetzt, ziehen Sie an Naht 3 und durchtrennen Sie die Halsschlagader.
- Entnahme von Gewebe
- Enthauptung: Wenn die Durchblutung vorbei ist, trennen Sie den Kopf des Tieres mit einem Skalpell vom Körper, indem Sie die Haut und den Muskel durchschneiden und die Klinge zwischen den ersten und zweiten Wirbel einführen.
- Postfixation: Tauchen Sie den Kopf für weitere 48 Stunden bei 4 °C in 4 % PFA in PBS und übertragen Sie ihn dann vor der Gehirnextraktion in PBS.
- Extraktion des Gehirns und der Implantate:
- Entfernen Sie die Haut mit einem Skalpell und beginnen Sie, den Knochen vorsichtig mit einem Rongeur zu schneiden, beginnend mit den ersten Wirbeln, entlang des Rückenmarks bis zum Kleinhirn. Sobald das Kleinhirn freigelegt ist, entfernen Sie vorsichtig die Schläfenknochen und legen Sie den Parietallappen und den Frontallappen frei.
- Schrauben Sie an dieser Stelle den Sockel von der Fußplatte ab und schneiden Sie die Füße der Fußplatte mit einer Zange ab. Entfernen Sie den Knochen in der Nähe des Kabeleingangs in den Schädel, um das Implantatsystem vom Knochen zu befreien, ohne die Implantate aus dem Dura-Mater-Ausgang zu ziehen.
- Wenn die Implantatkabel in den Knochen eingebettet sind, schneiden Sie das Kabel so nah wie möglich am Ausgang durch. Sobald genügend Gehirnoberfläche freigelegt ist, schneiden Sie die Dura vorsichtig mit einer kleinen Schere entlang der Mittellinie ab.
- Befreien Sie die Implantatkabel vom Dura-Mater-Ausgang. Machen Sie Fotos von der Implantation im Gehirn. Verwenden Sie dann einen kleinen Löffel, um das Gehirn von den darunter liegenden Hirnnerven zu lösen. Entferne vorsichtig das Gehirn. Entfernen Sie die Implantate aus dem Gehirn.
- Postfixation des Gehirns: Je nach Perfusionsqualität wird das extrahierte Gehirn erneut für 24 h in 4% PFA in PBS bei 4 °C nachfixiert. In 0,1 M PBS bei 4 °C aufbewahren, bis das Gehirn durchtrennt ist.
- Hirnschnitt: Trennen Sie die beiden Hemisphären mit einer Rasierklinge. Dann schneidest du das Gehirn orthogonal in vier verschiedene Stücke. Schneiden Sie die implantierte Zone in zwei Hälften, um zwei Blöcke zu erhalten, die die implantierte Zone und einen Kontrollbereich enthalten. Bewahren Sie die anderen beiden Blöcke auf, wenn weitere Steuerfolien benötigt werden.
- Kryoprotektion und Einfrieren des Gehirns: Die Hirnblöcke werden zuerst in eine Lösung von 15 % Saccharose und dann 30 % Saccharose bei 4 °C überführt, bis das Gehirn eintaucht und das Gleichgewicht erreicht. Anschließend wird das Gewebe in Isopentan bei -55 °C in einem Gewebegefriersystem eingefroren.
8. Histologie
- Schneiden von Gewebe
- Kryostat: Legen Sie das gefrorene Gehirn in einen Kryostaten und trimmen Sie, bis vollständige Abschnitte erreicht sind. Dann wird das Gehirn in 40-μm-Abschnitte geschnitten und in Dreiergruppen in 0,1 M PBS in Well-Platten getaucht. Achten Sie sorgfältig auf die Reihenfolge der Platten.
- Schnittauswahl: Wählen Sie die Schnitte in Abhängigkeit von der zu analysierenden Zone (implantierte Region oder Kontrollzone) aus. Nehmen Sie die Abschnitte nacheinander aus den Well-Platten und untersuchen Sie sie mit einem feinen Pinsel auf Beschädigungen. Legen Sie sie zur weiteren Färbung in neue Well-Platten, die mit 0,1 M PBS gefüllt sind.
- Immunhistochemie
- Vorbereitung: Inkubation der Schnitte in 0,3 % Triton X/PBS für 15 min, gefolgt von 3 % Rinderserumalbumin (BSA)/PBS für 1 h bei Raumtemperatur (RT).
- Primärantikörper: Inkubieren Sie das Gewebe mit Primärantikörpern für 48 Stunden bei RT (Anti-GFAP, Ratte, verdünnt bei 1/300; Anti-Iba1, Kaninchen, verdünnt bei 1/400; Anti-NeuN, Meerschweinchen, verdünnt bei 1/1.000; alles in 1% BSA/PBS). Decken Sie die Well-Platten mit Aluminiumfolie ab.
- Waschen: Waschen Sie die Vertiefungen dreimal mit 0,1 M PBS für 5 Minuten.
- Sekundäre Antikörper: Inkubieren Sie das Gewebe mit sekundären Antikörpern für 2 Stunden bei RT (Alexa Fluor 488, Alexa Fluor 647, Alexa Fluor 555; alle verdünnt auf 1/400 in 1% BSA/PBS).
- DAPI (4′,6-Diamidino-2-phenylindol): Inkubieren Sie das Gewebe 15 Minuten lang mit DAPI (1/1.000 in 1% BSA/PBS).
- Waschen: Waschen Sie die Vertiefungen mit 0,1 M PBS fünfmal für 15 Minuten.
- Montage: Montieren Sie die Objektträger mit einem Eindeckmedium und einem Deckglas. Bewahren Sie die Objektträger dunkel im Kühlschrank bei 4 °C auf.
- Bildgebung
- Bildgebung ganzer Objektträger: Bildbearbeitung der Objektträger mit 10-facher Vergrößerung (objektiver Arbeitsabstandswert = 3.100 μm) mit einem Objektträger-Scanner-Mikroskop bei drei verschiedenen Wellenlängen (640 nm, 560 nm, 485 nm). Alle Informationen zu Leistung und Gewinn finden Sie in der Zusatzdatei 2.
- Mikroskopische Bildgebung: Fotografieren Sie den interessierenden Bereich bei 20-facher Vergrößerung (Apochromat 20x/0,8 M27) mit einem konfokalen Mikroskop bei vier Wellenlängen (Alexa Fluor 647, DAPI, Cy3, EGFP). Alle Informationen zu Leistung und Verstärkung finden Sie in der Zusatzdatei 3.
Ergebnisse
Um die Platzierung (Abbildung 3A) und die Funktionalität der Geräte zu bestätigen, werden nach der Sockelplatzierung intraoperativ elektrophysiologische Ableitungen durchgeführt. Das Baseline-Signal wird zunächst über 2 Minuten ohne Stimuli als Kontrolle der Basalaktivität erfasst. Zweitens wird das Tier akustisch mit einem Tonstoß bei verschiedenen Frequenzen (500-20.000 Hz) stimuliert, und die Rohdaten werden über den Stimuluszeitraum gemittelt, um auditiv evozierte Potentiale über das Array abzubilden (z. B. bei 800 Hz im Vergleich zum Ausgangswert; Abbildung 3B). Die hier gezeigten Daten sind unverarbeitet, aber wenn zu viel Rauschen vorhanden ist, können Kerb- und Bandpassfilter angewendet werden. Typische Geräuschquellen im Operationssaal sind unter anderem Heizkissen, verstopfte Bohrer und Absaug- oder Kautrizer, die vor der Aufnahme entfernt werden sollten. Bei Wachaufnahmen sollten große Muskelbewegungen um den Kopf herum, wie z. B. Kauen, vermieden werden, um sauberere Datensätze zu erhalten.
Dieses Protokoll wurde zu jedem Zeitpunkt der Aufnahme angewendet, und die Signale für einen einzelnen Kanal konnten über die Zeit verglichen werden. Ein Beispiel ist in Abbildung 3C dargestellt, das die Robustheit und Entwicklung der Antwort zeigt. Die Aufzeichnungskapazität jedes Kontakts über den Zeitverlauf des Experiments kann bewertet werden, indem die Standardabweichung des Basissignals zu jedem Zeitpunkt berechnet wird (Abbildung 3D). In dieser Studie nahm das Signal-Rausch-Verhältnis ab und pendelte sich zwischen Tag 0 und Monat 6 ein, trotz einer gewissen Variabilität aufgrund der begrenzten Dauer des Aufzeichnungszeitraums (d. h. 2 Minuten). Dies kann weiter mit den Elektrodenimpedanzen korreliert werden.
Die In-vivo-Bildgebung wird postoperativ durchgeführt, um den Gehirnzustand und die Implantatpositionierung zu beurteilen. In der ersten Iteration des Protokolls wurde keine intraoperative Röntgenaufnahme durchgeführt, was zu einem gefalteten Gerät führte, wie in Abbildung 4A an einer T1-gewichteten MRT-Sequenz zu sehen ist (siehe zusätzlich Abbildung 4B). Bei dem Tier wurde keine Verhaltensänderung beobachtet, aber im Laufe der Zeit führte dies aufgrund der makroskopischen Kompression des Gehirns um die Implantatstelle herum zu einer fibrotischen Verkapselung um das Gerät herum (Abbildung 4C). Nach dieser Erfahrung wurde das intraoperative Röntgen eingeführt, wie in Abbildung 4D gezeigt, wobei die röntgendichten Marker (schwarze Balken, die auf dem Implantat in Abbildung 4D sichtbar sind) gut positioniert sind. Die Oberfläche des Gehirns ist dann intakt, wie im postoperativen MRT in Abbildung 4E zu sehen ist. Insgesamt ist mit diesem Implantat- und Sockelsystem eine Bildgebung des gesamten Gehirns möglich. Unterschiedliche Sequenzen in den koronalen Ebenen ermöglichen es, anatomische Strukturen zu erkennen (Abbildung 4F,G; T1- und T2-MRT-Sequenzen) oder das Vorhandensein von Flüssigkeit und Blut um das Implantat herum (Abbildung 4H; TSE-gewichtete MRT-Sequenz). Das Sockelsystem erzeugt fast keine Artefakte, abgesehen von einigen kleinen schwarz kontrastierten Hohlräumen um die Titanschrauben herum (siehe Abbildung 4G). Darüber hinaus werden in dieser Studie klinische Elektroden als Komparatoren verwendet, die jedoch aufgrund von Erwärmungs- und Sicherheitsbedenken nicht im MRT abgebildet werden können. Daher werden CT-Scans von diesen Tieren aufgenommen, wie in Abbildung 4I dargestellt. Die Elektroden sind gut sichtbar, und das Sockelsystem hat keinen Einfluss auf die Bildqualität.
Nach der Einnistungsphase wird das Tier durchblutet und das Gehirn entnommen. In dieser Studie wird die Analyse der Entzündungsreaktion auf jede Hemisphäre unabhängig voneinander durchgeführt. Das Schneiden des Gehirns in zwei Hälften ist für die Gewebepräparation vor dem Schneiden einfacher und hat den Vorteil, dass die Schnitte auf Standard-Objektträgern montiert werden können. Ein Beispiel für eine Gehirnprobe ist vor (Abbildung 5A) und nach dem Schneiden in Blöcke (Abbildung 5B) dargestellt. Die Umrisse des Implantats sind deutlich sichtbar und haben eine kleine Delle im Gehirn hinterlassen. Durch das Schneiden in parallelen Ebenen ist das Gewebe dann bereits auf den Kryostaten ausgerichtet, und Schnitte können ohne Gewebeverlust zum Trimmen geschnitten werden (Abbildung 5C). Nach der Färbung wird der gesamte Gewebeschnitt abgebildet (Abbildung 5D), wobei z.B. die Neuronenschicht im Detail deutlich sichtbar ist (siehe NeuN-Marker). Ganze Abschnitte sind zerbrechlich und können manchmal zu einem gewissen Gewebeverlust führen (siehe unten in Abbildung 5D), aber der interessierende Bereich ist intakt. Bei genauerem Hinsehen, ermöglicht durch konfokale mikroskopische Bildgebung bei 40x, sind die Zellen klar definiert und ermöglichen beispielsweise eine feine Untersuchung von Entzündungsmarkern (Abbildung 5E). Weitere quantifizierende Analysen können durchgeführt werden, um die Entzündung zwischen Kontroll- und implantierten Hemisphären zu vergleichen. Abbildung 6 zeigt die elektrochemische Charakterisierung der implantierten Elektroden. Die elektrochemische In-vitro-Impedanzspektroskopie des Soft-Elektroden-Arrays mit Impedanzmodul und Phase ist in Abbildung 6A dargestellt, und der Impedanzmodul bei 1 kHz über 6 Monate nach der Implantation ist in Abbildung 6B dargestellt.
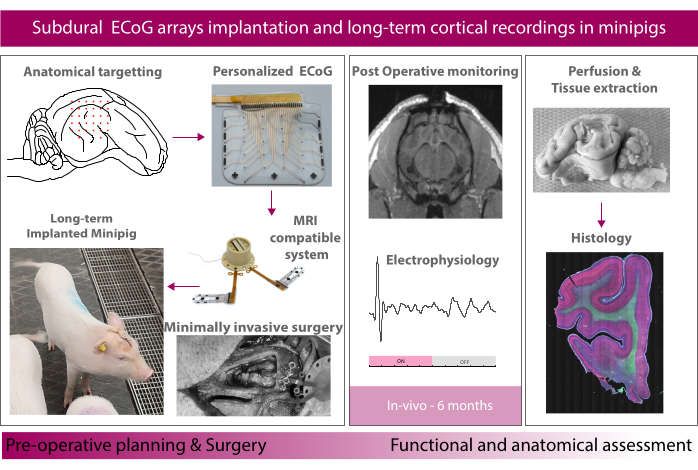
Abbildung 1: Schematische Darstellung des Experiments. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
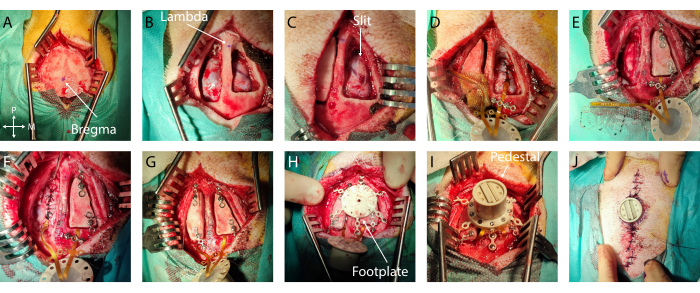
Abbildung 2: Minimalinvasive Implantation von weichem ECoG in das Gehirn . (A) Chirurgischer Zugang zum Schädel mit Indikation eines Bregmas. (B) Beidseitige Kraniotomie mit sichtbarer Dura mater. (C) Schlitzdurotomie auf der ersten Hemisphäre. (D) Subdurale Implantation von weichem ECoG und Dura-Mater-Verschluss. (E) Schlitzdurotomie auf der zweiten Hemisphäre. Knochenlappenfixierung auf der ersten Hemisphäre mit Hilfe von Titanbrücken. (F) Implantation von weichem ECoG auf der zweiten Hemisphäre und dem Dura-Mater-Verschluss. (G) Fixierung des Knochenlappens auf der zweiten Hemisphäre. (H) Positionierung der Fußplatte auf dem Schädel. (I) Sockelbefestigung auf der Fußplatte. (J) Hautverschluss um die Sockelbasis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
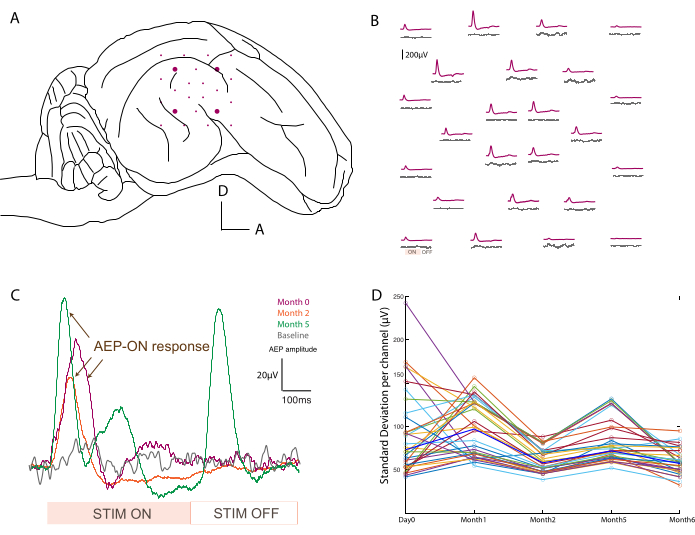
Abbildung 3: Aufzeichnung von akustisch evozierten Potentialen . (A) Schematische Darstellung der Elektrodenplatzierung an der Oberfläche des Temporallappens. (B) Repräsentative Abbildung der Baseline-Aktivität (graue Spuren) und der auditiv evozierten Potentiale als Reaktion auf eine 800 Hz-Ton-Burst-Stimulation (violette Spur). Jeder Mittelwert entspricht einem Kanal auf dem Soft-ECoG-Array. Die Mittelwertbildung wird am analogen Eingangssignal der Schallstimulation ausgelöst. Die akustischen Stimulationsperioden "ON" und "OFF" werden auf einem Kanal unten links notiert. (C) Entwicklung im Zeitverlauf (Tag 0, Monat 2 und Monat 5) einer Einkanalantwort nach akustischem Stimulus im Vergleich zum Basissignal, wenn kein Stimulus präsentiert wird (grau). Die Mittelwertbildung wird am analogen Eingangssignal der Schallstimulation ausgelöst. Die Stimulationsperioden "ON" und "OFF" sind unten vermerkt. Das evozierte Potential der "ON"-Stimulation ist mit Pfeilen markiert. (D) Standardabweichung pro Kanal (farbige Punkte) pro Zeitpunkt der Baseline-Aufzeichnung. Medianwerte werden in fettem Blau dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
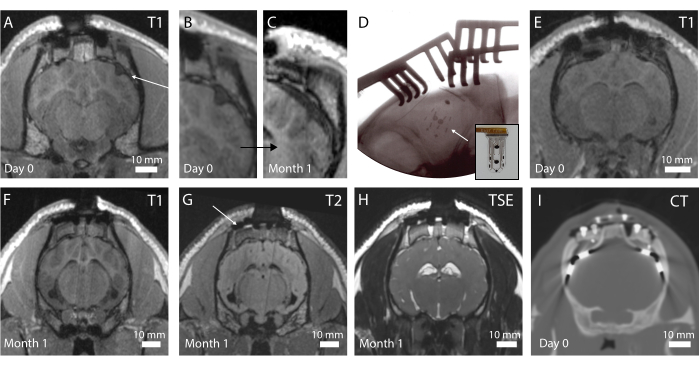
Abbildung 4: In-vivo-Bildgebung des Gehirns und der implantierten Elektroden . (A) Postoperative T1-gewichtete MRT in der koronalen Ebene. Ein Pfeil zeigt ein gefaltetes Implantat an. (B) Vergrößerter Teil von A, bei dem die Faltung des Implantats eine Delle im Gehirn erzeugt. (C) T1-gewichtete MRT nach 1 Monat Implantation, die eine Kompression des Gehirns aufgrund der fibrotischen Verkapselung des Gehirns an der gleichen Stelle wie C zeigt. (D) Intraoperatives Röntgenbild in der Ebene, das die Implantatinsertion und keine Faltung überprüft, wie durch die röntgendichte Markerplatzierung beobachtet. Einschub: Foto des Implantats mit röntgendichter Markierung sichtbar. (E) Postoperative T1-gewichtete MRT in der koronalen Ebene mit optimaler Implantatinsertion. (F) T1-gewichtete MRT nach 1 Monat Implantation. (G) T2-gewichtete MRT nach 1 Monat Implantation. Ein Pfeil zeigt das bildgebende Artefakt der Titanschrauben, die die Fußplatte auf dem Schädel fixieren. (H) TSE-gewichtete MRT nach 1 Monat Implantation. (I) CT-Scan des Tieres, dem die klinischen Elektroden implantiert wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
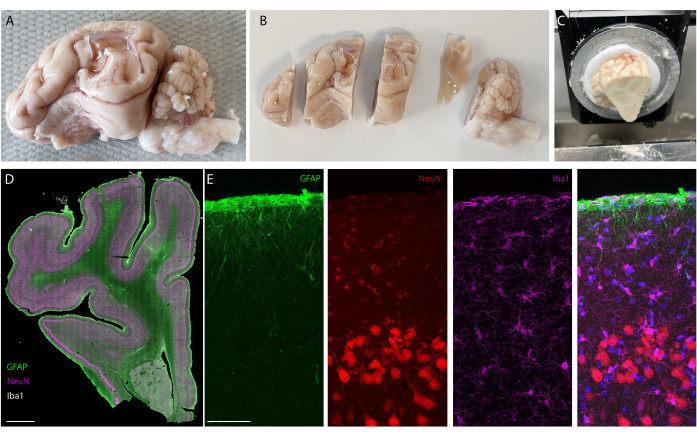
Abbildung 5: Histologische Analyse des Gehirns nach Langzeitimplantation. (A) Foto einer explantierten und durchbluteten linken Gehirnhälfte. (B) Perfundiertes Gehirn, das vor dem Einfrieren in Blöcken geschnitten wurde. (C) Bild des gesamten Blockschnitts auf dem Kryostaten; Die gesamten "vorgeschnittenen Blöcke" können geschnitten werden. (D) Immunfärbende Bildgebung der gesamten Hemisphäre (Objektträgerscanner, 20-fach-Objektiv) und (E) Zoomen auf die ersten Schichten des Kortex (konfokale Bildgebung, 40-faches Objektiv) mit Gliazellen, Astrozyten und Neuronen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
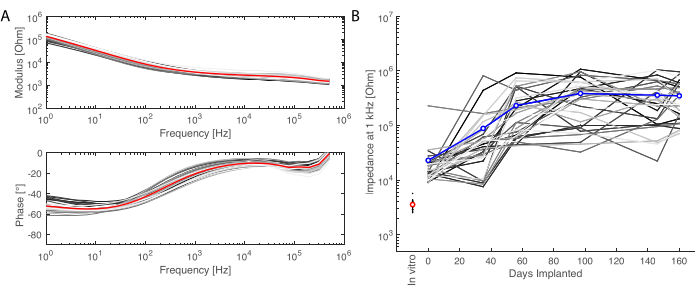
Abbildung 6: Elektrochemische Charakterisierung der implantierten Elektroden. (A) Elektrochemische In-vitro-Impedanzspektroskopie des Soft-Elektroden-Arrays (kleine graue Linien für jeden Kanal, Mittelwert rot) mit Impedanzmodul (oben) und Phase (unten). (B) Entwicklung des Impedanzmoduls bei 1 kHz über 6 Monate nach der Implantation (Mittelwert blau; graue Linien sind die einzelnen Kanäle; die In-vitro-Messung ist als Referenz in rot angegeben). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: MRT-kompatibler Sockel. (A) Chronisches MRT-kompatibles transdermales Verbindungssystem (Sockel) für den Zugang zum Soft-Elektroden-Array. (B) Sockel mit Elektroden, die auf der Fußplatte zur Schädelverankerung montiert sind. Einschub: Details der Fußplatte. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Chirurgischer Zugang für eine optimale Durchblutung des Gehirns. (A) Hautschnitt und Zugang zur Lage der Halsschlagader und der Halsschlagader. (B) Dissektion des Gewebes um die Blutgefäße. (C,D) Identifizierung und Dissektion des Gewebes um die Halsschlagader und die Halsschlagader. (E) Isolierung der Halsschlagader vom darunter liegenden Gewebe. (F) Isolierung der Jugularvene aus dem darunter liegenden Gewebe. (G) Platzierung des Nahtdrahtes um die Halsschlagader (Naht 1 und Naht 2) und die Halsschlagader (Naht 3). (H) Verschluss der Naht 3 an der Basis der Halsschlagader (Herzseite), um Blutungen während der Öffnung des Gefäßes zu vermeiden. (I) Abklemmung der Halsschlagader auf der H gegenüberliegenden Seite. (J) Durchtrennung der Halsschlagader. (K) Eingeführter Katheter in die Öffnung von J. Einsatz: Vorbereiteter Katheter mit Kochsalzlösung, die aus einer Spritze an die Katheterspitze gespült wird. (L) Verschluss von Naht 2, um den Katheter an Ort und Stelle und entlang der Arterie zu halten. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 1: Parameter für T1- (Seiten 1-2), T2- (Seiten (3-4) bzw. TSE-gewichtete (Seiten 5-6) MRT-Sequenzen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 2: Metadaten für Objektträgerscanner für die Bildgebung ganzer Objektträger von gefärbten Hirnschnitten. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 3: Metadaten für die konfokale Bildgebung von vergrößerten Schnitten gefärbter Hirnschnitte. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Wir berichten hier über eine Methode zur Langzeitimplantation und Evaluierung von weichen ECoG-Arrays. In dieser Studie haben wir einen konsistenten, minimal-invasiven chirurgischen Ansatz für die bilaterale Implantation von funktionellen Elektrodengittern über den Temporallappen (hier auf den auditorischen Kortex abzielend) entwickelt. Wir evaluierten zunächst die Funktionalität des Gitters, indem wir die evozierten Potentiale über den Zeitraum der Studie (6 Monate) erfolgreich aufzeichneten und die elektrochemischen Eigenschaften der Elektroden verfolgten (siehe Abbildung 6). Zweitens bewerteten wir die Biosicherheit der Gitter, in vivo durch MRT und die Etablierung eines vollständig MRT-kompatiblen Systems und postmortal durch die Entwicklung eines Protokolls für die Gewebeentnahme und Immunfärbung.
Um die Invasivität zu minimieren, haben wir die Größe des Kraniotomiefensters optimiert. Um den auditorischen Kortex im Temporallappen zu erreichen und eine Resektion des Schläfenmuskels zu vermeiden, haben wir eine Technik entwickelt, bei der das Implantat unter die Dura geschoben wird. Diese Technik ermöglicht es, die Oberfläche des exponierten Gehirns drastisch zu verkleinern und dennoch weit entfernte Ziele zu erreichen. Während diese Art der Implantation blind erscheinen mag, ermöglicht die Implementierung von röntgendichten Markern auf den Geräten, die im Röntgenbild der intraoperativen Ebene visualisiert werden, die Überprüfung der Positionierung und stellt sicher, dass das Array nicht unter die Dura mater gefaltet wird. Das subdurale Gleiten hat sich bei den meisten Wiederholungen, die wir durchgeführt haben, als sicher erwiesen. Darüber hinaus minimiert die Durotomie in einem Schlitzzugang die Vorwölbung des Gehirns während der Zeit, in der die Kraniotomie geöffnet ist, und erleichtert den Verschluss um das Implantat herum, ohne dass zusätzliches Material wie künstliche Dura mater erforderlich ist, die die Entzündungsreaktion verzerren könnten. Schließlich liegt die Stärke dieses chirurgischen Ansatzes in seiner Fähigkeit, auf verschiedene kortikale Regionen übertragen zu werden. Das Spiel mit Koordinaten, der Kraniotomieposition und der Gerätegröße, die alle angepasst werden können, ermöglicht es dieser Methode, den größten Teil des Kortexbereichs anzuvisieren.
Die hier vorgestellte Operationsmethode, zusammen mit der funktionellen Bewertung und der Untersuchung der Biointegration über die Zeit, ist nicht auf die in diesem Bericht verwendete Softelektrodentechnologie beschränkt. Andere subdurale Elektroden, die für die menschliche Translation entwickelt werden, könnten mit dem gleichen Protokoll ausgewertet werden. Die Stärke dieser Methode beruht auf der Tatsache, dass die meisten Teile, wie z. B. das Kabel und der Sockel, modular und personalisierbar sind und an das jeweilige Prüfgerät angepasst werden können. Darüber hinaus können auch intrakortikale oder tief eindringende Sonden anstelle oder in Kombination mit den subduralen Elektroden verwendet werden, da hierfür nur die Kraniotomie- und Durotomiegeometrie angepasst werden muss. Die Langzeitergebnisse können dann mit ihren klinischen Pendants verglichen werden, wie wir es hier getan haben.
Eine der Haupteinschränkungen der vorgestellten Methode ist das Vorhandensein von Schädelhöhlen bei Minischweinen, die sich im Laufe des ersten Lebensjahres entwickeln12. Wichtige Aspekte, die in diesem Zusammenhang zu berücksichtigen sind, sind das Alter der Einnistung und auch die Größe des Tieres. Die Durchführung von Kraniotomien im Schädel eines Erwachsenen zerstört die Integrität der Nasennebenhöhlen und führt zu einem hohen Risiko für schwere Infektionen in chronischen Situationen. Solche Nasennebenhöhlen sind präoperativ im ebenen Röntgen- und CT-Scan sichtbar. Auf der anderen Seite ist eine zu frühe chronische Implantation bei einem zu kleinen Tier auch nicht optimal, wenn der Schädel massiv wächst und umgebaut wird. Wir stellten die Hypothese auf, dass diese "Schädelbewegungen" nach der Operation dazu führen könnten, dass sich das Implantat bewegt und faltet, was letztendlich für das Experiment nachteilig ist. Wir haben hier festgestellt, dass Göttinger Minischweine, die zum Zeitpunkt der Implantation etwa 5-6 Monate alt (und 8 kg) sind, die besten Ergebnisse liefern sollten.
Um die Leistung des implantierten ECoG für elektrophysiologische Aufzeichnungen zu bewerten, haben wir ein Schnellprotokoll für die Aufzeichnung des auditiv evozierten Potentials (AEP) erstellt, das bei sich frei bewegenden Tieren und unter Sedierung verwendet werden kann. Es besteht darin, eine Reihe von akustischen Tonausbrüchen bei bestimmten Frequenzen im Laufe einiger Minuten zu präsentieren. Der Vorteil eines solchen Protokolls besteht darin, dass es auf die verfügbare Aufnahmelänge abgestimmt werden kann, indem die Anzahl der abgetasteten Frequenzen reduziert wird. Eine Herausforderung bei der Aufzeichnung kortikaler Signale unter Narkose besteht darin, dass bei der Analyse und dem Vergleich der Daten der Bewusstseinszustand des Tieres berücksichtigt werden sollte.
Das Protokoll für die Perfusion wurde im Laufe der Zeit durch Beobachtung der Qualität des extrahierten Gehirns angepasst. In der Tat fanden wir es einfacher, nur die Halsschlagader und nicht die Halsschlagader zu katheterisieren. In der Literatur werden zunächst Methoden vorgestellt, bei denen die Halsvene katheterisiert wird, um Abfall abzuleiten20. In der Praxis schränkt dies den Abfluss aus dem Gehirn ein und führt zu einer schlechteren Blutentnahme und einer schlechteren Durchblutungsqualität. Durch das Durchtrennen der Halsschlagader und das Entweichen der Flüssigkeit in einem großen Behälter, in dem das Tier liegt, erhöht sich die Effizienz der Durchblutung.
Wir haben eine robuste Methode zur Gewebepräparation entwickelt, die mit Antikörpern arbeitet, die routinemäßig zur Entzündungsverfolgung verwendet werden. Wir haben die beiden Hemisphären aus praktischen Gründen getrennt, da die Hälfte des Schweinegehirns auf Standard-Objektträger passt und somit mit den meisten bildgebenden Geräten kompatibel ist, die in histologischen Labors erhältlich sind. Durch das Schneiden des Gehirns in Blöcke wird ein direkter Zugang zur interessierenden Zone ermöglicht, ohne dass das gesamte Gehirn weiter durchtrennt oder große Teile des Gewebes gekürzt werden müssen. Die Gehirnschnitte bei 40 μm können in Standard-Well-Platten gepoolt und frei schwebend gefärbt werden, ohne dass sich das Protokoll durch die Immunfärbungen anderer Spezies grundlegend ändert. Eine vollständige Immunfärbung des Gehirns könnte auch durch die Verwendung von z. B. CLARITY-Methoden21 in Betracht gezogen werden.
Insgesamt ist dieses Protokoll, das das personalisierte Implantatdesign bis hin zur Implantation, der Funktionsüberwachung und der Bewertung der biologischen Sicherheit abdeckt, robust und konsistent. Wir haben hier gezeigt, dass es möglich ist, das auditorische System zu untersuchen, aber es kann auch auf andere physiologische Funktionen übertragen werden. Darüber hinaus liegt die Stärke unserer Methode in der Tatsache, dass sie nicht auf Minischweine beschränkt ist, sondern vollständig auf andere Arten wie Schafe, Ziegen oder nichtmenschliche Primaten übertragbar ist. Bis zu einem gewissen Grad lässt es sich auch leicht an Ratten anpassen.
Offenlegungen
F.F. und S.P.L. sind Mitbegründer und Aktionäre von Neurosoft Bioelectronics SA, die weiche Elektrodenarrays entwickeln.
Danksagungen
Die Autorinnen und Autoren bedanken sich für die finanzielle Unterstützung durch die Bertarelli-Stiftung und das SNF-Stipendium Sinergia CRSII5_183519. Die Autoren danken auch Katia Galan von der EPFL für ihre Hilfe bei der Entwicklung des Färbeprotokolls für die Histologie, den Mitarbeitern der Neural Microsystems Platform des Wyss Center for Bio and Neuroengineering in Genf für ihre Hilfe bei den Herstellungsprozessen, den Mitarbeitern der Tierplattform im University Medical Center (CMU) der Universität Genf (UNIGE) für die Tierpflege, chirurgische Assistenz und postoperatives Management des Minischweins (John Diaper, Xavier Belin, Fabienne Fontao und Walid Habre), der Teammitglieder des Zentrums für Biomedizinische Bildgebung (CIBM) der Universität Genf (Julien Songeon, François Lazeyras und Rares Salomir), der Mitarbeiter der Pathologie des Universitätsspitals Genf (HUG) (Sami Schranz, Francesca Versili, Ruben Soto und Coraline Egger) und Blaise Yvert von der Université Grenobles-Alpes für seinen Input und Austausch über chronische Minischwein-Experimente. Die Autoren danken den Mitarbeitern von Neurosoft Bioelectronics SA für ihre Hilfe beim Herstellungsprozess und für ihre Hilfe bei den Minipig-Experimenten (Benoit Huguet und Margaux Roulet).
Materialien
| Name | Company | Catalog Number | Comments |
| Bone drill | BBraun | Elan 4 with GA861 handpiece | |
| Bone drill bit | BBraun | Neurocutter GP204R | |
| Bonewax | Ethicon | W31G | |
| Catheter | Venisystems | Abbocath 14G | |
| Confocal Microscope | Zeiss | LSM 880 | |
| Cryostat | Leica | CM1950 | |
| Gelfoam | Pfizer | Gelfoam | |
| Insert speakers | Etymotic | Etymotic ER2 insert Earphones | |
| Multimeter | Fluke | Fluke 1700 | |
| Oscilloscope | Tektronix | MDO3014 Mixed Domain Oscilloscope | |
| Perfusion pump | Shenzen | LabS3/UD15 | |
| Potentiostat | Gamry Instruments | Reference 600 | |
| Primary Antibody Anti-GFAP | Thermofischer | Anti-GFAP, Rat, # 13-0300 | |
| Primary Antibody Anti-Iba1 | Fujifilm | Anti Iba1, Rabbit, 019-19741 | |
| Primary Antibody Anti-NeuN | SigmaAldrich | Anti-NeuN, GuineaPig, ABN90 | |
| Pulse Generator | AM Systems | Model 2100 Isolated Pulse Stimulator | |
| Recording headstage | Multichannel systems | W2100-HS32 | |
| Recording system | Multichannel systems | W2100 | |
| Screwdriver | Medtronic | Handle: 001201, Shaft: 8001205 | |
| Secondary Antibody 488 | Thermofischer | Goat anti-Rat IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488, # A-11006 | |
| Secondary Antibody 555 | Thermofischer | Goat anti-Guinea Pig IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555, # A-21435 | |
| Secondary Antibody 647 | Thermofischer | Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 647, # A-21245 | |
| Slide Scanner | Olympus | VS120 | |
| Snapfrost | Excilone | Excilone Snapfrost | |
| Stab knife | Fine Science Tools | 10316-14 | |
| Suture wire dermal | Ethicon | Vicryl 2-0 | |
| Suture wire dura mater | Ethicon | Mersilk 5-0 | |
| Suture wire for catheter | Ethicon | Vycril 3-0 without needle | |
| Suture wire for lifting dura | Ethicon | Prolene 6-0 with BV-1 needle | |
| Suture wire subcutaneous | Ethicon | Vicryl 4-0 | |
| Titanium bridge | Medtronic | TiMesh 015-2001-4 | Cut out the required size |
| Titanium screws | Medtronic | 9001635, 9001640 | |
| X-ray system | GE | GE OEC 9800 Plus C-Arm |
Referenzen
- Ritaccio, A. L., Brunner, P., Schalk, G. Electrical stimulation mapping of the brain: Basic principles and emerging alternatives. Journal of Clinical Neurophysiology. 35 (2), 86-97 (2018).
- Mullin, J. P., Sexton, D., Al-Omar, S., Bingaman, W., Gonzalez-Martinez, J. Outcomes of subdural grid electrode monitoring in the stereoelectroencephalography era. World Neurosurgery. 89, 255-258 (2016).
- Vansteensel, M. J., et al. Fully implanted brain-computer interface in a locked-in patient with ALS. The New England Journal of Medicine. 375 (21), 2060-2066 (2016).
- Lacour, S. P., Courtine, G., Guck, J. Materials and technologies for soft implantable neuroprostheses. Nature Reviews. Materilas. 1, 16063 (2016).
- Fallegger, F., Schiavone, G., Lacour, S. P. Conformable hybrid systems for implantable bioelectronic interfaces. Advanced Materials. 32 (15), 1903904 (2019).
- Pearce, A. I., Richards, R. G., Milz, S., Schneider, E., Pearce, S. G. Animal models for implant biomaterial research in bone: A review. European Cells & Materials. 13, 1-10 (2007).
- Swindle, M. M., Makin, A., Herron, A. J., Clubb, F. J., Frazier, K. S. Swine as models in biomedical research and toxicology testing. Veterinary Pathology. 49 (2), 344-356 (2012).
- Khoshnevis, M., et al. Development of induced glioblastoma by implantation of a human xenograft in Yucatan minipig as a large animal model. Journal of Neuroscience Methods. 282, 61-68 (2017).
- Borton, D., et al. Developing implantable neuroprosthetics: A new model in pig. Annual International Conference of the IEEE Engineering in Medicine & Biology Society. 2011, 3024-3030 (2011).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Gierthmuehlen, M., et al. Evaluation of mECoG electrode arrays in the minipig: Experimental procedure and neurosurgical approach. Journal of Neuroscience Methods. 202 (1), 77-86 (2011).
- Palma, M., et al. Chronic recording of cortical activity underlying vocalization in awake minipigs. Journal of Neuroscience Methods. 366, 109427 (2022).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C. H., Palomero-Gallagher, N. The telencephalon of the Göttingen minipig, cytoarchitecture and cortical surface anatomy. Brain Structure & Function. 222 (5), 2093-2114 (2017).
- Lind, N. M., et al. The use of pigs in neuroscience: Modeling brain disorders. Neuroscience and Biobehavioral Reviews. 31 (5), 728-751 (2007).
- Shepherd, R. K., Villalobos, J., Burns, O., Nayagam, D. A. X. The development of neural stimulators: A review of preclinical safety and efficacy studies. Journal of Neural Engineering. 15 (4), 041004 (2018).
- Schiavone, G., et al. Soft, implantable bioelectronic interfaces for translational research. Advanced Matererials. 32 (17), 1906512 (2020).
- Fallegger, F., et al. MRI-compatible and conformal electrocorticography grids for translational research. Advanced Science. 8 (9), 2003761 (2021).
- Minev, I. R., Wenger, N., Courtine, G., Lacour, S. P. Research update: Platinum-elastomer mesocomposite as neural electrode coating. APL Materials. 3 (1), 014701 (2015).
- Schiavone, G., et al. Guidelines to study and develop soft electrode systems for neural stimulation. Neuron. 108 (2), 238-258 (2020).
- Musigazi, G. U., De Vleeschauwer, S., Sciot, R., Verbeken, E., Depreitere, B. Brain perfusion fixation in male pigs using a safer closed system. Laboratory Animals. 52 (4), 413-417 (2018).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nature Methods. 10 (6), 508-513 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten