Method Article
경막하 연피질검사(ECoG) 어레이 이식 및 Minipig의 장기 피질 기록
요약
여기에서는 수술 방법 및 도구, 수술 후 자기 공명 영상, 청각 피질의 전기 생리학, 임플란트의 전기 화학적 특성 및 사후 면역 화학을 설명하는 minipig 모델에서 연질 경막하 전극 어레이의 장기 성능 및 안전성 평가 방법을 제시합니다.
초록
신경 장애 및 질병은 피질 전기 검사(ECoG) 어레이를 사용하여 진단하거나 치료할 수 있습니다. 약물 내성 간질에서 이들은 절제할 간질 부위를 묘사하는 데 도움이 됩니다. 뇌-컴퓨터 인터페이스와 같은 장기 응용 분야에서 이러한 피질 상부 전극은 뇌의 운동 의도를 기록하고 마비 환자의 로봇 팔다리를 제어하는 데 사용됩니다. 그러나 현재의 뻣뻣한 전극 그리드는 고해상도 뇌 기록 및 장기 생체 통합의 필요성에 부응하지 못합니다. 최근에는 고성능으로 장기간의 임플란트 안정성을 달성하기 위해 순응 가능한 전극 어레이가 제안되고 있다. 그러나 이러한 새로운 임플란트 기술에 대한 전임상 연구는 인간 환자에게 적용하기 위한 장기적인 기능 및 안전성 프로파일을 검증하기 위해 필요합니다. 이러한 맥락에서 돼지 모델은 장기 크기가 크고 동물을 쉽게 다룰 수 있기 때문에 의료 기기 개발에 일상적으로 사용됩니다. 그러나 문헌에는 몇 가지 뇌 응용 분야만 설명되어 있으며, 대부분 수술의 한계와 살아있는 동물에 대한 임플란트 시스템의 통합으로 인해 설명됩니다.
여기에서는 장기 이식(6개월) 방법과 minipig 모델에서 소프트 ECoG 어레이의 평가를 보고합니다. 이 연구는 먼저 전기생리학 기록을 위한 계측 커넥터를 수용하는 자기공명영상(MRI) 호환 고분자 경피 포트와 통합된 연질 미세 가공 전극 어레이로 구성된 임플란트 시스템을 제시합니다. 그런 다음 연구는 경막하 이식에서 동물 회복에 이르는 수술 절차를 설명합니다. 우리는 청각 자극에 의해 유발된 전위가 유도되는 표적 영역의 예로서 청각 피질에 초점을 맞춥니다. 마지막으로 전체 뇌의 MRI, 임플란트 전기화학적 특성 분석, 수술 중 및 자유롭게 움직이는 전기생리학, 추출된 뇌의 면역조직화학 염색을 포함하는 데이터 수집 시퀀스를 설명합니다.
이 모델은 피질 보철물의 새로운 디자인의 안전성과 기능을 조사하는 데 사용할 수 있습니다. 인간 환자에 대한 번역을 구상하기 위한 필수 전임상 연구.
서문
신경 장애 및 질병은 피질 전기 검사(ECoG) 어레이를 사용하여 진단하거나 치료할 수 있습니다. 이 전극 격자는 뇌 표면에 이식되어 인간 피질(human cortex)1을 기록하거나 자극할 수 있다. 예를 들어, 약물 내성 간질의 경우, 뇌전증 부위를 절제하는 데 도움이 된다2. 뇌-컴퓨터 인터페이스와 같은 장기적인 응용 분야에서 이러한 피질 상부 전극은 뇌의 운동 의도를 기록하고 마비 환자의 로봇 팔다리를 제어하는 데 사용됩니다3. 그러나 현재의 전극 그리드는 단단한 고분자 기판에 내장된 단단한 금속 블록으로 만들어지며 고해상도 뇌 기록 및 장기 경막하 생체 통합(>30일)의 필요성에 부응하지 못합니다. 오히려, 이식된 장치의 섬유화 캡슐화로 이어지는 국소 조직 반응을 일으켜 시간이 지남에 따라 성능이 저하됩니다. 최근에, 미세 가공 기술에 의해 제조된 얇은 고분자 기판을 사용하는 유연하거나 신축성 있는 전극 어레이는 조직 반응 4,5를 제한함으로써 장기 이식에서 높은 성능을 달성하기 위해 제안되었습니다. 그러나 이러한 새로운 임플란트 기술에 대한 전임상 연구는 장기적인 기능 및 안전성 프로파일을 검증하여 인간 환자에 대한 번역을 구상할 수 있도록 해야 합니다. 이러한 맥락에서, 미니피그 및 돼지 모델은 장기 크기가 크고 동물을 쉽게 다룰 수 있기 때문에 다른 의학적 맥락(예: 심혈관, 골격 또는 위계)의 장치 개발에 일상적으로 사용됩니다 6,7,8. 그러나, 신경 생리학을 위해 뇌를 표적으로 하는 몇 가지 응용 프로그램만이 문헌에 기술되어 있는데, 이는 대부분 외과적 접근의 한계와 살아있는 동물에 대한 임플란트 시스템의 통합으로 인한것이다 9,10,11,12. 이는 예를 들어 이식 가능한 임베디드 전자 장치와 같은 복잡한 하드웨어의 개발이 필요하기 때문에 살아있는 동물의 만성 이식과 호환되지 않는 경우가 많습니다. 또한, 그들은 중개 연구의 생물학적 안전성 측면에 중요한 표적 조직에 대한 임플란트 시스템의 영향을 조사하지 않습니다. 돼지 모델은 피질 구조, 두개골 뼈 및 피부 두께13 측면에서 인체 해부학에 가깝습니다. 또한, 행동 과제를 학습하는 능력은 기능적 재활 전략이나 감각 지각을 조사하기 위한 강력한 모델이 된다14.
새로운 기술과 치료법을 인간에게 적용하기 위해서는 유능한 의료 당국의 요구에 따라 안전성과 효능에 대한 평가가 필요합니다. 이는 일반적으로 기술 문서 및 규범15에 설명되어 있지만 이러한 테스트의 통과만 요구하며 안전 연구와 병행하여 장치 이식 또는 기타 유용한 데이터 수집의 실제 효과를 조사하지 않습니다. 뇌에 대한 완전한 생물 안전성 및 성능 연구를 위해 뇌 영상 데이터, 전기 생리학적 측정, 이식된 전극의 전기화학적 특성 평가 및 돼지 모델의 사후 조직학의 종단적이고 체계적인 수집을 제시합니다. 이를 달성하기 위해서는 완전한 실험 모델을 만들기 위해 몇 가지 측면을 고려해야 합니다: (i) 전극에 연결하기 위한 기계적으로 안정적인 경피 포트와 함께 장치 이식을 위한 최소 침습적 수술 접근, (ii) 마취 및 자유롭게 움직이는 조건에서 이식된 전극에 대한 성능 출력 역할을 하는 강력한 전기생리학적 기록 패러다임, (iii) 뇌 및 임플란트의 진화를 추적하기 위한 서로 다른 시점에서의 생체 내 영상(컴퓨터 단층 촬영[CT] 및/또는 자기 공명 영상[MRI]) 및 이식된 시스템과 영상 장비의 호환성, (iv) 조직학적 분석을 위해 뇌를 추출하기 위한 조직 준비 파이프라인.
여기에서는 장기 이식 방법(6개월)과 minipig 모델(그림 1에 개략적으로 표시)에서 소프트 ECoG 어레이 평가에 대해 보고합니다. 연질 전극 어레이는 이전 보고서에서 제시되었으며 전기 트랙으로 사용되는 탄성 금 박막을 내장한 얇은 실리콘 멤브레인으로 만들어집니다(16,17). 조직과의 접촉은 뇌 조직(18)에 대한 부드럽고 효율적인 전기화학적 인터페이스를 위해 실리콘 매트릭스에 내장된 백금 나노입자의 혼합물을 통해 이루어진다. 임플란트는 두개골과 피부를 통해 관통하는 유연한 케이블을 통해 동물의 머리에 있는 커넥터를 수용하는 경피 포트에 연결됩니다. 임플란트의 크기와 모양은 대상과 연구의 필요에 따라 맞춤화할 수 있습니다. 이 연구의 현재 전극 스트립은 임상 스트립의 실제 크기를 반영합니다. 임상적으로 이용 가능한 경막하 스트립과 그리드를 동일한 접근법을 사용하여 비교기로 사용했습니다. 고분자 MRI 호환 경피 포트는 두개골에 단단히 고정하는 발판 시스템을 사용하여 두개골에 배치됩니다. 여기에서는 양쪽 반구의 경막하 이식부터 동물의 회복에 이르기까지 수술 절차에 대해 자세히 설명합니다. 우리는 청각 피질(auditory cortex)을 표적 영역의 예로 들며, 여기서 유발된 전위는 마취된 조건과 자유롭게 움직이는 조건 모두에서 음향 자극에 의해 유도됩니다. 다른 시점에서 동물의 뇌는 마취 하에 MRI(또는 임상 전극의 경우 CT)로 이미지화되고 전극의 전기화학적 특성이 측정됩니다. 전극 특성화 방법은 임플란트 및 전극-조직 계면의 진화를 추적하는 데 사용됩니다(자세한 내용은 Schiavone et al.19 참조). 여기에는 전극 접촉의 자극 능력을 조사하기 위한 크로노암페로메트리, 전극의 저항 및 용량성 구성 요소의 진화를 나타낼 수 있는 전기화학 임피던스 분광법(EIS), 밀폐 캡슐화 실패를 조사하기 위한 채널 간 저항 측정이 포함됩니다. 마지막으로, 안락사 후 뇌에 관류하고, 전극을 삽입하고, 절제하고, 다양한 염증 마커를 사용하여 조직학적 분석을 수행하는 조직 추출 파이프라인을 개발했습니다. 전반적으로, 이 방법은 뇌에 대한 새로운 기술 및 치료법의 향후 임상 번역을 위한 강력한 다중 모드 데이터 수집을 통해 전임상 연구를 가능하게 할 것입니다.
프로토콜
수술 및 행동 절차는 실험실 동물의 관리 및 사용 지침에 따라 지역 윤리 위원회의 승인을 받았으며 승인 번호 GE11120A로 지역(제네바 주) 및 연방(스위스) 수의학 당국의 승인을 받았습니다. 이 연구에서는 생후 2-6개월(5-8kg)의 암컷 괴팅겐 미니피그(n=7)를 사용했습니다.
1. 수술 전 계획
- 연질 임플란트 시스템의 체외 특성 분석
- 크로노암페로메트리: 펄스 발생기에 병렬로 연결된 오실로스코프를 사용하여 바이페이직 전류 펄스 진화(즉, 전압 과도 [VT]) 주입 시 전압 강하를 기록합니다. 펄스 발생기를 각 전극과 식염수(인산염 완충 식염수[PBS] 1x)의 백금 카운터에 순차적으로 연결합니다. 설정은 3.1단계를 참조하십시오.
- 전기화학 임피던스 스펙트로그램: 전위차계를 사용하여 다양한 주파수에서 전기화학 임피던스를 측정합니다. 식염수(PBS 1x)에서 백금 카운터와 Ag/AgCl 기준 전극을 사용하여 전위차계를 각 전극에 순차적으로 연결합니다. 설정은 3.2단계를 참조하십시오.
- 채널 간 저항: 건조한 상태에서 휴대용 멀티미터를 사용하여 인접 채널 간의 직류(DC) 저항을 측정합니다.
- 임플란트 선택: 위에서 언급한 세 가지 측정 후 1kHz에서 임피던스가 100kΩ 미만이고 채널 간 저항이 1MΩ 미만이 아닌 기준에 따라 임플란트를 선택합니다.
- 멸균
- 임플란트 멸균: 선택한 임플란트를 멸균 마커와 함께 멸균 백에 개별적으로 넣고 밀봉합니다. 수술 중 멸균을 보장하기 위해 이중 포장을 사용하십시오.
참고: 이 경우 짧은 시간 주기와 저온(55°C)으로 인해 과산화수소(H2O2) 가스 살균이 사용됩니다. 대안은 에틸렌옥사이드(ETO) 가스 또는 오토클레이브 멸균이지만 임플란트 시스템과의 호환성이 보장되어야 합니다. - 기구 멸균: 세척된 기구를 멸균 마커와 함께 이중 멸균 백 또는 멸균 기구 상자에 넣습니다. 오토클레이브 멸균은 기기에 가장 일반적이지만 H 2 O2또는 ETO가 가능한 대안입니다.
- 임플란트 멸균: 선택한 임플란트를 멸균 마커와 함께 멸균 백에 개별적으로 넣고 밀봉합니다. 수술 중 멸균을 보장하기 위해 이중 포장을 사용하십시오.
2. 연질 ECoG 어레이의 외과적 이식
- 마취
- 약물 투여 전: 동물을 격리하고 밤새 금식시킵니다. 미다졸람 0.75mg/kg, 아트로핀 0.25μg/kg, 할돌 0.1mg/kg의 혼합물을 피내로 주사하고 동물이 진정될 때까지 기다립니다. 계속하기 전에 동물의 무게를 잰다.
- 정맥 주사(IV) 리드 설치:
- 동물을 온열 패드의 수술 테이블 위에 놓습니다. 3%-3.5%의 세보플루란을 사용하여 동물에게 안면 마스크를 씌워 마취를 유도합니다.
- 복부에 심전도 리드를 놓고, 꼬리에 혈액 포화도 센서를, 콧구멍에 온도 센서를 놓습니다.
- IV 리드를 귀 정맥에 놓고 식염수로 채워진 주사기를 사용하여 혈액 접근을 확인합니다. 연고를 사용하여 눈에 수분을 유지하십시오.
- 삽관: 0.5mg/kg의 아트라큐륨, 1mg/kg의 케타민, 1-2μg/kg의 펜타닐을 주사합니다. 삽관을 위해 동물을 등에 눕힙니다. 4.5mm 튜브를 삽입합니다.
- 약물: 삽관 후 세보플루란 마취를 중단하고 10mg/kg/h의 프로포폴 주입, 2μg/kg/h의 펜타닐, 0.2-0.5mg/kg/h의 아트라큐륨, 4-7mg/kg/h의 식염수를 설치합니다. 수술 중 뇌 부종을 줄이기 위해 1g/kg/h의 속도로 만니톨 주입을 시작합니다.
알림: 지역 동물 윤리 위원회에서 권장하는 경우 복합 진통제 요법을 사용할 수 있습니다.
- 수술 전 엑스레이
- 스핑크스 자세의 복부에 동물을 놓습니다. 동물의 뇌와 두개골 근처에 있는 금속 물체(예: 콧구멍의 온도 납)를 일시적으로 제거합니다.
- 뼈의 대비로 축 및 시상면 X-ray를 획득합니다. 뇌의 앞면과 뒷면의 두개골 두께를 측정하기 위한 저울 역할을 하기 위해 시상 획득 필드에 알려진 치수를 가진 금속 물체를 놓습니다.
- 전두동(두개골 아래 공극으로 볼 수 있음)의 위치를 식별하고 영구 마커를 사용하여 동물의 머리에서 가장 뒤쪽 위치를 표시합니다. 이것은 아래에 설명된 외과적 접근 방식에서 개두술 또는 나사 배치를 수행할 수 있는 가장 먼 지점을 나타냅니다.
- 무균 필드 및 피부 준비: 수술 영역을 넘어 머리의 전체 표면을 면도합니다. 멸균 패드를 사용하여 베타딘으로 머리를 철저히 문지릅니다. 다음으로, 기구 테이블과 동물 위에 멸균 커튼을 놓아 수술 창만 보이도록 합니다. 마지막으로 베타딘을 사용하는 멸균 패드로 머리를 다시 문지릅니다.
- 개두술과 자궁절개술
- 피부 절단: 정중선을 따라 메스 나이프로 피부를 절개합니다. 근육과 골막(양쪽 브레그마에서 측면으로 25mm, 브레그마에서 전방 및 후방 40mm)을 라스파토리를 사용하여 뼈에서 분리하고 스프레더를 배치하여 나중에 드릴링할 때 최적의 접근을 확보합니다.
- 측정 및 표시: 브레그마와 람다를 식별하고 멸균 수술용 펜으로 표시합니다(그림 2A, B). 멸균 자를 사용하여 양쪽 반구의 이식 대상을 중심으로 뼈 피판 윤곽을 정의합니다. 이 특별한 경우, 청각 피질은 브레그마에서 -5mm에서 -15mm, 측면으로 -4mm에서 -20mm의 좌표를 갖도록 선택되었습니다. 그런 다음 개두술을 임플란트의 크기와 해부학적 랜드마크에 맞게 조정하여 개구부 크기를 제한합니다.
- 개두술:
- 둥근 절단 비트가 있는 뼈 드릴을 사용하여 2.2단계에서 측정한 두개골의 두께를 고려하여 개두술의 윤곽을 뚫습니다. 뼈의 과열을 방지하기 위해 식염수로 드릴링 위치를 관개하십시오.
- 경막에 도달할 때까지 윤곽선을 균일하게 조심스럽게 뚫습니다. 첫 번째 돌파구에서 윤곽선이 거의 뚫릴 수 있을 만큼 얇아질 때까지 드릴링을 마칩니다. 그런 다음 평평한 주걱(정중선 쪽 또는 측면)을 사용하여 개두술 가장자리를 지렛대로 사용하여 뼈 피판을 한 조각으로 부러뜨립니다. 너무 많은 저항이 발생하면 뼈를 계속 얇게 하십시오.
- 뼈 조각을 멸균 식염수에 넣으십시오.
- 뼈 피판이 제거되면 날카로운 뼈 가장자리가 경막으로 절단되지 않도록 Kerison을 사용하여 개두술의 가장자리를 조심스럽게 깎아냅니다.
- 경막이나 뼈에 과도한 출혈이 발생하면 각각 젤폼이나 본왁스를 사용하십시오. 개두술에 습식 찜질(멸균 식염수 표준 패드)을 넣고 다른 반구에서도 이 단계를 반복합니다(그림 2B).
- 듀로토미:
- 6-0 봉합사 키트의 바늘을 사용하여 내측과 측면 사이의 중간에 있는 개두술의 앞쪽 또는 뒤쪽 끝에서 경막을 조심스럽게 뚫고 들어 올리고 찌르는 칼로 절개의 시작을 만듭니다.
- 그런 다음 피질을 보호하기 위해 절단 베이스 역할을 하는 경막하 공간에 삽입된 작고 평평한 주걱을 사용하여 두 도구를 동시에 전진시켜 경막에 전후 슬릿을 만듭니다. 슬릿이 임플란트 너비보다 약간 큰지 확인합니다(그림 2C). 이 단계에서 출혈이나 손상이 발생하면 젤 폼으로 덮고 멈출 때까지 기다리십시오.
참고: 출혈을 피하기 위해 경막에 큰 혈관이 있는 경우 슬릿 궤적을 조정해야 합니다.
- 주입
- 장치 삽입:
- 임플란트(보충 그림 1A)를 양쪽에 식염수로 세척하여 경막하 공간으로 더 쉽게 미끄러질 수 있도록 합니다. 임플란트를 경막 슬릿 위에 놓고 작은 집게를 사용하여 각 가장자리를 순차적으로 밀어 장치를 경막하로 삽입합니다.
- 삽입을 방해하는 장력이 발생하지 않도록 장치의 받침대 끝을 조심스럽게 잡고 임플란트와 함께 전진합니다. 커넥터 가장자리가 슬릿 위에 있으면 삽입을 중지합니다.
- 임플란트 고정: 임플란트를 제자리에 고정하려면 개두술의 가장자리 또는 고정 날개 뒤에 케이블 위에 티타늄 브리지를 놓고 적절한 드라이버를 사용하여 하나 또는 두 개의 티타늄 나사로 고정합니다(그림 2D).
- 접지 배치: 접지선 절연체 1cm를 조심스럽게 제거하고 개두술의 뒤쪽 끝(또는 관심 피질이나 큰 혈관에서 멀리 떨어진 경막외 위치)에 경막외로 삽입합니다( 그림 2E의 와이어).
- 2.4.4단계를 반복합니다. 및 2.5.1.-2.5.3 반대쪽 반구에서.
- 배치를 확인하기 위한 수술 중 X-레이:
- 수술 부위에 습식 패드(멸균 식염수의 표준 패드)를 놓아 조직에 수분을 유지합니다. 다음으로, 동물의 머리를 덮을 멸균 수술 드레이프를 놓습니다.
- X선 마커를 지표로 사용하여 임플란트가 잘 배치되고 접히지 않았는지 확인하기 위해 평면 X선 이미지(축 방향 및 시상)를 촬영합니다. 그렇지 않은 경우 드레이프를 제거하고 장치를 이식하여 다시 삽입하십시오(2.4.4. 및 2.5.1.-2.5.3단계를 다시 수행).
- 경막 봉합: 3-0 흡수성 봉합사와 작은 바늘 홀더를 사용하여 임플란트 케이블 주위에 경막을 조심스럽게 봉합합니다. 봉합사로 얇은 막을 찢지 않고 두 개의 경막 가장자리를 최대한 함께 가져옵니다(그림 2D, E).
- 뼈 플랩 배치: 티타늄 나사를 사용하여 각 뼈 플랩의 앞쪽과 뒤쪽 부분에 티타늄 브리지를 고정합니다. 다음 단계에서 발판 다리의 배치와 관련하여 Ti-브리지의 위치를 신중하게 계획하십시오. 티타늄 브릿지의 끝을 두개골에 나사로 고정합니다(그림 2F, G).
- 장치 삽입:
- 받침대 및 발판 배치
- 포지셔닝: 이 구성에서 발판에는 각각 2개의 나사 구멍이 있는 6개의 다리가 있습니다(보충 그림 1B). 나사의 위치를 최적화하기 위해 두개골에 발판의 배치를 계획하십시오(개두술의 가장자리나 측두근에 놓지 마십시오). 나사로 고정할 수 없는 경우 다리의 구멍을 건너뜁니다.
- 발판 고정: 제자리에 단단히 고정될 때까지 발판의 티타늄 나사를 조입니다( 그림 2H 참조).
- 받침대 배치: 연결 케이블 위의 티타늄 브리지를 제거하고 받침대를 뒤집어 발판에 착지합니다. 받침대를 발판에 나사로 고정합니다. 받침대가 제자리에 단단히 고정되어 있는지 확인합니다(그림 2I).
- 봉합사 및 봉합
- 상처 청소: 식염수로 씻어내어 뼈나 기타 부스러기가 있는 피하 공간을 청소합니다. 받침대 가장자리 주변의 피부를 잘라내어 실린더를 따라 둥근 가장자리를 만듭니다.
- 피하 봉합사: 스프레더를 제거하고 피부 플랩을 함께 접습니다. 단순 단속 봉합사 또는 단순 연속 봉합사를 사용하여 3mm 간격으로 4-0 비흡수성 봉합사 와이어로 피하 봉합사를 만듭니다. 받침대에서 시작하여 절개 양쪽에서 받침대쪽으로 이동합니다.
- 피부 봉합사: 5mm 간격으로 봉합사를 사용하여 6-0 비흡수성 봉합사 와이어를 사용하여 피부를 봉합합니다. 받침대에서 시작하여 절개 양쪽에서 받침대쪽으로 이동합니다. 공극을 피하기 위해 두 피부 플랩 사이와 받침대 가장자리 근처에 조직이 잘 배치되도록 주의하십시오(그림 2J).
- 상처 드레싱: 멸균 패드와 베타딘으로 상처 부위를 다시 청소합니다. 상처 부위에 접착식 멸균 붕대를 감습니다.
- In vivo 측정: In vivo 측정의 경우 섹션 3, 4 및 5를 따르십시오.
- 각성: 모든 측정이 수행된 후 동물의 모든 마취제를 제거하고 환기를 유지하십시오. 진통을 위해 부프레노르핀 패치(25mg/h)를 24시간 동안 바르십시오. 기상시간을 단축하기 위해 커튼으로 덮인 가열 패드에 동물을 놓습니다. 자발적 호흡이 회복되면 동물의 발관을 하고 의식이 회복될 때까지 산소 안면 마스크를 착용합니다(1-4시간이 소요될 수 있음).
- 수술 후 동물 관리: 5일 동안 동물을 면밀히 관찰하십시오. 세팔렉신 75mg을 하루 2회 다른 동물과 분리하여 음식과 함께 투여하십시오. 적신 멸균 패드로 다량의 베타딘을 도포하여 매일 상처 소독을 수행하십시오(수유 중에 가장 잘 수행).
참고: 장기 요양 및 주거: 수술된 동물은 24시간 동안 격리됩니다. 동물이 동료와 사회적으로 상호 작용할 수 있을 만큼 충분히 건강하면 원래의 사회 집단으로 돌아갑니다. 받침대와 피부 개구부에 대한 일일 관찰은 머리에 장치를 통합하기 위해 수행되어야 합니다. 적절한 경우 받침대 주변을 다량의 베타딘으로 청소하십시오.
3. 연질 임플란트의 In vivo 특성 분석
- 크로노암페로메트리: 펄스 발생기에 병렬로 연결된 오실로스코프를 사용하여 바이페이직 전류 펄스 진화(즉, VT) 주입 시 전압 강하를 기록합니다. 펄스 발생기를 각 전극과 접지선에 순차적으로 연결합니다. 100Hz에서 300μs의 펄스 폭으로 100μA에서 자극 펄스를 수행합니다.
- 전기화학 임피던스 분광법: 전위차계를 사용하여 다양한 주파수에서 전기화학 임피던스를 측정합니다. 펄스 발생기를 각 전극에 순차적으로 연결하고 접지선을 상대 전극과 접지로 사용합니다. 여기 전압을 200mV로 설정하고 주파수 범위를 1Hz에서 1MHz로 설정하며 10진법당 3포인트로 설정합니다.
- 채널 간 짧은 측정: 핸드헬드 멀티미터를 사용하여 인접 채널 간의 DC 저항을 측정합니다. 생체 내에서 채널 간 DC 저항은 1kΩ 미만의 부족이 나타나지 않는지 확인하기 위해서만 측정되며, 이는 전체 캡슐화 실패를 나타냅니다.
4. 전기생리학적 기록
- 자발적인 활동: 받침대를 통해 무선 녹음 시스템을 연결하고 2-3분 동안 기준 활동을 기록합니다. 이 녹음은 청각적 유발 전위를 분석하기 위한 제어 역할을 합니다.
- 청각 유발 전위: 무선 시스템 외에도 동물 귀의 닫힌 필드에 스피커를 삽입합니다. 재생 톤은 120회 반복에 걸쳐 약 70dB 음압 레벨(SPL)에서 다양한 주파수(20,000-20,000Hz 범위)에서 음향 자극을 버스트합니다. 그런 다음 기록을 평균화하고 분석을 위해 자극 기간 동안 정렬합니다.
- 감각 유발 전위: 주둥이에 바늘을 세 가지 다른 위치에 놓습니다. 모집 곡선을 얻기 위해 다른 진폭에서 펄스 발생기로 ~30초 동안 주둥이를 자극하여 감각 전위를 불러일으킵니다.
5. 생체 내 이미징
- 동물 운송: 2.1단계에 설명된 대로 동물을 프로포폴 마취 상태로 유지하십시오. 인공호흡기, 주사기 펌프 및 활력 징후 모니터가 있는 운송 카트를 사용하여 동물을 수술실에서 영상 시설로 이송하고 다시 이송합니다.
- 컴퓨터 단층 촬영 X선 스캔: 동물을 스캐너 테이블 위에 놓고 머리 주변의 금속 물체(예: 온도 센서)를 제거합니다. 뼈 대비에 대한 자동 전류 및 전압 선택 기능이 있는 아이소메트릭 수집을 사용하여 가장 작은 해상도(0.4mm 절편 두께)로 CT 스캔을 획득합니다.
- 자기 공명 영상: 동물에서 금속이 포함된 모든 장비를 제거합니다(MRI 호환 IV 리드 및 삽관 튜브 사용). MRI 챔버 외부에 위치한 인공호흡기를 사용하여 동물을 3%-3.5%의 세보플루란 하에서 환기 및 마취 상태로 유지하고 긴 튜브를 통해 동물에 연결합니다. 첫 번째 시퀀스 전에 1-2μg/kg의 펜타닐 덩어리를 주입합니다. 가장 작은 분해능에서 세 개의 등각 투영 시퀀스, 즉 T1, T2 및 터보 스핀 에코(TSE) 가중치 시퀀스( 보충 파일 1에 표시된 파라미터)를 사용합니다.
6. 자유롭게 움직이는 녹음
- 뇌의 깨어 있는 신호를 기록하기 위해 섹션 4에 설명된 것과 동일한 절차를 따르십시오. 동물을 실험자의 팔에 안거나 동물에게 간식을 먹여 주의를 분산시켜 무선 헤드스테이지를 연결합니다. 동물 가까이에 배치된 외부 스피커를 사용하여 음향 자극을 제공합니다.
7. 관류 및 조직 준비
- 선택 사항: 동물이 아직 마취되지 않은 경우 마취 프로토콜에 대해 2.1단계를 따르십시오.
- 관류를 위해 경동맥에 카테터 삽입(보충 그림 2)
- 경동맥 및 경정맥 박리: 소작기/절단기를 사용하여 정중선에서 목을 자릅니다. 피부를 먼저 자른 다음 중간 흰색 선을 따라 근육을 자릅니다(아래에 혈관이 없음)(보충 그림 2A).
- 손가락을 사용하여 기관 주변과 근육 아래에 공간을 만들면서 더 벌립니다. 경동맥(박동 및 분홍빛이 도는 동맥)을 찾으십시오. 미주신경은 때때로 주변(흰색)에 있고 경정맥은 아래 또는 옆(빨간색)에 있을 수 있습니다. 스프레더를 놓습니다( 보충 그림 2B 참조).
- 가는 집게와 둥근 가위를 사용하여 경동맥 박리를 시작합니다. 가위를 사용하여 결막 조직을 엽니다. 혈관이 없으면 잘라냅니다. 혈관이 있으면 소작하고 앞으로 이동합니다(보충 그림 2C, D). 충분히 절개되면 클램프를 사용하여 경동맥 아래로 내려가 완전히 격리되도록 합니다(보충 그림 2E).
- 경정맥으로 동일한 작업을 반복합니다(보충 그림 2F).
- 두 혈관이 완전히 절개되고 분리되면 그 주위에 봉합사를 놓습니다. 아직 닫지 마십시오. 경동맥 주위에 있는 두 개의 봉합사, 즉 맨 밑에 있는 봉합사(뇌 관류를 위한 봉합사 1-심장 쪽)와 다른 쪽에 있는 봉합사 2 가 보충 그림 2G에 나와 있습니다.
- 경정맥 주위에 하나의 봉합사를 놓습니다(봉합사 3). 나중에 정맥을 절단하기 위해 테이프로 전선을 표시하십시오.
- 봉합사 1을 매우 단단히 닫지 않으면 출혈이 발생합니다(보충 그림 2H). 세 개의 매듭을 묶습니다. 클램프를 와이어에 올려 무게를 싣고 경동맥에 장력을 가합니다.
- 경동맥 박리술의 반대쪽에 혈관 클램프를 사용하여 경동맥을 고정합니다(뇌 관류를 위한 뇌 쪽; 보충 그림 2I). 봉합사 2는 아직 닫히지 않은 중간에 있습니다.
- 검은색 집게를 사용하여 경동맥을 잡아당깁니다. 가는 가위를 사용하여 박리 기저 부근의 경동맥 절반을 절편합니다(봉합사 1 근처, 심장 쪽, 보충 그림 2J 참조). 섹션이 가능한 한 깔끔하고 "외피"뿐만 아니라 용기 자체에 도달하는지 확인하십시오. 그렇지 않으면 카테터가 통과하지 못합니다. 보충 그림 2K와 같이 카테터를 삽입합니다.
- 카테터를 세척하고 먼저 PBS로 채워 카테터에 공기가 남지 않도록 합니다(보충 그림 2K 삽입).
- 봉합사 2를 충분히 단단히 닫아 사라지지 않도록 하되 카테터가 약간 움직일 수 있도록 너무 많이 닫지 마십시오(보충 그림 2L). 그런 다음 혈관 클램프를 제거하고 카테터 삽입을 최대한 마무리하고 봉합사 2의 봉합을 마무리합니다(단단히 닫힘).
- 원하는 경우 추가 보안 단계로 봉합사 1의 봉합사 와이어를 사용하여 카테터 바닥을 상처 출구의 피부에 부착합니다. 그런 다음 동물을 관류 영역으로 옮기고 PBS/헤파린에 연결합니다. 관류가 시작되면 봉합사 3을 당겨 경정맥을 자릅니다
- 안락사: 펜토바르비탈(90mg/kg)을 정맥 주사로 전달하고 식염수로 라인을 씻어내어 전체 용량이 성공적으로 투여되도록 합니다.
- 관류: 관류 펌프(200mL/분)를 사용하여 경동맥 카테터를 PBS/헤파린(15kg 돼지의 경우 1L)에 연결한 다음 4% 파라포름알데히드(PFA)가 포함된 PBS(15kg 돼지의 경우 5L)에 연결합니다. 관류가 시작되면 봉합사 3을 당겨 경정맥을 자릅니다.
- 조직 채취
- 참수: 관류가 끝나면 메스를 사용하여 피부와 근육을 자르고 첫 번째 척추와 두 번째 척추 사이에 칼날을 삽입하여 동물의 머리를 몸에서 분리합니다.
- Postfixation: 4°C에서 48시간 동안 PBS의 4% PFA에 머리를 담근 다음 뇌 추출 전에 PBS로 옮깁니다.
- 뇌 및 임플란트 적출:
- 메스를 사용하여 피부를 제거하고 첫 번째 척추에서 시작하여 척수를 따라 소뇌까지 롱게르를 사용하여 조심스럽게 뼈를 자르기 시작합니다. 소뇌가 노출되면 측두골을 조심스럽게 제거하고 두정엽과 전두엽을 노출시킵니다.
- 이때 받침대를 발판에서 나사로 고정하고 펜치로 발판의 발을 자릅니다. 두개골의 케이블 입구 근처에 있는 뼈를 제거하여 임플란트를 경막 출구에서 빼내지 않고 뼈에서 임플란트 시스템을 제거합니다.
- 임플란트 케이블이 뼈에 내장되어 있는 경우 케이블을 출구에 최대한 가깝게 자릅니다. 뇌 표면이 충분히 노출되면 작은 가위를 사용하여 정중선을 따라 경막을 조심스럽게 자릅니다.
- 경막 출구에서 임플란트 케이블을 풉니다. 뇌에 임플란트를 식립한 부위를 사진으로 찍습니다. 그런 다음 작은 숟가락을 사용하여 뇌를 아래의 뇌 신경에서 분리합니다. 조심스럽게 뇌를 추출합니다. 뇌에서 임플란트를 제거합니다.
- 뇌 후고정: 관류 품질에 따라 추출된 뇌를 4°C의 PBS에서 4% PFA로 24시간 동안 다시 후고정합니다. 뇌가 절단될 때까지 4°C에서 0.1M PBS에 보관하십시오.
- 브레인 컷: 면도날을 사용하여 두 반구를 분리합니다. 그런 다음 뇌를 직각으로 네 조각으로 자릅니다. 이식된 영역을 반으로 잘라 이식된 영역과 제어 영역을 포함하는 두 개의 블록을 얻습니다. 더 많은 제어 슬라이드가 필요한 경우 다른 두 블록을 저장합니다.
- 뇌 동결 보호 및 동결: 뇌가 급강하하여 평형에 도달할 때까지 뇌 블록을 먼저 15%의 자당 용액으로 옮긴 다음 4°C에서 30%의 자당을 사용합니다. 그런 다음 조직 동결 시스템에서 -55°C에서 이소펜탄의 조직을 동결합니다.
8. 조직학
- 조직 절편
- 냉동 유지 장치: 얼어붙은 뇌를 냉동 유지 장치에 넣고 전체 절편이 될 때까지 다듬습니다. 그런 다음 뇌를 40μm 섹션으로 자르고 웰 플레이트의 0.1M PBS에 3개 그룹으로 담그십시오. 접시의 순서를 주의 깊게 기록해 두십시오.
- 단면 선택: 분석할 구역(이식 영역 또는 제어 영역)에 따라 단면을 선택합니다. 미세한 브러시를 사용하여 손상 여부를 검사하여 웰 플레이트에서 섹션을 순차적으로 꺼냅니다. 추가 염색을 위해 0.1M PBS로 채워진 새 웰 플레이트에 놓습니다.
- 면역조직화학(Immunohistochemistry)
- 준비: 절편을 0.3% Triton X/PBS에서 15분 동안 배양한 다음 실온(RT)에서 1시간 동안 3% 소 혈청 알부민(BSA)/PBS를 배양합니다.
- 1차 항체: RT에서 48시간 동안 1차 항체로 조직을 배양합니다(항-GFAP, 쥐, 1/300으로 희석; 항 Iba1, 토끼, 1/400으로 희석; 항-NeuN, 기니피그, 1/1,000으로 희석; 모두 1% BSA/PBS로 희석). 알루미늄 호일로 웰 플레이트를 덮습니다.
- 세척: 0.1M PBS로 5분 동안 우물을 세 번 세척합니다.
- 2차 항체: RT에서 2시간 동안 2차 항체로 조직을 배양합니다(Alexa Fluor 488, Alexa Fluor 647, Alexa Fluor 555; 모두 1% BSA/PBS에서 1/400으로 희석).
- DAPI(4′,6-diamidino-2-phenylindole): DAPI로 조직을 15분 동안 배양합니다(1% BSA/PBS에서 1,000/1).
- 세척: 0.1M PBS로 15분 동안 5회 우물을 세척합니다.
- 장착: 장착 미디어와 커버슬립을 사용하여 슬라이드를 장착합니다. 슬라이드를 어두운 곳에 보관하고 4°C의 냉장고에 보관하세요.
- 이미징
- 전체 슬라이드 이미징: 슬라이드 스캐너 현미경을 사용하여 세 가지 파장(640nm, 560nm, 485nm)에서 10배 배율(대물렌즈 작동 거리 값 = 3,100μm)로 슬라이드를 이미지화합니다. 모든 전력 및 이득 정보는 보충 파일 2에서 찾을 수 있습니다.
- 현미경 이미징: 4파장(Alexa Fluor 647, DAPI, Cy3, EGFP)에서 컨포칼 현미경을 사용하여 20배 배율(아포크로맷 20x/0.8 M27)로 관심 영역을 이미지화합니다. 모든 전력 및 이득 정보는 보충 파일 3에서 찾을 수 있습니다.
결과
장치의 배치(그림 3A) 및 기능을 확인하기 위해 받침대 배치 후 수술 중 전기생리학적 기록이 수행됩니다. 기준선 신호는 기초 활동의 제어로 자극 없이 2분 동안 먼저 획득됩니다. 둘째, 동물은 서로 다른 주파수(500-20,000Hz)에서 톤 버스트로 음향적으로 자극되고, 원시 데이터는 자극 기간 동안 평균화되어 어레이 전체에 걸쳐 청각적 유발 전위를 매핑합니다(예: 기준선과 비교하여 800Hz에서; 그림 3B). 여기에 표시된 데이터는 처리되지 않았지만 노이즈가 너무 많으면 노치 및 대역 통과 필터를 적용할 수 있습니다. 수술실의 일반적인 소음원에는 가열 패드, 막힌 드릴, 흡입 또는 소작기(그 중에서도)가 포함되며 획득 전에 제거해야 합니다. 깨어 있는 녹음에서는 더 깨끗한 데이터 세트를 위해 씹는 것과 같이 머리 주위의 큰 근육 움직임을 피해야 합니다.
이 프로토콜은 모든 녹화 시점에 적용되었으며 단일 채널의 신호를 시간 경과에 따라 비교할 수 있었습니다. 한 가지 예는 그림 3C에 나와 있으며, 반응의 견고성과 진화를 보여줍니다. 실험의 시간 경과에 따른 각 접촉의 기록 용량은 모든 시점에서 기준선 신호의 표준 편차를 계산하여 평가할 수 있습니다(그림 3D). 이 연구에서 신호 대 잡음비는 기록 기간(즉, 2분)의 제한된 기간으로 인해 약간의 변동성에도 불구하고 0일과 6개월 사이에 감소하고 안정되었습니다. 이것은 전극 임피던스와 더 관련이 있을 수 있습니다.
생체 내 영상은 뇌 상태와 임플란트 위치를 평가하기 위해 수술 후 수행됩니다. 프로토콜의 첫 번째 반복에서는 수술 중 X-ray가 수행되지 않아 T1 가중 MRI 시퀀스의 그림 4A에서 볼 수 있듯이 접힌 장치가 발생했습니다(그림 4B 참조). 동물에서 행동 변화는 관찰되지 않았지만 시간이 지남에 따라 임플란트 위치 주변의 뇌의 거시적 압축으로 인해 장치 주위에 섬유화 캡슐화가 발생했습니다(그림 4C). 이 경험 후, 그림 4D와 같이 수술 중 X-ray가 도입되었으며, 방사선 불투과성 마커(삽입된 그림 4D의 임플란트에 보이는 검은색 막대)가 잘 배치되어 있는 것으로 나타났습니다. 뇌의 표면은 그림 4E의 수술 후 MRI에서 관찰할 수 있듯이 손상되지 않습니다. 전반적으로 이 임플란트와 받침대 시스템을 사용하면 전뇌 영상이 가능합니다. 관상면(coronal plane)의 상이한 서열은 해부학적 구조를 볼 수 있게 해준다(그림 4F,G; T1 및 T2 MRI 시퀀스) 또는 임플란트 주변에 액체와 혈액이 존재하는지(그림 4H; TSE 가중 MRI 시퀀스). 받침대 시스템은 티타늄 나사 주위에 검은색 대비가 되는 작은 공극을 제외하고는 아티팩트가 거의 발생하지 않습니다(그림 4G 참조). 또한 이 연구에서는 임상 전극을 비교기로 사용하지만 가열 및 안전 문제로 인해 MRI에서 이미징할 수 없습니다. 따라서 그림 4I와 같이 이러한 동물에 대한 CT 스캔을 획득합니다. 전극이 선명하게 보이고 받침대 시스템이 이미지 품질에 영향을 미치지 않습니다.
이식 기간이 지나면 동물을 관류하고 뇌를 적출합니다. 이 연구에서 염증 반응 분석은 각 반구에서 독립적으로 수행됩니다. 뇌를 반으로 자르는 것은 절편 전에 조직을 준비하는 데 더 쉬우며, 단면을 표준 현미경 슬라이드에 장착할 수 있다는 장점이 있습니다. 뇌 샘플의 한 가지 예는 블록을 절단하기 전(그림 5A)과 후(그림 5B)입니다. 임플란트의 윤곽이 선명하게 보이며 뇌에 작은 움푹 들어간 곳이 생겼습니다. 평행 평면에서 절단하면 조직이 이미 저온 유지 장치에 정렬되어 있으며 트리밍을 위한 조직 손실 없이 단면을 쉽게 절단할 수 있습니다(그림 5C). 염색 후 전체 조직 절편을 이미지화하며(그림 5D), 예를 들어 뉴런 층을 자세히 볼 수 있습니다(NeuN 마커 참조). 전체 절편은 깨지기 쉽고 때로는 약간의 조직 손실로 이어질 수 있지만(그림 5D 하단 참조) 관심 영역은 손상되지 않습니다. 40x에서 컨포칼 현미경 이미징을 통해 자세히 보면 세포가 명확하게 정의되고 염증 마커 등을 정밀하게 조사할 수 있습니다(그림 5E). 대조군과 이식된 반구 간의 염증을 비교하기 위해 추가 정량화 분석을 수행할 수 있습니다. 그림 6은 이식된 전극의 전기화학적 특성을 보여줍니다. 임피던스 탄성률 및 위상을 갖는 연질 전극 어레이의 시험관 내 전기화학 임피던스 분광법은 그림 6A에 나와 있고 이식 6개월 동안 1kHz에서의 임피던스 계수는 그림 6B에 나와 있습니다.
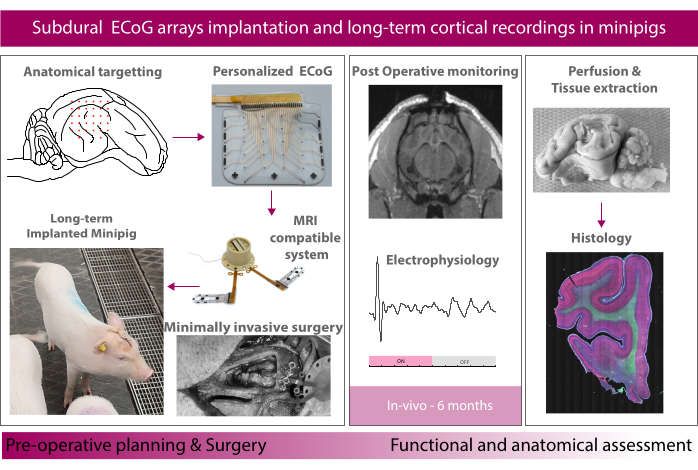
그림 1: 실험 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
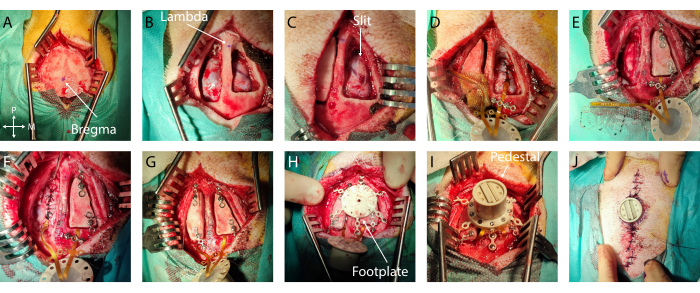
그림 2: 뇌에 연약한 ECoG를 최소 침습적으로 이식한 경우. (A) 브레그마의 징후가 있는 두개골에 대한 외과적 접근. (B) 눈에 보이는 경막을 이용한 양측 개두술. (C) 첫 번째 반구의 슬릿 듀로토미. (D) 연질 ECoG 및 경막 폐쇄의 경막하 이식. (E) 두 번째 반구의 슬릿 듀로토미. 티타늄 브릿지를 사용한 첫 번째 반구에 뼈 플랩 고정. (F) 제2반구 및 경막 폐쇄에 연질 ECoG 이식. (G) 두 번째 반구에 뼈 플랩 고정. (H) 두개골의 발판 위치. (I) 발판에 받침대 고정. (J) 받침대 바닥 주변의 피부 폐쇄. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
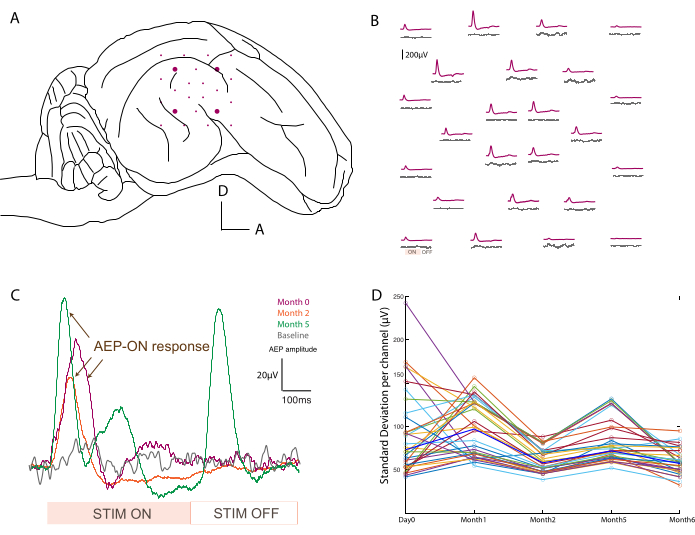
그림 3: 청각 유발 전위 기록 . (A) 측두엽 표면의 전극 배치 개략도. (B) 800Hz 톤 버스트 자극(보라색 트레이스)에 대한 반응으로 기준 활동(회색 트레이스)과 청각 유발 전위의 대표 매핑. 각 평균은 소프트 ECoG 어레이의 한 채널에 해당합니다. 평균화는 소리 자극의 아날로그 입력 신호에서 트리거됩니다. "ON" 및 "OFF" 음향 자극 기간은 왼쪽 하단의 한 채널에 표시됩니다. (C) 음향 자극 후 단일 채널 응답의 시간 경과(0일, 2개월 및 5개월)에 따른 진화를 자극이 없는 경우의 기준선 신호와 비교하여 (회색). 평균화는 소리 자극의 아날로그 입력 신호에서 트리거됩니다. "ON" 및 "OFF" 자극 기간은 하단에 표시됩니다. "ON" 자극의 유발 전위는 화살표로 표시됩니다. (D) 기준선 기록의 시점당 채널당 표준 편차(컬러 도트). 중앙값은 굵은 파란색으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
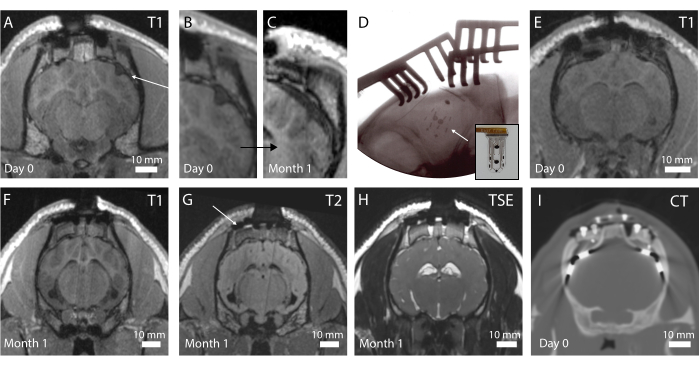
그림 4: 뇌와 이식된 전극의 생체 내 이미징 . (A) 관상면의 수술 후 T1 가중 MRI. 화살표는 접힌 임플란트를 나타냅니다. (B) 임플란트의 접힘으로 인해 뇌에 움푹 들어간 곳이 생기는 A의 확대된 부분. (C) 이식 1개월 시 T1 가중 MRI, C와 동일한 위치에서 뇌의 섬유화 캡슐화로 인한 뇌 압박 표시. (D) 방사선 불투과성 마커 배치로 관찰된 바와 같이 임플란트 배치 및 접힘 없음을 확인하는 수술 중 평면 X-레이. 삽입 사진: 방사선 불투과성 마커가 보이는 임플란트 사진. (E) 최적의 임플란트 배치가 있는 관상면에서의 수술 후 T1 가중 MRI. (F) 이식 1개월 시 T1 가중 MRI. (G) 이식 1개월 시 T2 가중 MRI. 화살표는 두개골의 발판을 제자리에 고정하는 티타늄 나사의 이미징 아티팩트를 보여줍니다. (H) 이식 1개월 시 TSE 가중 MRI. (I) 임상 전극을 이식한 동물의 CT 스캔. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
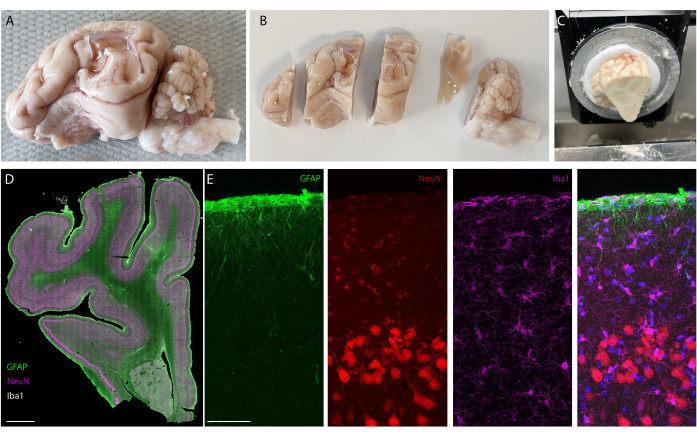
그림 5: 장기 이식 후 뇌의 조직학 분석 . (A) 이식 및 관류된 뇌-좌반구의 사진. (B) 동결 단계 전에 블록으로 절단된 관류된 뇌. (C) 저온 유지 장치의 전체 블록 절편 설정 그림; 전체 "사전 절단 블록"을 절단할 수 있습니다. (D) 전체 반구의 면역염색 이미징(슬라이드 스캐너, 20x 대물렌즈) 및 (E) 신경교세포, 성상교세포 및 뉴런을 보여주는 피질의 첫 번째 층 확대(공초점 이미징, 40x 대물렌즈). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
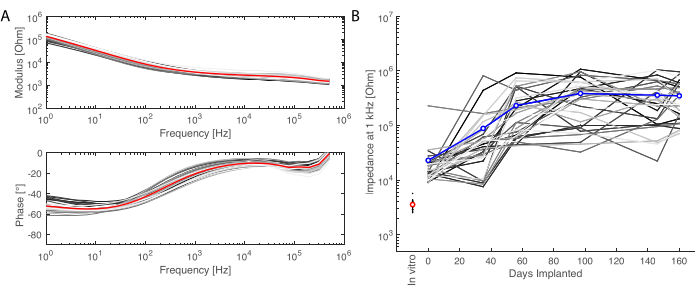
그림 6: 이식된 전극의 전기화학적 특성. (A) 임피던스 모듈러스(상단) 및 위상(하단)이 있는 연질 전극 어레이(각 채널의 작은 회색 선, 빨간색의 평균)의 체외 전기화학 임피던스 분광법. (B) 이식 6개월 동안 1kHz에서 임피던스 모듈러스의 진화(평균은 파란색, 회색 선은 개별 채널, 시험관 내 측정은 빨간색으로 참조). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: MRI 호환 받침대. (A) 연질 전극 어레이에 접근하기 위한 만성 MRI 호환 경피 연결 시스템(받침대). (B) 두개골 고정을 위해 발판에 전극이 장착된 받침대. 삽입 사진: 발판의 세부 사항. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: 뇌의 최적 관류를 위한 외과적 접근. (A) 피부 절단 및 경동맥 및 경정맥 위치에 대한 접근. (B) 혈관 주변 조직의 해부. (씨,디) 경동맥과 경정맥 주변 조직의 식별 및 해부. (E) 아래 조직에서 경동맥의 분리. (F) 아래 조직에서 경정맥의 분리. (G) 경동맥(봉합사 1 및 봉합사 2)과 경정맥(봉합사 3) 주위에 봉합사 와이어 배치. (H) 혈관을 여는 동안 출혈을 피하기 위해 경동맥(심장 쪽)의 기저부에서 봉합사 3을 봉합합니다. (I) H의 반대쪽에 있는 경동맥의 클램핑. (J) 경동맥 절개. (K) J의 개구부에 삽입된 카테터. 삽입물: 주사기에서 카테터 팁으로 식염수를 세척하는 프라이밍된 카테터. (L) 카테터를 제자리에 유지하고 동맥을 따라 유지하기 위한 봉합사 2의 폐쇄. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 각각 T1-(1-2페이지), T2-(3-4페이지) 및 TSE 가중(5-6페이지) MRI 시퀀스에 대한 매개변수. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2: 염색된 뇌 절편의 전체 슬라이드 이미징을 위한 슬라이드 스캐너용 메타데이터. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 3: 염색된 뇌 절편의 확대된 부분의 컨포칼 이미징을 위한 메타데이터. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기서는 소프트 ECoG 어레이의 장기 이식 및 평가 방법을 보고합니다. 이 연구에서 우리는 측두엽(여기서는 청각 피질을 표적으로 함)에 기능적 전극 그리드의 양측 이식을 위한 일관된 최소 침습적 수술 접근 방식을 설계했습니다. 먼저 연구 기간(6개월) 동안 유발된 전위를 성공적으로 기록하고 전극의 전기화학적 특성을 추적하여 그리드의 기능을 평가했습니다( 그림 6 참조). 둘째, MRI를 사용하고 MRI와 완전히 호환되는 시스템을 구축하여 생체 내 그리드의 생물학적 안전성을 평가하고, 조직 수집 및 면역염색을 위한 프로토콜을 설계하여 사후 검시를 평가했습니다.
침습성을 최소화하기 위해 개두술 창의 크기를 최적화했습니다. 측두엽에 위치한 청각 피질에 도달하고 측두근 절제를 피하기 위해 임플란트를 경막 아래로 밀어 넣는 기술을 개발했습니다. 이 기술을 사용하면 노출된 뇌의 표면을 크게 줄이면서도 멀리 있는 목표물에 도달할 수 있습니다. 이러한 유형의 이식은 맹목적으로 보일 수 있지만, 수술 중 평면 X-ray에서 시각화된 장치에 방사선 불투과성 마커를 구현하면 위치를 확인할 수 있으며 어레이가 경막 아래로 접히지 않도록 할 수 있습니다. 경막하 슬라이딩은 우리가 수행한 대부분의 반복에서 안전한 것으로 입증되었습니다. 또한 슬릿 접근법의 두절개술은 개두술이 열려 있는 동안 뇌 팽창을 최소화하고 염증 반응을 편향시킬 수 있는 인공 경막과 같은 추가 재료 없이 임플란트 주변의 봉합을 용이하게 합니다. 마지막으로, 이 수술적 접근법의 강점은 다른 피질 영역으로 전치할 수 있다는 것이다. 좌표, 개두술 위치 및 장치 크기를 모두 조정할 수 있으므로 이 방법은 대부분의 피질 영역을 대상으로 할 수 있습니다.
여기에 제시된 수술 방법은 시간 경과에 따른 생체 통합에 대한 기능 평가 및 조사와 함께 이 보고서에 사용된 연질 전극 기술에 국한되지 않습니다. 인간 번역을 위해 개발 중인 다른 경막하 전극은 동일한 프로토콜로 평가할 수 있습니다. 이 방법의 강점은 케이블 및 받침대와 같은 대부분의 부품이 모듈식이고 개인화가 가능하며 테스트 중인 특정 장치에 적용할 수 있다는 사실에 달려 있습니다. 또한, 피질 내 또는 심층 침투 프로브는 경막하 전극 대신 또는 경막하 전극과 함께 사용할 수도 있는데, 이는 개두술 및 두막 절개술 형상을 조정하기만 하면 되기 때문입니다. 그런 다음 장기 결과를 여기에서 수행한 것처럼 임상 결과와 비교할 수 있습니다.
제시된 방법의 주요 한계 중 하나는 미니피그에서 두개골 부비동의 존재이며, 이는12년 동안 발달합니다. 이와 관련하여 고려해야 할 중요한 측면에는 이식 연령과 동물의 크기가 포함됩니다. 성인의 두개골에 개두술을 시행하면 부비동의 무결성이 손상되고 만성 환경에서 주요 감염의 위험이 높아집니다. 이러한 부비동은 수술 전 평면 X-ray와 CT 스캔에서 볼 수 있습니다. 반면에, 너무 작은 동물에서 만성 이식을 너무 일찍 수행하는 것은 두개골이 대규모로 성장하고 리모델링되는 경우 최적이 아닙니다. 우리는 수술 후 이러한 "두개골 움직임"으로 인해 임플란트가 움직이고 접힐 수 있으며, 이는 궁극적으로 실험에 해로울 수 있다는 가설을 세웠습니다. 우리는 이식 당시 약 5-6개월(및 8kg)의 괴팅겐 미니피그가 최상의 결과를 제공해야 한다는 것을 발견했습니다.
전기생리학적 기록을 위한 이식형 ECoG의 성능을 평가하기 위해 당사는 자유롭게 움직이는 동물과 진정 상태에서 사용할 수 있는 청각 유발 전위(AEP) 기록을 위한 신속한 프로토콜을 설정했습니다. 몇 분 동안 특정 주파수에서 일련의 음향 톤 버스트를 제공하는 것으로 구성됩니다. 이러한 프로토콜의 장점은 프로브되는 주파수 수를 줄여 사용 가능한 녹음 길이에 맞게 조정할 수 있다는 사실입니다. 마취 상태에서 대뇌 피질 신호를 기록할 때 한 가지 문제는 데이터를 분석하고 비교할 때 동물의 의식 수준을 고려해야 한다는 것입니다.
관류에 대한 프로토콜은 추출된 뇌의 품질을 관찰하여 시간이 지남에 따라 조정되었습니다. 실제로, 경정맥이 아닌 경동맥에만 카테터를 삽입하는 것이 더 쉽다는 것을 알게 되었습니다. 초기에, 문헌은 노폐물을 배출하기 위해 경정맥을 카테터로 삽입하는 방법을 제시한다20. 실질적으로 이것은 뇌의 유출을 제한하고 혈액 추출과 전반적인 관류의 질을 떨어뜨립니다. 경정맥을 절단하고 동물이 누워있는 큰 용기에 액체를 빠져 나가게하면 관류 효율이 높아집니다.
당사는 염증 추적에 일상적으로 사용되는 항체와 함께 작동하는 강력한 조직 준비 방법을 개발했습니다. 돼지 뇌의 절반이 표준 현미경 슬라이드에 맞기 때문에 조직학 실험실에서 사용할 수 있는 대부분의 이미징 장비와 호환되기 때문에 실용적인 이유로 두 반구를 분리했습니다. 뇌를 여러 블록으로 자르면 뇌 전체를 더 자르거나 조직의 광범위한 부분을 다듬을 필요 없이 관심 영역에 직접 접근할 수 있습니다. 40μm의 뇌 절편은 표준 웰 플레이트에 모일 수 있으며 다른 종의 면역 염색으로 인한 주요 프로토콜 변경 없이 자유 부유 방식으로 염색할 수 있습니다. 전체 뇌 면역염색은 예를 들어, CLARITY 방법21을 사용하여 구상할 수도 있다.
전반적으로 이 프로토콜은 맞춤형 임플란트 설계부터 이식, 기능 후속 조치 및 생물 안전성 평가를 다루며 강력하고 일관성이 있습니다. 우리는 여기에서 청각 시스템을 연구할 수 있는 타당성을 입증했지만 다른 생리적 기능을 테스트하기 위해 전치할 수 있습니다. 더욱이, 우리 방법의 강점은 미니피그에만 국한되지 않고 양, 염소 또는 인간이 아닌 영장류와 같은 다른 종으로 완전히 전이될 수 있다는 사실에 있습니다. 어느 정도는 쥐에게도 쉽게 적응할 수 있습니다.
공개
F.F.와 S.P.L.은 연질 전극 어레이를 개발하는 Neurosoft Bioelectronics SA의 공동 설립자이자 주주입니다.
감사의 말
저자는 Bertarelli Foundation과 SNSF Sinergia 보조금 CRSII5_183519의 재정적 지원에 감사드립니다. 저자들은 또한 조직학을 위한 염색 프로토콜 개발에 도움을 준 EPFL의 Katia Galan, 제조 공정에 도움을 준 제네바에 있는 Wyss Center for Bio and Neuroengineering의 Neural Microsystems Platform 직원, 동물 관리를 위한 제네바 대학(UNIGE)의 University Medical Center(CMU)의 동물 플랫폼 직원, 미니피그의 수술 지원 및 수술 후 관리(John Diaper, Xavier Belin, Fabienne Fontao, Walid Habre), 제네바 대학교 생의학 영상 센터(CIBM) 팀원(Julien Songeon, François Lazeyras, Rares Salomir), 제네바 대학병원(HUG) 병리과 직원(Sami Schranz, Francesca Versili, 루벤 소토(Ruben Soto)와 코렐린 에거(Coraline Egger), 그리고 그르노블-알프스 대학(Université Grenobles-Alpes)의 블레이즈 이버트(Blaise Yvert)가 만성 미니피그 실험에 대한 의견을 제시하고 의견을 교환했습니다. 저자들은 제조 공정과 미니피그 실험에 도움을 준 Neurosoft Bioelectronics SA 직원들의 도움에 감사를 표합니다(Benoit Huguet 및 Margaux Roulet).
자료
| Name | Company | Catalog Number | Comments |
| Bone drill | BBraun | Elan 4 with GA861 handpiece | |
| Bone drill bit | BBraun | Neurocutter GP204R | |
| Bonewax | Ethicon | W31G | |
| Catheter | Venisystems | Abbocath 14G | |
| Confocal Microscope | Zeiss | LSM 880 | |
| Cryostat | Leica | CM1950 | |
| Gelfoam | Pfizer | Gelfoam | |
| Insert speakers | Etymotic | Etymotic ER2 insert Earphones | |
| Multimeter | Fluke | Fluke 1700 | |
| Oscilloscope | Tektronix | MDO3014 Mixed Domain Oscilloscope | |
| Perfusion pump | Shenzen | LabS3/UD15 | |
| Potentiostat | Gamry Instruments | Reference 600 | |
| Primary Antibody Anti-GFAP | Thermofischer | Anti-GFAP, Rat, # 13-0300 | |
| Primary Antibody Anti-Iba1 | Fujifilm | Anti Iba1, Rabbit, 019-19741 | |
| Primary Antibody Anti-NeuN | SigmaAldrich | Anti-NeuN, GuineaPig, ABN90 | |
| Pulse Generator | AM Systems | Model 2100 Isolated Pulse Stimulator | |
| Recording headstage | Multichannel systems | W2100-HS32 | |
| Recording system | Multichannel systems | W2100 | |
| Screwdriver | Medtronic | Handle: 001201, Shaft: 8001205 | |
| Secondary Antibody 488 | Thermofischer | Goat anti-Rat IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488, # A-11006 | |
| Secondary Antibody 555 | Thermofischer | Goat anti-Guinea Pig IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555, # A-21435 | |
| Secondary Antibody 647 | Thermofischer | Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 647, # A-21245 | |
| Slide Scanner | Olympus | VS120 | |
| Snapfrost | Excilone | Excilone Snapfrost | |
| Stab knife | Fine Science Tools | 10316-14 | |
| Suture wire dermal | Ethicon | Vicryl 2-0 | |
| Suture wire dura mater | Ethicon | Mersilk 5-0 | |
| Suture wire for catheter | Ethicon | Vycril 3-0 without needle | |
| Suture wire for lifting dura | Ethicon | Prolene 6-0 with BV-1 needle | |
| Suture wire subcutaneous | Ethicon | Vicryl 4-0 | |
| Titanium bridge | Medtronic | TiMesh 015-2001-4 | Cut out the required size |
| Titanium screws | Medtronic | 9001635, 9001640 | |
| X-ray system | GE | GE OEC 9800 Plus C-Arm |
참고문헌
- Ritaccio, A. L., Brunner, P., Schalk, G. Electrical stimulation mapping of the brain: Basic principles and emerging alternatives. Journal of Clinical Neurophysiology. 35 (2), 86-97 (2018).
- Mullin, J. P., Sexton, D., Al-Omar, S., Bingaman, W., Gonzalez-Martinez, J. Outcomes of subdural grid electrode monitoring in the stereoelectroencephalography era. World Neurosurgery. 89, 255-258 (2016).
- Vansteensel, M. J., et al. Fully implanted brain-computer interface in a locked-in patient with ALS. The New England Journal of Medicine. 375 (21), 2060-2066 (2016).
- Lacour, S. P., Courtine, G., Guck, J. Materials and technologies for soft implantable neuroprostheses. Nature Reviews. Materilas. 1, 16063 (2016).
- Fallegger, F., Schiavone, G., Lacour, S. P. Conformable hybrid systems for implantable bioelectronic interfaces. Advanced Materials. 32 (15), 1903904 (2019).
- Pearce, A. I., Richards, R. G., Milz, S., Schneider, E., Pearce, S. G. Animal models for implant biomaterial research in bone: A review. European Cells & Materials. 13, 1-10 (2007).
- Swindle, M. M., Makin, A., Herron, A. J., Clubb, F. J., Frazier, K. S. Swine as models in biomedical research and toxicology testing. Veterinary Pathology. 49 (2), 344-356 (2012).
- Khoshnevis, M., et al. Development of induced glioblastoma by implantation of a human xenograft in Yucatan minipig as a large animal model. Journal of Neuroscience Methods. 282, 61-68 (2017).
- Borton, D., et al. Developing implantable neuroprosthetics: A new model in pig. Annual International Conference of the IEEE Engineering in Medicine & Biology Society. 2011, 3024-3030 (2011).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Gierthmuehlen, M., et al. Evaluation of mECoG electrode arrays in the minipig: Experimental procedure and neurosurgical approach. Journal of Neuroscience Methods. 202 (1), 77-86 (2011).
- Palma, M., et al. Chronic recording of cortical activity underlying vocalization in awake minipigs. Journal of Neuroscience Methods. 366, 109427 (2022).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C. H., Palomero-Gallagher, N. The telencephalon of the Göttingen minipig, cytoarchitecture and cortical surface anatomy. Brain Structure & Function. 222 (5), 2093-2114 (2017).
- Lind, N. M., et al. The use of pigs in neuroscience: Modeling brain disorders. Neuroscience and Biobehavioral Reviews. 31 (5), 728-751 (2007).
- Shepherd, R. K., Villalobos, J., Burns, O., Nayagam, D. A. X. The development of neural stimulators: A review of preclinical safety and efficacy studies. Journal of Neural Engineering. 15 (4), 041004 (2018).
- Schiavone, G., et al. Soft, implantable bioelectronic interfaces for translational research. Advanced Matererials. 32 (17), 1906512 (2020).
- Fallegger, F., et al. MRI-compatible and conformal electrocorticography grids for translational research. Advanced Science. 8 (9), 2003761 (2021).
- Minev, I. R., Wenger, N., Courtine, G., Lacour, S. P. Research update: Platinum-elastomer mesocomposite as neural electrode coating. APL Materials. 3 (1), 014701 (2015).
- Schiavone, G., et al. Guidelines to study and develop soft electrode systems for neural stimulation. Neuron. 108 (2), 238-258 (2020).
- Musigazi, G. U., De Vleeschauwer, S., Sciot, R., Verbeken, E., Depreitere, B. Brain perfusion fixation in male pigs using a safer closed system. Laboratory Animals. 52 (4), 413-417 (2018).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nature Methods. 10 (6), 508-513 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유