Method Article
ミニブタにおける硬膜下軟性皮質電図(ECoG)アレイ移植と長期皮質記録
要約
ここでは、ミニブタモデルにおける軟硬膜下電極アレイの長期的な性能と安全性を評価する方法を提示し、手術方法とツール、術後の磁気共鳴画像法、聴覚皮質の電気生理学、インプラントの電気化学的特性、および死後の免疫化学について説明します。
要約
神経学的障害および疾患は、皮質電図検査(ECoG)アレイを使用して診断または治療することができる。薬剤耐性てんかんでは、これらは切除するてんかん領域の輪郭を描くのに役立ちます。ブレイン・コンピュータ・インターフェースなどの長期的な用途では、これらの皮質上皮質電極は、脳の運動意図を記録し、麻痺患者のロボット手足を制御するために使用されます。しかし、現在の硬い電極グリッドでは、高解像度の脳記録や長期的なバイオインテグレーションの必要性に応えることはできません。近年、高性能で長期のインプラント安定性を実現するためのコンフォーマブル電極アレイが提案されています。しかし、これらの新しいインプラント技術の前臨床試験は、ヒト患者への転用に対する長期的な機能性と安全性プロファイルを検証するために必要です。これに関連して、ブタモデルは、臓器のサイズが大きく、動物の取り扱いが容易なため、医療機器の開発に日常的に使用されています。しかし、文献に記載されている脳への応用はごくわずかであり、そのほとんどは手術の制限と生きている動物へのインプラントシステムの統合によるものです。
本稿では、ミニブタモデルにおける長期(6ヶ月)の移植方法とソフトECoGアレイの評価について報告する。この研究では、まず、磁気共鳴画像法(MRI)と互換性のあるポリマー経皮ポートを統合した軟質微細加工電極アレイで構成されるインプラントシステムを紹介します。次に、硬膜下移植から動物の回復までの外科的処置について説明します。ここでは、聴覚刺激によって誘発電位が誘導される標的領域の例として、聴覚野に着目します。最後に、脳全体のMRI、インプラントの電気化学的特性評価、術中および自由に動く電気生理学、および抽出された脳の免疫組織化学染色を含むデータ取得シーケンスについて説明します。
このモデルは、皮質プロテーゼの新しいデザインの安全性と機能を調査するために使用できます。ヒト患者への翻訳を想定した必須の前臨床試験。
概要
神経学的障害および疾患は、皮質電図検査(ECoG)アレイを使用して診断または治療することができる。これらの電極グリッドは、脳の表面に埋め込まれ、ヒト皮質1の記録または刺激を可能にする。例えば、薬剤耐性てんかんの場合、てんかん領域を切除するのに役立っています2。ブレイン・コンピュータ・インターフェースなどの長期的な用途では、これらの皮質電極は、脳の運動意図を記録し、麻痺患者のロボット手足を制御するために使用されます3。しかし、現在の電極グリッドは、硬質のポリマー基板に埋め込まれた硬い金属ブロックから作られており、高解像度の脳記録や長期の硬膜下生体統合(>30日)の必要性に応えていません。むしろ、それらは局所的な組織反応を引き起こし、埋め込まれたデバイスの線維化カプセル化を引き起こし、時間の経過とともに性能の低下につながります。近年、微細加工技術によって製造された薄い高分子基板を用いた可撓性または伸縮性電極アレイが提案されており、組織反応を制限することにより、長期間の移植において高い性能を達成することが提案されている4,5。しかし、これらの新しいインプラント技術の前臨床試験は、その長期的な機能性と安全性プロファイルを検証し、ヒト患者への応用を想定するために必要です。これに関連して、ミニブタとブタのモデルは、臓器のサイズが大きく、動物の取り扱いが容易なため、他の医療状況(心血管系、骨格系、胃系など)のデバイス開発に日常的に採用されています6,7,8。しかし、神経生理学のために脳を標的とするアプリケーションはごくわずかであり、主に外科的アプローチの制限と生きている動物へのインプラントシステムの統合が原因です9,10,11,12。これらは、例えば、埋め込み型組み込み電子機器などの複雑なハードウェアの開発を必要とするため、生きている動物への慢性的な移植とは互換性がないことがよくあります。さらに、トランスレーショナルスタディにおけるバイオセーフティの側面にとって重要な標的組織に対するインプラントシステムの影響は調査されていません。ブタのモデルは、皮質構造、頭蓋骨、皮膚の厚さの点で人体の解剖学的構造に近い13。さらに、行動課題を学習する能力は、機能的リハビリテーション戦略や感覚知覚を調査するための強力なモデルとなります14。
新しい技術や治療法を人間に応用するには、管轄の医療当局の要求に応じて、安全性と有効性を評価する必要があります。これらは通常、技術文書および基準15に記載されていますが、これらのテストに合格するだけであり、安全性試験と並行してデバイスの埋め込みやその他の有用なデータの収集の実際の効果を調査するものではありません。脳の完全なバイオセーフティとパフォーマンス研究のために、ここでは、脳画像データ、電気生理学的測定、埋め込まれた電極の電気化学的特性の評価、およびブタモデルにおける死後組織学の縦断的かつ体系的なコレクションを紹介します。これを達成するためには、完全な実験モデルを作成するために、いくつかの側面を考慮する必要があります:(i)電極に接続するための機械的に安定した経皮ポートとともに、デバイス埋め込みのための低侵襲外科的アクセス、(ii)麻酔下および自由に動く条件の両方で、埋め込まれた電極の性能出力として機能する堅牢な電気生理学的記録パラダイム、 (iii)脳とインプラントの進化、およびインプラントとイメージング装置との適合性を追跡するためのさまざまな時点での in vivo イメージング(コンピューター断層撮影[CT]および/または磁気共鳴画像法[MRI])、および(iv)組織学的分析のために脳を抽出するための組織調製パイプライン。
本稿では、ミニピッグモデルにおける長期移植(6ヶ月)の方法とソフトECoGアレイの評価について報告する(図1に模式的に示す)。軟質電極アレイは、以前のレポートで紹介したもので、電気トラックとして使用される弾性金薄膜を埋め込んだ薄いシリコーン膜で作られています16,17。組織との接触は、脳組織18への柔らかく効率的な電気化学的界面のためにシリコーンマトリックスに埋め込まれた白金ナノ粒子の混合物を介して行われる。インプラントは、頭蓋骨と皮膚を貫通して硬膜下トンネルを敷設された柔軟なケーブルを介して、動物の頭部のコネクターを収容する経皮ポートに接続されます。インプラントのサイズと形状は、研究のターゲットとニーズに応じてカスタマイズできます。この研究の現在の電極ストリップは、臨床ストリップの実際のサイズを反映しています。臨床的に利用可能な硬膜下ストリップおよびグリッドを、同じアプローチを用いてコンパレータとして使用した。ポリマーMRI対応経皮ポートは、頭蓋骨にしっかりと固定するフットプレートシステムを使用して頭蓋骨に配置されます。ここでは、両半球の硬膜下移植から動物の回復までの外科的処置について詳しく説明します。ここでは、聴覚野を標的領域として、麻酔状態と自由に動く状態の両方で音響刺激によって誘発電位が誘導される場所に焦点を当てています。さまざまな時点で、麻酔下で動物の脳をMRI(または臨床電極の場合はCT)で画像化し、電極の電気化学的特性を測定します。電極の特性評価法は、インプラントと電極-組織界面の進化を追跡するために使用されます(詳細については、Schiavone et al.19を参照)。これらには、電極接点の刺激能力を調べるクロノアンペロメトリー、電極の抵抗成分と容量成分の変化を示すことができる電気化学インピーダンス分光法(EIS)、および気密封止の故障を調査するためのチャネル間抵抗測定が含まれます。最後に、安楽死後の脳を灌流し、電極を装着した状態で摘出し、切片化し、さまざまな炎症マーカーを用いて組織学的解析を行うための組織抽出パイプラインを開発しました。全体として、この方法は、脳に関する新しい技術や治療法の将来の臨床翻訳のための堅牢なマルチモーダルデータ収集による前臨床試験を可能にします。
プロトコル
外科的および行動的処置は、実験動物のケアと使用に関するガイドラインに従って地元の倫理委員会によって承認され、地方(ジュネーブ州)および連邦(スイス)の獣医当局によって承認番号GE11120Aで承認されました。この研究では、生後2〜6か月(5〜8 kg)のメスのゲッティンゲンミニブタ(n = 7)を使用しました。
1.術前計画
- ソフトインプラントシステムのin vitro特性評価
- クロノアンペロメトリー:パルス発生器に並列に接続されたオシロスコープを使用して、二相性電流パルス発生(つまり、電圧過渡[VT])の注入時の電圧降下を記録します。パルス発生器を各電極と生理食塩水中の白金カウンターに順次接続します(リン酸緩衝生理食塩水[PBS] 1x)。設定については、手順3.1を参照してください。
- 電気化学インピーダンススペクトログラム:ポテンショメータを使用して、さまざまな周波数で電気化学インピーダンスを測定します。生理食塩水(PBS 1x)中の白金カウンターとAg/AgCl参照電極を使用して、ポテンショメータを各電極に順次接続します。設定については、手順3.2を参照してください。
- チャネル間抵抗:ドライ状態で、ハンドヘルドマルチメータを使用して隣接するチャネル間の直流(DC)抵抗を測定します。
- インプラントの選択:上記の3つの測定の後、100kΩ未満の1kHzでのインピーダンスと1MΩ未満のチャネル間抵抗なしの基準とともにインプラントを選択します。
- 殺菌
- インプラント滅菌:選択したインプラントを滅菌マーカーと一緒に滅菌バッグに個別に入れ、密封します。手術中の無菌性を確保するために、二重包装を採用してください。
注:この場合、タイムサイクルが短く、低温(55°C)であるため、過酸化水素(H2O2)ガス滅菌が使用されます。代替案は、エチレンオキシド(ETO)ガスまたはオートクレーブ滅菌ですが、インプラントシステムとの互換性を確保する必要があります。 - 器具の滅菌:洗浄した器具を、滅菌マーカーと一緒に二重滅菌バッグまたは滅菌器具ボックスに入れます。オートクレーブ滅菌は器具に最も一般的であるが、H2O2 またはETOが可能な代替手段である。
- インプラント滅菌:選択したインプラントを滅菌マーカーと一緒に滅菌バッグに個別に入れ、密封します。手術中の無菌性を確保するために、二重包装を採用してください。
2. ソフトECoGアレイの外科的移植
- 麻酔
- 前投薬:動物を隔離し、一晩絶食します。ミダゾラムを0.75 mg/kg、アトロピンを0.25 μg/kg、ハルドールを0.1 mg/kgの混合液を皮内に注射し、動物が鎮静するまで待ちます。先に進む前に動物の体重を量ってください。
- 静脈内(IV)リードの取り付け:
- 動物を手術台の上に温熱パッドの上に置きます。3%〜3.5%のセボフルランを使用して、動物にフェイスマスクを置き、麻酔を誘発します。.
- 腹部に心電図のリード線を、尾部に血中飽和度センサーを、鼻孔に温度センサーを配置します。
- 点滴リード線を耳静脈に装着し、生理食塩水で満たされた注射器を使用して血液へのアクセスを確認します。軟膏を使用して、目の潤いが保たれていることを確認してください。
- 挿管:0.5 mg / kgのアトラクリウム、1 mg / kgのケタミン、1〜2 μg / kgのフェンタニルのボーラスを注射します。挿管のために動物を仰向けに置きます。4.5mmチューブを挿入します。
- 投薬:挿管後、セボフルラン麻酔を中止し、10 mg / kg / hのプロポフォール注入、2 μg / kg / hのフェンタニル、0.2〜0.5 mg / kg / hのアトラクリウム、4〜7 mg / kg / hの生理食塩水を設置します。.手術中の脳の腫れを軽減するために、1 g / kg / hでマンニトールの注入を開始します。
注:集学的鎮痛レジメンは、地元の動物倫理委員会によって推奨されている場合、使用できます。
- 術前X線
- 動物をスフィンクスの位置で腹部に置きます。動物の脳や頭蓋骨の近くにある金属製の物体(鼻孔の鉛など)を一時的に取り除きます。
- 骨のコントラストで軸面と矢状面のX線を取得します。矢状取得フィールドに既知の寸法の金属物体を配置し、脳の前部と後部の頭蓋骨の厚さを測定するためのスケールとして機能します。
- 前頭洞の位置(頭蓋骨の下の空洞で見える)を特定し、油性マーカーを使用して動物の頭の最も後方の位置をマークします。これは、以下に説明する外科的アプローチで開頭術またはスクリュー配置を行うことができる最も遠いポイントを示します。
- 無菌フィールドと皮膚の準備:手術野を超えて頭の表面全体を剃ります。滅菌パッドを使用して、ベタジンで頭を徹底的にこすります。次に、器具台と動物の上に滅菌ドレープを置き、手術窓だけが見えるようにします。最後に、ベタジンを使用して滅菌パッドで頭をもう一度こすります。
- 開頭術と硬膜切開術
- 皮膚の切り傷:正中線に沿ってメスナイフで皮膚を切開します。筋肉と骨膜(両側のブレグマから横方向に25 mm、ブレグマから前方と後方に40 mm)をラスパトリーを使用して骨から分離し、スプレッダーを配置して、後の掘削に最適なアクセスを確保します。
- 測定とマーキング:ブレグマとラムダを識別し、滅菌手術用ペンでマーキングします(図2A、B)。滅菌定規を使用して、両半球の移植ターゲットを中心に骨皮弁の輪郭を定義します。この特定のケースでは、聴覚皮質が選択され、ブレグマからの座標は-5mmから-15mm、横方向の座標は-4mmから-20mmでした。次に、開頭手術をインプラントのサイズと解剖学的ランドマークに合わせて調整し、開口部のサイズを制限します。
- 開頭術:
- 丸いカッティングビット付きの骨ドリルを使用して、ステップ2.2で測定した頭蓋骨の厚さを考慮して、開頭術の輪郭をドリルで開けます。骨の過熱を防ぐために、掘削場所を生理食塩水で灌漑します。
- 硬膜に達するまで、輪郭を均一に慎重にドリルで開けます。最初のブレークスルーでは、アウトラインがほぼ突き抜けるほど薄くなるまで穴あけを終了します。次に、平らなスパチュラ(正中線側または外側のいずれか)を使用して、開頭術の縁をテコにして、骨皮弁を1つに分解します。抵抗が大きすぎる場合は、骨を薄くし続けます。
- 骨片を滅菌生理食塩水に入れます。
- 骨皮弁が取り除かれたら、鋭利な骨の縁が硬膜に食い込まないようにケリソンを使用して、開頭術の端を慎重に削り取ります。
- 硬膜または骨に過度の出血が発生した場合は、それぞれゲルフォームまたは骨ワックスを使用してください。開頭術に湿布(滅菌生理食塩水の標準パッド)を置き、もう一方の半球でこの手順を繰り返します(図2B)。
- 硬膜切開術:
- 6-0縫合キットの針を使用して、開頭術の前端または後端の内側と外側の中間にある硬膜を慎重に突き刺して持ち上げ、スタブナイフで切開の始まりを作成します。
- 次に、硬膜下腔に挿入された小さな平らなヘラを切断ベースとして使用して皮質を保護し、両方のツールを同時に進めることで硬膜に前後スリットを作成します。スリットがインプラントの幅よりわずかに大きいことを確認します(図2C)。このステップで出血や損傷が発生した場合は、ジェルフォームで覆い、止まるまで待ちます。
注:スリットの軌跡は、出血を避けるために硬膜に大きな血管が存在する場合に適合させる必要があります。
- 移植
- デバイスの挿入:
- インプラント(補足図1A)の両側に生理食塩水を灌漑し、硬膜下腔に滑り込みやすくします。硬膜スリットの上にインプラントを配置し、小さな鉗子を使用して、デバイスを各端で順番にスライドさせて硬膜下に挿入します。
- デバイスの台座の端を慎重に保持し、挿入を妨げる張力を発生させないようにインプラントを前進させます。コネクタの端がスリットの上に来たら、挿入を停止します。
- インプラントを固定する:インプラントを所定の位置に固定するには、開頭術の端またはアンカーウィングのケーブルの上にチタン製のブリッジを置き、適切なドライバーを使用して1本または2本のチタン製ネジで固定します(図2D)。
- 接地配置:接地線の絶縁体を1cm慎重に取り除き、開頭術の後端(または目的の皮質または太い血管から遠く離れた硬膜外の位置)に硬膜外に挿入します( 図2Eのワイヤー)
- 手順 2.4.4 を繰り返します。および2.5.1.-2.5.3対側半球。
- 配置を確認するための術中X線:
- ウェットパッド(滅菌生理食塩水の標準パッド)を手術部位に置き、組織の水分補給を保ちます。次に、動物の頭を覆うように滅菌手術用ドレープを置きます。
- X線マーカーを指標として使用して、インプラントが適切に配置され、折りたたまれていないことを確認するために、平面X線画像(軸方向および矢状)を撮影します。そうでない場合は、ドレープを取り外し、デバイスを外植して再度挿入します(手順2.4.4.および2.5.1.-2.5.3を再度実行します)。
- 硬膜閉鎖:3-0吸収性縫合糸と小さなニードルホルダーを使用して、インプラントケーブルの周囲に硬膜を慎重に縫合します。縫合ワイヤーで薄い膜を引き裂くことなく、2つの硬膜の縁をできるだけ一緒にします(図2D、E)。
- 骨フラップの配置:チタン製のネジを使用して、各骨フラップの前部と後部にチタン製のブリッジを固定します。次のステップでは、フットプレートの脚の配置に関してTiブリッジの位置を計画するように注意してください。チタン製ブリッジの端を頭蓋骨にねじ込みます(図2F、G)。
- デバイスの挿入:
- 台座とフットプレートの配置
- 位置決め:この構成では、フットプレートにはそれぞれ2つのネジ穴が付いた6本の脚があります(補足図1B)。頭蓋骨へのフットプレートの配置を計画して、ネジの位置を最適化します(開頭術の端や側頭筋に配置することは避けてください)。脚の穴をねじ込めない場合はスキップします。
- フットプレートの固定:フットプレートのチタン製ネジをしっかりと所定の位置に収まるまでねじ込みます( 図2Hを参照)。
- ペデスタルの配置:接続ケーブルの上にあるチタンブリッジを取り外し、ペデスタルを裏返してフットプレートに着陸させます。台座をフットプレートにねじ込みます。台座がしっかりと固定されていることを確認します(図2I)。
- 縫合と閉鎖
- 創傷の洗浄:生理食塩水で洗い流して、骨やその他の破片の皮下空間をきれいにします。台座の端の周りの皮膚を切り取り、円柱に続く丸い縁を作成します。
- 皮下縫合:スプレッダーを取り外し、皮膚フラップを一緒に折ります。単純な断続縫合糸または単純な連続縫合糸を使用して、4-0の非吸収性縫合糸ワイヤーを3mm離して皮下縫合糸を作成します。台座から離れ、切開の両側で台座に向かって移動します。
- 皮膚縫合糸:6-0の非吸収性縫合糸ワイヤーを使用して皮膚を縫合し、縫合糸を5mm離して縫合します。台座から離れ、切開の両側で台座に向かって移動します。空隙を避けるために、2つの皮膚フラップの間とペデスタルエッジの近くで良好な組織配置を実現するように注意してください(図2J)。
- 創傷被覆材:滅菌パッドとベタジンで創傷領域を再度清掃します。創傷の上に粘着性の滅菌包帯を貼ります。
- in vivo 測定:in vivo 測定については、セクション 3、4、5 に従ってください。
- 覚醒:すべての測定が行われた後、動物をすべての麻酔薬から外し、換気を保ちます。鎮痛剤の場合は、ブプレノルフィンパッチ(25 mg / h)を24時間塗布します。.ドレープで覆われた温熱パッドの上に動物を置き、起床時間を早めます。自発呼吸が回復したら、動物を抜管し、意識が回復するまで酸素フェイスマスクの下に置いてください(1〜4時間かかる場合があります)。
- 術後の動物のケア:5日間、動物を綿密な監視下に置きます。75mgのセファレキシンを1日2回、他の動物から分離して食物と一緒に投与します。浸した滅菌パッドで大量のベタジンを塗布することにより、毎日創傷の消毒を行います(給餌中に行うのが最適です)。
注:長期ケアと飼育:手術を受けた動物は24時間隔離されます。動物が仲間と社会的に交流するのに十分な健康状態であれば、元の社会集団に戻されます。台座と皮膚の開口部を毎日観察して、頭部へのデバイスの統合を追跡する必要があります。必要に応じて、台座の周りの場所を大量のベタジンで清掃します。
3. 軟部インプラントの in vivo 特性評価
- クロノアンペロメトリー:パルス発生器に並列に接続されたオシロスコープを使用して、二相性電流パルス発生(VT)の注入時の電圧降下を記録します。パルス発生器を各電極とアース線に順次接続します。100Hzで300μsのパルス幅で100μAの刺激パルスを実行します。
- 電気化学インピーダンス分光法:ポテンショメータを使用して、さまざまな周波数で電気化学インピーダンスを測定します。パルス発生器を各電極に順次接続し、アース線を対向電極とアースの両方として使用します。励起電圧を 200 mV、周波数範囲を 1 Hz から 1 MHz に設定し、ディケードごとに 3 ポイントに設定します。
- チャンネル間短絡測定:ハンドヘルドマルチメータを使用して、隣接するチャンネル間のDC抵抗を測定します。 In vivoでは、チャンネル間DC抵抗は、1kΩ未満の不足が発生しないことを確認するためにのみ測定され、完全な封止不良を示します。
4.電気生理学的記録
- 自発的な活動:ワイヤレス録音システムを台座に差し込み、ベースライン活動を2〜3分間記録します。これらの記録は、聴覚誘発電位を分析するためのコントロールとして機能します。
- 聴覚誘発電位:ワイヤレスシステムに加えて、動物の耳の閉音場にスピーカーを挿入します。さまざまな周波数(200〜20,000 Hzの範囲)で、約70dBの音圧レベル(SPL)で120回の繰り返しでトーンバースト音響刺激を再生します。次に、記録を平均化し、分析のために刺激期間にわたってそれらを調整します。
- 感覚誘発電位:針を鼻の3つの異なる位置に置きます。異なる振幅のパルス発生器で鼻を~30秒間刺激することにより、感覚電位を呼び起こし、動員曲線を取得します。
5. 生体内 イメージング
- 動物の輸送:ステップ2.1で説明したように、動物をプロポフォール麻酔下に置いてください。人工呼吸器、シリンジポンプ、バイタルサインモニターを収納した搬送カートを使用して、手術室から画像診断施設まで動物を輸送します。
- コンピュータ断層撮影X線スキャン:動物をスキャナーテーブルの上に置き、頭の周りの金属物(温度センサーなど)をすべて取り除きます。骨造影のための自動電流および電圧選択を備えたアイソメトリック取得を使用して、最小の解像度(スライス厚さ0.4mm)でCTスキャンを取得します。
- 磁気共鳴画像法:動物から金属を含むすべての機器を取り除きます(MRI互換のIVリード線と挿管チューブを使用してください)。MRIチャンバーの外側にあり、長いチューブを介して動物にリンクされている人工呼吸器を使用して、3%〜3.5%のセボフルラン下で動物を換気および麻酔します。.最初のシーケンスの前に、フェンタニルのボーラスを1〜2 μg / kgで注射します。.最小分解能で 3 つのアイソメトリック配列 (T1、T2、ターボスピンエコー (TSE) 加重配列) を使用します (パラメーターは 補足ファイル 1 に示されています)。
6.自由に動く録音
- 脳からの覚醒信号を記録するために、セクション4で説明したのと同じ手順に従います。動物を実験者の腕に抱きかかえるか、動物におやつを与えて気をそらすことで、ワイヤレスヘッドステージを接続します。動物の近くに設置した外部スピーカーを使って音響刺激を与えます。
7. 灌流および組織調製
- オプション:動物がまだ麻酔を受けていない場合は、麻酔プロトコルのステップ2.1に従います。
- 灌流のための頸動脈へのカテーテルの挿入(補足図2)
- 頸動脈および頸静脈解離:焼灼器/カッターを使用して正中線で喉を切断します。最初に皮膚を切開し、次に真ん中の白い線(下に血管がない)に続く筋肉を切開します(補足図2A)。
- さらに開き、指を使って気管の周りと筋肉の下にスペースを作ります。頸動脈(鼓動とピンクがかった)を探します。迷走神経も時々周り(白)にあり、頸静脈は下または横(赤)にあることがあります。スプレッダーを配置します( 補足図2Bを参照)。
- 細かい鉗子と丸いハサミを使用して頸動脈の解剖を開始します。はさみを使用して結膜組織を開きます。血管がない場合は、切ります。血管がある場合は、焼灼して前進します(補足図2C、D)。十分に解剖したら、クランプを使用して頸動脈の下をくぐり、完全に分離します(補足図2E)。
- 頸静脈でも同じ操作を繰り返します(補足図2F)。
- 両方の血管が完全に解剖され、隔離されたら、それらの周りに縫合糸を配置します。まだ閉じないでください。頸動脈の周囲に2本の縫合糸があり、1本は基部(脳灌流用の縫合糸1-心臓側)ともう片側(縫合糸2)に1本は、 補足図2Gに示されている。
- 頸静脈(縫合糸3)の周りに1本の縫合糸を置き、閉じないようにします。後で静脈を切片化するために、ワイヤーにテープで印を付けます。
- 縫合糸1を非常にしっかりと閉じないと、出血します(補足図2H)。3つの結び目を作ります。ワイヤーにクランプをかけて体重をかけ、頸動脈に緊張をかけます。
- 頸動脈解離の反対側(脳灌流の場合は脳側)の血管クランプを使用して頸動脈をクランプします。 補足図2I)。縫合糸2は真ん中にあり、まだ閉じていません。
- 黒い鉗子を使用して頸動脈を引っ張ってください。細いハサミを使用して、解剖の基部近くの頸動脈の半分を切片(縫合糸1の近く、心臓側; 補足図2Jを参照)。セクションができるだけきれいで、「シース」だけでなく容器自体にも届いていることを確認してください。そうしないと、カテーテルが通過しません。 補足図2Kに示すようにカテーテルを挿入します。
- カテーテルを洗い流して満たし、まずPBSで満たし、カテーテル内に空気が残らないようにします(補足図2K挿入図 )。
- 縫合糸2が離れないように十分にしっかりと閉じますが、カテーテルがまだ少し動くことができるようにしすぎないようにします(補足図2L)。次に、血管クランプを取り外し、カテーテルの挿入を可能な限り終了し、縫合糸2の閉鎖を確定します(しっかりと閉じます)。
- 必要に応じて、縫合糸1で縫合ワイヤーを使用して、追加のセキュリティステップとして、カテーテルの基部を創傷出口の皮膚に取り付けます。次に、動物を灌流ゾーンに移し、PBS/ヘパリンに差し込みます。灌流が始まったら、縫合糸3を引っ張り、頸静脈を切断します
- 安楽死:ペントバルビタール(90 mg / kg)を静脈内投与し、生理食塩水でラインを洗い流して、全用量が正常に投与されるようにします。.
- 灌流:灌流ポンプ(200 mL / min)を使用して、頸動脈カテーテルをPBS/ヘパリン(15 kgのブタの場合は1 L)に差し込み、次に4%パラホルムアルデヒド(PFA)を含むPBS(15 kgのブタの場合は5 L)に差し込みます。灌流が始まったら、縫合糸3を引っ張り、頸静脈を切断します。
- 組織採取
- 斬首:灌流が終わったら、メスを使って皮膚と筋肉を切り裂き、第1椎骨と第2椎骨の間に刃を挿入して、動物の頭を体から切り離します。
- 固定後:頭部をPBS中の4%PFAに4°Cでさらに48時間浸し、脳摘出前にPBSに移します。
- 脳とインプラントの摘出:
- メスを使って皮膚を取り除き、脊髄から小脳まで、最初の椎骨から始めてロンジュールを使用して慎重に骨を切り始めます。小脳が露出したら、側頭骨を慎重に除去し、頭頂葉と前頭葉を露出させます。
- この時点で、台座をフットプレートからねじ込み、フットプレートの足をペンチで切断します。頭蓋骨へのケーブル入口付近の骨を取り除き、インプラントを硬膜出口から引き抜くことなく、インプラントシステムを骨から解放します。
- インプラントケーブルが骨に埋め込まれている場合は、ケーブルをできるだけ出口の近くで切断します。脳表面が十分に露出したら、小さなハサミを使用して正中線に沿って硬膜を慎重に切ります。
- インプラントケーブルを硬膜出口から解放します。脳へのインプラント埋入から写真を撮ります。次に、小さなスプーンを使用して、脳を下の脳神経から切り離します。脳を慎重に抽出します。脳からインプラントを取り除きます。
- 脳の事後固定:灌流の質に応じて、摘出した脳を4°CのPBS中の4%PFAで24時間再度後付けします。 脳が切断されるまで、0.1 M PBSを4°Cで保持します。
- 脳の切断:カミソリの刃を使用して2つの半球を分離します。次に、脳を直交して4つの異なる部分に切ります。植込みゾーンを半分に切断して、植込みゾーンとコントロールエリアを含む2つのブロックを取得します。他の 2 つのブロックは、さらにコントロール スライドが必要な場合は保管します。
- 脳の凍結保護と凍結:脳ブロックを最初に15%のショ糖の溶液に移し、次に4°Cで30%のスクロースの溶液に移し、脳が急降下して平衡に達するまで加熱します。次に、組織凍結システムで-55°Cのイソペンタンで組織を凍結します。
8.組織学
- 組織切片化
- クライオスタット:凍結した脳をクライオスタットに入れ、完全な切片が得られるまでトリミングします。次に、脳を40 μmの切片にスライスし、ウェルプレートの0.1 M PBSに3つのグループで浸します。プレートの順序に注意してください。
- セクションの選択:分析するゾーン(埋め込み領域またはコントロールゾーン)に応じてセクションを選択します。ウェルプレートから切片を順番に取り出し、細いブラシを使用して損傷がないか検査します。0.1 M PBSで満たされた新しいウェルプレートに入れ、さらに染色します。
- 免疫組織化学
- 調製:切片を0.3% Triton X/PBSで15分間インキュベートし、続いて3%ウシ血清アルブミン(BSA)/PBSで室温(RT)で1時間インキュベートします。
- 一次抗体:一次抗体とともに組織を室温で48時間インキュベートします(抗GFAP、ラット、1/300に希釈、抗Iba1、ウサギ、1/400に希釈、抗NeuN、モルモット、1/1,000に希釈、すべて1%BSA/PBS中)。ウェルプレートをアルミホイルで覆います。
- 洗浄:ウェルを0.1 M PBSで5分間3回洗浄します。
- 二次抗体:二次抗体(Alexa Fluor 488、Alexa Fluor 647、Alexa Fluor 555、すべて1% BSA/PBSで1/400に希釈)で2時間インキュベートします。
- DAPI(4',6-ジアミジノ-2-フェニルインドール):組織をDAPIで15分間インキュベートします(1%BSA/PBS中1/1,000)。
- 洗浄:ウェルを0.1 M PBSで15分間5回洗浄します。
- 取り付け:封入剤とカバーガラスを使用してスライドを取り付けます。スライドは暗所で4°Cの冷蔵庫で保管してください。
- イメージング
- ホールスライドイメージング:3つの異なる波長(640 nm、560 nm、485 nm)のスライドスキャナー顕微鏡を使用して、10倍の倍率(対物レンズ作動距離値=3,100 μm)でスライドをイメージングします。すべての電力とゲインの情報は、 補足ファイル2に記載されています。
- 顕微鏡イメージング:共焦点顕微鏡を用いて、4波長(Alexa Fluor 647、DAPI、Cy3、EGFP)で20倍の倍率(アポクロマート20x/0.8 M27)で関心領域をイメージングします。すべての電力とゲインの情報は、 補足ファイル3に記載されています。
結果
デバイスの配置(図3A)と機能を確認するために、台座の配置後に術中に電気生理学的記録が実行されます。ベースライン信号は、基礎活動の制御として、刺激なしで最初に2分間にわたって取得されます。第二に、動物は異なる周波数(500-20,000 Hz)でのトーンバーストで音響刺激を受け、生データは刺激期間にわたって平均化され、アレイ全体の聴覚誘発電位をマッピングします(たとえば、ベースラインと比較して800Hz; 図3B)。ここに示すデータは未処理ですが、ノイズが多すぎる場合は、ノッチフィルターとバンドパスフィルターを適用できます。手術室の典型的な騒音源には、加熱パッド、詰まったドリル、吸引器や焼灼器などがあり、取得前に取り外す必要があります。覚醒中の記録では、よりクリーンなデータセットのために、咀嚼などの頭の周りの大きな筋肉の動きを避ける必要があります。
このプロトコルはすべての記録時点で適用され、1つのチャンネルの信号を経時的に比較することができました。1つの例を 図3Cに示し、応答のロバスト性と変化を示しています。実験の経時的な経過に伴う各接触の記録能力は、各時点におけるベースライン信号の標準偏差を計算することによって評価できます(図3D)。この研究では、記録期間が限られているため(つまり、2分)、多少のばらつきはあるものの、S/N比は減少し、0日目から6か月目の間に落ち着きました。これは、電極インピーダンスとさらに相関させることができます。
in vivoイメージングは、脳の状態とインプラントの位置を評価するために術後に行われます。プロトコルの最初の反復では、術中X線は行われず、T1強調MRIシーケンスの図4Aに見られるように、折りたたまれたデバイスになりました(さらに図4Bを参照)。動物では行動の変化は観察されませんでしたが、時間の経過とともに、インプラント位置の周りの脳の巨視的圧迫により、デバイスの周囲に線維化カプセル化が見られました(図4C)。この経験の後、図4Dに示すように、術中X線が導入され、X線不透過性マーカー(挿入図4Dのインプラントに見える黒いバー)が適切に配置されていることが示されています。その後、図4Eの術後MRIで観察できるように、脳の表面は無傷です。全体として、このインプラントとペデスタルシステムにより、全脳イメージングが可能です。冠状面のさまざまな配列により、解剖学的構造を見ることができます(図4F、G;T1およびT2 MRIシーケンス)またはインプラント周囲の液体と血液の存在(図4H;TSE強調MRIシーケンス)。ペデスタルシステムは、チタンネジの周りのいくつかの小さな黒いコントラストの空洞を除いて、ほとんどアーチファクトを作成しません(図4Gを参照)。さらに、この研究では臨床用電極がコンパレータとして使用されていますが、加熱と安全性の懸念からMRIでは画像化できません。したがって、図4Iに示すように、これらの動物でCTスキャンが取得されます。電極ははっきりと見え、ペデスタルシステムは画質に影響を与えていません。
移植期間の後、動物は灌流され、脳が抽出されます。この研究では、炎症反応の分析は各半球で独立して行われます。脳を半分に切断すると、切片化前の組織調製が容易になり、切片を標準的な顕微鏡スライドに取り付けることができるという利点があります。脳サンプルの一例は、ブロックを切断する前(図5A)と切断後(図5B)を示しています。インプラントの輪郭がはっきりと見え、脳に小さなへこみができています。平行な平面で切断することにより、組織はすでにクライオスタットに位置合わせされており、トリミングのために組織を失うことなく切片を容易に切断できます(図5C)。染色後、組織切片全体が画像化され(図5D)、例えば、ニューロン層が詳細にはっきりと見えます(NeuNマーカーを参照)。切片全体が壊れやすく、組織がいくらか失われることもありますが( 図5Dの下部を参照)、関心領域は無傷です。40倍の共焦点顕微鏡イメージングにより、細胞が明確に定義され、炎症マーカーの精密な調査などが可能になります(図5E)。さらに定量化分析を行って、対照半球と移植半球の間の炎症を比較することができます。 図6 は、埋め込まれた電極の電気化学的特性評価を示しています。インピーダンス弾性率と位相を持つ軟電極アレイの In vitro 電気化学インピーダンス分光法を 図 6A に示し、注入から 6 か月間の 1 kHz でのインピーダンス係数を 図 6B に示します。
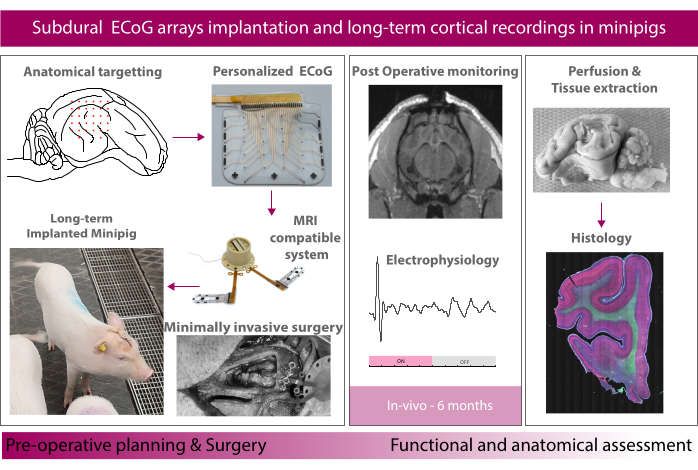
図1:実験の概略図。 この図の拡大版をご覧になるには、ここをクリックしてください。
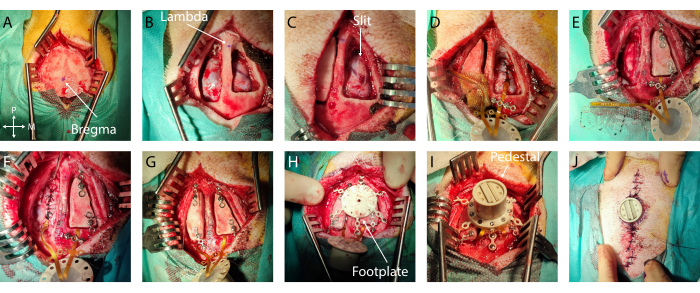
図2:脳へのソフトECoGの低侵襲移植 。 (A)ブレグマの兆候を伴う頭蓋骨への外科的アクセス。(B)硬膜が見える両側開頭術。(C)第1半球のスリット硬膜切開術。(D)軟質ECoGの硬膜下移植と硬膜閉鎖。(E)第2半球のスリット硬膜切開術。チタンブリッジを使用した第1半球の骨皮弁固定。(F)第2半球への軟ECoGの移植と硬膜閉鎖。(g)第2半球の骨皮弁固定。(H)頭蓋骨上のフットプレートの位置。(I)フットプレートへの台座の固定。(J)台座基部の周りの皮膚閉鎖。 この図の拡大版をご覧になるには、ここをクリックしてください。
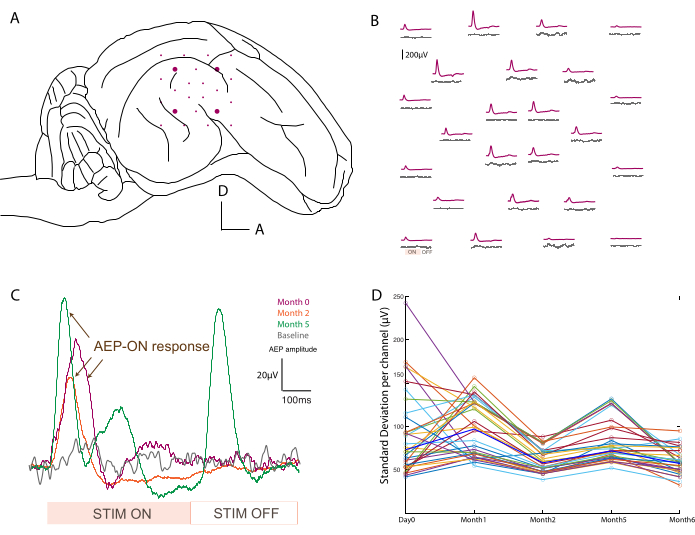
図3:聴覚誘発電位の記録 。 (A)側頭葉表面の電極配置の模式図。(B)800 Hzのトーンバースト刺激(紫色のトレース)に応答するベースライン活動(灰色のトレース)と聴覚誘発電位の代表的なマッピング。各平均は、ソフト ECoG アレイの 1 つのチャネルに対応します。平均化は、音の刺激からのアナログ入力信号でトリガーされます。「ON」と「OFF」の音響刺激期間は、左下の1つのチャンネルに記録されています。(C)刺激が提示されていない場合のベースライン信号と比較した、音響刺激後の単一チャネル応答の経時的変化(0日目、2か月目、5か月目)。平均化は、音の刺激からのアナログ入力信号でトリガーされます。「ON」と「OFF」の刺激期間は下部に記載されています。「ON」刺激の誘発電位は矢印でマークされています。(D)ベースライン記録の時点ごとのチャンネル(色付きのドット)ごとの標準偏差。中央値は太字の青で表されます。 この図の拡大版をご覧になるには、ここをクリックしてください。
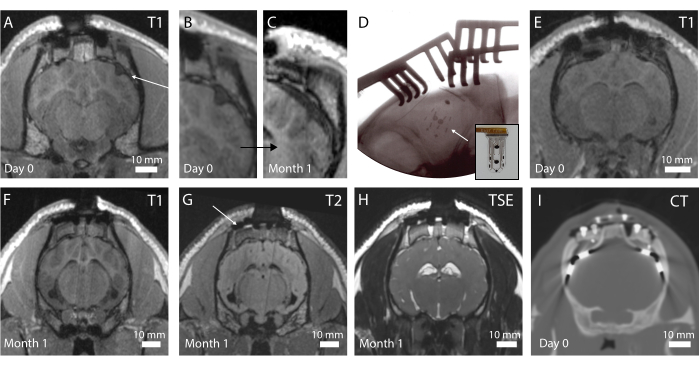
図4:脳と埋め込み電極のin vivoイメージング。 (A)冠状面の術後T1強調MRI。矢印は折り畳まれたインプラントを示します。(B)インプラントの折り畳みが脳にへこみを作るAの拡大部分。(C)1ヶ月の移植時のT1強調MRIで、Cと同じ位置に脳の線維化被覆による脳の圧迫が見られる。(D)術中平面X線検査で、インプラントの埋入と折り畳みなしを確認する X線不透過性マーカーの配置。挿入図:X線不透過性マーカーが見えるインプラントの写真。(E)最適なインプラント埋入を伴う冠状面での術後T1強調MRI。(F)1ヶ月の移植時のT1強調MRI。(G) 1 か月の移植時の T2 強調 MRI。矢印は、頭蓋骨のフットプレートを固定しているチタン製のネジからの画像アーチファクトを示しています。(H)1か月の移植時のTSE強調MRI。(i)臨床用電極を埋め込んだ動物のCTスキャン。この図の拡大版をご覧になるには、ここをクリックしてください。
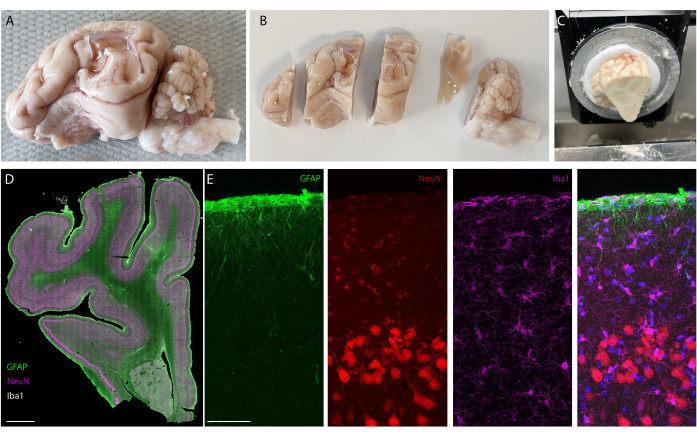
図5:長期移植後の脳の組織学的分析 。 (A)移植・灌流した脳左半球の写真。(B)凍結ステップの前にブロックに切断された灌流脳。(C)クライオスタットのブロック全体の切片化セットアップの写真。「プレカットブロック」全体を切断することができます。(D)全半球の免疫染色イメージング(スライドスキャナー、20倍対物レンズ)および(E)皮質の最初の層のズーム(共焦点イメージング、40倍対物レンズ)グリア細胞、アストロサイト、およびニューロンを示す。 この図の拡大版をご覧になるには、ここをクリックしてください。
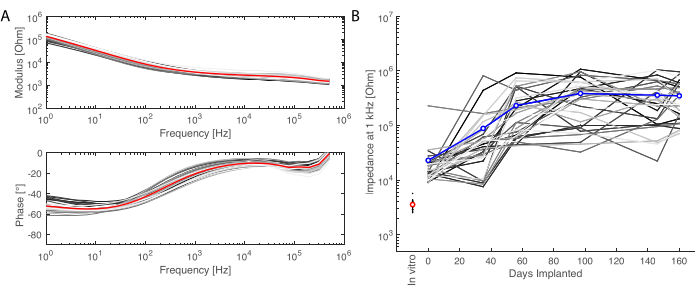
図6:埋め込まれた電極の電気化学的特性評価 。 (A)インピーダンス弾性率(上)と位相(下)の軟質電極アレイ(各チャネルの小さな灰色の線、赤の平均)の in vitro 電気化学インピーダンス分光法。(B)移植後6ヶ月間の1 kHzでのインピーダンス弾性率の変化(青字は平均、灰色の線は個々のチャンネル、 in vitro 測定値は赤色で基準値)。 この図の拡大版をご覧になるには、ここをクリックしてください。
補足図1:MRI対応ペデスタル。 (A)軟電極アレイにアクセスするための慢性MRI対応経皮接続システム(ペデスタル)。(B)頭蓋骨を固定するためのフットプレートに電極が取り付けられた台座。挿入図: フットプレートの詳細。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:脳の最適な灌流のための外科的アクセス。 (A)皮膚の切断と頸動脈と頸静脈の位置へのアクセス。(B)血管周辺の組織の解剖。(C、D)頸動脈と頸静脈周辺の組織の同定と解剖。(E)頸動脈を下の組織から分離する。(F)頸静脈を下の組織から分離する。(g)頸動脈(縫合糸1および縫合糸2)および頸静脈(縫合糸3)の周囲に縫合線を配置する。(H)頸動脈の基部(心臓側)で縫合糸3を閉鎖し、血管を開く際の出血を防ぎます。(I) Hとは反対側の頸動脈をクランプする。(J)頸動脈の切片化。(k) Jから開口部にカテーテルを挿入した。挿入図:生理食塩水を注射器からカテーテル先端に流したプライミングカテーテル。(L)カテーテルを所定の位置に維持し、動脈に沿って縫合糸2を閉鎖する。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル1:T1-(1-2ページ)、T2-(ページ(3-4)およびTSE重み付け(5-6ページ)のMRIシーケンスのパラメーター。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:染色された脳スライスのスライド全体イメージングのためのスライドスキャナーのメタデータ。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル3:染色された脳スライスの拡大切片の共焦点イメージングのメタデータ。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
本稿では、ソフトECoGアレイの長期移植と評価法について報告する。本研究では、側頭葉(ここでは聴覚皮質を標的とする)に機能的電極グリッドを両側に移植するための一貫した低侵襲手術アプローチを設計した。まず、研究の期間(6か月)にわたって誘発電位を記録し、電極の電気化学的特性を追跡することで、グリッドの機能を評価しました( 図6を参照)。第二に、MRIを用いてMRIに完全対応システムを確立し、組織採取と免疫染色のプロトコルを設計して死後分析 を行い、グリッド のバイオセーフティを評価しました。
侵襲性を最小限に抑えるために、開頭窓のサイズを最適化しました。側頭葉に位置する聴覚野に到達し、側頭筋の切除を避けるために、硬膜の下にインプラントをスライドさせる技術を開発しました。この技術により、露出した脳の表面を大幅に縮小し、遠くのターゲットに到達することができます。このタイプの移植は盲目に見えるかもしれませんが、術中の平面X線で視覚化されるデバイスにX線不透過性マーカーを実装することで、位置の検証が可能になり、アレイが硬膜の下で折りたたまれないようにすることができます。硬膜下スライドは、私たちが行ったほとんどの反復で安全であることが証明されています。さらに、スリットアプローチでの硬膜切開術は、開頭術が開いている間の脳の膨らみを最小限に抑え、炎症反応に偏りを与える可能性のある人工硬膜などの追加材料を必要とせずに、インプラントの周囲の閉鎖を容易にします。最後に、この外科的アプローチの強みは、異なる皮質領域に転位する能力です。座標、開頭位置、デバイスサイズなど、すべて調整可能な方法で遊ぶことで、この方法は皮質領域のほとんどをターゲットにすることができます。
ここで紹介する手術方法は、機能評価と経時的な生体統合の調査とともに、このレポートで使用されている軟電極技術に限定されません。ヒト翻訳用に開発されている他の硬膜下電極は、同じプロトコルで評価できます。この方法の強みは、ケーブルや台座などのほとんどの部品がモジュール式でパーソナライズ可能であり、テスト対象の特定のデバイスに適合できるという事実に依存しています。さらに、皮質内または深部貫通プローブは、開頭術と硬膜切開術の形状を調整するだけで済むため、硬膜下電極の代わりに、または硬膜下電極と組み合わせて使用することもできます。長期的な結果は、ここで行ったように、臨床の結果と比較することができます。
提示された方法の主な制限の1つは、最初の12年の間に発達するミニブタの頭蓋骨洞の存在です。その点で、考慮すべき重要な側面には、着床の年齢と動物の大きさが含まれます。成人の頭蓋骨に開頭手術を行うと、副鼻腔の完全性が損なわれ、慢性的な状況では大きな感染症のリスクが高くなります。このような副鼻腔は、術前の平面X線およびCTスキャンで見ることができます。一方、小さすぎる動物に慢性的な着床を早すぎると、頭蓋骨が大規模な成長とリモデリングを受けているときにも最適ではありません。私たちは、手術後のこれらの「頭蓋骨の動き」がインプラントを動かして折りたたむ原因となり、最終的に実験に悪影響を与える可能性があるという仮説を立てました。ここでは、着床時に生後約5〜6か月(および8 kg)のゲッティンゲンミニブタが最良の結果をもたらす必要があることがわかりました。
電気生理学的記録のための移植されたECoGの性能を評価するために、私たちは、自由に動く動物や鎮静下で使用できる聴覚誘発電位(AEP)記録の迅速なプロトコルを設定しました。これは、数分の間に特定の周波数で一連のアコースティックトーンバーストを提示することで構成されます。このようなプロトコルの利点は、プローブする周波数の数を減らすことによって、利用可能な記録の長さに調整できるという事実です。麻酔下で皮質信号を記録する際の課題の1つは、データを分析および比較する際に動物の意識レベルを考慮する必要があることです。
灌流のプロトコルは、抽出された脳の質を観察することにより、経時的に調整されました。実際、頸動脈のみにカテーテルを挿入し、頸静脈にはカテーテル挿入しない方が簡単であることがわかりました。最初に、文献は、頸静脈が老廃物を排出するためにカテーテル挿入される方法を提示している20。実際には、これは脳からの流出を制限し、血液の抽出と灌流の全体的な質の低下につながります。頸静脈を切断し、動物が横たわっている大きな容器に液体を逃がすことにより、灌流の効率が高まります。
私たちは、炎症追跡に日常的に使用される抗体で機能する堅牢な組織調製法を開発しました。ブタの脳の半分は標準的な顕微鏡スライドに収まるため、組織学ラボで入手可能なほとんどのイメージング機器と互換性があるため、実用的な理由から2つの半球を分離しました。脳をブロック状に切断することで、脳全体をさらに切断したり、組織の広範な部分をトリミングしたりすることなく、関心のある領域に直接アクセスできるようになります。40 μmの脳スライスは、標準的なウェルプレートにプールし、他の種の免疫染色によるプロトコルの大きな変更なしに、自由に浮遊する方法で染色することができます。全脳免疫染色は、例えば、CLARITY法21を用いても考えられる。
全体として、このプロトコルは、パーソナライズされたインプラント設計から移植、機能フォローアップ、およびバイオセーフティ評価までをカバーし、堅牢で一貫性があります。ここでは、聴覚系を研究する可能性を示しましたが、他の生理学的機能をテストするために置き換えることができます。さらに、私たちの方法の強みは、ミニブタに限定されず、ヒツジ、ヤギ、または人間以外の霊長類などの他の種に完全に転用可能であるという事実にあります。ある程度、ラットにも簡単に適応できます。
開示事項
F.F.とS.P.L.は、軟質電極アレイを開発するNeurosoft Bioelectronics SAの共同設立者兼株主です。
謝辞
著者らは、Bertarelli FoundationおよびSNSF Sinergia助成金CRSII5_183519からの財政的支援に感謝します。著者らはまた、組織学の染色プロトコルの開発に協力してくれたEPFLのKatia Galan氏、製造プロセスを支援してくれたジュネーブのWyss Center for Bio and NeuroengineeringのNeural Microsystems Platformのスタッフ、動物のケアに協力してくれたジュネーブ大学大学医療センター(CMU)の動物プラットフォームのスタッフ、 ミニブタの外科的支援、術後管理(John Diaper、Xavier Belin、Fabienne Fontao、Walid Habre)、ジュネーブ大学の生物医学イメージングセンター(CIBM)のチームメンバー(Julien Songeon、François Lazeyras、Rares Salomir)、ジュネーブ大学病院(HUG)の病理科のスタッフ(Sami Schranz、Francesca Versili、 Ruben Soto、Coraline Egger)、およびグルノーブル・アルプ大学のBlaise Yvert氏には、慢性ミニブタの実験に関する意見と意見交換をいただきました。著者らは、Neurosoft Bioelectronics SAの従業員(Benoit Huguet氏とMargaux Roulet氏)の製作プロセスへの協力とミニブタの実験への協力に感謝したい。
資料
| Name | Company | Catalog Number | Comments |
| Bone drill | BBraun | Elan 4 with GA861 handpiece | |
| Bone drill bit | BBraun | Neurocutter GP204R | |
| Bonewax | Ethicon | W31G | |
| Catheter | Venisystems | Abbocath 14G | |
| Confocal Microscope | Zeiss | LSM 880 | |
| Cryostat | Leica | CM1950 | |
| Gelfoam | Pfizer | Gelfoam | |
| Insert speakers | Etymotic | Etymotic ER2 insert Earphones | |
| Multimeter | Fluke | Fluke 1700 | |
| Oscilloscope | Tektronix | MDO3014 Mixed Domain Oscilloscope | |
| Perfusion pump | Shenzen | LabS3/UD15 | |
| Potentiostat | Gamry Instruments | Reference 600 | |
| Primary Antibody Anti-GFAP | Thermofischer | Anti-GFAP, Rat, # 13-0300 | |
| Primary Antibody Anti-Iba1 | Fujifilm | Anti Iba1, Rabbit, 019-19741 | |
| Primary Antibody Anti-NeuN | SigmaAldrich | Anti-NeuN, GuineaPig, ABN90 | |
| Pulse Generator | AM Systems | Model 2100 Isolated Pulse Stimulator | |
| Recording headstage | Multichannel systems | W2100-HS32 | |
| Recording system | Multichannel systems | W2100 | |
| Screwdriver | Medtronic | Handle: 001201, Shaft: 8001205 | |
| Secondary Antibody 488 | Thermofischer | Goat anti-Rat IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488, # A-11006 | |
| Secondary Antibody 555 | Thermofischer | Goat anti-Guinea Pig IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555, # A-21435 | |
| Secondary Antibody 647 | Thermofischer | Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 647, # A-21245 | |
| Slide Scanner | Olympus | VS120 | |
| Snapfrost | Excilone | Excilone Snapfrost | |
| Stab knife | Fine Science Tools | 10316-14 | |
| Suture wire dermal | Ethicon | Vicryl 2-0 | |
| Suture wire dura mater | Ethicon | Mersilk 5-0 | |
| Suture wire for catheter | Ethicon | Vycril 3-0 without needle | |
| Suture wire for lifting dura | Ethicon | Prolene 6-0 with BV-1 needle | |
| Suture wire subcutaneous | Ethicon | Vicryl 4-0 | |
| Titanium bridge | Medtronic | TiMesh 015-2001-4 | Cut out the required size |
| Titanium screws | Medtronic | 9001635, 9001640 | |
| X-ray system | GE | GE OEC 9800 Plus C-Arm |
参考文献
- Ritaccio, A. L., Brunner, P., Schalk, G. Electrical stimulation mapping of the brain: Basic principles and emerging alternatives. Journal of Clinical Neurophysiology. 35 (2), 86-97 (2018).
- Mullin, J. P., Sexton, D., Al-Omar, S., Bingaman, W., Gonzalez-Martinez, J. Outcomes of subdural grid electrode monitoring in the stereoelectroencephalography era. World Neurosurgery. 89, 255-258 (2016).
- Vansteensel, M. J., et al. Fully implanted brain-computer interface in a locked-in patient with ALS. The New England Journal of Medicine. 375 (21), 2060-2066 (2016).
- Lacour, S. P., Courtine, G., Guck, J. Materials and technologies for soft implantable neuroprostheses. Nature Reviews. Materilas. 1, 16063 (2016).
- Fallegger, F., Schiavone, G., Lacour, S. P. Conformable hybrid systems for implantable bioelectronic interfaces. Advanced Materials. 32 (15), 1903904 (2019).
- Pearce, A. I., Richards, R. G., Milz, S., Schneider, E., Pearce, S. G. Animal models for implant biomaterial research in bone: A review. European Cells & Materials. 13, 1-10 (2007).
- Swindle, M. M., Makin, A., Herron, A. J., Clubb, F. J., Frazier, K. S. Swine as models in biomedical research and toxicology testing. Veterinary Pathology. 49 (2), 344-356 (2012).
- Khoshnevis, M., et al. Development of induced glioblastoma by implantation of a human xenograft in Yucatan minipig as a large animal model. Journal of Neuroscience Methods. 282, 61-68 (2017).
- Borton, D., et al. Developing implantable neuroprosthetics: A new model in pig. Annual International Conference of the IEEE Engineering in Medicine & Biology Society. 2011, 3024-3030 (2011).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Gierthmuehlen, M., et al. Evaluation of mECoG electrode arrays in the minipig: Experimental procedure and neurosurgical approach. Journal of Neuroscience Methods. 202 (1), 77-86 (2011).
- Palma, M., et al. Chronic recording of cortical activity underlying vocalization in awake minipigs. Journal of Neuroscience Methods. 366, 109427 (2022).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C. H., Palomero-Gallagher, N. The telencephalon of the Göttingen minipig, cytoarchitecture and cortical surface anatomy. Brain Structure & Function. 222 (5), 2093-2114 (2017).
- Lind, N. M., et al. The use of pigs in neuroscience: Modeling brain disorders. Neuroscience and Biobehavioral Reviews. 31 (5), 728-751 (2007).
- Shepherd, R. K., Villalobos, J., Burns, O., Nayagam, D. A. X. The development of neural stimulators: A review of preclinical safety and efficacy studies. Journal of Neural Engineering. 15 (4), 041004 (2018).
- Schiavone, G., et al. Soft, implantable bioelectronic interfaces for translational research. Advanced Matererials. 32 (17), 1906512 (2020).
- Fallegger, F., et al. MRI-compatible and conformal electrocorticography grids for translational research. Advanced Science. 8 (9), 2003761 (2021).
- Minev, I. R., Wenger, N., Courtine, G., Lacour, S. P. Research update: Platinum-elastomer mesocomposite as neural electrode coating. APL Materials. 3 (1), 014701 (2015).
- Schiavone, G., et al. Guidelines to study and develop soft electrode systems for neural stimulation. Neuron. 108 (2), 238-258 (2020).
- Musigazi, G. U., De Vleeschauwer, S., Sciot, R., Verbeken, E., Depreitere, B. Brain perfusion fixation in male pigs using a safer closed system. Laboratory Animals. 52 (4), 413-417 (2018).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nature Methods. 10 (6), 508-513 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved