Method Article
Impianto di array di elettrocorticografia morbida subdurale (ECoG) e registrazione corticale a lungo termine nei minipig
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, presentiamo un metodo per la valutazione delle prestazioni e della sicurezza a lungo termine di array di elettrodi subdurali morbidi in un modello di minipig, descrivendo il metodo e gli strumenti chirurgici, la risonanza magnetica postoperatoria, l'elettrofisiologia della corteccia uditiva, le proprietà elettrochimiche dell'impianto e l'immunochimica post-mortem.
Abstract
I disturbi e le malattie neurologiche possono essere diagnosticati o trattati utilizzando array di elettrocorticografia (ECoG). Nell'epilessia resistente ai farmaci, questi aiutano a delineare la regione epilettica da resecare. In applicazioni a lungo termine come le interfacce cervello-computer, questi elettrodi epicorticali vengono utilizzati per registrare l'intenzione di movimento del cervello, per controllare gli arti robotici di pazienti paralizzati. Tuttavia, le attuali griglie di elettrodi rigidi non rispondono alla necessità di registrazioni cerebrali ad alta risoluzione e di biointegrazione a lungo termine. Recentemente, sono stati proposti array di elettrodi conformabili per ottenere una stabilità dell'impianto a lungo termine con prestazioni elevate. Tuttavia, sono necessari studi preclinici per queste nuove tecnologie implantari per convalidare la loro funzionalità a lungo termine e il profilo di sicurezza per la loro traduzione su pazienti umani. In questo contesto, i modelli suini sono abitualmente impiegati nello sviluppo di dispositivi medici grazie alle loro grandi dimensioni degli organi e alla facilità di gestione degli animali. Tuttavia, solo poche applicazioni cerebrali sono descritte in letteratura, per lo più a causa di limitazioni chirurgiche e dell'integrazione del sistema implantare su un animale vivo.
Qui, riportiamo il metodo per l'impianto a lungo termine (6 mesi) e la valutazione degli array morbidi di ECoG nel modello minipig. Lo studio presenta in primo luogo il sistema implantare, costituito da un array di elettrodi microfabbricati morbidi integrati con una porta transdermica polimerica compatibile con la risonanza magnetica (MRI) che ospita i connettori della strumentazione per le registrazioni elettrofisiologiche. Quindi, lo studio descrive la procedura chirurgica, dall'impianto subdurale al recupero dell'animale. Ci concentriamo sulla corteccia uditiva come esempio di area bersaglio in cui i potenziali evocati sono indotti dalla stimolazione acustica. Descriviamo infine una sequenza di acquisizione dati che include la risonanza magnetica dell'intero cervello, la caratterizzazione elettrochimica dell'impianto, l'elettrofisiologia intraoperatoria e in movimento libero e la colorazione immunoistochimica dei cervelli estratti.
Questo modello può essere utilizzato per studiare la sicurezza e la funzione di un nuovo design di protesi corticali; Studio preclinico obbligatorio per prevedere la traduzione su pazienti umani.
Introduzione
I disturbi e le malattie neurologiche possono essere diagnosticati o trattati utilizzando array di elettrocorticografia (ECoG). Queste griglie di elettrodi sono impiantate sulla superficie del cervello e consentono la registrazione o la stimolazione della corteccia umana1. Nel caso dell'epilessia resistente ai farmaci, ad esempio, aiutano a delineare la regione epilettica da resecare2. In applicazioni a lungo termine come le interfacce cervello-computer, questi elettrodi epicorticali vengono utilizzati per registrare l'intenzione di movimento del cervello, per controllare gli arti robotici di pazienti paralizzati3. Tuttavia, le attuali griglie di elettrodi sono costituite da blocchi metallici rigidi incorporati in substrati polimerici rigidi e non rispondono alla necessità di registrazioni cerebrali ad alta risoluzione e di biointegrazione subdurale a lungo termine (>30 giorni). Piuttosto, creano reazioni tissutali locali che portano all'incapsulamento fibrotico del dispositivo impiantato, portando a prestazioni peggiori nel tempo. Recentemente, sono stati proposti array di elettrodi flessibili o estensibili che utilizzano substrati polimerici sottili prodotti con tecniche di microfabbricazione per ottenere elevate prestazioni in impianti a lungo termine limitando la reazione tissutale 4,5. Tuttavia, sono necessari studi preclinici per queste nuove tecnologie implantari per convalidarne la funzionalità a lungo termine e il profilo di sicurezza, in modo da poter prevedere la traslazione su pazienti umani. In questo contesto, i modelli di minipig e suini sono abitualmente impiegati nello sviluppo di dispositivi in altri contesti medici (ad esempio, il sistema cardiovascolare, scheletrico o gastrico) a causa delle loro grandi dimensioni degli organi e della facile gestione degli animali 6,7,8. Tuttavia, solo poche applicazioni mirate al cervello per la neurofisiologia sono descritte in letteratura, principalmente a causa delle limitazioni dell'approccio chirurgico e dell'integrazione del sistema implantare su un animale vivente 9,10,11,12. Questi spesso non sono compatibili con l'impianto cronico in animali vivi, in quanto richiederebbero, ad esempio, lo sviluppo di hardware complessi come l'elettronica incorporata impiantabile. Inoltre, non studiano l'influenza del sistema implantare sul tessuto bersaglio, che è cruciale per l'aspetto della biosicurezza negli studi traslazionali. Il modello suino è vicino all'anatomia umana in termini di struttura corticale, osso del cranio e spessore della pelle13. Inoltre, la loro capacità di apprendere compiti comportamentali li rende un potente modello per lo studio di strategie di riabilitazione funzionale o percezioni sensoriali14.
La traslazione delle nuove tecnologie e terapie all'uomo richiede la valutazione della sicurezza e dell'efficacia, come richiesto dalle autorità mediche competenti. Questi sono solitamente descritti nei documenti tecnici e nelle norme15, tuttavia richiedono solo il superamento di questi test e non indagano l'effetto effettivo dell'impianto del dispositivo o la raccolta di altri dati utili in parallelo allo studio di sicurezza. Per uno studio completo sulla biosicurezza e sulle prestazioni del cervello, presentiamo qui una raccolta longitudinale e sistematica di dati di imaging cerebrale, misurazioni elettrofisiologiche, valutazione delle proprietà elettrochimiche degli elettrodi impiantati e istologia post-mortem in un modello suino. Per raggiungere questo obiettivo, è necessario considerare diversi aspetti, al fine di creare un modello sperimentale completo: (i) accesso chirurgico minimamente invasivo per l'impianto del dispositivo insieme a una porta transdermica meccanicamente stabile per il collegamento agli elettrodi, (ii) un robusto paradigma di registrazione elettrofisiologica che funge da output prestazionale per gli elettrodi impiantati sia in anestesia che in condizioni di movimento libero, (iii) imaging in vivo (tomografia computerizzata [TC] e/o risonanza magnetica [MRI]) in diversi momenti temporali per seguire l'evoluzione del cervello e dell'impianto, nonché la compatibilità del sistema impiantato con l'apparecchiatura di imaging, e (iv) una pipeline di preparazione dei tessuti per estrarre il cervello per l'analisi istologica.
In questo articolo, riportiamo il metodo per l'impianto a lungo termine (6 mesi) e la valutazione degli array di ECoG morbidi nel modello minipig (mostrato schematicamente nella Figura 1). Gli array di elettrodi morbidi sono stati presentati nei nostri precedenti rapporti e sono costituiti da sottili membrane siliconiche che incorporano film sottili elastici d'oro utilizzati come piste elettriche16,17. Il contatto con il tessuto avviene attraverso una miscela di nanoparticelle di platino incorporate in una matrice siliconica per un'interfaccia elettrochimica morbida ed efficiente con il tessuto cerebrale18. Gli impianti sono collegati attraverso un cavo flessibile incanalato subduralmente attraverso il cranio e la pelle a una porta transdermica che ospita i connettori sulla testa dell'animale. Le dimensioni e la forma dell'impianto possono essere personalizzate in base al target e alle esigenze dello studio. Le attuali strisce di elettrodi in questo studio rispecchiano le dimensioni reali delle strisce cliniche. Le strisce e le griglie subdurali clinicamente disponibili sono state utilizzate come comparatori utilizzando lo stesso approccio. La porta transdermica polimerica compatibile con la risonanza magnetica viene posizionata sul cranio utilizzando un sistema di pedane che la ancorano saldamente al cranio. Qui descriviamo in dettaglio la procedura chirurgica, dall'impianto subdurale di entrambi gli emisferi al recupero dell'animale. Ci concentriamo sulla corteccia uditiva come area bersaglio di esempio, dove i potenziali evocati sono indotti dalla stimolazione acustica sia in condizioni anestetizzate che in movimento libero. In diversi momenti, il cervello dell'animale viene sottoposto a risonanza magnetica (o TC per gli elettrodi clinici) sotto anestesia e vengono misurate le proprietà elettrochimiche degli elettrodi. I metodi di caratterizzazione degli elettrodi sono utilizzati per seguire l'evoluzione dell'impianto e dell'interfaccia elettrodo-tessuto (vedi Schiavone et al.19 per maggiori dettagli). Questi includono la cronoamperometria per sondare le capacità di stimolazione del contatto dell'elettrodo, la spettroscopia di impedenza elettrochimica (EIS) che può indicare l'evoluzione dei componenti resistivi e capacitivi dell'elettrodo e le misurazioni della resistenza intercanale per sondare i guasti di incapsulamento ermetico. Infine, abbiamo sviluppato una pipeline di estrazione dei tessuti per perfondere il cervello dopo l'eutanasia, espiantarlo con gli elettrodi in posizione, sezionarlo ed eseguire analisi istologiche utilizzando diversi marcatori di infiammazione. Nel complesso, questo metodo consentirà studi preclinici con una robusta raccolta di dati multimodali per la futura traduzione clinica di nuove tecnologie e terapie sul cervello.
Protocollo
Le procedure chirurgiche e comportamentali sono state approvate dal comitato etico locale in conformità con le linee guida per la cura e l'uso degli animali da laboratorio e approvate dalle autorità veterinarie locali (Cantone di Ginevra) e federali (Svizzera) con numero di autorizzazione GE11120A. In questo studio sono state utilizzate femmine di maialini di Göttingen (n = 7) di 2-6 mesi di età (5-8 kg).
1. Pianificazione prechirurgica
- Caratterizzazione in vitro del sistema implantare morbido
- Cronoamperometria: Registrare la caduta di tensione all'iniezione di un'evoluzione dell'impulso di corrente bifasica (cioè il transitorio di tensione [VT]) utilizzando un oscilloscopio collegato in parallelo a un generatore di impulsi. Collegare il generatore di impulsi in sequenza a ciascun elettrodo e a un contatore di platino in soluzione salina (soluzione salina tamponata con fosfato [PBS] 1x). Fare riferimento al passaggio 3.1 per le impostazioni.
- Spettrogramma di impedenza elettrochimica: misura l'impedenza elettrochimica a diverse frequenze utilizzando un potenziometro. Collegare il potenziometro in sequenza a ciascun elettrodo utilizzando il contatore di platino e un elettrodo di riferimento Ag/AgCl in soluzione salina (PBS 1x). Fare riferimento al passaggio 3.2 per le impostazioni.
- Resistenza intercanale: nello stato a secco, misurare la resistenza in corrente continua (CC) tra canali adiacenti utilizzando un multimetro portatile.
- Selezione dell'impianto: Dopo le tre misurazioni sopra citate, selezionare l'impianto con i seguenti criteri: impedenza a 1 kHz inferiore a 100 kΩ e nessuna resistenza intercanale inferiore a 1 MΩ.
- Sterilizzazione
- Sterilizzazione dell'impianto: Posizionare gli impianti selezionati singolarmente in sacchetti di sterilizzazione insieme a un marcatore di sterilizzazione e sigillarli. Utilizzare un doppio imballaggio per garantire la sterilità durante l'intervento chirurgico.
NOTA: In questo caso, viene utilizzata la sterilizzazione con gas a perossido di idrogeno (H 2 O2) a causa del breve ciclo di tempo e della bassa temperatura (55 °C). Le alternative sono il gas di ossido di etilene (ETO) o la sterilizzazione in autoclave, ma deve essere garantita la compatibilità con il sistema implantare. - Sterilizzazione degli strumenti: Mettere gli strumenti puliti in doppi sacchetti di sterilizzazione o scatole sterili per strumenti insieme ai marcatori di sterilizzazione. La sterilizzazione in autoclave è più comune per gli strumenti, ma H 2 O2o ETO sono possibili alternative.
- Sterilizzazione dell'impianto: Posizionare gli impianti selezionati singolarmente in sacchetti di sterilizzazione insieme a un marcatore di sterilizzazione e sigillarli. Utilizzare un doppio imballaggio per garantire la sterilità durante l'intervento chirurgico.
2. Impianto chirurgico di matrici morbide di ECoG
- Anestesia
- Premedicazione: Isolare l'animale e digiunarlo durante la notte. Iniettare una miscela di midazolam a 0,75 mg/kg, atropina a 0,25 μg/kg e haldol a 0,1 mg/kg per via intradermica e attendere che l'animale sia sedato. Pesare l'animale prima di procedere.
- Installazione dell'elettrocatetere endovenoso (IV):
- Posizionare l'animale sul tavolo operatorio su un termoforo. Indurre l'anestesia posizionando una maschera facciale sull'animale, utilizzando sevoflurano al 3%-3,5%.
- Posizionare gli elettrocardiogrammi sull'addome, un sensore di saturazione del sangue sulla coda e un sensore di temperatura nella narice.
- Posizionare un elettrocatetere endovenoso su una vena dell'orecchio e confermare l'accesso al sangue utilizzando una siringa riempita di soluzione fisiologica. Assicurati che gli occhi siano mantenuti idratati usando un unguento.
- Intubazione: iniettare un bolo di atracurio a 0,5 mg/kg, ketamina a 1 mg/kg e fentanil a 1-2 μg/kg. Posizionare l'animale sulla schiena per l'intubazione. Inserire un tubo da 4,5 mm.
- Farmaci: Dopo l'intubazione, interrompere l'anestesia con sevoflurano e installare un'infusione di propofol a 10 mg/kg/h, fentanil a 2 μg/kg/h, atracurio a 0,2-0,5 mg/kg/h e soluzione fisiologica a 4-7 mg/kg/h. Iniziare un'infusione di mannitolo a 1 g/kg/h per ridurre il gonfiore cerebrale durante l'intervento.
NOTA: Un regime di analgesia multimodale può essere utilizzato se raccomandato dal comitato etico animale locale.
- Radiografia preoperatoria
- Posiziona l'animale sull'addome nella posizione della sfinge. Rimuovere temporaneamente qualsiasi oggetto metallico in prossimità del cervello e del cranio dell'animale (ad esempio, piombo della temperatura nella narice).
- Acquisire una radiografia del piano assiale e sagittale con un contrasto dell'osso. Posizionare un oggetto metallico di dimensioni note nel campo di acquisizione sagittale che funga da scala per misurare lo spessore del cranio nella parte anteriore e posteriore del cervello.
- Identificare la posizione dei seni frontali (visibili dai vuoti sotto il cranio) e segnare la posizione più posteriore sulla testa dell'animale utilizzando un pennarello indelebile. Questo indicherà il punto più lontano in cui è possibile eseguire qualsiasi craniotomia o posizionamento di viti nell'approccio chirurgico descritto di seguito.
- Campo asettico e preparazione della pelle: radere l'intera superficie della testa oltre il campo operatorio. Usando un tampone sterile, strofinare accuratamente la testa con betadine. Successivamente, posizionare teli sterili sul tavolo della strumentazione e sull'animale per rivelare solo la finestra chirurgica. Infine, strofinare nuovamente la testa con un tampone sterile utilizzando betadine.
- Craniotomia e durotomia
- Taglio della pelle: incidi la pelle con un bisturi lungo la linea mediana. Separare il muscolo e il periostio (25 mm lateralmente dal bregma su entrambi i lati e 40 mm anteriormente e posteriormente al bregma) dall'osso utilizzando un raspatore e posizionare i divaricatori per ottenere un accesso ottimale per la successiva perforazione.
- Misurazioni e marcatura: Identificare bregma e lambda e contrassegnarli con una penna chirurgica sterile (Figura 2A, B). Utilizzando un righello sterile, definire il contorno del lembo osseo centrato attorno al bersaglio dell'impianto su entrambi gli emisferi. In questo caso specifico, è stata scelta la corteccia uditiva, con coordinate da -5 mm a -15 mm dal bregma e da -4 mm a -20 mm lateralmente. Quindi, regolare la craniotomia in base alle dimensioni dell'impianto e ai punti di riferimento anatomici, limitando la dimensione dell'apertura.
- Craniotomia:
- Utilizzando un trapano per ossa con una punta da taglio rotonda, praticare il contorno della craniotomia, tenendo conto dello spessore del cranio misurato al punto 2.2. Irrigare il punto di perforazione con soluzione salina per evitare il surriscaldamento dell'osso.
- Forare con cura il contorno in modo omogeneo fino a raggiungere la dura madre. Alla prima apertura, finisci di forare il contorno fino a quando non si è assottigliato abbastanza da quasi sfondare. Quindi, utilizzare una spatola piatta (sul lato della linea mediana o sul lato laterale) per staccare il lembo osseo in un unico pezzo, usando il bordo della craniotomia come leva. Se si incontra troppa resistenza, continuare ad assottigliare l'osso.
- Mettere il pezzo di osso in soluzione fisiologica sterile.
- Una volta rimosso il lembo osseo, scheggiare con cautela il bordo della craniotomia, utilizzando un Kerison per evitare che il bordo osseo affilato tagli la dura madre.
- Se si riscontra un sanguinamento eccessivo sulla dura madre o sull'osso, utilizzare rispettivamente Gelfoam o cera ossea. Posizionare un impacco umido (tampone standard in soluzione salina sterile) nella craniotomia e ripetere questo passaggio sull'altro emisfero (Figura 2B).
- Durotomia:
- Utilizzando l'ago di un kit di sutura 6-0, perforare e sollevare con cautela la dura madre all'estremità anteriore o posteriore della craniotomia a metà strada tra il lato mediale e laterale e creare l'inizio di un'incisione con il coltello da taglio.
- Quindi, utilizzando una piccola spatola piatta inserita nello spazio subdurale che funge da base di taglio per proteggere la corteccia, creare una fessura anteroposteriore nella dura madre avanzando contemporaneamente con entrambi gli strumenti. Assicurarsi che la fessura sia leggermente più grande della larghezza dell'impianto (Figura 2C). Se si verifica un'emorragia o un danno in questa fase, coprirlo con schiuma di gel e attendere che si fermi.
NOTA: La traiettoria della fessura deve essere adattata se sono presenti grandi vasi sanguigni nella dura madre per evitare sanguinamento.
- Impianto
- Inserimento del dispositivo:
- Irrigare l'impianto (Figura supplementare 1A) con soluzione fisiologica su entrambi i lati in modo che scivoli più facilmente nello spazio subdurale. Posizionare l'impianto sopra la fessura della dura madre e, con una piccola pinza, inserire subduralmente il dispositivo facendolo scorrere in sequenza su ciascun bordo.
- Tenere con cura l'estremità del piedistallo del dispositivo e avanzare con l'impianto per non creare tensioni che ne impediscano l'inserimento. Quando il bordo del connettore si trova sulla parte superiore della fessura, interrompere l'inserimento.
- Fissare l'impianto: Per fissare l'impianto in posizione, posizionare un ponte in titanio sul cavo dopo il bordo della craniotomia o nelle alette di ancoraggio e fissarlo con una o due viti in titanio utilizzando l'apposito cacciavite (Figura 2D).
- Posizionamento a terra: rimuovere con cautela 1 cm di isolamento dei fili di terra e inserirlo epidurale all'estremità posteriore della craniotomia (o in qualsiasi posizione epidurale lontana dalla corteccia di interesse o dai grandi vasi sanguigni) (filo nella Figura 2E)
- Ripetere i passaggi 2.4.4. e 2.5.1.-2.5.3 sull'emisfero controlaterale.
- Radiografia intraoperatoria per confermare il posizionamento:
- Posizionare un tampone umido (tampone standard in soluzione salina sterile) sul luogo dell'intervento chirurgico per mantenere il tessuto idratato. Successivamente, posiziona un telo chirurgico sterile per coprire la testa dell'animale.
- Eseguire immagini radiografiche piane (assiali e sagittali) per assicurarsi che gli impianti siano ben posizionati e non piegati, utilizzando i marcatori radiografici come indicatori. In caso contrario, rimuovere il telo ed espiantare il dispositivo per inserirlo nuovamente (seguire nuovamente i passaggi 2.4.4. e 2.5.1.-2.5.3).
- Chiusura della dura madre: suturare con cura la dura madre attorno al cavo dell'impianto utilizzando una sutura riassorbibile 3-0 e un piccolo portaaghi. Avvicinare il più possibile i due bordi della dura madre senza strappare la sottile membrana con il filo di sutura (Figura 2D, E).
- Posizionamento del lembo osseo: fissare un ponte in titanio sulla parte anteriore e posteriore di ciascun lembo osseo utilizzando una vite in titanio. Fare attenzione a pianificare il posizionamento dei ponti a Ti rispetto al posizionamento delle gambe della pedana nei passaggi successivi. Avvitare l'estremità dei ponti in titanio al cranio (Figura 2F, G).
- Inserimento del dispositivo:
- Posizionamento del piedistallo e della pedana
- Posizionamento: In questa configurazione, la pedana ha sei gambe con due fori per le viti ciascuna (Figura supplementare 1B). Pianificare il posizionamento della pedana sul cranio per ottimizzare la posizione delle viti (evitare di posizionarle sul bordo della craniotomia o nel muscolo temporale). Salta i fori nelle gambe se non possono essere avvitati.
- Fissaggio della pedana: Avvitare le viti in titanio della pedana finché non è saldamente in posizione (vedere la Figura 2H).
- Posizionamento del piedistallo: rimuovere i ponti in titanio sui cavi di collegamento e capovolgere il piedistallo per atterrare sulla pedana. Avvitare il piedistallo sulla pedana. Verificare che il piedistallo sia saldamente in posizione (Figura 2I).
- Sutura e chiusura
- Pulizia della ferita: pulire lo spazio sottocutaneo da eventuali ossa o altri detriti sciacquando con soluzione fisiologica. Taglia via un po' di pelle intorno ai bordi del piedistallo per creare un bordo arrotondato che segua il cilindro.
- Suture sottocutanee: rimuovere i divaricatori e piegare insieme i lembi cutanei. Crea suture sottocutanee con un filo di sutura 4-0 non riassorbibile, a 3 mm di distanza l'una dall'altra, utilizzando semplici suture interrotte o semplici suture continue. Inizia lontano dal piedistallo, muovendoti verso di esso su entrambi i lati dell'incisione.
- Suture dermiche: suturare la pelle utilizzando un filo di sutura 6-0 non riassorbibile, con punti di sutura distanti 5 mm. Inizia lontano dal piedistallo, muovendoti verso di esso su entrambi i lati dell'incisione. Fare attenzione a ottenere una buona apposizione del tessuto tra i due lembi cutanei e vicino al bordo del piedistallo per evitare un vuoto (Figura 2J).
- Medicazione della ferita: pulire nuovamente l'area della ferita con un tampone sterile e betadine. Applicare una benda sterile autoadesiva sulla ferita.
- Misurazioni in vivo: Per le misurazioni in vivo , seguire le sezioni 3, 4 e 5.
- Risveglio: Dopo aver eseguito tutte le misurazioni, togliere all'animale tutti gli anestetici ma tenerlo sotto ventilazione. Per l'analgesia, applicare un cerotto a base di buprenorfina (25 mg/h) per 24 ore. Posiziona l'animale su un termoforo coperto da tende per accelerare l'orario di sveglia. Quando viene recuperata la respirazione spontanea, estubare l'animale e metterlo sotto una maschera facciale di ossigeno fino a quando non viene ripreso conoscenza (che può richiedere da 1 a 4 ore).
- Cura dell'animale dopo l'intervento: per 5 giorni, tenere l'animale sotto stretta sorveglianza. Somministrare una dose di cefalexina alla dose di 75 mg due volte al giorno con il cibo, separatamente dagli altri animali. Effettuare quotidianamente la disinfezione della ferita applicando abbondanti quantità di betadine con tamponi sterili imbevuti (meglio durante l'alimentazione).
NOTA: Assistenza a lungo termine e stabulazione: l'animale operato viene tenuto isolato per 24 ore. Viene reinserito nel suo gruppo sociale originario se l'animale sta abbastanza bene da interagire socialmente con i suoi simili. È necessario condurre un'osservazione quotidiana del piedistallo e dell'apertura della pelle per seguire l'integrazione del dispositivo sulla testa. Quando appropriato, pulire la posizione intorno al piedistallo con abbondanti quantità di betadine.
3. Caratterizzazione in vivo dell'impianto soft
- Cronoamperometria: Registra la caduta di tensione all'iniezione di un'evoluzione dell'impulso di corrente bifasica (cioè il VT) utilizzando un oscilloscopio collegato in parallelo a un generatore di impulsi. Collegare il generatore di impulsi in sequenza a ciascun elettrodo e al filo di terra. Eseguire l'impulso di stimolazione a 100 μA con un'ampiezza dell'impulso di 300 μs a 100 Hz.
- Spettroscopia di impedenza elettrochimica: misura l'impedenza elettrochimica a diverse frequenze utilizzando un potenziometro. Collegare il generatore di impulsi in sequenza a ciascun elettrodo, utilizzando il filo di terra sia come controelettrodo che come massa. Impostare la tensione di eccitazione a 200 mV e l'intervallo di frequenza da 1 Hz a 1 MHz, con tre punti per decennio.
- Brevi misurazioni intercanale: misurare la resistenza CC tra canali adiacenti utilizzando un multimetro portatile. In vivo, la resistenza c.c. intercanale viene misurata solo per verificare che non si verifichino carenze inferiori a 1 kΩ, indicando un fallimento totale dell'incapsulamento.
4. Registrazione elettrofisiologica
- Attività spontanea: collegare il sistema di registrazione wireless attraverso il piedistallo e registrare l'attività di base per 2-3 minuti. Queste registrazioni serviranno come controllo per analizzare i potenziali evocati uditivi.
- Potenziali evocati uditivi: oltre al sistema wireless, inserire gli altoparlanti in un campo chiuso nelle orecchie degli animali. Riproduci la stimolazione acustica a raffica di toni a diverse frequenze (comprese tra 200 e 20.000 Hz) a un livello di pressione sonora (SPL) di circa 70 dB su 120 ripetizioni. Quindi, calcola la media delle registrazioni e allineale sul periodo di stimolo per l'analisi.
- Potenziali evocati sensoriali: Posizionare gli aghi nel muso in tre posizioni diverse. Evocare potenziali sensoriali stimolando il muso per ~30 s con il generatore di impulsi a diverse ampiezze per ottenere le curve di reclutamento.
5. Imaging in vivo
- Trasporto dell'animale: Tenere l'animale sotto anestesia con propofol, come descritto al punto 2.1. Utilizzare un carrello di trasporto che ospita un ventilatore, una pompa a siringa e un monitor dei segni vitali per trasportare l'animale dalla sala operatoria alle strutture di imaging e viceversa.
- Tomografia computerizzata a raggi X: posizionare l'animale sul tavolo dello scanner e rimuovere qualsiasi oggetto metallico intorno alla testa (ad es. il sensore di temperatura). Acquisisci una TAC alla risoluzione più piccola (0,4 mm di spessore della fetta) utilizzando l'acquisizione isometrica con selezione automatica di corrente e tensione per il contrasto osseo.
- Risonanza magnetica: rimuovere tutte le apparecchiature contenenti metallo dall'animale (utilizzare elettrocateteri per flebo e tubo di intubazione compatibili con la risonanza magnetica). Mantenere l'animale ventilato e anestetizzato sotto sevoflurano al 3%-3,5%, utilizzando un ventilatore situato all'esterno della camera di risonanza magnetica e collegato all'animale attraverso un lungo tubo. Prima della prima sequenza, iniettare un bolo di fentanil a 1-2 μg/kg. Utilizzare tre sequenze isometriche alla risoluzione più piccola: sequenze pesate in T1, T2 e turbo spin echo (TSE) (parametri mostrati nel file supplementare 1).
6. Registrazione in movimento libero
- Seguire la stessa procedura descritta nel paragrafo 4 per registrare i segnali di veglia provenienti dal cervello. Collega l'headstage wireless tenendo l'animale tra le braccia dello sperimentatore o nutrendolo con dolcetti per distrarlo. Fornire la stimolazione acustica utilizzando altoparlanti esterni posti vicino all'animale.
7. Perfusione e preparazione dei tessuti
- FACOLTATIVO: Se l'animale non è già sotto anestesia, seguire il passaggio 2.1 per il protocollo di anestesia.
- Inserimento di un catetere nell'arteria carotide per la perfusione (Figura 2 supplementare)
- Dissezione dell'arteria carotide e della vena giugulare: tagliare la gola sulla linea mediana utilizzando un cauterizzatore/taglierino. Tagliare prima la pelle e poi il muscolo seguendo la linea bianca centrale (senza vasi sotto) (Figura supplementare 2A).
- Aprire ulteriormente, usando le dita per fare spazio intorno alla trachea e sotto il muscolo. Cerca l'arteria carotide (battente e rosata); A volte anche il nervo vagale è intorno (bianco) e la vena giugulare può essere sotto o di lato (rossa). Posizionare gli spandiconcime (vedere la Figura 2B supplementare).
- Iniziare la dissezione dell'arteria carotide utilizzando pinze sottili e forbici rotonde. Usa le forbici per aprire il tessuto congiuntivo. Se non ci sono vasi sanguigni, tagliare; se ci sono vasi sanguigni, cauterizzare e andare avanti (Figura supplementare 2C, D). Una volta sezionata a sufficienza, utilizzare una pinza per passare sotto l'arteria carotide in modo che sia completamente isolata (Figura 2E supplementare).
- Ripetere la stessa operazione con la vena giugulare (Figura 2F supplementare).
- Quando entrambi i vasi sono completamente sezionati e isolati, posizionare il filo di sutura attorno ad essi. Non chiuderli ancora. Due punti di sutura intorno alla carotide, uno alla base (sutura 1-lato cuore per la perfusione cerebrale) e uno sull'altro lato (sutura 2), sono mostrati nella Figura 2G supplementare.
- Posizionare una sutura attorno alla vena giugulare (sutura 3), non chiusa; Contrassegnare i fili con del nastro adesivo per sezionare la vena in un secondo momento.
- Chiudere la sutura 1 molto saldamente, altrimenti sanguinerà (Figura supplementare 2H). Fai tre nodi. Posiziona un morsetto sul filo per mettere peso e creare tensione nell'arteria carotide.
- Clamp l'arteria carotide utilizzando una pinza vascolare sul lato opposto della dissezione dell'arteria carotide (lato cervello per la perfusione cerebrale; Figura 2I supplementare). La sutura 2 è al centro, non ancora chiusa.
- Usa una pinza nera per afferrare e tirare l'arteria carotide. Usando delle forbici sottili, sezionare metà dell'arteria carotide vicino alla base della dissezione (vicino alla sutura 1, lato cuore; vedere la Figura 2J supplementare). Assicurarsi che la sezione sia il più ordinata possibile e raggiunga l'imbarcazione stessa, non solo la "guaina"; in caso contrario, il catetere non passerà. Inserire il catetere come mostrato nella Figura supplementare 2K.
- Sciacquare e riempire il catetere, prima con PBS, in modo che non rimanga aria nel catetere (riquadro della Figura 2K supplementare ).
- Chiudere la sutura 2 con sufficiente fermezza in modo che non scompaia, ma non troppo in modo che il catetere possa ancora muoversi un po' (Figura supplementare 2L). Quindi, rimuovere il morsetto vascolare, completare l'inserimento del catetere il più possibile e finalizzare la chiusura della sutura 2 (chiudere saldamente).
- Se lo si desidera, utilizzare i fili di sutura in corrispondenza della sutura 1 per fissare la base del catetere alla pelle all'uscita della ferita come ulteriore misura di sicurezza. Quindi, trasferisci l'animale nella zona di perfusione e collegalo al PBS/eparina. Quando inizia la perfusione, tirare la sutura 3 e tagliare la vena giugulare
- Eutanasia: somministrare pentobarbital (90 mg/kg) per via endovenosa e lavare la linea con soluzione fisiologica per garantire che l'intera dose venga somministrata con successo.
- Perfusione: Utilizzando una pompa di perfusione (200 mL/min) collegare il catetere carotideo al PBS/eparina (1 L per un suino di 15 kg) e poi al PBS contenente il 4% di paraformaldeide (PFA) (5 L per un suino di 15 kg). Quando inizia la perfusione, tirare la sutura 3 e tagliare la vena giugulare.
- Raccolta di tessuti
- Decapitazione: Terminata la perfusione, staccare la testa dell'animale dal corpo con un bisturi, tagliando la pelle e il muscolo e inserendo la lama tra la prima e la seconda vertebra.
- Postfissazione: immergere la testa in PFA al 4% in PBS per altre 48 ore a 4 °C e poi trasferire in PBS prima dell'estrazione cerebrale.
- Estrazione del cervello e dell'impianto:
- Rimuovere la pelle con un bisturi e iniziare a tagliare con cura l'osso utilizzando un rongeur partendo dalle prime vertebre, seguendo il midollo spinale fino al cervelletto. Una volta che il cervelletto è esposto, rimuovere con cura le ossa temporali ed esporre i lobi parietali e frontali.
- A questo punto, svitare il piedistallo dalla pedana e tagliare i piedini della pedana con una pinza. Rimuovere l'osso vicino all'ingresso del cavo nel cranio per liberare il sistema implantare dall'osso, senza estrarre gli impianti dall'uscita della dura madre.
- Se i cavi dell'impianto sono incorporati nell'osso, tagliare il cavo il più vicino possibile all'uscita. Una volta che la superficie cerebrale è sufficientemente esposta, taglia con cura la dura seguendo la linea mediana usando piccole forbici.
- Liberare i cavi dell'impianto dall'uscita della dura madre. Scatta fotografie dal posizionamento dell'impianto sul cervello. Quindi, usa un cucchiaino per staccare il cervello dai nervi cranici sottostanti. Estrai con cura il cervello. Rimuovere gli impianti dal cervello.
- Postfissazione del cervello: A seconda della qualità della perfusione, postfissare nuovamente il cervello estratto per 24 ore in PFA al 4% in PBS a 4 °C. Tenere in PBS 0,1 M a 4 °C fino a quando il cervello non viene tagliato.
- Taglio del cervello: separare i due emisferi usando una lametta da barba. Quindi, taglia il cervello ortogonalmente in quattro pezzi diversi. Tagliare a metà la zona impiantata per ottenere due blocchi contenenti la zona impiantata e un'area di controllo. Conservare gli altri due blocchi se sono necessari più vetrini di controllo.
- Crioprotezione cerebrale e congelamento: trasferire i blocchi cerebrali in una soluzione di saccarosio prima al 15% e poi al 30% di saccarosio a 4 °C fino a quando il cervello si immerge e raggiunge l'equilibrio. Quindi, congelare il tessuto in isopentano a -55 °C in un sistema di congelamento dei tessuti.
8. Istologia
- Sezionamento dei tessuti
- Criostato: Posizionare il cervello congelato in un criostato e tagliare fino a ottenere sezioni complete. Quindi, tagliare il cervello in sezioni di 40 μm e immergerlo in gruppi di tre in PBS da 0,1 M in piastre a pozzetti. Annotare attentamente l'ordine delle piastre.
- Selezione delle sezioni: selezionare le sezioni in base alla zona da analizzare (regione impiantata o zona di controllo). Estrarre le sezioni in sequenza dalle piastre dei pozzetti, utilizzando una spazzola fine per ispezionarle per verificare che non siano danneggiate. Metterli in nuove piastre a pozzetti riempite con PBS da 0,1 M per un'ulteriore colorazione.
- Immunoistochimica
- Preparazione: Incubare le sezioni in Triton X/PBS allo 0,3% per 15 minuti, seguito da albumina sierica bovina (BSA)/PBS al 3% per 1 ora a temperatura ambiente (RT).
- Anticorpi primari: incubare i tessuti con anticorpi primari per 48 ore a RT (anti-GFAP, ratto, diluito a 1/300; anti Iba1, coniglio, diluito a 1/400; anti-NeuN, cavia, diluito a 1/1.000; tutti in BSA/PBS all'1%). Coprire le piastre del pozzetto con un foglio di alluminio.
- Lavaggio: Lavare i pozzetti con PBS 0,1 M tre volte per 5 min.
- Anticorpi secondari: incubare i tessuti con anticorpi secondari per 2 ore a RT (Alexa Fluor 488, Alexa Fluor 647, Alexa Fluor 555; tutti diluiti a 1/400 in 1% BSA/PBS).
- DAPI (4′,6-diamidino-2-fenilindolo): Incubare i tessuti con DAPI per 15 minuti (1/1.000 in 1% BSA/PBS).
- Lavaggio: lavare i pozzetti con PBS 0,1 M cinque volte per 15 min.
- Montaggio: Montare le guide utilizzando un supporto di montaggio e un vetrino coprioggetti. Conservare i vetrini al buio in frigorifero a 4 °C.
- Imaging
- Imaging dell'intero vetrino: Immagine dei vetrini con un ingrandimento 10x (valore della distanza di lavoro oggettiva = 3.100 μm) utilizzando un microscopio scanner per vetrini a tre diverse lunghezze d'onda (640 nm, 560 nm, 485 nm). Tutte le informazioni sulla potenza e sul guadagno sono disponibili nel file supplementare 2.
- Imaging microscopico: Immagine della regione di interesse con un ingrandimento di 20x (apocromatico 20x/0,8 M27) utilizzando un microscopio confocale a quattro lunghezze d'onda (Alexa Fluor 647, DAPI, Cy3, EGFP). Tutte le informazioni sulla potenza e sul guadagno sono disponibili nel file supplementare 3.
Risultati
Al fine di confermare il posizionamento (Figura 3A) e la funzionalità dei dispositivi, le registrazioni elettrofisiologiche vengono eseguite intraoperatoriamente dopo il posizionamento del piedistallo. Il segnale basale viene acquisito per la prima volta nell'arco di 2 minuti senza stimoli come controllo dell'attività basale. In secondo luogo, l'animale viene stimolato acusticamente con un'esplosione di tono a diverse frequenze (500-20.000 Hz) e i dati grezzi vengono mediati durante il periodo di stimolo per mappare i potenziali evocati uditivi attraverso l'array (ad esempio, a 800 Hz rispetto al basale; Figura 3B). I dati mostrati qui non sono elaborati, ma se è presente troppo rumore, è possibile applicare filtri notch e passa-banda. Le tipiche fonti di rumore nella sala operatoria includono piastre riscaldanti, trapani tappati e aspiratori o cauterizzatori (tra gli altri) che devono essere rimossi prima dell'acquisizione. Nelle registrazioni da sveglio, i grandi movimenti muscolari intorno alla testa, come la masticazione, dovrebbero essere evitati per set di dati più puliti.
Questo protocollo è stato applicato in ogni momento di registrazione e i segnali per un singolo canale potevano essere confrontati nel tempo. Un esempio è illustrato nella Figura 3C, che mostra la robustezza e l'evoluzione della risposta. La capacità di registrazione di ciascun contatto nel corso dell'esperimento può essere valutata calcolando la deviazione standard del segnale di base in ogni punto temporale (Figura 3D). In questo studio, il rapporto segnale/rumore è diminuito e si è stabilizzato tra il giorno 0 e il mese 6, nonostante una certa variabilità dovuta alla durata limitata del periodo di registrazione (cioè 2 minuti). Questo può essere ulteriormente correlato alle impedenze degli elettrodi.
L'imaging in vivo viene eseguito nel postoperatorio per valutare lo stato cerebrale e il posizionamento dell'impianto. Nella prima iterazione del protocollo, non è stata eseguita alcuna radiografia intraoperatoria, risultando in un dispositivo piegato, come è visibile nella Figura 4A su una sequenza di risonanza magnetica pesata in T1 (vedere in aggiunta la Figura 4B). Non è stato osservato alcun cambiamento comportamentale nell'animale, ma nel tempo ciò ha provocato un incapsulamento fibrotico intorno al dispositivo a causa della compressione macroscopica del cervello intorno alla posizione dell'impianto (Figura 4C). A seguito di questa esperienza, è stata introdotta la radiografia intraoperatoria, come mostrato nella Figura 4D, dove i marcatori radiopachi (barre nere visibili sull'impianto nel riquadro della Figura 4D) sono ben posizionati. La superficie del cervello è quindi intatta, come si può osservare nella risonanza magnetica postoperatoria nella Figura 4E. Nel complesso, con questo sistema di impianti e piedistalli, è possibile l'imaging dell'intero cervello. Diverse sequenze nei piani coronali permettono di vedere le strutture anatomiche (Figura 4F,G; Sequenze di risonanza magnetica T1 e T2) o la presenza di liquido e sangue intorno all'impianto (Figura 4H; Sequenza di risonanza magnetica pesata per TSE). Il sistema del piedistallo non crea quasi nessun artefatto, ad eccezione di alcuni piccoli vuoti a contrasto nero intorno alle viti in titanio (vedi Figura 4G). Inoltre, gli elettrodi clinici sono utilizzati come comparatori in questo studio, ma non possono essere visualizzati nella risonanza magnetica a causa di problemi di riscaldamento e sicurezza. Pertanto, le scansioni TC vengono acquisite su questi animali, come mostrato nella Figura 4I. Gli elettrodi sono chiaramente visibili e il sistema a piedistallo non influenza la qualità dell'immagine.
Dopo il periodo di impianto, l'animale viene perfuso e il cervello estratto. In questo studio, l'analisi della risposta infiammatoria viene eseguita su ciascun emisfero in modo indipendente. Tagliare il cervello a metà è più facile per la preparazione del tessuto prima del sezionamento e ha il vantaggio che le sezioni possono essere montate su vetrini per microscopia standard. Un esempio di campione di cervello è mostrato prima (Figura 5A) e dopo (Figura 5B) tagliato in blocchi. Il contorno dell'impianto è ben visibile e ha creato una piccola ammaccatura nel cervello. Tagliando su piani paralleli, il tessuto è quindi già allineato al criostato e le sezioni possono essere facilmente tagliate senza perdita di tessuto per il taglio (Figura 5C). Dopo la colorazione, viene visualizzata l'intera sezione di tessuto (Figura 5D), dove ad esempio lo strato neuronale è chiaramente visibile in dettaglio (vedi marcatore NeuN). Intere sezioni sono fragili e a volte possono portare a una certa perdita di tessuto (vedi la parte inferiore della Figura 5D), ma l'area di interesse è intatta. A una visione più ravvicinata, grazie all'imaging al microscopio confocale a 40x, le cellule sono chiaramente definite e consentono, ad esempio, un'indagine fine dei marcatori infiammatori (Figura 5E). È possibile eseguire un'ulteriore analisi quantitativa per confrontare l'infiammazione tra gli emisferi di controllo e quelli impiantati. La Figura 6 mostra la caratterizzazione elettrochimica degli elettrodi impiantati. La spettroscopia di impedenza elettrochimica in vitro dell'array di elettrodi morbidi con modulo di impedenza e fase è mostrata nella Figura 6A e il modulo di impedenza a 1 kHz su 6 mesi di impianto è mostrato nella Figura 6B.
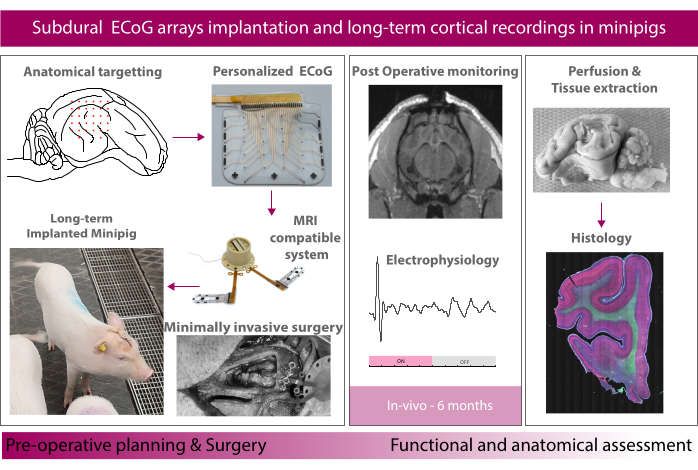
Figura 1: Schema dell'esperimento. Fare clic qui per visualizzare una versione più grande di questa figura.
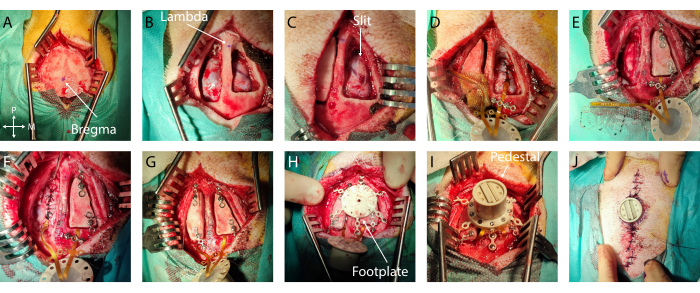
Figura 2: Impianto minimamente invasivo di ECoG molle nel cervello . (A) Accesso chirurgico al cranio, con indicazione di bregma. (B) Craniotomia bilaterale con dura madre visibile. (C) Durotomia a fessura sul primo emisfero. (D) Impianto subdurale di ECoG morbido e chiusura della dura madre. (E) Durotomia a fessura sul secondo emisfero. Fissaggio del lembo osseo sul primo emisfero mediante ponti in titanio. (F) Impianto di ECoG molle sul secondo emisfero e chiusura della dura madre. (G) Fissazione del lembo osseo sul secondo emisfero. (H) Posizionamento della pedana sul cranio. (I) Fissaggio del piedistallo sulla pedana. (J) Chiusura a pelle attorno alla base del piedistallo. Fare clic qui per visualizzare una versione più grande di questa figura.
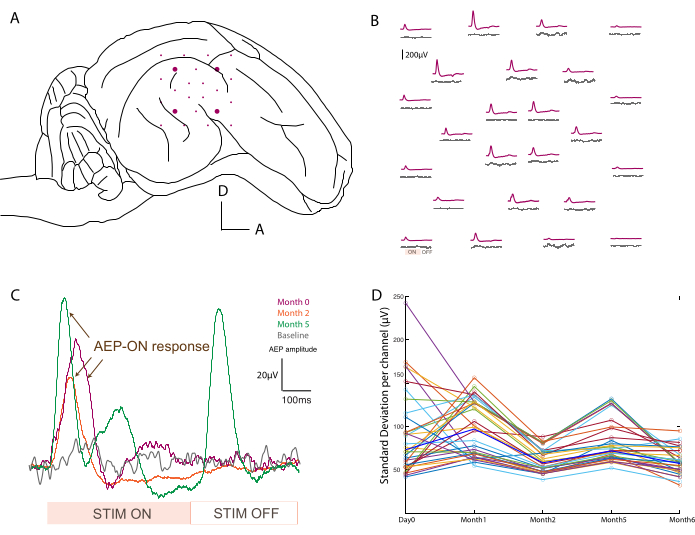
Figura 3: Registrazione dei potenziali evocati uditivi . (A) Schema del posizionamento degli elettrodi sulla superficie del lobo temporale. (B) Mappatura rappresentativa dell'attività basale (tracce grigie) e dei potenziali evocati uditivi in risposta ad una stimolazione a burst di tono a 800 Hz (traccia viola). Ogni media corrisponde a un canale sull'array ECoG soft. La media viene attivata sul segnale di ingresso analogico dalla stimolazione sonora. I periodi di stimolazione acustica "ON" e "OFF" sono annotati su un canale in basso a sinistra. (C) Evoluzione nel tempo (giorno 0, mese 2 e mese 5) della risposta di un singolo canale dopo lo stimolo acustico, rispetto al segnale basale quando non viene presentato alcuno stimolo (grigio). La media viene attivata sul segnale di ingresso analogico dalla stimolazione sonora. I periodi di stimolazione "ON" e "OFF" sono indicati in basso. Il potenziale evocato della stimolazione "ON" è contrassegnato da frecce. (D) Deviazione standard per canale (punti colorati) per punto temporale della registrazione di base. I valori mediani sono rappresentati in grassetto blu. Fare clic qui per visualizzare una versione più grande di questa figura.
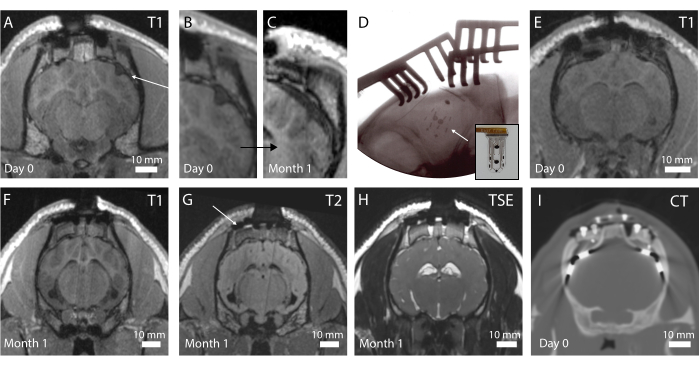
Figura 4: Imaging in vivo del cervello ed elettrodi impiantati . (A) Risonanza magnetica postoperatoria pesata in T1 sul piano coronale. Una freccia indica un impianto piegato. (B) Porzione ingrandita di A, dove il ripiegamento dell'impianto crea un'ammaccatura nel cervello. (C) Risonanza magnetica pesata in T1 all'impianto di 1 mese, che mostra una compressione del cervello dovuta all'incapsulamento fibrotico del cervello nella stessa posizione di C. (D) Radiografia del piano intraoperatorio che verifica il posizionamento dell'impianto e l'assenza di ripiegamento, come osservato dal posizionamento del marcatore radiopaco. Riquadro: Fotografia dell'impianto con marcatore radiopaco visibile. (E) Risonanza magnetica postoperatoria pesata in T1 nel piano coronale con posizionamento ottimale dell'impianto. (F) Risonanza magnetica pesata in T1 a 1 mese di impianto. (G) Risonanza magnetica pesata in T2 all'impianto di 1 mese. Una freccia mostra l'artefatto di imaging delle viti in titanio che tengono in posizione la pedana sul cranio. (H) Risonanza magnetica ponderata TSE a 1 mese di impianto. (I) TAC dell'animale impiantato con gli elettrodi clinici. Fare clic qui per visualizzare una versione più grande di questa figura.
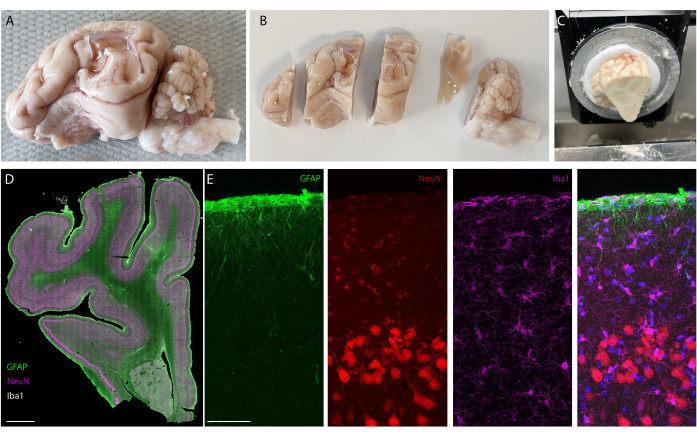
Figura 5: Analisi istologica del cervello dopo l'impianto a lungo termine. (A) Fotografia di un emisfero cerebrale sinistro espiantato e perfuso. (B) Cervello perfuso tagliato in blocchi prima della fase di congelamento. (C) Immagine della configurazione del sezionamento dell'intero blocco sul criostato; L'intero "blocco pretagliato" può essere sezionato. (D) Imaging immunocolorante dell'intero emisfero (scanner a vetrino, obiettivo 20x) e (E) zoom sui primi strati della corteccia (imaging confocale, obiettivo 40x) che mostrano cellule gliali, astrociti e neuroni. Fare clic qui per visualizzare una versione più grande di questa figura.
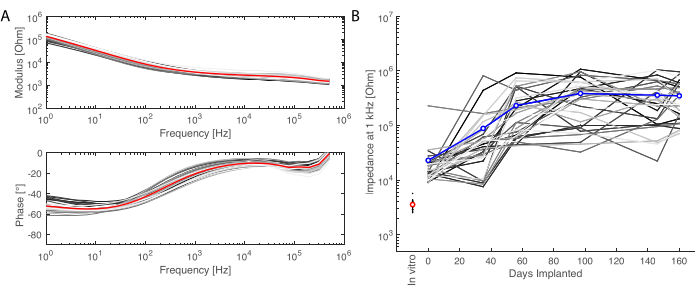
Figura 6: Caratterizzazione elettrochimica degli elettrodi impiantati. (A) Spettroscopia di impedenza elettrochimica in vitro dell'array di elettrodi morbidi (piccole linee grigie per ogni canale, la media in rosso) con modulo di impedenza (in alto) e fase (in basso). (B) Evoluzione del modulo di impedenza a 1 kHz nell'arco di 6 mesi dall'impianto (media in blu; le linee grigie sono i singoli canali; la misurazione in vitro è data come riferimento in rosso). Fare clic qui per visualizzare una versione più grande di questa figura.
Figura 1 supplementare: Piedistallo compatibile con la risonanza magnetica. (A) Sistema di connessione transdermica cronico compatibile con la risonanza magnetica (piedistallo) per accedere all'array di elettrodi morbidi. (B) Piedistallo con elettrodi montati sulla pedana per l'ancoraggio del cranio. Riquadro: Dettagli della pedana. Fare clic qui per scaricare il file.
Figura 2 supplementare: Accesso chirurgico per una perfusione ottimale del cervello. (A) Taglio cutaneo e accesso alla posizione dell'arteria carotide e della vena giugulare. (B) Dissezione del tessuto intorno ai vasi sanguigni. (C,D) Identificazione e dissezione del tessuto intorno all'arteria carotide e alla vena giugulare. (E) Isolamento dell'arteria carotide dal tessuto sottostante. (F) Isolamento della vena giugulare dal tessuto sottostante. (G) Posizionamento del filo di sutura attorno all'arteria carotide (sutura 1 e sutura 2) e alla vena giugulare (sutura 3). (H) Chiusura della sutura 3 alla base dell'arteria carotide (lato cuore) per evitare sanguinamento durante l'apertura del vaso. (I) Bloccaggio dell'arteria carotide sul lato opposto rispetto a H. (J) Sezione dell'arteria carotide. (K) Catetere inserito nell'apertura da J. Inserto: Catetere innescato con soluzione fisiologica lavata da una siringa alla punta del catetere. (L) Chiusura della sutura 2 per mantenere il catetere in posizione e lungo l'arteria. Fare clic qui per scaricare il file.
File supplementare 1: Parametri per le sequenze di risonanza magnetica T1- (pagine 1-2), T2- (pagine (3-4) e ponderate TSE (pagine 5-6), rispettivamente. Fare clic qui per scaricare questo file.
File supplementare 2: Metadati per lo scanner di vetrini per l'imaging di vetrini interi di fette di cervello colorate. Fare clic qui per scaricare il file.
File supplementare 3: Metadati per l'imaging confocale di una sezione ingrandita di fette di cervello colorate. Fare clic qui per scaricare il file.
Discussione
Riportiamo qui un metodo per l'impianto a lungo termine e la valutazione di array soft ECoG. In questo studio, abbiamo progettato un approccio chirurgico coerente e minimamente invasivo per l'impianto bilaterale di griglie di elettrodi funzionali sui lobi temporali (in questo caso, mirando alla corteccia uditiva). In primo luogo abbiamo valutato la funzionalità della griglia registrando con successo i potenziali evocati nel corso dello studio (6 mesi) e monitorando le proprietà elettrochimiche degli elettrodi (vedi Figura 6). In secondo luogo, abbiamo valutato la biosicurezza delle griglie, in vivo utilizzando la risonanza magnetica e stabilendo un sistema completamente compatibile con la risonanza magnetica, e post-mortem progettando un protocollo per la raccolta dei tessuti e l'immunocolorazione.
Per ridurre al minimo l'invasività, abbiamo ottimizzato le dimensioni della finestra craniotomica. Per raggiungere la corteccia uditiva situata sul lobo temporale ed evitare di resecare il muscolo temporale, abbiamo sviluppato una tecnica per far scorrere l'impianto sotto la dura. Questa tecnica permette di ridurre drasticamente la superficie del cervello esposto e di raggiungere comunque bersagli lontani. Sebbene questo tipo di impianto possa sembrare cieco, l'implementazione di marcatori radiopachi sui dispositivi visualizzati nella radiografia del piano intraoperatorio consente di verificare il posizionamento e garantisce che l'array non sia ripiegato sotto la dura madre. Lo scivolamento subdurale si è dimostrato sicuro nella maggior parte delle ripetizioni che abbiamo eseguito. Inoltre, la durotomia in un approccio a fessura riduce al minimo il rigonfiamento cerebrale durante il tempo in cui la craniotomia è aperta e facilita la chiusura intorno all'impianto senza richiedere materiale aggiuntivo come la dura madre artificiale, che potrebbe influenzare la risposta infiammatoria. Infine, il punto di forza di questo approccio chirurgico è la sua capacità di essere trasposto in diverse regioni corticali. Giocare con le coordinate, la posizione della craniotomia e le dimensioni del dispositivo, che possono essere regolate, consente a questo metodo di mirare alla maggior parte dell'area della corteccia.
Il metodo chirurgico qui presentato, insieme alla valutazione funzionale e allo studio della biointegrazione nel tempo, non è limitato alla tecnologia degli elettrodi morbidi utilizzata in questo rapporto. Altri elettrodi subdurali che sono in fase di sviluppo per la traduzione umana potrebbero essere valutati con lo stesso protocollo. La forza di questo metodo si basa sul fatto che la maggior parte dei pezzi, come il cavo e il piedistallo, sono modulari, personalizzabili e possono essere adattati allo specifico dispositivo in prova. Inoltre, le sonde intracorticali o a penetrazione profonda possono anche essere utilizzate al posto o in combinazione con gli elettrodi subdurali, poiché ciò richiede solo la regolazione della geometria della craniotomia e della durotomia. I risultati a lungo termine possono quindi essere confrontati con le loro controparti cliniche, come abbiamo fatto qui.
Uno dei principali limiti del metodo presentato è la presenza di seni cranici nei minipig, che si sviluppano nel corso del primo anno12. A tale riguardo, tra gli aspetti importanti da prendere in considerazione figurano l'età di impianto e anche le dimensioni dell'animale. L'esecuzione di craniotomie nel cranio adulto rompe l'integrità dei seni paranasali e porta a un alto rischio di infezioni gravi in contesti cronici. Tali seni paranasali sono visibili nella radiografia piana e nella TAC preoperatoria. D'altra parte, anche l'esecuzione dell'impianto cronico troppo presto, in un animale troppo piccolo, non è ottimale quando il cranio sta subendo una crescita massiccia e un rimodellamento. Abbiamo ipotizzato che questi "movimenti del cranio" post-operatorio potrebbero causare il movimento e la piegatura dell'impianto, il che alla fine è dannoso per l'esperimento. Abbiamo scoperto qui che i maialini di Gottinga, di circa 5-6 mesi (e 8 kg) al momento dell'impianto, dovrebbero dare i migliori risultati.
Per valutare le prestazioni dell'ECoG impiantato per le registrazioni elettrofisiologiche, abbiamo messo a punto un protocollo rapido per la registrazione del potenziale evocato uditivo (AEP) che può essere utilizzato in animali che si muovono liberamente e sotto sedazione. Consiste nel presentare una serie di esplosioni di tono acustico a frequenze specifiche nel corso di pochi minuti. Il vantaggio di un tale protocollo è il fatto che può essere sintonizzato sulla lunghezza disponibile della registrazione riducendo il numero di frequenze sondate. Una sfida quando si registrano i segnali corticali sotto anestesia è che il livello di coscienza dell'animale deve essere preso in considerazione quando si analizzano e si confrontano i dati.
Il protocollo per la perfusione è stato adattato nel tempo dall'osservazione della qualità del cervello estratto. In effetti, abbiamo trovato più facile cateterizzare solo l'arteria carotide e non la vena giugulare. Inizialmente, la letteratura presenta metodi in cui la vena giugulare viene cateterizzata per drenare i rifiuti20. In pratica, questo limita il flusso fuori dal cervello e porta a una scarsa estrazione del sangue e alla qualità complessiva della perfusione. Tagliando la vena giugulare e lasciando fuoriuscire il liquido in un grande contenitore dove giace l'animale, aumenta l'efficienza della perfusione.
Abbiamo sviluppato un robusto metodo di preparazione dei tessuti che funziona con gli anticorpi utilizzati di routine per il tracciamento dell'infiammazione. Abbiamo separato i due emisferi per motivi pratici, poiché metà del cervello del maiale si adatta ai vetrini da microscopio standard ed è quindi compatibile con la maggior parte delle apparecchiature di imaging disponibili nei laboratori di istologia. Tagliando il cervello in blocchi, l'accesso diretto alla zona di interesse è reso possibile senza richiedere un ulteriore taglio dell'intero cervello o il taglio di ampie parti del tessuto. Le fette di cervello a 40 μm possono essere raggruppate in piastre a pozzetti standard e colorate in modo fluttuante senza importanti modifiche al protocollo da parte delle immunocolorazioni di altre specie. L'immunocolorazione completa del cervello potrebbe anche essere immaginata utilizzando, ad esempio, i metodi CLARITY21.
Nel complesso, questo protocollo, che copre la progettazione personalizzata dell'impianto fino all'impianto, il follow-up della funzionalità e la valutazione della biosicurezza, è solido e coerente. Abbiamo dimostrato qui la sua fattibilità per studiare il sistema uditivo, ma può essere trasposto per testare altre funzioni fisiologiche. Inoltre, la forza del nostro metodo risiede nel fatto che non è limitato ai maialini, ma completamente trasponibile ad altre specie come pecore, capre o primati non umani. In una certa misura, può anche essere facilmente adattato ai ratti.
Divulgazioni
F.F. e S.P.L. sono co-fondatori e azionisti di Neurosoft Bioelectronics SA che sviluppa array di elettrodi morbidi.
Riconoscimenti
Gli autori ringraziano la Fondazione Bertarelli e il CRSII5_183519 di sovvenzioni Sinergia del FNS. Gli autori desiderano inoltre ringraziare Katia Galan dell'EPFL per il suo aiuto nello sviluppo del protocollo di colorazione per l'istologia, il personale della piattaforma di microsistemi neurali del Wyss Center for Bio and Neuroengineering di Ginevra per il loro aiuto nei processi di fabbricazione, il personale della piattaforma di animali nel Centro medico universitario (CMU) dell'Università di Ginevra (UNIGE) per la cura degli animali, l'assistenza chirurgica e la gestione postoperatoria del maialino (John Diaper, Xavier Belin, Fabienne Fontao e Walid Habre), i membri del team del Center for Biomedical Imaging (CIBM) dell'Università di Ginevra (Julien Songeon, François Lazeyras e Rares Salomir), i membri del Dipartimento di Patologia dell'Ospedale Universitario di Ginevra (HUG) (Sami Schranz, Francesca Versili, Ruben Soto e Coraline Egger) e Blaise Yvert dell'Université Grenobles-Alpes per il suo contributo e i suoi scambi sugli esperimenti sui minipig cronici. Gli autori ringraziano i dipendenti di Neurosoft Bioelectronics SA, per il loro aiuto nel processo di fabbricazione e per il loro aiuto negli esperimenti sui maialini (Benoit Huguet e Margaux Roulet).
Materiali
| Name | Company | Catalog Number | Comments |
| Bone drill | BBraun | Elan 4 with GA861 handpiece | |
| Bone drill bit | BBraun | Neurocutter GP204R | |
| Bonewax | Ethicon | W31G | |
| Catheter | Venisystems | Abbocath 14G | |
| Confocal Microscope | Zeiss | LSM 880 | |
| Cryostat | Leica | CM1950 | |
| Gelfoam | Pfizer | Gelfoam | |
| Insert speakers | Etymotic | Etymotic ER2 insert Earphones | |
| Multimeter | Fluke | Fluke 1700 | |
| Oscilloscope | Tektronix | MDO3014 Mixed Domain Oscilloscope | |
| Perfusion pump | Shenzen | LabS3/UD15 | |
| Potentiostat | Gamry Instruments | Reference 600 | |
| Primary Antibody Anti-GFAP | Thermofischer | Anti-GFAP, Rat, # 13-0300 | |
| Primary Antibody Anti-Iba1 | Fujifilm | Anti Iba1, Rabbit, 019-19741 | |
| Primary Antibody Anti-NeuN | SigmaAldrich | Anti-NeuN, GuineaPig, ABN90 | |
| Pulse Generator | AM Systems | Model 2100 Isolated Pulse Stimulator | |
| Recording headstage | Multichannel systems | W2100-HS32 | |
| Recording system | Multichannel systems | W2100 | |
| Screwdriver | Medtronic | Handle: 001201, Shaft: 8001205 | |
| Secondary Antibody 488 | Thermofischer | Goat anti-Rat IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488, # A-11006 | |
| Secondary Antibody 555 | Thermofischer | Goat anti-Guinea Pig IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555, # A-21435 | |
| Secondary Antibody 647 | Thermofischer | Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 647, # A-21245 | |
| Slide Scanner | Olympus | VS120 | |
| Snapfrost | Excilone | Excilone Snapfrost | |
| Stab knife | Fine Science Tools | 10316-14 | |
| Suture wire dermal | Ethicon | Vicryl 2-0 | |
| Suture wire dura mater | Ethicon | Mersilk 5-0 | |
| Suture wire for catheter | Ethicon | Vycril 3-0 without needle | |
| Suture wire for lifting dura | Ethicon | Prolene 6-0 with BV-1 needle | |
| Suture wire subcutaneous | Ethicon | Vicryl 4-0 | |
| Titanium bridge | Medtronic | TiMesh 015-2001-4 | Cut out the required size |
| Titanium screws | Medtronic | 9001635, 9001640 | |
| X-ray system | GE | GE OEC 9800 Plus C-Arm |
Riferimenti
- Ritaccio, A. L., Brunner, P., Schalk, G. Electrical stimulation mapping of the brain: Basic principles and emerging alternatives. Journal of Clinical Neurophysiology. 35 (2), 86-97 (2018).
- Mullin, J. P., Sexton, D., Al-Omar, S., Bingaman, W., Gonzalez-Martinez, J. Outcomes of subdural grid electrode monitoring in the stereoelectroencephalography era. World Neurosurgery. 89, 255-258 (2016).
- Vansteensel, M. J., et al. Fully implanted brain-computer interface in a locked-in patient with ALS. The New England Journal of Medicine. 375 (21), 2060-2066 (2016).
- Lacour, S. P., Courtine, G., Guck, J. Materials and technologies for soft implantable neuroprostheses. Nature Reviews. Materilas. 1, 16063 (2016).
- Fallegger, F., Schiavone, G., Lacour, S. P. Conformable hybrid systems for implantable bioelectronic interfaces. Advanced Materials. 32 (15), 1903904 (2019).
- Pearce, A. I., Richards, R. G., Milz, S., Schneider, E., Pearce, S. G. Animal models for implant biomaterial research in bone: A review. European Cells & Materials. 13, 1-10 (2007).
- Swindle, M. M., Makin, A., Herron, A. J., Clubb, F. J., Frazier, K. S. Swine as models in biomedical research and toxicology testing. Veterinary Pathology. 49 (2), 344-356 (2012).
- Khoshnevis, M., et al. Development of induced glioblastoma by implantation of a human xenograft in Yucatan minipig as a large animal model. Journal of Neuroscience Methods. 282, 61-68 (2017).
- Borton, D., et al. Developing implantable neuroprosthetics: A new model in pig. Annual International Conference of the IEEE Engineering in Medicine & Biology Society. 2011, 3024-3030 (2011).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Gierthmuehlen, M., et al. Evaluation of mECoG electrode arrays in the minipig: Experimental procedure and neurosurgical approach. Journal of Neuroscience Methods. 202 (1), 77-86 (2011).
- Palma, M., et al. Chronic recording of cortical activity underlying vocalization in awake minipigs. Journal of Neuroscience Methods. 366, 109427 (2022).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C. H., Palomero-Gallagher, N. The telencephalon of the Göttingen minipig, cytoarchitecture and cortical surface anatomy. Brain Structure & Function. 222 (5), 2093-2114 (2017).
- Lind, N. M., et al. The use of pigs in neuroscience: Modeling brain disorders. Neuroscience and Biobehavioral Reviews. 31 (5), 728-751 (2007).
- Shepherd, R. K., Villalobos, J., Burns, O., Nayagam, D. A. X. The development of neural stimulators: A review of preclinical safety and efficacy studies. Journal of Neural Engineering. 15 (4), 041004 (2018).
- Schiavone, G., et al. Soft, implantable bioelectronic interfaces for translational research. Advanced Matererials. 32 (17), 1906512 (2020).
- Fallegger, F., et al. MRI-compatible and conformal electrocorticography grids for translational research. Advanced Science. 8 (9), 2003761 (2021).
- Minev, I. R., Wenger, N., Courtine, G., Lacour, S. P. Research update: Platinum-elastomer mesocomposite as neural electrode coating. APL Materials. 3 (1), 014701 (2015).
- Schiavone, G., et al. Guidelines to study and develop soft electrode systems for neural stimulation. Neuron. 108 (2), 238-258 (2020).
- Musigazi, G. U., De Vleeschauwer, S., Sciot, R., Verbeken, E., Depreitere, B. Brain perfusion fixation in male pigs using a safer closed system. Laboratory Animals. 52 (4), 413-417 (2018).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nature Methods. 10 (6), 508-513 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon