Method Article
Modelo post-resección de la recaída del glioblastoma para investigaciones terapéuticas de hidrogel
* Estos autores han contribuido por igual
En este artículo
Resumen
El presente protocolo establece un modelo post-resección de recaída de glioblastoma (GBM) utilizando microscopía para investigar el efecto terapéutico de un hidrogel inyectable y biosensible in vivo.
Resumen
La recidiva tumoral es un factor importante indicativo de un mal pronóstico en el glioblastoma (GBM). Muchos estudios están tratando de identificar estrategias terapéuticas efectivas para prevenir la recurrencia de GBM después de la cirugía. Los hidrogeles terapéuticos biorreactivos capaces de mantener los fármacos liberados localmente se utilizan con frecuencia para el tratamiento local de la GBM después de la cirugía. Sin embargo, la investigación es limitada debido a la falta de un modelo adecuado de recaída de GBM después de la resección. Aquí, se desarrolló un modelo de recaída de GBM post-resección y se aplicó en investigaciones terapéuticas de hidrogeles. Este modelo se construyó con base en el modelo ortotópico intracraneal de GBM, que es ampliamente utilizado en estudios sobre GBM. Se realizó una resección subtotal en el ratón modelo GBM intracraneal ortotópico para imitar el tratamiento clínico. El tumor residual se utilizó para indicar el tamaño del crecimiento tumoral. Este modelo es fácil de construir, puede imitar mejor la situación de la resección quirúrgica de GBM y se puede aplicar en varios estudios sobre el tratamiento local de la recaída de GBM después de la resección. Como resultado, el modelo de recaída posresección de GBM proporciona un modelo único de recurrencia de GBM para estudios de tratamiento local eficaces de la recaída después de la resección.
Introducción
El glioblastoma (GBM) es el tumor maligno más frecuente entre todos los cánceres del sistema nervioso central 1,2. La cirugía es el tratamiento de primera línea para los pacientes con GBM, y la quimiorradiación es el principal tratamiento adyuvante después de la cirugía. Sin embargo, la recurrencia tumoral a menudo se desarrolla dentro de los 3-6 meses en la mayoría de los pacientes con GBM con diversos tratamientos 3,4,5. Por lo tanto, existe una necesidad urgente de desarrollar estrategias de tratamiento más efectivas para prevenir la recurrencia del GBM.
Los estudios recientes sobre GBM se han centrado principalmente en los tumores primarios más que en los recurrentes6. Sin embargo, el problema más común que debe resolverse en la clínica es cómo inhibir la recurrencia del GBM después de la cirugía. Por lo tanto, la investigación sobre la recurrencia del GBM después de la cirugía necesita más atención. Los hidrogeles terapéuticos biosensibles son el vector más utilizado en los estudios sobre la recurrencia tumoral después de la cirugía 7,8. Sin embargo, debido a la estructura especial del sistema nervioso central, es difícil desarrollar un modelo adecuado de recaída de GBM post-resección9, que es crítico para el estudio de la recurrencia de GBM.
Este estudio ha generado un modelo mejorado de recaída post-resección basado en el modelo ortotópico intracraneal de GBM utilizado en la investigación sobre GBM primaria. En este modelo, la mayoría de los tumores se extirpan mediante cirugía microscópica y el tumor residual se detecta mediante imágenes bioluminiscentes in vivo y tinción con hematoxilina y eosina (H&E). Este modelo imita el estado de resección de los pacientes con tumores cerebrales y se puede utilizar en varios estudios sobre la recaída de GBM.
Protocolo
Todos los experimentos con animales fueron aprobados y supervisados por la Junta de Revisión Institucional y el Comité de Ética Animal de la Universidad Médica de Nanjing (IACUC-1904004). Para el presente estudio se utilizaron ratones hembra C57BL/6J, de 6-8 semanas de edad. Los animales se obtuvieron de una fuente comercial (ver Tabla de Materiales).
1. Preparación animal
- Pesar a los ratones y anestesiarlos con una inyección intraperitoneal de 50 mg/kg de pentobarbital sódico (ver Tabla de materiales). Administrar meloxicam (5 mg/kg; i.p.) para la analgesia perioperatoria. Aloje a los ratones en una jaula bajo un ciclo de luz/oscuridad de 12 h/12 h, una temperatura ambiente de 24 °C y una humedad relativa del 50%.
NOTA: Para el presente estudio, el peso inicial de los ratones fue de aproximadamente 22 g. - Retire el pelo de la cabeza de un ratón con una máquina de afeitar para animales de laboratorio y fije la cabeza y las extremidades en el aparato estereotáxico (consulte la tabla de materiales).
NOTA: Esterilice todo el equipo antes de usarlo. - Desinfecte la cabeza del ratón con al menos tres rondas alternas de exfoliante de clorhexidina o povidona yodada seguidas de alcohol, y cubra el ratón con un paño quirúrgico estéril. Aplique ungüento oftálmico en ambos ojos para evitar que se sequen.
- Corta el cuero cabelludo del ratón aproximadamente 1 cm a lo largo de la línea media en la parte superior de la frente derecha con unas tijeras oftálmicas.
NOTA: Confirme el plano quirúrgico de la anestesia por la ausencia de reflejo pedal antes de realizar la incisión. - Ajuste el aparato estereotáxico para asegurarse de que la costura en espiga y la punta de la fontanela frontal estén ubicadas al mismo nivel.
2. Construcción del modelo ortotópico intracraneal de GBM
- Marque el punto 1 mm hacia el lado frontal de la fontanela frontal, 1,8 mm hacia el lado derecho de la fontanela frontal y 3 mm hacia abajo desde la fontanela frontal con un hisopo de algodón humedecido con violeta de genciana2 (ver Tabla de materiales).
- Taladre la punta con un mini taladro craneal de 1 mm de diámetro (consulte la Tabla de materiales) para crear un tamaño de poro de aproximadamente 1 mm de diámetro y 1 mm de profundidad.
- Retire el líquido cefalorraquídeo exudado con un hisopo de algodón estéril.
- Aspirar 5 μL de suspensión de células tumorales (GL261-Luci, 5 × 105 células suspendidas en 5 μL de PBS) con una microjeringa.
NOTA: El GL261-Luci se obtuvo de una fuente comercial (ver Tabla de Materiales). - Alinee la punta de la aguja de la microjeringa verticalmente con el orificio de perforación del cráneo, insértelo hasta que la punta de la aguja entre en el plano del cráneo durante 3 mm y devuelva la aguja 0,5 mm7.
- Abra la microjeringa e inyecte a una velocidad de 1 μL/min.
- Conserve la aguja durante 10 minutos después de la inyección.
- Retire la microjeringa lentamente y presione el punto de inyección con una bola de algodón seca estéril.
- Suturar el cuero cabelludo con una sutura quirúrgica no absorbible (10-0, ver Tabla de materiales) y volver a desinfectar la incisión.
- Vigile la salud del animal y manténgalo en condiciones cálidas.
- Mueva el ratón de vuelta a la jaula de la carcasa después de que el ratón se despierte.
- Obtener imágenes del ratón con un sistema de imágenes bioluminiscentes in vivo (ver Tabla de materiales) para detectar el tumor trasplantado en el décimo día después de la portadora del tumor.
NOTA: La luciferasa cargada en las células GBM, GL261, se utilizó para la obtención de imágenes bioluminiscentes.- Anestesiar al ratón con isoflurano al 1,5% con un caudal de oxígeno de 0,6L/min. Después de confirmar la profundidad de la anestesia a través de la falta de reflejo pedal, inyectar al ratón por vía intraperitoneal fluoresceína de potasio (10 mg/mL, ver Tabla de Materiales) y, 11 s después, realizar la obtención de imágenes bioluminiscentes in vivo . Cuando el valor de fluorescencia alcanza ~5 × 105, el procedimiento es exitoso.
NOTA: Anestesiar al animal antes de tomar imágenes. Mantener la anestesia a través del cono de la nariz suministrado con isoflurano vaporizado.
- Anestesiar al ratón con isoflurano al 1,5% con un caudal de oxígeno de 0,6L/min. Después de confirmar la profundidad de la anestesia a través de la falta de reflejo pedal, inyectar al ratón por vía intraperitoneal fluoresceína de potasio (10 mg/mL, ver Tabla de Materiales) y, 11 s después, realizar la obtención de imágenes bioluminiscentes in vivo . Cuando el valor de fluorescencia alcanza ~5 × 105, el procedimiento es exitoso.
- Seleccionar los ratones con tumores exitosos para construir el modelo de recaída post-resección de GBM.
3. Construcción del modelo post-resección de recaída GBM
- Cuando el tamaño del tumor en los ratones modelo de GBM intracraneal ortotópico sea de ~6,5 × 105, seleccione los ratones para el modelo de recaída postoperatoria.
- Pesar los ratones modelo GBM intracraneales ortotópicos y anestesiar a los ratones con una inyección intraperitoneal de 50 mg/kg de pentobarbital sódico. Administrar meloxicam (5 mg/kg; i.p.) para la analgesia perioperatoria.
- Repita el proceso de los pasos 1.2 y 1.5.
- Separe el tejido del cuero cabelludo y el cráneo, y verifique el orificio de perforación utilizado para construir el modelo ortotópico intracraneal de GBM. Si el orificio se ha curado, identifíquelo usando un aparato estereotáxico y siga el procedimiento mencionado en los pasos 2.1-2.3.
- Amplíe el diámetro del orificio a 5 mm con un taladro de cráneo y extraiga el líquido cefalorraquídeo exudado con un hisopo de algodón estéril.
- Enfoca el microscopio en la cabeza del ratón y ajusta la configuración para asegurarte de que el orificio de perforación esté situado en el centro del campo de visión.
- Cortar las meninges con unas tijeras y extirpar parte del tejido tumoral con una microcureta y un microbisturí bajo el microscopio.
NOTA: Con respecto a las meninges, cuando se abre el cráneo, la membrana delgada cercana al tejido cerebral son las meninges. - Detenga el sangrado con una gasa estéril y lave la incisión con solución salina fisiológica estéril.
- Inyectar el hidrogel disponible comercialmente (10 μL, ver Tabla de Materiales) en la cavidad de resección con una jeringa de 1 mL, suturar el cuero cabelludo con una sutura quirúrgica no absorbible (10-0) y desinfectar la incisión nuevamente (Figura 1).
- Controle la salud del animal y mantenga al ratón caliente.
- Mueva el ratón de vuelta a la jaula de la carcasa después de que el ratón se despierte.
- Realizar imágenes bioluminiscentes in vivo para detectar el tumor trasplantado 1 día después para cuantificar el tamaño del tumor residual (Figura 2 y Figura 3).
- Pesar a los ratones cada 2 días hasta el punto final terminal.
NOTA: Para el presente estudio, el criterio de valoración terminal fue el día 30, y los ratones fueron sacrificados mediante una sobredosis de pentobarbital sódico con una inyección intraperitoneal.
Resultados
En la Figura 1 se muestra el proceso de construcción del modelo post-resección de recaída GBM. Se muestra la cavidad de resección después de que el tumor se extirpó parcialmente al microscopio. El hidrogel se inyectó en la cavidad de resección con una jeringa para demostrar el efecto terapéutico. El cronograma del diseño experimental se muestra en la Figura 2A. Después de que las células GBM se implantaron en el cerebro de los ratones, el crecimiento tumoral se probó mediante imágenes bioluminiscentes in vivo el día 10. La resección se realizó el día 11 y luego se inyectó el hidrogel en la cavidad de resección. La prueba de imagen bioluminiscente in vivo se realizó el día 15, el día 20, el día 25 y el día 30 para monitorear el crecimiento tumoral residual. Como se muestra en la Figura 2B,C, el tamaño de los tumores en el modelo de recaída post-resección de GBM fue significativamente menor que el del modelo de GBM intracraneal ortotópico, como lo muestran las pruebas de imágenes bioluminiscentes in vivo. El día 25, los tumores recidivaron significativamente después de la resección (Figura 2D). La tinción de H&E confirmó que el modelo de recaída de GBM después de la resección se construyó con éxito y que los tumores residuales recidivaron significativamente después de la resección (Figura 3A,B).
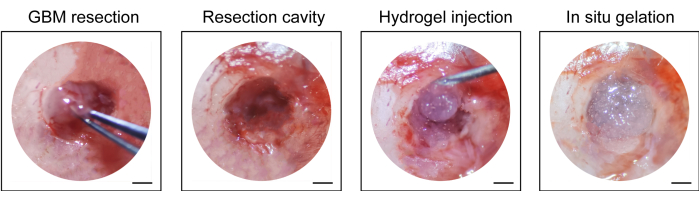
Figura 1: Vista intraoperatoria de la resección tumoral e inyección del hidrogel. Se extirpó parte del tejido tumoral con una microcureta y un microbisturí bajo el microscopio, y se inyectó hidrogel en la cavidad de resección. Barras de escala: 50 μm. Esta figura ha sido modificada a partir de Sun et al.10. Haga clic aquí para ver una versión más grande de esta figura.
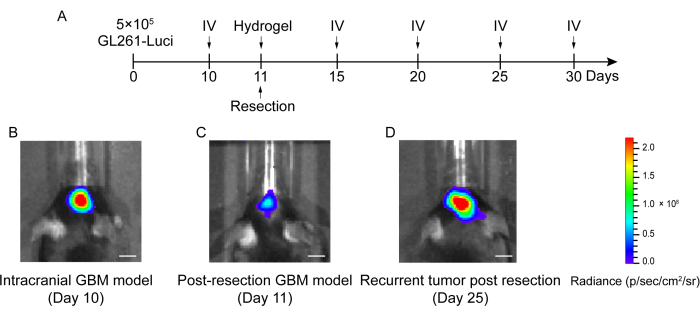
Figura 2: Cronograma del diseño experimental y de la imagen bioluminiscente in vivo de ratones en el modelo GBM intracraneal y post-resección. (A) El cronograma del diseño experimental que muestra que la resección se realizó el día 11 y que la imagen bioluminiscente (IV) in vivo se realizó el día 10, el día 15, el día 20, el día 25 y el día 30. (B) Los ratones modelo de GBM intracraneal mostraron un tamaño tumoral grande en el día 10, (C) el tamaño del tumor se redujo significativamente después de la resección en el día 11 y (D) el tamaño del tumor aumentó después de la resección en el día 25 en el modelo GBM posterior a la resección. El grupo de control incluyó a los ratones modelo de recaída de GBM después de la resección sin tratamiento. En este estudio se utilizaron un total de 42 ratones. Barras de escala: 100 μm. Esta figura ha sido modificada a partir de Sun et al.10. Haga clic aquí para ver una versión más grande de esta figura.
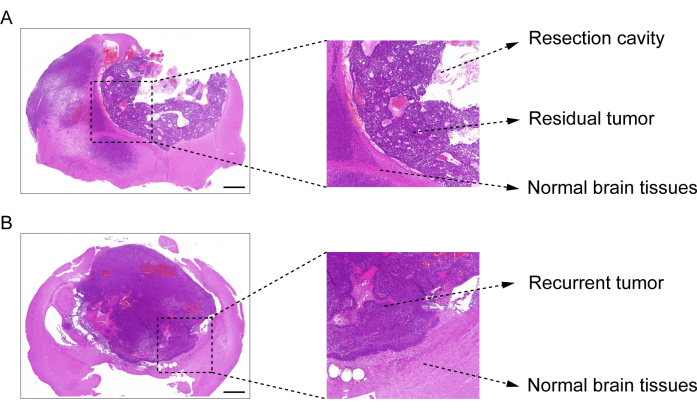
Figura 3: Imagen de tinción de H&E del tejido cerebral del modelo GBM posterior a la resección. (A) Una imagen de tinción de H&E que muestra la cavidad de resección, el tumor residual y el tejido cerebral normal. El tejido cerebral se recolectó 1 día después de la resección. (B) Una imagen de tinción de H&E que demuestre el tumor recidivante y el tejido cerebral normal. El tejido cerebral se recolectó el día 12 después de la resección. Barras de escala: 100 μm. Esta figura ha sido modificada a partir de Sun et al.10. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La cirugía sigue siendo la primera opción para la mayoría de los pacientes con GBM11. Debido a la característica de crecimiento invasivo de GBM, aún queda un pequeño número de células tumorales después de las técnicas microneuroquirúrgicas, lo que resulta en una eventual recurrencia tumoral12. Cómo inhibir la recurrencia de GBM después de la cirugía se ha convertido en el foco de la investigación relacionada con GBM. Sin embargo, debido a la compleja estructura anatómica del tejido cerebral, la construcción de un modelo adecuado de GBM postoperatorio se ha convertido en el principal problema a resolver en este campo.
En este estudio se desarrolló un modelo de recaída posresección de MBG. En el proceso de construcción de este modelo, la construcción del modelo ortotópico intracraneal de GBM es crítica. Una vez que este modelo se ha desarrollado con éxito, la resección debe realizarse en el momento adecuado. El momento recomendado es cuando el valor de fluorescencia del tamaño del tumor es de aproximadamente 6,5 × 105. Para reducir la mortalidad de los ratones, se realizó la resección bajo anestesia con 40 mg/kg de pentobarbital sódico al 1% por inyección intraperitoneal. Sin embargo, la resección fue difícil de realizar, y los ratones a menudo se movían debido a la pequeña dosis del anestésico. Sobre esta base, la dosis del anestésico se incrementó a 50 mg/kg. Después de aumentar la dosis anestésica, las respuestas intraoperatorias de los ratones desaparecieron y la resección se realizó con éxito. El gas isoflurano también se puede utilizar en este protocolo.
En este estudio, se utilizaron células GL261-Luci para desarrollar el modelo; por lo tanto, se deben utilizar más líneas celulares GBM para validar el protocolo en el futuro. Para que el protocolo sea más convincente, es necesario utilizar varios modelos de ratón GBM, como los modelos de ratón GBM modificados genéticamente. Además, la resonancia magnética puede ser el mejor medio para detectar la recurrencia de tumores después de la cirugía.
En resumen, en este trabajo se ha desarrollado un modelo post-resección de recaída de GBM. En este modelo, la recidiva tumoral se monitorea mediante la evaluación del crecimiento del tumor residual después de la resección. Aunque no se puede considerar que este modelo imite completamente la recidiva tumoral, el estilo de resección en este modelo es similar al estándar de cirugía de máxima seguridad en el tratamiento clínico de pacientes con GBM. Este trabajo proporciona un método conveniente y factible para construir el modelo de recaída post-resección de GBM y representa un avance en el campo de la investigación sobre la recaída de GBM post-resección.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Este trabajo contó con el apoyo de subvenciones para proyectos de la Fundación Nacional de Ciencias Naturales de China (82071767 y 82171781).
Materiales
| Name | Company | Catalog Number | Comments |
| Gentian violet | Sigma | C6158 | |
| GL261-Luci | Shanghai Zhong Qiao Xin Zhou Biotechnology Co.,Ltd. | ZQ0932 | |
| In vivo bioluminescent imaging system | Tanon | Tanon ABL X6 | |
| Laboratory animal shaver | Beyotime Biotechnology | FS600 | |
| Mice | Beijing Vital River Laboratory Animal Technology Co., Ltd. | ||
| Micro curette | Belevor Medical Co.,Ltd. | ||
| Micro scalpel | Belevor Medical Co.,Ltd. | ||
| Microscope | Shanghai Xiangfan Instrument Co., Ltd | JSZ5A/B | |
| Microsyringe | Hamilton | 87943 | |
| Mini cranial drill | RWD | 78001 | |
| Nonabsorbable surgical suture | Shanghai Yuyan Instruments Co.,Ltd. | ||
| Pentobarbital sodium | ChemSrc | 57-33-0 | |
| PVA-TSPBA hydrogel | Aladdin | 9002-89-5 | |
| Stereotaxic apparatus | RWD | 68043 |
Referencias
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews Clinical Oncology. 15 (7), 422-442 (2018).
- Wang, X., et al. In situ targeting nanoparticles-hydrogel hybrid system for combined chemo-immunotherapy of glioma. Journal of Controlled Release. 345, 786-797 (2022).
- Binder, Z. A., O'Rourke, D. M. Glioblastoma: The current state of biology and therapeutic strategies. Cancer Research. 82 (5), 769-772 (2022).
- Kauer, T. M., Figueiredo, J. L., Hingtgen, S., Shah, K. Encapsulated therapeutic stem cells implanted in the tumor resection cavity induce cell death in gliomas. Nature Neuroscience. 15 (2), 197-204 (2011).
- Jiang, X., et al. Nanoparticle engineered TRAIL-overexpressing adipose-derived stem cells target and eradicate glioblastoma via intracranial delivery. Proceedings of the National Academy of Sciences of the United States of America. 113 (48), 13857-13862 (2016).
- Quail, D. F., Joyce, J. A. The microenvironmental landscape of brain tumors. Cancer Cell. 31 (3), 326-341 (2017).
- Zhang, J., et al. Immunostimulant hydrogel for the inhibition of malignant glioma relapse post-resection. Nature Nanotechnology. 16 (5), 538-548 (2021).
- Ruan, H., et al. A dual-bioresponsive drug-delivery depot for combination of epigenetic modulation and immune checkpoint blockade. Advanced Materials. 31 (17), 1806957 (2019).
- Louveau, A., et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 523 (7560), 337-341 (2015).
- Sun, S., et al. Immunostimulant in situ hydrogel improves synergetic radioimmunotherapy of malignant glioblastoma relapse post-resection. Advanced Functional Materials. 32 (43), 2205038 (2022).
- Liu, D. K., Sulman, E. P., Wen, P. Y., Kurz, S. C. Novel therapies for glioblastoma. Current Neurology and Neuroscience Reports. 20 (7), 19 (2020).
- Mellinghoff, I. K., Cloughesy, T. F. Balancing risk and efficiency in drug development for rare and challenging tumors: A new paradigm for glioma. Journal of Clinical Oncology. 40 (30), 3510-3519 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados