Method Article
Terapötik Hidrojel Araştırmaları için Glioblastoma Relaps Post-Rezeksiyon Modeli
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Mevcut protokol, in vivo olarak enjekte edilebilir, biyo-duyarlı bir hidrojelin terapötik etkisini araştırmak için mikroskopi kullanarak bir glioblastoma (GBM) relaps sonrası modeli oluşturur.
Özet
Tümör nüksü, glioblastomda (GBM) kötü prognozun göstergesi olan önemli bir faktördür. Birçok çalışma, ameliyattan sonra GBM'nin nüksetmesini önlemek için etkili terapötik stratejiler belirlemeye çalışmaktadır. Lokal olarak salınan ilaçları sürdürebilen biyosensitif terapötik hidrojeller, ameliyat sonrası GBM'nin lokal tedavisinde sıklıkla kullanılmaktadır. Bununla birlikte, uygun bir GBM nüks sonrası rezeksiyon modelinin olmaması nedeniyle araştırmalar sınırlıdır. Burada, bir GBM nüks sonrası rezeksiyon modeli geliştirilmiş ve terapötik hidrojel araştırmalarında uygulanmıştır. Bu model, GBM ile ilgili çalışmalarda yaygın olarak kullanılan ortotopik intrakraniyal GBM modeli temel alınarak oluşturulmuştur. Klinik tedaviyi taklit etmek için ortotopik intrakraniyal GBM model fareye subtotal rezeksiyon yapıldı. Rezidüel tümör, tümör büyümesinin boyutunu belirtmek için kullanıldı. Bu modelin yapımı kolaydır, GBM cerrahi rezeksiyonunun durumunu daha iyi taklit edebilir ve rezeksiyon sonrası GBM nüksetinin lokal tedavisi ile ilgili çeşitli çalışmalarda uygulanabilir. Sonuç olarak, GBM relaps sonrası rezeksiyon modeli, rezeksiyon sonrası nüksün etkili lokal tedavi çalışmaları için benzersiz bir GBM nüks modeli sağlar.
Giriş
Glioblastoma (GBM) tüm santral sinir sistemi kanserleri arasında en sık görülen malign tümördür 1,2. GBM'li hastalar için cerrahi ilk basamak tedavidir ve kemoradyasyon cerrahi sonrası ana adjuvan tedavidir. Bununla birlikte, çeşitli tedavilerle GBM hastalarının çoğunda tümör nüksü sıklıkla 3-6 ay içinde gelişir 3,4,5. Bu nedenle, GBM nüksünü önlemek için daha etkili tedavi stratejilerinin geliştirilmesine acil ihtiyaç vardır.
GBM ile ilgili son çalışmalar, nüks tümörlerden ziyade esas olarak primer tümörlere odaklanmıştır6. Bununla birlikte, klinikte çözülmesi gereken en yaygın sorun, ameliyattan sonra GBM'nin nüksünün nasıl engelleneceğidir. Bu nedenle, ameliyat sonrası GBM'nin nüksü üzerine yapılan araştırmalara daha fazla dikkat edilmesi gerekmektedir. Biyosensitif terapötik hidrojeller, cerrahi sonrası tümör nüksü üzerine yapılan çalışmalarda kullanılan en yaygın vektördür 7,8. Bununla birlikte, merkezi sinir sisteminin özel yapısı nedeniyle, GBM nüksü çalışması için kritik olan uygun bir GBM nüks sonrası rezeksiyon modeli9 geliştirmek zordur.
Bu çalışma, primer GBM araştırmalarında kullanılan ortotopik intrakraniyal GBM modeline dayalı olarak geliştirilmiş bir GBM nüks sonrası rezeksiyon modeli oluşturmuştur. Bu modelde, tümörlerin çoğu mikroskopi ile ameliyatla çıkarılır ve rezidüel tümör in vivo biyolüminesan görüntüleme ve hematoksilen ve eozin (H&E) boyama ile tespit edilir. Bu model, beyin tümörü hastalarının rezeksiyon durumunu taklit eder ve GBM nüksü ile ilgili çeşitli çalışmalarda kullanılabilir.
Protokol
Tüm hayvan deneyleri, Kurumsal İnceleme Kurulu ve Nanjing Tıp Üniversitesi Hayvan Etik Komitesi (IACUC-1904004) tarafından onaylandı ve denetlendi. Bu çalışma için 6-8 haftalık C57BL/6J dişi fareler kullanıldı. Hayvanlar ticari bir kaynaktan elde edilmiştir (bkz.
1. Hayvan hazırlama
- Fareleri tartın ve 50 mg / kg pentobarbital sodyum intraperitoneal enjeksiyonu ile uyuşturun (bkz. Perioperatif analjezi için meloksikam (5 mg / kg; i.p.) uygulayın. Fareleri 12 saat/12 saat aydınlık/karanlık döngüsü, 24 °C ortam sıcaklığı ve %50 bağıl nem altında bir kafeste barındırın.
NOT: Bu çalışma için, farelerin başlangıç ağırlığı yaklaşık 22 g idi. - Bir laboratuvar hayvanı tıraş makinesi kullanarak bir farenin kafasındaki tüyleri alın ve başı ve uzuvları stereotaksik aparata sabitleyin (bkz.
NOT: Kullanmadan önce tüm ekipmanı sterilize edin. - Farenin kafasını en az üç alternatif tur klorheksidin veya povidon-iyot fırçalama ve ardından alkol ile dezenfekte edin ve fareyi steril bir cerrahi örtü ile örtün. Kurumayı önlemek için her iki göze de oftalmik merhem sürün.
- Farenin kafa derisini sağ alnın üst kısmındaki orta hat boyunca oftalmik makasla yaklaşık 1 cm kesin.
NOT: Kesi yapmadan önce anestezi cerrahi düzlemini pedal refleksinin yokluğuyla onaylayın. - Balıksırtı dikişinin ve ön bıngıldak noktasının aynı seviyede olduğundan emin olmak için stereotaksik aparatı ayarlayın.
2. Ortotopik intrakraniyal GBM modelinin yapımı
- Centiyana menekşesi2 ile batırılmış bir pamuklu çubuk kullanarak ön bıngıldak 1 mm ön bıngıldak ön tarafından 1,8 mm ve ön bıngıldaktan 3 mm aşağı noktayı işaretleyin (bkz.
- Yaklaşık 1 mm çapında ve 1 mm derinliğinde bir gözenek boyutu oluşturmak için 1 mm çapında bir mini kraniyal matkap ( Malzeme Tablosuna bakın) kullanarak noktayı delin.
- Sızan beyin omurilik sıvısını steril bir pamuklu çubukla çıkarın.
- Bir mikroşırınga ile 5 μL tümör hücresi süspansiyonunu (GL261-Luci, 5 μL PBS'de süspanse edilmiş 5 × 105 hücre) aspire edin.
NOT: GL261-Luci, ticari bir kaynaktan elde edilmiştir (bkz. - Mikroşırınganın iğne ucunu kafatası delme deliği ile dikey olarak hizalayın, iğne ucu kafatası düzlemine 3 mm girene kadar yerleştirin ve iğneyi 0.5 mm geri döndürün7.
- Mikroşırıngayı açın ve 1 μL/dk hızla enjekte edin.
- İğneyi enjeksiyondan sonra 10 dakika tutun.
- Mikroşırıngayı yavaşça çekin ve enjeksiyon noktasına steril kuru bir pamuk topuyla bastırın.
- Kafa derisini emilmeyen bir cerrahi sütürle dikin (10-0, Malzeme Tablosuna bakınız) ve kesiyi tekrar dezenfekte edin.
- Hayvanın sağlığını izleyin ve sıcak koşullarda tutun.
- Fare uyandıktan sonra fareyi muhafaza kafesine geri taşıyın.
- Tümör taşındıktan sonraki 10. günde nakledilen tümörü tespit etmek için fareyi bir in vivo biyolüminesan görüntüleme sistemi ile görüntüleyin (Malzeme Tablosuna bakın).
NOT: Biyolüminesan görüntüleme için GBM hücrelerine yüklenen lusiferaz, GL261 kullanıldı.- Fareyi 0,6 L / dak oksijen akış hızına sahip %1,5 izofluran ile uyuşturun. Pedal refleksi eksikliği ile anestezi derinliğini doğruladıktan sonra, fareye intraperitoneal olarak potasyum floresein (10 mg / mL, Malzeme Tablosuna bakınız) enjekte edin ve 11 saniye sonra in vivo biyolüminesan görüntülemeyi gerçekleştirin. Floresan değeri ~5 × 105'e ulaştığında işlem başarılı olur.
NOT: Görüntülemeden önce hayvanı uyuşturun. Buharlaştırılmış izofluran ile beslenen burun konisi ile anesteziyi koruyun.
- Fareyi 0,6 L / dak oksijen akış hızına sahip %1,5 izofluran ile uyuşturun. Pedal refleksi eksikliği ile anestezi derinliğini doğruladıktan sonra, fareye intraperitoneal olarak potasyum floresein (10 mg / mL, Malzeme Tablosuna bakınız) enjekte edin ve 11 saniye sonra in vivo biyolüminesan görüntülemeyi gerçekleştirin. Floresan değeri ~5 × 105'e ulaştığında işlem başarılı olur.
- GBM nüks sonrası rezeksiyon modelini oluşturmak için başarılı tümör taşıyan fareleri seçin.
3. GBM nüks sonrası rezeksiyon modelinin oluşturulması
- Ortotopik intrakraniyal GBM model farelerde tümör boyutu ~ 6.5 × 105 olduğunda, postoperatif nüks modeli için fareleri seçin.
- Ortotopik intrakraniyal GBM model fareleri tartın ve fareleri 50 mg / kg pentobarbital sodyum intraperitoneal enjeksiyonu ile uyuşturun. Perioperatif analjezi için meloksikam (5 mg / kg; i.p.) uygulayın.
- 1.2−1.5 adımlarındaki işlemi tekrarlayın.
- Kafa derisi dokusunu ve kafatasını ayırın ve ortotopik intrakraniyal GBM modelini oluşturmak için kullanılan delme deliğini kontrol edin. Delik iyileştiyse, stereotaktik aparat kullanarak deliği tanımlayın ve 2.1-2.3 adımlarında belirtilen prosedürü izleyin.
- Bir kafatası matkabı ile delik çapını 5 mm'ye genişletin ve sızan beyin omurilik sıvısını steril bir pamuklu çubukla çıkarın.
- Mikroskobu farenin kafasına odaklayın ve delme deliğinin görüş alanının merkezinde olduğundan emin olmak için ayarları yapın.
- Meninksleri mikromakasla kesin ve tümör dokusunun bir kısmını mikroskop altında bir mikro küret ve bir mikro neşter ile çıkarın.
NOT: Beyin zarları ile ilgili olarak, kafatası açıldığında beyin dokusuna yakın ince zar beyin zarıdır. - Kanamayı steril gazlı bezle durdurun ve insizyonu steril fizyolojik salinle yıkayın.
- Piyasada bulunan hidrojeli (10 μL, Malzeme Tablosuna bakınız) 1 mL'lik bir şırınga ile rezeksiyon boşluğuna enjekte edin, kafa derisini emilmeyen bir cerrahi sütür (10-0) ile dikin ve insizyonu tekrar dezenfekte edin (Şekil 1).
- Hayvanın sağlığını izleyin ve fareyi sıcak tutun.
- Fare uyandıktan sonra fareyi muhafaza kafesine geri taşıyın.
- Rezidüel tümörün boyutunu ölçmek için nakledilen tümörü 1 gün sonra tespit etmek için in vivo biyolüminesan görüntüleme gerçekleştirin (Şekil 2 ve Şekil 3).
- Fareleri terminal bitiş noktasına kadar her 2 günde bir tartın.
NOT: Bu çalışma için, terminal sonlanım noktası 30. gündü ve fareler, intraperitoneal enjeksiyon ile aşırı dozda pentobarbital sodyum ile ötenazi yapıldı.
Sonuçlar
GBM nüks sonrası rezeksiyon modelinin yapım süreci Şekil 1'de gösterilmektedir. Mikroskopi altında tümör kısmen çıkarıldıktan sonra rezeksiyon boşluğu gösterilmiştir. Hidrojel, terapötik etkiyi göstermek için bir şırınga ile rezeksiyon boşluğuna enjekte edildi. Deneysel tasarımın programı Şekil 2A'da gösterilmiştir. GBM hücreleri farelerin beynine implante edildikten sonra, tümör büyümesi 10. günde in vivo biyolüminesan görüntüleme ile test edildi. Rezeksiyon 11. günde yapıldı ve hidrojel daha sonra rezeksiyon boşluğuna enjekte edildi. Rezidüel tümör büyümesini izlemek için in vivo biyolüminesan görüntüleme testi 15. günde, 20. günde, 25. günde ve 30. günde yapıldı. Şekil 2B,C'de gösterildiği gibi, GBM relaps sonrası rezeksiyon modelindeki tümörlerin boyutu, in vivo biyolüminesan görüntüleme testi ile gösterildiği gibi, ortotopik intrakraniyal GBM modelindekilerden önemli ölçüde daha küçüktü. 25. günde, tümörler rezeksiyon sonrası önemli ölçüde nüks etti (Şekil 2D). H&E boyama, GBM nüks sonrası rezeksiyon modelinin başarılı bir şekilde oluşturulduğunu ve rezeksiyondan sonra rezidüel tümörlerin önemli ölçüde nüks ettiğini doğruladı (Şekil 3A,B).
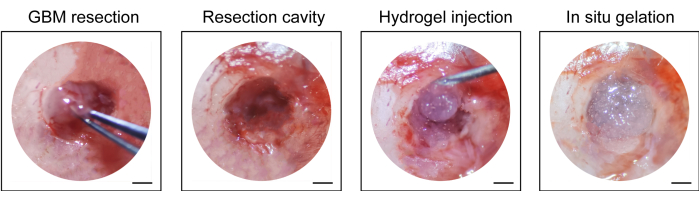
Şekil 1: Tümör rezeksiyonu ve hidrojel enjeksiyonunun intraoperatif görünümü. Mikroskop altında mikro küret ve mikro bistüri ile tümör dokusunun bir kısmı çıkarıldı ve rezeksiyon boşluğuna hidrojel enjekte edildi. Ölçek çubukları: 50 μm. Bu rakam Sun ve ark.10'dan değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
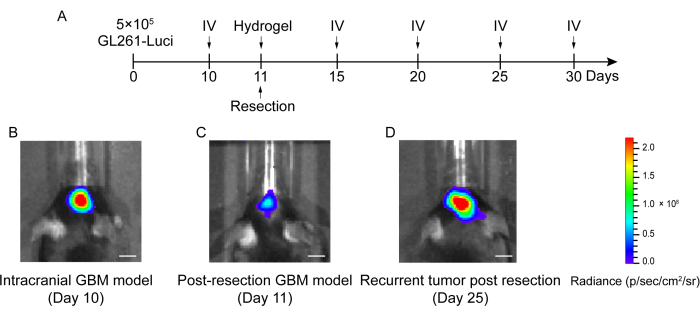
Şekil 2: İntrakraniyal ve rezeksiyon sonrası GBM modelinde farelerin deneysel tasarım ve in vivo biyolüminesan görüntüleme programı. (A) Rezeksiyonun 11. günde yapıldığını ve in vivo biyolüminesan görüntülemenin (IV) 10. günde, 15. günde, 20. günde, 25. günde ve 30. günde yapıldığını gösteren deneysel tasarım programı. (B) İntrakraniyal GBM model fareler 10. günde büyük bir tümör boyutu gösterdi, (C) 11. günde rezeksiyondan sonra tümör boyutu önemli ölçüde azaldı ve (D) rezeksiyon sonrası GBM modelinde 25. günde rezeksiyondan sonra tümör boyutu arttı. Kontrol grubu, tedavi edilmeyen GBM nüks sonrası rezeksiyon model fareleri içeriyordu. Bu çalışmada toplam 42 fare kullanıldı. Ölçek çubukları: 100 μm. Bu rakam Sun ve ark.10'dan değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
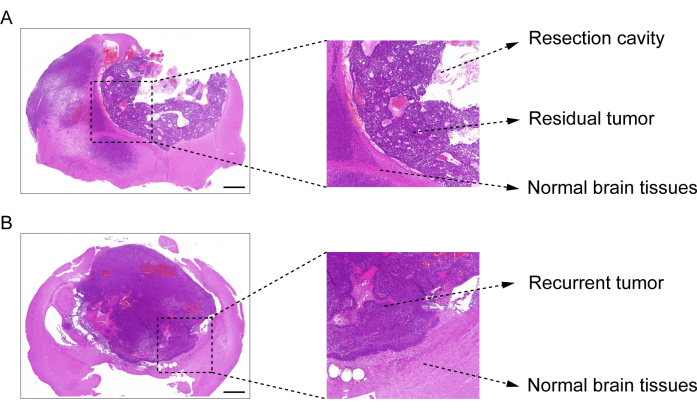
Şekil 3: Rezeksiyon sonrası GBM modelinden beyin dokusunun H&E boyama görüntüsü. (A) Rezeksiyon boşluğunu, rezidüel tümörü ve normal beyin dokusunu gösteren bir H&E boyama görüntüsü. Rezeksiyondan 1 gün sonra beyin dokusu toplandı. (B) Tekrarlayan tümörü ve normal beyin dokusunu gösteren bir H & E boyama görüntüsü. Beyin dokusu rezeksiyondan 12. günde toplandı. Ölçek çubukları: 100 μm. Bu rakam Sun ve ark.10'dan değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Cerrahi, çoğu GBM hastası için ilk seçenek olmaya devam etmektedir11. GBM'nin invaziv büyümesinin karakteristiği nedeniyle, mikro nöroşirürji tekniklerinden sonra hala az sayıda tümör hücresi kalır ve bu da nihai tümör nüksü ile sonuçlanır12. Ameliyattan sonra GBM'nin nüksünün nasıl engelleneceği, GBM ile ilgili araştırmaların odak noktası haline gelmiştir. Ancak beyin dokusunun karmaşık anatomik yapısı nedeniyle ameliyat sonrası uygun bir GBM modelinin oluşturulması bu alanda çözülmesi gereken öncelikli sorun haline gelmiştir.
Bu çalışmada GBM nüks sonrası rezeksiyon modeli geliştirilmiştir. Bu modelin oluşturulması sürecinde, ortotopik intrakraniyal GBM modelinin inşası kritik öneme sahiptir. Bu model başarılı bir şekilde geliştirildikten sonra rezeksiyonun doğru zamanda yapılması gerekir. Önerilen süre, tümör boyutunun floresan değerinin yaklaşık 6.5 × 105 olduğu zamandır. Farelerin mortalitesini azaltmak için anestezi altında rezeksiyon intraperitoneal enjeksiyon ile 40 mg/kg %1 pentobarbital sodyum ile yapıldı. Bununla birlikte, rezeksiyonun gerçekleştirilmesi zordu ve fareler genellikle anestezinin küçük dozu nedeniyle hareket etti. Bu temelde, anestezik dozu 50 mg / kg'a yükseltildi. Anestezik dozu arttırıldıktan sonra, farelerin intraoperatif yanıtları kayboldu ve rezeksiyon başarıyla gerçekleştirildi. Bu protokolde izofluran gazı da kullanılabilir.
Bu çalışmada, modeli geliştirmek için GL261-Luci hücreleri kullanıldı; bu nedenle, gelecekte protokolü doğrulamak için daha fazla GBM hücre hattı kullanılmalıdır. Protokolü daha inandırıcı hale getirmek için, genetiği değiştirilmiş GBM fare modelleri gibi çeşitli GBM fare modellerinin kullanılması gerekir. Ek olarak, MRG, ameliyattan sonra tümörlerin nüksünü tespit etmenin en iyi yolu olabilir.
Özetle, bu çalışmada bir GBM nüks sonrası rezeksiyon modeli geliştirilmiştir. Bu modelde, rezeksiyon sonrası rezidüel tümörün büyümesi değerlendirilerek tümör nüksü izlenir. Bu modelin tümör nüksünü tamamen taklit ettiği düşünülemese de, bu modeldeki rezeksiyon stili, GBM hastalarının klinik tedavisinde maksimum güvenli cerrahi standardına benzer. Bu çalışma, GBM relaps sonrası rezeksiyon modelini oluşturmak için uygun ve uygulanabilir bir yöntem sağlar ve GBM relaps sonrası araştırma alanında bir ilerlemeyi temsil eder.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmezler.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı'ndan (82071767 ve 82171781) proje hibeleri ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Gentian violet | Sigma | C6158 | |
| GL261-Luci | Shanghai Zhong Qiao Xin Zhou Biotechnology Co.,Ltd. | ZQ0932 | |
| In vivo bioluminescent imaging system | Tanon | Tanon ABL X6 | |
| Laboratory animal shaver | Beyotime Biotechnology | FS600 | |
| Mice | Beijing Vital River Laboratory Animal Technology Co., Ltd. | ||
| Micro curette | Belevor Medical Co.,Ltd. | ||
| Micro scalpel | Belevor Medical Co.,Ltd. | ||
| Microscope | Shanghai Xiangfan Instrument Co., Ltd | JSZ5A/B | |
| Microsyringe | Hamilton | 87943 | |
| Mini cranial drill | RWD | 78001 | |
| Nonabsorbable surgical suture | Shanghai Yuyan Instruments Co.,Ltd. | ||
| Pentobarbital sodium | ChemSrc | 57-33-0 | |
| PVA-TSPBA hydrogel | Aladdin | 9002-89-5 | |
| Stereotaxic apparatus | RWD | 68043 |
Referanslar
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews Clinical Oncology. 15 (7), 422-442 (2018).
- Wang, X., et al. In situ targeting nanoparticles-hydrogel hybrid system for combined chemo-immunotherapy of glioma. Journal of Controlled Release. 345, 786-797 (2022).
- Binder, Z. A., O'Rourke, D. M. Glioblastoma: The current state of biology and therapeutic strategies. Cancer Research. 82 (5), 769-772 (2022).
- Kauer, T. M., Figueiredo, J. L., Hingtgen, S., Shah, K. Encapsulated therapeutic stem cells implanted in the tumor resection cavity induce cell death in gliomas. Nature Neuroscience. 15 (2), 197-204 (2011).
- Jiang, X., et al. Nanoparticle engineered TRAIL-overexpressing adipose-derived stem cells target and eradicate glioblastoma via intracranial delivery. Proceedings of the National Academy of Sciences of the United States of America. 113 (48), 13857-13862 (2016).
- Quail, D. F., Joyce, J. A. The microenvironmental landscape of brain tumors. Cancer Cell. 31 (3), 326-341 (2017).
- Zhang, J., et al. Immunostimulant hydrogel for the inhibition of malignant glioma relapse post-resection. Nature Nanotechnology. 16 (5), 538-548 (2021).
- Ruan, H., et al. A dual-bioresponsive drug-delivery depot for combination of epigenetic modulation and immune checkpoint blockade. Advanced Materials. 31 (17), 1806957 (2019).
- Louveau, A., et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 523 (7560), 337-341 (2015).
- Sun, S., et al. Immunostimulant in situ hydrogel improves synergetic radioimmunotherapy of malignant glioblastoma relapse post-resection. Advanced Functional Materials. 32 (43), 2205038 (2022).
- Liu, D. K., Sulman, E. P., Wen, P. Y., Kurz, S. C. Novel therapies for glioblastoma. Current Neurology and Neuroscience Reports. 20 (7), 19 (2020).
- Mellinghoff, I. K., Cloughesy, T. F. Balancing risk and efficiency in drug development for rare and challenging tumors: A new paradigm for glioma. Journal of Clinical Oncology. 40 (30), 3510-3519 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır