Method Article
Modelo Pós-Ressecção de Glioblastoma para Investigações de Hidrogel Terapêutico
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O presente protocolo estabelece um modelo pós-ressecção de glioblastoma (GBM) usando microscopia para investigar o efeito terapêutico de um hidrogel injetável bioresponsivo in vivo.
Resumo
A recorrência tumoral é um importante fator indicativo de mau prognóstico no glioblastoma (GBM). Muitos estudos estão tentando identificar estratégias terapêuticas eficazes para prevenir a recorrência do GBM após a cirurgia. Hidrogéis terapêuticos biorresponsivos capazes de sustentar fármacos liberados localmente são frequentemente utilizados para o tratamento local do GBM após a cirurgia. No entanto, a pesquisa é limitada devido à falta de um modelo adequado de recidiva pós-ressecção de GBM. Aqui, um modelo de recidiva pós-ressecção de GBM foi desenvolvido e aplicado em investigações terapêuticas com hidrogel. Esse modelo foi construído com base no modelo ortotópico intracraniano do GBM, amplamente utilizado em estudos sobre GBM. A ressecção subtotal foi realizada em camundongo modelo GBM intracraniano ortotópico para mimetizar o tratamento clínico. O tumor residual foi utilizado para indicar o tamanho do crescimento tumoral. Esse modelo é de fácil construção, pode mimetizar melhor a situação de ressecção cirúrgica do GBM e pode ser aplicado em vários estudos sobre o tratamento local da recidiva do GBM pós-ressecção. Como resultado, o modelo de recidiva de GBM pós-ressecção fornece um modelo único de recidiva de GBM para estudos eficazes de tratamento local de recidiva pós-ressecção.
Introdução
O glioblastoma (GBM) é o tumor maligno mais comum entre todos os cânceres do sistema nervosocentral1,2. A cirurgia é o tratamento de primeira linha para pacientes com GBM, e a quimiorradiação é o principal tratamento adjuvante após a cirurgia. No entanto, a recorrência tumoral geralmente se desenvolve dentro de 3-6 meses na maioria dos pacientes com GBM com váriostratamentos3,4,5. Portanto, há uma necessidade urgente de desenvolver estratégias de tratamento mais eficazes para prevenir a recorrência do GBM.
Estudos recentes sobre GBM têm se concentrado principalmente em tumores primários em vez de tumoresrecorrentes6. No entanto, o problema mais comum que precisa ser resolvido na clínica é como inibir a recorrência do GBM após a cirurgia. Portanto, a pesquisa sobre a recorrência do GBM após a cirurgia necessita de maior atenção. Os hidrogéis terapêuticos bioresponsivos são o vetor mais comumente utilizado em estudos de recidiva tumoral apóscirurgia7,8. No entanto, devido à estrutura especial do sistema nervoso central, é difícil desenvolver um modelo adequado de recidiva pós-ressecção doGBM9, o que é crítico para o estudo da recidiva do GBM.
Este estudo gerou um modelo melhorado de recidiva do GBM pós-ressecção baseado no modelo de GBM intracraniano ortotópico usado em pesquisas sobre GBM primário. Nesse modelo, a maioria dos tumores é removida cirurgicamente com microscopia, e o tumor residual é detectado por bioluminescência in vivo e coloração pela hematoxilina e eosina (H&E). Esse modelo mimetiza o estado de ressecção de pacientes com tumor cerebral e pode ser usado em vários estudos sobre recidiva do GBM.
Protocolo
Todos os experimentos com animais foram aprovados e supervisionados pelo Comitê de Ética Institucional e pelo Comitê de Ética Animal da Nanjing Medical University (IACUC-1904004). Camundongos fêmeas C57BL/6J, com idade entre 6 e 8 semanas, foram utilizados para o presente estudo. Os animais foram obtidos de fonte comercial (ver Tabela de Materiais).
1. Preparo dos animais
- Pesar os ratinhos e anestesiar-os com uma injeção intraperitoneal de 50 mg/kg de pentobarbital sódico (ver Tabela de Materiais). Administrar meloxicam (5mg/kg; i.p.) para analgesia perioperatória. Alojar os ratos numa gaiola sob um ciclo claro/escuro de 12 h/12 h, uma temperatura ambiente de 24 °C e uma humidade relativa de 50%.
NOTA: Para o presente estudo, o peso inicial dos camundongos foi de cerca de 22 g. - Remova o pelo na cabeça de um rato usando um barbeador de animais de laboratório e fixe a cabeça e os membros no aparelho estereotáxico (ver Tabela de Materiais).
OBS: Esterilizar todos os equipamentos antes do uso. - Desinfete a cabeça do rato com pelo menos três rondas alternadas de clorexidina ou esfoliação de iodopovidona, seguidas de álcool, e cubra o rato com um campo cirúrgico estéril. Aplique pomada oftálmica em ambos os olhos para evitar o ressecamento.
- Corte o couro cabeludo do rato cerca de 1 cm ao longo da linha média no topo da testa direita com tesoura oftálmica.
OBS: Confirmar o plano cirúrgico da anestesia pela ausência do reflexo pedioso antes de realizar a incisão. - Ajuste o aparelho estereotáxico para garantir que a costura da espinha de arenque e o ponto da fontanela frontal estejam localizados no mesmo nível.
2. Construção do modelo ortotópico intracraniano de GBM
- Marque o ponto 1 mm para o lado frontal da fontanela frontal, 1,8 mm para o lado direito da fontanela frontal e 3 mm para baixo da fontanela frontal usando um cotonete mergulhado com violeta de genciana2 (ver Tabela de Materiais).
- Perfure o ponto usando uma mini broca craniana de 1 mm de diâmetro (consulte Tabela de Materiais) para criar um tamanho de poro de cerca de 1 mm de diâmetro e 1 mm de profundidade.
- Retire o líquido cefalorraquidiano exsudado com um cotonete estéril.
- Aspirar 5 μL de suspensão de células tumorais (GL261-Luci, 5 × 10 5 células suspensas em5 μL de PBS) com uma microseringa.
NOTA: O GL261-Luci foi obtido de uma fonte comercial (ver Tabela de Materiais). - Alinhe verticalmente a ponta da agulha da microseringa com o orifício de perfuração do crânio, insira até que a ponta da agulha entre no plano do crânio por 3 mm e devolva a agulha em 0,5 mm7.
- Abra a microseringa e injete a uma velocidade de 1 μL/min.
- Retenha a agulha durante 10 minutos após a injeção.
- Retire a microseringa lentamente e pressione o ponto de injeção com uma bola de algodão seca estéril.
- Sutura do couro cabeludo com sutura cirúrgica inabsorvível (10-0, ver Tabela de Materiais) e desinfecção da incisão novamente.
- Monitore a saúde do animal e mantenha-o em condições quentes.
- Mova o mouse de volta para a gaiola da caixa depois que o mouse for ativado.
- Imagem do camundongo com um sistema de imagem bioluminescente in vivo (ver Tabela de Materiais) para detectar o tumor transplantado no 10º dia após a realização do tumor.
NOTA: Luciferase carregada nas células GBM, GL261, foi usada para a imagem bioluminescente.- Anestesiar o camundongo com isoflurano a 1,5% com fluxo de oxigênio de 0,6L/min. Após confirmar a profundidade da anestesia por meio da ausência do reflexo pedal, injetar o camundongo intraperitonealmente com fluoresceína de potássio (10 mg/mL, ver Tabela de Materiais) e, 11 s depois, realizar a imagem bioluminescente in vivo . Quando o valor de fluorescência atinge ~5 × 105, o procedimento é bem-sucedido.
OBS: Anestesiar o animal antes da aquisição de imagens. Manter a anestesia através do cone nasal fornecido com isoflurano vaporizado.
- Anestesiar o camundongo com isoflurano a 1,5% com fluxo de oxigênio de 0,6L/min. Após confirmar a profundidade da anestesia por meio da ausência do reflexo pedal, injetar o camundongo intraperitonealmente com fluoresceína de potássio (10 mg/mL, ver Tabela de Materiais) e, 11 s depois, realizar a imagem bioluminescente in vivo . Quando o valor de fluorescência atinge ~5 × 105, o procedimento é bem-sucedido.
- Selecione os camundongos com sucesso portador de tumor para construir o modelo pós-ressecção de recidiva de GBM.
3. Construção do modelo pós-ressecção de recidiva do GBM
- Quando o tamanho do tumor nos camundongos modelo GBM intracraniano ortotópico se tornar ~6,5 × 105, selecione os camundongos para o modelo de recidiva pós-operatória.
- Pesar os camundongos modelo GBM intracraniano ortotópico e anestesiar os camundongos com uma injeção intraperitoneal de 50 mg/kg de pentobarbital sódico. Administrar meloxicam (5mg/kg; i.p.) para analgesia perioperatória.
- Repita o processo das etapas 1.2 a 1.5.
- Separe o tecido do couro cabeludo e o crânio e verifique o orifício de perfuração usado para construir o modelo ortotópico intracraniano de GBM. Se o orifício tiver cicatrizado, identifique o orifício usando aparato estereotáxico e siga o procedimento mencionado nos passos 2.1-2.3.
- Expanda o diâmetro do orifício para 5 mm com uma broca de crânio e remova o líquido cefalorraquidiano exsudado com um cotonete estéril.
- Concentre o microscópio na cabeça do mouse e ajuste as configurações para garantir que o furo de perfuração esteja localizado no centro do campo de visão.
- Corte as meninges com microtesoura e remova parte do tecido tumoral com uma micro cureta e um microbisturi ao microscópio.
OBS: Em relação às meninges, quando o crânio é aberto, a fina membrana próxima ao tecido cerebral são as meninges. - Pare o sangramento com gaze estéril e lave a incisão com soro fisiológico estéril.
- Injetar o hidrogel comercialmente disponível (10 μL, ver Tabela de Materiais) na cavidade de ressecção com uma seringa de 1 mL, suturar o couro cabeludo com uma sutura cirúrgica inabsorvível (10-0) e desinfetar novamente a incisão (Figura 1).
- Monitore a saúde do animal e mantenha o rato aquecido.
- Mova o mouse de volta para a gaiola da caixa depois que o mouse for ativado.
- Realizar imagem bioluminescente in vivo para detectar o tumor transplantado 1 dia depois para quantificar o tamanho do tumor residual (Figura 2 e Figura 3).
- Pese os ratos a cada 2 dias até o ponto de extremidade terminal.
NOTA: Para o presente estudo, o desfecho terminal foi o dia 30, e os camundongos foram eutanasiados por uma overdose de pentobarbital sódico com uma injeção intraperitoneal.
Resultados
O processo de construção do modelo pós-ressecção de recidiva do GBM é mostrado na Figura 1. A cavidade de ressecção após a remoção parcial do tumor sob a microscopia é mostrada. O hidrogel foi injetado na cavidade de ressecção com uma seringa para demonstrar o efeito terapêutico. O cronograma do planejamento experimental é mostrado na Figura 2A. Depois que as células GBM foram implantadas no cérebro dos camundongos, o crescimento do tumor foi testado por imagem bioluminescente in vivo no dia 10. A ressecção foi realizada no 11º dia, e o hidrogel foi então injetado na cavidade de ressecção. O exame de imagem bioluminescente in vivo foi realizado no dia 15, dia 20, dia 25 e dia 30 para monitorar o crescimento residual do tumor. Como mostrado na Figura 2B,C, o tamanho dos tumores no modelo de recidiva pós-ressecção de GBM foi significativamente menor do que no modelo de GBM intracraniano ortotópico, como mostrado pelo exame de imagem bioluminescente in vivo. No 25º dia, houve recidiva significativa dos tumores após a ressecção (Figura 2D). A coloração H&E confirmou que o modelo de recidiva do GBM pós-ressecção foi construído com sucesso e que os tumores residuais recorreram significativamente após a ressecção (Figura 3A,B).
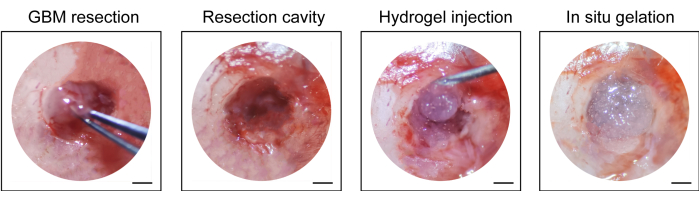
Figura 1: Visão intraoperatória da ressecção do tumor e injeção do hidrogel. Parte do tecido tumoral foi removida com microcureta e microbisturi ao microscópio, e hidrogel foi injetado na cavidade de ressecção. Barras de escala: 50 μm. Esse valor foi modificado de Sun et al.10. Clique aqui para ver uma versão maior desta figura.
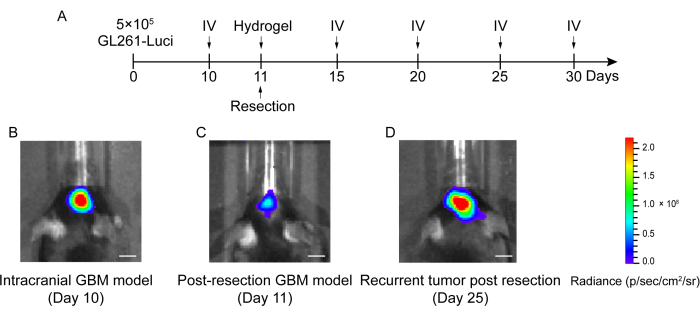
Figura 2: Cronograma do desenho experimental e das imagens bioluminescentes in vivo de camundongos no modelo GBM intracraniano e pós-ressecção. (A) O cronograma do delineamento experimental mostrando que a ressecção foi realizada no dia 11 e que a imagem bioluminescente (IV) in vivo foi realizada no dia 10, dia 15, dia 20, dia 25 e dia 30. (B) Os camundongos modelo GBM intracraniano mostraram um grande tamanho do tumor no dia 10, (C) o tamanho do tumor foi significativamente reduzido após a ressecção no dia 11, e (D) o tamanho do tumor aumentou após a ressecção no dia 25 no modelo GBM pós-ressecção. O grupo controle incluiu camundongos modelo GBM recidiva pós-ressecção sem tratamento. Um total de 42 camundongos foi utilizado neste estudo. Barras de escala: 100 μm. Esse valor foi modificado de Sun et al.10. Clique aqui para ver uma versão maior desta figura.
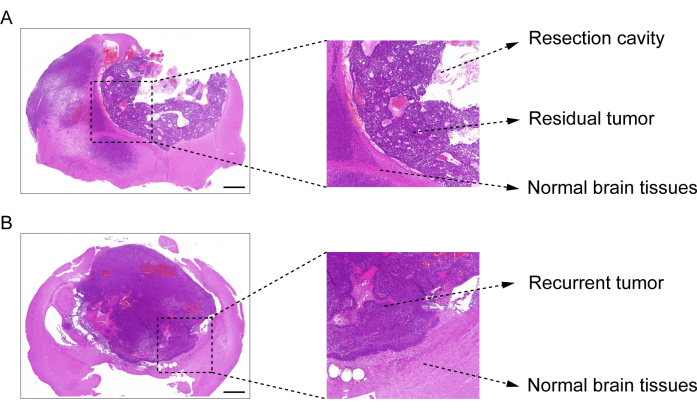
Figura 3: Imagem de H&E do tecido cerebral do modelo GBM pós-ressecção. (A) Imagem corada por H&E demonstrando a cavidade de ressecção, tumor residual e tecido cerebral normal. O tecido cerebral foi coletado 1 dia após a ressecção. (B) Imagem de H&E demonstrando o tumor recorrente e o tecido cerebral normal. O tecido cerebral foi coletado no 12º dia após a ressecção. Barras de escala: 100 μm. Esse valor foi modificado de Sun et al.10. Clique aqui para ver uma versão maior desta figura.
Discussão
A cirurgia continua sendo a primeira escolha para a maioria dos pacientes com GBM11. Devido à característica de crescimento invasivo do GBM, um pequeno número de células tumorais ainda permanece após técnicas microneurocirúrgicas, resultando em eventual recidivatumoral12. Como inibir a recorrência do GBM após a cirurgia tornou-se o foco da pesquisa relacionada ao GBM. No entanto, devido à complexa estrutura anatômica do tecido cerebral, a construção de um modelo adequado de GBM pós-operatório tornou-se o principal problema a ser resolvido neste campo.
Este estudo desenvolveu um modelo de recidiva pós-ressecção de GBM. No processo de construção desse modelo, a construção do modelo ortotópico intracraniano de GBM é fundamental. Após esse modelo ter sido desenvolvido com sucesso, a ressecção precisa ser realizada no momento certo. O tempo recomendado é quando o valor de fluorescência do tamanho do tumor é de cerca de 6,5 × 105. Para reduzir a mortalidade dos camundongos, a ressecção sob anestesia foi realizada com 40 mg/kg de pentobarbital sódico a 1% por injeção intraperitoneal. No entanto, a ressecção foi difícil de realizar, e os camundongos muitas vezes se moviam devido à pequena dose do anestésico. Com base nisso, a dose do anestésico foi aumentada para 50 mg/kg. Após o aumento da dose anestésica, as respostas intraoperatórias dos camundongos desapareceram, e a ressecção foi realizada com sucesso. O gás isoflurano também pode ser utilizado neste protocolo.
Neste estudo, células GL261-Luci foram usadas para desenvolver o modelo; portanto, mais linhagens celulares GBM devem ser usadas para validar o protocolo no futuro. Para tornar o protocolo mais convincente, vários modelos de camundongos GBM, como modelos de camundongos GBM geneticamente modificados, precisam ser usados. Além disso, a RM pode ser o melhor meio para detectar a recorrência de tumores após a cirurgia.
Em resumo, neste trabalho, um modelo de recidiva pós-ressecção de GBM foi desenvolvido. Nesse modelo, a recidiva tumoral é monitorada avaliando-se o crescimento residual do tumor após a ressecção. Embora esse modelo não possa ser considerado para mimetizar completamente a recidiva tumoral, o estilo de ressecção nesse modelo é semelhante ao padrão de cirurgia maximamente segura no tratamento clínico de pacientes com GBM. Este trabalho fornece um método conveniente e viável de construção do modelo pós-ressecção de recidiva de GBM e representa um avanço no campo da pesquisa sobre recidiva de GBM pós-ressecção.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Este trabalho foi apoiado por bolsas de projeto da Fundação Nacional de Ciências Naturais da China (82071767 e 82171781).
Materiais
| Name | Company | Catalog Number | Comments |
| Gentian violet | Sigma | C6158 | |
| GL261-Luci | Shanghai Zhong Qiao Xin Zhou Biotechnology Co.,Ltd. | ZQ0932 | |
| In vivo bioluminescent imaging system | Tanon | Tanon ABL X6 | |
| Laboratory animal shaver | Beyotime Biotechnology | FS600 | |
| Mice | Beijing Vital River Laboratory Animal Technology Co., Ltd. | ||
| Micro curette | Belevor Medical Co.,Ltd. | ||
| Micro scalpel | Belevor Medical Co.,Ltd. | ||
| Microscope | Shanghai Xiangfan Instrument Co., Ltd | JSZ5A/B | |
| Microsyringe | Hamilton | 87943 | |
| Mini cranial drill | RWD | 78001 | |
| Nonabsorbable surgical suture | Shanghai Yuyan Instruments Co.,Ltd. | ||
| Pentobarbital sodium | ChemSrc | 57-33-0 | |
| PVA-TSPBA hydrogel | Aladdin | 9002-89-5 | |
| Stereotaxic apparatus | RWD | 68043 |
Referências
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews Clinical Oncology. 15 (7), 422-442 (2018).
- Wang, X., et al. In situ targeting nanoparticles-hydrogel hybrid system for combined chemo-immunotherapy of glioma. Journal of Controlled Release. 345, 786-797 (2022).
- Binder, Z. A., O'Rourke, D. M. Glioblastoma: The current state of biology and therapeutic strategies. Cancer Research. 82 (5), 769-772 (2022).
- Kauer, T. M., Figueiredo, J. L., Hingtgen, S., Shah, K. Encapsulated therapeutic stem cells implanted in the tumor resection cavity induce cell death in gliomas. Nature Neuroscience. 15 (2), 197-204 (2011).
- Jiang, X., et al. Nanoparticle engineered TRAIL-overexpressing adipose-derived stem cells target and eradicate glioblastoma via intracranial delivery. Proceedings of the National Academy of Sciences of the United States of America. 113 (48), 13857-13862 (2016).
- Quail, D. F., Joyce, J. A. The microenvironmental landscape of brain tumors. Cancer Cell. 31 (3), 326-341 (2017).
- Zhang, J., et al. Immunostimulant hydrogel for the inhibition of malignant glioma relapse post-resection. Nature Nanotechnology. 16 (5), 538-548 (2021).
- Ruan, H., et al. A dual-bioresponsive drug-delivery depot for combination of epigenetic modulation and immune checkpoint blockade. Advanced Materials. 31 (17), 1806957 (2019).
- Louveau, A., et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 523 (7560), 337-341 (2015).
- Sun, S., et al. Immunostimulant in situ hydrogel improves synergetic radioimmunotherapy of malignant glioblastoma relapse post-resection. Advanced Functional Materials. 32 (43), 2205038 (2022).
- Liu, D. K., Sulman, E. P., Wen, P. Y., Kurz, S. C. Novel therapies for glioblastoma. Current Neurology and Neuroscience Reports. 20 (7), 19 (2020).
- Mellinghoff, I. K., Cloughesy, T. F. Balancing risk and efficiency in drug development for rare and challenging tumors: A new paradigm for glioma. Journal of Clinical Oncology. 40 (30), 3510-3519 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados