Method Article
Modello post-resezione recidiva di glioblastoma per indagini terapeutiche sull'idrogel
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il presente protocollo stabilisce un modello post-resezione di recidiva del glioblastoma (GBM) utilizzando la microscopia per studiare l'effetto terapeutico di un idrogel iniettabile bioresponsivo in vivo.
Abstract
La recidiva del tumore è un fattore importante indicativo di una prognosi sfavorevole nel glioblastoma (GBM). Molti studi stanno tentando di identificare strategie terapeutiche efficaci per prevenire il ripetersi di GBM dopo l'intervento chirurgico. Gli idrogel terapeutici bioresponsivi in grado di sostenere i farmaci rilasciati localmente sono spesso utilizzati per il trattamento locale del GBM dopo l'intervento chirurgico. Tuttavia, la ricerca è limitata a causa della mancanza di un modello adeguato di recidiva post-resezione GBM. Qui, un modello di post-resezione di recidiva GBM è stato sviluppato e applicato nelle indagini terapeutiche sull'idrogel. Questo modello è stato costruito sulla base del modello ortotopico intracranico GBM, che è ampiamente utilizzato negli studi sul GBM. La resezione subtotale è stata eseguita sul topo modello di GBM intracranico ortotopico per imitare il trattamento clinico. Il tumore residuo è stato utilizzato per indicare la dimensione della crescita del tumore. Questo modello è facile da costruire, può imitare meglio la situazione della resezione chirurgica GBM e può essere applicato in vari studi sul trattamento locale della recidiva GBM post-resezione. Di conseguenza, il modello di recidiva post-resezione GBM fornisce un modello di recidiva GBM unico per efficaci studi di trattamento locale della recidiva post-resezione.
Introduzione
Il glioblastoma (GBM) è il tumore maligno più comune tra tutti i tumori del sistema nervoso centrale 1,2. La chirurgia è il trattamento di prima linea per i pazienti con GBM e la chemioradioterapia è il principale trattamento adiuvante dopo l'intervento chirurgico. Tuttavia, la recidiva del tumore si sviluppa spesso entro 3-6 mesi nella maggior parte dei pazienti GBM con vari trattamenti 3,4,5. Quindi, vi è un urgente bisogno di sviluppare strategie di trattamento più efficaci per prevenire la recidiva di GBM.
Recenti studi sul GBM si sono concentrati principalmente sui tumori primari piuttosto che sui tumori ricorrenti6. Tuttavia, il problema più comune che deve essere risolto in clinica è come inibire la recidiva di GBM dopo l'intervento chirurgico. Pertanto, la ricerca sulla recidiva di GBM dopo l'intervento chirurgico richiede maggiore attenzione. Gli idrogel terapeutici bioresponsivi sono il vettore più comune utilizzato negli studi sulla recidiva tumorale dopo l'intervento chirurgico 7,8. Tuttavia, a causa della particolare struttura del sistema nervoso centrale, è difficile sviluppare un adeguato modello9 di recidiva di GBM recidiva, che è fondamentale per lo studio della recidiva di GBM.
Questo studio ha generato un modello migliorato di post-resezione di recidiva GBM basato sul modello ortotopico di GBM intracranico utilizzato nella ricerca sul GBM primario. In questo modello, la maggior parte dei tumori viene rimossa chirurgicamente con microscopia e il tumore residuo viene rilevato mediante imaging bioluminescente in vivo e colorazione con ematossilina ed eosina (H & E). Questo modello imita lo stato di resezione dei pazienti con tumore cerebrale e può essere utilizzato in vari studi sulla recidiva GBM.
Protocollo
Tutti gli esperimenti sugli animali sono stati approvati e supervisionati dall'Institutional Review Board e dall'Animal Ethics Committee dell'Università di Medicina di Nanchino (IACUC-1904004). Per il presente studio sono stati utilizzati topi femmina C57BL / 6J, di età compresa tra 6 e 8 settimane. Gli animali sono stati ottenuti da una fonte commerciale (vedi Tabella dei materiali).
1. Preparazione degli animali
- Pesare i topi e anestetizzarli con un'iniezione intraperitoneale di 50 mg/kg di pentobarbital sodico (vedere Tabella dei materiali). Somministrare meloxicam (5mg/kg; i.p.) per l'analgesia perioperatoria. Ospitare i topi in una gabbia con un ciclo luce/buio di 12 ore/12 ore, una temperatura ambiente di 24 °C e un'umidità relativa del 50%.
NOTA: Per il presente studio, il peso iniziale dei topi era di circa 22 g. - Rimuovere i peli sulla testa di un topo usando un rasoio per animali da laboratorio e fissare la testa e gli arti sull'apparato stereotassico (vedi Tabella dei materiali).
NOTA: Sterilizzare tutte le apparecchiature prima dell'uso. - Disinfettare la testa del topo con almeno tre cicli alternati di clorexidina o scrub povidone-iodio seguiti da alcool e coprire il topo con un drappo chirurgico sterile. Applicare unguento oftalmico su entrambi gli occhi per prevenire l'essiccazione.
- Tagliare il cuoio capelluto del topo di circa 1 cm lungo la linea mediana sulla parte superiore della fronte destra con le forbici oftalmiche.
NOTA: Confermare il piano chirurgico dell'anestesia dall'assenza di riflesso del pedale prima di effettuare l'incisione. - Sintonizzare l'apparato stereotassico per assicurarsi che la cucitura a spina di pesce e il punto della fontanella anteriore si trovino allo stesso livello.
2. Costruzione del modello ortotopico di GBM intracranico
- Segnare il punto 1 mm sul lato anteriore della fontanella anteriore, 1,8 mm sul lato destro della fontanella anteriore e 3 mm verso il basso rispetto alla fontanella anteriore usando un batuffolo di cotone imbevuto di violetto genziana2 (vedi Tabella dei materiali).
- Forare il punto utilizzando un mini trapano cranico da 1 mm di diametro (vedere la tabella dei materiali) per creare una dimensione dei pori di circa 1 mm di diametro e 1 mm di profondità.
- Rimuovere il liquido cerebrospinale essudato con un batuffolo di cotone sterile.
- Aspirare 5 μL di sospensione di cellule tumorali (GL261-Luci, 5 × 10 5 cellule sospese in5 μL di PBS) con una microsiringa.
NOTA: Il GL261-Luci è stato ottenuto da una fonte commerciale (vedi Tabella dei materiali). - Allineare verticalmente la punta dell'ago della microsiringa con il foro di perforazione del cranio, inserire fino a quando la punta dell'ago entra nel piano del cranio per 3 mm e riportare l'ago di 0,5 mm7.
- Aprire la microsiringa e iniettare con una velocità di 1 μL/min.
- Trattenere l'ago per 10 minuti dopo l'iniezione.
- Prelevare lentamente la microsiringa e premere il punto di iniezione con un batuffolo di cotone asciutto sterile.
- Suturare il cuoio capelluto con una sutura chirurgica non assorbibile (10-0, vedi Tabella dei materiali) e disinfettare nuovamente l'incisione.
- Monitorare la salute dell'animale e tenerlo in condizioni calde.
- Spostare nuovamente il mouse nella gabbia dell'alloggiamento dopo che il mouse si è risvegliato.
- Immagina il topo con un sistema di imaging bioluminescente in vivo (vedi Tabella dei materiali) per rilevare il tumore trapiantato il 10 ° giorno dopo il tumore.
NOTA: La luciferasi caricata nelle cellule GBM, GL261, è stata utilizzata per l'imaging bioluminescente.- Anestetizzare il topo con isoflurano all'1,5% con una portata di ossigeno di 0,6 L/min. Dopo aver confermato la profondità dell'anestesia attraverso la mancanza di riflesso del pedale, iniettare il topo per via intraperitoneale con fluoresceina di potassio (10 mg / ml, vedere Tabella dei materiali) e 11 s dopo, eseguire l'imaging bioluminescente in vivo . Quando il valore di fluorescenza raggiunge ~ 5 × 105, la procedura ha esito positivo.
NOTA: Anestetizzare l'animale prima dell'imaging. Mantenere l'anestesia tramite cono nasale fornito con isoflurano vaporizzato.
- Anestetizzare il topo con isoflurano all'1,5% con una portata di ossigeno di 0,6 L/min. Dopo aver confermato la profondità dell'anestesia attraverso la mancanza di riflesso del pedale, iniettare il topo per via intraperitoneale con fluoresceina di potassio (10 mg / ml, vedere Tabella dei materiali) e 11 s dopo, eseguire l'imaging bioluminescente in vivo . Quando il valore di fluorescenza raggiunge ~ 5 × 105, la procedura ha esito positivo.
- Selezionare i topi con successo il portatore tumorale per costruire il modello di post-resezione di recidiva GBM.
3. Costruzione del modello GBM relapse post-resection
- Quando la dimensione del tumore nei topi modello di GBM intracranico ortotopico diventa ~ 6,5 × 105, selezionare i topi per il modello di recidiva postoperatoria.
- Pesare i topi modello di GBM intracranico ortotopico e anestetizzare i topi con un'iniezione intraperitoneale di 50 mg / kg di pentobarbital sodico. Somministrare meloxicam (5mg/kg; i.p.) per l'analgesia perioperatoria.
- Ripetere il processo dei passaggi 1.2-1.5.
- Separare il tessuto del cuoio capelluto e il cranio e controllare il foro di perforazione utilizzato per costruire il modello ortotopico di GBM intracranico. Se il foro è guarito, identificarlo usando un apparecchio stereotassico e seguire la procedura descritta nei punti 2.1-2.3.
- Espandere il diametro del foro a 5 mm con un trapano cranico e rimuovere il liquido cerebrospinale essudato con un batuffolo di cotone sterile.
- Focalizzare il microscopio sulla testa del mouse e regolare le impostazioni per assicurarsi che il foro di perforazione si trovi al centro del campo visivo.
- Tagliare le meningi con microforbici e rimuovere parte del tessuto tumorale con una micro curette e un micro bisturi al microscopio.
NOTA: Per quanto riguarda le meningi, quando il cranio viene aperto, la sottile membrana vicino al tessuto cerebrale sono le meningi. - Fermare l'emorragia con una garza sterile e lavare l'incisione con soluzione fisiologica sterile.
- Iniettare l'idrogel disponibile in commercio (10 μL, vedere Tabella dei materiali) nella cavità di resezione con una siringa da 1 ml, suturare il cuoio capelluto con una sutura chirurgica non assorbibile (10-0) e disinfettare nuovamente l'incisione (Figura 1).
- Monitorare la salute dell'animale e tenere il mouse al caldo.
- Spostare nuovamente il mouse nella gabbia dell'alloggiamento dopo che il mouse si è risvegliato.
- Eseguire l'imaging bioluminescente in vivo per rilevare il tumore trapiantato 1 giorno dopo per quantificare la dimensione del tumore residuo (Figura 2 e Figura 3).
- Pesare i topi ogni 2 giorni fino all'endpoint terminale.
NOTA: Per il presente studio, l'endpoint terminale era il giorno 30 e i topi sono stati sottoposti a eutanasia da un sovradosaggio di pentobarbital sodico con un'iniezione intraperitoneale.
Risultati
Il processo di costruzione del modello di post-resezione di recidiva GBM è mostrato nella Figura 1. Viene mostrata la cavità di resezione dopo che il tumore è stato parzialmente rimosso al microscopio. L'idrogel è stato iniettato nella cavità di resezione con una siringa per dimostrare l'effetto terapeutico. La schedulazione del disegno sperimentale è illustrata nella Figura 2A. Dopo che le cellule GBM sono state impiantate nel cervello dei topi, la crescita del tumore è stata testata mediante imaging bioluminescente in vivo il giorno 10. La resezione è stata eseguita il giorno 11 e l'idrogel è stato quindi iniettato nella cavità di resezione. Il test di imaging bioluminescente in vivo è stato eseguito il giorno 15, il giorno 20, il giorno 25 e il giorno 30 per monitorare la crescita residua del tumore. Come mostrato in Figura 2B,C, la dimensione dei tumori nel modello post-resezione recidivante GBM era significativamente inferiore a quella nel modello ortotopico di GBM intracranico, come mostrato dal test di imaging bioluminescente in vivo. Il giorno 25, i tumori si sono ripresentati significativamente dopo la resezione (Figura 2D). La colorazione H & E ha confermato che il modello post-resezione recidivante GBM è stato costruito con successo e che i tumori residui si sono ripresentati significativamente dopo la resezione (Figura 3A, B).
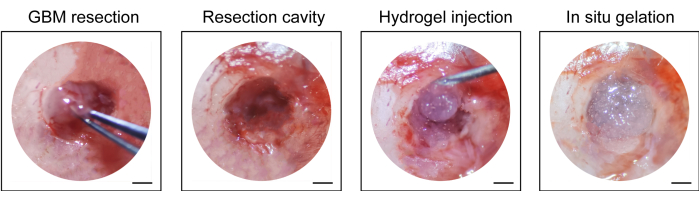
Figura 1: Vista intraoperatoria della resezione tumorale e dell'iniezione dell'idrogel. Parte del tessuto tumorale è stato rimosso con una micro curette e un micro bisturi al microscopio e l'idrogel è stato iniettato nella cavità di resezione. Barre scala: 50 μm. Questa cifra è stata modificata da Sun et al.10. Fare clic qui per visualizzare una versione ingrandita di questa figura.
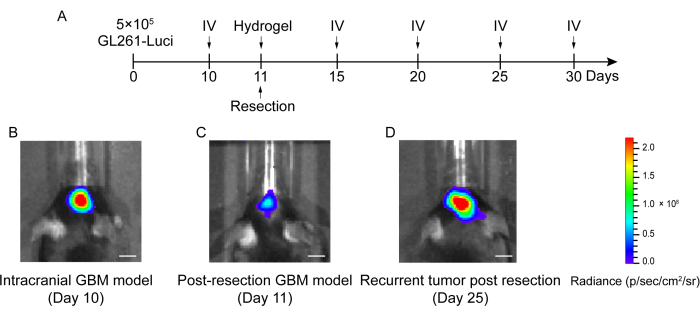
Figura 2: Schema del disegno sperimentale e dell'imaging bioluminescente in vivo di topi nel modello GBM intracranico e post-resezione. (A) Il programma del disegno sperimentale che mostra che la resezione è stata eseguita il giorno 11 e che l'imaging bioluminescente in vivo (IV) è stato eseguito il giorno 10, giorno 15, giorno 20, giorno 25 e giorno 30. (B) I topi modello GBM intracranico hanno mostrato una grande dimensione del tumore il giorno 10, (C) la dimensione del tumore è stata significativamente ridotta dopo la resezione il giorno 11 e (D) la dimensione del tumore è aumentata dopo la resezione il giorno 25 nel modello GBM post-resezione. Il gruppo di controllo ha incluso topi modello post-resezione recidivante GBM senza trattamento. Un totale di 42 topi sono stati utilizzati in questo studio. Barre scala: 100 μm. Questa cifra è stata modificata da Sun et al.10. Fare clic qui per visualizzare una versione ingrandita di questa figura.
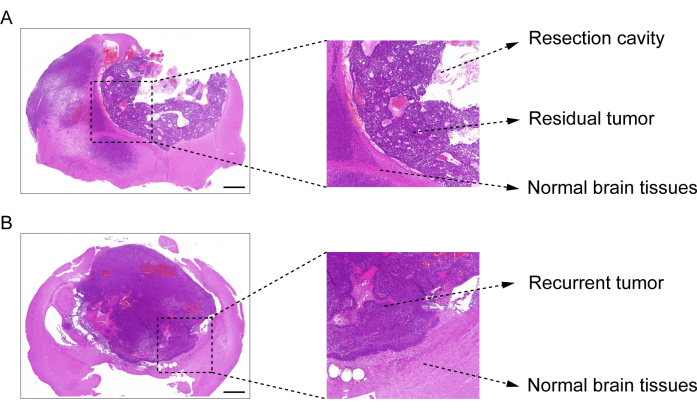
Figura 3: Immagine di colorazione H&E del tessuto cerebrale dal modello GBM post-resezione. (A) Un'immagine di colorazione H&E che dimostra la cavità di resezione, il tumore residuo e il tessuto cerebrale normale. Il tessuto cerebrale è stato raccolto 1 giorno dopo la resezione. (B) Un'immagine di colorazione H & E che dimostri il tumore ricorrente e il tessuto cerebrale normale. Il tessuto cerebrale è stato raccolto il giorno 12 dopo la resezione. Barre scala: 100 μm. Questa cifra è stata modificata da Sun et al.10. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
La chirurgia rimane la prima scelta per la maggior parte dei pazienti GBM11. A causa della caratteristica di crescita invasiva del GBM, un piccolo numero di cellule tumorali rimane ancora dopo tecniche micro neurochirurgiche, con conseguente eventuale recidiva del tumore12. Come inibire la recidiva di GBM dopo l'intervento chirurgico è diventato il fulcro della ricerca relativa al GBM. Tuttavia, a causa della complessa struttura anatomica del tessuto cerebrale, la costruzione di un idoneo modello postoperatorio di GBM è diventato il problema primario da risolvere in questo campo.
Questo studio ha sviluppato un modello post-resezione di recidiva GBM. Nel processo di costruzione di questo modello, la costruzione del modello ortotopico di GBM intracranico è fondamentale. Dopo che questo modello è stato sviluppato con successo, la resezione deve essere eseguita al momento giusto. Il momento raccomandato è quando il valore di fluorescenza della dimensione del tumore è di circa 6,5 × 105. Per ridurre la mortalità dei topi, la resezione in anestesia è stata eseguita con 40 mg/kg di pentobarbital sodico all'1% mediante iniezione intraperitoneale. Tuttavia, la resezione era difficile da eseguire e i topi spesso si muovevano a causa della piccola dose di anestetico. Su questa base, la dose dell'anestetico è stata aumentata a 50 mg/kg. Dopo aver aumentato la dose di anestetico, le risposte intraoperatorie dei topi sono scomparse e la resezione è stata eseguita con successo. Anche il gas isoflurano può essere utilizzato in questo protocollo.
In questo studio, le cellule GL261-Luci sono state utilizzate per sviluppare il modello; pertanto, è necessario utilizzare più linee cellulari GBM per convalidare il protocollo in futuro. Per rendere il protocollo più convincente, è necessario utilizzare vari modelli di mouse GBM, come i modelli di mouse GBM geneticamente modificati. Inoltre, la risonanza magnetica può essere il mezzo migliore per rilevare la recidiva dei tumori dopo l'intervento chirurgico.
In sintesi, in questo lavoro, è stato sviluppato un modello post-resezione di recidiva GBM. In questo modello, la recidiva del tumore viene monitorata valutando la crescita del tumore residuo dopo la resezione. Sebbene questo modello non possa essere considerato imitare completamente la recidiva del tumore, lo stile di resezione in questo modello è simile allo standard della chirurgia massimamente sicura nel trattamento clinico dei pazienti con GBM. Questo lavoro fornisce un metodo conveniente e fattibile per costruire il modello di post-resezione di recidiva GBM e rappresenta un progresso nel campo della ricerca sulla post-resezione di recidiva GBM.
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni di progetto della National Natural Science Foundation of China (82071767 e 82171781).
Materiali
| Name | Company | Catalog Number | Comments |
| Gentian violet | Sigma | C6158 | |
| GL261-Luci | Shanghai Zhong Qiao Xin Zhou Biotechnology Co.,Ltd. | ZQ0932 | |
| In vivo bioluminescent imaging system | Tanon | Tanon ABL X6 | |
| Laboratory animal shaver | Beyotime Biotechnology | FS600 | |
| Mice | Beijing Vital River Laboratory Animal Technology Co., Ltd. | ||
| Micro curette | Belevor Medical Co.,Ltd. | ||
| Micro scalpel | Belevor Medical Co.,Ltd. | ||
| Microscope | Shanghai Xiangfan Instrument Co., Ltd | JSZ5A/B | |
| Microsyringe | Hamilton | 87943 | |
| Mini cranial drill | RWD | 78001 | |
| Nonabsorbable surgical suture | Shanghai Yuyan Instruments Co.,Ltd. | ||
| Pentobarbital sodium | ChemSrc | 57-33-0 | |
| PVA-TSPBA hydrogel | Aladdin | 9002-89-5 | |
| Stereotaxic apparatus | RWD | 68043 |
Riferimenti
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews Clinical Oncology. 15 (7), 422-442 (2018).
- Wang, X., et al. In situ targeting nanoparticles-hydrogel hybrid system for combined chemo-immunotherapy of glioma. Journal of Controlled Release. 345, 786-797 (2022).
- Binder, Z. A., O'Rourke, D. M. Glioblastoma: The current state of biology and therapeutic strategies. Cancer Research. 82 (5), 769-772 (2022).
- Kauer, T. M., Figueiredo, J. L., Hingtgen, S., Shah, K. Encapsulated therapeutic stem cells implanted in the tumor resection cavity induce cell death in gliomas. Nature Neuroscience. 15 (2), 197-204 (2011).
- Jiang, X., et al. Nanoparticle engineered TRAIL-overexpressing adipose-derived stem cells target and eradicate glioblastoma via intracranial delivery. Proceedings of the National Academy of Sciences of the United States of America. 113 (48), 13857-13862 (2016).
- Quail, D. F., Joyce, J. A. The microenvironmental landscape of brain tumors. Cancer Cell. 31 (3), 326-341 (2017).
- Zhang, J., et al. Immunostimulant hydrogel for the inhibition of malignant glioma relapse post-resection. Nature Nanotechnology. 16 (5), 538-548 (2021).
- Ruan, H., et al. A dual-bioresponsive drug-delivery depot for combination of epigenetic modulation and immune checkpoint blockade. Advanced Materials. 31 (17), 1806957 (2019).
- Louveau, A., et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 523 (7560), 337-341 (2015).
- Sun, S., et al. Immunostimulant in situ hydrogel improves synergetic radioimmunotherapy of malignant glioblastoma relapse post-resection. Advanced Functional Materials. 32 (43), 2205038 (2022).
- Liu, D. K., Sulman, E. P., Wen, P. Y., Kurz, S. C. Novel therapies for glioblastoma. Current Neurology and Neuroscience Reports. 20 (7), 19 (2020).
- Mellinghoff, I. K., Cloughesy, T. F. Balancing risk and efficiency in drug development for rare and challenging tumors: A new paradigm for glioma. Journal of Clinical Oncology. 40 (30), 3510-3519 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon