Method Article
Пострезекционная модель рецидива глиобластомы для терапевтических гидрогелевых исследований
* Эти авторы внесли равный вклад
В этой статье
Резюме
Настоящий протокол устанавливает модель рецидива глиобластомы (ГБМ) после резекции с использованием микроскопии для изучения терапевтического эффекта инъекционного биочувствительного гидрогеля in vivo.
Аннотация
Рецидив опухоли является важным фактором, указывающим на неблагоприятный прогноз при глиобластоме (ГБМ). Во многих исследованиях предпринимаются попытки определить эффективные терапевтические стратегии для предотвращения рецидива ГБМ после операции. Биочувствительные терапевтические гидрогели, способные поддерживать местное высвобождение лекарственных средств, часто используются для местного лечения ГБМ после операции. Тем не менее, исследования ограничены из-за отсутствия подходящей модели пострезекционного рецидива ГБМ. Здесь была разработана модель пострезекционного рецидива GBM, которая была применена в терапевтических гидрогелевых исследованиях. Данная модель была построена на основе ортотопической внутричерепной модели GBM, которая широко используется в исследованиях GBM. Субтотальная резекция выполнялась на ортотопической внутричерепной модели GBM мыши для имитации клинического лечения. Остаточная опухоль использовалась для определения размера опухолевого роста. Эта модель проста в построении, может лучше имитировать ситуацию хирургической резекции ГБМ и может быть применена в различных исследованиях по местному лечению рецидива ГБМ после резекции. В результате, модель пострезекционного рецидива ГБМ обеспечивает уникальную модель рецидива ГБМ для эффективных локальных исследований лечения рецидива после резекции.
Введение
Глиобластома (ГБМ) является наиболее распространенной злокачественной опухолью среди всех видов рака центральной нервной системы 1,2. Хирургическое вмешательство является лечением первой линии для пациентов с ГБМ, а химиолучевая терапия является основным адъювантным лечением после операции. Однако рецидив опухоли часто развивается в течение 3-6 месяцев у большинства пациентов с ГБМ при различных методах лечения 3,4,5. Следовательно, существует острая необходимость в разработке более эффективных стратегий лечения для предотвращения рецидива ГБМ.
Недавние исследования ГБМ в основном были сосредоточены на первичных опухолях, а не на рецидивирующих опухолях6. Однако самая распространенная проблема, которую необходимо решить в клинике, заключается в том, как затормозить рецидив ГБМ после операции. Поэтому исследования рецидива ГБМ после операции требуют большего внимания. Биочувствительные терапевтические гидрогели являются наиболее распространенным вектором, используемым в исследованиях рецидива опухоли после операции 7,8. Однако из-за особого строения центральной нервной системы трудно разработать подходящую модель рецидива ГБМ после резекции9, что имеет решающее значение для изучения рецидива ГБМ.
В этом исследовании была создана улучшенная модель пострезекционного рецидива ГБМ, основанная на ортотопической внутричерепной модели ГБМ, используемой в исследованиях первичного ГБМ. В этой модели большинство опухолей удаляются хирургическим путем с помощью микроскопии, а остаточная опухоль обнаруживается с помощью биолюминесцентной визуализации in vivo и окрашивания гематоксилином и эозином (H&E). Эта модель имитирует состояние резекции пациентов с опухолями головного мозга и может быть использована в различных исследованиях рецидива ГБМ.
протокол
Все эксперименты на животных были одобрены и контролировались Институциональным наблюдательным советом и Комитетом по этике животных Нанкинского медицинского университета (IACUC-1904004). Для настоящего исследования были использованы самки мышей C57BL/6J в возрасте 6-8 недель. Животные были получены из коммерческого источника (см. Таблицу материалов).
1. Подготовка животных
- Взвесьте мышей и обезболивайте их внутрибрюшинной инъекцией пентобарбитала натрия в дозе 50 мг/кг (см. таблицу материалов). Назначают мелоксикам (5 мг/кг; в/в) для периоперационной анальгезии. Содержате мышей в клетке в течение 12 часов/12 часов в свете/темноте, температуре окружающей среды 24 °C и относительной влажности 50%.
Примечание: В данном исследовании первоначальный вес мышей составлял около 22 г. - Удалите волосы на голове мыши с помощью бритвы для лабораторных животных, а голову и конечности зафиксируйте на стереотаксическом аппарате (см. таблицу материалов).
ПРИМЕЧАНИЕ: Стерилизуйте все оборудование перед использованием. - Продезинфицируйте голову мыши не менее чем тремя чередующимися циклами хлоргексидина или повидон-йодного скраба с последующим употреблением спирта и накройте мышь стерильной хирургической простыней. Нанесите офтальмологическую мазь на оба глаза, чтобы предотвратить пересыхание.
- Обрежьте офтальмологическими ножницами кожу головы мыши примерно на 1 см по средней линии на верхней части правого лба.
ПРИМЕЧАНИЕ: Перед выполнением разреза подтвердите хирургическую плоскость анестезии отсутствием педального рефлекса. - Настройте стереотаксический аппарат так, чтобы шов «елочка» и передняя родничковая точка располагались на одном уровне.
2. Построение ортотопической внутричерепной модели GBM
- Отметьте точку на расстоянии 1 мм от передней стороны переднего родничка, 1,8 мм от правой стороны переднего родничка и 3 мм вниз от переднего родничка с помощью ватного тампона, смоченного горечавкой фиолетовой2 (см. Таблицу материалов).
- Просверлите острие с помощью мини-краниального сверла диаметром 1 мм (см. Таблицу материалов), чтобы создать поры диаметром около 1 мм и глубиной 1 мм.
- Удалите выделившуюся спинномозговую жидкость стерильным ватным тампоном.
- Аспират 5 мкл суспензии опухолевых клеток (GL261-Luci, 5 × 105 клеток, взвешенных в 5 мкл PBS) с помощью микрошприца.
ПРИМЕЧАНИЕ: GL261-Luci был получен из коммерческого источника (см. Таблицу материалов). - Совместите кончик иглы микрошприца вертикально с отверстием для сверления черепа, вводите до тех пор, пока кончик иглы не войдет в плоскость черепа на 3 мм, и верните иглу на 0,5 мм7.
- Откройте микрошприц и введите со скоростью 1 мкл/мин.
- Держите иглу в течение 10 минут после инъекции.
- Медленно извлеките микрошприц и прижмите место инъекции стерильным сухим ватным тампоном.
- Зашить кожу головы нерассасывающимся хирургическим швом (10-0, см. Таблицу материалов) и снова продезинфицировать разрез.
- Следите за здоровьем животного, и держите его в теплых условиях.
- Переместите мышь обратно в клетку корпуса после того, как мышь проснется.
- Визуализируйте мышь с помощью биолюминесцентной системы визуализации in vivo (см. таблицу материалов) для обнаружения трансплантированной опухоли на 10-й день после носительства опухоли.
ПРИМЕЧАНИЕ: Люцифераза, загруженная в клетки GBM, GL261, была использована для биолюминесцентной визуализации.- Обезболить мышь 1,5% изофлураном со скоростью потока кислорода 0,6 л/мин. После подтверждения глубины анестезии из-за отсутствия педального рефлекса мышь внутрибрюшинно вводят флуоресцеин калия (10 мг/мл, см. таблицу материалов) и через 11 с проводят биолюминесцентную визуализацию in vivo . Когда значение флуоресценции достигает ~5 × 105, процедура проходит успешно.
ПРИМЕЧАНИЕ: Обезболивайте животное перед визуализацией. Поддерживайте анестезию через носовой конус, снабженный испаренным изофлураном.
- Обезболить мышь 1,5% изофлураном со скоростью потока кислорода 0,6 л/мин. После подтверждения глубины анестезии из-за отсутствия педального рефлекса мышь внутрибрюшинно вводят флуоресцеин калия (10 мг/мл, см. таблицу материалов) и через 11 с проводят биолюминесцентную визуализацию in vivo . Когда значение флуоресценции достигает ~5 × 105, процедура проходит успешно.
- Выберите мышей с успешным опухоленосительством для построения модели пострезекционного рецидива GBM.
3. Построение пострезекционной модели рецидива ГБМ
- Когда размер опухоли у ортотопических внутричерепных мышей модели GBM станет ~6,5 × 105, выберите мышей для модели послеоперационного рецидива.
- Взвесьте ортотопических внутричерепных мышей модели GBM и обезболивайте мышей внутрибрюшинной инъекцией пентобарбитала натрия в дозе 50 мг/кг. Назначают мелоксикам (5 мг/кг; в/в) для периоперационной анальгезии.
- Повторите процесс шагов 1.2−1.5.
- Отделите ткани волосистой части головы и черепа и проверьте отверстие, используемое для построения ортотопической внутричерепной модели GBM. Если отверстие зажило, определите отверстие с помощью стереотаксического аппарата и выполните процедуру, описанную в шагах 2.1-2.3.
- Увеличьте диаметр отверстия до 5 мм с помощью черепной дрели и удалите выделяющуюся спинномозговую жидкость стерильным ватным тампоном.
- Наведите микроскоп на голову мыши и отрегулируйте настройки так, чтобы отверстие для сверления находилось в центре поля зрения.
- Микроножницами разрезать мозговые оболочки, а микрокюреткой и микроскальпелем удалить часть опухолевой ткани под микроскопом.
ПРИМЕЧАНИЕ: Что касается мозговых оболочек, когда череп открыт, тонкая мембрана, расположенная близко к мозговой ткани, является мозговой оболочкой. - Остановите кровотечение стерильной марлей, а разрез промойте стерильным физиологическим раствором.
- Шприц объемом 1 мл вводят имеющийся в продаже гидрогель (10 мкл, см. Таблицу материалов) в полость резекции, зашивают кожу головы нерассасывающимся хирургическим шовным материалом (10-0) и снова дезинфицируют разрез (рисунок 1).
- Следите за здоровьем животного и держите мышь в тепле.
- Переместите мышь обратно в клетку корпуса после того, как мышь проснется.
- Выполните биолюминесцентную визуализацию in vivo для обнаружения трансплантированной опухоли через 1 день для количественной оценки размера остаточной опухоли (Рисунок 2 и Рисунок 3).
- Взвешивайте мышей каждые 2 дня до конечной точки.
Примечание: В настоящем исследовании терминальная конечная точка была на 30-й день, и мышей усыпляли передозировкой пентобарбитала натрия с внутрибрюшинной инъекцией.
Результаты
Процесс построения пострезекционной модели рецидива ГБМ показан на рисунке 1. Показана резекционная полость после частичного удаления опухоли под микроскопией. Гидрогель вводили в резекционную полость шприцем для демонстрации терапевтического эффекта. График проведения эксперимента представлен на рисунке 2А. После того, как клетки GBM были имплантированы в мозг мышей, рост опухоли был проверен с помощью биолюминесцентной визуализации in vivo на 10-й день. Резекция проводилась на 11-е сутки, после чего гидрогель вводился в полость резекции. Биолюминесцентное визуализирующее тестирование in vivo проводили на 15-й, 20-й, 25-й и 30-й день для мониторинга остаточного роста опухоли. Как показано на рисунке 2B, C, размер опухолей в модели рецидива после резекции GBM был значительно меньше, чем в модели ортотопической внутричерепной GBM, как показано при тестировании биолюминесцентной визуализации in vivo . На 25-е сутки опухоли значительно рецидивировали после резекции (рис. 2D). Окрашивание H&E подтвердило, что модель пострезекционного рецидива GBM была успешно построена и что остаточные опухоли значительно рецидивировали после резекции (рис. 3A, B).
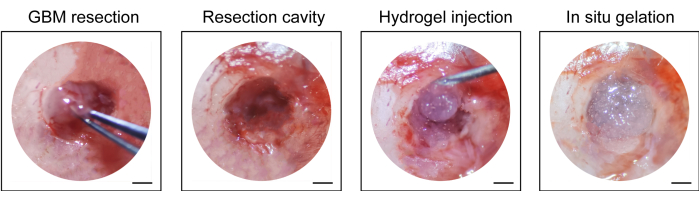
Рисунок 1: Интраоперационный вид резекции опухоли и введения гидрогеля. Часть опухолевой ткани удаляли микрокюреткой и микроскальпелем под микроскопом, а в полость резекции вводили гидрогель. Масштабные линейки: 50 мкм. Эта цифра была изменена по данным Sun et al.10. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
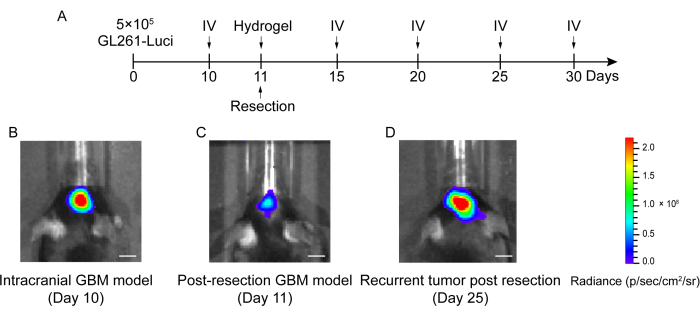
Рисунок 2: График экспериментального дизайна и биолюминесцентной визуализации in vivo мышей в модели интракраниальной и пострезекционной GBM. (A) График экспериментального плана, показывающий, что резекция была выполнена на 11-й день, а биолюминесцентная визуализация in vivo (IV) была выполнена на 10-й, 15-й, 20-й, 25-й и 30-й день. (B) Внутричерепные мыши с моделью GBM показали большой размер опухоли на 10-й день, (C) размер опухоли был значительно уменьшен после резекции на 11-й день, и (D) размер опухоли увеличился после резекции на 25-й день в пострезекционной модели GBM. Контрольная группа включала мышей с пострезекционной моделью ГБМ без лечения. Всего в этом исследовании было использовано 42 мыши. Масштабные линейки: 100 мкм. Эта цифра была изменена по данным Sun et al.10. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
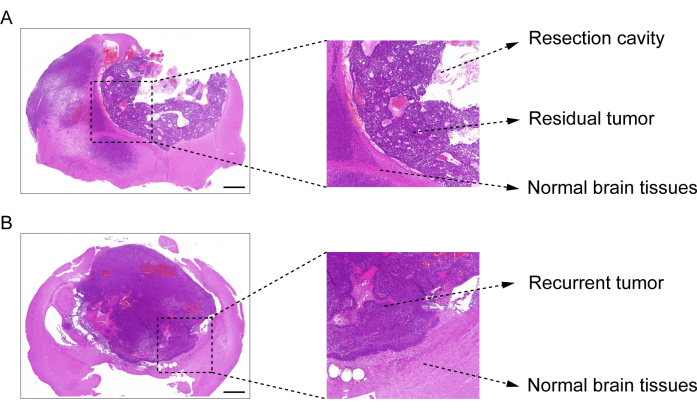
Рисунок 3: Изображение ткани головного мозга с окрашиванием H&E из пострезекционной модели GBM. (A) Изображение с окрашиванием H&E, демонстрирующее резекционную полость, остаточную опухоль и нормальную ткань мозга. Ткань головного мозга собирали через 1 сутки после резекции. (Б) Изображение H&E, демонстрирующее рецидивирующую опухоль и нормальную ткань головного мозга. Ткань головного мозга собирали на 12-е сутки после резекции. Масштабные линейки: 100 мкм. Эта цифра была изменена по данным Sun et al.10. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Обсуждение
Хирургическое вмешательство остается первым выбором для большинства пациентов с ГБМ11. Из-за характерной для инвазивного роста ГБМ небольшое количество опухолевых клеток все еще остается после микронейрохирургических методов, что приводит к возможному рецидиву опухоли12. Вопрос о том, как подавить рецидив GBM после операции, стал предметом исследований, связанных с GBM. Однако из-за сложного анатомического строения тканей головного мозга первостепенной задачей, требующей решения в этой области, стало построение подходящей послеоперационной модели GBM.
В этом исследовании была разработана модель рецидива ГБМ после резекции. В процессе построения этой модели решающее значение имеет построение ортотопической внутричерепной модели GBM. После того, как эта модель была успешно разработана, резекция должна быть выполнена в нужное время. Рекомендуемое время – когда значение флуоресценции размера опухоли составляет около 6,5 × 105. Для снижения смертности мышей резекцию под наркозом проводили внутрибрюшинным введением 40 мг/кг 1% пентобарбитала натрия. Однако резекцию было сложно выполнить, и мыши часто двигались из-за малой дозы анестетика. Исходя из этого, доза анестетика была увеличена до 50 мг/кг. После увеличения дозы анестетика интраоперационные реакции мышей исчезли, и резекция была выполнена успешно. В этом протоколе также может быть использован газ изофлуран.
В этом исследовании для разработки модели были использованы клетки GL261-Luci; поэтому для валидации протокола в будущем необходимо использовать больше клеточных линий GBM. Чтобы сделать протокол более убедительным, необходимо использовать различные модели мышей GBM, такие как генетически модифицированные модели мышей GBM. Кроме того, МРТ может быть лучшим средством для выявления рецидивов опухолей после операции.
Таким образом, в данной работе была разработана пострезекционная модель рецидива ГБМ. В этой модели рецидив опухоли контролируется путем оценки роста остаточной опухоли после резекции. Несмотря на то, что эта модель не может полностью имитировать рецидив опухоли, стиль резекции в этой модели аналогичен стандарту максимально безопасной хирургии в клиническом лечении пациентов с ГБМ. Данная работа представляет собой удобный и осуществимый метод построения пострезекционной модели рецидива ГБМ и представляет собой прогресс в области исследований пострезекционного рецидива ГБМ.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Работа выполнена при поддержке грантов Национального фонда естественных наук Китая (82071767 и 82171781).
Материалы
| Name | Company | Catalog Number | Comments |
| Gentian violet | Sigma | C6158 | |
| GL261-Luci | Shanghai Zhong Qiao Xin Zhou Biotechnology Co.,Ltd. | ZQ0932 | |
| In vivo bioluminescent imaging system | Tanon | Tanon ABL X6 | |
| Laboratory animal shaver | Beyotime Biotechnology | FS600 | |
| Mice | Beijing Vital River Laboratory Animal Technology Co., Ltd. | ||
| Micro curette | Belevor Medical Co.,Ltd. | ||
| Micro scalpel | Belevor Medical Co.,Ltd. | ||
| Microscope | Shanghai Xiangfan Instrument Co., Ltd | JSZ5A/B | |
| Microsyringe | Hamilton | 87943 | |
| Mini cranial drill | RWD | 78001 | |
| Nonabsorbable surgical suture | Shanghai Yuyan Instruments Co.,Ltd. | ||
| Pentobarbital sodium | ChemSrc | 57-33-0 | |
| PVA-TSPBA hydrogel | Aladdin | 9002-89-5 | |
| Stereotaxic apparatus | RWD | 68043 |
Ссылки
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews Clinical Oncology. 15 (7), 422-442 (2018).
- Wang, X., et al. In situ targeting nanoparticles-hydrogel hybrid system for combined chemo-immunotherapy of glioma. Journal of Controlled Release. 345, 786-797 (2022).
- Binder, Z. A., O'Rourke, D. M. Glioblastoma: The current state of biology and therapeutic strategies. Cancer Research. 82 (5), 769-772 (2022).
- Kauer, T. M., Figueiredo, J. L., Hingtgen, S., Shah, K. Encapsulated therapeutic stem cells implanted in the tumor resection cavity induce cell death in gliomas. Nature Neuroscience. 15 (2), 197-204 (2011).
- Jiang, X., et al. Nanoparticle engineered TRAIL-overexpressing adipose-derived stem cells target and eradicate glioblastoma via intracranial delivery. Proceedings of the National Academy of Sciences of the United States of America. 113 (48), 13857-13862 (2016).
- Quail, D. F., Joyce, J. A. The microenvironmental landscape of brain tumors. Cancer Cell. 31 (3), 326-341 (2017).
- Zhang, J., et al. Immunostimulant hydrogel for the inhibition of malignant glioma relapse post-resection. Nature Nanotechnology. 16 (5), 538-548 (2021).
- Ruan, H., et al. A dual-bioresponsive drug-delivery depot for combination of epigenetic modulation and immune checkpoint blockade. Advanced Materials. 31 (17), 1806957 (2019).
- Louveau, A., et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 523 (7560), 337-341 (2015).
- Sun, S., et al. Immunostimulant in situ hydrogel improves synergetic radioimmunotherapy of malignant glioblastoma relapse post-resection. Advanced Functional Materials. 32 (43), 2205038 (2022).
- Liu, D. K., Sulman, E. P., Wen, P. Y., Kurz, S. C. Novel therapies for glioblastoma. Current Neurology and Neuroscience Reports. 20 (7), 19 (2020).
- Mellinghoff, I. K., Cloughesy, T. F. Balancing risk and efficiency in drug development for rare and challenging tumors: A new paradigm for glioma. Journal of Clinical Oncology. 40 (30), 3510-3519 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены