Method Article
Glioblastom-Rezidiv-Post-Resektionsmodell für therapeutische Hydrogel-Untersuchungen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll etabliert ein Glioblastom (GBM) Rezidivmodell nach Resektion unter Verwendung von Mikroskopie, um die therapeutische Wirkung eines injizierbaren, bioresponsiven Hydrogels in vivo zu untersuchen.
Zusammenfassung
Das Tumorrezidiv ist ein wichtiger Faktor, der auf eine schlechte Prognose beim Glioblastom (GBM) hinweist. Viele Studien versuchen, wirksame therapeutische Strategien zu identifizieren, um das Wiederauftreten von GBM nach einer Operation zu verhindern. Bioresponsive therapeutische Hydrogele, die in der Lage sind, lokal freigesetzte Medikamente aufrechtzuerhalten, werden häufig für die lokale Behandlung von GBM nach Operationen eingesetzt. Die Forschung ist jedoch aufgrund des Fehlens eines geeigneten GBM-Rezidiv-Post-Resektionsmodells begrenzt. Hier wurde ein GBM-Rezidiv-Post-Resektionsmodell entwickelt und in therapeutischen Hydrogel-Untersuchungen eingesetzt. Dieses Modell wurde auf der Grundlage des orthotopen intrakraniellen GBM-Modells konstruiert, das in Studien zum GBM weit verbreitet ist. Eine subtotale Resektion wurde an der orthotopen intrakraniellen GBM-Modellmaus durchgeführt, um die klinische Behandlung nachzuahmen. Der Resttumor wurde verwendet, um die Größe des Tumorwachstums anzuzeigen. Dieses Modell ist einfach zu erstellen, kann die Situation der chirurgischen GBM-Resektion besser nachahmen und kann in verschiedenen Studien zur lokalen Behandlung von GBM-Rezidiven nach Resektion angewendet werden. Infolgedessen bietet das GBM-Rezidivmodell nach Resektion ein einzigartiges GBM-Rezidivmodell für effektive lokale Behandlungsstudien von Rezidiven nach Resektion.
Einleitung
Das Glioblastom (GBM) ist der häufigste bösartige Tumor unter allen Krebserkrankungen des Zentralnervensystems 1,2. Die Operation ist die Erstlinienbehandlung für Patienten mit GBM, und die Radiochemotherapie ist die wichtigste adjuvante Behandlung nach der Operation. Bei den meisten GBM-Patienten mit verschiedenen Behandlungen entwickelt sich jedoch häufig innerhalb von 3-6 Monatenein Tumorrezidiv 3,4,5. Daher besteht ein dringender Bedarf, effektivere Behandlungsstrategien zu entwickeln, um ein Wiederauftreten des GBM zu verhindern.
Neuere Studien zu GBM haben sich hauptsächlich auf Primärtumoren und nicht auf rezidivierende Tumoren konzentriert6. Das häufigste Problem, das in der Klinik gelöst werden muss, ist jedoch, wie das Wiederauftreten von GBM nach der Operation gehemmt werden kann. Daher muss der Erforschung des Wiederauftretens von GBM nach einer Operation mehr Aufmerksamkeit geschenkt werden. Bioresponsive therapeutische Hydrogele sind der häufigste Vektor, der in Studien zum Tumorrezidiv nach einer Operation verwendet wird 7,8. Aufgrund der besonderen Struktur des zentralen Nervensystems ist es jedoch schwierig, ein geeignetes GBM-Rezidiv-Post-Resektionsmodell9 zu entwickeln, das für die Untersuchung des GBM-Rezidivs entscheidend ist.
Diese Studie hat ein verbessertes GBM-Rezidiv-Post-Resektionsmodell hervorgebracht, das auf dem orthotopen intrakraniellen GBM-Modell basiert, das in der Forschung zum primären GBM verwendet wird. In diesem Modell werden die meisten Tumore durch eine Operation mit Mikroskopie entfernt, und der verbleibende Tumor wird durch in vivo Biolumineszenz-Bildgebung und Hämatoxylin- und Eosinfärbung (H&E) nachgewiesen. Dieses Modell ahmt den Resektionszustand von Hirntumorpatienten nach und kann in verschiedenen Studien zum GBM-Rezidiv eingesetzt werden.
Protokoll
Alle Tierversuche wurden vom Institutional Review Board und der Tierethikkommission der Nanjing Medical University genehmigt und überwacht (IACUC-1904004). Für die vorliegende Studie wurden weibliche C57BL/6J-Mäuse im Alter von 6-8 Wochen verwendet. Die Tiere stammten aus einer kommerziellen Quelle (siehe Materialtabelle).
1. Zubereitung von Tieren
- Wiegen Sie die Mäuse und betäuben Sie sie mit einer intraperitonealen Injektion von 50 mg/kg Pentobarbital-Natrium (siehe Materialtabelle). Verabreichen Sie Meloxicam (5 mg/kg; i.p.) zur perioperativen Analgesie. Halten Sie die Mäuse in einem Käfig bei einem Hell-Dunkel-Zyklus von 12 h/12 h, einer Umgebungstemperatur von 24 °C und einer relativen Luftfeuchtigkeit von 50 %.
ANMERKUNG: Für die vorliegende Studie betrug das Anfangsgewicht der Mäuse etwa 22 g. - Entfernen Sie die Haare auf dem Kopf einer Maus mit einem Laborrasierer und fixieren Sie den Kopf und die Gliedmaßen auf dem stereotaktischen Apparat (siehe Materialtabelle).
HINWEIS: Sterilisieren Sie alle Geräte vor dem Gebrauch. - Desinfizieren Sie den Kopf der Maus mit mindestens drei abwechselnden Runden Chlorhexidin- oder Povidon-Jod-Peeling, gefolgt von Alkohol, und bedecken Sie die Maus mit einem sterilen OP-Tuch. Tragen Sie Augensalbe auf beide Augen auf, um ein Austrocknen zu verhindern.
- Schneiden Sie die Kopfhaut der Maus mit einer Augenschere ca. 1 cm entlang der Mittellinie oben auf der rechten Stirn ab.
HINWEIS: Bestätigen Sie die chirurgische Ebene der Anästhesie durch das Fehlen eines Pedalreflexes, bevor Sie den Schnitt vornehmen. - Stimmen Sie den stereotaktischen Apparat so ab, dass sich die Fischgrätnaht und die vordere Fontanelle-Spitze auf gleicher Höhe befinden.
2. Aufbau des orthotopen intrakraniellen GBM-Modells
- Markieren Sie den Punkt 1 mm von der Vorderseite der vorderen Fontanelle, 1,8 mm von der rechten Seite der vorderen Fontanelle und 3 mm von der vorderen Fontanelle entfernt mit einem Wattestäbchen, das mit Enzianviolett2 getaucht ist (siehe Materialtabelle).
- Bohren Sie die Spitze mit einem Mini-Schädelbohrer mit einem Durchmesser von 1 mm (siehe Materialtabelle), um eine Porengröße von etwa 1 mm Durchmesser und 1 mm Tiefe zu erhalten.
- Entfernen Sie die ausgeschiedene Zerebrospinalflüssigkeit mit einem sterilen Wattestäbchen.
- 5 μl Tumorzellsuspension (GL261-Luci, 5 × 10 5 Zellen, suspendiert in5 μl PBS) mit einer Mikrospritze absaugen.
HINWEIS: Der GL261-Luci wurde aus einer kommerziellen Quelle bezogen (siehe Materialtabelle). - Richten Sie die Nadelspitze der Mikrospritze senkrecht auf das Schädelbohrloch aus, führen Sie sie ein, bis die Nadelspitze 3 mm lang in die Schädelebene eindringt, und führen Sie die Nadel um 0,5 mm zurück7.
- Öffnen Sie die Mikrospritze und injizieren Sie mit einer Geschwindigkeit von 1 μl/min.
- Halten Sie die Nadel nach der Injektion 10 Minuten lang zurück.
- Ziehen Sie die Mikrospritze langsam zurück und drücken Sie mit einem sterilen, trockenen Wattebausch auf die Injektionsstelle.
- Vernähen Sie die Kopfhaut mit einem nicht resorbierbaren chirurgischen Nahtmaterial (10-0, siehe Materialtabelle) und desinfizieren Sie den Schnitt erneut.
- Überwachen Sie die Gesundheit des Tieres und halten Sie es unter warmen Bedingungen.
- Bewegen Sie die Maus nach dem Aufwachen zurück in den Gehäusekäfig.
- Die Maus wird mit einem biolumineszierenden In-vivo-Bildgebungssystem (siehe Materialtabelle) abgebildet, um den transplantierten Tumor am 10. Tag nach der Tumortragung zu erkennen.
HINWEIS: Die in den GBM-Zellen geladene Luciferase, GL261, wurde für die biolumineszierende Bildgebung verwendet.- Betäuben Sie die Maus mit 1,5 % Isofluran mit einer Sauerstoffflussrate von 0,6 l/min. Nachdem die Anästhesietiefe durch fehlenden Pedalreflex bestätigt wurde, injizieren Sie der Maus intraperitoneal Kaliumfluorescein (10 mg/ml, siehe Materialtabelle) und führen Sie 11 s später die biolumineszierende In-vivo-Bildgebung durch. Wenn der Fluoreszenzwert ~5 × 105 erreicht, ist das Verfahren erfolgreich.
HINWEIS: Betäuben Sie das Tier vor der Bildgebung. Halten Sie die Anästhesie über einen Nasenkonus aufrecht, der mit verdampftem Isofluran versorgt wird.
- Betäuben Sie die Maus mit 1,5 % Isofluran mit einer Sauerstoffflussrate von 0,6 l/min. Nachdem die Anästhesietiefe durch fehlenden Pedalreflex bestätigt wurde, injizieren Sie der Maus intraperitoneal Kaliumfluorescein (10 mg/ml, siehe Materialtabelle) und führen Sie 11 s später die biolumineszierende In-vivo-Bildgebung durch. Wenn der Fluoreszenzwert ~5 × 105 erreicht, ist das Verfahren erfolgreich.
- Wählen Sie die Mäuse mit erfolgreicher Tumorträchtigkeit aus, um das GBM-Rezidivmodell nach der Resektion zu konstruieren.
3. Aufbau des GBM-Rezidiv-Post-Resektionsmodells
- Wenn die Tumorgröße in den orthotopen intrakraniellen GBM-Modellmäusen ~6,5 × 105 beträgt, wählen Sie die Mäuse für das postoperative Rezidivmodell aus.
- Wiegen Sie die orthotopen intrakraniellen GBM-Modellmäuse und betäuben Sie die Mäuse mit einer intraperitonealen Injektion von 50 mg/kg Pentobarbitalnatrium. Verabreichen Sie Meloxicam (5 mg/kg; i.p.) zur perioperativen Analgesie.
- Wiederholen Sie den Vorgang der Schritte 1.2−1.5.
- Trennen Sie das Kopfhautgewebe und den Schädel und überprüfen Sie das Bohrloch, das zur Erstellung des orthotopen intrakraniellen GBM-Modells verwendet wurde. Wenn das Loch verheilt ist, identifizieren Sie das Loch mit einem stereotaktischen Gerät und befolgen Sie das in den Schritten 2.1-2.3 beschriebene Verfahren.
- Erweitern Sie den Lochdurchmesser mit einem Schädelbohrer auf 5 mm und entfernen Sie die ausgeschiedene Zerebrospinalflüssigkeit mit einem sterilen Wattestäbchen.
- Fokussieren Sie das Mikroskop auf den Kopf der Maus und passen Sie die Einstellungen so an, dass sich das Bohrloch in der Mitte des Sichtfelds befindet.
- Schneiden Sie die Hirnhäute mit einer Mikroschere und entfernen Sie einen Teil des Tumorgewebes mit einer Mikrokürette und einem Mikroskalpell unter dem Mikroskop.
HINWEIS: Wenn der Schädel geöffnet ist, ist die dünne Membran in der Nähe des Hirngewebes die Hirnhäute. - Stoppen Sie die Blutung mit steriler Gaze und waschen Sie den Einschnitt mit steriler physiologischer Kochsalzlösung.
- Injizieren Sie das handelsübliche Hydrogel (10 μl, siehe Materialtabelle) mit einer 1-ml-Spritze in die Resektionshöhle, vernähen Sie die Kopfhaut mit einer nicht resorbierbaren chirurgischen Naht (10-0) und desinfizieren Sie den Schnitt erneut (Abbildung 1).
- Überwachen Sie die Gesundheit des Tieres und halten Sie die Maus warm.
- Bewegen Sie die Maus nach dem Aufwachen zurück in den Gehäusekäfig.
- Führen Sie eine In-vivo-Biolumineszenz-Bildgebung durch, um den transplantierten Tumor 1 Tag später zu erkennen und die Größe des Resttumors zu quantifizieren (Abbildung 2 und Abbildung 3).
- Wiegen Sie die Mäuse alle 2 Tage bis zum terminalen Endpunkt.
HINWEIS: In der vorliegenden Studie war der terminale Endpunkt Tag 30, und die Mäuse wurden durch eine Überdosierung von Pentobarbital-Natrium mit einer intraperitonealen Injektion euthanasiert.
Ergebnisse
Der Prozess der Erstellung des GBM-Rezidiv-Post-Resektionsmodells ist in Abbildung 1 dargestellt. Die Resektionshöhle nach teilweiser Entfernung des Tumors unter dem Mikroskop ist dargestellt. Das Hydrogel wurde mit einer Spritze in die Resektionshöhle injiziert, um die therapeutische Wirkung zu demonstrieren. Der Zeitplan der Versuchsplanung ist in Abbildung 2A dargestellt. Nachdem die GBM-Zellen in das Gehirn der Mäuse implantiert wurden, wurde das Tumorwachstum an Tag 10 mittels in vivo Biolumineszenz-Bildgebung getestet. Die Resektion wurde am 11. Tag durchgeführt, und das Hydrogel wurde dann in die Resektionshöhle injiziert. Die In-vivo-Biolumineszenz-Bildgebung wurde an Tag 15, Tag 20, Tag 25 und Tag 30 durchgeführt, um das verbleibende Tumorwachstum zu überwachen. Wie in Abbildung 2B,C zu sehen ist, war die Größe der Tumoren im GBM-Rezidiv-Post-Resektions-Modell signifikant kleiner als die im orthotopen intrakraniellen GBM-Modell, wie die In-vivo-Biolumineszenz-Bildgebungstests zeigten. Am Tag 25 traten die Tumoren nach der Resektion signifikant auf (Abbildung 2D). Die H&E-Färbung bestätigte, dass das GBM-Rezidivmodell nach der Resektion erfolgreich konstruiert wurde und dass Resttumoren nach der Resektion signifikant rezidivierten (Abbildung 3A,B).
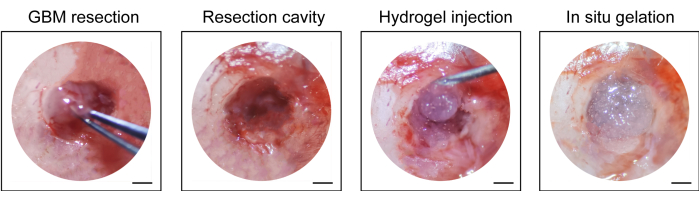
Abbildung 1: Intraoperative Ansicht der Tumorresektion und Injektion des Hydrogels. Ein Teil des Tumorgewebes wurde mit einer Mikrokürette und einem Mikroskalpell unter dem Mikroskop entfernt und Hydrogel in die Resektionshöhle injiziert. Maßstabsleisten: 50 μm. Diese Abbildung wurde von Sun et al.10 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
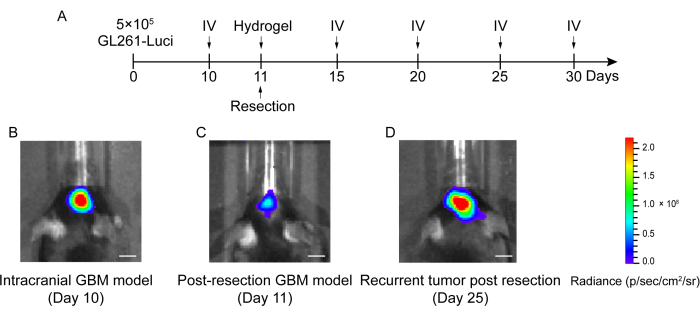
Abbildung 2: Zeitplan des experimentellen Designs und der in vivo biolumineszierenden Bildgebung von Mäusen im intrakraniellen und postresektionalen GBM-Modell. (A) Der Zeitplan des Versuchsplans, aus dem hervorgeht, dass die Resektion an Tag 11 durchgeführt wurde und dass die in vivo biolumineszierende Bildgebung (IV) an Tag 10, Tag 15, Tag 20, Tag 25 und Tag 30 durchgeführt wurde. (B) Die intrakraniellen GBM-Modellmäuse zeigten eine große Tumorgröße an Tag 10, (C) die Tumorgröße war nach der Resektion an Tag 11 signifikant reduziert und (D) die Tumorgröße nahm nach der Resektion am Tag 25 im GBM-Modell nach der Resektion zu. Die Kontrollgruppe umfasste die GBM-Modellmäuse nach der Resektion ohne Behandlung. Insgesamt wurden 42 Mäuse in dieser Studie verwendet. Maßstabsleisten: 100 μm. Diese Abbildung wurde von Sun et al.10 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
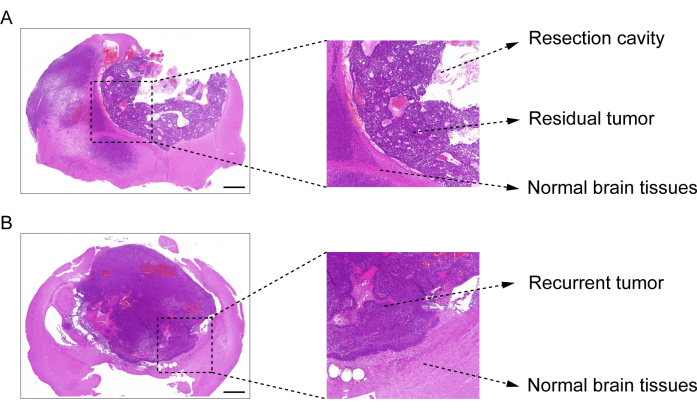
Abbildung 3: H&E-Färbebild von Hirngewebe aus dem GBM-Modell nach Resektion. (A) Ein H&E-Färbebild, das die Resektionshöhle, den Resttumor und das normale Hirngewebe zeigt. Das Hirngewebe wurde 1 Tag nach der Resektion entnommen. (B) Ein H&E-Färbebild, das den rezidivierenden Tumor und das normale Hirngewebe zeigt. Das Hirngewebe wurde am 12. Tag nach der Resektion entnommen. Maßstabsleisten: 100 μm. Diese Abbildung wurde von Sun et al.10 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Eine Operation ist für die meisten GBM-Patienten nach wie vor die erste Wahl11. Aufgrund der Charakteristik des invasiven Wachstums von GBM verbleibt nach mikroneurochirurgischen Techniken immer noch eine kleine Anzahl von Tumorzellen, was schließlich zu einem Tumorrezidiv führt12. Die Frage, wie das Wiederauftreten von GBM nach einer Operation gehemmt werden kann, ist zum Schwerpunkt der GBM-bezogenen Forschung geworden. Aufgrund der komplexen anatomischen Struktur des Hirngewebes ist jedoch die Konstruktion eines geeigneten postoperativen GBM-Modells zum primären Problem geworden, das es in diesem Bereich zu lösen gilt.
In dieser Studie wurde ein GBM-Rezidivmodell nach Resektion entwickelt. Bei der Konstruktion dieses Modells ist die Konstruktion des orthotopen intrakraniellen GBM-Modells von entscheidender Bedeutung. Nachdem dieses Modell erfolgreich entwickelt wurde, muss die Resektion zum richtigen Zeitpunkt durchgeführt werden. Die empfohlene Zeit ist, wenn der Fluoreszenzwert der Tumorgröße etwa 6,5 × 105 beträgt. Um die Mortalität der Mäuse zu reduzieren, wurde eine Resektion unter Narkose mit 40 mg/kg 1%igem Pentobarbital-Natrium durch intraperitoneale Injektion durchgeführt. Die Resektion war jedoch schwierig durchzuführen, und die Mäuse bewegten sich aufgrund der geringen Dosis des Anästhetikums oft. Auf dieser Grundlage wurde die Dosis des Anästhetikums auf 50 mg/kg erhöht. Nach Erhöhung der Anästhesiedosis verschwanden die intraoperativen Reaktionen der Mäuse und die Resektion wurde erfolgreich durchgeführt. In diesem Protokoll kann auch Isoflurangas verwendet werden.
In dieser Studie wurden GL261-Luci-Zellen verwendet, um das Modell zu entwickeln; Daher müssen in Zukunft mehr GBM-Zelllinien verwendet werden, um das Protokoll zu validieren. Um das Protokoll überzeugender zu machen, müssen verschiedene GBM-Mausmodelle, wie z.B. gentechnisch veränderte GBM-Mausmodelle, verwendet werden. Darüber hinaus kann die MRT das beste Mittel sein, um das Wiederauftreten von Tumoren nach einer Operation zu erkennen.
Zusammenfassend lässt sich sagen, dass in dieser Arbeit ein GBM-Rezidivmodell nach Resektion entwickelt wurde. In diesem Modell wird das Tumorrezidiv überwacht, indem das Wachstum des Resttumors nach der Resektion beurteilt wird. Obwohl bei diesem Modell nicht davon ausgegangen werden kann, dass es das Tumorrezidiv vollständig nachahmt, ähnelt der Resektionsstil in diesem Modell dem Standard einer maximal sicheren Chirurgie in der klinischen Behandlung von GBM-Patienten. Diese Arbeit stellt eine bequeme und praktikable Methode zur Konstruktion des GBM-Rezidiv-Post-Resektionsmodells dar und stellt einen Fortschritt auf dem Gebiet der Erforschung des GBM-Rezidivs nach der Resektion dar.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Diese Arbeit wurde durch Projektzuschüsse der National Natural Science Foundation of China (82071767 und 82171781) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Gentian violet | Sigma | C6158 | |
| GL261-Luci | Shanghai Zhong Qiao Xin Zhou Biotechnology Co.,Ltd. | ZQ0932 | |
| In vivo bioluminescent imaging system | Tanon | Tanon ABL X6 | |
| Laboratory animal shaver | Beyotime Biotechnology | FS600 | |
| Mice | Beijing Vital River Laboratory Animal Technology Co., Ltd. | ||
| Micro curette | Belevor Medical Co.,Ltd. | ||
| Micro scalpel | Belevor Medical Co.,Ltd. | ||
| Microscope | Shanghai Xiangfan Instrument Co., Ltd | JSZ5A/B | |
| Microsyringe | Hamilton | 87943 | |
| Mini cranial drill | RWD | 78001 | |
| Nonabsorbable surgical suture | Shanghai Yuyan Instruments Co.,Ltd. | ||
| Pentobarbital sodium | ChemSrc | 57-33-0 | |
| PVA-TSPBA hydrogel | Aladdin | 9002-89-5 | |
| Stereotaxic apparatus | RWD | 68043 |
Referenzen
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews Clinical Oncology. 15 (7), 422-442 (2018).
- Wang, X., et al. In situ targeting nanoparticles-hydrogel hybrid system for combined chemo-immunotherapy of glioma. Journal of Controlled Release. 345, 786-797 (2022).
- Binder, Z. A., O'Rourke, D. M. Glioblastoma: The current state of biology and therapeutic strategies. Cancer Research. 82 (5), 769-772 (2022).
- Kauer, T. M., Figueiredo, J. L., Hingtgen, S., Shah, K. Encapsulated therapeutic stem cells implanted in the tumor resection cavity induce cell death in gliomas. Nature Neuroscience. 15 (2), 197-204 (2011).
- Jiang, X., et al. Nanoparticle engineered TRAIL-overexpressing adipose-derived stem cells target and eradicate glioblastoma via intracranial delivery. Proceedings of the National Academy of Sciences of the United States of America. 113 (48), 13857-13862 (2016).
- Quail, D. F., Joyce, J. A. The microenvironmental landscape of brain tumors. Cancer Cell. 31 (3), 326-341 (2017).
- Zhang, J., et al. Immunostimulant hydrogel for the inhibition of malignant glioma relapse post-resection. Nature Nanotechnology. 16 (5), 538-548 (2021).
- Ruan, H., et al. A dual-bioresponsive drug-delivery depot for combination of epigenetic modulation and immune checkpoint blockade. Advanced Materials. 31 (17), 1806957 (2019).
- Louveau, A., et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 523 (7560), 337-341 (2015).
- Sun, S., et al. Immunostimulant in situ hydrogel improves synergetic radioimmunotherapy of malignant glioblastoma relapse post-resection. Advanced Functional Materials. 32 (43), 2205038 (2022).
- Liu, D. K., Sulman, E. P., Wen, P. Y., Kurz, S. C. Novel therapies for glioblastoma. Current Neurology and Neuroscience Reports. 20 (7), 19 (2020).
- Mellinghoff, I. K., Cloughesy, T. F. Balancing risk and efficiency in drug development for rare and challenging tumors: A new paradigm for glioma. Journal of Clinical Oncology. 40 (30), 3510-3519 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten