Method Article
Métodos mejorados para preparar secciones transversales y montajes enteros desenrollados de primordios de hojas de maíz para imágenes de fluorescencia y confocales
En este artículo
Resumen
Los primordios de hojas de maíz están profundamente enfundados y enrollados, lo que los hace difíciles de estudiar. Aquí, presentamos métodos para preparar secciones transversales y montajes enteros desenrollados de primordios de hojas de maíz para imágenes fluorescentes y confocales.
Resumen
En el maíz (Zea mays) y otras gramíneas (Poaceae), los primordios de las hojas están profundamente enfundados y enrollados dentro del verticilo de la hoja, lo que dificulta el estudio del desarrollo temprano de las hojas. Aquí, describimos métodos para preparar secciones transversales y montajes enteros desenrollados de primordios de hojas de maíz para imágenes fluorescentes y confocales. El primer método utiliza un decapante de alambre para eliminar las porciones superiores de las hojas más viejas, exponiendo la punta del primordio de la hoja y permitiendo su medición para un muestreo de sección transversal más preciso. El segundo método utiliza cinta nano transparente de doble cara para desenrollar y montar primordios de hoja entera para obtener imágenes. Mostramos la utilidad de los dos métodos para visualizar y analizar reporteros de proteínas fluorescentes en maíz. Estos métodos proporcionan una solución a los desafíos presentados por la morfología distintiva de los primordios de la hoja de maíz y serán útiles para visualizar y cuantificar los rasgos anatómicos y de desarrollo de las hojas en el maíz y otras especies de gramíneas.
Introducción
Los cultivos de gramíneas son una fuente importante de alimentos y biocombustibles para la población mundial1, y mejorar la anatomía de las hojas tiene el potencial de aumentar su productividad 2,3. Sin embargo, nuestra comprensión actual de cómo se regula la anatomía de la hoja en las gramíneas es limitada4 y requiere el análisis de los primordios de la hoja, ya que muchos rasgos anatómicos y fisiológicos de la hoja están predeterminados temprano en el desarrollo 5,6,7. Las técnicas de imagen celular, como la fluorescencia y las imágenes confocales, son indispensables para estudiar la anatomía de la hoja de hierba y los rasgos celulares, pero estas técnicas son difíciles de aplicar a los primordios de la hoja de hierba porque están profundamente enfundadas y enrolladas dentro de la espiral de la hoja. Abordamos este tema desarrollando métodos para preparar secciones transversales y montajes de hojas enteras desenrolladas para el análisis de fluorescencia y confocal de primordios de hojas de maíz, un sistema modelo para estudiar la anatomía y el desarrollo de la hoja de gramínea 2,8.
La hoja de maíz, como todas las hojas de hierba, consiste en una hoja en forma de correa con una vaina que se envuelve alrededor del tallo y el brote en desarrollo 9,10,11,12,13. Las hojas se desarrollan a partir del meristemo apical del brote (SAM) en un patrón distichoso, donde cada nueva hoja se inicia en la posición opuesta a la hoja anterior, lo que resulta en dos filas de hojas a lo largo del eje vertical (Figura 1A)14 . La etapa de desarrollo de cada primordio foliar se identifica por su posición relativa al SAM, con el primordio más cercano designado como plastocrono1 (P1) y los siguientes primordios designados como P2, P3, y así sucesivamente (Figura 1B, C) 2. Durante el desarrollo (Figura 1D), el primordio de la hoja aparece primero como un contrafuerte en forma de media luna alrededor de la base del SAM (P1), y luego crece en un primordio en forma de capucha que se extiende sobre el meristemo (P2)9,10,11. Los márgenes basales de la capucha se expanden lateralmente y se superponen entre sí a medida que la punta crece hacia arriba, formando un primordio en forma de cono (P3-P5)10. El primordio crece rápidamente en longitud, y el límite de la lámina de la vaina en la base se vuelve más prominente con la formación de la lígula, la proyección en forma de franja en el lado adaxial de la hoja (P6 / P7). Finalmente, la hoja se desenrolla a medida que emerge del verticilo durante el crecimiento en estado estacionario, en el que las células en división están restringidas dentro de la pequeña región basal de la lámina, formando un gradiente con células en expansión y diferenciación a lo largo del eje proximal-distal (P7/P8)15. El ápice del brote de una plántula de maíz contiene múltiples primordios en diferentes etapas de desarrollo, lo que lo convierte en un excelente modelo para estudiar el desarrollo de las hojas8.
El análisis preciso del desarrollo temprano de las hojas requiere la estadificación o el uso de criterios estandarizados para definir distintas etapas del desarrollo del primordio en relación con otros parámetros morfológicos o de crecimiento. Debido a que los primordios de la hoja están ocultos dentro del brote de hierba, los investigadores suelen utilizar parámetros como la edad de la planta o el tamaño de las hojas emergentes como predictores de las etapas y tamaños de los primordios de la hoja 9,16. En el maíz, la edad cronológica de la planta está determinada por el número de días después de la siembra o la germinación (DAP/DAG)17,18. La etapa vegetativa (etapa V) está determinada por la hoja superior con un collar visible, una línea pálida en el lado abaxial entre la lámina y la vaina que corresponde a la posición de la lígula y las aurículas, un par de regiones en forma de cuña en la base de la lámina (Figura 1A,B)17,19 . Entre 20 y 25 DAG, el SAM pasa a un meristemo de inflorescencia y deja de producir nuevas hojas20. Las tasas de crecimiento de los primordios de la hoja de maíz pueden variar según el medio ambiente y el genotipo de la planta. Por esta razón, la edad de la planta y el tamaño de las hojas emergentes no pueden predecir con precisión los tamaños de los primordios de las hojas; Sin embargo, el uso de estos parámetros puede ayudar a predecir el rango de etapas y tamaños de primordia con fines experimentales.
El análisis de sección transversal es un método popular para examinar la anatomía y el desarrollo de las hojas en maíz y otras gramíneas, ya que permite el muestreo de múltiples plastochrones en una sola sección a través del brote21,22,23. Este método también es conveniente para la obtención de imágenes celulares de muestras frescas, ya que las hojas circundantes sirven como un andamio que mantiene los primordios de las hojas en su lugar durante la sección y el montaje24. Sin embargo, una desventaja de este método es que puede ser difícil localizar con precisión el plastocrón objetivo y la región dentro del primordio cuando se secciona desde un brote intacto. Además, debido a que el crecimiento de las hojas varía entre plastochrones y a lo largo del eje proximal-distal2,5, un muestreo impreciso podría dar lugar a una interpretación incorrecta de la etapa de desarrollo y la región del primordio en una sección dada. Por lo tanto, el desarrollo de un método para el muestreo preciso de la sección transversal es fundamental para garantizar la precisión y la reproducibilidad de los análisis anatómicos y de desarrollo de los primordios de hojas de gramíneas.
El análisis de montaje de hoja entera permite la investigación integral e integradora de los procesos tisulares y celulares que ocurren a escala de todo el órgano, como el crecimiento proliferativo25 y el patrón de venas26,27,28. El método proporciona una visión paradérmica de la hoja, permitiendo el descubrimiento de distintos procesos y patrones que de otro modo serían difíciles de detectar utilizando el análisis de sección transversal24,27. A diferencia de Arabidopsis, donde ya existen métodos establecidos para obtener imágenes de montajes de hojas enteras29,30, actualmente no existe un método estándar para obtener imágenes de montajes de hojas enteras desenrollados en gramíneas. Un protocolo previo para desenrollar primordios aislados de hojas de maíz involucraba materiales poco comunes y no era adecuado para imágenes celulares31. Las técnicas avanzadas de imagen, como la tomografía computarizada (TC) y la resonancia magnética (RM), pueden adquirir información anatómica 3D sin aislar y desenrollar los primordios 11,32,33, pero son costosas y requieren equipo especializado. El desarrollo de una técnica para superar las limitaciones impuestas por la morfología enrollada y cónica de los primordios foliares en el maíz y otras gramíneas avanzaría en las investigaciones sobre sus rasgos anatómicos y de desarrollo.
Aquí, presentamos métodos para preparar secciones transversales y montajes enteros desenrollados de primordios de hojas de maíz para imágenes fluorescentes y confocales. Utilizamos estos métodos para cuantificar el número de venas y mapear la distribución hormonal espacio-temporal en primordios de hojas de maíz con proteínas fluorescentes (PF)24. El primer método consiste en extraer la porción superior de las hojas más viejas de las plántulas de maíz con un decapante de alambre (Figura 1E). Al exponer la punta del primordio (P5-P7), es posible determinar su longitud sin tener que eliminar completamente las hojas circundantes más viejas, lo que permite un seccionamiento fácil y preciso. El segundo método consiste en desenrollar y montar primordios de hoja entera (P3-P7) con cinta nano transparente de doble cara (Figura 1F). Estos métodos son adecuados para visualizar varios FP24, pero necesitan optimización para usar tintes fluorescentes y reactivos de limpieza. Además, describimos algunos procedimientos para aplanar pilas z, unir imágenes y combinar canales en ImageJ/FIJI34, que se aplican a las imágenes producidas por los dos métodos. Estos métodos son útiles para la fluorescencia de rutina o las imágenes confocales de las hojas de maíz, pero también se pueden adaptar para otras especies de gramíneas modelo, como el arroz, Setaria y Brachypodium.
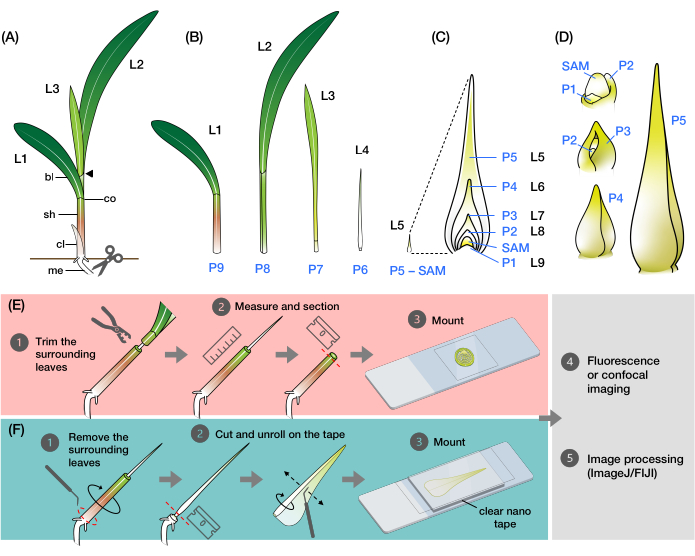
Figura 1: Organización y morfología de los primordios de la hoja de maíz y visión general de los métodos . (A) Representación esquemática de una plántula de maíz. El maíz tiene una filotaxia distichosa, con la nueva hoja iniciándose en la posición opuesta a la hoja anterior. El número de hoja indica el orden cronológico en el que las hojas emergieron de la germinación (es decir, primera hoja, L1; segunda hoja, L2; tercera hoja, L3; etc.). Cada hoja tiene una lámina distal y una vaina basal delineada por un collar que corresponde a la lígula y la aurícula. La hoja superior con el collar visible denota la etapa vegetativa. La plántula en este ejemplo está en la etapa V2, con el collar L2 (punta de flecha) visible. El icono de tijeras indica la ubicación en el mesocótilo (me) donde se debe cortar la plántula para ser recolectada. (B) Representación esquemática del brote disecado que muestra aislados de L1 a L4, con los primordios de la hoja L5 a L9 mostrados como una imagen ampliada en (C). El número de plastocrono indica la posición del primordio en relación con el SAM, con el primordio de la hoja más joven (P1) más cercano al SAM y los primordios de hojas más viejos (P2, P3, P4, etc.) sucesivamente más lejos2. (D) Representación esquemática de la morfología de los primordios de la hoja de maíz de P1 a P5. (E) Resumen esquemático del método para el análisis de secciones transversales de los primordios de la hoja de maíz. (1) Recorte las hojas más viejas con un decapante de alambre. (2) Mida el primadio y seccione el brote. (3) Monte la sección en una diapositiva para obtener imágenes y procesamiento (4, 5). (F) Resumen esquemático del método para el análisis de montaje completo de los primordios de la hoja de maíz. (1) Retire las hojas circundantes para extraer el primordio. (2) Corte y desenrolle el primordium plano en la cinta nano. (3) Monte la muestra para obtener imágenes y procesarla (4, 5). Abreviaturas: L = hoja; bl = cuchilla; sh = vaina; co = collar; me = mesocótilo; V = vegetativo; P = plastocrono; SAM = meristemo apical del brote. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. Puesta en escena del desarrollo de la hoja de maíz y diseño del experimento
- Cultivo de las plantas y puesta en escena del desarrollo de las hojas
- Determine la edad y la etapa de desarrollo de las plantas que se utilizarán para el experimento y realice una puesta en escena detallada del desarrollo de las hojas.
NOTA: Se recomienda que la estadificación se realice en plantas con los mismos antecedentes genéticos que las líneas mutantes o transgénicas que se utilizarán en los experimentos. El SAM deja de producir nuevas hojas entre 20 y 25 DAG, dependiendo de los antecedentes genéticos y las condiciones de crecimiento. Por esta razón, los métodos descritos aquí son ideales para plántulas de maíz de 7 a 14 años DAG. - Cultivar las plantas de maíz en un invernadero o cámara de crecimiento siguiendo un protocolo adecuado de cuidado de las plantas35.
- Recoja las plantas a la edad deseada o etapa V con un cuchillo pequeño o un par de tijeras cortando en el mesocótilo, que es el tallo debajo de la superficie del suelo (Figura 1A). Inserte cuidadosamente la herramienta de corte en el suelo al lado de la plántula y deslícela hacia abajo hasta la base en un ángulo de 45 ° para cortar el mesocótilo.
- Levante la plántula del suelo y elimine cualquier suciedad restante o partículas de tierra que puedan estar adheridas a la planta. Retire el coleoptilo, la vaina protectora que cubre el brote emergente en las plántulas jóvenes, a mano.
- Para cada planta, registre la etapa V, el número de hojas y la longitud de la última hoja que emerge del verticilo. Tome fotos de las plantas para referencia futura.
- Retire las hojas más viejas una por una. Para hacer esto, sostenga la planta por los restos del mesocótilo o tallo, y extirpe cada hoja de la base de la vaina y despliegue suavemente la vaina en forma circular con una sonda dental (Figura 1B).
NOTA: Consulte el paso 2.1 para obtener un método rápido para eliminar las hojas circundantes. - Bajo un microscopio estéreo con un aumento de aproximadamente 2x, diseccione cuidadosamente el resto del ápice del brote en toallitas húmedas para evitar que la muestra se seque. Extirpe y despliegue suavemente cada primordio foliar con una sonda dental con una aguja doblada o un par de pinzas finas hasta que el SAM, P1 y P2 sean visibles (Figura 1D). Registre la apariencia y la medida de cada plastocon.
NOTA: Vea un ejemplo de estadificación del desarrollo foliar en plántulas de maíz en el Archivo Suplementario 1.
- Determine la edad y la etapa de desarrollo de las plantas que se utilizarán para el experimento y realice una puesta en escena detallada del desarrollo de las hojas.
- Planificación del experimento
NOTA: Planificar el experimento cuidadosamente puede mejorar la eficiencia. Por ejemplo, en el análisis de sección transversal, determinar la ubicación aproximada para cortar al obtener imágenes de plastocrones o regiones específicas puede reducir el tiempo de disección. La figura 2 muestra un ejemplo de muestreo estandarizado. Además, la optimización de los parámetros de imagen en función de las propiedades de los FP o sondas fluorescentes puede mejorar la eficiencia de los experimentos.- Utilice la información de estadificación como guía para enfocar el experimento en plastocrones específicos, regiones de primordio y tejidos. Utilice los FP u otras sondas fluorescentes de interés para seguir las secciones 2 y/o 3 a continuación en algunas muestras.
NOTA: Véanse las existencias de semillas disponibles de la línea 36-42 del marcador FP de maíz en https://www.maizegdb.org/data_center/stock. - Determine los parámetros óptimos de adquisición de imágenes para cada reportero o sonda FP, incluido el detector o filtro apropiado, las longitudes de onda de excitación y emisión, el tamaño del agujero de alfiler y otras configuraciones. Guarde la configuración para reproducir las condiciones de trabajo para cada uno de los experimentos.
NOTA: Consulte Linh y Scarpella30 para obtener algunas pautas técnicas para la microscopía de barrido láser confocal de hojas en desarrollo. - Planifique el tiempo de imagen basado en la vida media y otras propiedades del reportero de FP43.
NOTA: El tiempo entre la disección y la obtención de imágenes también debe considerarse al planificar un experimento, ya que las muestras de plantas frescas se someten a desecación y cambios celulares durante este período.
- Utilice la información de estadificación como guía para enfocar el experimento en plastocrones específicos, regiones de primordio y tejidos. Utilice los FP u otras sondas fluorescentes de interés para seguir las secciones 2 y/o 3 a continuación en algunas muestras.
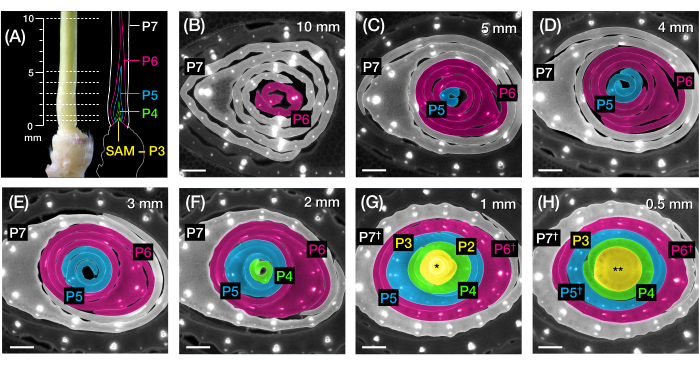
Figura 2: Esquema de muestreo para el análisis de sección transversal de primordios de hojas de maíz. (A, izquierda) Brote proximal de una plántula de maíz 7 DAG, mostrando una cuarta hoja expuesta (L4) en P7. Las líneas discontinuas indican los siete puntos de muestreo a lo largo del primordio, de 0,5 mm a 10 mm. (A, derecha) Representación esquemática de los primordios de la hoja, con el tamaño proyectado y la posición de cada plastocon: P7 (blanco); P6 (magenta); P5 (azul); P4 (verde); y P3 hasta el SAM (amarillo). (B-H) Imágenes de fluorescencia de secciones transversales que representan los puntos de muestreo mostrados en A de 10 mm (B) a 0,5 mm (H). Los primordios son pseudocoloreados de acuerdo con el esquema de color del plastochron en (A). Las secciones fueron fotografiadas con un microscopio de epifluorescencia utilizando un filtro UV de emisión de paso largo para autofluorescencia. Barra de escala = 200 μm (B-H). Esta figura ha sido modificada y reproducida con permiso de Robil y McSteen24. Abreviaturas: DAG = días después de la germinación; P = plastocrono; SAM = meristemo apical del brote; † = vaina foliar o prelígula propiamente dicha; * = meristemo apical del brote; ** = tallo. Haga clic aquí para ver una versión más grande de esta figura.
2. Obtención de imágenes de secciones transversales de primordios de hojas de maíz
- Extracción de hojas circundantes más viejas y medición del primordio de la hoja
- Recoja la plántula cortándola cuidadosamente en el mesocótilo debajo de la superficie del suelo con un cuchillo pequeño o un par de tijeras, como se describe en los pasos 1.1.3-1.1.4 (Figura 1A).
- Determine el tamaño correcto del orificio del pelacables que se utilizará y dónde se realizará el corte a lo largo del brote. Asegúrese de que el orificio sea lo suficientemente grande como para caber en el primordio objetivo.
- Comience a cortar en la parte más distal del brote y trabaje gradualmente hacia la base hasta que la punta del primordio quede expuesta.
- Para hacer el corte, sostenga el pelacables con las mandíbulas hacia el brote. Coloque el brote en el orificio seleccionado y apriete los mangos de la peladora para cortar a través de la espiral de la hoja.
NOTA: Para evitar cortar accidentalmente el primordio objetivo, alinee cuidadosamente el centro del brote con el orificio en el pelacable. Para plantas más grandes, se recomienda quitar manualmente algunas de las hojas circundantes a mano antes de usar el decapante.
PRECAUCIÓN: Los pelacables tienen mandíbulas afiladas que pueden causar cortes u otras lesiones si no se usan con cuidado. - Mientras continúa apretando los mangos juntos, deslice el decapante lejos del brote para recortar la parte superior de las hojas. Asegúrese de que la región objetivo en el primordio permanezca envainada por las hojas circundantes (Figura suplementaria S1C, D).
NOTA: Después de recortar las hojas superiores, el brote queda con una punta de primordio expuesta (P5, P6 o P7, dependiendo de la posición del corte y el tamaño del orificio del peladura utilizado; Figura 1E). Este primordio servirá como referencia para estimar el tamaño y la etapa de los primordios más jóvenes. P6 es la referencia más práctica para usar en plántulas de maíz debido a su rango de tamaño y morfología similar a un alfiler. - Use una regla para medir la longitud desde la punta del primordio hasta la base del brote. Registre la medición.
NOTA: La longitud del primordio se sobreestimará ligeramente ya que hay unos pocos milímetros de tallo en la base de los primordios (Figura 2A).
- Sección a mano alzada e imágenes del primordio de la hoja
- Bajo un microscopio estéreo con un aumento de aproximadamente 0,8x, mantenga el brote firme sobre una superficie lisa, como una tabla de cortar de vidrio u otro material resistente a los arañazos. Use una cuchilla de afeitar o un bisturí para cortar secciones delgadas (0.25-0.8 mm) del brote en los puntos deseados a lo largo del primidordio.
- Haga un corte inicial ligeramente por encima de la región objetivo para descartar la parte distal del disparo y luego obtenga secciones delgadas alrededor de la región objetivo. Para hacer cortes limpios, sostenga la cuchilla perpendicular al brote y deslícela hacia adentro con un movimiento suave y uniforme.
NOTA: Puede haber unos pocos milímetros de margen de maniobra de sección para primordios más grandes (P6 o P7). Sin embargo, para primordios más pequeños (P5 y anteriores), 1 mm puede marcar una diferencia significativa en el muestreo, ya que estos primordios se apilan dentro de los primeros milímetros de la base del brote (ver Figura 2A, F-H). Se recomienda utilizar una hoja de afeitar de doble filo para una sección más fina.
PRECAUCIÓN: Tenga cuidado al usar cuchillas de afeitar y bisturíes para evitar cortes o lesiones accidentales. - Reemplace la hoja de afeitar regularmente, ya que las vainas de las hojas pueden opacar fácilmente la hoja. Cubra el brote con toallitas húmedas después de cada ronda de seccionamiento para evitar que la muestra se seque.
- Monte la sección de la hoja en un portaobjetos de vidrio limpio (75 mm x 25 mm), use una pipeta para aplicar una gota de agua (o 50% de glicerol) directamente a la sección y coloque un cubreobjetos (22 mm x 22 mm) en la parte superior.
- Si usa un tinte fluorescente, aplique la solución de tinte en la sección, coloque un cubreobjetos en la parte superior e incube según sea necesario.
NOTA: Dependiendo del tipo de tinte, pueden ser necesarios pasos adicionales para procesar las secciones de la hoja antes de continuar con el siguiente paso. Estas referencias44,45,46,47 proporcionan detalles generales y usos de colorantes fluorescentes en imágenes de células vegetales. Un colorante fluorescente que tinte el núcleo, la 5-etinil-2′-desoxiuridina (EdU), se ha utilizado eficazmente en secciones transversales de primordios de hojas de maíz48. Por el contrario, los colorantes para la tinción de la membrana plasmática, como Fei Mao 4-64 (FM 4-64) y yoduro de propidio, no producen resultados satisfactorios (Figura 3A-D). - Coloque el portaobjetos en el escenario de un microscopio de escaneo láser confocal o de epifluorescencia y ajuste el enfoque y los ajustes según sea necesario para visualizar el fluoróforo30. Consulte la Tabla 1 para conocer los ajustes de iluminación y adquisición de imágenes utilizados para las líneas reporteras de PF de maíz seleccionadas.
NOTA: Las secciones gruesas pueden producir altos niveles de autofluorescencia de fondo. Considere algunas estrategias de obtención de imágenes y preparación de muestras que pueden ayudar a mitigar este problema30,49 (ver Tabla 2).
PRECAUCIÓN: Tenga cuidado y use gafas protectoras cuando trabaje con potentes fuentes de luz y láseres para reducir el riesgo de daño ocular. - Imagen a través de la sección de la hoja a diferentes aumentos y canales de detección (incluida la iluminación de campo claro)30. Utilice un aumento de 4x para obtener imágenes de toda la sección transversal y un aumento de 20x o 40x para obtener imágenes de tejidos específicos. Reduzca el tiempo de exposición a aumentos más altos para imágenes de epifluorescencia para proteger las muestras del fotoblanqueo rápido (ver Tabla 1).
- Capture imágenes de toda la sección o regiones específicas de interés (ROI). Si es necesario, adquiera una pila z, que es una serie de imágenes capturadas a diferentes profundidades focales30.
- Para adquirir una pila z, primero determine las posiciones superior e inferior en la muestra, luego el número de secciones ópticas que deben capturarse entre estas posiciones. Menos secciones ópticas dan como resultado un tamaño de paso z más grande, que es la distancia entre cada sección. Dependiendo de las propiedades del PF y del aumento utilizado, capture de tres a 25 secciones ópticas con tamaños de pasos z entre 1 y 12 μm para obtener imágenes de secciones transversales de primordios de hojas de maíz.
NOTA: Para acoplar la pila z, utilice una técnica de renderizado de volumen50 adecuada que se pueda lograr mediante el software del microscopio o mediante ImageJ/FIJI34 (consulte los pasos 4.1 y 4.2). - Guarde todos los archivos de imagen y sus metadatos asociados, si están disponibles.
Tabla 1: Ajustes de iluminación y adquisición de imágenes utilizados para imágenes fluorescentes y confocales de reporteros seleccionados de PF de maíz. Abreviaturas: FP = proteína fluorescente; TRITC = tetrametilrodamina; FITC = isotiocianato de fluoresceína; WLL = láser de luz blanca; Ar-ion = láser de iones de argón; HyD = detector híbrido; AU = Unidad Airy; Hz = Hertz, línea de escaneo por segundo. Haga clic aquí para descargar esta tabla.
3. Imágenes de monturas enteras desenrolladas de primordios de hojas de maíz
- Diseccionando los primordios y preparando el portaobjetos de vidrio con cinta nano
- Recoja la plántula cortándola cuidadosamente en el mesocótilo debajo de la superficie del suelo con un cuchillo pequeño o un par de tijeras, como se describe en los pasos 1.1.3-1.1.4 (Figura 1A).
- Prepare el portaobjetos de vidrio (75 mm x 25 mm) con la nanocinta transparente de doble cara (Figura suplementaria S1H) antes de diseccionar la planta. Corte un trozo rectangular de cinta nano y péguelo en el centro de un tobogán de vidrio limpio. No retire la película plástica protectora en la parte superior de la cinta.
NOTA: Determine el tamaño de la cinta que se utilizará de acuerdo con el tamaño de las muestras a la imagen (ver ejemplos de muestras de gran tamaño en la Figura Suplementaria S1I,J). La cinta nano está disponible en material de gel acrílico o poliuretano. Ambos tipos son efectivos para la fluorescencia y la imagen confocal24. Para evitar la decoloración de la cinta, protéjala de la exposición prolongada a la luz almacenándola en un recipiente oscuro. - Comience a diseccionar el brote quitando la parte superior de las hojas más viejas con un decapante de alambre, como se describe en el paso 2.1.
- Sostenga el brote por el mesocótilo y retire cuidadosamente las hojas circundantes con una sonda dental para extraer los primordios. Para hacer esto, retire las hojas de la base del brote y despliéguelas una a la vez hasta que el primordio de interés esté expuesto.
- Alternativamente, use el pelacables para extraer directamente los primordios de la hoja haciendo un corte en la región basal del brote (Figura suplementaria S1E-G).
NOTA: Este método conlleva un mayor riesgo de romper los primordia.
- Montaje e imágenes del primordio.
- Retire la película protectora de la cinta. Coloque el primordio expuesto sobre la cinta. Use una cuchilla de afeitar para cortar el primordio en la base, desechando el tallo basal y el hipocótilo (Figura 1F).
- Desenrolle el primordio con una sonda dental con una aguja doblada (diámetro de punta de 0.25-0.6 mm). Utilice una microsonda (diámetro de punta de 0,15-0,2 mm) para primordios menores de 3 mm (P3 a P4 temprano).
- Coloque la punta de la aguja paralela a la superficie y despliegue el margen basal externo, presionándolo suavemente contra la cinta.
- Para un desenrollado más suave, lubrique la superficie interna (adaxial) de la hoja sumergiendo la punta de la aguja en 100% de glicerol.
- Con el margen exterior adherido a la cinta, alinee la punta de la aguja paralela al eje largo de la hoja. Deslice suavemente la aguja hacia los lados para desenrollar y aplanar la hoja sobre la cinta (Figura 1F).
NOTA: Es común romper o dañar la hoja al desenrollarla, especialmente en primordios más grandes con una nervadura central robusta (ver Figura 3E-G). Desenrollar la hoja vigorosamente puede magullar su superficie y producir artefactos durante la obtención de imágenes (Figura 3H). Consulte la Tabla 2 y la discusión para obtener soluciones recomendadas a estos problemas. - Aplique una gota de agua al primordio desenrollado. Coloque inmediatamente un cubreobjetos sobre la gota de agua y el primordio. Presione suavemente los bordes del cubreobjetos para que se adhieran a la cinta.
NOTA: Se recomienda utilizar cubreobjetos rectangulares grandes (50 mm x 24 mm o 60 mm x 24 mm) con áreas adicionales para adherirse a la cinta. Minimice la formación de burbujas de aire, que pueden distorsionar la hoja y causar una refracción desigual de la luz (ver Figura 3I-K). Asegúrese de que el cubreobjetos se adhiera completamente a la cinta, ya que los márgenes del primordio montado pueden retroceder bajo un cubreobjetos poco adherido (véase la figura 3L). - Coloque el portaobjetos en el escenario de un microscopio de exploración láser confocal (consulte la figura suplementaria S1K) o en un microscopio de barrido láser confocal y ajuste el enfoque y los ajustes según sea necesario para visualizar el fluoróforo30. Consulte la Tabla 1 para conocer los ajustes de iluminación y adquisición de imágenes utilizados para las líneas reporteras de PF de maíz seleccionadas.
- Imagen de toda la hoja o de un ROI específico a través de varios canales de detección30. Para obtener imágenes de toda la hoja, capture manualmente imágenes de mosaico de la hoja o use la operación de mosaico del microscopio a bajo aumento (4x o 10x).
NOTA: Incluso con el aumento más bajo, los primordios de la hoja de maíz pueden ser demasiado grandes para obtener imágenes con un microscopio de escaneo láser confocal o de epifluorescencia, lo que resulta en tiempos de imagen más largos que pueden resultar en fotoblanqueo (ver Figura 3M) o aumento de la autofluorescencia de fondo. Por lo tanto, se recomienda utilizar un microscopio estereoscópico de fluorescencia para obtener imágenes de muestras de hojas enteras de más de 5 mm. - Para las imágenes confocales, será necesario obtener pilas z que abarquen el grosor de la hoja (ver paso 2.2.9).
- Guarde todos los archivos de imagen y sus metadatos asociados, si están disponibles.
Tabla 2: Solución de problemas comunes en la obtención de imágenes de secciones transversales y montajes enteros de primordios de hojas de maíz. Haga clic aquí para descargar esta tabla.
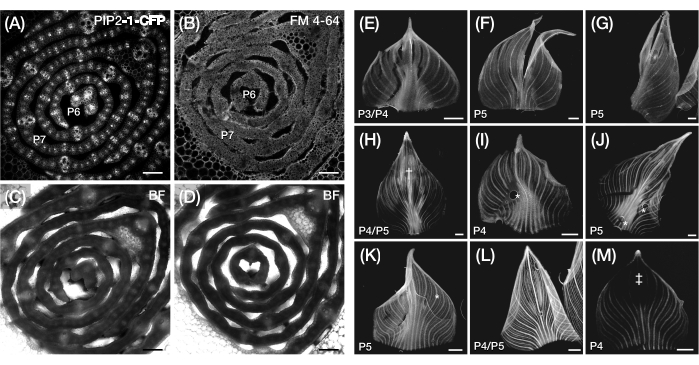
Figura 3: Sección transversal subóptima y preparación de montaje completo de primordios de hojas de maíz. (A-D) Imágenes confocales representativas de secciones transversales de primordios foliares con un marcador de membrana plasmática, PIP2-1-CFP (A), y un colorante fluorescente de unión a la membrana plasmática, FM 4-64 (B), con las correspondientes imágenes de campo claro (C, D). En comparación con PIP2-1-CFP, FM 4-64 muestra una visualización subóptima de los contornos celulares. (E-M) Imágenes de fluorescencia representativas de monturas enteras de primordios de hojas que muestran la presencia de desgarros (E-G), superficies magulladas† (H), burbujas de aire* (I-K), márgenes hacia atrás enrollados (L) y regiones fotoblanqueadas‡ (M). Los primordios de la hoja expresan DII-Venus (E-G), GAR2-YFP (H-J), mDII-Venus (K), PIN1a-YFP (L) y DR5-RFP (M). Barra de escala = 200 μm (A-D); 500 μm (E-M). La Figura 3A ha sido modificada y reproducida con permiso de Robil y McSteen24, mientras que la Figura 5B-M son datos no publicados de los autores. Abreviaturas: P = plastocrono; YFP = proteína fluorescente amarilla; RFP = proteína fluorescente roja; CFP = proteína fluorescente cian; PIP2-1-CFP = p Zm PIP2-1::ZmPIP2-1:CFP; DII-Venus = pZmUbi:DII:YFP-NLS; GAR2-YFP = p Zm GAR2::ZmGAR2:YFP; mDII-Venus = pZmUbi:mDII:YFP-NLS; PIN1a-YFP = p Zm PIN1a::ZmPIN1a:YFP; DR5-RFP = DR5rev::mRFPer; BF = campo brillante. Haga clic aquí para ver una versión más grande de esta figura.
4. Procesamiento de las imágenes usando ImageJ/FIJI
- Aplanamiento de pilas z mediante proyección de intensidad máxima (MIP)
- Inicie ImageJ/FIJI y abra la pila de imágenes, o cree una nueva pila a partir de varias imágenes separadas seleccionando Imagen | Pilas | Imágenes para apilar desde el menú.
- Seleccione la pila de imágenes. En el menú, seleccione Imagen | Pilas | Proyecto Z.... En el cuadro de diálogo Proyecto Z , elija Intensidad máxima en el menú desplegable Tipo de proyección . Haga clic en Aceptar para crear la proyección z de intensidad máxima.
NOTA: La imagen aplanada es una proyección 2D de los píxeles con la intensidad más alta en las pilas z50. Este método es adecuado para visualizar el fluoróforo, pero no las características anatómicas en imágenes de campo claro de secciones transversales gruesas y montajes de hojas enteras. - Guarde la imagen como TIFF (Tagged Image File Format) seleccionando Archivo | Guardar como | Tiff. Introduzca un nombre para el archivo y haga clic en Guardar.
NOTA: Se recomienda utilizar TIFF para almacenar imágenes fluorescentes y confocales, ya que conserva la calidad y el detalle cuando se guarda la imagen.
- Aplanamiento de pilas z con el plugin de profundidad de campo extendida (EDF)51
- Instale el pluginEDF 52. Descargue el archivo Extended_Depth_Field.jar (versión 17.05.2021) de http://bigwww.epfl.ch/demo/edf/ y colóquelo en la carpeta "plugins" de ImageJ / FIJI.
- Inicie ImageJ/FIJI y abra la pila de imágenes, o cree una nueva pila a partir de varias imágenes separadas seleccionando Imagen | Pilas | Imágenes para apilar desde el menú.
- Seleccione la pila de imágenes. En el menú, selecciona Plugins | Profundidad de campo ampliada | Modo fácil de EDF. En el cuadro de diálogo Profundidad de campo extendida , utilice los controles deslizantes de Velocidad/ calidad para establecer la calidad y la velocidad de procesamiento deseadas, y el registro Mapa de altura para establecer el nivel de suavidad de la topografía. Haga clic en Ejecutar para crear la imagen reconstruida.
NOTA: EDF combina la pila en una imagen 2D compuesta y nítida proyectando el mejor enfoque51. Esta técnica es útil para superar la profundidad de enfoque limitada y es adecuada para reconstruir imágenes de campo claro de secciones transversales gruesas o montajes de hojas completas. Tenga cuidado al aplicar este filtro para visualizar el fluoróforo porque, a diferencia de MIP, EDF ajusta el contraste de la imagen, afectando la intensidad del píxel. - Guarde la imagen como un archivo TIFF seleccionando Archivo | Guardar como | Tiff. Introduzca un nombre para el archivo y haga clic en Guardar.
- Unir imágenes con el plugin Grid/Collection Stitching53
- Guarde la colección de imágenes o pilas de imágenes para unirlas en un solo directorio.
- Inicie ImageJ/FIJI y seleccione Plugins | Costura | Cuadrícula/Colección Costura desde el menú. En el cuadro de diálogo Ensamblaje de cuadrícula/colección, elija Posición desconocida en el menú desplegable Tipo y, a continuación, Todos los archivos del directorio en Orden. Haga clic en Aceptar.
- En el cuadro de diálogo Montaje de cuadrícula: Posición desconocida, Todos los archivos del directorio, especifique la ubicación de las imágenes escribiendo o pegando la ruta del directorio en el campo de texto Directorio o haciendo clic en Examinar... para localizar el directorio. Haga clic en Aceptar para comenzar el proceso de costura.
NOTA: La opción Posición desconocida en el complemento Grid/Collection Stitching reconstruye una imagen compuesta a partir de un conjunto de imágenes contiguas mediante el análisis de sus regiones superpuestas. Por lo tanto, esta opción es útil para unir mosaicos de imágenes de secciones transversales o montajes de hoja completa que no se obtienen mediante una operación de escaneo de mosaicos. - Cuando termine la costura, aparecerá una nueva ventana con la imagen cosida. Guarde la imagen como un archivo TIFF seleccionando Archivo | Guardar como | Tiff. Introduzca un nombre para el archivo y haga clic en Guardar.
NOTA: La unión de grandes montajes de imágenes 2D y 3D también se puede lograr utilizando comandos de reconstrucción de imágenes en el software del microscopio o a través de las Opciones de importación de bioformatos en ImageJ/FIJI.
- Combinación de varios canales mediante el comando Combinar canales
- Inicie ImageJ/FIJI y abra las imágenes o pilas de imágenes que se van a combinar.
NOTA: Las pilas de imágenes se pueden acoplar primero mediante los pasos 4.1 o 4.2. MIP se recomienda generalmente para aplanar canales fluoróforos, mientras que EDF es más adecuado para aplanar canales de campo claro u otros canales con profundidad de enfoque variable. - Ajustar el brillo y el contraste de las imágenes con Imagen | Ajustar | Brillo/Contraste. Utilice los controles deslizantes o los campos de entrada para ajustar los parámetros y, a continuación, haga clic en Aplicar. Como alternativa, utilice un método de estiramiento de histograma lineal seleccionando Proceso | Mejorar el contraste.... Defina el porcentaje de píxeles saturados, seleccione Normalizar y, a continuación, haga clic en Aceptar.
NOTA: Al cuantificar o comparar la intensidad de la señal de fluoróforos entre imágenes, generalmente es mejor no ajustar el brillo o el contraste porque esto puede cambiar las intensidades relativas de píxeles en la imagen, lo que puede afectar las mediciones y comparaciones. - Para diferenciar entre canales, aplique pseudocolores a imágenes específicas mediante una tabla de búsqueda (LUT). Para ello, seleccione la imagen y, a continuación, en el menú ImageJ/FIJI, seleccione Imagen, haga clic en Tablas de búsqueda y elija la LUT adecuada de la lista desplegable.
- En el menú, seleccione Imagen | Color | Combinar canales. Para cada canal (C1, C2, C3...), utilice la lista desplegable para seleccionar la imagen que se asignará a ese canal. Haga clic en Aceptar para combinar los canales.
- Guarde la nueva imagen como TIFF seleccionando Archivo | Guardar como | Tiff. Introduzca un nombre para el archivo y haga clic en Guardar.
- Inicie ImageJ/FIJI y abra las imágenes o pilas de imágenes que se van a combinar.
Resultados
Análisis de sección transversal de primordios de hojas de maíz
Se utilizó la sección 2 del protocolo para cuantificar el número de venas y caracterizar los patrones de respuesta hormonal en secciones transversales de primordios de hojas de maíz con PF (Figura 4)24. Para evaluar el papel de la hormona vegetal auxina en el crecimiento foliar y la formación de venas, cuantificamos el número de venas en los primordios foliares de un mutante de maíz deficiente en auxina, borla desapareciendo254. En los primeros plastochrones, las venas en desarrollo exhiben una celularización distinta en la capa celular mediana del primordio de la hoja de maíz21,22. Sin embargo, la identificación y el recuento de venas mediante técnicas histológicas convencionales22 pueden requerir mucha mano de obra y mucho tiempo. Así, para cuantificar las venas, se utilizó el marcador de proteína de eflujo de auxina de maíz p Zm PIN1a::ZmPIN1a:YFP41 (PIN1a-YFP en adelante), que marca venas en desarrollo y hebras procambial (PCSs; Figura 4A). Usando la sección 2 del protocolo, pudimos estandarizar el muestreo de la sección transversal midiendo los primordios antes de la sección (Figura 4B, C). Descubrimos una tendencia en la que vt2 tiene un primordio más ancho y más venas de lo normal (Figura 4D,E)24, lo que es consistente con los datos de hojas completamente expandidas55, lo que indica que el defecto en vt2 comenzó temprano en el desarrollo de la hoja. Usando la sección 2 del protocolo, también pudimos examinar sistemáticamente los patrones de expresión de los reporteros de PF de respuesta hormonal en los primordios de la hoja (ver ejemplos de las imágenes en la Figura 4F-I). A través de un esquema estandarizado de muestreo de sección transversal, mapeamos la distribución de las respuestas de auxina, citoquinina (CK) y ácido giberélico (GA) en diferentes plastocrones y regiones de primordios foliares, y descubrimos nuevos patrones de respuesta que hipotetizamos que tienen implicaciones para el crecimiento de las hojas y la formación de venas24. Por lo tanto, estos resultados representativos demuestran la utilidad de la sección 2 del protocolo para el análisis de sección transversal de primordios de hojas de maíz.
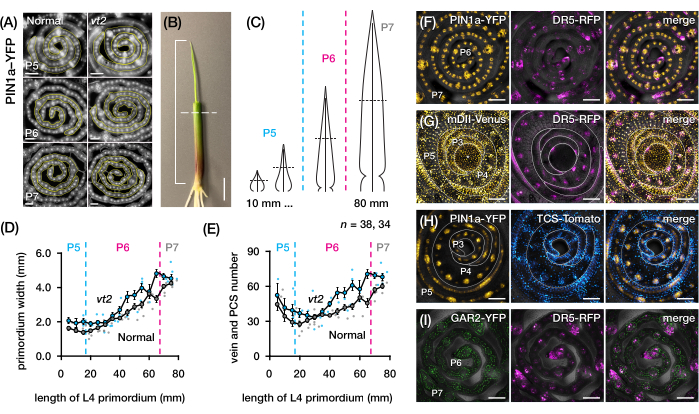
Figura 4: Resultados representativos para el análisis de sección transversal de primordios de hojas de maíz. (A-E) Cuantificación del número de venas y el ancho del primordio en primordios foliares de borla normal y en fuga2 con el marcador de proteína de eflujo de auxina PIN1a-YFP. (A) Imágenes representativas de fluorescencia de secciones transversales de P5 a P7 que expresan PIN1a-YFP en venas en desarrollo y hebras procambial. Las secciones transversales fueron fotografiadas con un microscopio de epifluorescencia utilizando un filtro FITC (excitación 495-519 nm). El número de venas y el ancho del primordio se cuantificaron utilizando las herramientas de línea multipunto y a mano alzada en FIJI/ImageJ, respectivamente. (B) Una plántula de maíz con los verticilos de la hoja superior eliminados con un pelante de alambre para exponer la punta de la cuarta hoja (L4). El corchete abarca la longitud proyectada del primibido, con la línea discontinua que indica la longitud media. (C) Diagrama esquemático de diferentes formas de primordio de P5 a P7, que ilustra cómo el número de venas y el ancho del primordio en la longitud media (línea discontinua horizontal) pueden variar dependiendo de la etapa de desarrollo del primordio. (D,E) Medición de la anchura del primordio (D) y del número de venas (E) en la sección media de longitud de la L4 de normal y vt2. La línea de tendencia representa promedios móviles de 10 mm de mediciones ± error estándar de la media (SEM). (F-I) Imágenes confocales representativas de secciones transversales de primordios foliares que expresan combinaciones de PIN1a-YFP, reportero de respuesta de auxina, DR5-RFP, reportero de respuesta de citoquinina, TCS-Tomate, marcador giberélico sensible al ácido, GAR2-YFP y mDII-Venus, una versión mutada del reportero de entrada de señalización de auxina DII-Venus. Los canales FP se superponen en el canal de campo claro en cada imagen. Barra de escala = 200 μm (A); 10 mm (B); 100 μm (F-I). Esta figura ha sido modificada y reproducida con permiso de Robil y McSteen24. Abreviaturas: DAG = días después de la germinación; P = plastocrono; vt2 = borla que desaparece2; PCS = cadena procambial; YFP = proteína fluorescente amarilla; FITC = isotiocianato de fluoresceína; RFP = proteína fluorescente roja; PIN1a-YFP = p Zm PIN1a::ZmPIN1a:YFP; DR5-RFP = DR5rev::mRFPer; TCS-Tomate = TCSv2::NLS-tdTomato; GAR2-YFP = p Zm GAR2::ZmGAR2:YFP; mDII-Venus = pZmUbi:mDII:YFP-NLS. Haga clic aquí para ver una versión más grande de esta figura.
Análisis de montaje completo de primordios de hojas de maíz
Seguimos la sección 3 del protocolo para visualizar y analizar la expresión de PF en montajes de hojas enteras de primordios de hojas de maíz (Figura 5). Al visualizar patrones de venas con PIN1a-YFP, encontramos que la formación de venas ocurre en todo el primordio durante los plastocrones tempranos, pero este proceso se restringe en las regiones proximales más adelante en el desarrollo (Figura 5A)24. Complementario a los análisis de sección transversal, los análisis de montaje de hoja entera han revelado patrones específicos de respuesta hormonal en tejidos y estadios durante la formación de venas24. Un ejemplo es el patrón de expresión del reportero de respuesta CK TCSv2::NLS-tdTomato37 (TCS-Tomato), relativo a la expresión PIN1a-YFP (Figura 5B)24. Siguiendo la sección 3 del protocolo, pudimos realizar análisis cualitativos y cuantitativos de la expresión de PF en los primordios foliares (Figura 5D-F; datos no publicados). Examinamos los patrones de expresión de un reportero de respuesta de auxina, DR5rev::mRFPer41 (DR5-RFP), y un marcador sensible a GA, p Zm GAR2::ZmGAR2:YFP39 (GAR2-YFP), en montajes de hoja entera de mutantes simples y dobles de vt2 y planta enana3 (d3), un mutante deficiente en GA56 (Figura 5D). También comparamos los niveles relativos de proliferación celular entre primordios foliares normales y vt2 usando p Zm Cyclin-D2B::ZmCyclin-D2B:YFP42 (Cyclin-D2B-YFP), que es un marcador de la transición G1/S en el ciclo celular57 (Figura 5E,F). Si bien no hubo diferencias significativas entre normal y vt2, la expresión de ciclina-D2B-YFP fue consistente con el perfil de proliferación celular conocido de plastochrons tempranos31. Concluimos que la sección 3 del protocolo es un método eficaz para analizar montos enteros de primordios de hojas de maíz, que son difíciles de visualizar debido a su morfología enrollada.
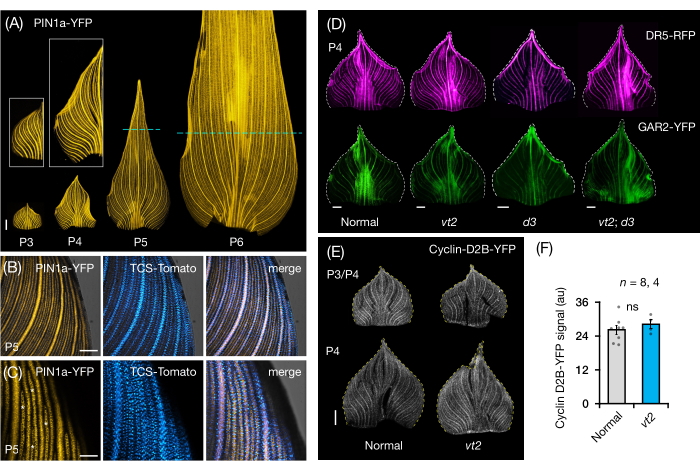
Figura 5: Resultados representativos para el análisis de montaje completo de primordios de hojas de maíz. (A) Imágenes representativas de fluorescencia de primordios de hojas de 7 plántulas de maíz DAG que muestran venas en desarrollo y hebras procambiales, marcadas por el marcador de proteína de eflujo de auxina PIN1a-YFP. Los primordios P3-P6 se extirparon de la base, se desenrollaron y se aplanaron con el lado adaxial hacia arriba. Los recuadros muestran primeros planos de P3 y P4. En P5 y P6, las líneas discontinuas demarcan el extremo distal de las zonas proliferativas, donde la mayoría de las hebras procambial todavía se están desarrollando y extendiendo. (B,C) Imágenes confocales representativas que muestran la expresión de PIN1a-YFP y el reportero de respuesta a citoquininas, TCS-Tomato, en la región marginal proximal de un primordio P5. (D) Imágenes representativas de fluorescencia de primordios P4 que muestran la expresión del reportero de respuesta de auxina, DR5-RFP, y el marcador giberélico sensible al ácido, GAR2-YFP en mutantes normales y simples y dobles de borla en fuga2 y planta enana3. (E) Imágenes confocales representativas de P3 y/o P4 que muestran la expresión de Cyclin-D2B-YFP, un reportero de la transición G1/S en el ciclo celular. (F) Cantidades relativas de proliferación celular en primordios foliares P3/P4 de normal y vt2, cuantificadas midiendo la densidad integrada de la señal Cyclin-D2B-YFP sobre el área del primordio utilizando ImageJ/FIJI. Las barras representan las medidas medias ± error estándar de la media. Barra de escala = 500 μm (A,D,E); 200 μm (B); 100 μm (C). La Figura 4A-C ha sido modificada y reproducida con permiso de Robil y McSteen24, mientras que la Figura 4D-F son datos no publicados de los autores. Abreviaturas: DAG = días después de la germinación; P = plastocrono; vt2 = borla que desaparece2; d3 = planta enana3; YFP = proteína fluorescente amarilla; RFP = proteína fluorescente roja; PIN1a-YFP = p Zm PIN1a::ZmPIN1a:YFP; TCS-Tomate = TCSv2::NLS-tdTomato; DR5-RFP = DR5rev::mRFPer; GAR2-YFP = p Zm GAR2::ZmGAR2:YFP; Ciclina-D2B-YFP = p Zm ciclina-D2B::ZmCyclin-D2B:YFP; ns = ninguna diferencia significativa; au = unidad arbitraria. Haga clic aquí para ver una versión más grande de esta figura.
Archivo Suplementario 1: Ejemplos de estadificación del desarrollo foliar en plántulas de maíz. Haga clic aquí para descargar este archivo.
Figura suplementaria S1: Muestras de plantas y materiales utilizados en los protocolos. (A,B) Una plántula de maíz 7-8 DAG con el verticilo de la hoja superior eliminado usando un pelacable. (B) El recuadro muestra un primer plano del brote con el primordio P6 expuesto. (C-G) Brotes de plántulas de maíz con los verticilos superiores eliminados para el análisis de sección transversal (C, D) y las hojas circundantes completamente eliminadas para el análisis de montaje completo (E-G). (H) Un rollo de gel de poliuretano transparente nano cinta de doble cara. (I,J) Primordio de la hoja P6 (I) y región proximal de la hoja P8 (J) desenrollados y montados en portaobjetos de vidrio con la cinta nano. (K) Un portaobjetos de vidrio con un primordio de hoja desenrollado montado en el escenario de un microscopio de epifluorescencia. Abreviatura: DAG = días después de la germinación. Haga clic aquí para descargar este archivo.
Discusión
Presentamos dos métodos para preparar primordios de hojas de maíz para imágenes celulares. El primer método (sección 2 del protocolo) permite la medición del primordio para el análisis de la sección transversal, mientras que el segundo método (sección 3 del protocolo) permite desenrollar y aplanar el primordio para el análisis de montaje completo. Estos métodos facilitan la obtención de imágenes celulares de PF en primordios24 de hojas de maíz (como se muestra en la Figura 4 y la Figura 5) y proporcionan soluciones simples a los desafíos de obtener imágenes de hojas de maíz en desarrollo. La sección 2 del protocolo reduce el tiempo de disección y mejora la precisión del muestreo al medir los primordios antes de la sección en lugar de depender únicamente de los parámetros de estadificación 9,16. Con la nanocinta disponible comercialmente, la sección 3 del protocolo resuelve el problema de larga data de obtener imágenes de primordios de hoja entera en el maíz. Este protocolo mejora el método anterior, que utilizaba tubos de diálisis 31, y es una alternativa mucho más barata a la TC y RM11,32,33. Sin embargo, cuando se trata de visualizar los rasgos anatómicos de las hojas y producir resultados óptimos, ambos protocolos tienen algunas limitaciones, que se describen en la Tabla 2 y se discuten con más detalle a continuación.
En la sección 2 del protocolo, encontramos dificultad para visualizar los contornos celulares en secciones transversales gruesas de los primordios de la hoja, y la contratinción con colorantes fluorescentes de unión a la pared celular o a la membrana plasmática no proporcionó resultados satisfactorios. Por ejemplo, FM 4-64 produjo resultados subóptimos en comparación con el marcador FP de membrana plasmática, p Zm PIP2-1::ZmPIP2-1:CFP39 (PIP2-1-CFP; Figura 3A-D). Para superar esta limitación, recomendamos usar un vibratomo para producir secciones de tejido más delgadas (~0.1 mm)58 que permitirán una imagen vívida de campo brillante de los contornos celulares u optimizando el protocolo de contratinción47,59.
En la sección 3 del protocolo, la principal limitación es la dificultad de montar la hoja sin desgarros, daños o burbujas de aire, como se detalla en los pasos del protocolo 3.2.5-3.2.6 (Figura 3E-K). Debido a que la hoja de maíz es bilateralmente simétrica, un montaje de media hoja en lugar de un montaje de hoja entera puede ser suficiente para la visualización9. Para hacer esto, el primordio se puede cortar con una cuchilla de afeitar a lo largo del eje longitudinal después de desenrollarlo hasta la nervadura central, permitiendo montar solo la mitad de la hoja. Otra limitación de la sección 3 del protocolo es que el grosor de la hoja puede limitar la resolución óptica de la señal del fluoróforo durante la obtención de imágenes profundas. Para abordar este problema, es posible emplear una técnica de limpieza de tejidos60. Sin embargo, encontramos que ClearSee61, un reactivo de limpieza comúnmente utilizado para obtener imágenes de tejidos vegetales, no es compatible con el protocolo porque hace que la muestra y el cubreobjetos se desprendan de la nanocinta. Una posible solución a este problema podría ser aplicar una membrana semipermeable31 sobre la muestra de hoja, permitiendo que sea tratada con la solución de limpieza mientras se mantiene en su lugar por la nano cinta. Este método que permite aplicar soluciones líquidas a la hoja desenrollada también podría utilizarse para técnicas de hibridación e inmunolocalización in situ de ARN de montaje completo, que previamente se han optimizado para desarrollar inflorescencias de maíz, pero no para primordios de hoja entera62,63.
Describimos protocolos para el maíz, que tiene primordios de hoja grande incluso en la etapa de plántula. Otras especies de gramíneas con primordios de hojas mucho más pequeñas, como el arroz, la cebada, el trigo, Setaria y Brachypodium 16,23,64,65,66, pueden requerir el uso de herramientas de precisión adicionales para aplicar eficazmente estos protocolos. Además, estos protocolos no estaban destinados a imágenes de células vivas, que capturan procesos dinámicos en tiempo real de formación de tejidos y respuestas celulares. Sin embargo, a medida que las sondas fluorescentes, las tecnologías de imagen y las capacidades informáticas continúan avanzando en las imágenes de células vivas para plantas67, la investigación futura podría basarse en estos protocolos para desarrollar estrategias de imágenes de células vivas adaptadas a las características únicas de los primordios de hojas de hierba.
Divulgaciones
Los autores no tienen ningún conflicto de intereses que revelar.
Agradecimientos
Los autores desean agradecer a Maize Genetics Cooperation, Maize Cell Genomics Project, Dave Jackson (Cold Spring Harbor Laboratory, NY), Anne W. Sylvester (Marine Biological Laboratory, University of Chicago, IL), Andrea Gallavotti (Rutgers University, NJ) y Carolyn G. Rasmussen (University of California, Riverside) por proporcionar las existencias mutantes y transgénicas, así como a Robert F. Baker y Alexander Jurkevich del Advanced Light Microscopy Core de la Universidad de Missouri-Columbia por su asistencia con la microscopía confocal. JMR fue apoyado por la Beca J. William Fulbright, el Fondo Diane P. y Robert E. Sharp, y el Programa de Investigación del Genoma Vegetal de la Fundación Nacional de Ciencias (IOS-1546873) a PM. CDTC, CMRV, EDCDP y RJRR son apoyados por el Programa de Becas Ateneo College. CDTC, EDCDP y RJRR cuentan con el apoyo de la beca de pregrado DOST-SEI S&T. DODL es apoyado por la Beca Académica Fr. Thomas Steinbugler SJ. RJRR cuenta con el apoyo de Aiducation International–Pathways to Higher Education Scholarship. Este trabajo fue apoyado por la Escuela de Ciencias e Ingeniería y la Biblioteca Rizal de la Universidad Ateneo de Manila.
Materiales
| Name | Company | Catalog Number | Comments |
| Acrylic Gel Clear Double Sided Nano Tape 16.5 ft x 1.2 in, 2 mm thick | EZlifego Store (Amazon) | B07YB1ZXG6 | 1 roll |
| Bellucci Pick Curved micro probe 16.8 cm, 6.6 in | Bausch & Lomb | N1692 9 | 1 pc |
| Clayman guide microprobe Sinskey hook angled shaft, 11.6 cm, 4.6 in | Storz Opthalmic Instruments | E0542 | 1 pc |
| Dental Probe, Bent Needle, 14 cm (5.5 in) | Ted Pella | 13553 | 1 pc |
| DOWELL 10-22 AWG Wire Stripper | Dowell Store (Amazon) | 10-22 AWG | 1 pc |
| Feather Double Edge Carbon Steel Blades | Ted Pella | 121-9 | pkg/10; for fine sectioning |
| Frosted End Glass Microscope Slides, 75 mm x 25 mm x 1-1.2 mm | Ted Pella | 260442 | pkg/144 |
| GEM Single Edge, Stainless Steel Uncoated Blades | Ted Pella | 121-1 | box/200; for general cutting/sectioning |
| Glycerol | Thermo Scientific | PI17904 | 1 liter |
| ImageJ/FIJI with EDF plugin (version 17.05.2021) and Grid/Collection Stitching plugin | National Institutes of Health (NIH) USA | version 2.9.0/1.54s | The EDF plugin was developed by Alex Prudencio, Jesse Berent, and Daniel Sage for the Biomedical Imaging Group, École Polytechnique Fédérale de Lausanne (EPFL; http://bigwww.epfl.ch/demo/edf/). The grid/collection stitching software was developed by Stephan Preibisch for the Max Planck Institute of Molecular Cell Biology and Genetics (MPI-CBG). |
| Kimwipes Ex-L Small 111.76 mm x 213.36 mm | Kimtech Science | 34155 | box/280 ply |
| Micro Cover Glasses, 22 mm x 22 mm x 0.13 - 0.16 mm thick | Ted Pella | 260140 | 1 ounce |
| PU Gel Clear Double Sided Nano Tape 29.5 ft x 1.18 in, 1 mm thick | Yecaye Store (Amazon) | L354 W1.18 | 2 rolls |
| Superslip Cover Glasses, 24 mm x 50 mm x 0.13 - 0.16 mm thick | Ted Pella | 260166 | 1 ounce |
| Superslip Cover Glasses, 24 mm x 60 mm x 0.13 - 0.16 mm thick | Ted Pella | 260168 | 1 ounce |
| Tempered Glass Cutting Board | Hacaroa (Amazon) | B09XMXBT5S | 4 pc |
Referencias
- McSteen, P., Kellogg, E. A. Molecular, cellular, and developmental foundations of grass diversity. Science. 377 (6606), 599-602 (2022).
- Wang, P., Vlad, D., Langdale, J. A. Finding the genes to build C4 rice. Current Opinion in Plant Biology. 31, 44-50 (2016).
- Wang, P., et al. Candidate regulators of early leaf development in maize perturb hormone signalling and secondary cell wall formation when constitutively expressed in rice. Scientific Reports. 7 (1), 4535(2017).
- Perico, C., Tan, S., Langdale, J. A. Developmental regulation of leaf venation patterns: Monocot versus eudicots and the role of auxin. New Phytologist. 234 (3), 783-803 (2022).
- Wang, P., Kelly, S., Fouracre, J. P., Langdale, J. A. Genome-wide transcript analysis of early maize leaf development reveals gene cohorts associated with the differentiation of C4 Kranz anatomy. The Plant Journal. 75 (4), 656-670 (2013).
- Liu, W. Y., et al. Regulators of early maize leaf development inferred from transcriptomes of laser capture microdissection (LCM)-isolated embryonic leaf cells. Proceedings of the National Academy of Sciences. 119 (35), e2208795119(2022).
- Liu, W. Y., et al. Anatomical and transcriptional dynamics of maize embryonic leaves during seed germination. Proceedings of the National Academy of Sciences. 110 (10), 3979-3984 (2013).
- Strable, J., Nelissen, H. The dynamics of maize leaf development: Patterned to grow while growing a pattern. Current Opinion in Plant Biology. 63, 102038(2021).
- Reynolds, J. O., Eisses, J. F., Sylvester, A. W. Balancing division and expansion during maize leaf morphogenesis: Analysis of the mutant, warty-1. Development. 125 (2), 259-268 (1998).
- Richardson, A. E., et al. Evolution of the grass leaf by primordium extension and petiole-lamina remodeling. Science. 374 (6573), 1377-1381 (2021).
- Johnston, R., Leiboff, S., Scanlon, M. J. Ontogeny of the sheathing leaf base in maize (Zea mays). New Phytologist. 205 (1), 306-315 (2015).
- Sharman, B. C. Developmental anatomy of the shoot of Zea mays L. Annals of Botany. 6 (22), 245-282 (1942).
- Johnston, R., et al. Transcriptomic analyses indicate that maize ligule development recapitulates gene expression patterns that occur during lateral organ initiation. The Plant Cell. 26 (12), 4718-4732 (2014).
- Sharman, B. C. Leaf and bud initiation in the Gramineae. Botanical Gazette. 106 (3), 269-289 (1945).
- Nelissen, H., et al. A local maximum in gibberellin levels regulates maize leaf growth by spatial control of cell division. Current Biology. 22 (13), 1183-1187 (2012).
- Itoh, J., et al. Rice plant development: From zygote to spikelet. Plant and Cell Physiology. 46 (1), 23-47 (2005).
- Ritchie, S. W., Hanway, J. J., Benson, G. O. How a corn plant develops. Iowa State University of Science and Technology. , (1986).
- Freeling, M., Walbot, V. The Maize Handbook. , Springer Science & Business Media. (2013).
- Freeling, M., Hake, S. Developmental genetics of mutants that specify knotted leaves in maize. Genetics. 111 (3), 617-634 (1985).
- Durbak, A. R., et al. Transport of boron by the tassel-less1 aquaporin is critical for vegetative and reproductive development in maize. The Plant Cell. 26 (7), 2978-2995 (2014).
- Langdale, J. A., Lane, B., Freeling, M., Nelson, T. Cell lineage analysis of maize bundle sheath and mesophyll cells. Developmental Biology. 133 (1), 128-139 (1989).
- Bosabalidis, A. M., Evert, R. F., Russin, W. A. Ontogeny of the vascular bundles and contiguous tissues in the maize leaf blade. American Journal of Botany. 81 (6), 745-752 (1994).
- Junqueira, N. E. G., et al. Anatomy and ultrastructure of embryonic leaves of the C4 species Setaria viridis. Annals of Botany. 121 (6), 1163-1172 (2018).
- Robil, J. M., McSteen, P. Hormonal control of medial-lateral growth and vein formation in the maize leaf. New Phytologist. 238 (1), 125-141 (2023).
- Donnelly, P. M., Bonetta, D., Tsukaya, H., Dengler, R. E., Dengler, N. G. Cell cycling and cell enlargement in developing leaves of Arabidopsis. Developmental Biology. 215 (2), 407-419 (1999).
- Govindaraju, P., Verna, C., Zhu, T., Scarpella, E. Vein patterning by tissue-specific auxin transport. Development. 147 (13), (2020).
- Linh, N. M., Scarpella, E. Leaf vein patterning is regulated by the aperture of plasmodesmata intercellular channels. PLoS Biology. 20 (9), e3001781(2022).
- Verna, C., Ravichandran, S. J., Sawchuk, M. G., Linh, N. M., Scarpella, E. Coordination of tissue cell polarity by auxin transport and signaling. eLife. 8, e51061(2019).
- Sawchuk, M. G., Head, P., Donner, T. J., Scarpella, E. Time-lapse imaging of Arabidopsis leaf development shows dynamic patterns of procambium formation. New Phytologist. 176 (3), 560-571 (2007).
- Linh, N. M., Scarpella, E. Confocal imaging of developing leaves. Current Protocols. 2 (1), e349(2022).
- Poethig, R. S., Szymkowiak, E. J. Clonal analysis of leaf development in maize. Maydica. 40, 67-76 (1995).
- Sprangers, K., Thys, S., van Dusschoten, D., Beemster, G. T. S. Gibberellin enhances the anisotropy of cell expansion in the growth zone of the maize leaf. Frontiers in Plant Science. 11, 1163(2020).
- Tsuda, K., et al. KNOTTED1 cofactors, BLH12 and BLH14, regulate internode patterning and vein anastomosis in maize. The Plant Cell. 29 (5), 1105-1118 (2017).
- Schindelin, J., et al. FIJI: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Plant Care Protocols - Maize. The Donald Danforth Plant Science Center's Plant Growth Facility. , Available from: https://www.danforthcenter.org/our-work/core-facilities/plant-growth/ (2019).
- Mir, R., et al. A DII domain-based auxin reporter uncovers low auxin signaling during telophase and early G1. Plant Physiology. 173 (1), 863-871 (2017).
- DeBlasio, S. L., Sylvester, A. W., Jackson, D. Illuminating plant biology: Using fluorescent proteins for high-throughput analysis of protein localization and function in plants. Briefings in Functional Genomics. 9 (2), 129-138 (2010).
- Wu, Q., Luo, A., Zadrozny, T., Sylvester, A., Jackson, D. Fluorescent protein marker lines in maize: Generation and applications. The International Journal of Developmental Biology. 57 (6-8), 535-543 (2013).
- Mohanty, A., et al. Advancing cell biology and functional genomics in maize using fluorescent protein-tagged lines. Plant Physiology. 149 (2), 601-605 (2009).
- Baker, R. F., et al. Sucrose transporter ZmSut1 expression and localization uncover new insights into sucrose phloem loading. Plant Physiology. 172 (3), 1876-1898 (2016).
- Gallavotti, A., Yang, Y., Schmidt, R. J., Jackson, D. The relationship between auxin transport and maize branching. Plant Physiology. 147 (4), 1913-1923 (2008).
- Krishnakumar, V., et al. A maize database resource that captures tissue-specific and subcellular-localized gene expression, via fluorescent tags and confocal imaging (Maize Cell Genomics Database). Plant and Cell Physiology. 56 (1), 12(2015).
- Snapp, E. L. Fluorescent proteins: A cell biologist's user guide. Trends in Cell Biology. 19 (11), 649-655 (2009).
- Geng, Y., Zhou, Y. Confocal live imaging of shoot apical meristems from different plant species. Journal of Visualized Experiments. (145), e59369(2019).
- Stanislas, T., Hamant, O., Traas, J. In-vivo analysis of morphogenesis in plants. Methods in Cell Biology. 139, Elsevier. 203-223 (2017).
- Fodor, E., Ayaydin, F. Fluorescent probes and live imaging of plant cells. Advances in Plant Ecophysiology Techniques. , Springer. 241-251 (2018).
- Grandjean, O., et al. In vivo analysis of cell division, cell growth, and differentiation at the shoot apical meristem in Arabidopsis. The Plant Cell. 16 (1), 74-87 (2004).
- Conklin, P. A., Johnston, R., Conlon, B. R., Shimizu, R., Scanlon, M. J. Plant homeodomain proteins provide a mechanism for how leaves grow wide. Development. 147 (20), (2020).
- Shaw, S. L. Imaging the live plant cell. The Plant Journal. 45 (4), 573-598 (2006).
- Klaus, A. V., Schawaroch, V., Frischmann, K. J. Confocal imaging and three-dimensional visualization of thick autofluorescent specimens. Methods in Molecular Biology. 1075, 213-225 (2014).
- Forster, B., Van De Ville, D., Berent, J., Sage, D., Unser, M. Extended depth-of-focus for multi-channel microscopy images: a complex wavelet approach. 2004 2nd IEEE International Symposium on Biomedical Imaging: Nano to Macro (IEEE Cat No. 04EX821). IEEE. , 660-663 (2004).
- Extended Depth of Field. EPFL Biomedical Imaging Group. , Available from: http://bigwww.epfl.ch/demo/edf/ (2022).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Phillips, K. A., et al. vanishing tassel2 encodes a grass-specific tryptophan aminotransferase required for vegetative and reproductive development in maize. The Plant Cell. 23 (2), 550-566 (2011).
- Robil, J. M., et al. GrasVIQ: An image analysis framework for automatically quantifying vein number and morphology in grass leaves. The Plant Journal. 107 (2), 629-648 (2021).
- Helliwell, C. A., Chandler, P. M., Poole, A., Dennis, E. S., Peacock, W. J. The CYP88A cytochrome P450, ent-kaurenoic acid oxidase, catalyzes three steps of the gibberellin biosynthesis pathway. Proceedings of the National Academy of Sciences. 98 (4), 2065-2070 (2001).
- Gutierrez, R., Quiroz-Figueroa, F., Vazquez-Ramos, J. M. Maize cyclin D2 expression, associated kinase activity and effect of phytohormones during germination. Plant and Cell Physiology. 46 (1), 166-173 (2005).
- Atkinson, J. A., Wells, D. M. An updated protocol for high throughput plant tissue sectioning. Frontiers in Plant Science. 8, 1721(2017).
- Lux, A., Morita, S., Abe, J., Ito, K. An improved method for clearing and staining free-hand sections and whole-mount samples. Annals of Botany. 96 (6), 989-996 (2005).
- Heriche, M., Arnould, C., Wipf, D., Courty, P. E. Imaging plant tissues: Advances and promising clearing practices. Trends in Plant Science. 27 (6), 601-615 (2022).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Chuck, G., Muszynski, M., Kellogg, E., Hake, S., Schmidt, R. J. The control of spikelet meristem identity by the branched silkless1 gene in maize. Science. 298 (5596), 1238-1241 (2002).
- Tran, T. M., et al. An optimized whole-mount immunofluorescence method for shoot apices. Current Protocols. 1 (4), e101(2021).
- O'Connor, D. L. PINs Lost and PINs Gained: Auxin-Transport Mediated Patterning in the Grasses. University of California, Berkeley. , Doctoral Dissertation (2012).
- Sharman, B. C., Hitch, P. A. Initiation of procambial strands in leaf primordia of bread wheat, Triticum aestivum L. Annals of Botany. 31 (2), 229-243 (1967).
- Serra, L., Tan, S., Robinson, S., Langdale, J. A. Flip-flap: A simple dual-view imaging method for 3D reconstruction of thick plant samples. Plants. 11 (4), 506(2022).
- Colin, L., et al. Imaging the living plant cell: From probes to quantification. The Plant Cell. 34 (1), 247-272 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados