Method Article
Усовершенствованные методы подготовки поперечных срезов и развернутых цельных креплений примордий листьев кукурузы для флуоресцентной и конфокальной визуализации
В этой статье
Резюме
Зачатки листьев кукурузы глубоко покрыты и свернуты, что затрудняет их изучение. Здесь мы представляем методы подготовки поперечных срезов и развернутых целых креплений зачатков листьев кукурузы для флуоресцентной и конфокальной визуализации.
Аннотация
У кукурузы (Zea mays) и других трав (Poaceae) зачатки листьев глубоко покрыты и свернуты в мутовку листа, что затрудняет изучение раннего развития листьев. Здесь мы описываем методы подготовки поперечных срезов и развернутых целых креплений зачатков листьев кукурузы для флуоресцентной и конфокальной визуализации. В первом методе используется проволочный стриппер для удаления верхних частей старых листьев, обнажая кончик зачатка листа и позволяя измерять его для более точного отбора проб поперечного сечения. Во втором методе используется прозрачная двусторонняя нанолента для развёртывания и крепления цельнолистовых зачатков для визуализации. Мы показываем полезность этих двух методов в визуализации и анализе репортеров флуоресцентных белков в кукурузе. Эти методы обеспечивают решение проблем, связанных с отличительной морфологией зачатков листьев кукурузы, и будут полезны для визуализации и количественной оценки анатомических признаков и особенностей развития листьев у кукурузы и других видов трав.
Введение
Травяные культуры являются основным источником продовольствия и биотопливадля населения планеты1, и улучшение анатомии листьев может повысить их продуктивность 2,3. Однако наше нынешнее понимание того, как регулируется анатомия листьев у трав, ограничено4 и требует анализа зачатков листьев, поскольку многие анатомические и физиологические особенности листа предопределены на ранних стадиях развития 5,6,7. Методы клеточной визуализации, такие как флуоресцентная и конфокальная визуализация, необходимы для изучения анатомии листьев травы и клеточных признаков, но эти методы трудно применить к зачаткам листьев травы, потому что они глубоко покрыты и свернуты внутри мутовки листа. Мы решили этот вопрос, разработав методы подготовки поперечных срезов и развернутых цельнолистовых креплений для флуоресцентного и конфокального анализа зачатков листьев кукурузы, модельную систему для изучения анатомии и развития листьев травы 2,8.
Лист кукурузы, как и все листья травы, состоит из ремешкообразной лопасти с оболочкой, которая оборачивается вокруг стебля и развивающегося побега 9,10,11,12,13. Листья развиваются из апикальной меристемы побега (SAM) по дистихозному рисунку, где каждый новый лист начинается в положении, противоположном предыдущему листу, в результате чего вдоль вертикальной оси образуются два ряда листьев (рис. 1A)14. Стадия развития каждого листового зачатка определяется его положением относительно SAM, при этом ближайший примордиум обозначается как пластохрон1 (P1), а следующие зачатки обозначаются как P2, P3 и т. д. (рис. 1B, C)2. Во время развития (рис. 1D) зачаток листа сначала появляется в виде контрфорса в форме полумесяца вокруг основания SAM (P1), а затем вырастает в примордиум в форме капюшона, который простирается над меристемой (P2)9,10,11. Затем базальные края капюшона расширяются латерально и перекрывают друг друга по мере роста кончика вверх, образуя конусообразный зачаток (P3-P5)10. Затем зачаток быстро увеличивается в длину, и граница влагалища и лопасти у основания становится более заметной с образованием лигулы, бахромчатого выступа на адаксиальной стороне листа (P6 / P7). Наконец, лист разворачивается, когда он выходит из мутовки во время стационарного роста, при котором делящиеся клетки ограничены в небольшой базальной области лопасти, образуя градиент с расширяющимися и дифференцирующимися клетками вдоль проксимально-дистальной оси (P7 / P8)15. Верхушка побега сеянца кукурузы содержит несколько зачатков на разных стадиях развития, что делает ее отличной моделью для изучения развития листьев8.
Точный анализ раннего развития листьев требует постановки или использования стандартизированных критериев для определения отдельных стадий развития зачатка по отношению к другим ростовым или морфологическим параметрам. Поскольку зачатки листьев скрыты внутри побега травы, исследователи обычно используют такие параметры, как возраст растения или размер появляющихся листьев, в качестве предикторов стадий и размеров зачатков листьев 9,16. У кукурузы хронологический возраст растения определяется либо количеством дней после посадки, либо прорастанием (DAP/DAG)17,18. Вегетативная стадия (V стадия) определяется самым верхним листом с видимым воротником, бледной линией на абаксиальной стороне между лопастью и влагалищем, соответствующей положению лигулы и ушных раковин, парой клиновидных областей у основания лопасти (рис. 1А,Б)17,19. Между 20 и 25 DAG SAM переходит в меристему соцветия и перестает давать новые листья20. Темпы роста зачатков листьев кукурузы могут варьироваться в зависимости от окружающей среды и генотипа растения. По этой причине возраст растения и размер появляющихся листьев не могут точно предсказать размеры листовых зачатков; Однако использование этих параметров может помочь предсказать диапазон стадий и размеров зачатков для экспериментальных целей.
Анализ поперечного среза является популярным методом изучения анатомии и развития листьев кукурузы и других трав, поскольку он позволяет отбирать образцы нескольких пластохронов в одном срезе побега21,22,23. Этот метод также удобен для клеточной визуализации свежих образцов, так как окружающие листья служат каркасом, который удерживает зачатки листьев на месте во время секционирования и монтажа24. Однако недостатком этого метода является то, что может быть сложно точно определить местоположение целевого пластохрона и области в зачатке при разделении неповрежденного побега. Кроме того, поскольку рост листьев различается по пластохронам и вдоль проксимально-дистальной оси2,5, неточный отбор проб может привести к неправильной интерпретации стадии развития и области зачатка в данном срезе. Таким образом, разработка метода точного отбора проб поперечного сечения имеет решающее значение для обеспечения точности и воспроизводимости анатомических анализов и анализов развития зачатков листьев травы.
Анализ цельного листа позволяет всесторонне и комплексно исследовать тканевые и клеточные процессы, происходящие в масштабе всего органа, такие как пролиферативный рост25 и рисунок вен26,27,28. Метод обеспечивает парадермальный обзор листа, позволяя обнаруживать различные отростки и закономерности, которые в противном случае было бы трудно обнаружить с помощью анализа поперечного сечения24,27. В отличие от Arabidopsis, где уже существуют установленные методы визуализации цельнолистовых креплений29,30, в настоящее время не существует стандартного метода визуализации развернутых цельнолистовых креплений в травах. Предыдущий протокол для развертывания изолированных зачатков листьев кукурузы включал необычные материалы и не подходил для клеточной визуализации31. Передовые методы визуализации, такие как компьютерная томография (КТ) и магнитно-резонансная томография (МРТ), позволяют получать 3D-анатомическую информацию без выделения и развертывания зачатков 11,32,33, но они дороги и требуют специализированного оборудования. Разработка метода преодоления ограничений, налагаемых свернутой и конической морфологией зачатков листьев кукурузы и других трав, будет способствовать исследованиям их анатомических особенностей и особенностей развития.
Здесь мы представляем методы подготовки поперечных срезов и развернутых целых креплений зачатков листьев кукурузы для флуоресцентной и конфокальной визуализации. Мы использовали эти методы для количественной оценки количества вен и картирования пространственно-временного распределения гормонов в зачатках листьев кукурузы с флуоресцентными белками (FP)24. Первый способ заключается в удалении верхней части старых листьев с рассады кукурузы с помощью проволочной зачистки (рис. 1E). Обнажая кончик зачатка (P5-P7), становится возможным определить его длину без необходимости полностью удалять более старые окружающие листья, что позволяет легко и точно срезать. Второй способ включает в себя разматывание и монтаж цельнолистовых зачатков (P3-P7) с помощью прозрачной двусторонней наноленты (рис. 1F). Эти методы подходят для визуализации различных FP24, но нуждаются в оптимизации для использования флуоресцентных красителей и очищающих реагентов. Кроме того, мы описываем некоторые процедуры сглаживания z-стеков, сшивания изображений и объединения каналов в ImageJ/FIJI34, которые применяются к изображениям, созданным двумя методами. Эти методы полезны для рутинной флуоресценции или конфокальной визуализации листьев кукурузы, но они также могут быть адаптированы для других модельных видов трав, таких как рис, сетария и брахиподиум.
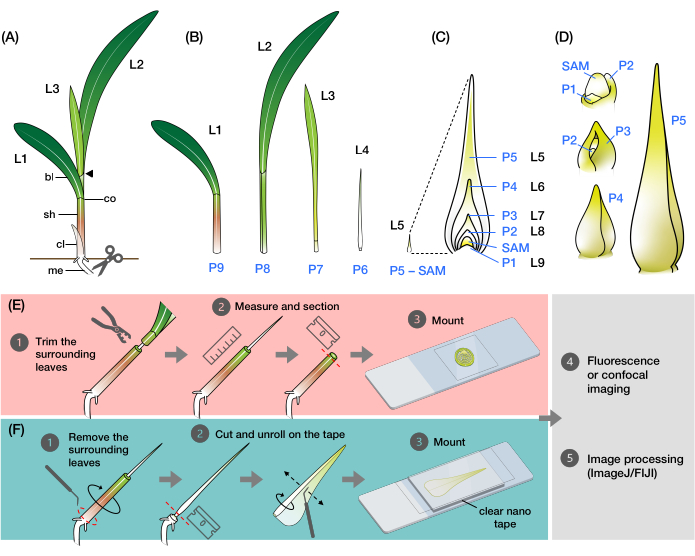
Рисунок 1: Организация и морфология зачатков листьев кукурузы и обзор методов . (А) Схематическое изображение саженца кукурузы. Кукуруза имеет дистихузную филлотаксию, при этом новый лист начинается в положении, противоположном предыдущему листу. Номер листа указывает на хронологический порядок, в котором листья появились в результате прорастания (т. е. первый лист, L1; второй лист, L2; третий лист, L3; и т. д.). Каждый лист имеет дистальную лопасть и базальную оболочку, очерченную воротником, который соответствует язычку и ушной раковине. Самый верхний лист с видимым воротником обозначает вегетативную стадию. Саженец в этом примере находится на стадии V2, с видимым воротником L2 (наконечником стрелки). Значок ножниц указывает на место в мезокотиле (me), где саженец должен быть срезан, чтобы его можно было собрать. (B) Схематическое изображение рассеченного побега, показывающего изолированные L1 - L4, с зачатками листьев от L5 до L9, показанными в виде увеличенного изображения в (C). Номер пластохрона указывает положение зачатка относительно SAM, при этом самый молодой зачаток листа (P1) находится ближе всего к SAM, а более старые зачатки листа (P2, P3, P4 и т. д.) последовательно находятся дальше2. (D) Схематическое изображение морфологии зачатков листьев кукурузы от P1 до P5. е) Схематический обзор метода анализа поперечного сечения зачатков листьев кукурузы. (1) Обрежьте старые листья с помощью проволочной зачистки. (2) Измерьте зародыш и разделите побег. (3) Закрепите секцию на предметном стекле для визуализации и обработки (4, 5). F) Схематический обзор метода анализа зачатков листьев кукурузы по всей маине. (1) Удалите окружающие листья, чтобы извлечь зачаток. (2) Разрежьте и разверните завичок на наноленте. (3) Смонтируйте образец для визуализации и обработки (4, 5). Сокращения: L = лист; bl = лезвие; sh = оболочка; СО = воротник; me = мезокотил; V = вегетативный; P = пластохрон; SAM = побег апикальной меристемы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
1. Постановка развития листьев кукурузы и планирование эксперимента
- Выращивание растений и стадия развития листьев
- Определите возраст и стадию развития растений, которые будут использоваться для эксперимента, и выполните детальную стадию развития листьев.
ПРИМЕЧАНИЕ: Рекомендуется проводить стадирование на растениях с тем же генетическим фоном, что и мутантные или трансгенные линии, которые будут использоваться в экспериментах. SAM перестает производить новые листья между 20 и 25 DAG, в зависимости от генетического фона и условий роста. По этой причине описанные здесь способы идеально подходят для всходов кукурузы в возрасте 7-14 лет назад. - Выращивайте растения кукурузы в теплице или камере выращивания, следуя подходящему протоколуухода за растениями 35.
- Соберите растения в желаемом возрасте или на стадии V с помощью небольшого ножа или ножниц, разрезав мезокотиль, который является стеблем под поверхностью почвы (рис. 1А). Осторожно вставьте режущий инструмент в почву рядом с саженцем и сдвиньте его вниз к основанию под углом 45°, чтобы разрезать мезокотиль.
- Извлеките саженец из почвы и удалите пыль с остатков грязи или частиц почвы, которые могут прилипнуть к растению. Удалите колеоптиль, защитную оболочку, покрывающую появляющийся побег у молодых саженцев, вручную.
- Для каждого растения запишите стадию V, количество листьев и длину последнего листа, выходящего из мутовки. Сфотографируйте растения для дальнейшего использования.
- Удаляйте старые листья один за другим. Для этого держите растение за остатки мезокотила или стебля, иссеките каждый лист от основания влагалища и аккуратно разверните оболочку по кругу с помощью зубного зонда (рис. 1B).
ПРИМЕЧАНИЕ: В шаге 2.1 описан быстрый способ удаления окружающих листьев. - Под стереомикроскопом с примерно 2-кратным увеличением тщательно препарируйте остальную часть верхушки побега на влажных салфетках, чтобы предотвратить высыхание образца. Аккуратно иссеките и разверните каждый лист зачатка зубным зондом с согнутой иглой или парой тонких щипцов до тех пор, пока SAM, P1 и P2 не станут видны (рис. 1D). Запишите внешний вид и размеры каждого пластохрона.
ПРИМЕЧАНИЕ: См. пример определения стадии развития листьев у проростков кукурузы в дополнительном файле 1.
- Определите возраст и стадию развития растений, которые будут использоваться для эксперимента, и выполните детальную стадию развития листьев.
- Планирование эксперимента
ПРИМЕЧАНИЕ: Тщательное планирование эксперимента может повысить эффективность. Например, при анализе поперечного сечения определение приблизительного места разреза при визуализации конкретных пластохронов или областей может сократить время вскрытия. На рисунке 2 показан пример стандартизированной выборки. Кроме того, оптимизация параметров визуализации на основе свойств FP или флуоресцентных зондов может повысить эффективность экспериментов.- Используйте информацию о постановке в качестве ориентира, чтобы сфокусировать эксперимент на конкретных пластохронах, областях зачатка и тканях. Используйте FP или другие флуоресцентные зонды, представляющие интерес, чтобы следовать разделам 2 и/или 3 ниже на нескольких образцах.
ПРИМЕЧАНИЕ: См. имеющиеся семена кукурузы FP линии FP36-42 на https://www.maizegdb.org/data_center/stock. - Определите оптимальные параметры получения изображения для каждого репортера или зонда FP, включая соответствующий детектор или фильтр, длины волн возбуждения и излучения, размер точечного отверстия и другие настройки. Сохраните настройки, чтобы воспроизвести условия работы для каждого из экспериментов.
ПРИМЕЧАНИЕ: См. Linh и Scarpella30 для некоторых технических рекомендаций по конфокальной лазерной сканирующей микроскопии развивающихся листьев. - Планируйте время получения изображения на основе периода полураспада и других свойств репортера43 FP.
ПРИМЕЧАНИЕ: Время между вскрытием и визуализацией также должно учитываться при планировании эксперимента, так как свежие образцы растений подвергаются высыханию и клеточным изменениям в течение этого периода.
- Используйте информацию о постановке в качестве ориентира, чтобы сфокусировать эксперимент на конкретных пластохронах, областях зачатка и тканях. Используйте FP или другие флуоресцентные зонды, представляющие интерес, чтобы следовать разделам 2 и/или 3 ниже на нескольких образцах.
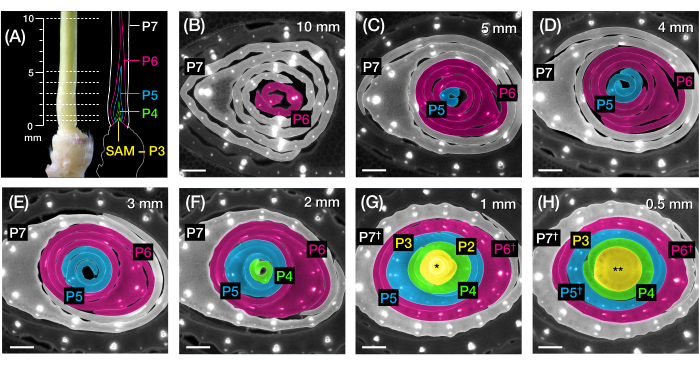
Рисунок 2: Схема отбора проб для анализа поперечного сечения зачатков листьев кукурузы. (А, слева) Проксимальный побег проростка кукурузы 7 DAG, показывающий открытый четвертый лист (L4) на P7. Прерывистыми линиями обозначены семь точек отбора проб вдоль зачатка от 0,5 мм до 10 мм. (А, справа) Схематическое изображение зачатков листьев с прогнозируемым размером и положением каждого пластохрона: P7 (белый); P6 (пурпурный); P5 (синий); P4 (зеленый); и P3 до ЗРК (желтый). (Б-Х) Флуоресцентные изображения поперечных срезов, представляющих точки отбора проб, показанные в А, от 10 мм (В) до 0,5 мм (В). Зачатки псевдоокрашены в соответствии с цветовой схемой пластохрона в (А). Срезы были изображены с помощью эпифлуоресцентного микроскопа с использованием длинночастотного эмиссионного УФ-фильтра для автофлуоресценции. Масштабная линейка = 200 мкм (B-H). Этот рисунок был изменен и воспроизведен с разрешения Робиля и МакСтина24. Сокращения: DAG = дни после появления всходов; P = пластохрон; SAM = побег апикальной меристемы; † = оболочка листа или собственно прелигула; * = побег верхушечной меристемы; ** = стебель. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Визуализация поперечных срезов зачатков листьев кукурузы
- Удаление старых окружающих листьев и измерение зачатка листа
- Соберите саженец, аккуратно разрезав его в мезокотиле под поверхностью почвы маленьким ножом или ножницами, как описано в шагах 1.1.3-1.1.4 (рис. 1A).
- Определите правильный размер отверстия для зачистки проволоки, который будет использоваться, и место, где будет сделан разрез вдоль побега. Убедитесь, что отверстие достаточно большое, чтобы соответствовать целевому зародышу.
- Начинайте срез с более дистальной части побега и постепенно двигайтесь к основанию, пока не обнажится кончик зачатка.
- Чтобы сделать срез, держите проволочный стриппер челюстями, обращенными к побегу. Поместите побег в выбранное отверстие и сожмите ручки стриппера вместе, чтобы прорезать мутовку листа.
ПРИМЕЧАНИЕ: Чтобы случайно не порезать зачаток мишени, аккуратно совместите центр побега с отверстием в проволочной зачистке. Для более крупных растений рекомендуется вручную удалить часть окружающих листьев вручную, прежде чем использовать стриппер.
ВНИМАНИЕ: Устройства для зачистки проволоки имеют острые челюсти, которые могут вызвать порезы или другие травмы, если их не использовать осторожно. - Продолжая сжимать черенки вместе, сдвиньте стриппер от побега, чтобы обрезать верхнюю часть листьев. Убедитесь, что целевая область в зачатке остается покрытой окружающими листьями (дополнительный рисунок S1C, D).
ПРИМЕЧАНИЕ: После обрезки верхних листьев побег оставляют с открытым кончиком зачатка (P5, P6 или P7, в зависимости от положения среза и размера используемого отверстия для зачистки проволоки; Рисунок 1E). Этот зачаток будет служить ориентиром для оценки размера и стадии более молодых зачатков. P6 является наиболее практичным эталоном для использования в проростках кукурузы из-за его диапазона размеров и булавочной морфологии. - С помощью линейки измерьте длину от кончика зачатка до основания побега. Запишите измерение.
ПРИМЕЧАНИЕ: Длина зачатка будет немного завышена, так как у основания зачатков есть несколько миллиметров стебля (рис. 2А).
- Срезы от руки и визуализация зачатка листа
- Под стереомикроскопом с увеличением около 0,8x держите съемку на гладкой поверхности, например на стеклянной разделочной доске или другом устойчивом к царапинам материале. Лезвием бритвы или скальпелем срежьте тонкие срезы (0,25-0,8 мм) побега в нужных точках по длине зачатка.
- Сделайте начальный срез немного выше целевой области, чтобы отбросить дистальную часть побега, а затем получите тонкие срезы вокруг целевой области. Чтобы сделать чистые надрезы, держите лезвие перпендикулярно побегу и плавным ровным движением сдвиньте его внутрь.
ПРИМЕЧАНИЕ: Для более крупных зачатков (P6 или P7) может быть несколько миллиметров свободы действий. Однако для меньших зачатков (P5 и более ранних) 1 мм может иметь существенное значение при отборе проб, так как эти зачатки складываются в пределах первых нескольких миллиметров от основания побега (см. рис. 2A, F-H). Рекомендуется использовать обоюдоострое бритвенное лезвие для более тонкого сечения.
ВНИМАНИЕ: Соблюдайте осторожность при использовании бритвенных лезвий и скальпелей, чтобы избежать случайных порезов или травм. - Регулярно заменяйте лезвие бритвы, так как листовые ножны могут легко затупить лезвие. Накрывайте побег влажными салфетками после каждого раунда секционирования, чтобы предотвратить высыхание образца.
- Установите створку на чистое предметное стекло (75 мм x 25 мм), с помощью пипетки нанесите каплю воды (или 50% глицерина) непосредственно на срез, а сверху поместите покровное стекло (22 мм x 22 мм).
- Если вы используете флуоресцентный краситель, нанесите раствор красителя на срез, поместите сверху покровное стекло и инкубируйте его по мере необходимости.
ПРИМЕЧАНИЕ: В зависимости от типа красителя могут потребоваться дополнительные этапы обработки срезов листьев, прежде чем переходить к следующему этапу. Эти ссылки44,45,46,47 содержат общие сведения и использование флуоресцентных красителей в визуализации растительных клеток. Окрашивающий ядро флуоресцентный краситель, 5-этинил-2'-дезоксиуридин (EdU), был эффективно использован на поперечных срезах зачатков48 листьев кукурузы. Напротив, окрашивающие плазматическую мембрану красители, такие как Fei Mao 4-64 (FM 4-64) и йодид пропидия, не дают удовлетворительных результатов (рис. 3A-D). - Поместите предметное стекло на столик эпифлуоресцентного или конфокального лазерного сканирующего микроскопа и отрегулируйте фокус и настройки по мере необходимости для визуализации флуорофора30. В таблице 1 приведены настройки освещения и получения изображений, используемые для выбранных репортерных линий FP кукурузы.
ПРИМЕЧАНИЕ: Толстые срезы могут давать высокие уровни фоновой автофлуоресценции. Рассмотрим некоторые стратегии визуализации и подготовки образцов, которые могут помочь смягчить эту проблему30,49 (см. Таблицу 2).
ВНИМАНИЕ: Соблюдайте осторожность и надевайте защитные очки при работе с мощными источниками света и лазерами, чтобы снизить риск повреждения глаз. - Изображение через срез листа при различных увеличениях и каналах обнаружения (включая яркое поле)30. Используйте 4-кратное увеличение для изображения всего поперечного сечения и 20-кратное или 40-кратное увеличение для изображения определенных тканей. Уменьшите время экспозиции при большем увеличении для эпифлуоресцентной визуализации, чтобы защитить образцы от быстрого фотообесцвечивания (см. Таблицу 1).
- Захват изображений всего раздела или конкретных областей интереса (ROI). При необходимости приобретите z-стек, представляющий собой серию снимков, снятых на разной глубине фокуса30.
- Чтобы получить z-стек, сначала определите верхнюю и нижнюю позиции в образце, затем количество оптических секций, которые должны быть захвачены между этими позициями. Меньшее количество оптических секций приводит к большему размеру z-шага, который представляет собой расстояние между каждой секцией. В зависимости от свойств FP и используемого увеличения, захватите от трех до 25 оптических срезов с шагом z от 1 до 12 мкм для визуализации поперечных срезов зачатков листьев кукурузы.
ПРИМЕЧАНИЕ: Чтобы сгладить z-стек, используйте соответствующую технику50 объемного рендеринга, которая может быть выполнена с помощью программного обеспечения микроскопа или с помощью ImageJ/FIJI34 (см. шаги 4.1 и 4.2). - Сохраните все файлы изображений и связанные с ними метаданные, если таковые имеются.
Таблица 1: Настройки освещения и получения изображений, используемые для флуоресцентной и конфокальной визуализации выбранных репортеров FP кукурузы. Сокращения: FP = флуоресцентный белок; TRITC = тетраметилродамин; FITC = изотиоцианат флуоресцеина; WLL = лазер белого света; Ar-ion = аргон-ионный лазер; HyD = гибридный детектор; AU = единица Эйри; Гц = Герц, строка развертки в секунду. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
3. Визуализация развернутых целых массивов зачатков листьев кукурузы
- Препарирование зачатков и подготовка предметного стекла с помощью наноленты
- Соберите саженец, аккуратно разрезав его в мезокотиле под поверхностью почвы маленьким ножом или ножницами, как описано в шагах 1.1.3-1.1.4 (рис. 1A).
- Подготовьте предметное стекло (75 мм x 25 мм) с помощью прозрачной двусторонней наноленты (дополнительный рисунок S1H) перед препарированием растения. Отрежьте прямоугольный кусок наноленты и приклейте его к центру чистого предметного стекла. Не снимайте защитную полиэтиленовую пленку с верхней стороны ленты.
ПРИМЕЧАНИЕ: Определите размер ленты для использования в соответствии с размером образцов для изображения (см. примеры негабаритных образцов на дополнительном рисунке S1I,J). Нанолента доступна как в акриловом, так и в полиуретановом гелевом материале. Оба типа эффективны для флуоресцентной и конфокальной визуализации24. Чтобы предотвратить обесцвечивание ленты, защищайте ее от длительного воздействия света, храня в темной таре. - Начните рассечение побега с удаления верхней части старых листьев с помощью проволочной зачистки, как описано в шаге 2.1.
- Держите побег за мезокотиль и аккуратно удалите окружающие листья с помощью зубного зонда, чтобы извлечь зачатки. Для этого удаляют листья с основания побега и разворачивают их по одному, пока не обнажится интересующий зачаток.
- В качестве альтернативы используйте проволочный стриппер для непосредственного извлечения зачатков листьев, сделав надрез в базальной области побега (дополнительный рисунок S1E-G).
ПРИМЕЧАНИЕ: Этот метод сопряжен с более высоким риском разрыва зачатков.
- Монтаж и визуализация зачатка.
- Снимите защитную пленку с ленты. Выложите оголенный завичок на ленту. С помощью бритвенного лезвия разрежьте зачаток у основания, отбросив базальный стебель и гипокотиль (рис. 1F).
- Разверните зародышко с помощью зубного зонда с согнутой иглой (диаметр кончика 0,25-0,6 мм). Используйте микрозонд (диаметр наконечника 0,15-0,2 мм) для зачатков размером менее 3 мм (от P3 до раннего P4).
- Расположите кончик иглы параллельно поверхности и разверните внешний базальный край, аккуратно прижимая его к ленте.
- Для более плавного разматывания смажьте внутреннюю поверхность (адаксиальную) листа, окунув кончик иглы в 100% глицерин.
- Прилипнув внешним краем к ленте, выровняйте кончик иглы параллельно длинной оси листа. Аккуратно сдвиньте иглу в сторону, чтобы развернуть и расплющить лист на ленте (рис. 1F).
ПРИМЕЧАНИЕ: Поломка или повреждение листа во время разворачивания является обычным явлением, особенно у крупных зачатков с крепкой средней жилкой (см. рис. 3E-G). Энергичное развёртывание листа может повредить его поверхность и привести к образованию артефактов во время визуализации (рис. 3H). Рекомендуемые решения этих проблем см. в таблице 2 и в обсуждении. - Нанесите каплю воды на раскатанный зачаток. Сразу же положите покровное стекло поверх капли воды и зачатка. Аккуратно прижмите края покровного стекла так, чтобы они прилипли к ленте.
ПРИМЕЧАНИЕ: Рекомендуется использовать большие прямоугольные покровные стекла (50 мм x 24 мм или 60 мм x 24 мм) с дополнительными областями для приклеивания ленты. Сведите к минимуму образование пузырьков воздуха, которые могут исказить лист и вызвать неравномерное преломление света (см. рис. 3I-K). Убедитесь, что покровное стекло полностью прилегает к ленте, так как края установленного зачатка могут откатиться под неплотно приклеенное покровное стекло (см. рис. 3L). - Поместите предметное стекло на столик эпифлуоресцентного (см. дополнительный рисунок S1K) или конфокального лазерного сканирующего микроскопа и отрегулируйте фокусировку и настройки по мере необходимости для визуализации флуорофора30. В таблице 1 приведены настройки освещения и получения изображений, используемые для выбранных репортерных линий FP кукурузы.
- Изображение всего листа или конкретного ROI через различные каналыобнаружения 30. Чтобы получить изображение всего листа, либо вручную сделайте мозаичные изображения листа, либо используйте мозаичную операцию микроскопа с малым увеличением (4x или 10x).
ПРИМЕЧАНИЕ: Даже при самом малом увеличении зачатки листьев кукурузы могут быть слишком большими для изображения с помощью эпифлуоресцентного или конфокального лазерного сканирующего микроскопа, что приводит к увеличению времени визуализации, что может привести к фотообесцвечиванию (см. рис. 3M) или усилению фоновой автофлуоресценции. Поэтому рекомендуется использовать флуоресцентный стереомикроскоп для визуализации цельных образцов размером более 5 мм. - Для конфокальной визуализации потребуется получение z-стеков, охватывающих толщину листа (см. этап 2.2.9).
- Сохраните все файлы изображений и связанные с ними метаданные, если таковые имеются.
Таблица 2: Устранение распространенных проблем при визуализации поперечных срезов и целых креплений зачатков листьев кукурузы. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
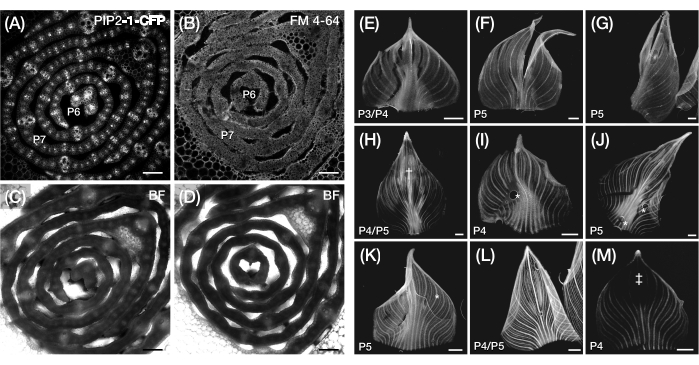
Рисунок 3: Субоптимальный поперечный срез и подготовка зачатков листьев кукурузы в цельном виде. (A-D) Репрезентативные конфокальные изображения поперечных срезов зачатков листьев с маркером плазматической мембраны PIP2-1-CFP (A) и флуоресцентным красителем, связывающим плазматическую мембрану, FM 4-64 (B), с соответствующими изображениями яркого поля (C, D). По сравнению с PIP2-1-CFP, FM 4-64 отображает неоптимальную визуализацию контуров ячеек. (Э-М) Репрезентативные флуоресцентные изображения целых креплений зачатков листьев, показывающие наличие разрывов (E-G), ушибленных поверхностей† (H), пузырьков воздуха * (I-K), откатанных краев (L) и фотообесцвеченных областей ‡ (M). Зачатки листьев экспрессируют DII-Венеру (E-G), GAR2-YFP (H-J), mDII-Венеру (K), PIN1a-YFP (L) и DR5-RFP (M). Масштабная линейка = 200 мкм (A-D); 500 мкм (Э-М). Рисунок 3A был изменен и воспроизведен с разрешения Робиля и МакСтина24, в то время как рисунок 5B-M является неопубликованными данными авторов. Сокращения: P = пластохрон; YFP = желтый флуоресцентный белок; RFP = красный флуоресцентный белок; CFP = голубой флуоресцентный белок; PIP2-1-CFP = p Zm PIP2-1::ZmPIP2-1:CFP; DII-Venus = pZmUbi:DII:YFP-NLS; GAR2-YFP = p Zm GAR2::ZmGAR2:YFP; mDII-Венера = pZmUbi:mDII:YFP-NLS; PIN1a-YFP = p Zm PIN1a::ZmPIN1a:YFP; DR5-RFP = DR5rev::mRFPer; BF = светлое поле. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Обработка изображений с помощью ImageJ/FIJI
- Сглаживание z-стеков с использованием проекции максимальной интенсивности (MIP)
- Запустите ImageJ/FIJI и откройте стек изображений или создайте новый стек из нескольких отдельных изображений, выбрав Изображение | Стеки | Изображения для стека из меню.
- Выберите стек изображений. В меню выберите Изображение | Стеки | Z-проект.... В диалоговом окне Z-Project выберите «Максимальная интенсивность » в раскрывающемся меню «Тип проекции ». Нажмите кнопку ОК , чтобы создать z-проекцию максимальной интенсивности.
ПРИМЕЧАНИЕ: Сглаженное изображение представляет собой 2D-проекцию пикселей с наибольшей интенсивностью по z-стекам50. Этот метод подходит для визуализации флуорофора, но не анатомических особенностей на изображениях толстых поперечных срезов и цельных створок. - Сохраните изображение в формате TIFF (формат файла изображения с тегами), выбрав « Файл» | Сохранить как | Тифф. Введите имя файла и нажмите кнопку «Сохранить».
ПРИМЕЧАНИЕ: Рекомендуется использовать TIFF для хранения флуоресцентных и конфокальных изображений, так как он сохраняет качество и детализацию при сохранении изображения.
- Сведение z-стеков с помощью плагина расширенной глубины резкости (EDF)51
- Установите плагинEDF 52. Скачайте файл Extended_Depth_Field.jar (версия 17.05.2021) с http://bigwww.epfl.ch/demo/edf/ и поместите его в папку «plugins» ImageJ/FIJI.
- Запустите ImageJ/FIJI и откройте стек изображений или создайте новый стек из нескольких отдельных изображений, выбрав Изображение | Стеки | Изображения для стека из меню.
- Выберите стек изображений. В меню выберите Плагины | Увеличенная глубина резкости | Простой режим EDF. В диалоговом окне « Расширенная глубина резкости » используйте ползунки в разделе « Скорость/ качество», чтобы задать желаемое качество и скорость обработки, и reg «Карта высот », чтобы задать уровень гладкости топографии. Нажмите кнопку Выполнить , чтобы создать восстановленный образ.
ПРИМЕЧАНИЕ: EDF объединяет стек в четкое композитное 2D-изображение, проецируя наилучший фокус51. Этот метод полезен для преодоления ограниченной глубины резкости и подходит для реконструкции изображений в светлом поле толстых поперечных срезов или цельнолистовых креплений. Будьте осторожны при применении этого фильтра для визуализации флуорофора, потому что, в отличие от MIP, EDF регулирует контрастность изображения, влияя на интенсивность пикселей. - Сохраните изображение в виде файла TIFF, выбрав « Файл» | Сохранить как | Тифф. Введите имя файла и нажмите кнопку «Сохранить».
- Сшивание изображений с помощью плагина Grid/Collection Stitching53
- Сохраните коллекцию изображений или стопки изображений, которые будут сшиты вместе в одном каталоге.
- Запустите ImageJ/FIJI и выберите Плагины | Сшивание | Сшивание сетки/коллекции из меню. В диалоговом окне « Сшивание сетки/коллекции » выберите « Неизвестное положение » в раскрывающемся меню « Тип », а затем « Все файлы в каталоге » из « Порядок». Нажмите кнопку ОК.
- В диалоговом окне « Сшивание сетки: неизвестное положение», «Все файлы в каталоге» укажите расположение изображений, введя или вставив путь к каталогу в текстовое поле « Каталог » или нажав кнопку «Обзор...», чтобы найти каталог. Нажмите кнопку ОК , чтобы начать процесс сшивания.
ПРИМЕЧАНИЕ: Опция « Неизвестное положение » в плагине «Сшивание сетки/коллекции » реконструирует составное изображение из набора смежных изображений, анализируя их перекрывающиеся области. Поэтому этот вариант полезен для сшивания мозаики изображений поперечных срезов или цельнолистовых креплений, полученных не с помощью операции сканирования плитки. - Когда сшивание будет завершено, появится новое окно со сшитым изображением. Сохраните изображение в виде файла TIFF, выбрав « Файл» | Сохранить как | Тифф. Введите имя файла и нажмите кнопку «Сохранить».
ПРИМЕЧАНИЕ: Сшивание больших монтажей 2D- и 3D-изображений также может быть выполнено с помощью команд реконструкции изображений в программном обеспечении микроскопа или с помощью опций импорта биоформатов в ImageJ/FIJI.
- Объединение нескольких каналов с помощью команды «Объединить каналы»
- Запустите ImageJ/FIJI и откройте изображения или стеки изображений, которые нужно объединить.
ПРИМЕЧАНИЕ: Стеки изображений можно сначала свести с помощью шагов 4.1 или 4.2. MIP обычно рекомендуется для сглаживания флуорофорных каналов, тогда как EDF лучше подходит для сплющивания каналов яркого поля или других каналов с различной глубиной резкости. - Отрегулируйте яркость и контрастность изображений с помощью Image | Отрегулируйте | Яркость/контрастность. Используйте ползунки или поля ввода для настройки параметров, затем нажмите «Применить». В качестве альтернативы можно использовать метод растяжения линейной гистограммы, выбрав «Обработать» | Повышение контрастности.... Установите процент насыщенных пикселей, выберите « Нормализовать» и нажмите кнопку «ОК».
ПРИМЕЧАНИЕ: При количественной оценке или сравнении интенсивности сигнала флуорофора между изображениями, как правило, лучше не регулировать яркость или контрастность, поскольку это может изменить относительную интенсивность пикселей на изображении, что может повлиять на измерения и сравнения. - Чтобы различать каналы, применяйте псевдоцвета к определенным изображениям с помощью таблицы подстановки (LUT). Для этого выберите изображение, затем в меню ImageJ/FIJI выберите Image, нажмите Lookup Tables и выберите соответствующий LUT из выпадающего списка.
- В меню выберите Изображение | Цвет | Слияние каналов. Для каждого канала (C1, C2, C3...) в раскрывающемся списке выберите изображение, которое будет назначено этому каналу. Нажмите кнопку ОК , чтобы объединить каналы.
- Сохраните новое изображение в формате TIFF, выбрав «Файл» | Сохранить как | Тифф. Введите имя файла и нажмите кнопку «Сохранить».
- Запустите ImageJ/FIJI и откройте изображения или стеки изображений, которые нужно объединить.
Результаты
Анализ поперечных срезов зачатков листьев кукурузы
Мы использовали раздел протокола 2 для количественной оценки количества вен и характеристики паттернов гормонального ответа в поперечных срезах зачатков листьев кукурузы с FP (рис. 4)24. Чтобы оценить роль растительного гормона ауксина в росте листьев и образовании жилок, мы количественно определили количество жилок в зачатках листьев мутанта кукурузы, дефицитного ауксина, исчезающей кисточки254. У ранних пластохронов развивающиеся жилки демонстрируют отчетливую клеточность в срединном клеточном слое зачатка листьев кукурузы21,22. Однако идентификация и подсчет вен с использованием обычных гистологических методов22 может быть трудоемким и длительным. Таким образом, для количественной оценки вен мы использовали белковый маркер оттока ауксина кукурузы p Zm PIN1a::ZmPIN1a:YFP41 (далее PIN1a-YFP), который отмечает развивающиеся вены и прокамбиальные нити (PCS; Рисунок 4А). Используя секцию протокола 2, мы смогли стандартизировать отбор проб поперечного сечения, измерив зачатки перед секционированием (рис. 4B, C). Мы обнаружили тенденцию, при которой vt2 имеет более широкий зачаток и больше жилок, чем обычно (рис. 4D, E)24, что согласуется с данными по полностью расширенным листьям55, что указывает на то, что дефект vt2 начался на ранних стадиях развития листьев. Используя раздел протокола 2, мы также смогли систематически исследовать паттерны экспрессии репортеров FP гормонального ответа в зачатках листьев (см. примеры изображений на рисунке 4F-I). С помощью стандартизированной схемы отбора проб поперечного сечения мы нанесли на карту распределение ответов ауксина, цитокинина (CK) и гибберелловой кислоты (GA) по различным пластохронам и областям зачатков листьев и обнаружили новые паттерны ответа, которые, как мы предполагаем, имеют значение для роста листьев и образования вен24. Таким образом, эти репрезентативные результаты демонстрируют полезность раздела протокола 2 для анализа поперечных срезов зачатков листьев кукурузы.
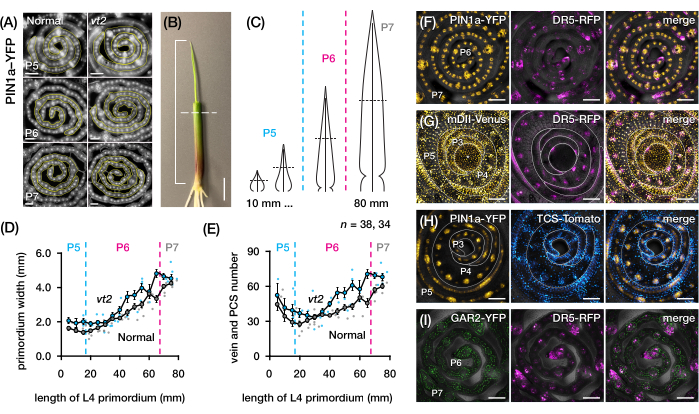
Рисунок 4: Репрезентативные результаты анализа поперечного сечения зачатков листьев кукурузы. (A-E) Количественная оценка количества жилок и ширины зачатков в зачатках листьев нормальной и исчезающей кисточки2 с маркером белка оттока ауксина PIN1a-YFP. (A) Репрезентативные флуоресцентные изображения поперечных срезов от P5 до P7, экспрессирующих PIN1a-YFP в развивающихся венах и прокамбиальных нитях. Поперечные срезы визуализировали с помощью эпифлуоресцентного микроскопа с использованием фильтра FITC (возбуждение 495-519 нм). Количество жилок и ширина зачатка были количественно определены с использованием многоточечных и произвольных линейных инструментов в FIJI/ImageJ, соответственно. (B) Саженец кукурузы с верхними завитками листьев, удаленными с помощью проволочной зачистки для обнажения кончика четвертого листа (L4). Кронштейн охватывает проецируемую длину зачатка, а пунктирная линия указывает на среднюю длину. (C) Принципиальная диаграмма различных форм зачатка от P5 до P7, иллюстрирующая, как количество жилок и ширина зачатка на средней длине (горизонтальная пунктирная линия) могут варьироваться в зависимости от стадии развития зачатка. (Д,Е) Измерение ширины зачатка (D) и числа жилок (E) в средней длине участка L4 нормы и vt2. Линия тренда представляет собой скользящие средние измерений 10 мм ± стандартной погрешности среднего значения (SEM). (Ф-И) Репрезентативные конфокальные изображения поперечных срезов зачатков листьев, экспрессирующих комбинации PIN1a-YFP, репортера ауксинового ответа, DR5-RFP, репортера цитокининового ответа, TCS-Tomato, маркера, чувствительного к гибберелловой кислоте, GAR2-YFP и mDII-Venus, мутировавшей версии репортера сигнального сигнала ауксина DII-Venus. Каналы FP накладываются на канал светлого поля на каждом изображении. Масштабная линейка = 200 мкм (А); 10 мм (В); 100 мкм (F-I). Этот рисунок был изменен и воспроизведен с разрешения Робиля и МакСтина24. Сокращения: DAG = дни после появления всходов; P = пластохрон; VT2 = исчезающая кисточка2; PCS = прокамбиальная прядь; YFP = желтый флуоресцентный белок; FITC = изотиоцианат флуоресцеина; RFP = красный флуоресцентный белок; PIN1a-YFP = p Zm PIN1a::ZmPIN1a:YFP; DR5-RFP = DR5rev::mRFPer; TCS-Tomato = TCSv2::NLS-tdTomato; GAR2-YFP = p Zm GAR2::ZmGAR2:YFP; mDII-Венера = pZmUbi:mDII:YFP-NLS. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Цельный анализ зачатков листьев кукурузы
Мы следовали разделу протокола 3 для визуализации и анализа экспрессии FP в цельнолистовых креплениях зачатков листьев кукурузы (рис. 5). Визуализируя паттерны вен с помощью PIN1a-YFP, мы обнаружили, что образование вен происходит во всем зачатке во время ранних пластохронов, но этот процесс становится ограниченным в проксимальных областях на более поздних стадиях развития (рис. 5A)24. В дополнение к анализу поперечного среза, анализ цельного листа выявил тканеспецифические и стадийные паттерны гормонального ответа во время образования вен24. Одним из примеров является паттерн экспрессии репортера ответа CK TCSv2::NLS-tdTomato37 (TCS-Tomato) относительно экспрессии PIN1a-YFP (рис. 5B)24. Следуя разделу 3 протокола, мы смогли провести как качественный, так и количественный анализ экспрессии FP в зачатках листьев (рис. 5D-F; неопубликованные данные). Мы изучили паттерны экспрессии репортера отклика ауксина, DR5rev::mRFPer41 (DR5-RFP), и GA-чувствительного маркера, p Zm GAR2::ZmGAR2:YFP39 (GAR2-YFP), в цельнолистовых креплениях одиночных и двойныхмутантов vt2 и карликового растения3 (d3), мутанта56 с дефицитом GA. Мы также сравнили относительные уровни клеточной пролиферации между нормальными и vt2 листовыми зачатками с использованием pZmCyclin-D2B::ZmCyclin-D2B:YFP42 (Cyclin-D2B-YFP), который является маркером перехода G1/S в клеточном цикле57 (рис. 5E, F). Хотя не было существенной разницы между нормальным и vt2, экспрессия Cyclin-D2B-YFP согласовывалась с известным профилем пролиферации клеток ранних пластохронов31. Мы пришли к выводу, что секция протокола 3 является эффективным методом анализа целых массивов зачатков листьев кукурузы, которые трудно визуализировать из-за их свернутой морфологии.
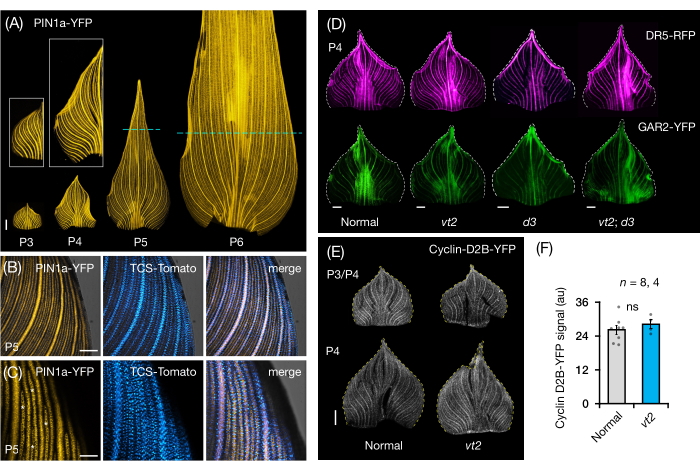
Рисунок 5: Репрезентативные результаты анализа зачатков листьев кукурузы по всей мане. (A) Репрезентативные флуоресцентные изображения зачатков листьев 7 проростков кукурузы DAG, показывающие развивающиеся жилки и прокамбиальные нити, отмеченные маркером белка оттока ауксина PIN1a-YFP. Зачатки Р3-Р6 вырезали из основания, разворачивали и уплощали адаксиальной стороной вверх. На врезках показаны крупные планы P3 и P4. В P5 и P6 пунктирные линии разграничивают дистальный конец пролиферативных зон, где большинство прокамбиальных нитей все еще развиваются и расширяются. (В,В) Репрезентативные конфокальные изображения, показывающие экспрессию PIN1a-YFP и репортера цитокинина, TCS-Tomato, в проксимальной краевой области зачатка P5. (D) Репрезентативные флуоресцентные изображения зачатков P4, показывающие экспрессию репортера ауксинового ответа, DR5-RFP и маркера, чувствительного к гибберелловой кислоте, GAR2-YFP у нормальных, одиночных и двойных мутантов исчезающей кисточки2 и карликового растения3. (E) Репрезентативные конфокальные изображения P3 и/или P4, показывающие экспрессию Cyclin-D2B-YFP, репортера перехода G1/S в клеточном цикле. (F) Относительные количества клеточной пролиферации в зачатках листьев P3/P4 в норме и vt2, количественно определяемые путем измерения интегральной плотности сигнала Cyclin-D2B-YFP по площади зачатка с использованием ImageJ/FIJI. Столбцы представляют средние измерения ± стандартную погрешность среднего значения. Линейка шкалы = 500 мкм (A, D, E); 200 мкм (В); 100 мкм (С). Рисунок 4A-C был изменен и воспроизведен с разрешения Робиля и Макстина24, в то время как рисунок 4D-F является неопубликованными данными авторов. Сокращения: DAG = дни после появления всходов; P = пластохрон; VT2 = исчезающая кисточка2; d3 = карликовое растение3; YFP = желтый флуоресцентный белок; RFP = красный флуоресцентный белок; PIN1a-YFP = p Zm PIN1a::ZmPIN1a:YFP; TCS-Tomato = TCSv2::NLS-tdTomato; DR5-RFP = DR5rev::mRFPer; GAR2-YFP = p Zm GAR2::ZmGAR2:YFP; Циклин-D2B-YFP = pZmЦиклин-D2B::ZmЦиклин-D2B:YFP; ns = нет существенной разницы; au = произвольная единица. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл 1: Примеры стадий развития листьев у проростков кукурузы. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S1: Образцы растений и материалы, используемые в протоколах. (А,Б) Рассада кукурузы 7-8 DAG с верхней листовой мутовкой удаляется с помощью проволочного стриппера. (B) На врезке показан крупный план съемки с экспонированным зачатком P6. (К-Г) Всходы проростков кукурузы с удаленными верхними мутовками для анализа поперечного сечения (C, D) и окружающими листьями полностью удаленными для анализа всей горы (E-G). (H) Рулон полиуретановой гелевой прозрачной двусторонней наноленты. (И,Ж) Зачаток листа P6 (I) и проксимальная область листа P8 (J) разворачиваются и устанавливаются на предметные стекла с помощью наноленты. (K) Предметное стекло с развернутым зачатком листа, установленное на столике эпифлуоресцентного микроскопа. Аббревиатура: DAG = дни после появления всходов. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Мы представляем два метода подготовки зачатков листьев кукурузы к клеточной визуализации. Первый метод (раздел протокола 2) позволяет измерять зачаток для анализа поперечного сечения, в то время как второй метод (раздел протокола 3) позволяет разворачивать и сплющивать зачаток для анализа всего крепления. Эти методы облегчают клеточную визуализацию FP в зачатках листьевкукурузы 24 (как показано на рисунках 4 и 5) и обеспечивают простые решения проблем визуализации развивающихся листьев кукурузы. Секция протокола 2 сокращает время вскрытия и повышает точность отбора проб за счет измерения зачатков до секционирования, а не полагаясь исключительно на параметры постановки 9,16. С помощью коммерчески доступной наноленты раздел протокола 3 решает давнюю проблему визуализации цельнолистовых зачатков кукурузы. Этот протокол улучшает предыдущий метод, в котором использовалась диализная трубка 31, и является гораздо более дешевой альтернативой КТ и МРТ11,32,33. Однако, когда дело доходит до визуализации анатомических признаков листа и получения оптимальных результатов, оба протокола имеют некоторые ограничения, которые изложены в таблице 2 и более подробно обсуждаются ниже.
В разделе протокола 2 мы столкнулись с трудностями визуализации контуров клеток в толстых поперечных срезах зачатков листьев, а контрокрашивание флуоресцентными красителями, связывающими клеточную стенку или плазматическую мембрану, не дало удовлетворительных результатов. Например, FM 4-64 дал субоптимальные результаты по сравнению с маркером FP плазматической мембраны, p Zm PIP2-1::ZmPIP2-1:CFP39 (PIP2-1-CFP; Рисунок 3А-Г). Чтобы преодолеть это ограничение, мы рекомендуем использовать вибратому для получения более тонких срезов ткани (~0,1 мм)58, что позволит получить яркую визуализацию очертаний клеток в ярком поле или оптимизировать протокол контрокрашивания47,59.
В разделе 3 протокола основным ограничением является сложность монтажа створки без разрыва, повреждения или пузырьков воздуха, как подробно описано в этапах протокола 3.2.5-3.2.6 (рис. 3E-K). Поскольку лист кукурузы является двусторонне симметричным, для визуализации9 может быть достаточно полулистового крепления, а не цельнолистового. Для этого зачаток можно разрезать лезвием бритвы вдоль продольной оси, предварительно развернув его до средней жилки, позволив смонтировать только половину листа. Еще одно ограничение раздела протокола 3 заключается в том, что толщина листа может ограничивать оптическое разрешение сигнала флуорофора во время глубокой визуализации. Для решения этой проблемы можно использовать технику очистки тканей60. Однако мы обнаружили, что ClearSee61, широко используемый очищающий реагент для визуализации тканей растений, несовместим с протоколом, поскольку он вызывает отделение образца и покровного стекла от наноленты. Потенциальным решением этой проблемы может быть нанесение полупроницаемой мембраны31 на образец листа, позволяющей обрабатывать его очищающим раствором, удерживая его на месте нанолентой. Такой метод, позволяющий наносить жидкие растворы на развернутый лист, может также быть использован для методов гибридизации и иммунолокализации цельной РНК in situ, которые ранее были оптимизированы для развития соцветий кукурузы, но не для цельнолистовых зачатков62,63.
Мы описали протоколы для кукурузы, которая имеет крупнолистные зачатки даже на стадии рассады. Другие виды трав с гораздо меньшими зачатками листьев, такие как рис, ячмень, пшеница, сетария и Brachypodium 16,23,64,65,66, могут потребовать использования дополнительных прецизионных инструментов для эффективного применения этих протоколов. Кроме того, эти протоколы не предназначались для визуализации живых клеток, которая фиксирует динамические процессы формирования тканей и клеточных реакций в режиме реального времени. Однако по мере того, как флуоресцентные зонды, технологии визуализации и вычислительные возможности продолжают развиваться в области визуализации живых клеток для растений67, будущие исследования могут основываться на этих протоколах для разработки стратегий визуализации живых клеток, адаптированных к уникальным особенностям зачатков листьев травы.
Раскрытие информации
У авторов нет конфликтов интересов, которые необходимо раскрывать.
Благодарности
Авторы хотели бы поблагодарить Сотрудничество в области генетики кукурузы, Проект геномики клеток кукурузы, Дэйва Джексона (Лаборатория Колд-Спринг-Харбор, Нью-Йорк), Энн В. Сильвестр (Морская биологическая лаборатория, Чикагский университет, Иллинойс), Андреа Галлавотти (Университет Рутгерса, Нью-Джерси) и Кэролин Г. Расмуссен (Калифорнийский университет, Риверсайд) за предоставление мутантных и трансгенных запасов, а также Роберта Ф. Бейкера и Александра Юркевича из Центра усовершенствованной световой микроскопии в Университете Нью-Джерси. Миссури-Колумбия за помощь в конфокальной микроскопии. JMR был поддержан стипендией Уильяма Фулбрайта, Фондом Дианы. и Роберта Э. Шарпа и Программой исследований генома растений Национального научного фонда (IOS-1546873) для PM. CDTC, CMRV, EDCDP и RJRR поддерживаются стипендиальной программой колледжа Атенео. CDTC, EDCDP и RJRR поддерживаются стипендией бакалавриата DOST-SEI S&T. DODL поддерживается академической стипендией о. Томас Штайнбуглер SJ. RJRR поддерживается стипендией Aiducation International - Pathways to Higher Education. Эта работа была поддержана Школой науки и техники и библиотекой Рисаль Университета Атенео де Манила.
Материалы
| Name | Company | Catalog Number | Comments |
| Acrylic Gel Clear Double Sided Nano Tape 16.5 ft x 1.2 in, 2 mm thick | EZlifego Store (Amazon) | B07YB1ZXG6 | 1 roll |
| Bellucci Pick Curved micro probe 16.8 cm, 6.6 in | Bausch & Lomb | N1692 9 | 1 pc |
| Clayman guide microprobe Sinskey hook angled shaft, 11.6 cm, 4.6 in | Storz Opthalmic Instruments | E0542 | 1 pc |
| Dental Probe, Bent Needle, 14 cm (5.5 in) | Ted Pella | 13553 | 1 pc |
| DOWELL 10-22 AWG Wire Stripper | Dowell Store (Amazon) | 10-22 AWG | 1 pc |
| Feather Double Edge Carbon Steel Blades | Ted Pella | 121-9 | pkg/10; for fine sectioning |
| Frosted End Glass Microscope Slides, 75 mm x 25 mm x 1-1.2 mm | Ted Pella | 260442 | pkg/144 |
| GEM Single Edge, Stainless Steel Uncoated Blades | Ted Pella | 121-1 | box/200; for general cutting/sectioning |
| Glycerol | Thermo Scientific | PI17904 | 1 liter |
| ImageJ/FIJI with EDF plugin (version 17.05.2021) and Grid/Collection Stitching plugin | National Institutes of Health (NIH) USA | version 2.9.0/1.54s | The EDF plugin was developed by Alex Prudencio, Jesse Berent, and Daniel Sage for the Biomedical Imaging Group, École Polytechnique Fédérale de Lausanne (EPFL; http://bigwww.epfl.ch/demo/edf/). The grid/collection stitching software was developed by Stephan Preibisch for the Max Planck Institute of Molecular Cell Biology and Genetics (MPI-CBG). |
| Kimwipes Ex-L Small 111.76 mm x 213.36 mm | Kimtech Science | 34155 | box/280 ply |
| Micro Cover Glasses, 22 mm x 22 mm x 0.13 - 0.16 mm thick | Ted Pella | 260140 | 1 ounce |
| PU Gel Clear Double Sided Nano Tape 29.5 ft x 1.18 in, 1 mm thick | Yecaye Store (Amazon) | L354 W1.18 | 2 rolls |
| Superslip Cover Glasses, 24 mm x 50 mm x 0.13 - 0.16 mm thick | Ted Pella | 260166 | 1 ounce |
| Superslip Cover Glasses, 24 mm x 60 mm x 0.13 - 0.16 mm thick | Ted Pella | 260168 | 1 ounce |
| Tempered Glass Cutting Board | Hacaroa (Amazon) | B09XMXBT5S | 4 pc |
Ссылки
- McSteen, P., Kellogg, E. A. Molecular, cellular, and developmental foundations of grass diversity. Science. 377 (6606), 599-602 (2022).
- Wang, P., Vlad, D., Langdale, J. A. Finding the genes to build C4 rice. Current Opinion in Plant Biology. 31, 44-50 (2016).
- Wang, P., et al. Candidate regulators of early leaf development in maize perturb hormone signalling and secondary cell wall formation when constitutively expressed in rice. Scientific Reports. 7 (1), 4535(2017).
- Perico, C., Tan, S., Langdale, J. A. Developmental regulation of leaf venation patterns: Monocot versus eudicots and the role of auxin. New Phytologist. 234 (3), 783-803 (2022).
- Wang, P., Kelly, S., Fouracre, J. P., Langdale, J. A. Genome-wide transcript analysis of early maize leaf development reveals gene cohorts associated with the differentiation of C4 Kranz anatomy. The Plant Journal. 75 (4), 656-670 (2013).
- Liu, W. Y., et al. Regulators of early maize leaf development inferred from transcriptomes of laser capture microdissection (LCM)-isolated embryonic leaf cells. Proceedings of the National Academy of Sciences. 119 (35), e2208795119(2022).
- Liu, W. Y., et al. Anatomical and transcriptional dynamics of maize embryonic leaves during seed germination. Proceedings of the National Academy of Sciences. 110 (10), 3979-3984 (2013).
- Strable, J., Nelissen, H. The dynamics of maize leaf development: Patterned to grow while growing a pattern. Current Opinion in Plant Biology. 63, 102038(2021).
- Reynolds, J. O., Eisses, J. F., Sylvester, A. W. Balancing division and expansion during maize leaf morphogenesis: Analysis of the mutant, warty-1. Development. 125 (2), 259-268 (1998).
- Richardson, A. E., et al. Evolution of the grass leaf by primordium extension and petiole-lamina remodeling. Science. 374 (6573), 1377-1381 (2021).
- Johnston, R., Leiboff, S., Scanlon, M. J. Ontogeny of the sheathing leaf base in maize (Zea mays). New Phytologist. 205 (1), 306-315 (2015).
- Sharman, B. C. Developmental anatomy of the shoot of Zea mays L. Annals of Botany. 6 (22), 245-282 (1942).
- Johnston, R., et al. Transcriptomic analyses indicate that maize ligule development recapitulates gene expression patterns that occur during lateral organ initiation. The Plant Cell. 26 (12), 4718-4732 (2014).
- Sharman, B. C. Leaf and bud initiation in the Gramineae. Botanical Gazette. 106 (3), 269-289 (1945).
- Nelissen, H., et al. A local maximum in gibberellin levels regulates maize leaf growth by spatial control of cell division. Current Biology. 22 (13), 1183-1187 (2012).
- Itoh, J., et al. Rice plant development: From zygote to spikelet. Plant and Cell Physiology. 46 (1), 23-47 (2005).
- Ritchie, S. W., Hanway, J. J., Benson, G. O. How a corn plant develops. Iowa State University of Science and Technology. , (1986).
- Freeling, M., Walbot, V. The Maize Handbook. , Springer Science & Business Media. (2013).
- Freeling, M., Hake, S. Developmental genetics of mutants that specify knotted leaves in maize. Genetics. 111 (3), 617-634 (1985).
- Durbak, A. R., et al. Transport of boron by the tassel-less1 aquaporin is critical for vegetative and reproductive development in maize. The Plant Cell. 26 (7), 2978-2995 (2014).
- Langdale, J. A., Lane, B., Freeling, M., Nelson, T. Cell lineage analysis of maize bundle sheath and mesophyll cells. Developmental Biology. 133 (1), 128-139 (1989).
- Bosabalidis, A. M., Evert, R. F., Russin, W. A. Ontogeny of the vascular bundles and contiguous tissues in the maize leaf blade. American Journal of Botany. 81 (6), 745-752 (1994).
- Junqueira, N. E. G., et al. Anatomy and ultrastructure of embryonic leaves of the C4 species Setaria viridis. Annals of Botany. 121 (6), 1163-1172 (2018).
- Robil, J. M., McSteen, P. Hormonal control of medial-lateral growth and vein formation in the maize leaf. New Phytologist. 238 (1), 125-141 (2023).
- Donnelly, P. M., Bonetta, D., Tsukaya, H., Dengler, R. E., Dengler, N. G. Cell cycling and cell enlargement in developing leaves of Arabidopsis. Developmental Biology. 215 (2), 407-419 (1999).
- Govindaraju, P., Verna, C., Zhu, T., Scarpella, E. Vein patterning by tissue-specific auxin transport. Development. 147 (13), (2020).
- Linh, N. M., Scarpella, E. Leaf vein patterning is regulated by the aperture of plasmodesmata intercellular channels. PLoS Biology. 20 (9), e3001781(2022).
- Verna, C., Ravichandran, S. J., Sawchuk, M. G., Linh, N. M., Scarpella, E. Coordination of tissue cell polarity by auxin transport and signaling. eLife. 8, e51061(2019).
- Sawchuk, M. G., Head, P., Donner, T. J., Scarpella, E. Time-lapse imaging of Arabidopsis leaf development shows dynamic patterns of procambium formation. New Phytologist. 176 (3), 560-571 (2007).
- Linh, N. M., Scarpella, E. Confocal imaging of developing leaves. Current Protocols. 2 (1), e349(2022).
- Poethig, R. S., Szymkowiak, E. J. Clonal analysis of leaf development in maize. Maydica. 40, 67-76 (1995).
- Sprangers, K., Thys, S., van Dusschoten, D., Beemster, G. T. S. Gibberellin enhances the anisotropy of cell expansion in the growth zone of the maize leaf. Frontiers in Plant Science. 11, 1163(2020).
- Tsuda, K., et al. KNOTTED1 cofactors, BLH12 and BLH14, regulate internode patterning and vein anastomosis in maize. The Plant Cell. 29 (5), 1105-1118 (2017).
- Schindelin, J., et al. FIJI: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Plant Care Protocols - Maize. The Donald Danforth Plant Science Center's Plant Growth Facility. , Available from: https://www.danforthcenter.org/our-work/core-facilities/plant-growth/ (2019).
- Mir, R., et al. A DII domain-based auxin reporter uncovers low auxin signaling during telophase and early G1. Plant Physiology. 173 (1), 863-871 (2017).
- DeBlasio, S. L., Sylvester, A. W., Jackson, D. Illuminating plant biology: Using fluorescent proteins for high-throughput analysis of protein localization and function in plants. Briefings in Functional Genomics. 9 (2), 129-138 (2010).
- Wu, Q., Luo, A., Zadrozny, T., Sylvester, A., Jackson, D. Fluorescent protein marker lines in maize: Generation and applications. The International Journal of Developmental Biology. 57 (6-8), 535-543 (2013).
- Mohanty, A., et al. Advancing cell biology and functional genomics in maize using fluorescent protein-tagged lines. Plant Physiology. 149 (2), 601-605 (2009).
- Baker, R. F., et al. Sucrose transporter ZmSut1 expression and localization uncover new insights into sucrose phloem loading. Plant Physiology. 172 (3), 1876-1898 (2016).
- Gallavotti, A., Yang, Y., Schmidt, R. J., Jackson, D. The relationship between auxin transport and maize branching. Plant Physiology. 147 (4), 1913-1923 (2008).
- Krishnakumar, V., et al. A maize database resource that captures tissue-specific and subcellular-localized gene expression, via fluorescent tags and confocal imaging (Maize Cell Genomics Database). Plant and Cell Physiology. 56 (1), 12(2015).
- Snapp, E. L. Fluorescent proteins: A cell biologist's user guide. Trends in Cell Biology. 19 (11), 649-655 (2009).
- Geng, Y., Zhou, Y. Confocal live imaging of shoot apical meristems from different plant species. Journal of Visualized Experiments. (145), e59369(2019).
- Stanislas, T., Hamant, O., Traas, J. In-vivo analysis of morphogenesis in plants. Methods in Cell Biology. 139, Elsevier. 203-223 (2017).
- Fodor, E., Ayaydin, F. Fluorescent probes and live imaging of plant cells. Advances in Plant Ecophysiology Techniques. , Springer. 241-251 (2018).
- Grandjean, O., et al. In vivo analysis of cell division, cell growth, and differentiation at the shoot apical meristem in Arabidopsis. The Plant Cell. 16 (1), 74-87 (2004).
- Conklin, P. A., Johnston, R., Conlon, B. R., Shimizu, R., Scanlon, M. J. Plant homeodomain proteins provide a mechanism for how leaves grow wide. Development. 147 (20), (2020).
- Shaw, S. L. Imaging the live plant cell. The Plant Journal. 45 (4), 573-598 (2006).
- Klaus, A. V., Schawaroch, V., Frischmann, K. J. Confocal imaging and three-dimensional visualization of thick autofluorescent specimens. Methods in Molecular Biology. 1075, 213-225 (2014).
- Forster, B., Van De Ville, D., Berent, J., Sage, D., Unser, M. Extended depth-of-focus for multi-channel microscopy images: a complex wavelet approach. 2004 2nd IEEE International Symposium on Biomedical Imaging: Nano to Macro (IEEE Cat No. 04EX821). IEEE. , 660-663 (2004).
- Extended Depth of Field. EPFL Biomedical Imaging Group. , Available from: http://bigwww.epfl.ch/demo/edf/ (2022).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Phillips, K. A., et al. vanishing tassel2 encodes a grass-specific tryptophan aminotransferase required for vegetative and reproductive development in maize. The Plant Cell. 23 (2), 550-566 (2011).
- Robil, J. M., et al. GrasVIQ: An image analysis framework for automatically quantifying vein number and morphology in grass leaves. The Plant Journal. 107 (2), 629-648 (2021).
- Helliwell, C. A., Chandler, P. M., Poole, A., Dennis, E. S., Peacock, W. J. The CYP88A cytochrome P450, ent-kaurenoic acid oxidase, catalyzes three steps of the gibberellin biosynthesis pathway. Proceedings of the National Academy of Sciences. 98 (4), 2065-2070 (2001).
- Gutierrez, R., Quiroz-Figueroa, F., Vazquez-Ramos, J. M. Maize cyclin D2 expression, associated kinase activity and effect of phytohormones during germination. Plant and Cell Physiology. 46 (1), 166-173 (2005).
- Atkinson, J. A., Wells, D. M. An updated protocol for high throughput plant tissue sectioning. Frontiers in Plant Science. 8, 1721(2017).
- Lux, A., Morita, S., Abe, J., Ito, K. An improved method for clearing and staining free-hand sections and whole-mount samples. Annals of Botany. 96 (6), 989-996 (2005).
- Heriche, M., Arnould, C., Wipf, D., Courty, P. E. Imaging plant tissues: Advances and promising clearing practices. Trends in Plant Science. 27 (6), 601-615 (2022).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Chuck, G., Muszynski, M., Kellogg, E., Hake, S., Schmidt, R. J. The control of spikelet meristem identity by the branched silkless1 gene in maize. Science. 298 (5596), 1238-1241 (2002).
- Tran, T. M., et al. An optimized whole-mount immunofluorescence method for shoot apices. Current Protocols. 1 (4), e101(2021).
- O'Connor, D. L. PINs Lost and PINs Gained: Auxin-Transport Mediated Patterning in the Grasses. University of California, Berkeley. , Doctoral Dissertation (2012).
- Sharman, B. C., Hitch, P. A. Initiation of procambial strands in leaf primordia of bread wheat, Triticum aestivum L. Annals of Botany. 31 (2), 229-243 (1967).
- Serra, L., Tan, S., Robinson, S., Langdale, J. A. Flip-flap: A simple dual-view imaging method for 3D reconstruction of thick plant samples. Plants. 11 (4), 506(2022).
- Colin, L., et al. Imaging the living plant cell: From probes to quantification. The Plant Cell. 34 (1), 247-272 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены