Method Article
Enine kesitler hazırlamak için geliştirilmiş yöntemler ve floresan ve konfokal görüntüleme için mısır yaprağı primordiasının bütün montajlarını açma
Bu Makalede
Özet
Mısır yaprağı primordiaları derinlemesine kaplanır ve yuvarlanır, bu da onları incelemeyi zorlaştırır. Burada, floresan ve konfokal görüntüleme için enine kesitler ve açılmış mısır yaprağı primordialarının bütün montajlarını hazırlamak için yöntemler sunuyoruz.
Özet
Mısır (Zea mays) ve diğer otlarda (Poaceae), yaprak primordiası yaprak fahişesi içinde derinlemesine kaplanır ve yuvarlanır, bu da erken yaprak gelişimini incelemeyi zorlaştırır. Burada, floresan ve konfokal görüntüleme için enine kesitler ve açılmış bütün mısır yaprağı primordia montajlarını hazırlama yöntemlerini açıklıyoruz. İlk yöntem, eski yaprakların üst kısımlarını çıkarmak, yaprak primordiyumunun ucunu açığa çıkarmak ve daha doğru enine kesit örneklemesi için ölçümüne izin vermek için bir tel sıyırıcı kullanır. İkinci yöntem, görüntüleme için tüm yaprak primordiasını açmak ve monte etmek için açık, çift taraflı nano bant kullanır. İki yöntemin mısırdaki floresan protein muhabirlerini görselleştirme ve analiz etmedeki faydasını gösteriyoruz. Bu yöntemler, mısır yaprağı primordiasının ayırt edici morfolojisinin sunduğu zorluklara bir çözüm sunar ve mısır ve diğer çim türlerinde yaprak anatomik ve gelişimsel özelliklerini görselleştirmek ve ölçmek için yararlı olacaktır.
Giriş
Çim bitkileri,küresel nüfus 1 için önemli bir gıda ve biyoyakıt kaynağıdır ve yaprak anatomisinin iyileştirilmesi, verimliliklerini artırma potansiyeline sahiptir 2,3. Bununla birlikte, yaprak anatomisinin çimlerde nasıl düzenlendiğine dair mevcut anlayışımızsınırlıdır 4 ve yaprağın birçok anatomik ve fizyolojik özelliği gelişimin erken dönemlerinde önceden belirlendiğinden, yaprak primordiasının analizini gerektirir 5,6,7. Floresan ve konfokal görüntüleme gibi hücresel görüntüleme teknikleri, çim yaprağı anatomisini ve hücresel özelliklerini incelemek için vazgeçilmezdir, ancak bu tekniklerin çim yaprağı primordiasına uygulanması zordur, çünkü bunlar yaprak fahişesi içinde derinlemesine kaplanmış ve yuvarlanmıştır. Bu sorunu, çim yaprağı anatomisini ve gelişimini incelemek için bir model sistem olan mısır yaprağı primordiasının floresan ve konfokal analizi için enine kesitler ve yuvarlanmamış tam yaprak montajları hazırlamak için yöntemler geliştirerek ele aldık 2,8.
Mısır yaprağı, tüm çim yaprakları gibi, sapın etrafını saran ve 9,10,11,12,13 filizlenen bir kılıfa sahip kayış benzeri bir bıçaktan oluşur. Yapraklar, sürgün apikal meristeminden (SAM) distichous bir desende gelişir, burada her yeni yaprak bir önceki yaprağın zıt pozisyonunda başlar ve dikey eksen boyunca iki yaprak sırası ile sonuçlanır (Şekil 1A)14 . Her yaprak primordiyumunun gelişim aşaması, SAM'a göre konumu ile tanımlanır, en yakın primordyum plastochron1 (P1) olarak adlandırılır ve aşağıdaki primordia P2, P3 vb. olarak adlandırılır (Şekil 1B, C)2. Geliştirme sırasında (Şekil 1D), yaprak primordiyumu ilk önce SAM'ın (P1) tabanı etrafında hilal şeklinde bir payanda olarak görünür ve daha sonra meristem (P2) 9,10,11 üzerinde uzanan başlık şeklinde bir primordiyuma dönüşür. Kaputun bazal kenar boşlukları daha sonra yanal olarak genişler ve uç yukarı doğru büyüdükçe üst üste binerek koni şeklinde bir primordyum (P3-P5)10 oluşturur. Primordium daha sonra hızla uzar ve tabandaki kılıf-bıçak sınırı, yaprağın adaksiyel tarafındaki saçak benzeri projeksiyon olan ligule oluşumu ile daha belirgin hale gelir (P6 / P7). Son olarak, yaprak kararlı durum büyümesi sırasında ortaya çıkarken açılır, burada bölünen hücreler bıçağın küçük bazal bölgesi içinde kısıtlanır, proksimal-distal eksen boyunca genişleyen ve farklılaşan hücrelerle bir gradyan oluşturur (P7 / P8)15. Bir mısır fidesinin sürgün tepesi, gelişimin farklı aşamalarında birden fazla primordia içerir ve bu da onu yaprak gelişimini incelemek için mükemmel bir model haline getirir8.
Erken yaprak gelişiminin doğru analizi, diğer büyüme veya morfolojik parametrelerle ilişkili olarak primordyum gelişiminin farklı aşamalarını tanımlamak için evreleme veya standartlaştırılmış kriterlerin kullanılmasını gerektirir. Yaprak primordiası çim çekiminin içine gizlendiğinden, araştırmacılar tipik olarak bitkinin yaşı veya ortaya çıkan yaprakların büyüklüğü gibi parametreleri yaprak primordiasının aşamaları ve boyutları için öngörücü olarak kullanırlar 9,16. Mısırda, bitkinin kronolojik yaşı, ekimden veya çimlenmeden sonraki gün sayısına göre belirlenir (DAP / DAG)17,18. Vejetatif aşama (V aşaması), görünür bir yakaya sahip en üstteki yaprak, bıçak ile kılıf arasındaki abaksiyel tarafta ligule ve kulak kepçelerinin konumuna karşılık gelen soluk bir çizgi, bıçağın tabanında bir çift kama şeklinde bölge tarafından belirlenir (Şekil 1A, B)17,19 . 20 ila 25 DAG arasında, SAM çiçeklenme meristemine dönüşür ve yeni yapraklar üretmeyi bırakır20. Mısır yaprağı primordiasının büyüme oranları, çevreye ve bitkinin genotipine bağlı olarak değişebilir. Bu nedenle, bitki yaşı ve ortaya çıkan yaprakların büyüklüğü, yaprak primordiasının boyutlarını doğru bir şekilde tahmin edemez; Bununla birlikte, bu parametrelerin kullanılması, deneysel amaçlar için primordia aşamalarının ve boyutlarının aralığını tahmin etmeye yardımcı olabilir.
Enine kesit analizi, mısır ve diğer çimlerde yaprak anatomisini ve gelişimini incelemek için popüler bir yöntemdir, çünkü sürgün21,22,23 boyunca tek bir bölümde birden fazla plastokronun örneklenmesine izin verir. Bu yöntem aynı zamanda taze numunelerin hücresel görüntülenmesi için de uygundur, çünkü çevreleyen yapraklar kesitleme ve montaj sırasında yaprak primordiasını yerinde tutan bir iskele görevi görür24. Bununla birlikte, bu yöntemin bir dezavantajı, sağlam bir çekimden kesit alırken hedef plastokronun ve bölgenin primordiyum içinde tam olarak konumlandırılmasının zor olabilmesidir. Ayrıca, yaprak büyümesi plastokronlar arasında ve proksimal-distal eksen2,5 boyunca değiştiğinden, kesin olmayan örnekleme, belirli bir bölümdeki primordiumun gelişim aşamasının ve bölgesinin yanlış yorumlanmasına neden olabilir. Bu nedenle, hassas enine kesit örneklemesi için bir yöntem geliştirmek, çim yaprağı primordiasının anatomik ve gelişimsel analizlerinin doğruluğunu ve tekrarlanabilirliğini sağlamak için kritik öneme sahiptir.
Tam yaprak montaj analizi, proliferatif büyüme 25 ve damar desenleme26,27,28 gibi tüm organ ölçeğinde meydana gelen doku ve hücresel süreçlerin kapsamlı ve bütünleştirici bir şekilde araştırılmasını sağlar. Yöntem, yaprağın paradermal bir genel bakışını sağlar ve enine kesit analizi24,27 kullanılarak tespit edilmesi zor olacak farklı süreçlerin ve kalıpların keşfedilmesini sağlar. Tam yaprak montajlarını görüntülemek için zaten belirlenmiş yöntemlerin bulunduğu Arabidopsis'in aksine29,30, şu anda çimlerde yuvarlanmamış tam yaprak montajlarını görüntülemek için standart bir yöntem yoktur. İzole mısır yaprağı primordiasının açılması için önceki bir protokol nadir materyalleri içeriyordu ve hücresel görüntüleme için uygun değildi31. Bilgisayarlı tomografi (BT) ve manyetik rezonans görüntüleme (MRG) gibi gelişmiş görüntüleme teknikleri, primordia 11,32,33'ü izole etmeden ve açmadan 3D anatomik bilgi elde edebilir, ancak pahalıdır ve özel ekipman gerektirir. Mısır ve diğer otlardaki yaprak primordiasının haddelenmiş ve konik morfolojisinin getirdiği kısıtlamaların üstesinden gelmek için bir teknik geliştirmek, anatomik ve gelişimsel özelliklerine yönelik araştırmaları ilerletecektir.
Burada, floresan ve konfokal görüntüleme için enine kesitler ve açılmış mısır yaprağı primordialarının bütün montajlarını hazırlamak için yöntemler sunuyoruz. Bu yöntemleri damar sayısını ölçmek ve mısır yaprağı primordiasında mekansal-zamansal hormon dağılımını floresan proteinlerle (FP'ler) haritalamak için kullandık24. İlk yöntem, yaşlı yaprakların üst kısmının mısır fidelerinden bir tel sıyırıcı ile çıkarılmasını içerir (Şekil 1E). Primordiumun ucunu (P5-P7) açığa çıkararak, eski çevreleyen yaprakları tamamen çıkarmak zorunda kalmadan uzunluğunu belirlemek mümkün hale gelir, böylece kolay ve doğru bölümleme sağlanır. İkinci yöntem, tüm yapraklı primordia'nın (P3-P7) şeffaf, çift taraflı nano bantla açılmasını ve monte edilmesini içerir (Şekil 1F). Bu yöntemler çeşitli FPs24'ü görselleştirmek için uygundur, ancak floresan boyaları ve temizleme reaktiflerini kullanmak için optimizasyona ihtiyaç duyar. Ek olarak, z-yığınlarını düzleştirmek, görüntüleri dikmek ve ImageJ / FIJI34'teki kanalları birleştirmek için iki yöntemle üretilen görüntüler için geçerli olan bazı prosedürleri özetliyoruz. Bu yöntemler, mısır yapraklarının rutin floresansı veya konfokal görüntülenmesi için yararlıdır, ancak pirinç, Setaria ve Brachypodium gibi diğer model çim türleri için de uyarlanabilirler.
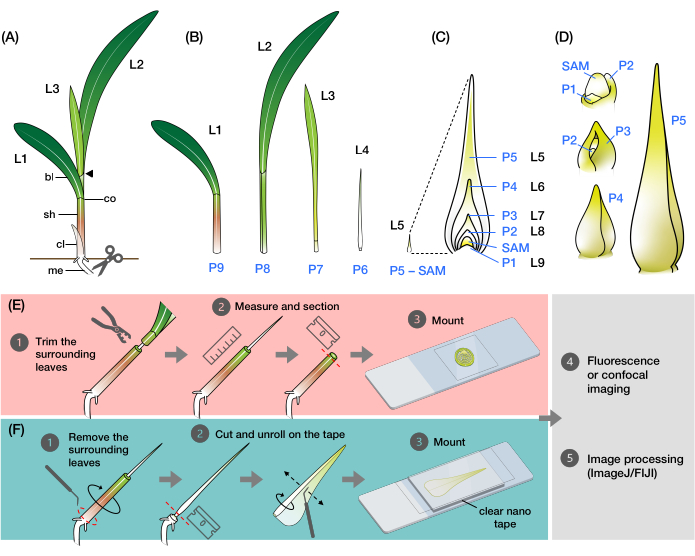
Şekil 1: Mısır yaprağı primordiasının organizasyonu ve morfolojisi ve yöntemlere genel bakış . (A) Bir mısır fidanının şematik gösterimi. Mısır, yeni yaprağın önceki yaprağın zıt pozisyonunda başladığı distichous phyllotaxy'ye sahiptir. Yaprak numarası, yaprakların çimlenmeden ortaya çıktığı kronolojik sırayı gösterir (yani, birinci yaprak, L1; ikinci yaprak, L2; üçüncü yaprak, L3; vb.). Her yaprağın distal bir bıçağı ve ligule ve kulak kepçesine karşılık gelen bir yaka ile çizilmiş bazal bir kılıfı vardır. Yakası görülebilen en üstteki yaprak vejetatif aşamayı gösterir. Bu örnekteki fide V2 aşamasındadır ve L2 tasması (ok ucu) görülebilir. Makas simgesi, fidenin toplanması için kesilmesi gereken mezokotil (me) yerini gösterir. (B) İzole edilmiş L1'den L4'e kadar olan disseke edilmiş çekimin şematik gösterimi, yaprak primordia L5 ila L9 (C)'de büyütülmüş bir görüntü olarak gösterilir. Plastochron sayısı, primordiumun SAM'a göre konumunu gösterir, en genç yaprak primordium (P1) SAM'a en yakın ve daha yaşlı yaprak primordia (P2, P3, P4vb.) art arda 2'den daha uzaktadır. (D) Mısır yaprağı primordiasının P1'den P5'e morfolojisinin şematik gösterimi. (E) Mısır yaprağı primordiasının enine kesit analizi yöntemine şematik genel bakış. (1) Eski yaprakları bir tel sıyırıcı ile kesin. (2) Primordiumu ölçün ve çekimi kesinleştirin. (3) Görüntüleme ve işleme için bölümü bir slayta monte edin (4, 5). (F) Mısır yaprağı primordiasının tam montajlı analizi için yönteme şematik genel bakış. (1) Primordiumu çıkarmak için çevredeki yaprakları çıkarın. (2) Primordiumu nano bant üzerinde düz bir şekilde kesin ve açın. (3) Numuneyi görüntüleme ve işleme için monte edin (4, 5). Kısaltmalar: L = yaprak; bl = bıçak; sh = kılıf; co = yaka; me = mezokotil; V = bitkisel; P = plastokron; SAM = apikal meristemi vur. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Protokol
1. Mısır yaprağı gelişiminin evrelendirilmesi ve deneyin tasarlanması
- Bitkilerin yetiştirilmesi ve yaprak gelişiminin evrelendirilmesi
- Deney için kullanılacak bitkilerin yaşını ve gelişim aşamasını belirler ve yaprak gelişiminin ayrıntılı bir evrelemesini gerçekleştirir.
NOT: Evrelemenin, deneylerde kullanılacak mutant veya transgenik çizgilerle aynı genetik altyapıya sahip bitkiler üzerinde yapılması önerilir. SAM, genetik arka plana ve büyüme koşullarına bağlı olarak 20 ila 25 DAG arasında yeni yapraklar üretmeyi durdurur. Bu nedenle, burada açıklanan yöntemler 7-14 DAG yaş arası mısır fideleri için idealdir. - Mısır bitkilerini uygun bir bitki bakım protokolünü izleyerek bir serada veya büyüme odasında yetiştirin35.
- İstenilen yaş veya V aşamasındaki bitkileri toprak yüzeyinin altındaki sap olan mezokotilden keserek küçük bir bıçak veya makas çifti ile toplayın (Şekil 1A). Kesici aleti fidenin yanındaki toprağa dikkatlice yerleştirin ve mezokotil kesmek için 45 ° 'lik bir açıyla tabana doğru kaydırın.
- Fideyi topraktan çıkarın ve bitkiye yapışmış olabilecek kalan kir veya toprak parçacıklarının tozunu alın. Genç fidelerde ortaya çıkan sürgünü kaplayan koruyucu kılıf olan koleoptili elle çıkarın.
- Her bitki için V aşamasını, yaprak sayısını ve çıkan son yaprağın uzunluğunu kaydedin. İleride başvurmak üzere bitkilerin fotoğraflarını çekin.
- Eski yaprakları tek tek çıkarın. Bunu yapmak için, bitkiyi mezokotil veya sapın kalıntıları tarafından tutun ve her bir yaprağı kılıfın tabanından çıkarın ve kılıfı bir diş probu ile dairesel bir şekilde yavaşça açın (Şekil 1B).
NOT: Çevredeki yaprakları çıkarmaya yönelik hızlı bir yöntem için adım 2.1'e bakın. - Yaklaşık 2x büyütmede stereo mikroskop altında, numunenin kurumasını önlemek için sürgün tepesinin geri kalanını nemli mendiller üzerinde dikkatlice disseke edin. Her yaprak primordiyumunu bükülmüş bir iğne veya bir çift ince forseps ile SAM, P1 ve P2 görünür olana kadar bir diş probu ile nazikçe tüketin ve açın (Şekil 1D). Her plastoronun görünümünü ve ölçümünü kaydedin.
NOT: Ek Dosya 1'deki mısır fidelerinde yaprak geliştirme evrelemesi örneğine bakın.
- Deney için kullanılacak bitkilerin yaşını ve gelişim aşamasını belirler ve yaprak gelişiminin ayrıntılı bir evrelemesini gerçekleştirir.
- Denemeyi planlama
NOT: Deneyin dikkatli bir şekilde planlanması verimliliği artırabilir. Örneğin, enine kesit analizinde, belirli plastokronları veya bölgeleri görüntülerken kesilecek yaklaşık yerin belirlenmesi diseksiyon süresini azaltabilir. Şekil 2'de standartlaştırılmış örneklemenin bir örneği gösterilmektedir. Ayrıca, görüntüleme parametrelerini FP'lerin veya floresan probların özelliklerine göre optimize etmek, deneylerin verimliliğini artırabilir.- Evreleme bilgilerini, deneyi belirli plastokronlara, primordium bölgelerine ve dokulara odaklamak için bir rehber olarak kullanın. Birkaç numune üzerinde aşağıdaki bölüm 2 ve / veya 3'ü takip etmek için FP'leri veya diğer ilgili floresan probları kullanın.
NOT: https://www.maizegdb.org/data_center/stock'de mevcut mısır FP marker hattına36-42 tohum stoklarına bakın. - Uygun dedektör veya filtre, uyarma ve emisyon dalga boyları, iğne deliği boyutu ve diğer ayarlar dahil olmak üzere her FP muhabiri veya probu için en uygun görüntü yakalama parametrelerini belirleyin. Denemelerin her birinin çalışma koşullarını yeniden oluşturmak için ayarları kaydedin.
NOT: Gelişmekte olan yaprakların konfokal lazer tarama mikroskopisi için bazı teknik kılavuzlar için Linh ve Scarpella30'a bakınız. - Görüntüleme süresini FP muhabiri43'ün yarı ömrüne ve diğer özelliklerine göre planlayın.
NOT: Bir deney planlanırken diseksiyon ve görüntüleme arasındaki süre de dikkate alınmalıdır, çünkü taze bitki örnekleri bu süre zarfında kurumaya ve hücresel değişikliklere maruz kalır.
- Evreleme bilgilerini, deneyi belirli plastokronlara, primordium bölgelerine ve dokulara odaklamak için bir rehber olarak kullanın. Birkaç numune üzerinde aşağıdaki bölüm 2 ve / veya 3'ü takip etmek için FP'leri veya diğer ilgili floresan probları kullanın.
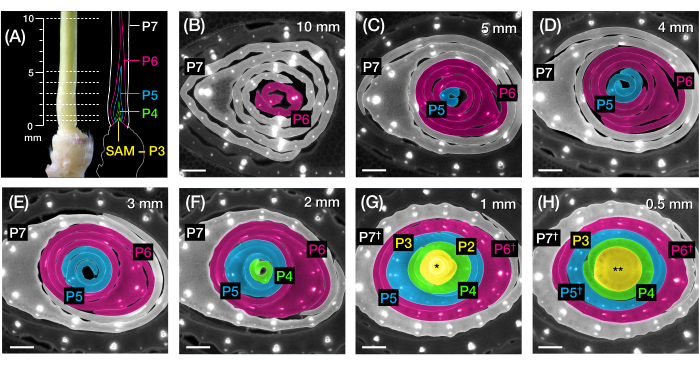
Şekil 2: Mısır yaprağı primordiasının enine kesit analizi için örnekleme şeması. (A, solda) 7 DAG'lık bir mısır fidesinin proksimal çekimi, P7'de açıkta kalan dördüncü bir yaprağı (L4) gösterir. Kırık çizgiler, primordiyum boyunca yedi örnekleme noktasını 0,5 mm'den 10 mm'ye kadar gösterir. (A, sağda) Yaprak primordiasının şematik gösterimi, her plastoronun öngörülen boyutu ve konumu ile: P7 (beyaz); P6 (macenta); P5 (mavi); P4 (yeşil); ve P3 SAM'a kadar (sarı). (B-H) A'da gösterilen örnekleme noktalarını temsil eden enine kesitlerin floresan görüntüleri 10 mm (B) ila 0,5 mm (H). Primordia, (A)'daki plastochron renk şemasına göre psödorenklidir. Kesitler, otofloresan için longpass-emisyonlu UV filtresi kullanılarak bir epifloresan mikroskobu ile görüntülendi. Ölçek çubuğu = 200 μm (B-H). Bu rakam Robil ve McSteen24'ün izniyle değiştirilmiş ve çoğaltılmıştır. Kısaltmalar: DAG = çimlenmeden sonraki günler; P = plastokron; SAM = apikal meristemi vurun; † = yaprak kılıfı veya uygun pre-ligule; * = apikal meristemi vurun; ** = kök. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
2. Mısır yaprağı primordiasının enine kesitlerinin görüntülenmesi
- Çevredeki yaşlı yaprakların soyulması ve yaprak primordiyumunun ölçülmesi
- Fideyi, 1.1.3-1.1.4 adımlarında açıklandığı gibi, toprak yüzeyinin altındaki mezokotilde küçük bir bıçak veya makasla dikkatlice keserek toplayın (Şekil 1A).
- Kullanılacak doğru tel sıyırıcı delik boyutunu ve kesimin çekim boyunca nerede yapılacağını belirleyin. Deliğin hedef primordiyuma uyacak kadar büyük olduğundan emin olun.
- Sürgünün daha distal kısmında kesmeye başlayın ve primordiumun ucu açığa çıkana kadar yavaş yavaş tabana doğru çalışın.
- Kesimi yapmak için, tel sıyırıcıyı çeneleri çekime bakacak şekilde tutun. Çekimi seçilen deliğe yerleştirin ve yaprak fahişesini kesmek için striptizci tutamaçlarını birbirine sıkın.
NOT: Hedef primordiyumun yanlışlıkla kesilmesini önlemek için, çekimin merkezini tel sıyırıcıdaki delikle dikkatlice hizalayın. Daha büyük bitkiler için, striptizciyi kullanmadan önce çevredeki yaprakların bir kısmının elle çıkarılması önerilir.
DİKKAT: Tel sıyırıcılar, dikkatli kullanılmadığı takdirde kesiklere veya diğer yaralanmalara neden olabilecek keskin çenelere sahiptir. - Tutamaçları birbirine sıkmaya devam ederken, yaprakların üst kısmını kesmek için striptizciyi sürgünden uzaklaştırın. Primordiyumdaki hedef bölgenin çevredeki yapraklar tarafından kaplandığından emin olun (Ek Şekil S1C, D).
NOT: Üst yaprakları kestikten sonra, sürgün açıkta kalan bir primordium ucu (kesimin konumuna ve kullanılan tel sıyırıcı deliğinin boyutuna bağlı olarak P5, P6 veya P7) ile bırakılır; Şekil 1E). Bu primordiyum, genç primordia'nın boyutunu ve aşamasını tahmin etmek için referans olarak hizmet edecektir. P6, boyut aralığı ve pim benzeri morfolojisi nedeniyle mısır fidelerinde kullanılacak en pratik referanstır. - Primordiumun ucundan çekimin tabanına kadar olan uzunluğu ölçmek için bir cetvel kullanın. Ölçümü kaydedin.
NOT: Primordia'nın tabanında birkaç milimetre gövde olduğu için primordiyumun uzunluğu biraz fazla tahmin edilecektir (Şekil 2A).
- Yaprak primordiyumunun serbest elle kesitlenmesi ve görüntülenmesi
- Yaklaşık 0,8x büyütmede stereo mikroskop altında, çekimi cam kesme tahtası veya çizilmeye karşı dayanıklı başka bir malzeme gibi pürüzsüz bir yüzeyde sabit tutun. Çekimin ince bölümlerini (0.25-0.8 mm) primordyum uzunluğu boyunca istenen noktalarda kesmek için bir tıraş bıçağı veya neşter kullanın.
- Çekimin distal kısmını atmak için hedef bölgenin biraz üzerinde bir ilk kesim yapın ve ardından hedef bölgenin etrafında ince kesitler elde edin. Temiz kesimler yapmak için, bıçağı sürgüne dik tutun ve pürüzsüz, eşit bir hareketle içeri doğru kaydırın.
NOT: Daha büyük primordia (P6 veya P7) için birkaç milimetre kesit boşluğu olabilir. Bununla birlikte, daha küçük primordialar için (P5 ve öncesi), 1 mm örneklemede önemli bir fark yaratabilir, çünkü bu primordialar sürgün tabanının ilk birkaç milimetresi içinde istiflenir (bkz. Şekil 2A, F-H). Daha ince kesitleme için çift kenarlı bir tıraş bıçağı kullanılması önerilir.
DİKKAT: Kazara kesik veya yaralanmalardan kaçınmak için tıraş bıçağı ve neşter kullanırken dikkatli olun. - Tıraş bıçağını düzenli olarak değiştirin, çünkü yaprak kılıfları bıçağı kolayca donuklaştırabilir. Numunenin kurumasını önlemek için her kesit turundan sonra sürgünü nemli mendillerle örtün.
- Yaprak bölümünü temiz bir cam slayda (75 mm x 25 mm) monte edin, doğrudan bölüme bir damla su (veya% 50 gliserol) uygulamak için bir pipet kullanın ve üstüne bir kapak kayması (22 mm x 22 mm) yerleştirin.
- Bir floresan boya kullanıyorsanız, boya çözeltisini bölüme uygulayın, üstüne bir kapak kayması yerleştirin ve gerektiğinde inkübe edin.
NOT: Boya türüne bağlı olarak, bir sonraki adıma geçmeden önce yaprak bölümlerinin işlenmesi için ek adımlar gerekebilir. Bu referanslar44,45,46,47, bitki hücresi görüntülemede floresan boyaların genel ayrıntılarını ve kullanımlarını sağlar. Çekirdek boyayan floresan boya, 5-etinil-2′-deoksiüridin (EdU), mısır yaprağı primordia48'in enine kesitlerinde etkili bir şekilde kullanılmıştır. Buna karşılık, Fei Mao 4-64 (FM 4-64) ve propidyum iyodür gibi plazma membran boyama boyaları tatmin edici sonuçlar vermez (Şekil 3A-D). - Slaydı bir epifloresan veya konfokal lazer tarama mikroskobunun sahnesine yerleştirin ve florofor30'u görselleştirmek için odağı ve ayarları gerektiği gibi ayarlayın. Seçilen mısır FP muhabir hatları için kullanılan aydınlatma ve görüntü yakalama ayarları için Tablo 1'e bakınız.
NOT: Kalın kesitler yüksek düzeyde arka plan otofloresansı üretebilir. Bu sorunu hafifletmeye yardımcı olabilecek bazı görüntüleme ve numune hazırlama stratejilerini göz önünde bulundurun30,49 (bkz. Tablo 2).
DİKKAT: Göz hasarı riskini azaltmak için güçlü ışık kaynakları ve lazerlerle çalışırken dikkatli olun ve koruyucu gözlük takın. - Yaprak bölümünden farklı büyütmelerde ve algılama kanallarında (parlak alan aydınlatması dahil) görüntü alın30. Enine bölümün tamamını görüntülemek için 4x büyütme ve belirli dokuları görüntülemek için 20x veya 40x büyütme kullanın. Numuneleri hızlı fotobeyazlatmadan korumak için epifloresan görüntüleme için daha yüksek büyütmelerde maruz kalma süresini azaltın (bkz. Tablo 1).
- Tüm bölümün veya belirli ilgi alanlarının (YG) görüntülerini yakalayın. Gerekirse, farklı odak derinliklerinde30 oranında yakalanan bir dizi görüntü olan bir z-yığını edinin.
- Bir z-yığını elde etmek için, önce numunedeki üst ve alt konumları, ardından bu konumlar arasında yakalanması gereken optik bölümlerin sayısını belirleyin. Daha az optik bölüm, her bölüm arasındaki mesafe olan daha büyük bir z-adım boyutuyla sonuçlanır. FP'nin özelliklerine ve kullanılan büyütmeye bağlı olarak, mısır yaprağı primordiasının enine kesitlerini görüntülemek için 1 ila 12 μm arasında z-adım boyutlarına sahip üç ila 25 optik bölüm yakalayın.
NOT: z-yığınını düzleştirmek için, mikroskop yazılımı veya ImageJ/FIJI34 kullanılarak gerçekleştirilebilecek uygun bir hacim oluşturma tekniği50 kullanın (bkz. adım 4.1 ve 4.2). - Varsa, tüm görüntü dosyalarını ve bunlarla ilişkili meta verileri kaydedin.
Tablo 1: Seçilen mısır FP muhabirlerinin floresan ve konfokal görüntülemesi için kullanılan aydınlatma ve görüntü yakalama ayarları. Kısaltmalar: FP = floresan protein; TRITC = tetrametilrhodamin; FITC = floresein izotiyosiyanat; WLL = beyaz ışık lazeri; Ar-ion = argon iyon lazer; HyD = hibrit dedektör; AU = Havadar birim; Hz = Hertz, saniyede tarama çizgisi. Bu Tabloyu indirmek için lütfen tıklayınız.
3. Görüntüleme mısır yaprağı primordia bütün monte açılmış
- Primordia'nın diseke edilmesi ve cam slaytın nano bantla hazırlanması
- Fideyi, 1.1.3-1.1.4 adımlarında açıklandığı gibi, toprak yüzeyinin altındaki mezokotilde küçük bir bıçak veya bir çift makasla dikkatlice keserek toplayın (Şekil 1A).
- Tesisi disseke etmeden önce cam slaydı (75 mm x 25 mm) berrak, çift taraflı nano bantla (Ek Şekil S1H) hazırlayın. Dikdörtgen bir nano bant parçasını kesin ve temiz bir cam slaydın ortasına yapıştırın. Bandın üst tarafındaki koruyucu plastik filmi çıkarmayın.
NOT: Kullanılacak bandın boyutunu, görüntüye alınan örneklerin boyutuna göre belirleyin ( Ek Şekil S1I,J'deki büyük boyutlu numune örneklerine bakın). Nano bant, akrilik veya poliüretan jel malzemede mevcuttur. Her iki tip de floresan ve konfokal görüntüleme için etkilidir24. Bandın renginin bozulmasını önlemek için, karanlık bir kapta saklayarak ışığa uzun süre maruz kalmaktan koruyun. - Adım 2.1'de açıklandığı gibi, eski yaprakların üst kısmını bir tel sıyırıcı ile çıkararak çekimi disseke etmeye başlayın.
- Sürgünü mezokotil tarafından tutun ve primordia'yı çıkarmak için çevredeki yaprakları bir diş probu ile dikkatlice çıkarın. Bunu yapmak için, yaprakları sürgünün tabanından çıkarın ve ilgilenilen primordium ortaya çıkana kadar teker teker açın.
- Alternatif olarak, sürgünün bazal bölgesinde bir kesim yaparak yaprak primordiasını doğrudan çıkarmak için tel sıyırıcıyı kullanın (Ek Şekil S1E-G).
NOT: Bu yöntem, primordia'yı yakalama riski daha yüksektir.
- Primordiumun montajı ve görüntülenmesi.
- Koruyucu filmi banttan çıkarın. Açıkta kalan primordiumu bandın üzerine yerleştirin. Primordyumu tabandan kesmek, bazal gövdeyi ve hipokotili atmak için bir tıraş bıçağı kullanın (Şekil 1F).
- Bükülmüş bir iğneye sahip bir diş probu kullanarak primordiumu açın (uç çapı 0.25-0.6 mm). 3 mm'den küçük primordia için bir mikroprob (uç çapı 0,15-0,2 mm) kullanın (P3 ila erken P4).
- İğne ucunu yüzeye paralel olarak konumlandırın ve dış bazal kenar boşluğunu açarak yavaşça banda bastırın.
- Daha yumuşak bir şekilde açmak için, iğnenin ucunu% 100 gliserol içine batırarak yaprağın iç yüzeyini (adaksiyel) yağlayın.
- Dış kenar boşluğu banda yapışırken, iğne ucunu yaprağın uzun eksenine paralel olarak hizalayın. Yaprağı açmak ve bandın üzerine düzleştirmek için iğneyi yavaşça yana doğru kaydırın (Şekil 1F).
NOT: Yuvarlanma sırasında yaprağın kırılması veya zarar görmesi, özellikle sağlam bir midrib ile daha büyük primordialarda yaygındır (bkz. Şekil 3E-G). Yaprağın kuvvetli bir şekilde açılması, yüzeyini çürütebilir ve görüntüleme sırasında artefaktlar üretebilir (Şekil 3H). Bu sorunlara önerilen çözümler için Tablo 2'ye ve tartışmaya bakın. - Yuvarlanmamış primordiyuma bir damla su uygulayın. Hemen su damlasının ve primordiumun üzerine bir kapak kayması yerleştirin. Kapak kaymasının kenarlarını, banda yapışmaları için yavaşça bastırın.
NOT: Banda yapışmak için ekstra alanlara sahip büyük dikdörtgen kapakların (50 mm x 24 mm veya 60 mm x 24 mm) kullanılması önerilir. Yaprağı bozabilecek ve eşit olmayan ışık kırılmasına neden olabilecek hava kabarcıklarının oluşumunu en aza indirin (bkz. Şekil 3I-K). Takılı primordiumun kenar boşlukları gevşek bir şekilde yapıştırılmış bir kapak kaymasının altına geri dönebileceğinden, kapak kaymasının banda tamamen yapıştığından emin olun (bkz. Şekil 3L). - Slaydı bir epifloresan ( bakınız Ek Şekil S1K) veya konfokal lazer tarama mikroskobu sahnesine yerleştirin ve florofor30'u görselleştirmek için odağı ve ayarları gerektiği gibi ayarlayın. Seçilen mısır FP muhabir hatları için kullanılan aydınlatma ve görüntü yakalama ayarları için Tablo 1'e bakınız.
- Tüm yaprağı veya belirli bir yatırım getirisini çeşitli algılama kanalları aracılığıyla görüntüleyin30. Tüm yaprağı görüntülemek için, yaprağın mozaik görüntülerini manuel olarak yakalayın veya mikroskobun döşeme işlemini düşük büyütmede (4x veya 10x) kullanın.
NOT: En düşük büyütmede bile, mısır yaprağı primordiası epifloresan veya konfokal lazer tarama mikroskobu ile görüntülenemeyecek kadar büyük olabilir, bu da fotobeyazlatmaya (bkz. Şekil 3M) veya artmış arka plan otofloresansına neden olabilecek daha uzun görüntüleme sürelerine neden olabilir. Bu nedenle, 5 mm'den büyük tüm yaprak örneklerini görüntülemek için floresan stereo mikroskop kullanılması önerilir. - Konfokal görüntüleme için, yaprağın kalınlığını kapsayan z-yığınlarının elde edilmesi gerekli olacaktır (bkz. adım 2.2.9).
- Varsa, tüm görüntü dosyalarını ve bunlarla ilişkili meta verileri kaydedin.
Tablo 2: Enine kesitlerin ve mısır yaprağı primordiasının bütün bineklerinin görüntülenmesinde sık karşılaşılan sorunların giderilmesi. Bu Tabloyu indirmek için lütfen tıklayınız.
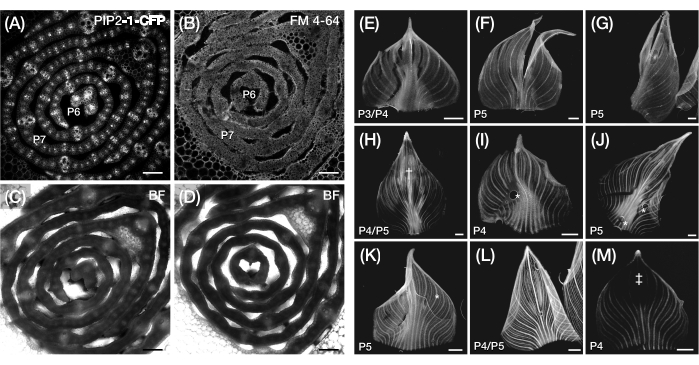
Şekil 3: Optimal olmayan enine kesit ve mısır yaprağı primordiasının tam montajlı preparasyonu. (A-D) Bir plazma membran markörü, PIP2-1-CFP (A) ve plazma membranı bağlayıcı floresan boyası, FM 4-64 (B) ile yaprak primordiasının enine kesitlerinin temsili konfokal görüntüleri, karşılık gelen parlak alan görüntüleri (C,D). PIP2-1-CFP ile karşılaştırıldığında, FM 4-64 hücre anahatlarının optimal olmayan görselleştirmesini görüntüler. (E-M) Yırtılma (E-G), çürük yüzeyler†, (H), hava kabarcıkları* (I-K), geri yuvarlanmış kenar boşlukları (L) ve fotoağartılmış bölgeler‡ (M) varlığını gösteren yaprak primordiasının tüm montajlarının temsili floresan görüntüleri. Yaprak primordia, DII-Venüs (E-G), GAR2-YFP (H-J), mDII-Venüs (K), PIN1a-YFP (L) ve DR5-RFP'yi (M) ifade eder. Ölçek çubuğu = 200 μm (A-D); 500 μm (E-M). Şekil 3A, Robil ve McSteen24'ün izniyle değiştirilmiş ve çoğaltılmıştır, Şekil 5B-M ise yazarların yayınlanmamış verileridir. Kısaltmalar: P = plastochron; YFP = sarı floresan proteini; RFP = kırmızı floresan proteini; CFP = camgöbeği floresan proteini; PIP2-1-CFP = p Zm PIP2-1::ZmPIP2-1:CFP; DII-Venüs = pZmUbi:DII:YFP-NLS; GAR2-YFP =pZm GAR2::ZmGAR2:YFP; mDII-Venüs = pZmUbi:mDII:YFP-NLS; PIN1a-YFP =pZm PIN1a::ZmPIN1a:YFP; DR5-RFP = DR5rev::mRFPer; BF = parlak alan. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
4. ImageJ / FIJI kullanarak görüntüleri işleme
- Maksimum yoğunluk projeksiyonu (MIP) kullanarak z-yığınlarını düzleştirme
- ImageJ/FIJI'yi başlatın ve görüntü yığınını açın veya Görüntü | Yığınlar | Menüden Yığınlanacak görüntüler.
- Görüntü yığınını seçin. Menüden Resim | Yığınlar | Z-Projesi.... Z-Project iletişim kutusunda, Projeksiyon türü açılır menüsünden Maksimum Yoğunluk'u seçin. Maksimum yoğunlukta z-projeksiyonu oluşturmak için Tamam'ı tıklatın.
NOT: Düzleştirilmiş görüntü, z-stacks50 boyunca en yüksek yoğunluğa sahip piksellerin 2D projeksiyonudur. Bu yöntem, floroforun görselleştirilmesi için uygundur, ancak kalın enine kesitlerin ve tüm yaprak montajlarının parlak alan görüntülerindeki anatomik özellikleri görselleştirmek için uygun değildir. - Dosya | Farklı Kaydet | Sert. Dosya için bir ad girin ve Kaydet'i tıklatın.
NOT: Floresan ve konfokal görüntüleri depolamak için TIFF kullanılması önerilir, çünkü görüntü kaydedildiğinde kaliteyi ve ayrıntıyı korur.
- Genişletilmiş Alan Derinliği (EDF) eklentisini kullanarak z-yığınlarını düzleştirme51
- EDF eklentisi52'yi yükleyin. Extended_Depth_Field.jar dosyasını (version 17.05.2021) http://bigwww.epfl.ch/demo/edf/'dan indirin ve ImageJ/FIJI'nin "plugins" klasörüne yerleştirin.
- ImageJ/FIJI'yi başlatın ve görüntü yığınını açın veya Görüntü | Yığınlar | Menüden Yığınlanacak görüntüler.
- Görüntü yığınını seçin. Menüden Eklentiler | Genişletilmiş Alan Derinliği | EDF Kolay Mod. Genişletilmiş Alan Derinliği iletişim kutusunda, istenen kaliteyi ve işleme hızını ayarlamak için Hız/Kalite altındaki kaydırıcıları ve topografyanın düzgünlük düzeyini ayarlamak için Yükseklik haritası kaydını kullanın. Yeniden oluşturulan görüntüyü oluşturmak için Çalıştır'ı tıklatın.
NOT: EDF, en iyi odağı yansıtarak yığını keskin, bileşik bir 2D görüntüde birleştirir51. Bu teknik, sınırlı odak derinliğinin üstesinden gelmek için kullanışlıdır ve kalın enine kesitlerin veya tam yaprak montajlarının parlak alan görüntülerini yeniden oluşturmak için uygundur. Floroforu görselleştirmek için bu filtreyi uygularken dikkatli olun, çünkü MIP'den farklı olarak EDF, görüntünün kontrastını ayarlayarak piksel yoğunluğunu etkiler. - Dosya | Farklı Kaydet | Sert. Dosya için bir ad girin ve Kaydet'i tıklatın.
- Grid/Collection Stitching eklentisini kullanarak görüntüleri birleştirme53
- Görüntü koleksiyonunu veya görüntü yığınlarını tek bir dizinde bir araya getirilecek şekilde kaydedin.
- ImageJ/FIJI'yi başlatın ve Eklentiler'i seçin | Dikiş | Menüden Izgara/Koleksiyon Dikişleri. Kılavuz/Koleksiyon Dikişi iletişim kutusunda, Tür açılır menüsünden Bilinmeyen konum'u ve ardından Sıra'dan Dizindeki tüm dosyalar'ı seçin. Tamam'ı tıklatın.
- Kılavuz Dikiş: Bilinmeyen konum, Dizindeki tüm dosyalar iletişim kutusunda, dizin yolunu Dizin metin alanına yazarak veya yapıştırarak ya da dizini bulmak için Gözat...'ı tıklatarak görüntülerin konumunu belirtin. Dikiş işlemine başlamak için Tamam'ı tıklatın.
NOT: Izgara/Koleksiyon Dikiş eklentisindeki Bilinmeyen Konum seçeneği, çakışan bölgelerini analiz ederek bir dizi bitişik görüntüden bileşik bir görüntüyü yeniden oluşturur. Bu nedenle, bu seçenek, bir karo tarama işlemi kullanılarak elde edilmeyen enine kesitlerin veya tam yaprak montajlarının görüntülerinin mozaiklerini dikmek için kullanışlıdır. - Dikiş bittiğinde, dikişli görüntüyle birlikte yeni bir pencere açılacaktır. Dosya | Farklı Kaydet | Sert. Dosya için bir ad girin ve Kaydet'i tıklatın.
NOT: 2D ve 3D görüntülerin büyük montajlarının dikilmesi, mikroskop yazılımındaki görüntü rekonstrüksiyon komutları kullanılarak veya ImageJ/FIJI'deki Biyo-Formatlar İçe Aktarma Seçenekleri aracılığıyla da gerçekleştirilebilir.
- Kanalları Birleştir komutunu kullanarak birden çok kanalı birleştirme
- ImageJ/FIJI'yi başlatın ve birleştirilecek görüntüleri veya görüntü yığınlarını açın.
NOT: Görüntü yığınları önce 4.1 veya 4.2 adımları kullanılarak düzleştirilebilir. MIP genellikle florofor kanallarını düzleştirmek için önerilirken, EDF parlak alan kanallarını veya değişen odak derinliğine sahip diğer kanalları düzleştirmek için daha uygundur. - Görüntü | Ayarlama | Parlaklık/Kontrast. Parametreleri ayarlamak için kaydırıcıları veya giriş alanlarını kullanın, sonra Uygula'yı tıklayın. Alternatif olarak, İşlem | Kontrastı Artırın .... Doymuş piksellerin yüzdesini ayarlayın, Normalleştir'i seçin, sonra Tamam'ı tıklayın.
NOT: Görüntüler arasındaki florofor sinyal yoğunluğunu ölçerken veya karşılaştırırken, genellikle parlaklığı veya kontrastı ayarlamamak en iyisidir, çünkü bu, görüntüdeki göreceli piksel yoğunluklarını değiştirebilir, bu da ölçümleri ve karşılaştırmaları etkileyebilir. - Kanallar arasında ayrım yapmak için, bir arama tablosu (LUT) kullanarak belirli görüntülere sahte renkler uygulayın. Bunu yapmak için görüntüyü seçin, ardından ImageJ/FIJI menüsünden Görüntü'yü seçin, Arama Tabloları'nı tıklatın ve açılır listeden uygun LUT'yi seçin.
- Menüden Resim | Renk | Kanalları Birleştir. Her kanal için (C1, C2, C3...), o kanala atanacak görüntüyü seçmek üzere açılır listeyi kullanın. Kanalları birleştirmek için Tamam'ı tıklatın.
- Dosya | Farklı Kaydet | Sert. Dosya için bir ad girin ve Kaydet'i tıklatın.
- ImageJ/FIJI'yi başlatın ve birleştirilecek görüntüleri veya görüntü yığınlarını açın.
Sonuçlar
Mısır yaprağı primordiasının enine kesit analizi
Damar sayısını ölçmek ve FP'lerle mısır yaprağı primordiasının enine kesitlerinde hormon yanıt paternlerini karakterize etmek için protokol bölüm 2'yi kullandık (Şekil 4)24. Bitki hormonu oksininin yaprak büyümesi ve damar oluşumundaki rolünü değerlendirmek için, oksin eksikliği olan bir mısır mutantının yaprak primordiasındaki damar sayısını ölçtük, kaybolan püskül254. Erken plastokronlarda, gelişmekte olan damarlar, mısır yaprağı primordium21,22'nin medyan hücre tabakasında belirgin hücreselleşme sergiler. Bununla birlikte, geleneksel histolojik teknikler22 kullanılarak damarların tanımlanması ve sayılması emek yoğun ve zaman alıcı olabilir. Bu nedenle, damarları ölçmek için, gelişmekte olan damarları ve prokambiyal iplikçikleri (PCS'ler; Şekil 4A). Protokol bölüm 2'yi kullanarak, kesitlemeden önce primordia'yı ölçerek enine kesit örneklemesini standartlaştırabildik (Şekil 4B, C). Vt2'nin normalden daha geniş bir primordyuma ve daha fazla damara sahip olduğu bir eğilim keşfettik (Şekil 4D, E)24, tamamen genişlemiş yapraklardan elde edilen verilerle tutarlıdır55, vt2'deki kusurun yaprak gelişiminde erken başladığını göstermektedir. Protokol bölüm 2'yi kullanarak, yaprak primordiasındaki hormon yanıtı FP muhabirlerinin ifade kalıplarını sistematik olarak inceleyebildik (Şekil 4F-I'deki görüntülerin örneklerine bakınız). Standartlaştırılmış bir enine kesit örnekleme şeması aracılığıyla, oksin, sitokinin (CK) ve gibberellik asit (GA) yanıtlarının farklı plastokronlar ve yaprak primordia bölgeleri arasındaki dağılımını haritalandırdık ve yaprak büyümesi ve damar oluşumu için etkileri olduğunu varsaydığımız yeni yanıt kalıplarını keşfettik24. Bu nedenle, bu temsili sonuçlar, mısır yaprağı primordiasının enine kesit analizi için protokol bölüm 2'nin yararlılığını göstermektedir.
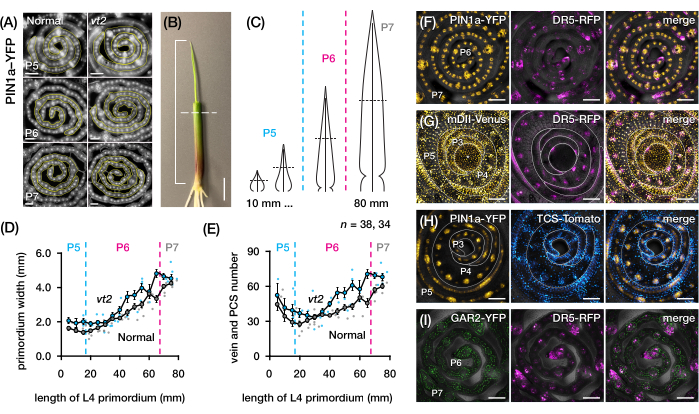
Şekil 4: Mısır yaprağı primordiasının enine kesit analizi için temsili sonuçlar. (A-E) Normal ve kaybolan püskülün2 yaprak primordiasında damar sayısının ve primordyum genişliğinin oksin efflux protein markörü PIN1a-YFP ile ölçülmesi. (A) Gelişmekte olan damarlarda ve prokambiyal iplikçiklerde PIN1a-YFP'yi ifade eden P5 ila P7 enine kesitlerinin temsili floresan görüntüleri. Enine kesitler bir FITC filtresi (495-519 nm uyarım) kullanılarak bir epifloresan mikroskobu ile görüntülendi. Damar sayısı ve primordyum genişliği, sırasıyla FIJI / ImageJ'deki çok noktalı ve serbest çizgi araçları kullanılarak ölçüldü. (B) Dördüncü yaprağın ucunu (L4) açığa çıkarmak için bir tel sıyırıcı ile çıkarılan üst yaprak olan bir mısır fidesi. Braket, öngörülen primordium uzunluğunu kapsar ve kesikli çizgi orta uzunluğu gösterir. (C) P5'ten P7'ye kadar değişen primordyum şekillerinin şematik diyagramı, orta uzunluktaki damar sayısının ve primordiyum genişliğinin (yatay kesikli çizgi) primordiumun gelişim aşamasına bağlı olarak nasıl değişebileceğini gösterir. (D,E) Normal ve vt2'nin L4'ünün orta uzunluktaki bölümünde primordyum genişliğinin (D) ve damar sayısının (E) ölçülmesi. Eğilim çizgisi, ölçümlerin 10 mm yuvarlanan ortalamalarını ± ortalamanın standart hatasını (SEM) temsil eder. (F-I) PIN1a-YFP, oksin yanıt muhabiri, DR5-RFP, sitokinin yanıt muhabiri, TCS-Domates, gibberellik aside duyarlı belirteç, GAR2-YFP ve oksin sinyal giriş muhabiri DII-Venüs'ün mutasyona uğramış bir versiyonu olan mDII-Venüs'ün kombinasyonlarını ifade eden yaprak primordiasının enine kesitlerinin temsili konfokal görüntüleri. FP kanalları, her görüntüdeki parlak alan kanalına bindirilir. Ölçek çubuğu = 200 μm (A); 10 mm (B); 100 μm (F-I). Bu rakam Robil ve McSteen24'ün izniyle değiştirilmiş ve çoğaltılmıştır. Kısaltmalar: DAG = çimlenmeden sonraki günler; P = plastokron; vt2 = kaybolan püskül2; PCS = prokambiyal iplikçik; YFP = sarı floresan proteini; FITC = floresein izotiyosiyanat; RFP = kırmızı floresan proteini; PIN1a-YFP =pZm PIN1a::ZmPIN1a:YFP; DR5-RFP = DR5rev::mRFPer; TCS-Domates = TCSv2::NLS-tdDomates; GAR2-YFP =pZm GAR2::ZmGAR2:YFP; mDII-Venüs = pZmUbi:mDII:YFP-NLS. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Mısır yaprağı primordiasının tam montajlı analizi
Mısır yaprağı primordiasının bütün yaprak montajlarında FP ekspresyonunu görselleştirmek ve analiz etmek için protokol bölüm 3'ü izledik (Şekil 5). PIN1a-YFP ile ven paternlerini görselleştirerek, damar oluşumunun erken plastokronlar sırasında tüm primordyumda meydana geldiğini, ancak bu sürecin gelişimin ilerleyen dönemlerinde proksimal bölgelerde kısıtlandığını bulduk (Şekil 5A)24. Enine kesit analizlerine tamamlayıcı olarak, tüm yaprak montaj analizleri, damar oluşumu sırasında doku ve aşamaya özgü hormon yanıtı modellerini ortaya çıkarmıştır24. Bir örnek, CK yanıt raporlayıcısı TCSv2::NLS-tdDomates37'nin (TCS-Domates) PIN1a-YFP ifadesine göre ifade desenidir (Şekil 5B)24. Protokol bölüm 3'ü izleyerek, yaprak primordiasında FP ekspresyonunun hem nitel hem de nicel analizlerini yapabildik (Şekil 5D-F; yayınlanmamış veriler). Bir oksin yanıt raporlayıcısı DR5rev::mRFPer41 (DR5-RFP) ve GA-duyarlı bir belirteç olan p Zm GAR2::ZmGAR2:YFP39'un (GAR2-YFP) ekspresyon kalıplarını, GA-eksikliği olan bir mutant 56 olan vt2 ve cüce bitki3 (d3) tek ve çift mutantlarının tam yaprak montajlarında inceledik (Şekil 5D). Ayrıca, hücre döngüsü57'deki G1 / S geçişi için bir belirteç olan p Zm Cyclin-D2B::ZmCyclin-D2B: YFP 42 (Cyclin-D2B-YFP) kullanarak normalve vt2 yaprak primordia arasındaki hücre proliferasyonunun göreceli seviyelerini karşılaştırdık (Şekil 5E, F). Normal ve vt2 arasında anlamlı bir fark olmamasına rağmen, Siklin-D2B-YFP ekspresyonu, erken plastokrkronların bilinen hücre proliferasyon profili ile tutarlıydı31. Protokol bölüm 3'ün, haddelenmiş morfolojileri nedeniyle görüntülenmesi zor olan mısır yaprağı primordiasının tüm montajlarını analiz etmek için etkili bir yöntem olduğu sonucuna vardık.
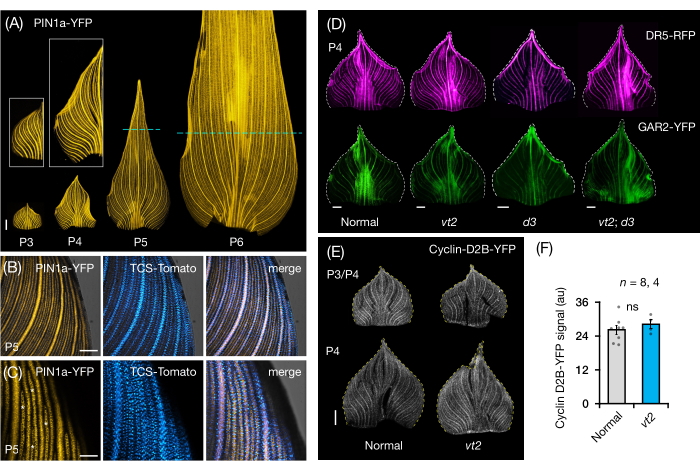
Şekil 5: Mısır yaprağı primordiasının tam montajlı analizi için temsili sonuçlar. (A) Oksin efflux protein markörü PIN1a-YFP ile işaretlenmiş, gelişmekte olan damarları ve prokambiyal iplikçikleri gösteren 7 DAG mısır fidanının yaprak primordiasının temsili floresan görüntüleri. P3-P6 primordia tabandan çıkarıldı, yuvarlandı ve adaksiyel tarafı yukarı bakacak şekilde düzleştirildi. Girişler P3 ve P4'ün yakın çekimlerini gösterir. P5 ve P6'da, kesikli çizgiler, prokambiyal iplikçiklerin çoğunluğunun hala gelişmekte ve genişlediği proliferatif bölgelerin distal ucunu sınırlar. (B,C) Bir P5 primordiyumunun proksimal marjinal bölgesinde PIN1a-YFP ve sitokinin yanıt muhabiri TCS-Domates ekspresyonunu gösteren temsili konfokal görüntüler. (D) Kaybolan püskül2 ve cüce bitkinin3 normal ve tek ve çift mutantlarında oksin yanıt muhabiri DR5-RFP ve gibberellik aside duyarlı belirteç GAR2-YFP'nin ekspresyonunu gösteren P4 primordia'nın temsili floresan görüntüleri. (E) Hücre döngüsündeki G1/S geçişi için bir muhabir olan Cyclin-D2B-YFP'nin ekspresyonunu gösteren P3 ve/veya P4'ün temsili konfokal görüntüleri. (F) Normal ve vt2'nin P3/P4 yaprak primordiasında hücre proliferasyonunun nispi miktarları, ImageJ/FIJI kullanılarak primordiyum alanı üzerindeki Siklin-D2B-YFP sinyalinin entegre yoğunluğunun ölçülmesiyle ölçülür. Çubuklar, ortalamanın standart hatasını ± ortalama ölçümlerini temsil eder. Ölçek çubuğu = 500 μm (A,D,E); 200 μm (B); 100 μm (C). Şekil 4A-C, Robil ve McSteen24'ün izniyle değiştirilmiş ve çoğaltılmıştır, Şekil 4D-F ise yazarlardan yayınlanmamış verilerdir. Kısaltmalar: DAG = çimlenmeden sonraki günler; P = plastokron; vt2 = kaybolan püskül2; d3 = cüce bitki3; YFP = sarı floresan proteini; RFP = kırmızı floresan proteini; PIN1a-YFP =pZm PIN1a::ZmPIN1a:YFP; TCS-Domates = TCSv2::NLS-tdDomates; DR5-RFP = DR5rev::mRFPer; GAR2-YFP =pZm GAR2::ZmGAR2:YFP; Siklin-D2B-YFP =pZm Siklin-D2B::ZmSiklin-D2B:YFP; ns = anlamlı bir fark yok; au = keyfi birim. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Ek Dosya 1: Mısır fidelerinde yaprak gelişim evrelemesi örnekleri. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil S1: Protokollerde kullanılan bitki örnekleri ve malzemeleri. (A,B) Üst yaprak fahişesi ile 7-8 DAG bir mısır fidesi bir tel sıyırıcı kullanılarak çıkarıldı. (B) İç kısım, açıkta kalan P6 primordium ile çekimin yakın çekimini gösterir. (C-G) Enine kesit analizi için üst çıkarılmış mısır fidelerinin sürgünleri (C,D) ve çevresindeki yapraklar tam montaj analizi için tamamen çıkarılmış (E-G). (H) Bir rulo poliüretan jel şeffaf çift taraflı nano bant. (I,J) P6 yaprak primordium (I) ve P8 yaprağının (J) proksimal bölgesi açılmış ve nano bant ile cam slaytlara monte edilmiştir. (K) Bir epifloresan mikroskobunun sahnesine monte edilmiş, yuvarlanmamış yaprak primordiyumlu bir cam slayt. Kısaltma: DAG = çimlenmeden sonraki günler. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Mısır yaprağı primordiasını hücresel görüntüleme için hazırlamak için iki yöntem sunuyoruz. İlk yöntem (protokol bölüm 2), enine kesit analizi için primordiumun ölçülmesine izin verirken, ikinci yöntem (protokol bölüm 3), tüm montaj analizi için primordiumun açılmasını ve düzleştirilmesini sağlar. Bu yöntemler, mısır yaprağı primordia24'teki FP'lerin hücresel görüntülemesini kolaylaştırır (Şekil 4 ve Şekil 5'te gösterildiği gibi) ve mısır yaprakları geliştirmenin görüntülenmesinin zorluklarına basit çözümler sunar. Protokol bölüm 2, diseksiyon süresini azaltır ve yalnızca evrelemeparametrelerine 9,16 güvenmek yerine, kesitlemeden önce primordia'yı ölçerek örnekleme doğruluğunu artırır. Ticari olarak temin edilebilen nano bant ile, protokol bölüm 3, mısırda tam yapraklı primordia'nın görüntülenmesi ile ilgili uzun süredir devam eden sorunu çözer. Bu protokol, diyaliz tüpü 31'i kullanan önceki yöntemi geliştirir ve BT ve MRG11,32,33'e çok daha ucuz bir alternatiftir. Bununla birlikte, yaprak anatomik özelliklerinin görselleştirilmesi ve optimal sonuçların üretilmesi söz konusu olduğunda, her iki protokolün de Tablo 2'de özetlenen ve aşağıda daha ayrıntılı olarak tartışılan bazı sınırlamaları vardır.
Protokol bölüm 2'de, yaprak primordiasının kalın enine kesitlerinde hücre ana hatlarını görselleştirmede zorlukla karşılaştık ve hücre duvarı veya plazma zarı bağlayıcı floresan boyalarla karşı boyama tatmin edici sonuçlar vermedi. Örneğin, FM 4-64, plazma membranı FP belirteci p Zm PIP2-1::ZmPIP2-1:CFP39 (PIP2-1-CFP; Şekil 3A-D). Bu sınırlamanın üstesinden gelmek için, hücre ana hatlarının canlı bir parlak alan görüntülemesine veya karşı boyama protokolünün optimize edilmesine izin verecek daha ince doku kesitleri (~ 0,1 mm)58 üretmek için bir vibratom kullanmanızı öneririz 47,59.
Protokol bölüm 3'te ana sınırlama, protokol adımları 3.2.5-3.2.6'da (Şekil 3E-K) ayrıntılı olarak açıklandığı gibi, yaprağın yırtılma, hasar görmeden veya hava kabarcıkları olmadan monte edilmesinin zorluğudur. Mısır yaprağı iki taraflı simetrik olduğundan, görselleştirme için tam yapraklı bir montaj yerine yarım yapraklı bir montaj yeterli olabilir9. Bunu yapmak için, primordiyum, midrib'e kadar açıldıktan sonra uzunlamasına eksen boyunca bir tıraş bıçağı ile kesilebilir, böylece yaprağın sadece yarısının monte edilmesine izin verilir. Protokol bölüm 3'ün bir başka sınırlaması, yaprağın kalınlığının derin görüntüleme sırasında florofor sinyalinin optik çözünürlüğünü sınırlayabilmesidir. Bu sorunu çözmek için, bir doku temizleme tekniği60 kullanmak mümkündür. Bununla birlikte, bitki dokularını görüntülemek için yaygın olarak kullanılan bir temizleme reaktifi olan ClearSee61'in protokolle uyumlu olmadığını bulduk, çünkü numunenin ve kapak kaymasının nano banttan ayrılmasına neden oluyor. Bu soruna potansiyel bir çözüm, yaprak numunesi üzerine yarı geçirgen bir membran31 uygulamak ve nano bant tarafından yerinde tutulurken temizleme çözeltisi ile muamele edilmesine izin vermek olabilir. Yuvarlanmamış yaprağa sıvı çözeltilerin uygulanmasına izin veren böyle bir yöntem, daha önce mısır salkımını geliştirmek için optimize edilmiş, ancak tam yapraklı primordia62,63 için değil, tam montajlı RNA in situ hibridizasyon ve immünolokalizasyon teknikleri için de kullanılabilir.
Fide aşamasında bile büyük yaprak primordiasına sahip olan mısır için protokolleri tanımladık. Pirinç, arpa, buğday, Setaria ve Brachypodium 16,23,64,65,66 gibi çok daha küçük yaprak primordiasına sahip diğer çim türleri, bu protokolleri etkili bir şekilde uygulamak için ek hassas araçların kullanılmasını gerektirebilir. Ayrıca, bu protokoller, doku oluşumunun ve hücresel yanıtların gerçek zamanlı dinamik süreçlerini yakalayan canlı hücre görüntülemesi için tasarlanmamıştır. Bununla birlikte, floresan problar, görüntüleme teknolojileri ve bilgi işlem yetenekleri bitkiler için canlı hücre görüntülemede ilerlemeye devam ettikçe67, gelecekteki araştırmalar, çim yaprağı primordiasının benzersiz özelliklerine uyarlanmış canlı hücre görüntüleme stratejileri geliştirmek için bu protokoller üzerine inşa edilebilir.
Açıklamalar
Yazarların açıklayacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar, mutant ve transgenik stokları sağladıkları için Mısır Genetiği İşbirliği, Mısır Hücresi Genomiği Projesi, Dave Jackson (Cold Spring Harbor Laboratuvarı, NY), Anne W. Sylvester (Deniz Biyolojisi Laboratuvarı, Chicago Üniversitesi, IL), Andrea Gallavotti (Rutgers Üniversitesi, NJ) ve Carolyn G. Rasmussen'e (Kaliforniya Üniversitesi, Riverside) ve ayrıca Robert F. Baker ve Alexander Jurkevich'e teşekkür etmek istiyor. Missouri-Columbia, konfokal mikroskopi ile ilgili yardımları için. JMR, J. William Fulbright Bursu, Diane P. ve Robert E. Sharp Fonu ve Ulusal Bilim Vakfı'nın Bitki Genomu Araştırma Programı (IOS-1546873) tarafından PM'ye desteklenmiştir. CDTC, EDCDP ve RJRR, DOST-SEI S&T Lisans Bursu ile desteklenmektedir. DODL, Fr. Thomas Steinbugler SJ Akademik Bursu tarafından desteklenmektedir. RJRR, Aiducation International-Pathways to Higher Education Bursu tarafından desteklenmektedir. Bu çalışma Fen ve Mühendislik Fakültesi ve Ateneo de Manila Üniversitesi Rizal Kütüphanesi tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acrylic Gel Clear Double Sided Nano Tape 16.5 ft x 1.2 in, 2 mm thick | EZlifego Store (Amazon) | B07YB1ZXG6 | 1 roll |
| Bellucci Pick Curved micro probe 16.8 cm, 6.6 in | Bausch & Lomb | N1692 9 | 1 pc |
| Clayman guide microprobe Sinskey hook angled shaft, 11.6 cm, 4.6 in | Storz Opthalmic Instruments | E0542 | 1 pc |
| Dental Probe, Bent Needle, 14 cm (5.5 in) | Ted Pella | 13553 | 1 pc |
| DOWELL 10-22 AWG Wire Stripper | Dowell Store (Amazon) | 10-22 AWG | 1 pc |
| Feather Double Edge Carbon Steel Blades | Ted Pella | 121-9 | pkg/10; for fine sectioning |
| Frosted End Glass Microscope Slides, 75 mm x 25 mm x 1-1.2 mm | Ted Pella | 260442 | pkg/144 |
| GEM Single Edge, Stainless Steel Uncoated Blades | Ted Pella | 121-1 | box/200; for general cutting/sectioning |
| Glycerol | Thermo Scientific | PI17904 | 1 liter |
| ImageJ/FIJI with EDF plugin (version 17.05.2021) and Grid/Collection Stitching plugin | National Institutes of Health (NIH) USA | version 2.9.0/1.54s | The EDF plugin was developed by Alex Prudencio, Jesse Berent, and Daniel Sage for the Biomedical Imaging Group, École Polytechnique Fédérale de Lausanne (EPFL; http://bigwww.epfl.ch/demo/edf/). The grid/collection stitching software was developed by Stephan Preibisch for the Max Planck Institute of Molecular Cell Biology and Genetics (MPI-CBG). |
| Kimwipes Ex-L Small 111.76 mm x 213.36 mm | Kimtech Science | 34155 | box/280 ply |
| Micro Cover Glasses, 22 mm x 22 mm x 0.13 - 0.16 mm thick | Ted Pella | 260140 | 1 ounce |
| PU Gel Clear Double Sided Nano Tape 29.5 ft x 1.18 in, 1 mm thick | Yecaye Store (Amazon) | L354 W1.18 | 2 rolls |
| Superslip Cover Glasses, 24 mm x 50 mm x 0.13 - 0.16 mm thick | Ted Pella | 260166 | 1 ounce |
| Superslip Cover Glasses, 24 mm x 60 mm x 0.13 - 0.16 mm thick | Ted Pella | 260168 | 1 ounce |
| Tempered Glass Cutting Board | Hacaroa (Amazon) | B09XMXBT5S | 4 pc |
Referanslar
- McSteen, P., Kellogg, E. A. Molecular, cellular, and developmental foundations of grass diversity. Science. 377 (6606), 599-602 (2022).
- Wang, P., Vlad, D., Langdale, J. A. Finding the genes to build C4 rice. Current Opinion in Plant Biology. 31, 44-50 (2016).
- Wang, P., et al. Candidate regulators of early leaf development in maize perturb hormone signalling and secondary cell wall formation when constitutively expressed in rice. Scientific Reports. 7 (1), 4535(2017).
- Perico, C., Tan, S., Langdale, J. A. Developmental regulation of leaf venation patterns: Monocot versus eudicots and the role of auxin. New Phytologist. 234 (3), 783-803 (2022).
- Wang, P., Kelly, S., Fouracre, J. P., Langdale, J. A. Genome-wide transcript analysis of early maize leaf development reveals gene cohorts associated with the differentiation of C4 Kranz anatomy. The Plant Journal. 75 (4), 656-670 (2013).
- Liu, W. Y., et al. Regulators of early maize leaf development inferred from transcriptomes of laser capture microdissection (LCM)-isolated embryonic leaf cells. Proceedings of the National Academy of Sciences. 119 (35), e2208795119(2022).
- Liu, W. Y., et al. Anatomical and transcriptional dynamics of maize embryonic leaves during seed germination. Proceedings of the National Academy of Sciences. 110 (10), 3979-3984 (2013).
- Strable, J., Nelissen, H. The dynamics of maize leaf development: Patterned to grow while growing a pattern. Current Opinion in Plant Biology. 63, 102038(2021).
- Reynolds, J. O., Eisses, J. F., Sylvester, A. W. Balancing division and expansion during maize leaf morphogenesis: Analysis of the mutant, warty-1. Development. 125 (2), 259-268 (1998).
- Richardson, A. E., et al. Evolution of the grass leaf by primordium extension and petiole-lamina remodeling. Science. 374 (6573), 1377-1381 (2021).
- Johnston, R., Leiboff, S., Scanlon, M. J. Ontogeny of the sheathing leaf base in maize (Zea mays). New Phytologist. 205 (1), 306-315 (2015).
- Sharman, B. C. Developmental anatomy of the shoot of Zea mays L. Annals of Botany. 6 (22), 245-282 (1942).
- Johnston, R., et al. Transcriptomic analyses indicate that maize ligule development recapitulates gene expression patterns that occur during lateral organ initiation. The Plant Cell. 26 (12), 4718-4732 (2014).
- Sharman, B. C. Leaf and bud initiation in the Gramineae. Botanical Gazette. 106 (3), 269-289 (1945).
- Nelissen, H., et al. A local maximum in gibberellin levels regulates maize leaf growth by spatial control of cell division. Current Biology. 22 (13), 1183-1187 (2012).
- Itoh, J., et al. Rice plant development: From zygote to spikelet. Plant and Cell Physiology. 46 (1), 23-47 (2005).
- Ritchie, S. W., Hanway, J. J., Benson, G. O. How a corn plant develops. Iowa State University of Science and Technology. , (1986).
- Freeling, M., Walbot, V. The Maize Handbook. , Springer Science & Business Media. (2013).
- Freeling, M., Hake, S. Developmental genetics of mutants that specify knotted leaves in maize. Genetics. 111 (3), 617-634 (1985).
- Durbak, A. R., et al. Transport of boron by the tassel-less1 aquaporin is critical for vegetative and reproductive development in maize. The Plant Cell. 26 (7), 2978-2995 (2014).
- Langdale, J. A., Lane, B., Freeling, M., Nelson, T. Cell lineage analysis of maize bundle sheath and mesophyll cells. Developmental Biology. 133 (1), 128-139 (1989).
- Bosabalidis, A. M., Evert, R. F., Russin, W. A. Ontogeny of the vascular bundles and contiguous tissues in the maize leaf blade. American Journal of Botany. 81 (6), 745-752 (1994).
- Junqueira, N. E. G., et al. Anatomy and ultrastructure of embryonic leaves of the C4 species Setaria viridis. Annals of Botany. 121 (6), 1163-1172 (2018).
- Robil, J. M., McSteen, P. Hormonal control of medial-lateral growth and vein formation in the maize leaf. New Phytologist. 238 (1), 125-141 (2023).
- Donnelly, P. M., Bonetta, D., Tsukaya, H., Dengler, R. E., Dengler, N. G. Cell cycling and cell enlargement in developing leaves of Arabidopsis. Developmental Biology. 215 (2), 407-419 (1999).
- Govindaraju, P., Verna, C., Zhu, T., Scarpella, E. Vein patterning by tissue-specific auxin transport. Development. 147 (13), (2020).
- Linh, N. M., Scarpella, E. Leaf vein patterning is regulated by the aperture of plasmodesmata intercellular channels. PLoS Biology. 20 (9), e3001781(2022).
- Verna, C., Ravichandran, S. J., Sawchuk, M. G., Linh, N. M., Scarpella, E. Coordination of tissue cell polarity by auxin transport and signaling. eLife. 8, e51061(2019).
- Sawchuk, M. G., Head, P., Donner, T. J., Scarpella, E. Time-lapse imaging of Arabidopsis leaf development shows dynamic patterns of procambium formation. New Phytologist. 176 (3), 560-571 (2007).
- Linh, N. M., Scarpella, E. Confocal imaging of developing leaves. Current Protocols. 2 (1), e349(2022).
- Poethig, R. S., Szymkowiak, E. J. Clonal analysis of leaf development in maize. Maydica. 40, 67-76 (1995).
- Sprangers, K., Thys, S., van Dusschoten, D., Beemster, G. T. S. Gibberellin enhances the anisotropy of cell expansion in the growth zone of the maize leaf. Frontiers in Plant Science. 11, 1163(2020).
- Tsuda, K., et al. KNOTTED1 cofactors, BLH12 and BLH14, regulate internode patterning and vein anastomosis in maize. The Plant Cell. 29 (5), 1105-1118 (2017).
- Schindelin, J., et al. FIJI: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Plant Care Protocols - Maize. The Donald Danforth Plant Science Center's Plant Growth Facility. , Available from: https://www.danforthcenter.org/our-work/core-facilities/plant-growth/ (2019).
- Mir, R., et al. A DII domain-based auxin reporter uncovers low auxin signaling during telophase and early G1. Plant Physiology. 173 (1), 863-871 (2017).
- DeBlasio, S. L., Sylvester, A. W., Jackson, D. Illuminating plant biology: Using fluorescent proteins for high-throughput analysis of protein localization and function in plants. Briefings in Functional Genomics. 9 (2), 129-138 (2010).
- Wu, Q., Luo, A., Zadrozny, T., Sylvester, A., Jackson, D. Fluorescent protein marker lines in maize: Generation and applications. The International Journal of Developmental Biology. 57 (6-8), 535-543 (2013).
- Mohanty, A., et al. Advancing cell biology and functional genomics in maize using fluorescent protein-tagged lines. Plant Physiology. 149 (2), 601-605 (2009).
- Baker, R. F., et al. Sucrose transporter ZmSut1 expression and localization uncover new insights into sucrose phloem loading. Plant Physiology. 172 (3), 1876-1898 (2016).
- Gallavotti, A., Yang, Y., Schmidt, R. J., Jackson, D. The relationship between auxin transport and maize branching. Plant Physiology. 147 (4), 1913-1923 (2008).
- Krishnakumar, V., et al. A maize database resource that captures tissue-specific and subcellular-localized gene expression, via fluorescent tags and confocal imaging (Maize Cell Genomics Database). Plant and Cell Physiology. 56 (1), 12(2015).
- Snapp, E. L. Fluorescent proteins: A cell biologist's user guide. Trends in Cell Biology. 19 (11), 649-655 (2009).
- Geng, Y., Zhou, Y. Confocal live imaging of shoot apical meristems from different plant species. Journal of Visualized Experiments. (145), e59369(2019).
- Stanislas, T., Hamant, O., Traas, J. In-vivo analysis of morphogenesis in plants. Methods in Cell Biology. 139, Elsevier. 203-223 (2017).
- Fodor, E., Ayaydin, F. Fluorescent probes and live imaging of plant cells. Advances in Plant Ecophysiology Techniques. , Springer. 241-251 (2018).
- Grandjean, O., et al. In vivo analysis of cell division, cell growth, and differentiation at the shoot apical meristem in Arabidopsis. The Plant Cell. 16 (1), 74-87 (2004).
- Conklin, P. A., Johnston, R., Conlon, B. R., Shimizu, R., Scanlon, M. J. Plant homeodomain proteins provide a mechanism for how leaves grow wide. Development. 147 (20), (2020).
- Shaw, S. L. Imaging the live plant cell. The Plant Journal. 45 (4), 573-598 (2006).
- Klaus, A. V., Schawaroch, V., Frischmann, K. J. Confocal imaging and three-dimensional visualization of thick autofluorescent specimens. Methods in Molecular Biology. 1075, 213-225 (2014).
- Forster, B., Van De Ville, D., Berent, J., Sage, D., Unser, M. Extended depth-of-focus for multi-channel microscopy images: a complex wavelet approach. 2004 2nd IEEE International Symposium on Biomedical Imaging: Nano to Macro (IEEE Cat No. 04EX821). IEEE. , 660-663 (2004).
- Extended Depth of Field. EPFL Biomedical Imaging Group. , Available from: http://bigwww.epfl.ch/demo/edf/ (2022).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Phillips, K. A., et al. vanishing tassel2 encodes a grass-specific tryptophan aminotransferase required for vegetative and reproductive development in maize. The Plant Cell. 23 (2), 550-566 (2011).
- Robil, J. M., et al. GrasVIQ: An image analysis framework for automatically quantifying vein number and morphology in grass leaves. The Plant Journal. 107 (2), 629-648 (2021).
- Helliwell, C. A., Chandler, P. M., Poole, A., Dennis, E. S., Peacock, W. J. The CYP88A cytochrome P450, ent-kaurenoic acid oxidase, catalyzes three steps of the gibberellin biosynthesis pathway. Proceedings of the National Academy of Sciences. 98 (4), 2065-2070 (2001).
- Gutierrez, R., Quiroz-Figueroa, F., Vazquez-Ramos, J. M. Maize cyclin D2 expression, associated kinase activity and effect of phytohormones during germination. Plant and Cell Physiology. 46 (1), 166-173 (2005).
- Atkinson, J. A., Wells, D. M. An updated protocol for high throughput plant tissue sectioning. Frontiers in Plant Science. 8, 1721(2017).
- Lux, A., Morita, S., Abe, J., Ito, K. An improved method for clearing and staining free-hand sections and whole-mount samples. Annals of Botany. 96 (6), 989-996 (2005).
- Heriche, M., Arnould, C., Wipf, D., Courty, P. E. Imaging plant tissues: Advances and promising clearing practices. Trends in Plant Science. 27 (6), 601-615 (2022).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Chuck, G., Muszynski, M., Kellogg, E., Hake, S., Schmidt, R. J. The control of spikelet meristem identity by the branched silkless1 gene in maize. Science. 298 (5596), 1238-1241 (2002).
- Tran, T. M., et al. An optimized whole-mount immunofluorescence method for shoot apices. Current Protocols. 1 (4), e101(2021).
- O'Connor, D. L. PINs Lost and PINs Gained: Auxin-Transport Mediated Patterning in the Grasses. University of California, Berkeley. , Doctoral Dissertation (2012).
- Sharman, B. C., Hitch, P. A. Initiation of procambial strands in leaf primordia of bread wheat, Triticum aestivum L. Annals of Botany. 31 (2), 229-243 (1967).
- Serra, L., Tan, S., Robinson, S., Langdale, J. A. Flip-flap: A simple dual-view imaging method for 3D reconstruction of thick plant samples. Plants. 11 (4), 506(2022).
- Colin, L., et al. Imaging the living plant cell: From probes to quantification. The Plant Cell. 34 (1), 247-272 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır