Method Article
Méthodes améliorées de préparation de sections transversales et de montures entières déroulées de primordia de feuilles de maïs pour la fluorescence et l’imagerie confocale
Dans cet article
Résumé
Les primordia des feuilles de maïs sont profondément gainées et roulées, ce qui les rend difficiles à étudier. Ici, nous présentons des méthodes de préparation de coupes transversales et de montures entières de primordia de feuilles de maïs pour la fluorescence et l’imagerie confocale.
Résumé
Chez le maïs (Zea mays) et d’autres graminées (Poaceae), les primordia foliaires sont profondément gainées et roulées dans le verticille des feuilles, ce qui rend difficile l’étude du développement précoce des feuilles. Ici, nous décrivons les méthodes de préparation des coupes transversales et des montures entières déroulées de primordia de feuilles de maïs pour la fluorescence et l’imagerie confocale. La première méthode utilise un dénudeur de fil pour enlever les parties supérieures des feuilles plus âgées, exposant l’extrémité du primordium foliaire et permettant sa mesure pour un échantillonnage transversal plus précis. La deuxième méthode utilise un ruban nano transparent double face pour dérouler et monter des primordia à feuilles entières pour l’imagerie. Nous montrons l’utilité des deux méthodes pour visualiser et analyser les rapporteurs de protéines fluorescentes dans le maïs. Ces méthodes apportent une solution aux défis posés par la morphologie distinctive des primordia des feuilles de maïs et seront utiles pour visualiser et quantifier les traits anatomiques et de développement des feuilles chez le maïs et d’autres espèces de graminées.
Introduction
Les cultures d’herbe sont une source majeure de nourriture et de biocarburants pour la population mondiale1, et l’amélioration de l’anatomie des feuilles a le potentiel d’augmenter leur productivité 2,3. Cependant, notre compréhension actuelle de la façon dont l’anatomie des feuilles est régulée chez les graminées est limitée4 et nécessite l’analyse des primordies foliaires, car de nombreux traits anatomiques et physiologiques de la feuille sont prédéterminés au début du développement 5,6,7. Les techniques d’imagerie cellulaire, telles que la fluorescence et l’imagerie confocale, sont indispensables pour étudier l’anatomie des feuilles de graminées et les traits cellulaires, mais ces techniques sont difficiles à appliquer aux primordia des feuilles de graminées car elles sont profondément gainées et roulées dans le verticille des feuilles. Nous avons abordé cette question en développant des méthodes de préparation de coupes transversales et de supports de feuilles entières déroulées pour la fluorescence et l’analyse confocale des primordia des feuilles de maïs, un système modèle pour étudier l’anatomie et le développement des feuilles de graminées 2,8.
La feuille de maïs, comme toutes les feuilles de graminées, se compose d’un limbe en forme de lanière avec une gaine qui s’enroule autour de la tige et développe la pousse 9,10,11,12,13. Les feuilles se développent à partir du méristème apical de la pousse (SAM) selon un motif distique, où chaque nouvelle feuille commence dans la position opposée à la feuille précédente, ce qui donne deux rangées de feuilles le long de l’axe vertical (Figure 1A)14 . Le stade de développement de chaque primordium foliaire est identifié par sa position par rapport à la SAM, avec le primordium le plus proche désigné comme plastochron1 (P1) et les primordia suivants désignés comme P2, P3, et ainsi de suite (Figure 1B,C)2. Au cours du développement (figure 1D), le primordium foliaire apparaît d’abord comme un contrefort en forme de croissant autour de la base de la SAM (P1), puis se développe en un primordium en forme de capuchon qui s’étend sur le méristème (P2)9,10,11. Les marges basales de la capuche se dilatent ensuite latéralement et se chevauchent à mesure que la pointe se développe vers le haut, formant un primordium en forme de cône (P3-P5)10. Le primordium croît alors rapidement en longueur, et la limite gaine-lame à la base devient plus proéminente avec la formation du ligule, la projection en forme de frange sur le côté adaxial de la feuille (P6/P7). Enfin, la feuille se déroule lorsqu’elle émerge du verticille pendant la croissance à l’état d’équilibre, dans laquelle les cellules en division sont restreintes dans la petite région basale du limbe, formant un gradient avec des cellules en expansion et en différenciation le long de l’axe proximal-distal (P7/P8)15. Le sommet des pousses d’un semis de maïs contient plusieurs primordia à différents stades de développement, ce qui en fait un excellent modèle pour étudier le développement des feuilles8.
Une analyse précise du développement précoce des feuilles nécessite la stadification ou l’utilisation de critères normalisés pour définir les stades distincts du développement du primordium par rapport à d’autres paramètres de croissance ou morphologiques. Parce que les primordia foliaires sont cachés dans la pousse de graminée, les chercheurs utilisent généralement des paramètres tels que l’âge de la plante ou la taille des feuilles émergentes comme prédicteurs des stades et des tailles des primordia des feuilles 9,16. Dans le maïs, l’âge chronologique de la plante est déterminé soit par le nombre de jours après la plantation, soit par la germination (DAP/DAG)17,18. Le stade végétatif (stade V) est déterminé par la feuille supérieure avec un collet visible, une ligne pâle sur la face abaxiale entre le limbe et la gaine qui correspond à la position de la ligule et des oreillettes, une paire de régions cunéiformes à la base du limbe (Figure 1A,B)17,19 . Entre 20 et 25 DAG, le SAM se transforme en méristème d’inflorescence et cesse de produire de nouvellesfeuilles20. Les taux de croissance des primordia des feuilles de maïs peuvent varier en fonction de l’environnement et du génotype de la plante. Pour cette raison, l’âge des plantes et la taille des feuilles émergentes ne peuvent pas prédire avec précision la taille des primordia foliaires; Cependant, l’utilisation de ces paramètres peut aider à prédire la gamme des stades et des tailles de Primordia à des fins expérimentales.
L’analyse de coupe transversale est une méthode populaire pour examiner l’anatomie et le développement des feuilles chez le maïs et d’autres graminées, car elle permet d’échantillonner plusieurs plastochrons dans une seule section à travers la pousse21,22,23. Cette méthode est également pratique pour l’imagerie cellulaire d’échantillons frais, car les feuilles environnantes servent d’échafaudage qui maintient les primordia foliaires en place pendant la section et le montage24. Cependant, un inconvénient de cette méthode est qu’il peut être difficile de localiser avec précision le plastochron cible et la région dans le primordium lors de la section à partir d’une pousse intacte. De plus, comme la croissance foliaire varie d’un plastochre à l’autre et le long de l’axe proximal-distal2,5, un échantillonnage imprécis pourrait entraîner une interprétation incorrecte du stade de développement et de la région du primordium dans une section donnée. Par conséquent, la mise au point d’une méthode d’échantillonnage transversal précis des coupes transversales est essentielle pour assurer la précision et la reproductibilité des analyses anatomiques et développementales des primordia des feuilles de graminées.
L’analyse du montage des feuilles entières permet l’étude complète et intégrative des processus tissulaires et cellulaires qui se produisent à l’échelle de l’organe entier, tels que la croissance proliférative25 et la structuration veineuse26,27,28. La méthode fournit une vue d’ensemble paradermique de la feuille, permettant la découverte de processus et de modèles distincts qui seraient autrement difficiles à détecter à l’aide de l’analyse de coupe transversale24,27. Contrairement à Arabidopsis, où il existe déjà des méthodes établies pour l’imagerie des montures de feuilles entières29,30, il n’existe actuellement aucune méthode standard pour l’imagerie des montures de feuilles entières déroulées dans les graminées. Un protocole précédent de déroulement des primordia isolées des feuilles de maïs impliquait des matériaux inhabituels et ne convenait pas à l’imagerie cellulaire31. Les techniques d’imagerie avancées, telles que la tomodensitométrie (TDM) et l’imagerie par résonance magnétique (IRM), peuvent acquérir des informations anatomiques 3D sans isoler et dérouler les primordia 11,32,33, mais elles sont coûteuses et nécessitent un équipement spécialisé. La mise au point d’une technique permettant de surmonter les contraintes imposées par la morphologie enroulée et conique des primordia foliaires du maïs et d’autres graminées ferait progresser les recherches sur leurs traits anatomiques et développementaux.
Ici, nous présentons des méthodes de préparation de coupes transversales et de montures entières de primordia de feuilles de maïs pour la fluorescence et l’imagerie confocale. Nous avons utilisé ces méthodes pour quantifier le nombre de veines et cartographier la distribution hormonologique spatio-temporelle chez les primordia des feuilles de maïs avec des protéines fluorescentes (FP)24. La première méthode consiste à enlever la partie supérieure des feuilles plus âgées des semis de maïs à l’aide d’un décapant métallique (figure 1E). En exposant l’extrémité du primordium (P5-P7), il devient possible de déterminer sa longueur sans avoir à enlever complètement les feuilles environnantes plus anciennes, permettant ainsi une section facile et précise. La deuxième méthode consiste à dérouler et à monter des primordia à feuilles entières (P3-P7) avec du ruban nano transparent double face (Figure 1F). Ces méthodes conviennent à la visualisation de divers PC24, mais nécessitent une optimisation pour l’utilisation de colorants fluorescents et de réactifs d’élimination. En outre, nous décrivons certaines procédures pour aplatir les piles z, assembler des images et fusionner des canaux dans ImageJ/FIJI34, qui s’appliquent aux images produites par les deux méthodes. Ces méthodes sont utiles pour la fluorescence de routine ou l’imagerie confocale des feuilles de maïs, mais elles peuvent également être adaptées à d’autres espèces de graminées modèles, telles que le riz, le setaria et le brachypodium.
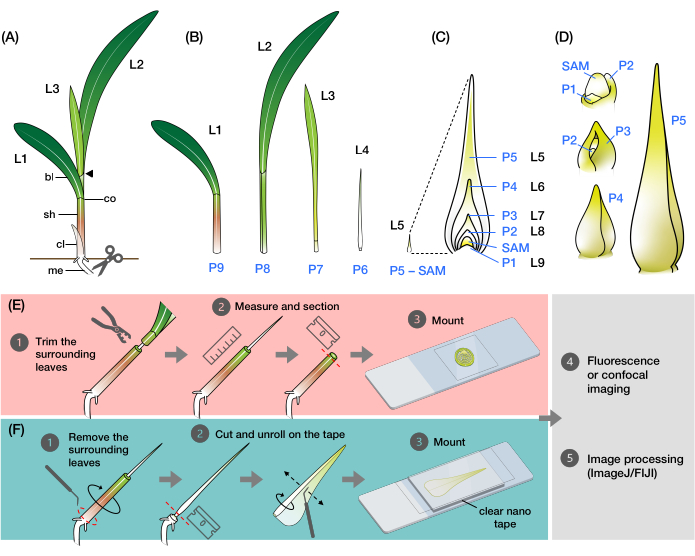
Figure 1: Organisation et morphologie des primordia des feuilles de maïs et aperçu des méthodes . (A) Représentation schématique d’un plant de maïs. Le maïs a une phyllotaxie distique, la nouvelle feuille commençant à la position opposée de la feuille précédente. Le numéro de feuille indique l’ordre chronologique dans lequel les feuilles ont émergé de la germination (c.-à-d. première feuille, L1; deuxième feuille, L2; troisième feuille, L3; etc.). Chaque feuille a un limbe distal et une gaine basale délimitée par un collier qui correspond à la ligule et à l’oreillette. La feuille supérieure avec le collier visible indique le stade végétatif. Le semis dans cet exemple est au stade V2, avec le collier L2 (pointe de flèche) visible. L’icône en forme de ciseaux indique l’emplacement au niveau du mésocotyle (me) où le semis doit être coupé pour être collecté. (B) Représentation schématique de la pousse disséquée montrant L1 à L4 isolée, avec les primordia foliaires L5 à L9 montrées sous forme d’image agrandie en (C). Le nombre de plastochron indique la position du primordium par rapport au SAM, avec le primordium foliaire le plus jeune (P1) le plus proche du SAM et le primordia foliaire plus âgé (P2, P3, P4, etc.) successivementplus loin 2. (D) Représentation schématique de la morphologie des primordia des feuilles de maïs de P1 à P5. E) Vue d’ensemble schématique de la méthode d’analyse transversale de la coupe transversale des primordia des feuilles de maïs. (1) Couper les feuilles plus âgées avec un dénudeur métallique. (2) Mesurer le primordium et couper la pousse. (3) Montez la section sur une lame pour l’imagerie et le traitement (4, 5). (F) Aperçu schématique de la méthode d’analyse en montage entier des primordia des feuilles de maïs. (1) Enlevez les feuilles environnantes pour extraire le primordium. (2) Couper et dérouler le primordium à plat sur le ruban nano. (3) Monter l’échantillon pour l’imagerie et le traitement (4, 5). Abréviations : L = feuille; bl = lame; sh = gaine; co = collier; moi = mésocotyle; V = végétatif; P = plastochron; SAM = méristème apical de pousse. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
1. Mise en scène du développement des feuilles de maïs et conception de l’expérience
- Cultiver les plantes et stadification du développement des feuilles
- Déterminer l’âge et le stade de développement des plantes à utiliser pour l’expérience et effectuer une étape détaillée du développement des feuilles.
NOTE: Il est recommandé que la stadification soit effectuée sur des plantes ayant le même bagage génétique que les lignées mutantes ou transgéniques qui seront utilisées dans les expériences. Le SAM cesse de produire de nouvelles feuilles entre 20 et 25 DAG, selon le bagage génétique et les conditions de croissance. Pour cette raison, les méthodes décrites ici sont idéales pour les plants de maïs âgés de 7 à 14 ans DAG. - Cultivez les plants de maïs dans une serre ou une chambre de croissance en suivant un protocole d’entretien approprié35.
- Ramassez les plantes à l’âge ou au stade V désiré avec un petit couteau ou une paire de ciseaux en coupant au niveau du mésocotyle, qui est la tige sous la surface du sol (figure 1A). Insérez soigneusement l’outil de coupe dans le sol à côté du semis et faites-le glisser vers la base à un angle de 45° pour couper le mésocotyle.
- Soulevez le semis du sol et dépoussiérez toute saleté ou particule de sol restante qui pourrait s’accrocher à la plante. Retirez le coléoptile, la gaine protectrice recouvrant la pousse émergente chez les jeunes plants, à la main.
- Pour chaque plante, notez le stade V, le nombre de feuilles et la longueur de la dernière feuille émergeant du verticille. Prenez des photos des plantes pour référence future.
- Retirez les feuilles plus anciennes une par une. Pour ce faire, tenez la plante par les restes du mésocotyle ou de la tige, et extrayez chaque feuille de la base de la gaine et déployez doucement la gaine en rond avec une sonde dentaire (Figure 1B).
REMARQUE : Voir l’étape 2.1 pour une méthode rapide pour enlever les feuilles environnantes. - Sous un stéréomicroscope à un grossissement d’environ 2x, disséquez soigneusement le reste de l’apex de la pousse sur des lingettes humides pour éviter que l’échantillon ne se dessèche. Écrouler délicatement et déployer chaque primordium foliaire à l’aide d’une sonde dentaire munie d’une aiguille pliée ou d’une paire de pinces fines jusqu’à ce que les SAM, P1 et P2 soient visibles (Figure 1D). Enregistrer l’apparence et la mesure de chaque plastochron.
REMARQUE : Voir un exemple de stadification du développement foliaire dans les semis de maïs dans le dossier supplémentaire 1.
- Déterminer l’âge et le stade de développement des plantes à utiliser pour l’expérience et effectuer une étape détaillée du développement des feuilles.
- Planification de l’expérience
REMARQUE: Planifier l’expérience avec soin peut améliorer l’efficacité. Par exemple, dans l’analyse de coupe transversale, la détermination de l’emplacement approximatif à couper lors de l’imagerie de plastochrons ou de régions spécifiques peut réduire le temps de dissection. La figure 2 montre un exemple d’échantillonnage normalisé. De plus, l’optimisation des paramètres d’imagerie en fonction des propriétés des PF ou des sondes fluorescentes peut améliorer l’efficacité des expériences.- Utilisez les informations de stadification comme guide pour concentrer l’expérience sur des plastochrons, des régions de primordium et des tissus spécifiques. Utilisez les PF ou d’autres sondes fluorescentes d’intérêt pour suivre les sections 2 et/ou 3 ci-dessous sur quelques échantillons.
NOTE: Voir les stocks de semences disponibles de la lignée de marqueurs FP de maïs36-42 à https://www.maizegdb.org/data_center/stock. - Déterminez les paramètres d’acquisition d’image optimaux pour chaque rapporteur ou sonde FP, y compris le détecteur ou le filtre approprié, les longueurs d’onde d’excitation et d’émission, la taille du sténopé et d’autres paramètres. Enregistrez les paramètres pour reproduire les conditions de travail de chacune des expériences.
NOTE: Voir Linh et Scarpella30 pour certaines directives techniques pour la microscopie confocale à balayage laser des feuilles en développement. - Planifiez le temps d’imagerie en fonction de la demi-vie et d’autres propriétés du rapporteur FP43.
REMARQUE : Le temps entre la dissection et l’imagerie doit également être pris en compte lors de la planification d’une expérience, car les échantillons de plantes fraîches sont soumis à la dessiccation et aux changements cellulaires pendant cette période.
- Utilisez les informations de stadification comme guide pour concentrer l’expérience sur des plastochrons, des régions de primordium et des tissus spécifiques. Utilisez les PF ou d’autres sondes fluorescentes d’intérêt pour suivre les sections 2 et/ou 3 ci-dessous sur quelques échantillons.
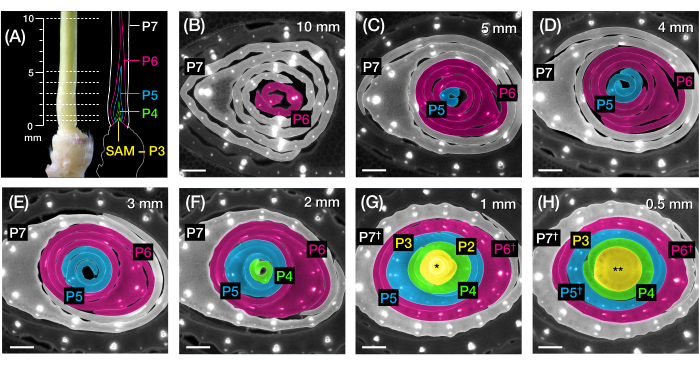
Figure 2: Plan d’échantillonnage pour l’analyse transversale de la feuille de maïs primordia. (A, à gauche) Pousse proximale d’un semis de maïs 7 DAG, montrant une quatrième feuille exposée (L4) à P7. Les lignes brisées indiquent les sept points d’échantillonnage le long du primordium, de 0,5 mm à 10 mm. (A, à droite) Représentation schématique du primordia foliaire, avec la taille et la position projetées de chaque plastochron: P7 (blanc); P6 (magenta); P5 (bleu); P4 (vert); et P3 jusqu’au SAM (jaune). (B-H) Images de fluorescence de coupes transversales représentant les points de prélèvement représentés au point A de 10 mm (B) à 0,5 mm (H). Les primordia sont pseudocolorées selon le schéma de couleurs plastochron en (A). Les coupes ont été imagées avec un microscope à épifluorescence à l’aide d’un filtre UV à émission passe-long pour l’autofluorescence. Barre d’échelle = 200 μm (B-H). Cette figure a été modifiée et reproduite avec la permission de Robil et McSteen24. Abréviations : DAG = jours après la germination; P = plastochron; SAM = méristème apical de pousse; † = gaine foliaire ou pré-ligule proprement dite; * = méristème apical de pousse; ** = tige. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Imagerie de coupes transversales de primordia de feuilles de maïs
- Dépouiller les feuilles environnantes plus âgées et mesurer le primordium des feuilles
- Ramassez le semis en le coupant soigneusement au niveau du mésocotyle sous la surface du sol à l’aide d’un petit couteau ou d’une paire de ciseaux, comme décrit aux étapes 1.1.3 à 1.1.4 (figure 1A).
- Déterminez la bonne taille de trou de dénudeur de fil à utiliser et où la coupe sera faite le long de la pousse. Assurez-vous que le trou est assez grand pour s’adapter au primordium cible.
- Commencez à couper à la partie la plus distale de la pousse et travaillez progressivement vers la base jusqu’à ce que la pointe du primordium soit exposée.
- Pour faire la coupe, tenez le dénudeur de fil avec les mâchoires face à la pousse. Placez la pousse sur le trou sélectionné et pressez les poignées de décapante ensemble pour couper à travers le verticille de la feuille.
REMARQUE: Pour éviter de couper accidentellement le primordium cible, alignez soigneusement le centre de la pousse avec le trou dans le dénudeur de fil. Pour les plantes plus grandes, il est recommandé d’enlever manuellement certaines des feuilles environnantes à la main avant d’utiliser le décapant.
ATTENTION : Les dénudeurs métalliques ont des mâchoires pointues qui peuvent causer des coupures ou d’autres blessures s’ils ne sont pas utilisés avec précaution. - Tout en continuant à serrer les poignées ensemble, faites glisser le décapant loin de la pousse pour couper la partie supérieure des feuilles. S’assurer que la région cible du primordium reste recouverte par les feuilles environnantes (figure supplémentaire S1C,D).
NOTE: Après avoir coupé les feuilles supérieures, la pousse est laissée avec une pointe de primordium exposée (P5, P6 ou P7, selon la position de la coupe et la taille du trou de dénudeur de fil utilisé; Figure 1E). Ce primordium servira de référence pour estimer la taille et le stade des primordies plus jeunes. P6 est la référence la plus pratique à utiliser dans les semis de maïs en raison de sa gamme de tailles et de sa morphologie en forme d’épingle. - Utilisez une règle pour mesurer la longueur de la pointe du primordium à la base de la pousse. Enregistrez la mesure.
NOTE: La longueur du primordium sera légèrement surestimée car il y a quelques millimètres de tige à la base du primordia (Figure 2A).
- Sectionnement à main levée et imagerie du primordium foliaire
- Sous un stéréomicroscope à un grossissement d’environ 0,8x, maintenez la pousse stable sur une surface lisse, telle qu’une planche à découper en verre ou un autre matériau résistant aux rayures. Utilisez une lame de rasoir ou un scalpel pour couper de fines sections (0,25-0,8 mm) de la pousse aux points souhaités le long du primordium.
- Faites une coupe initiale légèrement au-dessus de la région cible pour éliminer la partie distale du tir, puis obtenez de fines sections autour de la région cible. Pour faire des coupes nettes, tenez la lame perpendiculairement à la pousse et faites-la glisser vers l’intérieur avec un mouvement lisse et uniforme.
REMARQUE: Il peut y avoir quelques millimètres de marge de manœuvre de sectionnement pour les primordia plus grandes (P6 ou P7). Cependant, pour les primordies plus petites (P5 et antérieures), 1 mm peut faire une différence significative dans l’échantillonnage, car ces primordia sont empilées dans les premiers millimètres de la base de la pousse (voir Figure 2A, F-H). Il est recommandé d’utiliser une lame de rasoir à double tranchant pour une section plus fine.
ATTENTION: Faites preuve de prudence lorsque vous utilisez des lames de rasoir et des scalpels pour éviter toute coupure ou blessure accidentelle. - Remplacez régulièrement la lame de rasoir, car les gaines de feuilles peuvent facilement émousser la lame. Couvrir la pousse avec des lingettes humides après chaque cycle de sectionnement pour éviter que l’échantillon ne se dessèche.
- Montez la section de la feuille sur une lame de verre propre (75 mm x 25 mm), utilisez une pipette pour appliquer une goutte d’eau (ou 50% de glycérol) directement sur la section et placez une lamelle de couverture (22 mm x 22 mm) sur le dessus.
- Si vous utilisez un colorant fluorescent, appliquez la solution de colorant sur la section, placez une lamelle de couverture sur le dessus et incuberez-la au besoin.
REMARQUE: Selon le type de colorant, des étapes supplémentaires pour le traitement des sections de feuilles peuvent être nécessaires avant de passer à l’étape suivante. Ces références44,45,46,47 fournissent des détails généraux et les utilisations des colorants fluorescents en imagerie cellulaire végétale. Un colorant fluorescent colorant les noyaux, la 5-éthynyl-2′-désoxyuridine (EdU), a été utilisé efficacement sur les coupes transversales de primordia48 des feuilles de maïs. En revanche, les colorants colorants de membrane plasmique, tels que Fei Mao 4-64 (FM 4-64) et l’iodure de propidium, ne produisent pas de résultats satisfaisants (Figure 3A-D). - Placez la lame sur la scène d’un microscope à balayage laser confocale ou à épifluorescence et ajustez la mise au point et les réglages au besoin pour visualiser le fluorophore30. Voir le tableau 1 pour les paramètres d’éclairage et d’acquisition d’images utilisés pour certaines lignes de rapporteurs FP maïs.
REMARQUE : Les sections épaisses peuvent produire des niveaux élevés d’autofluorescence de fond. Envisager des stratégies d’imagerie et de préparation des échantillons qui peuvent aider à atténuer ce problème30,49 (voir le tableau 2).
ATTENTION : Soyez prudent et portez des lunettes de protection lorsque vous travaillez avec des sources lumineuses puissantes et des lasers pour réduire le risque de lésions oculaires. - Image à travers la section de la feuille à différents grossissements et canaux de détection (y compris l’éclairage en champ clair)30. Utilisez un grossissement 4x pour imager toute la section transversale et un grossissement 20x ou 40x pour imager des tissus spécifiques. Réduire le temps d’exposition à des grossissements plus élevés pour l’imagerie par épifluorescence afin de protéger les échantillons contre le photoblanchiment rapide (voir le tableau 1).
- Capturez des images de l’ensemble de la section ou de régions d’intérêt spécifiques (ROI). Si nécessaire, acquérir une pile z, qui est une série d’images capturées à différentes profondeurs focales30.
- Pour acquérir une pile z, déterminez d’abord les positions supérieure et inférieure dans l’échantillon, puis le nombre de sections optiques qui doivent être capturées entre ces positions. Moins de sections optiques se traduit par une taille de pas z plus grande, qui est la distance entre chaque section. Selon les propriétés du FP et le grossissement utilisé, capturer trois à 25 coupes optiques avec des tailles de pas z comprises entre 1 et 12 μm pour l’imagerie des coupes transversales de primordia des feuilles de maïs.
REMARQUE : Pour aplatir la pile z, utilisez une technique de rendu de volume50 appropriée qui peut être réalisée à l’aide du logiciel de microscope ou à l’aide d’ImageJ/FIJI34 (voir les étapes 4.1 et 4.2). - Enregistrez tous les fichiers image et leurs métadonnées associées, le cas échéant.
Tableau 1 : Paramètres d’éclairage et d’acquisition d’images utilisés pour la fluorescence et l’imagerie confocale de certains rapporteurs de PF pour le maïs. Abréviations : FP = protéine fluorescente; TRITC = tétraméthylrhodamine; FITC = isothiocyanate de fluorescéine; WLL = laser à lumière blanche; Ar-ion = laser ion argon; HyD = détecteur hybride; AU = Unité aérienne; Hz = Hertz, ligne de balayage par seconde. Veuillez cliquer ici pour télécharger ce tableau.
3. Imagerie de montures entières de primordia de feuilles de maïs déroulées
- Disséquer les primordia et préparer la lame de verre avec du ruban nano
- Recueillir le semis en le coupant soigneusement au niveau du mésocotyle sous la surface du sol à l’aide d’un petit couteau ou d’une paire de ciseaux, comme décrit aux étapes 1.1.3 à 1.1.4 (figure 1A).
- Préparez la lame de verre (75 mm x 25 mm) avec le ruban nano transparent double face (figure supplémentaire S1H) avant de disséquer la plante. Coupez un morceau rectangulaire de nano ruban adhésif et collez-le au centre d’une lame de verre propre. Ne retirez pas le film plastique protecteur sur la face supérieure du ruban.
REMARQUE : Déterminez la taille de la bande à utiliser en fonction de la taille des échantillons à imager (voir les exemples d’échantillons surdimensionnés dans la figure supplémentaire S1I,J). Le nano ruban est disponible en gel acrylique ou polyuréthane. Les deux types sont efficaces pour la fluorescence et l’imagerie confocale24. Pour éviter la décoloration du ruban, protégez-le d’une exposition prolongée à la lumière en le stockant dans un récipient sombre. - Commencez à disséquer la pousse en enlevant la partie supérieure des feuilles plus âgées à l’aide d’un dénudeur métallique, comme décrit à l’étape 2.1.
- Tenez la pousse par le mésocotyle et retirez soigneusement les feuilles environnantes avec une sonde dentaire pour extraire la primordie. Pour ce faire, retirez les feuilles de la base de la pousse et déployez-les une à la fois jusqu’à ce que le primordium d’intérêt soit exposé.
- Vous pouvez également utiliser le dénudeur métallique pour extraire directement la primordie foliaire en coupant la région basale de la pousse (figure supplémentaire S1E-G).
REMARQUE: Cette méthode comporte un risque plus élevé de casser la primordia.
- Montage et imagerie du primordium.
- Retirez le film protecteur de la bande. Posez le primordium exposé sur la bande. Utilisez une lame de rasoir pour couper le primordium à la base, en jetant la tige basale et l’hypocotyle (Figure 1F).
- Déroulez le primordium à l’aide d’une sonde dentaire avec une aiguille pliée (diamètre de la pointe de 0,25 à 0,6 mm). Utilisez une microsonde (diamètre de la pointe de 0,15 à 0,2 mm) pour les primordia de moins de 3 mm (P3 à P4 précoce).
- Placez la pointe de l’aiguille parallèlement à la surface et déployez la marge basale externe en la pressant doucement contre le ruban.
- Pour un déroulement plus lisse, lubrifiez la surface interne (adaxiale) de la feuille en plongeant la pointe de l’aiguille dans 100% glycérol.
- Avec la marge extérieure adhérant à la bande, alignez la pointe de l’aiguille parallèlement à l’axe long de la feuille. Faites glisser doucement l’aiguille sur le côté pour dérouler et aplatir la feuille sur le ruban (Figure 1F).
REMARQUE : Il est courant de casser ou d’endommager la feuille lors du déroulement de la feuille, en particulier chez les primordies plus grandes avec une nervure médiane robuste (voir la figure 3E-G). Le déroulement vigoureux de la feuille peut meurtrir sa surface et produire des artefacts pendant l’imagerie (Figure 3H). Voir le tableau 2 et la discussion pour les solutions recommandées à ces problèmes. - Appliquez une goutte d’eau sur le primordium déroulé. Placez immédiatement une glissière sur la goutte d’eau et le primordium. Appuyez doucement sur les bords de la lamelle de couverture afin qu’ils adhèrent au ruban.
REMARQUE: Il est recommandé d’utiliser de grandes lamelles rectangulaires (50 mm x 24 mm ou 60 mm x 24 mm) avec des zones supplémentaires pour adhérer à la bande. Minimiser la formation de bulles d’air, qui peuvent déformer la feuille et provoquer une réfraction inégale de la lumière (voir Figure 3I-K). Assurez-vous que la lamelle adhère complètement à la bande, car les marges du primordium monté peuvent revenir sous une lamelle de couverture faiblement collée (voir Figure 3L). - Placez la lame sur la scène d’un microscope à balayage laser confocale (voir figure supplémentaire S1K) (voir figure supplémentaire S1K) et ajustez la mise au point et les réglages au besoin pour visualiser le fluorophore30. Voir le tableau 1 pour les paramètres d’éclairage et d’acquisition d’images utilisés pour les lignes rapporteures FP de maïs sélectionnées.
- Imagez la feuille entière ou un ROI spécifique à travers différents canauxde détection 30. Pour imager la feuille entière, capturez manuellement des images en mosaïque de la feuille ou utilisez le carrelage du microscope à faible grossissement (4x ou 10x).
REMARQUE : Même au grossissement le plus faible, les primordies foliaires du maïs peuvent être trop grandes pour être visualisées avec un microscope à balayage laser ou confocale, ce qui entraîne des temps d’imagerie plus longs qui peuvent entraîner un photoblanchiment (voir la figure 3M) ou une augmentation de l’autofluorescence de fond. Par conséquent, il est recommandé d’utiliser un stéréomicroscope à fluorescence pour l’imagerie d’échantillons de feuilles entières de plus de 5 mm. - Pour l’imagerie confocale, il sera nécessaire d’obtenir des piles z qui englobent l’épaisseur de la feuille (voir étape 2.2.9).
- Enregistrez tous les fichiers image et leurs métadonnées associées, le cas échéant.
Tableau 2 : Résolution des problèmes courants liés à l’imagerie de coupes transversales et de montures entières de primordia de feuilles de maïs. Veuillez cliquer ici pour télécharger ce tableau.
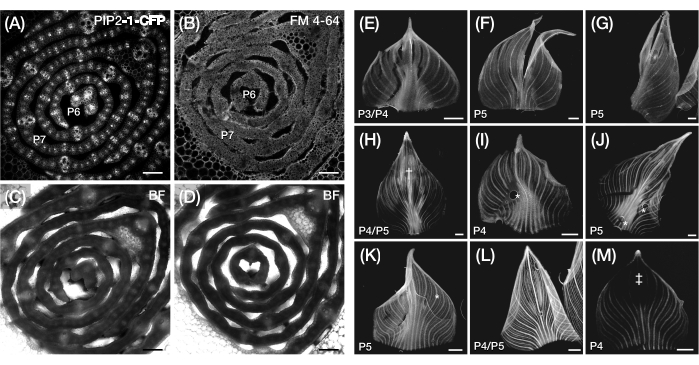
Figure 3 : Préparation transversale sous-optimale et montage entier des primordies foliaires du maïs. (A-D) Images confocales représentatives de sections transversales de primordia foliaire avec un marqueur de membrane plasmique, PIP2-1-CFP (A), et un colorant fluorescent liant la membrane plasmique, FM 4-64 (B), avec les images de fond clair correspondantes (C, D). Par rapport à PIP2-1-CFP, FM 4-64 affiche une visualisation sous-optimale des contours des cellules. (E-M) Images de fluorescence représentatives de montures entières de primordia foliaire montrant la présence de déchirures (E-G), de †surfaces meurtries (H), de bulles d’air* (I-K), de marges reculées (L) et de régions photoblanchies‡ (M). Les primordia foliaires expriment DII-Vénus (E-G), GAR2-YFP (H-J), mDII-Vénus (K), PIN1a-YFP (L) et DR5-RFP (M). Barre d’échelle = 200 μm (A-D); 500 μm (E-M). La figure 3A a été modifiée et reproduite avec la permission de Robil et McSteen24, tandis que la figure 5B-M sont des données non publiées des auteurs. Abréviations : P = plastochron; YFP = protéine fluorescente jaune; RFP = protéine fluorescente rouge; CFP = protéine cyanfluorescente; PIP2-1-CFP = pZmPIP2-1::ZmPIP2-1:CFP; DII-Vénus = pZmUbi:DII:YFP-NLS; GAR2-YFP = p Zm GAR2::ZmGAR2:YFP; mDII-Vénus = pZmUbi:mDII:YFP-NLS; PIN1a-YFP = p Zm PIN1a::ZmPIN1a:YFP; DR5-RFP = DR5rev::mRFPer; BF = champ clair. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Traitement des images à l’aide d’ImageJ/FIJI
- Aplatissement des piles z à l’aide de la projection d’intensité maximale (MIP)
- Lancez ImageJ/FIJI et ouvrez la pile d’images, ou créez une nouvelle pile à partir de plusieurs images distinctes en sélectionnant Image | Piles | Images à empiler à partir du menu.
- Sélectionnez la pile d’images. Dans le menu, sélectionnez Image | Piles | Z-projet.... Dans la boîte de dialogue Z-Project , choisissez Intensité maximale dans le menu déroulant Type de projection . Cliquez sur OK pour créer la projection z d’intensité maximale.
REMARQUE: L’image aplatie est une projection 2D des pixels avec l’intensité la plus élevée sur les piles z50. Cette méthode convient à la visualisation du fluorophore, mais pas des caractéristiques anatomiques dans les images en fond clair de sections transversales épaisses et de supports de feuilles entières. - Enregistrez l’image au format TIFF (Tagged Image File Format) en sélectionnant Fichier | Enregistrer sous | Tiff. Entrez un nom pour le fichier et cliquez sur Enregistrer.
REMARQUE: Il est recommandé d’utiliser TIFF pour stocker les images de fluorescence et confocales, car il conserve la qualité et les détails lorsque l’image est enregistrée.
- Aplatissement des piles z à l’aide du plugin Extended Depth of Field (EDF)51
- Installez le plugin EDF52. Téléchargez le fichier Extended_Depth_Field.jar (version 17.05.2021) depuis http://bigwww.epfl.ch/demo/edf/ et placez-le dans le dossier « plugins » de ImageJ/FIJI.
- Lancez ImageJ/FIJI et ouvrez la pile d’images, ou créez une nouvelle pile à partir de plusieurs images distinctes en sélectionnant Image | Piles | Images à empiler à partir du menu.
- Sélectionnez la pile d’images. Dans le menu, sélectionnez Plugins | Profondeur de champ étendue | Mode facile EDF. Dans la boîte de dialogue Profondeur de champ étendue , utilisez les curseurs sous Vitesse/Qualité pour définir la qualité et la vitesse de traitement souhaitées, et le reg Height-map pour définir le niveau de lissage de la topographie. Cliquez sur Exécuter pour créer l’image reconstruite.
REMARQUE: EDF combine la pile en une image 2D composite nette en projetant la meilleure mise au point51. Cette technique est utile pour surmonter la profondeur de champ limitée et convient à la reconstruction d’images en champ clair de sections transversales épaisses ou de supports de feuilles entières. Soyez prudent lorsque vous appliquez ce filtre pour visualiser le fluorophore car, contrairement à MIP, EDF ajuste le contraste de l’image, ce qui affecte l’intensité des pixels. - Enregistrez l’image en tant que fichier TIFF en sélectionnant Fichier | Enregistrer sous | Tiff. Entrez un nom pour le fichier et cliquez sur Enregistrer.
- Assemblage d’images à l’aide du plugin Grid/Collection Stitching53
- Enregistrez la collection d’images ou de piles d’images à assembler dans un seul répertoire.
- Lancez ImageJ/FIJI et sélectionnez Plugins | Cousures | Assemblage de grilles/collections à partir du menu. Dans la boîte de dialogue Assemblage de grille/collection, choisissez Position inconnue dans le menu déroulant Type, puis Tous les fichiers du répertoire dans l’ordre. Cliquez sur OK.
- Dans la boîte de dialogue Assemblage de grille : Position inconnue, Tous les fichiers du répertoire, spécifiez l’emplacement des images en tapant ou collant le chemin d’accès au répertoire dans le champ de texte Répertoire ou en cliquant sur Parcourir... pour localiser le répertoire. Cliquez sur OK pour commencer le processus d’assemblage.
REMARQUE: L’option Position inconnue dans le plug-in Grille/Collection Stitching reconstruit une image composite à partir d’un ensemble d’images contiguës en analysant leurs régions qui se chevauchent. Par conséquent, cette option est utile pour assembler des mosaïques d’images de sections transversales ou de supports de feuilles entières qui ne sont pas obtenus à l’aide d’une opération de numérisation de tuiles. - Lorsque l’assemblage est terminé, une nouvelle fenêtre apparaîtra avec l’image assemblée. Enregistrez l’image en tant que fichier TIFF en sélectionnant Fichier | Enregistrer sous | Tiff. Entrez un nom pour le fichier et cliquez sur Enregistrer.
REMARQUE: L’assemblage de grands montages d’images 2D et 3D peut également être effectué à l’aide de commandes de reconstruction d’image dans le logiciel de microscope ou via les options d’importation de bioformats dans ImageJ / FIJI.
- Combinaison de plusieurs canaux à l’aide de la commande Fusionner les canaux
- Lancez ImageJ/FIJI et ouvrez les images ou les piles d’images à fusionner.
Remarque : Les piles d’images peuvent être aplaties en premier à l’aide des étapes 4.1 ou 4.2. La MIP est généralement recommandée pour aplatir les canaux fluorophores, tandis que l’EDF est mieux adaptée pour aplatir les canaux en fond clair ou d’autres canaux avec une profondeur de champ variable variable. - Régler la luminosité et le contraste des images avec Image | Ajuster | Luminosité/Contraste. Utilisez les curseurs ou les champs de saisie pour ajuster les paramètres, puis cliquez sur Appliquer. Vous pouvez également utiliser une méthode d’étirement d’histogramme linéaire en sélectionnant Processus | Améliorer le contraste.... Définissez le pourcentage de pixels saturés, sélectionnez Normaliser, puis cliquez sur OK.
REMARQUE: Lors de la quantification ou de la comparaison de l’intensité du signal fluorophore entre les images, il est généralement préférable de ne pas ajuster la luminosité ou le contraste, car cela peut modifier les intensités relatives des pixels dans l’image, ce qui peut affecter les mesures et les comparaisons. - Pour différencier les canaux, appliquez des pseudo-couleurs à des images spécifiques à l’aide d’une table de correspondance (LUT). Pour ce faire, sélectionnez l’image, puis dans le menu ImageJ/FIJI, sélectionnez Image, cliquez sur Tables de choix et choisissez la LUT appropriée dans la liste déroulante.
- Dans le menu, sélectionnez Image | Couleur | Fusionner les canaux. Pour chaque canal (C1, C2, C3...), utilisez la liste déroulante pour sélectionner l’image à affecter à ce canal. Cliquez sur OK pour fusionner les canaux.
- Enregistrez la nouvelle image au format TIFF en sélectionnant Fichier | Enregistrer sous | Tiff. Entrez un nom pour le fichier et cliquez sur Enregistrer.
- Lancez ImageJ/FIJI et ouvrez les images ou les piles d’images à fusionner.
Résultats
Analyse transversale de la primordia des feuilles de maïs
Nous avons utilisé la section 2 du protocole pour quantifier le nombre de veines et caractériser les profils de réponse hormonale dans les sections transversales de primordia des feuilles de maïs avec des PF (Figure 4)24. Pour évaluer le rôle de l’hormone végétale auxine dans la croissance des feuilles et la formation des veines, nous avons quantifié le nombre de nervures dans la primordie foliaire d’un mutant du maïs déficient en auxine, le gland en voie de disparition254. Chez les premiers plastochrons, les veines en développement présentent une cellularisation distincte dans la couche cellulaire médiane de la feuille de maïs primordium21,22. Cependant, l’identification et le comptage des veines à l’aide de techniques histologiques conventionnelles22 peuvent être laborieux et prendre beaucoup de temps. Ainsi, pour quantifier les veines, nous avons utilisé le marqueur de la protéine d’efflux d’auxine de maïs p Zm PIN1a::ZmPIN1a:YFP41 (PIN1a-YFP ci-après), qui marque les veines en développement et les brins procambiaux (PCS; Figure 4A). À l’aide de la section 2 du protocole, nous avons pu normaliser l’échantillonnage de la section transversale en mesurant les primordia avant la section (Figure 4B, C). Nous avons découvert une tendance dans laquelle vt2 a un primordium plus large et plus de nervures que la normale (Figure 4D,E)24, ce qui est cohérent avec les données des feuilles complètement expansées55, indiquant que le défaut de vt2 a commencé tôt dans le développement des feuilles. En utilisant la section 2 du protocole, nous avons également pu examiner systématiquement les profils d’expression des rapporteurs de réponse hormonale PF dans les primordia foliaires (voir les exemples des images de la figure 4F-I). Grâce à un schéma d’échantillonnage de coupe transversale standardisé, nous avons cartographié la distribution des réponses auxines, cytokinines (CK) et acide gibbérellique (GA) dans différents plastochrons et régions des primordia foliaires, et découvert de nouveaux modèles de réponse qui, selon nous, ont des implications pour la croissance des feuilles et la formation des veines24. Par conséquent, ces résultats représentatifs démontrent l’utilité de la section 2 du protocole pour l’analyse transversale de la primordie des feuilles de maïs.
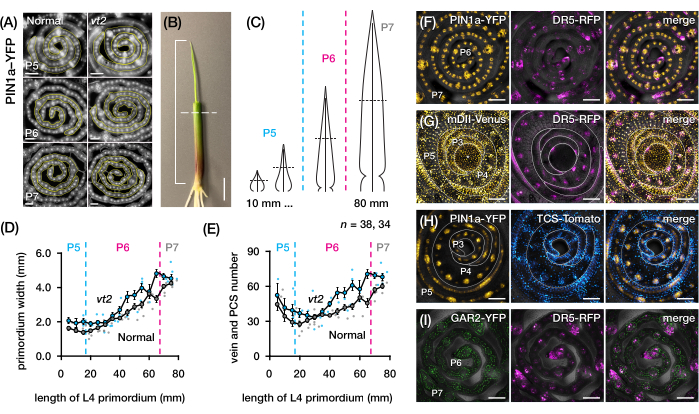
Figure 4 : Résultats représentatifs de l’analyse transversale de la primordie des feuilles de maïs. (A-E) Quantification du nombre de veines et de la largeur du primordium dans les primordia foliaires des glands normaux et en voie de disparition2 avec le marqueur de la protéine d’efflux d’auxine PIN1a-YFP. (A) Images de fluorescence représentatives de coupes transversales de P5 à P7 exprimant PIN1a-YFP dans les veines en développement et les brins procambiaux. Les coupes transversales ont été imagées avec un microscope à épifluorescence à l’aide d’un filtre FITC (excitation 495-519 nm). Le nombre de veines et la largeur du primordium ont été quantifiés à l’aide des outils de ligne multipoint et à main levée de FIJI/ImageJ, respectivement. (B) Un plant de maïs dont les verticilles supérieurs des feuilles ont été enlevés à l’aide d’un décapant métallique pour exposer l’extrémité de la quatrième feuille (L4). La parenthèse couvre la longueur projetée du primordium, la ligne pointillée indiquant la longueur médiane. (C) Diagramme schématique de différentes formes de primordium de P5 à P7, illustrant comment le nombre de veines et la largeur du primordium à mi-longueur (ligne pointillée horizontale) peuvent varier en fonction du stade de développement du primordium. (D, E) Mesure de la largeur du primordium (D) et du nombre de veines (E) à la section mi-longueur de L4 de normal et vt2. La courbe de tendance représente des moyennes mobiles de 10 mm de mesures ±'erreur type de la moyenne (MEB). (F-I) Images confocales représentatives de sections transversales de primordia foliaire exprimant des combinaisons de PIN1a-YFP, rapporteur de réponse auxine, DR5-RFP, rapporteur de réponse cytokinine, TCS-Tomate, marqueur sensible à l’acide gibbérellique, GAR2-YFP et mDII-Vénus, une version mutée du rapporteur d’entrée de signalisation auxine DII-Venus. Les canaux FP sont superposés au canal de fond clair dans chaque image. Barre d’échelle = 200 μm (A); 10 mm (B); 100 μm (F-I). Cette figure a été modifiée et reproduite avec la permission de Robil et McSteen24. Abréviations : DAG = jours après la germination; P = plastochron; vt2 = pompon en voie de disparition2; PCS = brin procambial; YFP = protéine fluorescente jaune; FITC = isothiocyanate de fluorescéine; RFP = protéine fluorescente rouge; PIN1a-YFP = p Zm PIN1a::ZmPIN1a:YFP; DR5-RFP = DR5rev::mRFPer; TCS-Tomate = TCSv2::NLS-tdTomato; GAR2-YFP = p Zm GAR2::ZmGAR2:YFP; mDII-Vénus = pZmUbi:mDII:YFP-NLS. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Analyse en montage entier des primordia des feuilles de maïs
Nous avons suivi la section 3 du protocole pour visualiser et analyser l’expression de la PF dans des supports de feuilles entières de primordia de feuilles de maïs (Figure 5). En visualisant les modèles veineux avec PIN1a-YFP, nous avons constaté que la formation de veines se produit dans l’ensemble du primordium au cours des premiers plastochrons, mais que ce processus devient restreint dans les régions proximales plus tard dans le développement (Figure 5A)24. En complément des analyses de coupe transversale, les analyses de montage de feuilles entières ont révélé des schémas de réponse hormonale spécifiques aux tissus et aux stades lors de la formation des veines24. Un exemple est le modèle d’expression du rapporteur de réponse CK TCSv2::NLS-tdTomato37 (TCS-Tomato), par rapport à l’expression PIN1a-YFP (Figure 5B)24. En suivant la section 3 du protocole, nous avons pu effectuer des analyses qualitatives et quantitatives de l’expression de la PF dans les primordia foliaires (Figure 5D-F; données non publiées). Nous avons examiné les profils d’expression d’un rapporteur de réponse auxine, DR5rev::mRFPer41 (DR5-RFP), et d’un marqueur sensible à GA, pZmGAR2::ZmGAR2:YFP39 (GAR2-YFP), dans des montures de feuilles entières de mutants simples et doubles de vt2 et de plante naine3 (d3), un mutant déficienten AG 56 (Figure 5D). Nous avons également comparé les niveaux relatifs de prolifération cellulaire entre les primordia foliaires normales et vt2 en utilisant p Zm Cyclin-D2B::ZmCyclin-D2B:YFP42 (Cyclin-D2B-YFP), qui est un marqueur de la transition G1/S dans le cycle cellulaire 57 (Figure 5E,F). Bien qu’il n’y ait pas eu de différence significative entre la normale et vt2, l’expression de Cyclin-D2B-YFP était cohérente avec le profil de prolifération cellulaire connu des premiers plastochrons31. Nous concluons que la section 3 du protocole est une méthode efficace pour analyser des montures entières de primordia de feuilles de maïs, qui sont difficiles à imager en raison de leur morphologie laminée.
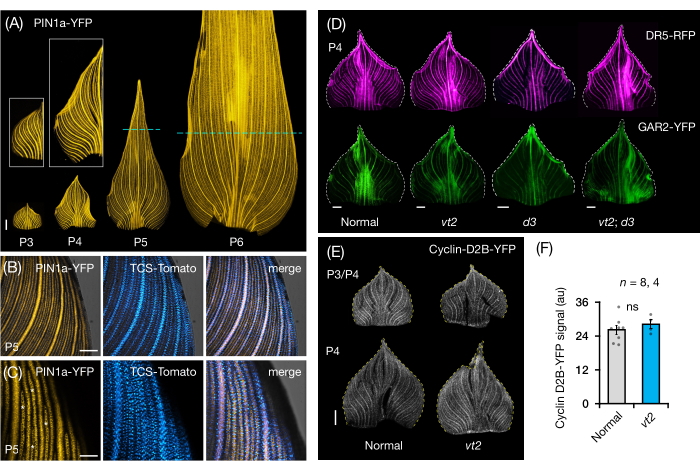
Figure 5 : Résultats représentatifs de l’analyse sur support entier des primordia foliaires du maïs. (A) Images de fluorescence représentatives des primordies foliaires de 7 plantules de maïs DAG montrant des nervures en développement et des brins procambiaux, marqués par le marqueur de la protéine d’efflux d’auxine PIN1a-YFP. Les primordia P3-P6 ont été excisées de la base, déroulées et aplaties avec le côté adaxial vers le haut. Les encarts montrent des gros plans de P3 et P4. Dans P5 et P6, des lignes pointillées délimitent l’extrémité distale des zones prolifératives, où la majorité des brins procambiaux se développent et s’étendent encore. (B,C) Images confocales représentatives montrant l’expression de PIN1a-YFP et du rapporteur de la réponse cytokinine, TCS-Tomato, dans la région marginale proximale d’un primordium P5. (D) Images de fluorescence représentatives de P4 primordia montrant l’expression du rapporteur de réponse auxine, DR5-RFP, et du marqueur sensible à l’acide gibbérellique, GAR2-YFP chez les mutants normaux et simples et doubles du gland en voie de disparition2 et de la plante naine3. (E) Images confocales représentatives de P3 et/ou P4 montrant l’expression de Cyclin-D2B-YFP, un rapporteur pour la transition G1/S dans le cycle cellulaire. (F) Quantités relatives de prolifération cellulaire dans les primordies foliaires P3/P4 normales et vt2, quantifiées en mesurant la densité intégrée du signal Cyclin-D2B-YFP sur la surface du primordium à l’aide d’ImageJ/FIJI. Les barres représentent les mesures moyennes ±'erreur-type de la moyenne. Barre d’échelle = 500 μm (A,D,E); 200 μm (B); 100 μm (C). La figure 4A-C a été modifiée et reproduite avec la permission de Robil et McSteen24, tandis que la figure 4D-F est une donnée non publiée des auteurs. Abréviations : DAG = jours après la germination; P = plastochron; vt2 = gland en voie de disparition2; d3 = plante naine3; YFP = protéine fluorescente jaune; RFP = protéine fluorescente rouge; PIN1a-YFP = p Zm PIN1a::ZmPIN1a:YFP; TCS-Tomate = TCSv2::NLS-tdTomato; DR5-RFP = DR5rev::mRFPer; GAR2-YFP = p Zm GAR2::ZmGAR2:YFP; Cycline-D2B-YFP = pZmCycline-D2B::ZmCycline-D2B:YFP; ns = aucune différence significative; Au = unité arbitraire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Dossier supplémentaire 1 : Exemples de stadification du développement foliaire dans les semis de maïs. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire S1 : Échantillons de plantes et matériaux utilisés dans les protocoles. (A,B) Un semis de maïs 7-8 DAG dont le verticille supérieur des feuilles a été enlevé à l’aide d’un dénudeur métallique. (B) L’encart montre un gros plan de la pousse avec le primordium P6 exposé. (C-G) Pousses de plants de maïs dont les verticilles supérieurs ont été enlevés pour l’analyse transversale (C, D) et les feuilles environnantes complètement enlevées pour l’analyse de montage entier (E-G). (H) Un rouleau de gel de polyuréthane transparent double face nano ruban adhésif. (I,J) Primordium (I) de la feuille P6 et région proximale de la feuille P8 (J) déroulés et montés sur des lames de verre avec le ruban nano. (K) Une lame de verre avec une feuille de primordium déroulée montée sur la scène d’un microscope à épifluorescence. Abréviation : DAG = jours après la germination. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Nous présentons deux méthodes de préparation des primordia des feuilles de maïs pour l’imagerie cellulaire. La première méthode (section 2 du protocole) permet de mesurer le primordium pour l’analyse transversale, tandis que la deuxième méthode (section 3 du protocole) permet de dérouler et d’aplatir le primordium pour l’analyse en montage entier. Ces méthodes facilitent l’imagerie cellulaire des PF dans les primordia24 des feuilles de maïs (comme illustré à la figure 4 et à la figure 5) et apportent des solutions simples aux défis de l’imagerie des feuilles de maïs en développement. La section 2 du protocole réduit le temps de dissection et améliore la précision de l’échantillonnage en mesurant les primordia avant la sectionnement plutôt que de se fier uniquement aux paramètres de stadification 9,16. Avec le nano-ruban disponible dans le commerce, la section 3 du protocole résout le problème de longue date de l’imagerie des primordia à feuilles entières dans le maïs. Ce protocole améliore la méthode précédente, qui utilisait des tubes de dialyse 31, et constitue une alternative beaucoup moins chère à la tomodensitométrie et à l’IRM11,32,33. Cependant, lorsqu’il s’agit de visualiser les traits anatomiques des feuilles et de produire des résultats optimaux, les deux protocoles présentent certaines limites, qui sont décrites dans le tableau 2 et sont discutées plus en détail ci-dessous.
Dans la section 2 du protocole, nous avons rencontré des difficultés à visualiser les contours cellulaires dans les sections transversales épaisses de la primordie foliaire, et la contre-coloration avec des colorants fluorescents liant la paroi cellulaire ou la membrane plasmique n’a pas donné de résultats satisfaisants. Par exemple, FM 4-64 a produit des résultats sous-optimaux par rapport au marqueur FP de la membrane plasmique, p Zm PIP2-1::ZmPIP2-1:CFP39 (PIP2-1-CFP; Figure 3A-D). Pour surmonter cette limitation, nous recommandons d’utiliser un vibratome pour produire des sections de tissu plus minces (~0,1 mm)58 qui permettront une imagerie en fond clair vif des contours cellulaires ou optimisant le protocole de contre-coloration 47,59.
Dans la section 3 du protocole, la principale limitation est la difficulté de monter la feuille sans déchirure, dommage ou bulles d’air, comme détaillé dans les étapes du protocole 3.2.5-3.2.6 (figure 3E-K). Étant donné que la feuille de maïs est bilatéralement symétrique, un montage en demi-feuille plutôt qu’un montage en feuille entière peut suffire pour la visualisation9. Pour ce faire, le primordium peut être coupé avec une lame de rasoir le long de l’axe longitudinal après l’avoir déroulé jusqu’à la nervure médiane, ce qui ne permet de monter que la moitié de la feuille. Une autre limitation de la section 3 du protocole est que l’épaisseur de la feuille peut limiter la résolution optique du signal fluorophore pendant l’imagerie profonde. Pour résoudre ce problème, il est possible d’utiliser une technique de nettoyage tissulaire60. Cependant, nous avons constaté que ClearSee61, un réactif de nettoyage couramment utilisé pour l’imagerie des tissus végétaux, n’est pas compatible avec le protocole car il provoque le détachement de l’échantillon et de la feuille de couverture de la bande nano. Une solution potentielle à ce problème pourrait être d’appliquer une membrane semi-perméable31 sur l’échantillon de feuille, ce qui permettrait de le traiter avec la solution de nettoyage tout en étant maintenu en place par le ruban nano. Une telle méthode permettant d’appliquer des solutions liquides sur la feuille déroulée pourrait également être utilisée pour les techniques d’hybridation in situ et d’immunolocalisation de l’ARN entier, qui ont été précédemment optimisées pour le développement d’inflorescences de maïs, mais pas pour les primordia à feuilles entières62,63.
Nous avons décrit des protocoles pour le maïs, qui a de grandes primordia foliaires même au stade des semis. D’autres espèces de graminées avec des primordies foliaires beaucoup plus petites, telles que le riz, l’orge, le blé, Setaria et Brachypodium 16,23,64,65,66, peuvent nécessiter l’utilisation d’outils de précision supplémentaires pour appliquer efficacement ces protocoles. De plus, ces protocoles n’étaient pas destinés à l’imagerie de cellules vivantes, qui capture en temps réel les processus dynamiques de formation tissulaire et de réponses cellulaires. Cependant, à mesure que les sondes fluorescentes, les technologies d’imagerie et les capacités informatiques continuent de progresser dans l’imagerie des cellules vivantes pour les plantes67, les recherches futures pourraient s’appuyer sur ces protocoles pour développer des stratégies d’imagerie de cellules vivantes adaptées aux caractéristiques uniques des primordia des feuilles de graminées.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Les auteurs tiennent à remercier la Maize Genetics Cooperation, le Maize Cell Genomics Project, Dave Jackson (Cold Spring Harbor Laboratory, NY), Anne W. Sylvester (Marine Biological Laboratory, University of Chicago, IL), Andrea Gallavotti (Rutgers University, NJ) et Carolyn G. Rasmussen (University of California, Riverside) pour avoir fourni les stocks mutants et transgéniques, ainsi que Robert F. Baker et Alexander Jurkevich du Advanced Light Microscopy Core de l’Université de Missouri-Columbia pour leur aide en microscopie confocale. JMR a été soutenu par la bourse J. William Fulbright, le Fonds Diane P. et Robert E. Sharp et le programme de recherche sur le génome végétal de la National Science Foundation (IOS-1546873) à PM. CDTC, CMRV, EDCDP et RJRR sont soutenus par le programme de bourses d’études Ateneo College. CDTC, EDCDP et RJRR sont soutenus par la bourse de premier cycle DOST-SEI S & T. DODL est soutenu par la bourse académique du père Thomas Steinbugler SJ. RJRR est soutenu par Aiducation International-Pathways to Higher Education Scholarship. Ce travail a été soutenu par l’École des sciences et de l’ingénierie et la Bibliothèque Rizal de l’Université Ateneo de Manille.
matériels
| Name | Company | Catalog Number | Comments |
| Acrylic Gel Clear Double Sided Nano Tape 16.5 ft x 1.2 in, 2 mm thick | EZlifego Store (Amazon) | B07YB1ZXG6 | 1 roll |
| Bellucci Pick Curved micro probe 16.8 cm, 6.6 in | Bausch & Lomb | N1692 9 | 1 pc |
| Clayman guide microprobe Sinskey hook angled shaft, 11.6 cm, 4.6 in | Storz Opthalmic Instruments | E0542 | 1 pc |
| Dental Probe, Bent Needle, 14 cm (5.5 in) | Ted Pella | 13553 | 1 pc |
| DOWELL 10-22 AWG Wire Stripper | Dowell Store (Amazon) | 10-22 AWG | 1 pc |
| Feather Double Edge Carbon Steel Blades | Ted Pella | 121-9 | pkg/10; for fine sectioning |
| Frosted End Glass Microscope Slides, 75 mm x 25 mm x 1-1.2 mm | Ted Pella | 260442 | pkg/144 |
| GEM Single Edge, Stainless Steel Uncoated Blades | Ted Pella | 121-1 | box/200; for general cutting/sectioning |
| Glycerol | Thermo Scientific | PI17904 | 1 liter |
| ImageJ/FIJI with EDF plugin (version 17.05.2021) and Grid/Collection Stitching plugin | National Institutes of Health (NIH) USA | version 2.9.0/1.54s | The EDF plugin was developed by Alex Prudencio, Jesse Berent, and Daniel Sage for the Biomedical Imaging Group, École Polytechnique Fédérale de Lausanne (EPFL; http://bigwww.epfl.ch/demo/edf/). The grid/collection stitching software was developed by Stephan Preibisch for the Max Planck Institute of Molecular Cell Biology and Genetics (MPI-CBG). |
| Kimwipes Ex-L Small 111.76 mm x 213.36 mm | Kimtech Science | 34155 | box/280 ply |
| Micro Cover Glasses, 22 mm x 22 mm x 0.13 - 0.16 mm thick | Ted Pella | 260140 | 1 ounce |
| PU Gel Clear Double Sided Nano Tape 29.5 ft x 1.18 in, 1 mm thick | Yecaye Store (Amazon) | L354 W1.18 | 2 rolls |
| Superslip Cover Glasses, 24 mm x 50 mm x 0.13 - 0.16 mm thick | Ted Pella | 260166 | 1 ounce |
| Superslip Cover Glasses, 24 mm x 60 mm x 0.13 - 0.16 mm thick | Ted Pella | 260168 | 1 ounce |
| Tempered Glass Cutting Board | Hacaroa (Amazon) | B09XMXBT5S | 4 pc |
Références
- McSteen, P., Kellogg, E. A. Molecular, cellular, and developmental foundations of grass diversity. Science. 377 (6606), 599-602 (2022).
- Wang, P., Vlad, D., Langdale, J. A. Finding the genes to build C4 rice. Current Opinion in Plant Biology. 31, 44-50 (2016).
- Wang, P., et al. Candidate regulators of early leaf development in maize perturb hormone signalling and secondary cell wall formation when constitutively expressed in rice. Scientific Reports. 7 (1), 4535(2017).
- Perico, C., Tan, S., Langdale, J. A. Developmental regulation of leaf venation patterns: Monocot versus eudicots and the role of auxin. New Phytologist. 234 (3), 783-803 (2022).
- Wang, P., Kelly, S., Fouracre, J. P., Langdale, J. A. Genome-wide transcript analysis of early maize leaf development reveals gene cohorts associated with the differentiation of C4 Kranz anatomy. The Plant Journal. 75 (4), 656-670 (2013).
- Liu, W. Y., et al. Regulators of early maize leaf development inferred from transcriptomes of laser capture microdissection (LCM)-isolated embryonic leaf cells. Proceedings of the National Academy of Sciences. 119 (35), e2208795119(2022).
- Liu, W. Y., et al. Anatomical and transcriptional dynamics of maize embryonic leaves during seed germination. Proceedings of the National Academy of Sciences. 110 (10), 3979-3984 (2013).
- Strable, J., Nelissen, H. The dynamics of maize leaf development: Patterned to grow while growing a pattern. Current Opinion in Plant Biology. 63, 102038(2021).
- Reynolds, J. O., Eisses, J. F., Sylvester, A. W. Balancing division and expansion during maize leaf morphogenesis: Analysis of the mutant, warty-1. Development. 125 (2), 259-268 (1998).
- Richardson, A. E., et al. Evolution of the grass leaf by primordium extension and petiole-lamina remodeling. Science. 374 (6573), 1377-1381 (2021).
- Johnston, R., Leiboff, S., Scanlon, M. J. Ontogeny of the sheathing leaf base in maize (Zea mays). New Phytologist. 205 (1), 306-315 (2015).
- Sharman, B. C. Developmental anatomy of the shoot of Zea mays L. Annals of Botany. 6 (22), 245-282 (1942).
- Johnston, R., et al. Transcriptomic analyses indicate that maize ligule development recapitulates gene expression patterns that occur during lateral organ initiation. The Plant Cell. 26 (12), 4718-4732 (2014).
- Sharman, B. C. Leaf and bud initiation in the Gramineae. Botanical Gazette. 106 (3), 269-289 (1945).
- Nelissen, H., et al. A local maximum in gibberellin levels regulates maize leaf growth by spatial control of cell division. Current Biology. 22 (13), 1183-1187 (2012).
- Itoh, J., et al. Rice plant development: From zygote to spikelet. Plant and Cell Physiology. 46 (1), 23-47 (2005).
- Ritchie, S. W., Hanway, J. J., Benson, G. O. How a corn plant develops. Iowa State University of Science and Technology. , (1986).
- Freeling, M., Walbot, V. The Maize Handbook. , Springer Science & Business Media. (2013).
- Freeling, M., Hake, S. Developmental genetics of mutants that specify knotted leaves in maize. Genetics. 111 (3), 617-634 (1985).
- Durbak, A. R., et al. Transport of boron by the tassel-less1 aquaporin is critical for vegetative and reproductive development in maize. The Plant Cell. 26 (7), 2978-2995 (2014).
- Langdale, J. A., Lane, B., Freeling, M., Nelson, T. Cell lineage analysis of maize bundle sheath and mesophyll cells. Developmental Biology. 133 (1), 128-139 (1989).
- Bosabalidis, A. M., Evert, R. F., Russin, W. A. Ontogeny of the vascular bundles and contiguous tissues in the maize leaf blade. American Journal of Botany. 81 (6), 745-752 (1994).
- Junqueira, N. E. G., et al. Anatomy and ultrastructure of embryonic leaves of the C4 species Setaria viridis. Annals of Botany. 121 (6), 1163-1172 (2018).
- Robil, J. M., McSteen, P. Hormonal control of medial-lateral growth and vein formation in the maize leaf. New Phytologist. 238 (1), 125-141 (2023).
- Donnelly, P. M., Bonetta, D., Tsukaya, H., Dengler, R. E., Dengler, N. G. Cell cycling and cell enlargement in developing leaves of Arabidopsis. Developmental Biology. 215 (2), 407-419 (1999).
- Govindaraju, P., Verna, C., Zhu, T., Scarpella, E. Vein patterning by tissue-specific auxin transport. Development. 147 (13), (2020).
- Linh, N. M., Scarpella, E. Leaf vein patterning is regulated by the aperture of plasmodesmata intercellular channels. PLoS Biology. 20 (9), e3001781(2022).
- Verna, C., Ravichandran, S. J., Sawchuk, M. G., Linh, N. M., Scarpella, E. Coordination of tissue cell polarity by auxin transport and signaling. eLife. 8, e51061(2019).
- Sawchuk, M. G., Head, P., Donner, T. J., Scarpella, E. Time-lapse imaging of Arabidopsis leaf development shows dynamic patterns of procambium formation. New Phytologist. 176 (3), 560-571 (2007).
- Linh, N. M., Scarpella, E. Confocal imaging of developing leaves. Current Protocols. 2 (1), e349(2022).
- Poethig, R. S., Szymkowiak, E. J. Clonal analysis of leaf development in maize. Maydica. 40, 67-76 (1995).
- Sprangers, K., Thys, S., van Dusschoten, D., Beemster, G. T. S. Gibberellin enhances the anisotropy of cell expansion in the growth zone of the maize leaf. Frontiers in Plant Science. 11, 1163(2020).
- Tsuda, K., et al. KNOTTED1 cofactors, BLH12 and BLH14, regulate internode patterning and vein anastomosis in maize. The Plant Cell. 29 (5), 1105-1118 (2017).
- Schindelin, J., et al. FIJI: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Plant Care Protocols - Maize. The Donald Danforth Plant Science Center's Plant Growth Facility. , Available from: https://www.danforthcenter.org/our-work/core-facilities/plant-growth/ (2019).
- Mir, R., et al. A DII domain-based auxin reporter uncovers low auxin signaling during telophase and early G1. Plant Physiology. 173 (1), 863-871 (2017).
- DeBlasio, S. L., Sylvester, A. W., Jackson, D. Illuminating plant biology: Using fluorescent proteins for high-throughput analysis of protein localization and function in plants. Briefings in Functional Genomics. 9 (2), 129-138 (2010).
- Wu, Q., Luo, A., Zadrozny, T., Sylvester, A., Jackson, D. Fluorescent protein marker lines in maize: Generation and applications. The International Journal of Developmental Biology. 57 (6-8), 535-543 (2013).
- Mohanty, A., et al. Advancing cell biology and functional genomics in maize using fluorescent protein-tagged lines. Plant Physiology. 149 (2), 601-605 (2009).
- Baker, R. F., et al. Sucrose transporter ZmSut1 expression and localization uncover new insights into sucrose phloem loading. Plant Physiology. 172 (3), 1876-1898 (2016).
- Gallavotti, A., Yang, Y., Schmidt, R. J., Jackson, D. The relationship between auxin transport and maize branching. Plant Physiology. 147 (4), 1913-1923 (2008).
- Krishnakumar, V., et al. A maize database resource that captures tissue-specific and subcellular-localized gene expression, via fluorescent tags and confocal imaging (Maize Cell Genomics Database). Plant and Cell Physiology. 56 (1), 12(2015).
- Snapp, E. L. Fluorescent proteins: A cell biologist's user guide. Trends in Cell Biology. 19 (11), 649-655 (2009).
- Geng, Y., Zhou, Y. Confocal live imaging of shoot apical meristems from different plant species. Journal of Visualized Experiments. (145), e59369(2019).
- Stanislas, T., Hamant, O., Traas, J. In-vivo analysis of morphogenesis in plants. Methods in Cell Biology. 139, Elsevier. 203-223 (2017).
- Fodor, E., Ayaydin, F. Fluorescent probes and live imaging of plant cells. Advances in Plant Ecophysiology Techniques. , Springer. 241-251 (2018).
- Grandjean, O., et al. In vivo analysis of cell division, cell growth, and differentiation at the shoot apical meristem in Arabidopsis. The Plant Cell. 16 (1), 74-87 (2004).
- Conklin, P. A., Johnston, R., Conlon, B. R., Shimizu, R., Scanlon, M. J. Plant homeodomain proteins provide a mechanism for how leaves grow wide. Development. 147 (20), (2020).
- Shaw, S. L. Imaging the live plant cell. The Plant Journal. 45 (4), 573-598 (2006).
- Klaus, A. V., Schawaroch, V., Frischmann, K. J. Confocal imaging and three-dimensional visualization of thick autofluorescent specimens. Methods in Molecular Biology. 1075, 213-225 (2014).
- Forster, B., Van De Ville, D., Berent, J., Sage, D., Unser, M. Extended depth-of-focus for multi-channel microscopy images: a complex wavelet approach. 2004 2nd IEEE International Symposium on Biomedical Imaging: Nano to Macro (IEEE Cat No. 04EX821). IEEE. , 660-663 (2004).
- Extended Depth of Field. EPFL Biomedical Imaging Group. , Available from: http://bigwww.epfl.ch/demo/edf/ (2022).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Phillips, K. A., et al. vanishing tassel2 encodes a grass-specific tryptophan aminotransferase required for vegetative and reproductive development in maize. The Plant Cell. 23 (2), 550-566 (2011).
- Robil, J. M., et al. GrasVIQ: An image analysis framework for automatically quantifying vein number and morphology in grass leaves. The Plant Journal. 107 (2), 629-648 (2021).
- Helliwell, C. A., Chandler, P. M., Poole, A., Dennis, E. S., Peacock, W. J. The CYP88A cytochrome P450, ent-kaurenoic acid oxidase, catalyzes three steps of the gibberellin biosynthesis pathway. Proceedings of the National Academy of Sciences. 98 (4), 2065-2070 (2001).
- Gutierrez, R., Quiroz-Figueroa, F., Vazquez-Ramos, J. M. Maize cyclin D2 expression, associated kinase activity and effect of phytohormones during germination. Plant and Cell Physiology. 46 (1), 166-173 (2005).
- Atkinson, J. A., Wells, D. M. An updated protocol for high throughput plant tissue sectioning. Frontiers in Plant Science. 8, 1721(2017).
- Lux, A., Morita, S., Abe, J., Ito, K. An improved method for clearing and staining free-hand sections and whole-mount samples. Annals of Botany. 96 (6), 989-996 (2005).
- Heriche, M., Arnould, C., Wipf, D., Courty, P. E. Imaging plant tissues: Advances and promising clearing practices. Trends in Plant Science. 27 (6), 601-615 (2022).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Chuck, G., Muszynski, M., Kellogg, E., Hake, S., Schmidt, R. J. The control of spikelet meristem identity by the branched silkless1 gene in maize. Science. 298 (5596), 1238-1241 (2002).
- Tran, T. M., et al. An optimized whole-mount immunofluorescence method for shoot apices. Current Protocols. 1 (4), e101(2021).
- O'Connor, D. L. PINs Lost and PINs Gained: Auxin-Transport Mediated Patterning in the Grasses. University of California, Berkeley. , Doctoral Dissertation (2012).
- Sharman, B. C., Hitch, P. A. Initiation of procambial strands in leaf primordia of bread wheat, Triticum aestivum L. Annals of Botany. 31 (2), 229-243 (1967).
- Serra, L., Tan, S., Robinson, S., Langdale, J. A. Flip-flap: A simple dual-view imaging method for 3D reconstruction of thick plant samples. Plants. 11 (4), 506(2022).
- Colin, L., et al. Imaging the living plant cell: From probes to quantification. The Plant Cell. 34 (1), 247-272 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon