Method Article
형광 및 공초점 이미징을 위해 횡단면을 준비하고 옥수수 잎 원시의 전체 마운트를 펼치기 위한 개선된 방법
요약
옥수수 잎 primordia는 깊숙이 찢어지고 구겨져 연구하기가 어렵습니다. 여기에서 우리는 형광 및 공초점 이미징을 위해 옥수수 잎 원시의 횡단면과 펼쳐진 전체 마운트를 준비하는 방법을 제시합니다.
초록
옥수수 (Zea mays)와 다른 풀 (Poaceae)에서 잎 원시는 잎 소용돌이 속에 깊숙이 박혀 굴러있어 초기 잎 발달을 연구하기가 어렵습니다. 여기에서는 형광 및 컨포칼 이미징을 위해 옥수수 잎 원시의 횡단면과 펼쳐진 전체 마운트를 준비하는 방법을 설명합니다. 첫 번째 방법은 와이어 스트리퍼를 사용하여 오래된 잎의 윗부분을 제거하여 잎 원시의 끝을 노출시키고 보다 정확한 횡단면 샘플링을 위해 측정할 수 있도록 합니다. 두 번째 방법은 투명한 양면 나노 테이프를 사용하여 이미징을 위해 전체 잎 원시를 펼치고 장착합니다. 우리는 옥수수에서 형광 단백질 리포터를 시각화하고 분석하는 두 가지 방법의 유용성을 보여줍니다. 이러한 방법은 옥수수 잎 원시의 독특한 형태가 제시하는 문제에 대한 솔루션을 제공하며 옥수수 및 기타 풀 종의 잎 해부학적 및 발달 특성을 시각화하고 정량화하는 데 유용할 것입니다.
서문
잔디 작물은 전 세계 인구를 위한 식량 및 바이오 연료의 주요 공급원이며1, 잎 해부학적 구조를 개선하면 생산성을 높일 수 있는 잠재력이 있습니다 2,3. 그러나 풀에서 잎의 해부학이 어떻게 조절되는지에 대한 우리의 현재 이해는 제한적이며4 잎의 많은 해부학적 및 생리학적 특성이 발달 초기에 미리 결정되기 때문에 잎 원시의 분석이 필요합니다 5,6,7. 형광 및 컨포칼 이미징과 같은 세포 이미징 기술은 잔디 잎 해부학 및 세포 특성을 연구하는 데 없어서는 안될 필수 요소이지만, 이러한 기술은 잎 소용돌이 안에 깊숙이 박혀 굴러가기 때문에 잔디 잎 원시에는 적용하기 어렵습니다. 우리는 잔디 잎 해부학 및 발달 연구를 위한 모델 시스템인 옥수수 잎 원시의 형광 및 공초점 분석을 위한 횡단면 및 펼쳐진 전체 잎 마운트를 준비하는 방법을 개발하여 이 문제를 해결했습니다 2,8.
옥수수 잎은 모든 풀 잎과 마찬가지로 줄기를 감싸고 싹 9,10,11,12,13을 발달시키는 칼집이있는 끈 모양의 칼날로 구성됩니다. 잎은 싹 정단 분열조직(SAM)에서 먼 패턴으로 발달하며, 각각의 새 잎은 이전 잎의 반대 위치에서 시작하여 수직축을 따라 두 개의 잎 등급이 됩니다(그림 1A)14. 각 잎 원시의 발달 단계는 SAM에 대한 위치로 식별되며, 가장 가까운 원시는 플라스토크론1(P1)로 지정되고 다음 원시는 P2, P3 등으로 지정됩니다(그림 1B,C)2. 발달하는 동안(그림 1D), 잎 원시는 먼저 SAM(P1)의 기저부 주위에 초승달 모양의 부벽으로 나타난 다음 분열조직(P2)9,10,11 위로 뻗어 있는 후드 모양의 원시로 자랍니다. 그런 다음 후드의 기저 가장자리는 측면으로 확장되고 팁이 위쪽으로 자라면서 서로 겹쳐져 원뿔 모양의 원시(P3-P5)10를 형성합니다. 그런 다음 원시는 길이가 빠르게 증가하고 밑 부분의 칼집 가장자리는 잎의 인접 측면에 프린지 모양의 돌출부 인 결절이 형성됨에 따라 더욱 두드러집니다 (P6 / P7). 마지막으로, 잎은 정상 상태 성장 중에 소용돌이에서 나오면서 펼쳐지며, 분열하는 세포는 잎의 작은 기저 영역 내에서 제한되어 근위-원위 축(P7/P8)15을 따라 확장 및 분화 세포와 함께 구배를 형성합니다. 옥수수 묘목의 싹 정점에는 여러 발달 단계에서 여러 개의 원시가 포함되어 있어 잎 발달을 연구하는 데 훌륭한 모델입니다8.
초기 잎 발달에 대한 정확한 분석은 다른 성장 또는 형태학적 매개변수와 관련하여 원시 발달의 뚜렷한 단계를 정의하기 위한 표준화된 기준의 병기 결정 또는 사용이 필요합니다. 잎 원시는 풀싹 안에 숨겨져 있기 때문에 연구자들은 일반적으로 식물의 나이 또는 출현하는 잎의 크기와 같은 매개 변수를 잎 원시의 단계와 크기에 대한 예측 변수로 사용합니다 9,16. 옥수수에서 식물의 연대순 연령은 심기 또는 발아 후 일수(DAP/DAG)에 의해 결정됩니다.17,18. 식물 단계 (V 단계)는 눈에 보이는 고리가있는 최상층 잎, 결절과 귓바퀴의 위치에 해당하는 칼날과 칼집 사이의 축면에 옅은 선, 잎 바닥에 한 쌍의 쐐기 모양 영역에 의해 결정됩니다 (그림 1A, B) 17,19 . 20에서 25 DAG 사이에서 SAM은 꽃차례 분열 조직으로 전환되고 새로운 잎20 생산을 중단합니다. 옥수수 잎 원시의 성장률은 환경과 식물의 유전자형에 따라 달라질 수 있습니다. 이러한 이유로 식물의 나이와 신생 잎의 크기는 잎 원시의 크기를 정확하게 예측할 수 없습니다. 그러나 이러한 매개변수를 사용하면 실험 목적으로 원시 단계 및 크기의 범위를 예측하는 데 도움이 될 수 있습니다.
횡단면 분석은 싹21,22,23에 걸쳐 단일 섹션에서 여러 플라스토크로를 샘플링할 수 있기 때문에 옥수수 및 기타 풀의 잎 해부학 및 발달을 검사하는 데 널리 사용되는 방법입니다. 이 방법은 또한 신선한 샘플의 세포 이미징에 편리한데, 이는 주변 잎이 절편 및 장착 중에 잎 원시를 제자리에 유지하는 스캐폴드 역할을 하기 때문이다24. 그러나 이 방법의 단점은 온전한 싹에서 절편할 때 원시벽 내에서 표적 플라스토크로와 영역을 정확하게 찾는 것이 어려울 수 있다는 것입니다. 또한, 잎의 성장은 플라스토크론과 근위-원위 축 2,5를 따라 다양하기 때문에 부정확한 샘플링은 주어진 섹션에서 원시의 발달 단계와 영역에 대한 잘못된 해석을 초래할 수 있습니다. 따라서 정확한 횡단면 샘플링 방법을 개발하는 것은 잔디 잎 원시의 해부학적 및 발달적 분석의 정확성과 재현성을 보장하는 데 중요합니다.
전엽 마운트 분석은 증식성 성장25 및 정맥 패턴화26,27,28와 같이 전체 장기 규모에서 발생하는 조직 및 세포 과정에 대한 포괄적이고 통합적인 조사를 가능하게 합니다. 이 방법은 잎의 paradermal 개요를 제공하여 횡단면 분석24,27을 사용하여 감지하기 어려운 뚜렷한 과정과 패턴을 발견할 수 있도록 합니다. 전체 잎 마운트를 이미징하는 방법이 이미 확립된 애기장대와 달리29,30, 현재 풀밭에서 펼쳐지지 않은 전체 리프 마운트를 이미징하는 표준 방법은 없습니다. 분리된 옥수수 잎 원시를 풀기 위한 이전 프로토콜은 흔하지 않은 물질을 포함했으며 세포 이미징에 적합하지 않았습니다31. 컴퓨터 단층 촬영 (CT) 및 자기 공명 영상 (MRI)과 같은 고급 이미징 기술은 원시 11,32,33을 분리 및 펼치지 않고 3D 해부학 적 정보를 획득 할 수 있지만 비용이 많이 들고 특수 장비가 필요합니다. 옥수수와 다른 풀에서 잎 원시의 압연 및 원뿔 형태에 의해 부과된 제약을 극복하기 위한 기술을 개발하면 해부학적 및 발달적 특성에 대한 조사가 진행될 것입니다.
여기에서 우리는 형광 및 공초점 이미징을 위해 옥수수 잎 원시의 횡단면과 펼쳐진 전체 마운트를 준비하는 방법을 제시합니다. 우리는 이러한 방법을 사용하여 정맥 수를 정량화하고 형광 단백질(FP)을 사용하여 옥수수 잎 원시의 시공간 호르몬 분포를 매핑했습니다.24. 첫 번째 방법은 와이어 스트리퍼를 사용하여 옥수수 묘목에서 오래된 잎의 윗부분을 제거하는 것입니다(그림 1E). 원시(P5-P7)의 끝 부분을 노출시킴으로써 주변의 오래된 잎을 완전히 제거하지 않고도 길이를 결정할 수 있어 쉽고 정확한 절편이 가능합니다. 두 번째 방법은 투명한 양면 나노 테이프로 전체 잎 원시(P3-P7)를 펼치고 장착하는 것입니다(그림 1F). 이러한 방법들은 다양한 FP들(24)을 시각화하는데 적합하지만, 형광 염료 및 투명화 시약을 사용하기 위한 최적화가 필요하다. 또한 ImageJ/FIJI34에서 z-스택을 병합하고, 이미지를 결합하고, 채널을 병합하는 몇 가지 절차를 간략하게 설명하며, 이는 두 가지 방법으로 생성된 이미지에 적용됩니다. 이러한 방법은 옥수수 잎의 일상적인 형광 또는 컨포칼 이미징에 유용하지만 벼, Setaria 및 Brachypodium과 같은 다른 모델 잔디 종에도 적용할 수 있습니다.
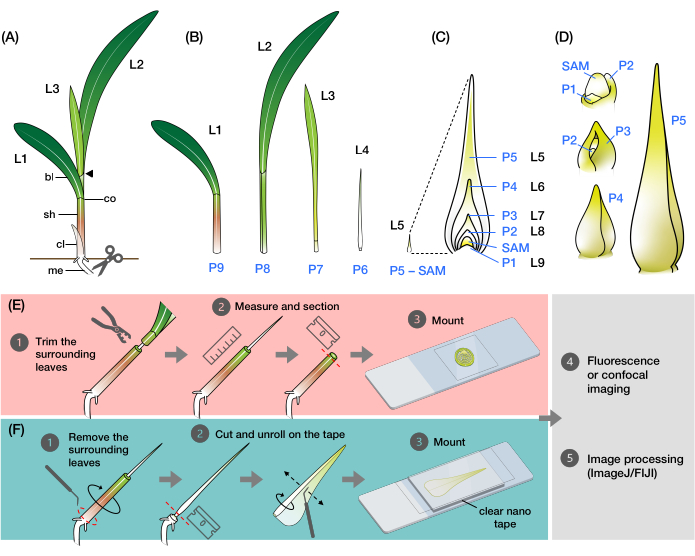
그림 1 : 옥수수 잎 원시의 조직과 형태 및 방법의 개요. (A) 옥수수 묘목의 개략도. 옥수수는 새 잎이 이전 잎의 반대 위치에서 시작되는 distichous phyllotaxy를 가지고 있습니다. 잎 번호는 잎이 발아에서 나온 연대순을 나타냅니다(즉, 첫 번째 잎, L1, 두 번째 잎, L2, 세 번째 잎, L3 등). 각 잎에는 원위 칼날과 결절과 귓바퀴에 해당하는 고리로 묘사 된 기저부가 있습니다. 칼라가 보이는 맨 위 잎은 식물 단계를 나타냅니다. 이 예제의 묘목은 V2 단계에 있으며 L2 칼라(화살촉)가 표시됩니다. 가위 아이콘은 묘목을 수집하기 위해 잘라야하는 중배엽 (me)의 위치를 나타냅니다. (B) (C)에서 확대된 이미지로 표시된 잎 원시(Leaf) L5 내지 L9와 함께 분리된 L1 내지 L4를 보여주는 해부된 새싹의 개략도. 플라스토크로 번호는 SAM에 대한 원시의 위치를 나타내며, 가장 어린 잎 원시(P1)가 SAM에 가장 가깝고 오래된 잎 원시(P2, P3, P4 등)가 연속적으로 더 멀리 떨어져 있습니다2. (D) P1에서 P5까지 옥수수 잎 원시의 형태를 도식적으로 표현합니다. (E) 옥수수 잎 원시의 횡단면 분석 방법의 개략도. (1) 와이어 스트리퍼로 오래된 잎을 다듬습니다. (2) 원시를 측정하고 싹을 분할합니다. (3) 이미징 및 처리를 위해 슬라이드에 섹션을 장착합니다(4, 5). (F) 옥수수 잎 원시의 전체 마운트 분석 방법의 개략도. (1) 주변의 잎을 떼어내어 원초를 추출합니다. (2) 나노 테이프에서 원초를 평평하게 자르고 펼칩니다. (3) 이미징 및 처리를 위해 샘플을 장착합니다(4, 5). 약어: L = 잎; BL = 블레이드; sh = 칼집; CO = 칼라; me = 중배엽; V = 식물성; P = 플라스토크로닉; SAM = 싹 정단 분열 조직. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. 옥수수 잎 개발 준비 및 실험 설계
- 식물 재배 및 잎 발달 준비
- 실험에 사용할 식물의 나이와 발달 단계를 결정하고 잎 발달의 상세한 단계를 수행합니다.
참고: 실험에 사용될 돌연변이 또는 형질전환 계통과 동일한 유전적 배경을 가진 식물에서 병기를 수행하는 것이 좋습니다. SAM은 유전적 배경과 성장 조건에 따라 20에서 25 DAG 사이의 새 잎 생산을 중단합니다. 이러한 이유로 여기에 설명 된 방법은 7-14 DAG의 옥수수 묘목에 이상적입니다. - 적절한 식물 관리 프로토콜35에 따라 온실 또는 성장 챔버에서 옥수수 식물을 재배하십시오.
- 토양 표면 아래의 줄기인 중배엽을 절단하여 작은 칼이나 가위로 원하는 나이 또는 V 단계의 식물을 수집합니다(그림 1A). 묘목 옆의 흙에 절단 도구를 조심스럽게 삽입하고 45° 각도로 바닥까지 밀어 중배엽을 자릅니다.
- 묘목을 토양에서 들어 올리고 식물에 달라붙을 수 있는 남아 있는 먼지나 토양 입자를 먼지로 제거합니다. 어린 묘목에서 떠오르는 새싹을 덮고 있는 보호용 덮개인 딱정벌레목을 손으로 제거합니다.
- 각 식물에 대해 V 단계, 잎의 수 및 소용돌이에서 나오는 마지막 잎의 길이를 기록합니다. 나중에 참조할 수 있도록 식물 사진을 찍습니다.
- 오래된 잎을 하나씩 제거하십시오. 이렇게하려면 중배엽 또는 줄기의 잔해로 식물을 잡고 칼집 바닥에서 각 잎을 절제하고 치과 용 탐침으로 원을 그리며 칼집을 부드럽게 펼칩니다 (그림 1B).
알림: 주변 나뭇잎을 제거하는 빠른 방법은 2.1단계를 참조하십시오. - 약 2배 배율의 실체 현미경으로 젖은 물티슈로 촬영 정점의 나머지 부분을 조심스럽게 해부하여 샘플이 마르지 않도록 합니다. SAM, P1 및 P2가 보일 때까지 구부러진 바늘 또는 한 쌍의 미세 집게가 있는 치과 프로브로 각 잎 원시를 부드럽게 절제하고 펼칩니다(그림 1D). 각 플라스토크로닉의 모양과 치수를 기록합니다.
참고: 보충 파일 1에서 옥수수 묘목의 잎 발달 단계의 예를 참조하십시오.
- 실험에 사용할 식물의 나이와 발달 단계를 결정하고 잎 발달의 상세한 단계를 수행합니다.
- 실험 계획
참고: 실험을 신중하게 계획하면 효율성을 높일 수 있습니다. 예를 들어, 횡단면 분석에서 특정 플라스토크로나 영역을 이미징할 때 절단할 대략적인 위치를 결정하면 해부 시간을 줄일 수 있습니다. 그림 2 는 표준화된 샘플링의 예를 보여줍니다. 또한 FP 또는 형광 프로브의 특성을 기반으로 이미징 파라미터를 최적화하면 실험의 효율성을 향상시킬 수 있습니다.- 병기 결정 정보를 가이드로 활용하여 특정 플라스토크로크론, 원시 영역 및 조직에 대한 실험에 초점을 맞춥니다. FP 또는 기타 관심 있는 형광 프로브를 사용하여 몇 가지 샘플에 대해 아래 섹션 2 및/또는 3을 따르십시오.
참고: https://www.maizegdb.org/data_center/stock 에서 사용 가능한 옥수수 FP 마커 line36-42 종자 재고를 참조하십시오. - 적절한 검출기 또는 필터, 여기 및 방출 파장, 핀홀 크기 및 기타 설정을 포함하여 각 FP 리포터 또는 프로브에 대한 최적의 이미지 획득 파라미터를 결정합니다. 설정을 저장하여 각 실험의 작업 조건을 재현합니다.
참고: Linh 및 Scarpella30 에서 발달 중인 잎의 컨포칼 레이저 스캐닝 현미경에 대한 몇 가지 기술 지침을 참조하십시오. - FP 리포터(43)의 반감기 및 다른 특성에 기초하여 이미징 시간을 계획한다.
참고: 실험을 계획할 때 해부와 이미징 사이의 시간도 고려해야 하는데, 이 기간 동안 신선한 식물 샘플이 건조 및 세포 변화를 겪기 때문입니다.
- 병기 결정 정보를 가이드로 활용하여 특정 플라스토크로크론, 원시 영역 및 조직에 대한 실험에 초점을 맞춥니다. FP 또는 기타 관심 있는 형광 프로브를 사용하여 몇 가지 샘플에 대해 아래 섹션 2 및/또는 3을 따르십시오.
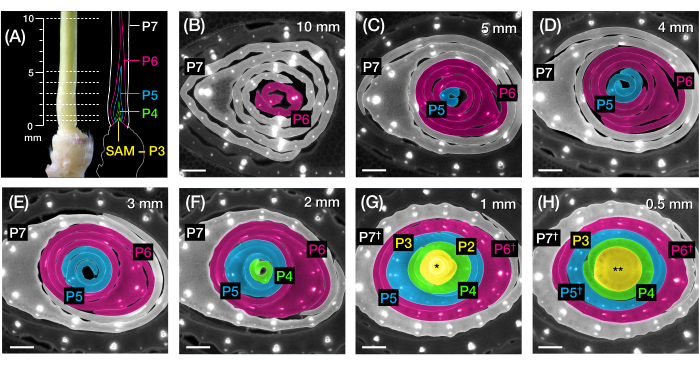
그림 2: 옥수수 잎 원시의 횡단면 분석을 위한 샘플링 계획. (A, 왼쪽) P7에서 노출된 네 번째 잎(L4)을 보여주는 7 DAG 옥수수 묘목의 근위 싹. 점선은 원시를 따라 0.5mm에서 10mm까지 7개의 샘플링 지점을 나타냅니다. (A, 오른쪽) 각 플라스토크로닉의 예상 크기와 위치가 있는 잎 원시의 개략도: P7(흰색); P6(마젠타); P5(파란색); P4(녹색); 및 P3 SAM(노란색)이 될 때까지. (BH) 10mm(B)에서 0.5mm(H)까지 A에 표시된 샘플링 포인트를 나타내는 횡단면의 형광 이미지. primordia는 (A)의 plastochron 색 구성표에 따라 유사 착색됩니다. 섹션은 자가형광을 위해 롱패스 방출 UV 필터를 사용하여 에피형광 현미경으로 이미지화되었습니다. 스케일 바 = 200 μm (B-H). 이 그림은 Robil과 McSteen24의 허가를 받아 수정 및 복제되었습니다. 약어: DAG = 발아 후 일수; P = 플라스토크로닉; SAM = shoot apical meristem; † = 잎집 또는 사전 ligule 적절한; * = 싹 정단 분열 조직; ** = 줄기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 옥수수 잎 primordia의 단면 이미징
- 주변의 오래된 잎을 벗겨내고 잎 원시를 측정합니다.
- 1.1.3-1.1.4 단계 (그림 1A)에 설명 된대로 작은 칼이나 가위로 토양 표면 아래의 중배엽에서 조심스럽게 잘라내어 묘목을 수집합니다.
- 사용할 올바른 와이어 스트리퍼 구멍 크기와 촬영을 따라 절단할 위치를 결정합니다. 구멍이 대상 원초에 맞을 만큼 충분히 큰지 확인하십시오.
- 싹의 더 말단 부분에서 절단을 시작하고 원시의 끝이 노출될 때까지 바닥을 향해 점차적으로 작업합니다.
- 절단하려면 턱이 싹을 향하도록 와이어 스트리퍼를 잡으십시오. 선택한 구멍에 싹을 놓고 스트리퍼 핸들을 함께 짜서 잎 소용돌이를 자릅니다.
알림: 실수로 대상 원초를 절단하는 것을 방지하려면 싹의 중심을 와이어 스트리퍼의 구멍에 조심스럽게 맞춥니다. 더 큰 식물의 경우 스트리퍼를 사용하기 전에 주변 잎의 일부를 손으로 수동으로 제거하는 것이 좋습니다.
주의 : 와이어 스트리퍼에는 날카로운 턱이 있어 조심스럽게 사용하지 않으면 베거나 기타 부상을 입을 수 있습니다. - 손잡이를 계속 쥐어 짜면서 스트리퍼를 싹에서 밀어 잎의 윗부분을 다듬습니다. 원시의 대상 영역이 주변 잎에 둘러싸여 있는지 확인합니다(보충 그림 S1C,D).
알림: 위쪽 잎을 다듬은 후 싹에 노출된 원시 팁(절단 위치와 사용된 와이어 스트리퍼 구멍의 크기에 따라 P5, P6 또는 P7)이 남습니다. 그림 1E). 이 원시는 어린 원시의 크기와 단계를 추정하기 위한 참고 자료가 될 것입니다. P6은 크기 범위와 핀 모양의 형태로 인해 옥수수 묘목에 사용하기에 가장 실용적인 참고 자료입니다. - 자를 사용하여 원시의 끝에서 싹의 바닥까지의 길이를 측정하십시오. 측정값을 기록합니다.
참고: 원시의 기저부에 몇 밀리미터의 줄기가 있기 때문에 원시의 길이는 약간 과대 평가됩니다(그림 2A).
- 잎 primordium의 자유형 절편 및 이미징
- 약 0.8x 배율의 실체 현미경에서 유리 도마나 기타 긁힘 방지 재료와 같은 매끄러운 표면에 촬영을 안정적으로 유지합니다. 면도날이나 메스를 사용하여 원시의 길이를 따라 원하는 지점에서 싹의 얇은 부분 (0.25-0.8 mm)을 자릅니다.
- 대상 영역보다 약간 높은 초기 절단을 만들어 촬영의 원위 부분을 버린 다음 대상 영역 주위에 얇은 부분을 얻습니다. 깔끔하게 자르려면 칼날을 싹에 수직으로 잡고 부드럽고 균일한 동작으로 안쪽으로 밉니다.
알림: 더 큰 원시(P6 또는 P7)를 위해 몇 밀리미터의 절편 여유가 있을 수 있습니다. 그러나 더 작은 원시(P5 이하)의 경우 이러한 원시가 싹 바닥의 처음 몇 밀리미터 이내에 쌓이기 때문에 1mm가 샘플링에 상당한 차이를 만들 수 있습니다( 그림 2A, FH 참조). 더 미세한 절단을 위해 양날 면도날을 사용하는 것이 좋습니다.
주의 : 면도날과 메스를 사용할 때 우발적인 베임이나 부상을 방지하기 위해 주의하십시오. - 면도날은 잎집이 면도날을 쉽게 무디게 할 수 있으므로 정기적으로 교체하십시오. 샘플이 마르지 않도록 각 절단 라운드 후에 젖은 물티슈로 촬영을 덮으십시오.
- 깨끗한 유리 슬라이드(75mm x 25mm)에 리프 섹션을 장착하고 피펫을 사용하여 섹션(또는 50% 글리세롤)을 섹션에 직접 적용한 다음 커버슬립(22mm x 22mm)을 맨 위에 놓습니다.
- 형광 염료를 사용하는 경우 염료 용액을 섹션에 바르고 그 위에 커버슬립을 놓고 필요에 따라 배양합니다.
알림: 염료 유형에 따라 다음 단계로 진행하기 전에 잎 부분을 처리하기 위한 추가 단계가 필요할 수 있습니다. 이들 참고문헌44,45,46,47은 식물 세포 이미징에서 형광 염료의 일반적인 세부사항 및 용도를 제공한다. 핵 염색 형광 염료인 5-ethynyl-2′-deoxyuridine(EdU)은 옥수수 잎 원시의 횡단면에 효과적으로 사용되었습니다48. 대조적으로, Fei Mao 4-64 (FM 4-64) 및 요오드화 프로피듐과 같은 원형질막 염색 염료는 만족스러운 결과를 생성하지 않습니다 (그림 3A-D). - 슬라이드를 에피형광 또는 공초점 레이저 스캐닝 현미경의 스테이지에 놓고 필요에 따라 초점과 설정을 조정하여 형광단30을 시각화합니다. 선택한 옥수수 FP 리포터 라인에 사용되는 조명 및 이미지 획득 설정은 표 1 을 참조하십시오.
알림: 두꺼운 섹션은 높은 수준의 배경 자가형광을 생성할 수 있습니다. 이 문제를 완화하는 데 도움이 될 수 있는 몇 가지 이미징 및 표본 준비 전략을 고려하십시오(30,49)(표 2 참조).
주의 : 눈 손상의 위험을 줄이기 위해 강력한 광원 및 레이저로 작업할 때 주의를 기울이고 보호 안경을 착용하십시오. - 다양한 배율 및 감지 채널(명시야 조명 포함)에서 리프 섹션을 통한 이미지(30). 4x 배율을 사용하여 전체 횡단면을 이미지화하고 20x 또는 40x 배율을 사용하여 특정 조직을 이미지화합니다. 에피플루오레센스 이미징을 위해 더 높은 배율에서 노출 시간을 줄여 빠른 광표백으로부터 샘플을 보호합니다( 표 1 참조).
- 전체 섹션 또는 특정 관심 영역(ROI)의 이미지를 캡처합니다. 필요하다면, 상이한 초점 심도들(30)에서 캡처된 일련의 이미지들인 z-스택(z-stack)을 획득한다.
- z-스택을 획득하려면 먼저 시편의 상부 및 하부 위치를 결정한 다음 이 위치 사이에서 캡처해야 하는 광학 섹션의 수를 결정합니다. 광학 단면이 적을수록 각 단면 사이의 거리인 z-스텝 크기가 커집니다. FP의 특성과 사용된 배율에 따라 1에서 12 μm 사이의 z-스텝 크기로 3-25개의 광학 섹션을 캡처하여 옥수수 잎 원시의 횡단면을 이미징합니다.
참고: z-스택을 평평하게 하려면 현미경 소프트웨어를 통해 또는 ImageJ/FIJI34(단계 4.1 및 4.2 참조)를 사용하여 수행할 수 있는 적절한 볼륨 렌더링 기술(50)을 사용합니다. - 사용 가능한 경우 모든 이미지 파일 및 관련 메타데이터를 저장합니다.
표 1: 선택된 옥수수 FP 리포터의 형광 및 컨포칼 이미징에 사용되는 조명 및 이미지 획득 설정. 약어: FP = 형광 단백질; TRITC = 테트라메틸로다민; FITC = 플루오레세인 이소티오시아네이트; WLL = 백색광 레이저; Ar-이온 = 아르곤 이온 레이저; HyD = 하이브리드 검출기; AU = 바람이 잘 통하는 단위; Hz = 헤르츠, 초당 스캔 라인. 이 표를 다운로드하려면 여기를 클릭하십시오.
3. 이미징 옥수수 잎 primordia의 전체 마운트를 펼치다
- 원시를 해부하고 나노 테이프로 유리 슬라이드를 준비하는 단계
- 1.1.3-1.1.4 단계 (그림 1A)에 설명 된대로 작은 칼이나 가위로 토양 표면 아래의 중배엽에서 조심스럽게 잘라서 묘목을 수집합니다.
- 식물을 해부하기 전에 투명한 양면 나노 테이프(보충 그림 S75H)로 유리 슬라이드(25mm x 1mm)를 준비합니다. 직사각형 나노 테이프를 잘라 깨끗한 유리 슬라이드 중앙에 붙입니다. 테이프 윗면에 있는 보호 플라스틱 필름을 제거하지 마십시오.
알림: s의 크기에 따라 사용할 테이프의 크기를 결정하십시오.amp이미지화할 파일(예: 크기가 큰 s의 파일amp보충 그림 S1I,J의 les). 나노 테이프는 아크릴 또는 폴리 우레탄 젤 재질로 제공됩니다. 두 가지 유형 모두 형광 및 컨포칼 이미징에 효과적이다24. 테이프의 변색을 방지하려면 어두운 용기에 보관하여 장시간 빛에 노출되지 않도록 보호하십시오. - 2.1 단계에서 설명한대로 와이어 스트리퍼로 오래된 잎의 윗부분을 제거하여 싹을 해부하기 시작합니다.
- 중코잎으로 싹을 잡고 치과 용 탐침으로 주변 잎을 조심스럽게 제거하여 원시를 추출하십시오. 이렇게하려면 싹의 바닥에서 나뭇잎을 제거하고 관심있는 원시가 노출 될 때까지 한 번에 하나씩 펼치십시오.
- 또는 와이어 스트리퍼를 사용하여 싹의 기저부를 절단하여 잎 원시를 직접 추출합니다(보충 그림 S1E-G).
알림: 이 방법은 원시를 스냅할 위험이 더 높습니다.
- 원초를 장착하고 이미징합니다.
- 테이프에서 보호 필름을 제거합니다. 노출 된 원시를 테이프에 놓습니다. 면도날을 사용하여 밑 부분의 원시를 자르고 기저 줄기와 배축을 버립니다 (그림 1F).
- 구부러진 바늘 (팁 직경 0.25-0.6 mm)이있는 치과 용 프로브를 사용하여 primordium을 펼칩니다. 3mm(P3에서 초기 P4)보다 작은 원시의 경우 마이크로프로브(팁 직경 0.15-0.2mm)를 사용하십시오.
- 바늘 끝을 표면과 평행하게 놓고 바깥쪽 기저부를 펼치고 테이프에 부드럽게 누릅니다.
- 더 부드럽게 풀리려면 바늘 끝을 100% 글리세롤에 담가 잎의 내부 표면(adaxial)에 윤활유를 바릅니다.
- 바깥 쪽 여백이 테이프에 붙어 바늘 끝을 잎의 장축과 평행하게 맞 춥니 다. 바늘을 옆으로 부드럽게 밀어 잎사귀를 펼치고 테이프에 평평하게 만듭니다(그림 1F).
알림: 펼치는 동안 잎이 부러지거나 손상되는 것은 일반적이며, 특히 견고한 중추뼈가 있는 더 큰 원시에서 일반적입니다(그림 3E-G 참조). 잎을 세게 펼치면 이미징 중에 표면이 멍이 들고 인공물이 생성될 수 있습니다(그림 3H). 표 2 및 이러한 문제에 대한 권장 해결 방법에 대한 논의를 참조하십시오. - 펼쳐진 원초에 물 한 방울을 바르십시오. 즉시 물방울과 원초 위에 커버 슬립을 놓습니다. 커버슬립의 가장자리를 테이프에 붙도록 부드럽게 누릅니다.
알림: 테이프에 부착할 추가 영역이 있는 큰 직사각형 커버슬립(50mm x 24mm 또는 60mm x 24mm)을 사용하는 것이 좋습니다. 잎을 왜곡하고 고르지 않은 빛의 굴절을 유발할 수 있는 기포의 형성을 최소화합니다(그림 3I-K 참조). 장착된 프라이모디움의 여백이 느슨하게 접착된 커버슬립 아래로 롤백될 수 있으므로 커버슬립이 테이프에 완전히 부착되었는지 확인하십시오(그림 3L 참조). - 슬라이드를 에피형광( 보충 그림 S1K 참조) 또는 공초점 레이저 주사 현미경의 스테이지에 놓고 필요에 따라 초점과 설정을 조정하여 형광단(30)을 시각화합니다. 선택한 옥수수 FP 리포터 라인에 사용되는 조명 및 이미지 획득 설정은 표 1 을 참조하십시오.
- 다양한 검출 채널(30)을 통해 전체 리프 또는 특정 ROI를 이미지화한다. 전체 나뭇잎을 이미지화하려면 나뭇잎의 모자이크 이미지를 수동으로 캡처하거나 현미경의 바둑판식 배열 작업을 저배율(4x 또는 10x)로 사용합니다.
참고: 가장 낮은 배율에서도 옥수수 잎 원시는 너무 커서 에피형광 또는 컨포칼 레이저 스캐닝 현미경으로 이미지화할 수 없으므로 이미징 시간이 길어져 광표백( 그림 3M 참조) 또는 배경 자가형광이 증가할 수 있습니다. 따라서 5mm보다 큰 전체 잎 샘플을 이미징하기 위해 형광 실체 현미경을 사용하는 것이 좋습니다. - 컨포칼 이미징의 경우 잎의 두께를 포함하는 z-스택을 얻어야 합니다(2.2.9단계 참조).
- 사용 가능한 경우 모든 이미지 파일 및 관련 메타데이터를 저장합니다.
표 2: 옥수수 잎 원시의 횡단면 및 전체 마운트를 이미징할 때 발생하는 일반적인 문제 해결. 이 표를 다운로드하려면 여기를 클릭하십시오.
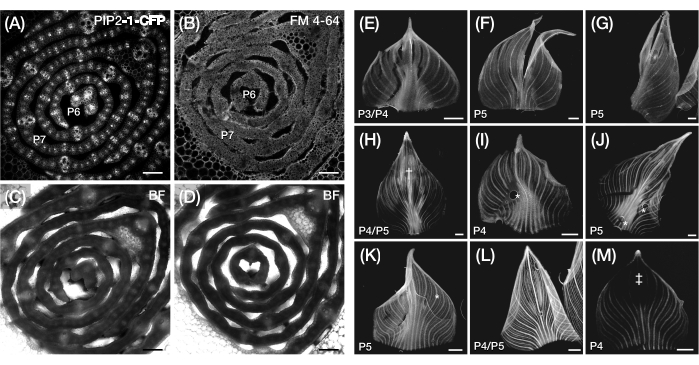
그림 3 : 옥수수 잎 primordia의 최적이 아닌 횡단면 및 전체 마운트 준비. (A-D) 원형질막 마커 PIP2-1-CFP(A) 및 원형질막 결합 형광 염료 FM 4-64(B)가 있는 잎 원시의 횡단면의 대표적인 공초점 이미지와 해당 명시야 이미지(C,D). PIP2-1-CFP와 비교할 때 FM 4-64는 세포 윤곽선의 최적이 아닌 시각화를 표시합니다. (엠) 찢어짐(E-G), 멍이 든 표면†(H), 기포*(I-K), 롤백된 여백(L) 및 광표백 영역‡(M)의 존재를 보여주는 잎 원시의 전체 마운트의 대표적인 형광 이미지입니다. 잎 원시는 DII-Venus(E-G), GAR2-YFP(H-J), mDII-Venus(K), PIN1a-YFP(L) 및 DR5-RFP(M)를 나타냅니다. 스케일 바 = 200 μm (A-D); 500 μm (E-M). 그림 3A는 Robil 및 McSteen24의 허가를 받아 수정 및 복제되었으며 그림 5B-M은 저자의 미공개 데이터입니다. 약어: P = 플라스토크로닉; YFP = 황색 형광 단백질; RFP = 적색 형광 단백질; CFP = 청록색 형광 단백질; PIP2-1-CFP = p Zm PIP2-1::ZmPIP2-1:CFP; DII-금성 = pZm유비:DII:YFP-NLS; GAR2-YFP = p Zm GAR2::ZmGAR2:YFP; mDII-금성 = pZmUbi:mDII:YFP-NLS; PIN1a-YFP = p Zm PIN1a::ZmPIN1a:YFP; DR5-RFP = DR5rev::mRFPer; BF = 명시야. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. ImageJ/FIJI를 사용하여 이미지 처리
- 최대 강도 투영(MIP)을 사용하여 z-스택 평면화
- ImageJ/FIJI를 실행하고 이미지 스택을 열거나 이미지 | 스택 | 메뉴에서 스택할 이미지.
- 이미지 스택을 선택합니다. 메뉴에서 Image | 스택 | Z-프로젝트.... Z-Project(Z-프로젝트) 대화 상자의 Projection type(투영 유형) 드롭다운 메뉴에서 Max Intensity(최대 강도)를 선택합니다. 확인(OK)을 클릭하여 최대 강도 z-투영을 생성합니다.
참고: 평면화된 이미지는 z-스택(50)에 걸쳐 가장 높은 강도를 갖는 픽셀의 2D 투영이다. 이 방법은 형광단을 시각화하는 데 적합하지만 두꺼운 횡단면과 전체 잎 마운트의 명시야 이미지에서 해부학적 특징은 그렇지 않습니다. - 파일 | 다른 이름으로 저장 | 티프. 파일 이름을 입력하고 저장을 클릭합니다.
참고: 형광 및 컨포칼 이미지를 저장할 때는 TIFF를 사용하는 것이 좋습니다., 이미지를 저장할 때 품질과 디테일을 유지하므로.
- EDF(Extended Depth of Field) 플러그인51을 사용하여 z-스택 평면화
- EDF 플러그인52를 설치합니다. http://bigwww.epfl.ch/demo/edf/ 에서 Extended_Depth_Field.jar 파일(버전 17.05.2021)을 다운로드하여 ImageJ/FIJI의 "plugins" 폴더에 넣습니다.
- ImageJ/FIJI를 실행하고 이미지 스택을 열거나 이미지 | 스택 | 메뉴에서 스택할 이미지.
- 이미지 스택을 선택합니다. 메뉴에서 Plugins | 확장된 피사계 심도 | EDF 이지 모드. 확장된 피사계 심도(Extended Depth of Field ) 대화상자에서 속도/품질(Speed/Quality) 아래의 슬라이더를 사용하여 원하는 품질과 처리 속도를 설정하고 하이트-맵 reg 를 사용하여 지형의 평활도 수준을 설정합니다. 실행을 클릭하여 재구성된 이미지를 만듭니다.
참고: EDF는 최상의 초점(51)을 투사하여 스택을 선명하고 합성된 2D 이미지로 결합합니다. 이 기술은 제한된 초점 심도를 극복하는 데 유용하며 두꺼운 가로 단면 또는 전체 리프 마운트의 명시야 이미지를 재구성하는 데 적합합니다. MIP와 달리 EDF는 이미지의 대비를 조정하여 픽셀 강도에 영향을 미치기 때문에 이 필터를 적용하여 형광단을 시각화할 때는 주의해야 합니다. - 파일 | 다른 이름으로 저장 | 티프. 파일 이름을 입력하고 저장을 클릭합니다.
- 그리드/컬렉션 스티칭 플러그인을 사용하여 이미지 연결53
- 함께 연결할 이미지 또는 이미지 스택 모음을 단일 디렉터리에 저장합니다.
- ImageJ/FIJI를 실행하고 플러그인 | 바느질 | 그리드/컬렉션 스티칭 메뉴에서. 그리드/컬렉션 스티칭 대화 상자의 유형 드롭다운 메뉴에서 알 수 없는 위치를 선택한 다음 주문에서 디렉터리의 모든 파일을 선택합니다. 확인을 클릭합니다.
- 그리드 결합: 알 수 없는 위치, 디렉터리의 모든 파일 대화 상자에서 디렉터리 텍스트 필드에 디렉터리 경로를 입력하거나 붙여 넣거나 찾아보기...를 클릭하여 디렉터리를 찾아 이미지의 위치를 지정합니다. 딸깍 하는 소리 OK 스티칭 프로세스를 시작합니다.
참고: Grid/Collection Stitching 플러그인의 Unknown Position 옵션은 겹치는 영역을 분석하여 연속된 이미지 세트에서 합성 이미지를 재구성합니다. 따라서 이 옵션은 타일 스캐닝 작업을 사용하여 얻지 못한 횡단면 또는 전체 리프 마운트 이미지의 모자이크를 스티칭하는 데 유용합니다. - 스티칭이 완료되면 스티칭된 이미지가 있는 새 창이 나타납니다. 파일 | 다른 이름으로 저장 | 티프. 파일 이름을 입력하고 저장을 클릭합니다.
참고: 2D 및 3D 이미지의 큰 몽타주를 스티칭하는 것은 현미경 소프트웨어의 이미지 재구성 명령을 사용하거나 ImageJ/FIJI의 Bio-Formats 가져오기 옵션을 통해서도 수행할 수 있습니다.
- 채널 병합 명령을 사용하여 여러 채널 결합
- ImageJ/FIJI를 실행하고 병합할 이미지 또는 이미지 스택을 엽니다.
참고: 이미지 스택은 먼저 4.1 또는 4.2 단계를 사용하여 병합할 수 있습니다. MIP는 일반적으로 형광단 채널을 평탄화하는 데 권장되는 반면, EDF는 명시야 채널 또는 다양한 초점 심도를 가진 기타 채널을 평탄화하는 데 더 적합합니다. - 이미지의 밝기와 대비를 조정하십시오 이미지 | 조정 | 밝기/대비. 슬라이더 또는 입력 필드를 사용하여 매개 변수를 조정한 다음 Apply(적용)를 클릭합니다. 또는 Process | 대비 향상.... 채도가 높은 픽셀의 백분율을 설정하고 [ 표준화]를 선택한 다음 [확인]을 클릭합니다.
참고: 이미지 간의 형광단 신호 강도를 정량화하거나 비교할 때 일반적으로 밝기나 대비를 조정하지 않는 것이 가장 좋으며, 이는 이미지의 상대적 픽셀 강도를 변경하여 측정 및 비교에 영향을 줄 수 있기 때문입니다. - 채널을 구분하려면 룩업 테이블(LUT)을 사용하여 특정 이미지에 유사 색상을 적용합니다. 이렇게 하려면 이미지를 선택한 다음 ImageJ/FIJI 메뉴에서 이미지를 선택하고 조회 테이블을 클릭한 다음 드롭다운 목록에서 적절한 LUT를 선택합니다.
- 메뉴에서 Image | 색상 | 채널을 병합합니다. 각 채널(C1, C2, C3...)에 대해 드롭다운 목록을 사용하여 해당 채널에 할당할 이미지를 선택합니다. 확인을 클릭하여 채널을 병합합니다.
- 파일 | 다른 이름으로 저장 | 티프. 파일 이름을 입력하고 저장을 클릭합니다.
- ImageJ/FIJI를 실행하고 병합할 이미지 또는 이미지 스택을 엽니다.
결과
옥수수 잎 primordia의 횡단면 분석
우리는 프로토콜 섹션 2를 사용하여 정맥 수를 정량화하고 FP가 있는 옥수수 잎 원시의 횡단면에서 호르몬 반응 패턴을 특성화했습니다(그림 4)24. 잎 성장과 정맥 형성에서 식물 호르몬 옥신의 역할을 평가하기 위해 우리는 옥신 결핍 옥수수 돌연변이의 잎 원시에서 정맥의 수를 정량화하여 술을 사라지게 했습니다.254. 초기 플라스토크론에서 발달 중인 정맥은 옥수수 잎 원시의 중앙 세포층에서 뚜렷한 세포화를 나타냅니다21,22. 그러나, 종래의 조직학적 기술(22)을 사용하여 정맥을 확인하고 계수하는 것은 노동 집약적이고 시간이 많이 소요될 수 있다. 따라서, 정맥을 정량화하기 위해, 우리는 옥수수 옥신 유출 단백질 마커 p Zm PIN1a::ZmPIN1a:YFP41(이하 PIN1a-YFP)을 활용했으며, 이는 발달 중인 정맥 및 procambial strands(PCS; 그림 4A). 프로토콜 섹션 2를 사용하여 절편 전에 원시를 측정하여 횡단면 샘플링을 표준화할 수 있었습니다(그림 4B,C). 우리는 vt2가 정상보다 더 넓은 원시와 더 많은 정맥을 갖는 경향을 발견했으며(그림 4D,E)24, 이는 완전히 확장된 잎(55)의 데이터와 일치하며, 이는 vt2의 결함이 잎 발달 초기에 시작되었음을 나타냅니다. 프로토콜 섹션 2를 사용하여 잎 원시에서 호르몬 반응 FP 리포터의 발현 패턴을 체계적으로 조사할 수 있었습니다(그림 4F-I의 이미지 예 참조). 표준화된 횡단면 샘플링 계획을 통해 우리는 다양한 플라스토크로닉과 잎 원시의 영역에 걸쳐 옥신, 사이토키닌(CK) 및 지베렐린산(GA) 반응의 분포를 매핑하고 잎 성장과 정맥 형성에 영향을 미친다는 가설을 세운 새로운 반응 패턴을 발견했습니다24. 따라서 이러한 대표적인 결과는 옥수수 잎 원시의 횡단면 분석을 위한 프로토콜 섹션 2의 유용성을 보여줍니다.
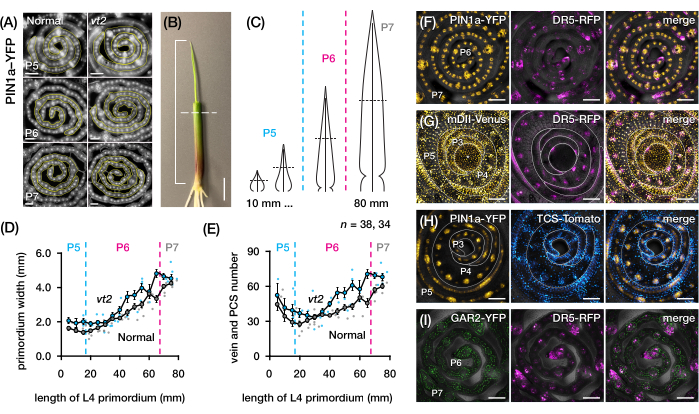
그림 4: 옥수수 잎 원시의 횡단면 분석에 대한 대표적인 결과. (AE) 옥신 유출 단백질 마커 PIN1a-YFP를 사용한 정상 및 소실 술2의 잎 원시에서 정맥 수 및 원초 너비의 정량화. (A) 발달 중인 정맥 및 procambial 가닥에서 PIN1a-YFP를 발현하는 P5 내지 P7의 횡단면의 대표적인 형광 이미지. 횡단면은 FITC 필터(495-519nm 여기)를 사용하여 에피형광 현미경으로 이미지화되었습니다. 정맥의 수와 원초 너비는 각각 FIJI/ImageJ의 다점 및 자유형 도구를 사용하여 정량화되었습니다. (B) 네 번째 잎(L4)의 끝을 노출시키기 위해 와이어 스트리퍼로 위쪽 잎 소용돌이를 제거한 옥수수 묘목. 브래킷은 투영된 원시 길이에 걸쳐 있으며 점선은 중간 길이를 나타냅니다. (C) P5에서 P7까지 다양한 원시형의 개략도로, 원시의 발달 단계에 따라 중간 길이(수평 점선)의 정맥 수와 원초 너비가 어떻게 달라질 수 있는지 보여줍니다. (D,E) 정상 및 vt2의 L4의 중간 길이 부분에서 원초 너비(D) 및 정맥 수(E)의 측정. 추세선은 측정의 10mm 이동 평균± 평균의 표준 오차(SEM)를 나타냅니다. (에프아이) PIN1a-YFP, 옥신 반응 리포터, DR5-RFP, 사이토키닌 반응 리포터, TCS-토마토, 지베렐린 산 반응 마커, GAR2-YFP 및 mDII-Venus, 옥신 신호 입력 리포터 DII-Venus의 돌연변이 버전. FP 채널은 각 이미지의 명시야 채널에 겹쳐집니다. 스케일 바 = 200 μm (A); 10mm(B); 100 μm (F-I). 이 그림은 Robil과 McSteen24의 허가를 받아 수정 및 복제되었습니다. 약어: DAG = 발아 후 일수; P = 플라스토크로닉; VT2 = 소실하는 TASSEL2; PCS = procambial strand; YFP = 황색 형광 단백질; FITC = 플루오레세인 이소티오시아네이트; RFP = 적색 형광 단백질; PIN1a-YFP = p Zm PIN1a::ZmPIN1a:YFP; DR5-RFP = DR5rev::mRFPer; TCS-토마토 = TCSv2::NLS-td토마토; GAR2-YFP = p Zm GAR2::ZmGAR2:YFP; mDII-금성 = pZmUbi:mDII:YFP-NLS. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
옥수수 잎 primordia의 전체 마운트 분석
우리는 옥수수 잎 원시의 전체 잎 마운트에서 FP 발현을 시각화하고 분석하기 위해 프로토콜 섹션 3을 따랐습니다(그림 5). PIN1a-YFP로 정맥 패턴을 시각화함으로써 우리는 정맥의 형성이 초기 플라스토크론 동안 전체 원시에서 발생하지만 이 과정은 발달 후반에 근위 영역에서 제한된다는 것을 발견했습니다(그림 5A)24. 횡단면 분석에 보완적인 전체잎 마운트 분석은 정맥 형성 중 호르몬 반응의 조직 및 단계별 패턴을 밝혀냈다24. 한 가지 예는 PIN1a-YFP 발현에 대한 CK 응답 리포터 TCSv2::NLS-tdTomato37(TCS-Tomato)의 발현 패턴입니다(그림 5B)24. 프로토콜 섹션 3에 따라 잎 원시에서 FP 발현의 정성적 및 정량적 분석을 모두 수행할 수 있었습니다(그림 5D-F, 미공개 데이터). 우리는 옥신 반응 리포터인 DR5rev::mRFPer41(DR5-RFP) 및 GA 반응성 마커인 p Zm GAR2::ZmGAR2:YFP39(GAR2-YFP)의 발현 패턴을 vt2 및 난쟁이 식물3(d3), GA 결핍 돌연변이56(그림 5D)의 단일 및 이중 돌연변이의 전체 잎 마운트에서 조사했습니다. 우리는 또한 세포 주기57에서 G1/S 전이에 대한 마커인 p Zm Cyclin-D2B::ZmCyclin-D2B:YFP 42(Cyclin-D2B-YFP)를 사용하여 정상과 vt2 잎 원시증 사이의 세포 증식의 상대적 수준을 비교했습니다(그림 5E, F). 정상과 vt2 사이에는 유의미한 차이가 없었지만, 사이클린-D2B-YFP 발현은 초기 플라스토크론31의 알려진 세포 증식 프로파일과 일치했습니다. 우리는 프로토콜 섹션 3이 롤링된 형태로 인해 이미지화하기 어려운 옥수수 잎 원시의 전체 마운트를 분석하는 효과적인 방법이라고 결론지었습니다.
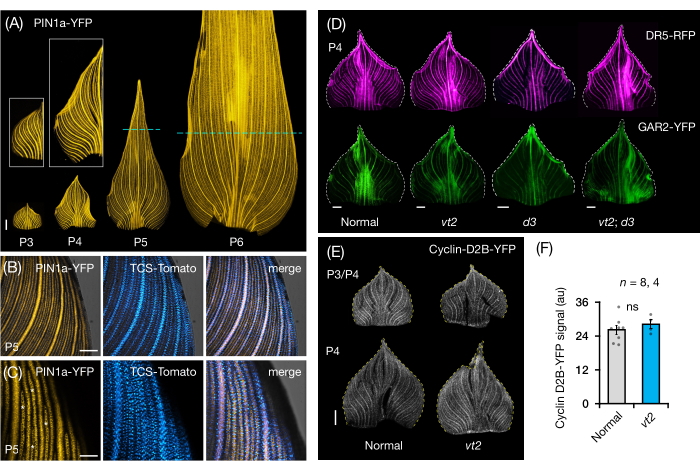
그림 5: 옥수수 잎 원시의 전체 마운트 분석에 대한 대표적인 결과. (A) 옥신 유출 단백질 마커 PIN1a-YFP로 표시된 바와 같이 발달 중인 정맥 및 procambial 가닥을 보여주는 7개 DAG 옥수수 묘목의 잎 원시의 대표적인 형광 이미지. P3-P6 원시를 베이스에서 절제하고, 펼치고, 축면이 위로 향하게 하여 평평하게 하였다. 삽입물은 P3 및 P4의 클로즈업을 보여줍니다. P5 및 P6에서 점선은 증식 영역의 말단부를 구분하며, 대부분의 procambial strands는 여전히 개발 및 확장되고 있습니다. (나,씨) P5 원시의 근위 변연 영역에서 PIN1a-YFP와 사이토키닌 반응 리포터인 TCS-Tomato의 발현을 보여주는 대표적인 공초점 이미지. (D) 소실하는 tassel2 및 난쟁이 식물3의 정상 및 단일 및 이중 돌연변이에서 옥신 반응 리포터, DR5-RFP 및 지베렐린 산 반응성 마커인 GAR2-YFP의 발현을 보여주는 P4 원시의 대표적인 형광 이미지. (E) 세포 주기에서 G1/S 전이에 대한 리포터인 Cyclin-D2B-YFP의 발현을 보여주는 P3 및/또는 P4의 대표적인 공초점 이미지. (F) ImageJ/FIJI를 사용하여 원시의 면적에 걸쳐 Cyclin-D2B-YFP 신호의 적분 밀도를 측정하여 정량화한 정상 및 vt2의 P3/P4 잎 원시에서 세포 증식의 상대적 양. 막대는 평균의 표준 오차± 평균 측정값을 나타냅니다. 스케일 바 = 500 μm (A,D,E); 200 μm (B); 100 μm (씨). 그림 4A-C는 Robil 및 McSteen24의 허가를 받아 수정 및 복제되었으며 그림 4D-F는 저자의 미공개 데이터입니다. 약어: DAG = 발아 후 일수; P = 플라스토크로닉; VT2 = 소실하는 술2; D3 = 난쟁이 식물3; YFP = 황색 형광 단백질; RFP = 적색 형광 단백질; PIN1a-YFP = p Zm PIN1a::ZmPIN1a:YFP; TCS-토마토 = TCSv2::NLS-td토마토; DR5-RFP = DR5rev::mRFPer; GAR2-YFP = p Zm GAR2::ZmGAR2:YFP; 사이클린-D2B-YFP = p Zm 사이클린-D2B::Zm사이클린-D2B:YFP; ns = 유의한 차이 없음; au = 임의 단위. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1: 옥수수 묘목의 잎 발달 단계의 예. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S1: 프로토콜에 사용된 식물 샘플 및 재료. (ᄀ,ᄂ) 옥수수 묘목 7-8 DAG와 상단 잎 소용돌이가 와이어 스트리퍼를 사용하여 제거되었습니다. (B) 삽입물은 노출된 P6 원시가 있는 촬영의 클로즈업을 보여줍니다. (씨지) 횡단면 분석(C,D)을 위해 상부 소용돌이를 제거한 옥수수 묘목의 싹과 전체 마운트 분석(E-G)을 위해 주변 잎을 완전히 제거합니다. (H) 폴리 우레탄 겔 투명 양면 나노 테이프 롤. (나,제) P6 잎 원시(I)와 P8 잎의 근위 영역(J)을 펼치고 나노 테이프로 유리 슬라이드에 장착합니다. (K) epifluorescence 현미경의 무대에 펼쳐진 잎 원시가 있는 유리 슬라이드. 약어 : DAG = 발아 후 일수. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
우리는 세포 이미징을 위해 옥수수 잎 원시를 준비하는 두 가지 방법을 제시합니다. 첫 번째 방법(프로토콜 섹션 2)은 횡단면 분석을 위한 원시의 측정을 가능하게 하고, 두 번째 방법(프로토콜 섹션 3)은 전체 마운트 분석을 위한 원시의 언롤링 및 평탄화를 가능하게 합니다. 이러한 방법은 옥수수 잎 원시(24)(그림 4 및 그림 5에 표시됨)에서 FP의 세포 이미징을 용이하게 하고 개발 중인 옥수수 잎을 이미징하는 문제에 대한 간단한 솔루션을 제공합니다. 프로토콜 섹션 2는 해부 시간을 줄이고 스테이징 매개변수 9,16에만 의존하지 않고 절편 전에 원시를 측정하여 샘플링 정확도를 향상시킵니다. 상업적으로 이용 가능한 나노 테이프를 사용하여 프로토콜 섹션 3은 옥수수에서 전체 잎 원시를 이미징하는 오랜 문제를 해결합니다. 이 프로토콜은 투석 튜브(31)를 사용했던 이전의 방법에서 개선되고, CT 및 MRI(11,32,33)에 대한 훨씬 저렴한 대안이다. 그러나 잎의 해부학적 특성을 시각화하고 최적의 결과를 생성하는 데 있어 두 프로토콜 모두 몇 가지 제한 사항이 있으며, 이는 표 2에 요약되어 있으며 아래에서 더 자세히 설명합니다.
프로토콜 섹션 2에서 우리는 잎 원시의 두꺼운 가로 단면에서 세포 윤곽을 시각화하는 데 어려움을 겪었고 세포벽 또는 원형질막 결합 형광 염료로 대조 염색해도 만족스러운 결과를 얻지 못했습니다. 예를 들어, FM 4-64는 원형질막 FP 마커에 비해 차선의 결과를 생성했으며, p Zm PIP2-1::ZmPIP2-1:CFP39 (PIP2-1-CFP; 그림 3A-D). 이러한 한계를 극복하기 위해, 우리는 비브라톰을 사용하여 더 얇은 조직 절편(~0.1 mm)을 생성하는 것이 좋습니다.58 세포 윤곽선의 생생한 명시야 이미징을 허용하거나 대조염색 프로토콜 47,59를 최적화할 수 있습니다.
프로토콜 섹션 3에서 주요 제한 사항은 프로토콜 단계 3.2.5-3.2.6(그림 3E-K)에 자세히 설명된 대로 찢어짐, 손상 또는 기포 없이 리프를 장착하는 것이 어렵다는 것입니다. 옥수수 잎은 양측 대칭이기 때문에, 전체 잎 산보다는 반잎 산이 시각화9에 충분할 수 있다. 이렇게하기 위해, primordium은 중추까지 펼친 후 세로축을 따라 면도날로자를 수 있으며, 잎의 절반 만 장착 할 수 있습니다. 프로토콜 섹션 3의 또 다른 한계는 리프의 두께가 딥 이미징 동안 형광단 신호의 광학 분해능을 제한할 수 있다는 것입니다. 이러한 문제를 해결하기 위해, 조직 투명화 기술(60)을 채용할 수 있다. 그러나 식물 조직 이미징에 일반적으로 사용되는 투명 시약인 ClearSee61은 샘플과 커버슬립이 나노 테이프에서 분리되기 때문에 프로토콜과 호환되지 않는다는 것을 발견했습니다. 이 문제에 대한 잠재적인 해결책은 잎 샘플 위에 반투과성 멤브레인(31)을 도포하여, 나노 테이프에 의해 제자리에 고정되어 있는 동안 투명 용액으로 처리될 수 있도록 하는 것이다. 액체 용액이 펼쳐진 잎에 적용될 수 있도록 하는 이러한 방법은 이전에 옥수수 꽃차례 개발에 최적화되었지만 전체 잎 원시(primordia)에 대해서는 최적화되지 않은 전체 마운트 RNA 제자리 혼성화 및 면역국소화 기술에도 사용될 수 있습니다62,63.
우리는 묘목 단계에서도 큰 잎 원시를 가진 옥수수에 대한 프로토콜을 설명했습니다. 쌀, 보리, 밀, Setaria 및 Brachypodium 16,23,64,65,66과 같이 잎이 훨씬 작은 다른 풀 종은 이러한 프로토콜을 효과적으로 적용하기 위해 추가 정밀 도구를 사용해야 할 수 있습니다. 또한, 이러한 프로토콜은 조직 형성 및 세포 반응의 실시간 동적 과정을 캡처하는 생세포 이미징을 위한 것이 아닙니다. 그러나 형광 프로브, 이미징 기술 및 컴퓨팅 기능이 식물67에 대한 생세포 이미징에서 계속 발전함에 따라 향후 연구는 이러한 프로토콜을 기반으로 잔디 잎 원시의 고유한 특징에 맞는 생세포 이미징 전략을 개발할 수 있습니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
저자는 옥수수 유전학 협력, 옥수수 세포 유전체학 프로젝트, Dave Jackson (콜드 스프링 하버 연구소, 뉴욕), Anne W. Sylvester (해양 생물학 연구소, 시카고 대학, 일리노이), Andrea Gallavotti (Rutgers 대학, 뉴저지), Carolyn G. Rasmussen (캘리포니아 대학, 리버 사이드)뿐만 아니라 돌연변이 및 형질 전환 주식을 제공 한 Robert F. Baker와 Alexander Jurkevich에게 감사드립니다. 컨포칼 현미경 검사에 도움을 준 Missouri-Columbia. JMR은 J. William Fulbright Fellowship, Diane P. 및 Robert E. Sharp Fund, National Science Foundation의 식물 게놈 연구 프로그램(IOS-1546873)의 지원을 받았습니다. CDTC, EDCDP 및 RJRR은 DOST-SEI S & T 학부 장학금으로 지원됩니다. DODL은 Fr. Thomas Steinbugler SJ 학업 장학금. RJRR은 Aiducation International–Pathways to Higher Education Scholarship의 지원을 받습니다. 이 작업은 과학 및 공학 학교와 Ateneo de Manila University의 Rizal Library에서 지원했습니다.
자료
| Name | Company | Catalog Number | Comments |
| Acrylic Gel Clear Double Sided Nano Tape 16.5 ft x 1.2 in, 2 mm thick | EZlifego Store (Amazon) | B07YB1ZXG6 | 1 roll |
| Bellucci Pick Curved micro probe 16.8 cm, 6.6 in | Bausch & Lomb | N1692 9 | 1 pc |
| Clayman guide microprobe Sinskey hook angled shaft, 11.6 cm, 4.6 in | Storz Opthalmic Instruments | E0542 | 1 pc |
| Dental Probe, Bent Needle, 14 cm (5.5 in) | Ted Pella | 13553 | 1 pc |
| DOWELL 10-22 AWG Wire Stripper | Dowell Store (Amazon) | 10-22 AWG | 1 pc |
| Feather Double Edge Carbon Steel Blades | Ted Pella | 121-9 | pkg/10; for fine sectioning |
| Frosted End Glass Microscope Slides, 75 mm x 25 mm x 1-1.2 mm | Ted Pella | 260442 | pkg/144 |
| GEM Single Edge, Stainless Steel Uncoated Blades | Ted Pella | 121-1 | box/200; for general cutting/sectioning |
| Glycerol | Thermo Scientific | PI17904 | 1 liter |
| ImageJ/FIJI with EDF plugin (version 17.05.2021) and Grid/Collection Stitching plugin | National Institutes of Health (NIH) USA | version 2.9.0/1.54s | The EDF plugin was developed by Alex Prudencio, Jesse Berent, and Daniel Sage for the Biomedical Imaging Group, École Polytechnique Fédérale de Lausanne (EPFL; http://bigwww.epfl.ch/demo/edf/). The grid/collection stitching software was developed by Stephan Preibisch for the Max Planck Institute of Molecular Cell Biology and Genetics (MPI-CBG). |
| Kimwipes Ex-L Small 111.76 mm x 213.36 mm | Kimtech Science | 34155 | box/280 ply |
| Micro Cover Glasses, 22 mm x 22 mm x 0.13 - 0.16 mm thick | Ted Pella | 260140 | 1 ounce |
| PU Gel Clear Double Sided Nano Tape 29.5 ft x 1.18 in, 1 mm thick | Yecaye Store (Amazon) | L354 W1.18 | 2 rolls |
| Superslip Cover Glasses, 24 mm x 50 mm x 0.13 - 0.16 mm thick | Ted Pella | 260166 | 1 ounce |
| Superslip Cover Glasses, 24 mm x 60 mm x 0.13 - 0.16 mm thick | Ted Pella | 260168 | 1 ounce |
| Tempered Glass Cutting Board | Hacaroa (Amazon) | B09XMXBT5S | 4 pc |
참고문헌
- McSteen, P., Kellogg, E. A. Molecular, cellular, and developmental foundations of grass diversity. Science. 377 (6606), 599-602 (2022).
- Wang, P., Vlad, D., Langdale, J. A. Finding the genes to build C4 rice. Current Opinion in Plant Biology. 31, 44-50 (2016).
- Wang, P., et al. Candidate regulators of early leaf development in maize perturb hormone signalling and secondary cell wall formation when constitutively expressed in rice. Scientific Reports. 7 (1), 4535(2017).
- Perico, C., Tan, S., Langdale, J. A. Developmental regulation of leaf venation patterns: Monocot versus eudicots and the role of auxin. New Phytologist. 234 (3), 783-803 (2022).
- Wang, P., Kelly, S., Fouracre, J. P., Langdale, J. A. Genome-wide transcript analysis of early maize leaf development reveals gene cohorts associated with the differentiation of C4 Kranz anatomy. The Plant Journal. 75 (4), 656-670 (2013).
- Liu, W. Y., et al. Regulators of early maize leaf development inferred from transcriptomes of laser capture microdissection (LCM)-isolated embryonic leaf cells. Proceedings of the National Academy of Sciences. 119 (35), e2208795119(2022).
- Liu, W. Y., et al. Anatomical and transcriptional dynamics of maize embryonic leaves during seed germination. Proceedings of the National Academy of Sciences. 110 (10), 3979-3984 (2013).
- Strable, J., Nelissen, H. The dynamics of maize leaf development: Patterned to grow while growing a pattern. Current Opinion in Plant Biology. 63, 102038(2021).
- Reynolds, J. O., Eisses, J. F., Sylvester, A. W. Balancing division and expansion during maize leaf morphogenesis: Analysis of the mutant, warty-1. Development. 125 (2), 259-268 (1998).
- Richardson, A. E., et al. Evolution of the grass leaf by primordium extension and petiole-lamina remodeling. Science. 374 (6573), 1377-1381 (2021).
- Johnston, R., Leiboff, S., Scanlon, M. J. Ontogeny of the sheathing leaf base in maize (Zea mays). New Phytologist. 205 (1), 306-315 (2015).
- Sharman, B. C. Developmental anatomy of the shoot of Zea mays L. Annals of Botany. 6 (22), 245-282 (1942).
- Johnston, R., et al. Transcriptomic analyses indicate that maize ligule development recapitulates gene expression patterns that occur during lateral organ initiation. The Plant Cell. 26 (12), 4718-4732 (2014).
- Sharman, B. C. Leaf and bud initiation in the Gramineae. Botanical Gazette. 106 (3), 269-289 (1945).
- Nelissen, H., et al. A local maximum in gibberellin levels regulates maize leaf growth by spatial control of cell division. Current Biology. 22 (13), 1183-1187 (2012).
- Itoh, J., et al. Rice plant development: From zygote to spikelet. Plant and Cell Physiology. 46 (1), 23-47 (2005).
- Ritchie, S. W., Hanway, J. J., Benson, G. O. How a corn plant develops. Iowa State University of Science and Technology. , (1986).
- Freeling, M., Walbot, V. The Maize Handbook. , Springer Science & Business Media. (2013).
- Freeling, M., Hake, S. Developmental genetics of mutants that specify knotted leaves in maize. Genetics. 111 (3), 617-634 (1985).
- Durbak, A. R., et al. Transport of boron by the tassel-less1 aquaporin is critical for vegetative and reproductive development in maize. The Plant Cell. 26 (7), 2978-2995 (2014).
- Langdale, J. A., Lane, B., Freeling, M., Nelson, T. Cell lineage analysis of maize bundle sheath and mesophyll cells. Developmental Biology. 133 (1), 128-139 (1989).
- Bosabalidis, A. M., Evert, R. F., Russin, W. A. Ontogeny of the vascular bundles and contiguous tissues in the maize leaf blade. American Journal of Botany. 81 (6), 745-752 (1994).
- Junqueira, N. E. G., et al. Anatomy and ultrastructure of embryonic leaves of the C4 species Setaria viridis. Annals of Botany. 121 (6), 1163-1172 (2018).
- Robil, J. M., McSteen, P. Hormonal control of medial-lateral growth and vein formation in the maize leaf. New Phytologist. 238 (1), 125-141 (2023).
- Donnelly, P. M., Bonetta, D., Tsukaya, H., Dengler, R. E., Dengler, N. G. Cell cycling and cell enlargement in developing leaves of Arabidopsis. Developmental Biology. 215 (2), 407-419 (1999).
- Govindaraju, P., Verna, C., Zhu, T., Scarpella, E. Vein patterning by tissue-specific auxin transport. Development. 147 (13), (2020).
- Linh, N. M., Scarpella, E. Leaf vein patterning is regulated by the aperture of plasmodesmata intercellular channels. PLoS Biology. 20 (9), e3001781(2022).
- Verna, C., Ravichandran, S. J., Sawchuk, M. G., Linh, N. M., Scarpella, E. Coordination of tissue cell polarity by auxin transport and signaling. eLife. 8, e51061(2019).
- Sawchuk, M. G., Head, P., Donner, T. J., Scarpella, E. Time-lapse imaging of Arabidopsis leaf development shows dynamic patterns of procambium formation. New Phytologist. 176 (3), 560-571 (2007).
- Linh, N. M., Scarpella, E. Confocal imaging of developing leaves. Current Protocols. 2 (1), e349(2022).
- Poethig, R. S., Szymkowiak, E. J. Clonal analysis of leaf development in maize. Maydica. 40, 67-76 (1995).
- Sprangers, K., Thys, S., van Dusschoten, D., Beemster, G. T. S. Gibberellin enhances the anisotropy of cell expansion in the growth zone of the maize leaf. Frontiers in Plant Science. 11, 1163(2020).
- Tsuda, K., et al. KNOTTED1 cofactors, BLH12 and BLH14, regulate internode patterning and vein anastomosis in maize. The Plant Cell. 29 (5), 1105-1118 (2017).
- Schindelin, J., et al. FIJI: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Plant Care Protocols - Maize. The Donald Danforth Plant Science Center's Plant Growth Facility. , Available from: https://www.danforthcenter.org/our-work/core-facilities/plant-growth/ (2019).
- Mir, R., et al. A DII domain-based auxin reporter uncovers low auxin signaling during telophase and early G1. Plant Physiology. 173 (1), 863-871 (2017).
- DeBlasio, S. L., Sylvester, A. W., Jackson, D. Illuminating plant biology: Using fluorescent proteins for high-throughput analysis of protein localization and function in plants. Briefings in Functional Genomics. 9 (2), 129-138 (2010).
- Wu, Q., Luo, A., Zadrozny, T., Sylvester, A., Jackson, D. Fluorescent protein marker lines in maize: Generation and applications. The International Journal of Developmental Biology. 57 (6-8), 535-543 (2013).
- Mohanty, A., et al. Advancing cell biology and functional genomics in maize using fluorescent protein-tagged lines. Plant Physiology. 149 (2), 601-605 (2009).
- Baker, R. F., et al. Sucrose transporter ZmSut1 expression and localization uncover new insights into sucrose phloem loading. Plant Physiology. 172 (3), 1876-1898 (2016).
- Gallavotti, A., Yang, Y., Schmidt, R. J., Jackson, D. The relationship between auxin transport and maize branching. Plant Physiology. 147 (4), 1913-1923 (2008).
- Krishnakumar, V., et al. A maize database resource that captures tissue-specific and subcellular-localized gene expression, via fluorescent tags and confocal imaging (Maize Cell Genomics Database). Plant and Cell Physiology. 56 (1), 12(2015).
- Snapp, E. L. Fluorescent proteins: A cell biologist's user guide. Trends in Cell Biology. 19 (11), 649-655 (2009).
- Geng, Y., Zhou, Y. Confocal live imaging of shoot apical meristems from different plant species. Journal of Visualized Experiments. (145), e59369(2019).
- Stanislas, T., Hamant, O., Traas, J. In-vivo analysis of morphogenesis in plants. Methods in Cell Biology. 139, Elsevier. 203-223 (2017).
- Fodor, E., Ayaydin, F. Fluorescent probes and live imaging of plant cells. Advances in Plant Ecophysiology Techniques. , Springer. 241-251 (2018).
- Grandjean, O., et al. In vivo analysis of cell division, cell growth, and differentiation at the shoot apical meristem in Arabidopsis. The Plant Cell. 16 (1), 74-87 (2004).
- Conklin, P. A., Johnston, R., Conlon, B. R., Shimizu, R., Scanlon, M. J. Plant homeodomain proteins provide a mechanism for how leaves grow wide. Development. 147 (20), (2020).
- Shaw, S. L. Imaging the live plant cell. The Plant Journal. 45 (4), 573-598 (2006).
- Klaus, A. V., Schawaroch, V., Frischmann, K. J. Confocal imaging and three-dimensional visualization of thick autofluorescent specimens. Methods in Molecular Biology. 1075, 213-225 (2014).
- Forster, B., Van De Ville, D., Berent, J., Sage, D., Unser, M. Extended depth-of-focus for multi-channel microscopy images: a complex wavelet approach. 2004 2nd IEEE International Symposium on Biomedical Imaging: Nano to Macro (IEEE Cat No. 04EX821). IEEE. , 660-663 (2004).
- Extended Depth of Field. EPFL Biomedical Imaging Group. , Available from: http://bigwww.epfl.ch/demo/edf/ (2022).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Phillips, K. A., et al. vanishing tassel2 encodes a grass-specific tryptophan aminotransferase required for vegetative and reproductive development in maize. The Plant Cell. 23 (2), 550-566 (2011).
- Robil, J. M., et al. GrasVIQ: An image analysis framework for automatically quantifying vein number and morphology in grass leaves. The Plant Journal. 107 (2), 629-648 (2021).
- Helliwell, C. A., Chandler, P. M., Poole, A., Dennis, E. S., Peacock, W. J. The CYP88A cytochrome P450, ent-kaurenoic acid oxidase, catalyzes three steps of the gibberellin biosynthesis pathway. Proceedings of the National Academy of Sciences. 98 (4), 2065-2070 (2001).
- Gutierrez, R., Quiroz-Figueroa, F., Vazquez-Ramos, J. M. Maize cyclin D2 expression, associated kinase activity and effect of phytohormones during germination. Plant and Cell Physiology. 46 (1), 166-173 (2005).
- Atkinson, J. A., Wells, D. M. An updated protocol for high throughput plant tissue sectioning. Frontiers in Plant Science. 8, 1721(2017).
- Lux, A., Morita, S., Abe, J., Ito, K. An improved method for clearing and staining free-hand sections and whole-mount samples. Annals of Botany. 96 (6), 989-996 (2005).
- Heriche, M., Arnould, C., Wipf, D., Courty, P. E. Imaging plant tissues: Advances and promising clearing practices. Trends in Plant Science. 27 (6), 601-615 (2022).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Chuck, G., Muszynski, M., Kellogg, E., Hake, S., Schmidt, R. J. The control of spikelet meristem identity by the branched silkless1 gene in maize. Science. 298 (5596), 1238-1241 (2002).
- Tran, T. M., et al. An optimized whole-mount immunofluorescence method for shoot apices. Current Protocols. 1 (4), e101(2021).
- O'Connor, D. L. PINs Lost and PINs Gained: Auxin-Transport Mediated Patterning in the Grasses. University of California, Berkeley. , Doctoral Dissertation (2012).
- Sharman, B. C., Hitch, P. A. Initiation of procambial strands in leaf primordia of bread wheat, Triticum aestivum L. Annals of Botany. 31 (2), 229-243 (1967).
- Serra, L., Tan, S., Robinson, S., Langdale, J. A. Flip-flap: A simple dual-view imaging method for 3D reconstruction of thick plant samples. Plants. 11 (4), 506(2022).
- Colin, L., et al. Imaging the living plant cell: From probes to quantification. The Plant Cell. 34 (1), 247-272 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유