Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Caracterización magnetométrica de intermedios en la electroquímica de estado sólido de estructuras metal-orgánicas redox-activas
En este artículo
Resumen
Los estudios magnéticos ex situ pueden proporcionar directamente información masiva y local en un electrodo magnético para revelar su mecanismo de almacenamiento de carga paso a paso. En esta invención, se demuestra que la resonancia de espín electrónico (ESR) y la susceptibilidad magnética monitorean la evaluación de especies paramagnéticas y su concentración en un marco metal-orgánico (MOF) redox-activo.
Resumen
El almacenamiento de energía electroquímica ha sido una aplicación ampliamente discutida de los marcos metal-orgánicos (MOF) redox-activos en los últimos 5 años. Aunque los MOF muestran un rendimiento sobresaliente en términos de capacitancia gravimétrica o de área y estabilidad cíclica, desafortunadamente sus mecanismos electroquímicos no se comprenden bien en la mayoría de los casos. Las técnicas espectroscópicas tradicionales, como la espectroscopia de fotoelectrones de rayos X (XPS) y la estructura fina de absorción de rayos X (XAFS), solo han proporcionado información vaga y cualitativa sobre los cambios de valencia de ciertos elementos, y los mecanismos propuestos basados en dicha información son a menudo muy discutibles. En este artículo, informamos una serie de métodos estandarizados, incluida la fabricación de celdas electroquímicas de estado sólido, mediciones electroquímicas, el desmontaje de celdas, la recolección de intermedios electroquímicos MOF y mediciones físicas de los intermedios bajo la protección de gases inertes. Mediante el uso de estos métodos para aclarar cuantitativamente la evolución electrónica y del estado de espín dentro de un solo paso electroquímico de los MOF redox-activos, se puede proporcionar una visión clara de la naturaleza de los mecanismos de almacenamiento de energía electroquímica no solo para los MOF, sino también para todos los demás materiales con estructuras electrónicas fuertemente correlacionadas.
Introducción
Desde que se introdujo el término marco metal-orgánico (MOF) a fines de la década de 1990, y especialmente en la década de 2010, los conceptos científicos más representativos sobre los MOF han surgido de su porosidad estructural, incluida la encapsulación invitada, la separación, las propiedades catalíticas y la detección de moléculas 1,2,3,4 . Mientras tanto, los científicos se dieron cuenta rápidamente de que es esencial que los MOF posean propiedades electrónicas sensibles a estímulos para integrarlos en dispositivos inteligentes modernos. Esta idea desencadenó el surgimiento y florecimiento de la familia MOF bidimensional conductora (2D) en los últimos 10 años, abriendo así la puerta para que los MOF desempeñen un papel clave en la electrónica5 y, más atractivamente, en los dispositivos de almacenamiento de energía electroquímica6. Estos MOF 2D se han incorporado como materiales activos en baterías de metales alcalinos, baterías acuosas, pseudocondensadores y supercondensadores 7,8,9, y han exhibido una tremenda capacidad y una excelente estabilidad. Sin embargo, para diseñar MOFs 2D de mejor rendimiento, es crucial comprender sus mecanismos de almacenamiento de carga en detalle. Por lo tanto, este artículo tiene como objetivo proporcionar una comprensión integral de los mecanismos electroquímicos de los MOF, que pueden ayudar en el diseño racional de MOFs de mejor rendimiento para aplicaciones de almacenamiento de energía.
En 2014, informamos por primera vez los mecanismos electroquímicos de estado sólido de los MOF con sitios redox-activos tanto en cationes metálicos como en ligandos10,11. Estos mecanismos se interpretaron con la ayuda de diversas técnicas espectroscópicas in situ y ex situ, como la espectroscopia de fotoelectrones de rayos X (XPS), la estructura fina de absorción de rayos X (XAFS), la difracción de rayos X (XRD) y la resonancia magnética nuclear de estado sólido (RMN). Desde entonces, este paradigma de investigación se ha convertido en una tendencia en los estudios de la electroquímica del estado sólido de materiales de base molecular12. Estos métodos funcionan bien para identificar los eventos redox de MOF convencionales con ligandos puente de carboxilato, ya que los orbitales moleculares y los niveles de energía de los bloques de construcción de grupos metálicos y los ligandos orgánicos son casi independientes entre sí en tales MOFs12,13.
Sin embargo, al encontrar los MOF 2D fuertemente correlacionados con una conjugación π-d significativa, se expusieron las limitaciones de estos métodos espectroscópicos. Una de estas limitaciones es que los niveles de banda de la mayoría de los MOF 2D antes mencionados no pueden considerarse como una simple combinación de grupos metálicos y ligandos, sino que son más bien una hibridación de ellos, mientras que la mayoría de los métodos espectroscópicos solo proporcionan información cualitativa promediada sobre los estados de oxidación14. La otra limitación es que la interpretación de estos datos siempre se basa en la suposición de orbitales atómicos localizados. Por lo tanto, los estados intermedios con hibridación metal-ligando y estados electrónicos deslocalizados generalmente se pasan por alto y se describen incorrectamente con solo estos métodos espectroscópicos15. Es necesario desarrollar nuevas sondas para los estados electrónicos de estos intermedios electroquímicos no solo de MOF 2D, sino también de otros materiales con estructuras electrónicas conjugadas o fuertemente correlacionadas, como los marcos orgánicos covalentes16, los conductores moleculares y los polímeros conjugados17.
Las herramientas más comunes y poderosas para evaluar las estructuras electrónicas de los materiales son la resonancia de espín electrónico (ESR) y las mediciones de susceptibilidad magnética del dispositivo de interferencia cuántica superconductora (SQUID)18,19. Como ambos dependen de electrones no apareados en el sistema, estas herramientas pueden proporcionar información tentativa sobre las densidades de espín, las distribuciones de espín y las interacciones espín-espín. La VSG ofrece una detección sensible de electrones no apareados, mientras que la medición de la susceptibilidad magnética proporciona señales más cuantitativas para las propiedades superiores20. Desafortunadamente, ambas técnicas inevitablemente enfrentan grandes desafíos cuando se utilizan para analizar los intermedios electroquímicos. Esto se debe a que las muestras objetivo no son puras, sino más bien una mezcla de material objetivo, aditivo conductor, aglutinante y subproducto del electrolito, por lo que los datos obtenidos21,22 son la suma de las contribuciones tanto del material como de las impurezas. Mientras tanto, la mayoría de los productos intermedios son sensibles al medio ambiente, incluyendo el aire, el agua, ciertos electrolitos o cualquier otra perturbación impredecible; Es necesario tener especial cuidado al manipular y medir productos intermedios. El ensayo y error es normalmente necesario cuando se trata de una nueva combinación de material de electrodo y electrolito.
Aquí, presentamos un nuevo paradigma, llamado magnetometría electroquímica, para analizar los estados electrónicos o estados de espín de MOF 2D y materiales similares utilizando una serie de técnicas, utilizando electroquímica y espectroscopía ESR ex situ variable de temperatura, así como mediciones de susceptibilidad magnética ex situ 20. Para demostrar la efectividad de este enfoque, utilizamos Cu3THQ 2 (THQ = 1,2,4,5-tetrahidroxibenzoquinona; denominado Cu-THQ), un MOF 2D representativo, como ejemplo. Explicamos la selección de aditivos conductores y electrolitos, la fabricación de electrodos y celdas electroquímicas, así como detalles sobre el manejo y la medición de muestras, incluidos los posibles problemas durante la medición. Al comparar con caracterizaciones clásicas como XRD y XAFS, la magnetometría electroquímica puede proporcionar una comprensión integral del mecanismo electroquímico de la mayoría de los MOF. Este enfoque es capaz de capturar estados intermedios únicos y evitar la asignación incorrecta de eventos redox. La elucidación de los mecanismos de almacenamiento de energía utilizando magnetometría electroquímica también puede contribuir a una mejor comprensión de las relaciones estructura-función en los MOF, lo que lleva a estrategias sintéticas más inteligentes para los MOF y otros materiales conjugados.
Protocolo
1. Fabricación de electrodos
- Sintetizando Cu-THQ MOF
NOTA: El polvo policristalino Cu-THQ MOF fue sintetizado por un método hidrotermal siguiendo procedimientos previamente publicados 14,20,23.- Ponga 60 mg de tetrahidroxiquinona en una ampolla de 20 ml, luego agregue 10 ml de agua desgasificada. En un vial de vidrio separado, disolver 110 mg de trihidrato de nitrato de cobre (II) en otros 10 ml de agua desgasificada. Añadir 46 μL del ligando competidor etilendiamina con una pipeta.
NOTA: Para desgasificar el agua desionizada, fluya gas nitrógeno durante 30 minutos antes de usar. Si la mezcla de reacción se calienta durante demasiado tiempo, se puede formar una impureza de Cu con un pico de difracción que aparece alrededor de 43 ° (Cu Kα). - Introduzca la solución de cobre en la ampolla que contiene la tetrahidroxiquinona. El color de la solución cambia inmediatamente de rojo a marino. Congele, bombee y descongele24 la solución resultante tres veces para eliminar aún más el oxígeno disuelto.
- Selle la ampolla con una antorcha al vacío. Calentar la solución a 60 °C durante 4 h.
- Después de la reacción, abra con cuidado la ampolla y retire el sobrenadante. Lavar el precipitado con 30 ml de agua desionizada a temperatura ambiente 3x y 30 ml de agua desionizada caliente (80 °C) por centrifugación 3x a 10.000 rpm durante 5 min.
- Dispersar el precipitado en acetona agitando, luego filtrar y lavar con acetona. Calentar el producto al vacío a 353 K durante la noche para eliminar el disolvente residual en el Cu-THQ MOF.
- Ponga 60 mg de tetrahidroxiquinona en una ampolla de 20 ml, luego agregue 10 ml de agua desgasificada. En un vial de vidrio separado, disolver 110 mg de trihidrato de nitrato de cobre (II) en otros 10 ml de agua desgasificada. Añadir 46 μL del ligando competidor etilendiamina con una pipeta.
- Preparación de electrodos CuTHQ
NOTA: Para distinguir entre el Cu-THQ MOF y el electrodo, el primero se conoce como Cu-THQ, mientras que la mezcla de Cu-THQ, carbono y aglutinante se conoce simplemente como CuTHQ.- Para preparar el electrodo Cu-THQ/CB/PVDF, disuelva 10 mg de poli(fluoruro de vinilideno) (PVDF) en 1,4 ml de N-metil-2-pirrolidona (NMP). Dispersar 50 mg de Cu-THQ MOF y 40 mg de negro de humo (CB) en la solución agitando vigorosamente durante la noche. Cubra la suspensión homogénea en un disco de Al con un diámetro de 15 mm y una masa de ~ 9,7 mg.
- Para preparar el electrodo Cu-THQ/Gr/SP/SA, siga el mismo procedimiento que el electrodo Cu-THQ/CB/PVDF, pero con una composición de suspensión diferente: Cu-THQ MOF (80 mg), alginato de sodio (SA, 2 mg) y grafeno/Super P (Gr/SP, dilución 1:1.8 en peso, total de 18 mg) en agua/isopropanol (dilución 1:1 en volumen, total de 1,2 ml).
- Secar los electrodos al vacío a 353 K durante 12 h. Ventilar el gas nitrógeno después del secado y medir la carga de masa.
2. Montaje de la batería y post-tratamiento
NOTA: Debido a la naturaleza sensible al aire de los intermedios electroquímicos, el montaje de la batería y el tratamiento posterior deben realizarse en una guantera de argón con estrictos modales libres de aire.
- Montaje de celdas tipo botón Li/CuTHQ
- Corte varias piezas de discos de litio con un diámetro de 15,5 mm y separadores Celgard con un diámetro de 17 mm antes de ensamblar la batería.
- Ensamble celdas de botón Li/CuTHQ (CR2032) de abajo hacia arriba en el siguiente orden: carcasa negativa, espaciador (altura = 0,5 mm), litio, separador, electrodo CuTHQ (preparado en el paso 1.2.1 o 1.2.2), espaciador, resorte y carcasa positiva (Figura 1A).
- Antes y después de agregar el separador, deje caer un total de 0,04 ml de electrolito (1,0 M LiBF4 en carbonato de etileno (EC)/carbonato de dietilo (DEC) a 1:1 en peso). No use pinzas de metal para sostener la celda de botón después de ensamblarla.
- Preparación de productos intermedios electroquímicos
- Comprima la celda de botón usando el tornillo de apriete (no sellado) con un dispositivo casero (Figura 1B) y conecte el dispositivo a los cables de medición en la guantera. Conecte el instrumento (fuera de la guantera) a los puertos correspondientes a la celda de botones. Realizar voltametría cíclica y mediciones galvanostáticas de carga/descarga20 para lograr los intermedios a diferentes potenciales (Figura 2).
- Después del ciclo electroquímico, desmonte la celda de botón con cuidado para evitar cortocircuitos.
- Enjuague el electrodo CuTHQ ciclado con 5 ml de carbonato de dimetilo (DMC) de grado de batería. Seque el electrodo naturalmente durante 30 minutos. Recoja la muestra del disco de Al a la lámina de Al usando una espátula limpia.
- Transfiera el polvo de muestra a un tubo de ESR o tubo SQUID a través de un embudo de vidrio casero (Figura 1C). Selle el tubo de muestra herméticamente con una tapa y una película transparente. Alternativamente, conecte el tubo de muestra a un tubo de goma y séllelo con una válvula, seguido de sellado por llama de la cabeza del tubo de muestra al vacío.
- Después de las mediciones magnéticas20, abra el tubo de muestra y vierta la muestra en la lámina de Al. Mida la masa de la muestra utilizando una balanza analítica con una resolución de 0,01 mg en el aire. Estimar la masa de Cu-THQ a partir de la masa total de la muestra.
NOTA: La masa del Cu-THQ MOF ciclado se estima en el 50% u 80% de la masa total, dependiendo del tipo de electrodos utilizados; esta estimación no tiene en cuenta los iones Li insertados y el electrolito residual.
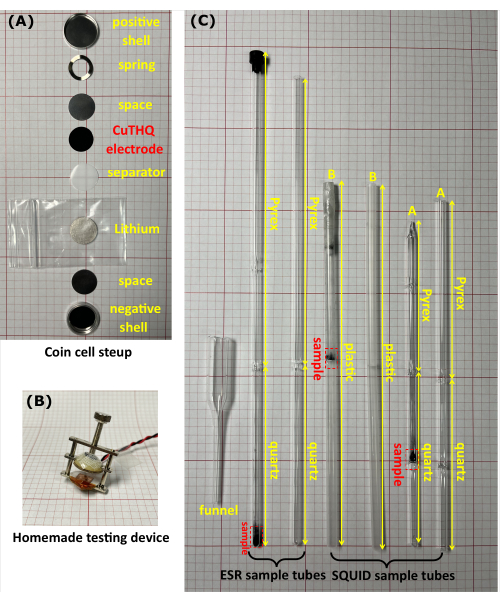
Figura 1: El equipo utilizado para experimentos de magnetometría ex situ. (A) Una fotografía de una celda tipo botón CR2032. (B) El dispositivo casero se utilizó para evaluar la celda de botón sin sellar en la guantera. (C) Fotografías de tubos de muestra ESR y SQUID con y sin muestras en su interior. El tubo ESR consiste en una punta de cuarzo de alta pureza de 10 cm (sección de medición) y una cabeza de vidrio borosilicato de 17 cm. Hay dos tipos de tubos SQUID. El tubo A consiste en una punta de cuarzo de 2 cm x 5 cm con un diafragma de cuarzo en el punto medio y una cabeza de vidrio de borosilicato de 10 cm, y el tubo B es un tubo de plástico (20 cm de largo) con un diafragma de plástico en el punto medio. Todos los tubos de muestra tienen un diámetro exterior de 5 mm. Haga clic aquí para ver una versión más grande de esta figura.
3. Registro de espectros de VSG a temperaturas variables
- Registro de los espectros de VSG a temperatura ambiente
- Una vez que el espectrómetro ESR esté listo, inserte el tubo de muestra preparado en la cavidad del microondas y centre la muestra. Sintoniza automáticamente la fase de microondas, el acoplamiento y la frecuencia para alcanzar la condición de resonancia de la cavidad. Compruebe el Q-dip en el centro de la pantalla para obtener una forma simétrica y una profundidad máxima.
NOTA: Si la muestra contiene demasiado carbono conductor, como el negro de humo, el proceso de autoajuste puede fallar o dar lugar a un pequeño factor de calidad (valor Q) de la cavidad. La masa típica de la muestra es de 3 mg. - Elija los parámetros óptimos, tales como: microondas: potencia; campo magnético: tiempo de barrido; campo central: ancho de barrido; modulación: frecuencia, anchura; Canal: amplitud, constante de tiempo. Luego, barre el campo magnético y registre el espectro ESR. Los valores típicos de los parámetros de medición se muestran en la Figura 3 y la Figura 4.
- Ajuste la cantidad de inserción del marcador Mn a 800. Repita los pasos 3.1.1 y 3.1.2 para registrar un espectro ESR con el marcador Mn. Calibrar el campo magnético empleando seis líneas hiperfinas para los iones Mn(II).
- Una vez que el espectrómetro ESR esté listo, inserte el tubo de muestra preparado en la cavidad del microondas y centre la muestra. Sintoniza automáticamente la fase de microondas, el acoplamiento y la frecuencia para alcanzar la condición de resonancia de la cavidad. Compruebe el Q-dip en el centro de la pantalla para obtener una forma simétrica y una profundidad máxima.
- Análisis de forma de línea de Cu-THQ
- Importe el conjunto de datos ESR a Python (versión 3.9.7). Normalice el espectro ESR dividiendo la intensidad por la masa de la muestra, la raíz cuadrada de la potencia de microondas, el ancho de modulación y la amplitud.
- Ajuste el espectro ESR calibrado y normalizado de Cu-THQ MOF preparado a la función lorentziana axialmente simétrica25:
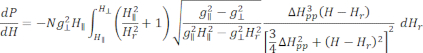
Donde N es un factor de escala que incluye los parámetros del instrumento g lly las constantes H II, ( y ) son el componente paralelo (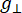 perpendicular) del factor g de Lander y el campo magnético de resonancia correspondiente, Δ Hpp es el ancho de línea pico a pico, y
perpendicular) del factor g de Lander y el campo magnético de resonancia correspondiente, Δ Hpp es el ancho de línea pico a pico, y 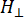 Hres una variable integral.
Hres una variable integral.
NOTA: Los códigos Python para la función Lorentzian están disponibles en el archivo de codificación suplementario 1 (que se denomina AxialLorentz). - Obtenga el valor g anisótropo y el ancho de línea pico a pico para los iones Cu(II) axialmente simétricos.
- Ajuste el espectro ESR calibrado y normalizado con la función Lorentziana para las muestras radicales. Obtenga el valor g isotrópico y el ancho de línea pico a pico para los radicales.
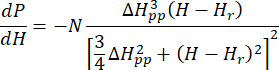
Esto se denomina SymLorentz en el archivo de codificación suplementario 1.
- Cuantificación de la concentración de radicales
- Moler 3,45 mg de 4-hidroxi-2,2,6,6-tetrametilpiperidina-1-oxilo (TEMPOL) y 96,55 mg de KBr juntos en un mortero de ágata hasta conseguir una mezcla homogénea. Coloque 1 mg (0,2 μmol), 2 mg (0,4 μmol) y 4 mg (0,8 μmol) de mezclas TEMPOL/KBr en tres tubos de muestra de VSG, respectivamente.
- Siga los pasos 3.1.1 y 3.1.2 para registrar los espectros ESR para los estándares TEMPOL/KBr.
- Realizar un ajuste lineal de línea base entre la doble integración de los espectros ESR y el número de espines en los estándares TEMPOL/KBr. Determine el número de giros en el Cu-THQ ciclado utilizando la línea de base lineal de los estándares TEMPOL/KBr26.
- Registro de los espectros de ESR a bajas temperaturas
NOTA: Utilice helio líquido para alcanzar una temperatura criogénica. Es necesario usar guantes criogénicos cuando se trabaja con helio líquido.- Compruebe primero el espectro de VSG a temperatura ambiente siguiendo el paso 3.1.
- Evacúe el escudo térmico a un alto nivel de vacío. Purgue la cavidad del microondas con gas nitrógeno para evitar la condensación.
- Introducir helio líquido del recipiente en el criostato. Enfriar gradualmente la muestra a la temperatura más baja (alrededor de 10 K). Espere 30 minutos para lograr el equilibrio térmico.
- Registre los espectros de ESR dependientes de la temperatura durante el calentamiento. Confirme que el espectro ESR no sufre el efecto de saturación de potencia a baja temperatura, y la relación entre la intensidad de la señal (altura pico a pico) y la raíz cuadrada de la potencia de microondas permanece constante en ausencia de saturación de potencia.
NOTA: Cuando la potencia está saturada, la intensidad de la señal aumenta más lentamente que la raíz cuadrada de la potencia de microondas. La densidad de muestreo podría disminuir gradualmente a medida que aumenta la temperatura.
4. Mediciones de susceptibilidad magnética
- Fije el tubo de muestra a la parte inferior de la varilla de muestra. Asegúrese de que la superficie del tubo de muestra esté limpia.
- Purgue la cámara de muestra e inserte el tubo de muestra en el SQUID. Aplique un campo magnético y centre la muestra dentro de la bobina de detección. Retire el campo magnético externo después de centrarlo.
NOTA: Si la concentración de espín es demasiado baja para detectarla, considere aumentar el campo magnético o el centrado después del enfriamiento a 2 K. La masa de muestra típica para las mediciones de SQUID es de aproximadamente 6 mg. - Enfriar el sistema a 20 K a una velocidad de 10 K/min. Pausa el enfriamiento durante 30 minutos, luego enfríe a 2 K durante 1 h.
- Medir la susceptibilidad magnética del electrodo CuTHQ ciclado bajo un campo magnético de 1.000 Oe mientras se calienta a 300 K; esto se conoce como el proceso de enfriamiento de campo cero (ZFC). A continuación, enfríe a 2 K nuevamente y registre la susceptibilidad magnética en el proceso enfriado en campo (FC).
- Repita los pasos 4.1 a 4.4 con electrodos CuTHQ ciclados en diferentes grados de reducción.
- Medir la susceptibilidad magnética de los materiales de carbono (Gr/SP) en las mismas condiciones. Utilice este resultado para compensar la susceptibilidad magnética de los electrodos CuTHQ.
- Ajuste la dependencia de la temperatura de la susceptibilidad magnética a la ley de Curie-Weiss modificada:
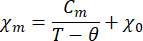
Donde χ m es la susceptibilidad magnética molar, Cmes la constante de Curie molar, θ es la temperatura de Weiss y χ0es un término independiente de la temperatura.
Resultados
Nuestro trabajo anterior incluyó una discusión detallada de la espectroscopia de ESR ex situ y las mediciones de susceptibilidad magnética ex situ para CuTHQ20 ciclado electroquímicamente. A continuación, presentamos los resultados más representativos y detallados que se pueden obtener siguiendo el protocolo descrito en este trabajo.
Discusión
Para producir cátodos, es necesario mezclar el material activo con carbono conductor para lograr una baja polarización durante el proceso electroquímico. El aditivo de carbono es el primer punto crítico para la magnetometría ex situ ; si el carbono tiene defectos radicales, la aparición del radical orgánico inducido electroquímicamente no se puede observar en el espectro de ESR. Esto hace que sea difícil determinar con precisión la concentración de espín o la concentración de radicales orgánicos, y...
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Este estudio fue apoyado por una subvención KAKENHI (JP20H05621) de la Sociedad Japonesa para la Promoción de la Ciencia (JSPS). Z. Zhang también agradece a la Fundación Tatematsu y a la beca Toyota Riken por su apoyo financiero.
Materiales
| Name | Company | Catalog Number | Comments |
| 1-Methyl-2-pyrrolidone | FUJIFILM Wako Chemicals | 139-17611 | Super Dehydrated |
| 1mol/L LiBF4 EC:DEC (1:1 v/v%) | Kishida | LBG-96533 | electrolyte |
| 4-Hydroxy-2,2,6,6-tetramethylpiperidine-1-oxyl | FUJIFILM Wako Chemicals | 089-04191 | TEMPOL, for Spin Labeling |
| Ampule tube | Maruemu Corporation | 5-124-05 | 20mL |
| Carbon black, Super P Conductive | Alfa Aesar | H30253 | |
| Conductive Carbon Black | Mitsubishi Chemical | ||
| Copper (II) Nitrate Trihydrate | FUJIFILM Wako Chemicals | 033-12502 | deleterious substances |
| Dimethyl Carbonate | FUJIFILM Wako Chemicals | 046-31935 | battery grade |
| Ethylenediamine | FUJIFILM Wako Chemicals | 053-00936 | deleterious substances |
| Graphene Nanoplatelets | Tokyo Chemical Industry | G0442 | 6-8nm(thick), 15µm(wide) |
| Poly(vinylidene fluoride) | Sigma Aldrich | 182702 | |
| Potassium Bromide | FUJIFILM Wako Chemicals | 165-17111 | for Infrared Spectrophotometry |
| Sodium Alginate | FUJIFILM Wako Chemicals | 199-09961 | 500-600 cP |
| SQUID Magnetometer | Quantum Design | MPMS-XL 5 | |
| Tetrahydroxy-1,4-benzoquinone Hydrate | Tokyo Chemical Industry | T1090 | |
| X-Band ESR | JEOL | JES-F A200 |
Referencias
- Lee, J., et al. Metal-organic framework materials as catalysts. Chemical Society Reviews. 38 (5), 1450-1459 (2009).
- Dolgopolova, E. A., Rice, A. M., Martin, C. R., Shustova, N. B. Photochemistry and photophysics of MOFs: steps towards MOF-based sensing enhancements. Chemical Society Reviews. 47 (13), 4710-4728 (2018).
- Qian, Q., et al. MOF-based membranes for gas separations. Chemical Reviews. 120 (16), 8161-8266 (2020).
- Wang, Q., Astruc, D. State of the art and prospects in metal-organic framework (MOF)-based and MOF-derived nanocatalysis. Chemical Reviews. 120 (2), 1438-1511 (2020).
- Wang, M., Dong, R., Feng, X. Two-dimensional conjugated metal-organic frameworks (2D c-MOFs): chemistry and function for MOFtronics. Chemical Society Reviews. 50 (4), 2764-2793 (2021).
- Baumann, A. E., Burns, D. A., Liu, B., Thoi, V. S. Metal-organic framework functionalization and design strategies for advanced electrochemical energy storage devices. Communications Chemistry. 2 (1), 86 (2019).
- Nam, K. W., et al. Conductive 2D metal-organic framework for high-performance cathodes in aqueous rechargeable zinc batteries. Nature Communications. 10 (1), 4948 (2019).
- Sheberla, D., et al. Conductive MOF electrodes for stable supercapacitors with high areal capacitance. Nature Materials. 16 (2), 220-224 (2017).
- Wang, Z., et al. Ultrathin two-dimensional conjugated metal-organic framework single-crystalline nanosheets enabled by surfactant-assisted synthesis. Chemical Science. 11 (29), 7665-7671 (2020).
- Zhang, Z., Yoshikawa, H., Awaga, K. Monitoring the solid-state electrochemistry of Cu(2,7-AQDC) (AQDC = anthraquinone dicarboxylate) in a lithium battery: Coexistence of metal and ligand redox activities in a metal-organic framework. Journal of the American Chemical Society. 136 (46), 16112-16115 (2014).
- Zhang, Z., Yoshikawa, H., Awaga, K. Discovery of a "bipolar charging" mechanism in the solid-state electrochemical process of a flexible metal-organic framework. Chemistry of Materials. 28 (5), 1298-1303 (2016).
- Li, C., Hu, X., Hu, B. Cobalt(II) dicarboxylate-based metal-organic framework for long-cycling and high-rate potassium-ion battery anode. Electrochimica Acta. 253, 439-444 (2017).
- Liu, J., et al. Reversible formation of coordination bonds in Sn-based metal-organic frameworks for high-performance lithium storage. Nature Communications. 12 (1), 3131 (2021).
- Jiang, Q., et al. A redox-active 2D metal-organic framework for efficient lithium storage with extraordinary high capacity. Angewandte Chemie. 59 (13), 5273-5277 (2020).
- Sakaushi, K., Nishihara, H. Two-dimensional π-conjugated frameworks as a model system to unveil a multielectron-transfer-based energy storage mechanism. Accounts of Chemical Research. 54 (15), 3003-3015 (2021).
- Li, H., et al. 2D organic radical conjugated skeletons with paramagnetic behaviors. Advanced Materials Interfaces. 8 (18), 2100943 (2021).
- Peeks, M. D., et al. Electronic delocalization in the radical cations of porphyrin oligomer molecular wires. Journal of the American Chemical Society. 139 (30), 10461-10471 (2017).
- Krug von Nidda, H. A., et al. Anisotropic exchange in LiCuVO4 probed by ESR. Physical Review B. 65 (13), 134445 (2002).
- Zeng, Z., et al. Pro-aromatic and anti-aromatic π-conjugated molecules: An irresistible wish to be diradicals. Chemical Society Reviews. 44 (18), 6578-6596 (2015).
- Chen, Q., Adeniran, O., Liu, Z. F., Zhang, Z., Awaga, K. Graphite-like charge storage mechanism in a 2D π-d conjugated metal-organic framework revealed by stepwise magnetic monitoring. Journal of the American Chemical Society. 145 (2), 1062-1071 (2023).
- Julien, C. M., Mauger, A., Groult, H., Zhang, X., Gendron, F. LiCo1-yByO2 as cathode materials for rechargeable lithium batteries. Chemistry of Materials. 23 (2), 208-218 (2011).
- Niemöller, A., Jakes, P., Eichel, R. A., Granwehr, J. In operando EPR investigation of redox mechanisms in LiCoO2. Chemical Physics Letters. 716, 231-236 (2019).
- Park, J., et al. Synthetic routes for a 2D semiconductive copper hexahydroxybenzene metal-organic framework. Journal of the American Chemical Society. 140 (44), 14533-14537 (2018).
- Rondeau, R. E. A technique for degassing liquid samples. Journal of Chemical Education. 44 (9), 530 (1967).
- Flores-Llamas, H. Inhomogeneously broadened EPR lineshape of axial powder. Applied Magnetic Resonance. 9 (2), 289-298 (1995).
- Sun, L., et al. Room-temperature quantitative quantum sensing of lithium ions with a radical-embedded metal-organic framework. Journal of the American Chemical Society. 144 (41), 19008-19016 (2022).
- Chen, Y., et al. Successive storage of cations and anions by ligands of π-d-conjugated coordination polymers enabling robust sodium-ion batteries. Angewandte Chemie. 60 (34), 18769-18776 (2021).
- Roessler, M. M., Salvadori, E. Principles and applications of EPR spectroscopy in the chemical sciences. Chemical Society Reviews. 47 (8), 2534-2553 (2018).
- Ji, X., et al. Pauli paramagnetism of stable analogues of pernigraniline salt featuring ladder-type constitution. Journal of the American Chemical Society. 142 (1), 641-648 (2020).
- Noel, M., Santhanam, R. Electrochemistry of graphite intercalation compounds. Journal of Power Sources. 72 (1), 53-65 (1998).
- Wu, K. H., Ting, T. H., Wang, G. P., Ho, W. D., Shih, C. C. Effect of carbon black content on electrical and microwave absorbing properties of polyaniline/carbon black nanocomposites. Polymer Degradation and Stability. 93 (2), 483-488 (2008).
- Yao, M., Taguchi, N., Ando, H., Takeichi, N., Kiyobayashi, T. Improved gravimetric energy density and cycle life in organic lithium-ion batteries with naphthazarin-based electrode materials. Communications Materials. 1 (1), 70 (2020).
- Krzystek, J., et al. EPR spectra from "EPR-silent" species: High-frequency and high-field EPR spectroscopy of pseudotetrahedral complexes of nickel(II). Inorganic Chemistry. 41 (17), 4478-4487 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados