Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Magnetometrische Charakterisierung von Zwischenprodukten in der Festkörperelektrochemie redoxaktiver metallorganischer Gerüstverbindungen
In diesem Artikel
Zusammenfassung
Ex-situ-Magnetfelduntersuchungen können direkt Bulk- und lokale Informationen über eine magnetische Elektrode liefern, um ihren Ladungsspeichermechanismus Schritt für Schritt aufzudecken. In dieser Arbeit werden Elektronenspinresonanz (ESR) und magnetische Suszeptibilität demonstriert, um die Bewertung paramagnetischer Spezies und ihrer Konzentration in einem redoxaktiven metallorganischen Gerüst (MOF) zu überwachen.
Zusammenfassung
Die elektrochemische Energiespeicherung war in den letzten 5 Jahren eine viel diskutierte Anwendung von redoxaktiven metallorganischen Gerüstverbindungen (MOFs). Obwohl MOFs eine hervorragende Leistung in Bezug auf gravimetrische oder flächenhafte Kapazität und Zyklenstabilität aufweisen, sind ihre elektrochemischen Mechanismen leider in den meisten Fällen nicht gut verstanden. Traditionelle spektroskopische Techniken wie die Röntgenphotoelektronenspektroskopie (XPS) und die Feinstruktur der Röntgenabsorption (XAFS) haben nur vage und qualitative Informationen über Valenzänderungen bestimmter Elemente geliefert, und die auf dieser Information basierenden Mechanismen sind oft höchst umstritten. In diesem Artikel berichten wir über eine Reihe standardisierter Methoden, darunter die Herstellung elektrochemischer Festkörperzellen, elektrochemische Messungen, die Demontage von Zellen, die Sammlung elektrochemischer MOF-Zwischenprodukte und physikalische Messungen der Zwischenprodukte unter dem Schutz von Inertgasen. Durch die Verwendung dieser Methoden zur quantitativen Klärung der Elektronen- und Spinzustandsentwicklung innerhalb eines einzigen elektrochemischen Schritts von redoxaktiven MOFs kann man einen klaren Einblick in die Natur elektrochemischer Energiespeichermechanismen nicht nur für MOFs, sondern auch für alle anderen Materialien mit stark korrelierten elektronischen Strukturen geben.
Einleitung
Seit der Einführung des Begriffs metallorganisches Gerüst (MOF) in den späten 1990er Jahren und insbesondere in den 2010er Jahren sind die repräsentativsten wissenschaftlichen Konzepte zu MOFs aus ihrer strukturellen Porosität entstanden, einschließlich Gastverkapselung, Trennung, katalytische Eigenschaften und Molekülerkennung 1,2,3,4 . In der Zwischenzeit erkannten Wissenschaftler schnell, dass es für MOFs unerlässlich ist, auf Reize reagierende elektronische Eigenschaften zu besitzen, um sie in moderne intelligente Geräte zu integrieren. Diese Idee löste in den letzten 10 Jahren die Entstehung und das Gedeihen der konduktiven zweidimensionalen (2D) MOF-Familie aus und öffnete damit das Tor für MOFs, um eine Schlüsselrolle in der Elektronik5 und, noch attraktiver, in elektrochemischen Energiespeichern6 zu spielen. Diese 2D-MOFs wurden als aktive Materialien in Alkalimetallbatterien, wässrige Batterien, Pseudokondensatoren und Superkondensatoren 7,8,9 eingebaut und haben eine enorme Kapazität sowie eine ausgezeichnete Stabilität gezeigt. Um leistungsfähigere 2D-MOFs zu entwickeln, ist es jedoch entscheidend, ihre Ladungsspeichermechanismen im Detail zu verstehen. Daher zielt dieser Artikel darauf ab, ein umfassendes Verständnis der elektrochemischen Mechanismen von MOFs zu vermitteln, was bei der rationalen Entwicklung leistungsfähigerer MOFs für Energiespeicheranwendungen helfen kann.
Im Jahr 2014 berichteten wir erstmals über die elektrochemischen Festkörpermechanismen von MOFs mit redoxaktiven Zentren sowohl auf Metallkationen als auch auf Liganden10,11. Diese Mechanismen wurden mit Hilfe verschiedener in situ und ex situ spektroskopischer Techniken wie Röntgenphotoelektronenspektroskopie (XPS), Röntgenabsorptionsfeinstruktur (XAFS), Röntgenbeugung (XRD) und Festkörper-Kernspinresonanz (NMR) interpretiert. Seitdem hat sich dieses Forschungsparadigma zu einem Trend in der Untersuchung der Festkörperelektrochemie molekularer Materialien entwickelt12. Diese Methoden eignen sich hervorragend für die Identifizierung der Redoxereignisse herkömmlicher MOFs mit Carboxylat-überbrückenden Liganden, da die Molekülorbitale und Energieniveaus von Metallcluster-Bausteinen und organischen Liganden in solchen MOFs nahezu unabhängig voneinander sind12,13.
Bei der Begegnung mit den stark korrelierten 2D-MOFs mit signifikanter π-d-Konjugation wurden jedoch die Grenzen dieser spektroskopischen Methoden aufgezeigt. Eine dieser Einschränkungen besteht darin, dass die Bandenniveaus der meisten oben genannten 2D-MOFs nicht als einfache Kombination von Metallclustern und Liganden betrachtet werden können, sondern eher eine Hybridisierung dieser sind, während die meisten spektroskopischen Methoden nur gemittelte, qualitative Informationen über die Oxidationsstufen liefern14. Die andere Einschränkung besteht darin, dass die Interpretation dieser Daten immer auf der Annahme lokalisierter Atomorbitale basiert. Daher werden die Zwischenzustände mit Metall-Ligand-Hybridisierung und delokalisierten elektronischen Zuständen in der Regel übersehen und nur mit diesen spektroskopischen Methoden falsch beschrieben15. Es ist notwendig, neue Sonden für die elektronischen Zustände dieser elektrochemischen Zwischenprodukte nicht nur von 2D-MOFs, sondern auch von anderen Materialien mit ähnlichen konjugierten oder stark korrelierten elektronischen Strukturen zu entwickeln, wie z. B. kovalente organische Gerüstverbindungen16, molekulare Leiter und konjugierte Polymere17.
Die gebräuchlichsten und leistungsfähigsten Werkzeuge zur Beurteilung der elektronischen Strukturen von Materialien sind Elektronenspinresonanz (ESR) und supraleitende Quanteninterferenzgeräte (SQUID) magnetische Suszeptibilitätsmessungen18,19. Da beide auf ungepaarte Elektronen im System angewiesen sind, können diese Werkzeuge vorläufige Informationen über die Spindichten, Spinverteilungen und Spin-Spin-Wechselwirkungen liefern. ESR bietet eine empfindliche Detektion ungepaarter Elektronen, während die magnetische Suszeptibilitätsmessung quantitativere Signale für obere Eigenschaften liefert20. Leider stehen beide Techniken bei der Analyse der elektrochemischen Zwischenprodukte zwangsläufig vor großen Herausforderungen. Dies liegt daran, dass die Zielproben nicht rein sind, sondern eine Mischung aus Zielmaterial, leitfähigem Additiv, Bindemittel und Nebenprodukt aus dem Elektrolyten, so dass die erhaltenen Daten21,22 die Summe der Beiträge sowohl des Materials als auch der Verunreinigungen sind. In der Zwischenzeit reagieren die meisten Zwischenprodukte empfindlich auf die Umgebung, einschließlich Luft, Wasser, bestimmte Elektrolyte oder andere unvorhersehbare Störungen. Besondere Sorgfalt ist bei der Handhabung und Messung von Zwischenprodukten erforderlich. Versuch und Irrtum sind in der Regel notwendig, wenn es um eine neue Kombination aus Elektrodenmaterial und Elektrolyt geht.
In dieser Arbeit stellen wir ein neues Paradigma vor, das als elektrochemische Magnetometrie bezeichnet wird, um die elektronischen Zustände oder Spinzustände von 2D-MOFs und ähnlichen Materialien unter Verwendung einer Reihe von Techniken zu analysieren, wobei Elektrochemie und temperaturvariable Ex-situ-ESR-Spektroskopie sowie Ex-situ-Messungen der magnetischen Suszeptibilität verwendetwerden 20. Um die Wirksamkeit dieses Ansatzes zu demonstrieren, verwenden wir Cu3THQ 2 (THQ = 1,2,4,5-Tetrahydroxybenzochinon; Cu-THQ genannt), ein repräsentatives 2D-MOF, als Beispiel. Wir erläutern die Auswahl leitfähiger Additive und Elektrolyte, die Herstellung von Elektroden und elektrochemischen Zellen sowie Details zur Probenhandhabung und -messung, einschließlich möglicher Probleme während der Messung. Durch den Vergleich mit klassischen Charakterisierungen wie XRD und XAFS kann die elektrochemische Magnetometrie ein umfassendes Verständnis der elektrochemischen Mechanismen der meisten MOFs liefern. Dieser Ansatz ist in der Lage, eindeutige Zwischenzustände zu erfassen und eine falsche Zuordnung von Redoxereignissen zu vermeiden. Die Aufklärung von Energiespeichermechanismen mittels elektrochemischer Magnetometrie kann auch zu einem besseren Verständnis der Struktur-Funktions-Beziehungen in MOFs beitragen, was zu intelligenteren Synthesestrategien für MOFs und andere konjugierte Materialien führt.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Herstellung von Elektroden
- Synthese von Cu-THQ MOF
ANMERKUNG: Das polykristalline Cu-THQ-MOF-Pulver wurde mittels einer hydrothermalen Methode nach den zuvor veröffentlichten Verfahren 14,20,23 synthetisiert.- Geben Sie 60 mg Tetrahydroxychinon in eine 20-ml-Ampulle und fügen Sie dann 10 ml entgastes Wasser hinzu. In einer separaten Durchstechflasche aus Glas werden 110 mg Kupfer(II)-nitrattrihydrat in weiteren 10 ml entgastem Wasser gelöst. 46 μl des konkurrierenden Liganden Ethylendiamin werden mit einer Pipette zugegeben.
Anmerkungen: Um das deionisierte Wasser zu entgasen, lassen Sie vor dem Gebrauch 30 Minuten lang Stickstoffgas einströmen. Wenn das Reaktionsgemisch zu lange erhitzt wird, kann sich eine Cu-Verunreinigung mit einer Beugungsspitze von etwa 43° (Cu Kα) bilden. - Die Kupferlösung wird in die Ampulle mit dem Tetrahydroxychinon eingeführt. Die Farbe der Lösung wechselt sofort von Rot zu Marineblau. Frieren Sie die resultierende Lösung dreimal ein, pumpen Sie sie und tauen Siesie 24 Mal auf, um den gelösten Sauerstoff weiter zu entfernen.
- Verschließen Sie die Ampulle mit einem Brenner unter Vakuum. Die Lösung 4 h lang auf 60 °C erhitzen.
- Öffnen Sie nach der Reaktion vorsichtig die Ampulle und entfernen Sie den Überstand. Waschen Sie den Niederschlag 3x mit 30 ml deionisiertem Wasser bei Raumtemperatur und 30 ml heißem deionisiertem Wasser (80 °C) durch 3x-Zentrifugation bei 10.000 U/min für 5 min.
- Dispergieren Sie den Niederschlag durch Schütteln zu Aceton, filtern Sie ihn und waschen Sie ihn mit Aceton. Erhitzen Sie das Produkt über Nacht unter Vakuum bei 353 K, um das restliche Lösungsmittel im Cu-THQ-MOF zu entfernen.
- Geben Sie 60 mg Tetrahydroxychinon in eine 20-ml-Ampulle und fügen Sie dann 10 ml entgastes Wasser hinzu. In einer separaten Durchstechflasche aus Glas werden 110 mg Kupfer(II)-nitrattrihydrat in weiteren 10 ml entgastem Wasser gelöst. 46 μl des konkurrierenden Liganden Ethylendiamin werden mit einer Pipette zugegeben.
- CuTHQ-Elektroden vorbereiten
HINWEIS: Um zwischen dem Cu-THQ MOF und der Elektrode zu unterscheiden, wird erstere als Cu-THQ bezeichnet, während die Mischung aus Cu-THQ, Kohlenstoff und Bindemittel einfach als CuTHQ bezeichnet wird.- Zur Herstellung der Cu-THQ/CB/PVDF-Elektrode werden 10 mg Polyvinylidenfluorid (PVDF) in 1,4 ml N-Methyl-2-pyrrolidon (NMP) gelöst. 50 mg Cu-THQ MOF und 40 mg Ruß (CB) werden in der Lösung unter kräftigem Rühren über Nacht dispergiert. Die homogene Aufschlämmung wird auf eine Al-Scheibe mit einem Durchmesser von 15 mm und einer Masse von ~9,7 mg aufgetragen.
- Zur Herstellung der Cu-THQ/Gr/SP/SA-Elektrode wird das gleiche Verfahren wie bei der Cu-THQ/CB/PVDF-Elektrode angewendet, jedoch mit einer anderen Slurry-Zusammensetzung: Cu-THQ MOF (80 mg), Natriumalginat (SA, 2 mg) und Graphen/Super P (Gr/SP, 1:1,8 Gewichtsverdünnung, insgesamt 18 mg) in Wasser/Isopropanol (1:1 Volumenverdünnung, insgesamt 1,2 ml).
- Trocknen Sie die Elektroden 12 h lang unter Vakuum bei 353 K. Lassen Sie das Stickstoffgas nach dem Trocknen ab und messen Sie die Massenbelastung.
2. Batteriemontage und Nachbehandlung
Anmerkungen: Aufgrund der Luftempfindlichkeit elektrochemischer Zwischenprodukte müssen die Batteriemontage und -nachbehandlung in einem Argon-Handschuhfach mit streng luftfreien Manieren durchgeführt werden.
- Montage von Li/CuTHQ-Knopfzellen
- Schneiden Sie mehrere Stücke Lithiumscheiben mit einem Durchmesser von 15,5 mm und Celgard-Separatoren mit einem Durchmesser von 17 mm zu, bevor Sie die Batterie zusammenbauen.
- Montieren Sie die Li/CuTHQ-Knopfzellen (CR2032) von unten nach oben in der folgenden Reihenfolge: negative Schale, Abstandshalter (Höhe = 0,5 mm), Lithium, Separator, CuTHQ-Elektrode (in Schritt 1.2.1 oder 1.2.2 vorbereitet), Abstandshalter, Feder und positive Schale (Abbildung 1A).
- Vor und nach der Zugabe des Separators werden insgesamt 0,04 ml Elektrolyt (1,0 M LiBF4 in Ethylencarbonat (EC)/Diethylcarbonat (DEC) bei 1:1 Gew.-%) getropft. Verwenden Sie keine Metallpinzette, um die Knopfzelle nach dem Zusammenbau zu halten.
- Herstellung elektrochemischer Zwischenprodukte
- Komprimieren Sie die Knopfzelle mit der Spannschraube (nicht abgedichtet) mit einem selbstgebauten Gerät (Abbildung 1B) und verbinden Sie das Gerät mit den Messkabeln im Handschuhfach. Schließen Sie das Instrument (außerhalb des Handschuhfachs) an die Anschlüsse an, die der Knopfzelle entsprechen. Führen Sie zyklische Voltammetrie und galvanostatische Lade-/Entladungsmessungen20 durch, um die Zwischenprodukte bei unterschiedlichen Potentialen zu erhalten (Abbildung 2).
- Zerlegen Sie die Knopfzelle nach dem elektrochemischen Zyklus vorsichtig, um Kurzschlüsse zu vermeiden.
- Spülen Sie die getaktete CuTHQ-Elektrode mit 5 ml Dimethylcarbonat (DMC) in Batteriequalität. Trocknen Sie die Elektrode 30 Minuten lang auf natürliche Weise. Sammeln Sie die Probe mit einem sauberen Spatel von der Al-Scheibe auf die Al-Folie.
- Übertragen Sie das Probenpulver durch einen selbstgebauten Glastrichter in ein BSG-Röhrchen oder ein SQUID-Röhrchen (Abbildung 1C). Verschließen Sie das Probenröhrchen fest mit einer Kappe und einer transparenten Folie. Alternativ können Sie das Probenröhrchen mit einem Gummischlauch verbinden und mit einem Ventil verschließen, gefolgt von einer Flammversiegelung des Kopfes des Probenröhrchens unter Vakuum.
- Öffnen Sie nach den magnetischen Messungen20 das Probenröhrchen und kippen Sie die Probe auf Al-Folie. Messen Sie die Masse der Probe mit einer Analysenwaage mit einer Auflösung von 0,01 mg an der Luft. Schätzen Sie die Masse von Cu-THQ aus der Gesamtmasse der Probe.
HINWEIS: Die Masse des zyklischen Cu-THQ-MOF wird je nach Art der verwendeten Elektroden auf 50 % oder 80 % der Gesamtmasse geschätzt. Diese Schätzung berücksichtigt nicht die eingesetzten Li-Ionen und den Restelektrolyten.
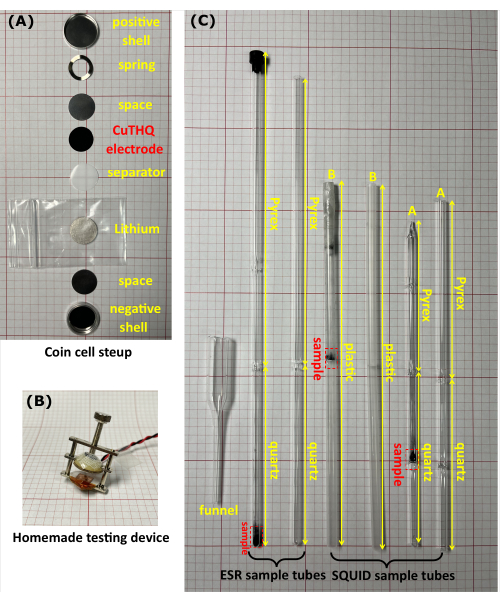
Abbildung 1: Die Ausrüstung, die für Ex-situ-Magnetometrie-Experimente verwendet wird . (A) Ein Foto einer CR2032-Knopfzelle. (B) Das selbstgebaute Gerät wurde verwendet, um die unversiegelte Knopfzelle im Handschuhfach zu bewerten. (C) Fotos von BSG- und SQUID-Probenröhrchen mit und ohne Proben im Inneren. Das ESR-Rohr besteht aus einer 10 cm hochreinen Quarzspitze (Messstrecke) und einem 17 cm großen Borosilikatglaskopf. Es gibt zwei Arten von SQUID-Röhren. Rohr A besteht aus einer 2 cm x 5 cm großen Quarzspitze mit einer Quarzmembran in der Mitte und einem 10 cm großen Borosilikatglaskopf, und Rohr B ist ein Kunststoffrohr (20 cm lang) mit einer Kunststoffmembran in der Mitte. Alle Probenröhrchen haben einen Außendurchmesser von 5 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Registrierung von BSG-Spektren bei variablen Temperaturen
- Aufnahme der ESR-Spektren bei Raumtemperatur
- Sobald das BSG-Spektrometer fertig ist, führen Sie das vorbereitete Probenröhrchen in den Mikrowellenhohlraum ein und zentrieren Sie die Probe. Passen Sie die Mikrowellenphase, die Kopplung und die Frequenz automatisch an, um den Resonanzzustand des Hohlraums zu erreichen. Überprüfen Sie die Q-Vertiefung in der Mitte des Bildschirms auf eine symmetrische Form und maximale Tiefe.
Anmerkungen: Wenn die Probe zu viel leitfähigen Kohlenstoff enthält, wie z. B. Ruß, kann der Autotune-Prozess fehlschlagen oder zu einem kleinen Qualitätsfaktor (Q-Wert) der Kavität führen. Die typische Masse der Probe beträgt 3 mg. - Wählen Sie die optimalen Parameter, wie zum Beispiel: Mikrowelle: Leistung; Magnetfeld: Sweep-Zeit; Mittelfeld: Sweep-Breite; Modulation: Frequenz, Breite; Kanal: Amplitude, Zeitkonstante. Sweepen Sie dann das Magnetfeld und zeichnen Sie das ESR-Spektrum auf. Die typischen Werte der Messparameter sind in Abbildung 3 und Abbildung 4 dargestellt.
- Stellen Sie den Einfügebetrag des Mn-Markers auf 800 ein. Wiederholen Sie die Schritte 3.1.1 und 3.1.2, um ein ESR-Spektrum mit dem Mn-Marker aufzuzeichnen. Kalibrieren Sie das Magnetfeld, indem Sie sechs Hyperfeinlinien für die Mn(II)-Ionen verwenden.
- Sobald das BSG-Spektrometer fertig ist, führen Sie das vorbereitete Probenröhrchen in den Mikrowellenhohlraum ein und zentrieren Sie die Probe. Passen Sie die Mikrowellenphase, die Kopplung und die Frequenz automatisch an, um den Resonanzzustand des Hohlraums zu erreichen. Überprüfen Sie die Q-Vertiefung in der Mitte des Bildschirms auf eine symmetrische Form und maximale Tiefe.
- Linienformanalyse von Cu-THQ
- Importieren Sie den ESR-Datensatz in Python (Version 3.9.7). Normalisieren Sie das ESR-Spektrum, indem Sie die Intensität durch die Probenmasse, die Quadratwurzel der Mikrowellenleistung, die Modulationsbreite und die Amplitude dividieren.
- Passen Sie das kalibrierte und normalisierte BSG-Spektrum von Cu-THQ MOF an die achsensymmetrische Lorentz-Funktion25 an:
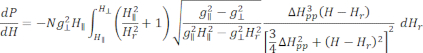
Dabei ist N ein Skalenfaktor, der die Geräteparameter g ll und H II-Konstantenenthält, (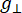 und ) sind die parallele (senkrechte) Komponente des Lander-g-Faktors und das entsprechende Resonanzmagnetfeld, Δ Hpp ist die Spitze-zu-Spitze-Linienbreite und
und ) sind die parallele (senkrechte) Komponente des Lander-g-Faktors und das entsprechende Resonanzmagnetfeld, Δ Hpp ist die Spitze-zu-Spitze-Linienbreite und 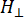 Hrist eine ganzzahlige Variable.
Hrist eine ganzzahlige Variable.
HINWEIS: Die Python-Codes für die Lorentz-Funktion sind in der ergänzenden Codierungsdatei 1 (die als AxialLorentz bezeichnet wird) verfügbar. - Erhalten Sie den anisotropen g-Wert und die Spitze-zu-Spitze-Linienbreite für die achsensymmetrischen Cu(II)-Ionen.
- Passen Sie das kalibrierte und normalisierte ESR-Spektrum mit der Lorentz-Funktion für die Radikalproben an. Ermitteln Sie den isotropen g-Wert und die Spitze-zu-Spitze-Linienbreite für die Radikale.
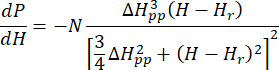
Dies wird in der ergänzenden Codierungsdatei 1 als SymLorentz bezeichnet.
- Quantifizierung der Radikalkonzentration
- 3,45 mg 4-Hydroxy-2,2,6,6-tetramethylpiperidin-1-oxyl (TEMPOL) und 96,55 mg KBr werden in einem Achatmörser vermahlen, bis ein homogenes Gemisch entsteht. Geben Sie 1 mg (0,2 μmol), 2 mg (0,4 μmol) und 4 mg (0,8 μmol) TEMPOL/KBr-Gemische in drei BSG-Probenröhrchen.
- Führen Sie die Schritte 3.1.1 und 3.1.2 aus, um die ESR-Spektren für die TEMPOL/KBr-Standards aufzuzeichnen.
- Führen Sie eine lineare Basislinienanpassung zwischen der doppelten Integration der ESR-Spektren und der Anzahl der Spins in den TEMPOL/KBr-Standards durch. Bestimmen Sie die Anzahl der Drehungen im zyklischen Cu-THQ unter Verwendung der linearen Basislinie der TEMPOL/KBr-Standards26.
- Aufnahme der ESR-Spektren bei tiefen Temperaturen
Anmerkungen: Verwenden Sie flüssiges Helium, um eine kryogene Temperatur zu erreichen. Bei der Arbeit mit flüssigem Helium müssen kryogene Handschuhe getragen werden.- Überprüfen Sie zuerst das ESR-Spektrum bei Raumtemperatur, indem Sie Schritt 3.1 befolgen.
- Evakuieren Sie den Hitzeschild auf ein hohes Vakuumniveau. Spülen Sie den Mikrowellenhohlraum mit Stickstoffgas, um Kondensation zu vermeiden.
- Geben Sie flüssiges Helium aus dem Gefäß in den Kryostaten. Kühlen Sie die Probe allmählich auf die niedrigste Temperatur (ca. 10 K) ab. Warten Sie 30 Minuten, um ein thermisches Gleichgewicht zu erreichen.
- Zeichnen Sie die temperaturabhängigen ESR-Spektren während der Erwärmung auf. Vergewissern Sie sich, dass das ESR-Spektrum bei niedrigen Temperaturen nicht unter dem Leistungssättigungseffekt leidet und das Verhältnis zwischen der Signalintensität (Spitze-zu-Spitze-Höhe) und der Quadratwurzel der Mikrowellenleistung konstant bleibt, wenn keine Leistungssättigung vorliegt.
Anmerkungen: Wenn die Leistung gesättigt ist, steigt die Signalintensität langsamer an als die Quadratwurzel der Mikrowellenleistung. Die Probenahmedichte könnte mit steigender Temperatur allmählich abnehmen.
4. Magnetische Suszeptibilitätsmessungen
- Befestigen Sie das Probenröhrchen an der Unterseite des Probenstabs. Stellen Sie sicher, dass die Oberfläche des Probenröhrchens sauber ist.
- Spülen Sie die Probenkammer und führen Sie das Probenröhrchen in den SQUID ein. Legen Sie ein Magnetfeld an und zentrieren Sie die Probe in der Detektionsspule. Entfernen Sie das externe Magnetfeld nach der Zentrierung.
Anmerkungen: Wenn die Spinkonzentration zu niedrig ist, um sie zu erkennen, sollten Sie in Betracht ziehen, das Magnetfeld oder die Zentrierung nach dem Abkühlen auf 2 K zu erhöhen. Die typische Probenmasse für SQUID-Messungen beträgt ca. 6 mg. - Kühlen Sie das System auf 20 K mit einer Geschwindigkeit von 10 K/min. Abkühlen 30 min pausieren, dann 1 h auf 2 K abkühlen lassen.
- Messung der magnetischen Suszeptibilität der getakteten CuTHQ-Elektrode unter einem Magnetfeld von 1.000 Oe bei Erwärmung auf 300 K; Dies wird als Nullfeld-gekühlter Prozess (ZFC) bezeichnet. Anschließend wird wieder auf 2 K abgekühlt und die magnetische Suszeptibilität im feldgekühlten (FC) Verfahren aufgezeichnet.
- Wiederholen Sie die Schritte 4.1 bis 4.4 mit CuTHQ-Elektroden, die in verschiedenen Reduktionsgraden getaktet werden.
- Messen Sie die magnetische Suszeptibilität der Kohlenstoffmaterialien (Gr/SP) unter den gleichen Bedingungen. Nutzen Sie dieses Ergebnis, um die magnetische Suszeptibilität der CuTHQ-Elektroden zu kompensieren.
- Passen Sie die Temperaturabhängigkeit der magnetischen Suszeptibilität an das modifizierte Curie-Weiss-Gesetz an:
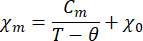
Dabei ist χ m die molare magnetische Suszeptibilität, Cmdie molare Curie-Konstante, θ die Weiss-Temperatur und χ0ein temperaturunabhängiger Term.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Unsere bisherigen Arbeiten beinhalteten eine detaillierte Diskussion der ex situ ESR-Spektroskopie und ex situ magnetischen Suszeptibilitätsmessungen für elektrochemisch zykliertes CuTHQ20. Hier präsentieren wir die repräsentativsten und detailliertesten Ergebnisse, die nach dem in diesem Artikel beschriebenen Protokoll erzielt werden können.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Um Kathoden herzustellen, ist es notwendig, das aktive Material mit leitfähigem Kohlenstoff zu mischen, um eine geringe Polarisation während des elektrochemischen Prozesses zu erreichen. Das Kohlenstoffadditiv ist der erste kritische Punkt für die Ex-situ-Magnetometrie ; Wenn der Kohlenstoff Radikaldefekte aufweist, kann das Auftreten des elektrochemisch induzierten organischen Radikals im ESR-Spektrum nicht beobachtet werden. Dies macht es schwierig, die Spinkonzentration oder die Konzentration organischer R...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu erklären.
Danksagungen
Diese Studie wurde von einem KAKENHI Grant (JP20H05621 der Japan Society for the Promotion of Science (JSPS) unterstützt. Z. Zhang bedankt sich auch bei der Tatematsu Foundation und dem Toyota Riken-Stipendium für die finanzielle Unterstützung.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 1-Methyl-2-pyrrolidone | FUJIFILM Wako Chemicals | 139-17611 | Super Dehydrated |
| 1mol/L LiBF4 EC:DEC (1:1 v/v%) | Kishida | LBG-96533 | electrolyte |
| 4-Hydroxy-2,2,6,6-tetramethylpiperidine-1-oxyl | FUJIFILM Wako Chemicals | 089-04191 | TEMPOL, for Spin Labeling |
| Ampule tube | Maruemu Corporation | 5-124-05 | 20mL |
| Carbon black, Super P Conductive | Alfa Aesar | H30253 | |
| Conductive Carbon Black | Mitsubishi Chemical | ||
| Copper (II) Nitrate Trihydrate | FUJIFILM Wako Chemicals | 033-12502 | deleterious substances |
| Dimethyl Carbonate | FUJIFILM Wako Chemicals | 046-31935 | battery grade |
| Ethylenediamine | FUJIFILM Wako Chemicals | 053-00936 | deleterious substances |
| Graphene Nanoplatelets | Tokyo Chemical Industry | G0442 | 6-8nm(thick), 15µm(wide) |
| Poly(vinylidene fluoride) | Sigma Aldrich | 182702 | |
| Potassium Bromide | FUJIFILM Wako Chemicals | 165-17111 | for Infrared Spectrophotometry |
| Sodium Alginate | FUJIFILM Wako Chemicals | 199-09961 | 500-600 cP |
| SQUID Magnetometer | Quantum Design | MPMS-XL 5 | |
| Tetrahydroxy-1,4-benzoquinone Hydrate | Tokyo Chemical Industry | T1090 | |
| X-Band ESR | JEOL | JES-F A200 |
Referenzen
- Lee, J., et al. Metal-organic framework materials as catalysts. Chemical Society Reviews. 38 (5), 1450-1459 (2009).
- Dolgopolova, E. A., Rice, A. M., Martin, C. R., Shustova, N. B. Photochemistry and photophysics of MOFs: steps towards MOF-based sensing enhancements. Chemical Society Reviews. 47 (13), 4710-4728 (2018).
- Qian, Q., et al. MOF-based membranes for gas separations. Chemical Reviews. 120 (16), 8161-8266 (2020).
- Wang, Q., Astruc, D. State of the art and prospects in metal-organic framework (MOF)-based and MOF-derived nanocatalysis. Chemical Reviews. 120 (2), 1438-1511 (2020).
- Wang, M., Dong, R., Feng, X. Two-dimensional conjugated metal-organic frameworks (2D c-MOFs): chemistry and function for MOFtronics. Chemical Society Reviews. 50 (4), 2764-2793 (2021).
- Baumann, A. E., Burns, D. A., Liu, B., Thoi, V. S. Metal-organic framework functionalization and design strategies for advanced electrochemical energy storage devices. Communications Chemistry. 2 (1), 86(2019).
- Nam, K. W., et al. Conductive 2D metal-organic framework for high-performance cathodes in aqueous rechargeable zinc batteries. Nature Communications. 10 (1), 4948(2019).
- Sheberla, D., et al. Conductive MOF electrodes for stable supercapacitors with high areal capacitance. Nature Materials. 16 (2), 220-224 (2017).
- Wang, Z., et al. Ultrathin two-dimensional conjugated metal-organic framework single-crystalline nanosheets enabled by surfactant-assisted synthesis. Chemical Science. 11 (29), 7665-7671 (2020).
- Zhang, Z., Yoshikawa, H., Awaga, K. Monitoring the solid-state electrochemistry of Cu(2,7-AQDC) (AQDC = anthraquinone dicarboxylate) in a lithium battery: Coexistence of metal and ligand redox activities in a metal-organic framework. Journal of the American Chemical Society. 136 (46), 16112-16115 (2014).
- Zhang, Z., Yoshikawa, H., Awaga, K. Discovery of a "bipolar charging" mechanism in the solid-state electrochemical process of a flexible metal-organic framework. Chemistry of Materials. 28 (5), 1298-1303 (2016).
- Li, C., Hu, X., Hu, B. Cobalt(II) dicarboxylate-based metal-organic framework for long-cycling and high-rate potassium-ion battery anode. Electrochimica Acta. 253, 439-444 (2017).
- Liu, J., et al. Reversible formation of coordination bonds in Sn-based metal-organic frameworks for high-performance lithium storage. Nature Communications. 12 (1), 3131(2021).
- Jiang, Q., et al. A redox-active 2D metal-organic framework for efficient lithium storage with extraordinary high capacity. Angewandte Chemie. 59 (13), 5273-5277 (2020).
- Sakaushi, K., Nishihara, H. Two-dimensional π-conjugated frameworks as a model system to unveil a multielectron-transfer-based energy storage mechanism. Accounts of Chemical Research. 54 (15), 3003-3015 (2021).
- Li, H., et al. 2D organic radical conjugated skeletons with paramagnetic behaviors. Advanced Materials Interfaces. 8 (18), 2100943(2021).
- Peeks, M. D., et al. Electronic delocalization in the radical cations of porphyrin oligomer molecular wires. Journal of the American Chemical Society. 139 (30), 10461-10471 (2017).
- Krug von Nidda, H. A., et al. Anisotropic exchange in LiCuVO4 probed by ESR. Physical Review B. 65 (13), 134445(2002).
- Zeng, Z., et al. Pro-aromatic and anti-aromatic π-conjugated molecules: An irresistible wish to be diradicals. Chemical Society Reviews. 44 (18), 6578-6596 (2015).
- Chen, Q., Adeniran, O., Liu, Z. F., Zhang, Z., Awaga, K. Graphite-like charge storage mechanism in a 2D π-d conjugated metal-organic framework revealed by stepwise magnetic monitoring. Journal of the American Chemical Society. 145 (2), 1062-1071 (2023).
- Julien, C. M., Mauger, A., Groult, H., Zhang, X., Gendron, F. LiCo1-yByO2 as cathode materials for rechargeable lithium batteries. Chemistry of Materials. 23 (2), 208-218 (2011).
- Niemöller, A., Jakes, P., Eichel, R. A., Granwehr, J. In operando EPR investigation of redox mechanisms in LiCoO2. Chemical Physics Letters. 716, 231-236 (2019).
- Park, J., et al. Synthetic routes for a 2D semiconductive copper hexahydroxybenzene metal-organic framework. Journal of the American Chemical Society. 140 (44), 14533-14537 (2018).
- Rondeau, R. E. A technique for degassing liquid samples. Journal of Chemical Education. 44 (9), 530(1967).
- Flores-Llamas, H. Inhomogeneously broadened EPR lineshape of axial powder. Applied Magnetic Resonance. 9 (2), 289-298 (1995).
- Sun, L., et al. Room-temperature quantitative quantum sensing of lithium ions with a radical-embedded metal-organic framework. Journal of the American Chemical Society. 144 (41), 19008-19016 (2022).
- Chen, Y., et al. Successive storage of cations and anions by ligands of π-d-conjugated coordination polymers enabling robust sodium-ion batteries. Angewandte Chemie. 60 (34), 18769-18776 (2021).
- Roessler, M. M., Salvadori, E. Principles and applications of EPR spectroscopy in the chemical sciences. Chemical Society Reviews. 47 (8), 2534-2553 (2018).
- Ji, X., et al. Pauli paramagnetism of stable analogues of pernigraniline salt featuring ladder-type constitution. Journal of the American Chemical Society. 142 (1), 641-648 (2020).
- Noel, M., Santhanam, R. Electrochemistry of graphite intercalation compounds. Journal of Power Sources. 72 (1), 53-65 (1998).
- Wu, K. H., Ting, T. H., Wang, G. P., Ho, W. D., Shih, C. C. Effect of carbon black content on electrical and microwave absorbing properties of polyaniline/carbon black nanocomposites. Polymer Degradation and Stability. 93 (2), 483-488 (2008).
- Yao, M., Taguchi, N., Ando, H., Takeichi, N., Kiyobayashi, T. Improved gravimetric energy density and cycle life in organic lithium-ion batteries with naphthazarin-based electrode materials. Communications Materials. 1 (1), 70(2020).
- Krzystek, J., et al. EPR spectra from "EPR-silent" species: High-frequency and high-field EPR spectroscopy of pseudotetrahedral complexes of nickel(II). Inorganic Chemistry. 41 (17), 4478-4487 (2002).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten