Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Metodología para la inactivación metabólica de bacterias para la investigación de Caenorhabditis elegans
En este artículo
Resumen
La fuente de alimento para Caenorhabditis elegans en el laboratorio es Escherichia coli viva. Dado que las bacterias son metabólicamente activas, presentan una variable de confusión en los estudios metabólicos y farmacológicos en C. elegans. Aquí se describe un protocolo detallado para inactivar metabólicamente las bacterias utilizando paraformaldehído.
Resumen
Caenorhabditis elegans es un organismo modelo común para la investigación en genética, desarrollo, envejecimiento, metabolismo y comportamiento. Debido a que C. elegans consume una dieta de bacterias vivas, la actividad metabólica de su fuente de alimento puede confundir los experimentos que buscan los efectos directos de diversas intervenciones en el gusano. Para evitar los efectos de confusión del metabolismo bacteriano, los investigadores de C. elegans han utilizado múltiples métodos para inactivar metabólicamente las bacterias, incluida la irradiación ultravioleta (UV), la eliminación del calor y los antibióticos. El tratamiento UV tiene un rendimiento relativamente bajo y no se puede utilizar en cultivos líquidos porque cada placa debe examinarse para detectar una eliminación bacteriana exitosa. Un segundo método de tratamiento, la eliminación por calor, afecta negativamente la textura y la calidad nutricional de las bacterias, lo que lleva a la detención del desarrollo de C. elegans. Por último, el tratamiento con antibióticos puede alterar directamente la fisiología de C. elegans , además de prevenir el crecimiento bacteriano. Este manuscrito describe un método alternativo para inactivar metabólicamente bacterias utilizando paraformaldehído (PFA). El tratamiento con PFA retila las proteínas dentro de las células bacterianas para prevenir la actividad metabólica al tiempo que preserva la estructura celular y el contenido nutricional. Este método es de alto rendimiento y se puede utilizar en cultivos líquidos o placas sólidas, ya que la prueba de crecimiento de una placa de bacterias tratadas con PFA valida todo el lote. La inactivación metabólica a través del tratamiento con PFA se puede utilizar para eliminar los efectos de confusión del metabolismo bacteriano en los estudios de suplementación con fármacos o metabolitos, resistencia al estrés, metabolómica y comportamiento en C. elegans.
Introducción
Caenorhabditis elegans fue propuesto originalmente como un organismo modelo en 19651 y desde entonces ha sido ampliamente adoptado en estudios de genética, desarrollo, comportamiento, envejecimiento y metabolismo2. Debido a su gran tamaño de cría y a su cutícula transparente, C. elegans es especialmente adecuado para el cribado de alto rendimiento con reporteros fluorescentes3. Su corto ciclo de vida, su reproducción hermafrodita y su homología genética con los humanos también hacen de C. elegans un valioso sistema modelo para estudios sobre el desarrollo4 y la biología del envejecimiento5. Además, C. elegans es relativamente fácil de mantener. Los gusanos pueden cultivarse en cultivo líquido o en placas de agar sólido y consumir una dieta de bacterias vivas Escherichia coli OP504.
Sin embargo, la fuente de alimento vivo de C. elegans puede confundir los estudios sobre el metabolismo, la suplementación con medicamentos y el comportamiento. Debido a que las bacterias vivas tienen su propio metabolismo, las condiciones experimentales que afectan a las bacterias también alteran los nutrientes y metabolitos disponibles para los gusanos. Por ejemplo, las diferencias en las concentraciones bacterianas de hierro, aminoácidos y folato tienen diversos efectos en el desarrollo, la fisiología y la esperanza de vida de C. elegans. Muchas prácticas comunes de laboratorio pueden provocar tales cambios en la composición de nutrientes y metabolitos producidos por OP50. Específicamente, la exposición a la 5-fluoro-2'-desoxiuridina (FUdR), un compuesto comúnmente utilizado para prevenir la reproducción en C. elegans, provoca amplios cambios en la expresión génica de OP50, incluidas las vías de biosíntesis de aminoácidos7. Las bacterias vivas también pueden confundir los estudios en los que C. elegans se complementa con moléculas pequeñas porque las bacterias pueden metabolizar parcial o completamente los compuestos activos. Además, los efectos de estas pequeñas moléculas sobre las bacterias pueden, a su vez, alterar la fisiología de C. elegans, como se informó con el fármaco metformina8, que prolonga la vida útil. Finalmente, las bacterias vivas pueden cambiar el entorno del gusano de maneras que alteran el comportamiento, como la secreción de olores atractivos9, la producción de neuromoduladores exógenos10 y la creación de gradientes de oxígeno en un césped de bacterias densas11.
Para mitigar los efectos de confusión del metabolismo bacteriano en la investigación de C. elegans , se han desarrollado múltiples métodos para matar bacterias (Tabla 1). Tres estrategias comunes para eliminar la OP50 son la irradiación UV, la eliminación del calor y el tratamiento con antibióticos. Si bien son sencillos y de costo relativamente bajo, cada uno de estos métodos puede tener efectos indeseables tanto en las bacterias como en C. elegans. La eliminación de UV a través de un reticulante UV12 es de bajo rendimiento y la velocidad está limitada por el número de placas que pueden caber en el reticulante UV. Además, la eficacia de la eliminación de los rayos UV puede variar de una placa a otra dentro de un lote, y las pruebas de crecimiento en todas las placas pueden resultar difíciles en experimentos grandes. Matar el calor de OP50 al exponer el cultivo a temperaturas de >60 °C conlleva un conjunto separado de desafíos. Las altas temperaturas pueden dañar los nutrientes esenciales para la lombriz y destruir la estructura celular de las bacterias, creando una textura más suave que disminuye la cantidad de tiempo que las lombrices pasan enla comida. Este método tampoco se puede utilizar durante todo el ciclo de vida de C. elegans porque los gusanos alimentados con bacterias muertas por calor pueden detenerse en las primeras etapas del desarrollo13. El tratamiento con antibióticos es un tercer método común para suprimir el metabolismo bacteriano14, pero los antibióticos también pueden alterar el crecimiento y el metabolismo de las lombrices15.
Una solución para eliminar los efectos metabólicos de las bacterias vivas mientras se preserva la estructura bacteriana y los nutrientes esenciales es matar el OP50 con paraformaldehído (PFA)16. El PFA es un polímero de formaldehído que puede reticularmente proteínas dentro de las células17 para evitar la replicación bacteriana sin destruir las estructuras celulares internas como la membrana plasmática interna18. Debido a esta preservación de la estructura celular interna, las bacterias tratadas con PFA no exhiben crecimiento ni actividad metabólica, pero siguen siendo una fuente de alimento comestible y rica en nutrientes para C. elegans16. Aquí, se proporciona un protocolo detallado que muestra cómo inactivar metabólicamente las bacterias usando paraformaldehído.
| Método | Materiales requeridos | ¿Escalable? | ¿Nutricional? | ¿Efectos en Worm? | ||||
| UV | Reticulante UV | Limitado por: | Sí | Efectos variables sobre la esperanza de vida en NGM12, 23, 24 | ||||
| Número de placas que caben en el reticulante UV | Efectos variables sobre la vida útil en FUdR24, 26, 27 | |||||||
| Tiempo de irradiación por placa | Disminución de la preferencia alimentaria16 | |||||||
| Capacidad para revisar el crecimiento de cada placa8 | ||||||||
| Calor | Incubadora a >60 °C | Sí | No: destruye la pared celular, disminuye el valor nutricional | Detención del desarrollo 13 | ||||
| Disminución de la preferencia alimentaria13 | ||||||||
| Prolonga la vida útil de NGM31 | ||||||||
| Antibióticos | Antibióticos (kanamicina, carbenicilina, etc.) | Sí | Sí | Retrasa el crecimiento y el desarrollo15 | ||||
| Prolonga la vida útil en medios líquidos19 | ||||||||
| Prolonga la vida útil de NGM15 | ||||||||
| PFA | 0,5% Paraformaldehído | Sí | Sí | Disminución del tamaño de las crías pequeñas16 | ||||
| Pequeño aumento del tiempo de desarrollo16 | ||||||||
| Disminución de la preferencia alimentaria16 | ||||||||
Tabla 1. Comparaciones de métodos para matar OP50. La eliminación de los rayos UV, la eliminación del calor, el tratamiento con antibióticos y el tratamiento con PFA tienen efectos variados sobre el estado nutricional de las bacterias y la salud de las lombrices alimentadas con bacterias tratadas. Estos métodos para inactivar replicativamente E. coli también difieren en sus materiales requeridos y escalabilidad.
Protocolo
1. Inoculación de bacterias
- Preparar caldo de Luria (LB) disolviendo 10 g de triptona, 5 g de extracto de levadura y 10 g de cloruro de sodio (NaCl) en 950 mL de agua destilada.
- Ajuste el pH del LB a 7.0 agregando hidróxido de sodio (NaOH) 5M. Esto solo debería requerir alrededor de 0.2 mL de NaOH.
- Autoclave el medio LB ajustado por pH en un ciclo de líquido durante 45 minutos a 15 psi. Deje que la solución se enfríe y guárdela a temperatura ambiente.
- Inocular una sola colonia de bacterias en 100 mL de LB en un matraz Erlenmeyer de 500 mL. Cultive las bacterias durante la noche en una incubadora agitadora a 37 °C.
- Dependiendo de la salud de la colonia bacteriana, el tamaño del matraz y la velocidad a la que esté ajustado el agitador, el tiempo que tardan las bacterias en crecer puede variar. Después de ~14 h, verifique la densidad óptica (OD) de las bacterias a 600 nm (OD600).
- Retire las bacterias del agitador cuando el diámetro exterior600 sea 3.0 (1 x 109 unidades formadoras de colonias (UFC)/ml). Si el diámetro exterior600 es inferior a 3,0, devuelva el matraz a la incubadora agitadora hasta alcanzar el diámetro exterior deseado.
- Alícuota de las bacterias en tubos cónicos de 50 ml y almacenarlas a 4 °C o continuar con el siguiente paso.
2. Trabajar con paraformaldehído
NOTA: La concentración de paraformaldehído (PFA) utilizada y la duración de la exposición pueden variar un poco según el clima, la ubicación y el tipo de bacteria que se esté tratando. Un buen punto de partida para OP50 es la exposición a PFA al 0,5% durante 1 h, mientras que el PFA al 0,25% durante 1 h puede ser suficiente para HT115.
- Prepare existencias de PFA al 32 % o use una solución de PFA al 32 % comprada comercialmente. Use el equipo de protección personal (EPP) adecuado cuando trabaje con PFA. Use guantes y protección para los ojos.
- Agregue PFA dentro de una campana de extracción de gases químicos con ventilación adecuada. Deseche los lavados y puntas que contengan PFA en recipientes adecuados para productos químicos peligrosos en la campana extractora.
3. Tratamiento bacteriano con paraformaldehído
- Una vez que las bacterias alcancen un OD600 de 3,0, utilice una pipeta serológica para transferir 50 ml a un nuevo matraz Erlenmeyer de 250 ml. Guarde el resto para un control en vivo, un control simulado (consulte el paso 4) o para tratar también con PFA según sea necesario.
- Evite verter de un matraz a otro y tenga cuidado de no salpicar los lados del nuevo matraz con bacterias. Las colonias en el costado del matraz pueden recibir una dosis más baja de PFA.
- En la campana química, agregue 781 μL de PFA al 32% a 50 ml de bacterias para llevar la concentración final al 0,5%. Deseche la punta utilizada en un contenedor de desechos sólidos para productos químicos peligrosos.
- Cubra el matraz con papel de aluminio y vuelva a colocarlo en la incubadora agitadora a 37 °C durante 1 h. Después de 1 h, retire el matraz de la incubadora y continúe con el paso 5.
4. Control simulado
- Una vez que las bacterias alcancen un OD600 de 3,0, utilice una pipeta serológica para transferir 50 ml de las bacterias a un tubo cónico de 50 ml.
- Continúe con el paso 5.3 para completar los pasos de lavado similares a los del grupo tratado con PFA.
5. Lavar las bacterias para eliminar los residuos de PFA
- En la campana química, utilice una pipeta serológica para transferir las bacterias tratadas del matraz Erlenmeyer a un tubo cónico de 50 ml. El uso de una pipeta serológica en lugar de verter las bacterias evitará la contaminación de cualquier colonia bacteriana en el borde del matraz que pueda haber evitado el tratamiento directo con PFA.
- Centrifugar las bacterias tratadas a aproximadamente 3000 x g durante 20 min. Retire el sobrenadante desechándolo en un contenedor de residuos líquidos peligrosos para productos químicos en la campana química.
- Agregue 25 ml de LB y vórtice para resuspender el gránulo bacteriano (llenar el tubo por completo dificulta la resuspensión del gránulo). Repetir la centrifugación y la resuspensión de pellets 4 veces.
- Vuelva a suspender el gránulo en volúmenes óptimos para diferentes ensayos. Para los ensayos de vida útil, siembre placas de 60 mm con 200 μL de bacterias resuspendidas en 10 mL de LB. La resuspensión de las bacterias en 10 mL de LB da como resultado una concentración de 5 veces mayor que el cultivo original de 50 mL.
- Almacenar las bacterias a 4 °C.
6. Control de calidad del crecimiento bacteriano
- Después del lavado final y la resuspensión, raye una placa LB (con una punta de pipeta estéril) con las bacterias preparadas. Es una buena práctica rayar el LB utilizado para lavar y volver a suspender en una placa separada para asegurarse de que el LB utilizado no esté contaminado.
- Coloque las placas en una incubadora a 37 °C durante la noche. Compruebe si hay algún crecimiento. Las bacterias se consideran muertas replicativamente cuando las colonias no crecen en la placa LB.
7. Control de calidad del metabolismo bacteriano mediante un respirómetro
- Después del lavado final y la resuspensión del paso 5.4, confirme que las bacterias están metabólicamente muertas utilizando las herramientas disponibles, como los respirómetros19,20 y midiendo la tasa de consumo basal de oxígeno (OCR).
- Preparar la solución M9: Disolver 3 g de fosfato de potasio monobásico (KH 2 PO 4),6 g de fosfato de sodio dibásico (Na2HPO4) y 5 g de cloruro de sodio (NaCl) en 950 ml de agua destilada. Autoclave en un ciclo de líquido durante 45 minutos a 15 psi, luego deje que la solución se enfríe a temperatura ambiente. Agregue 1 mL de sulfato de magnesio 1 M (MgSO4) y guárdelo a temperatura ambiente.
- Hidratar el cartucho del respirómetro: Agregue 200 μL de calibrante a todos los pocillos de una placa de 96 pocillos. Coloque el cartucho en la placa de 96 pocillos e incube durante la noche en una incubadora a 37 °C.
- Calibración del ensayo: Al día siguiente, coloque el cartucho hidratado en la máquina y comience la calibración.
- Configuración de la placa de prueba de ensayo: Con una nueva placa de 96 pocillos, agregue 160 μL de M9 y 40 μL de las bacterias preparadas (1 x 109 UFC/mL) para probar los pocillos. Agregue 200 μL de M9 a los 4 pocillos de esquina para usarlos como pocillos en blanco. Añadir 160 μL de M9 y 40 μL de LB utilizados para lavar y resuspender para usar como controles negativos. Añadir 200 μL de M9 al resto de pocillos que no se vayan a utilizar.
- Ejecute el ensayo: Una vez completada la calibración del cartucho, inserte la placa de ensayo del paso 7.5 en la máquina para su análisis. Los ajustes incluyen pasos para mezclar, esperar, medir y hacer un bucle. Los resultados se mostrarán como tasa de consumo de oxígeno (OCR). Las bacterias están metabólicamente muertas y listas para usar cuando el OCR es cero.
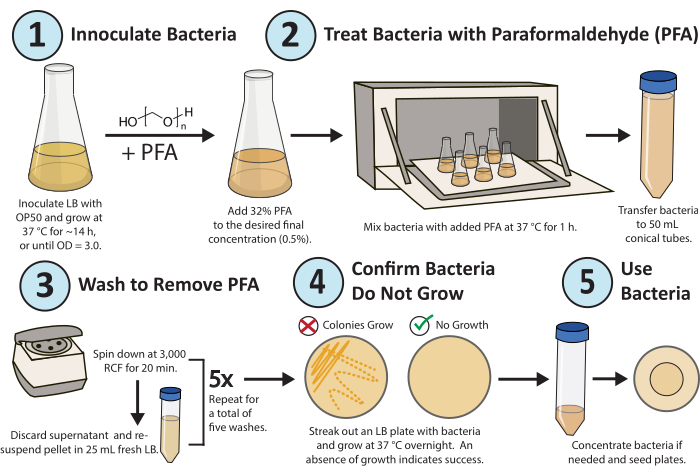
Figura 1. Flujo de trabajo para el tratamiento con paraformaldehído. Una sola colonia de la bacteria E. coli OP50 se cultiva durante la noche. Se añade PFA a una concentración final del 0,5% y el cultivo tratado con PFA se agita durante 1 h a 37 °C. Finalmente, el PFA se elimina lavando el cultivo con LB fresco 5x. Para confirmar que las bacterias tratadas están inactivas de forma replicativa, saque una placa LB de las bacterias tratadas y crezca durante la noche. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
En la Figura 1 se muestra un flujo de trabajo detallado del protocolo. Se desarrolló y optimizó un método de alto rendimiento para inactivar consistentemente la replicación bacteriana (Figura 2A) y el metabolismo (Figura 2B) para estudios metabólicos y de fármacos en la investigación de C. elegans utilizando paraformaldehído16. El objetivo era determinar la concentración más baja de PFA nec...
Discusión
Beneficios de la eliminación de PFA en relación con otros métodos de eliminación de bacterias
El tratamiento con PFA es un método de alto rendimiento para prevenir el metabolismo bacteriano mientras se mantiene una fuente de alimento nutritivo para C. elegans. La eliminación de bacterias mediante el tratamiento con PFA tiene múltiples ventajas sobre otros métodos. A diferencia del tratamiento UV, en el que cada placa debe probarse para comprobar si se ha eliminado con éxito, se puede...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por NIH R21AG059117 y los Laboratorios Paul F. Glenn para la Investigación de la Biología del Envejecimiento de la Universidad de Michigan. SB fue financiado por T32AG000114. ESK fue financiado por NSF DGE 1841052.
Materiales
| Name | Company | Catalog Number | Comments |
| Aluminum Foil | Staples | 2549291 | |
| Bunsen burner | VWR | 470121-700 | |
| Cell Density Meter | Denville | 80-3000-45 | |
| Centrifuge | Eppendorg | 5430 | |
| Chemical fume hood | Labcono | 975050411384RG | |
| Conincal tubes (50 mL) | Fisher | 339652 | |
| Cuvettes | Fisher | 14-955-127 | |
| E. coli OP50 | CGC | OP50 | |
| Erlenmyer flasks | Fisher | 250 mL: FB501250 500 mL: FB501500 1000 mL: FB5011000 | |
| Inoculation loop | Fisher | 22-363-605 | |
| LB Agar | Fisher | BP1425500 | |
| Liquid waste collection bottle | Thomas Scientific | 1230G50 | |
| Magnesium Sulfate (MgSO4) | Sigma | M7506 | |
| Paraformaldehyde (32%) | Electron Microscopy Sciences | 15714-S | Paraformaldehyde – methanol free solution |
| Pipettor | Eppendorf | Eppendorf Easypet 3 | |
| Plastic dishes (100 mm) | Fisher | FB0875712 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher | P2853 | |
| Seahorse XF Calibrant | Agilent | 100840-000 | |
| Seahorse XFe96 Extracellular Flux Assay Kit and Cell Culture Microplate | Agilent | 101085-004 | |
| Serological pipettes (50 mL) | Genesee Scientific | 12-107 | |
| Shaker incubator | Thermo | 11 676 083 | |
| Sodium Chloride (NaCl) | Fisher | S640-3 | |
| Sodium Hydroxide (NaOH) | Fisher | S318500 | |
| Sodium Phosphate Dibasic Anhydrous (Na2HPO4) | Sigma | S374-500 | |
| Solid waste collection bucket | M&M Industries | 5.0 Gallon M1 Traditional Pail | |
| Tryptone | Genesee Scientific | 20-251 | |
| Vortex | Thermo | 11676331 | |
| Weighing balance | C Goldenwall | HZ10K6B | |
| Yeast Extract | Genesee Scientific | 20-255 |
Referencias
- Riddle, D. L., Blumenthal, T., Meyer, B. J., Priess, J. R. C. . Elegans II. 33, (1997).
- Corsi, A. K., Wightman, B., Chalfie, M. A transparent window into biology: A primer on caenorhabditis elegans. WormBook. , 1-31 (2015).
- Kaletta, T., Hengartner, M. O. Finding function in novel targets: C. elegans as a model organism. Nature reviews. Drug discovery. 5 (5), 387-398 (2006).
- Meneely, P. M., Dahlberg, C. L., Rose, J. K. Working with worms: Caenorhabditis elegans as a model organism. Current Protocols Essential Laboratory Techniques. 19 (1), (2019).
- Zhang, S., Li, F., Zhou, T., Wang, G., Li, Z. Caenorhabditis elegans as a useful model for studying aging mutations. Frontiers in Endocrinology. 11, 554994 (2020).
- Feng, M., Gao, B., Garcia, L. R., Sun, Q. Microbiota-derived metabolites in regulating the development and physiology of Caenorhabditis elegans. Frontiers in Microbiology. 14, 1035582 (2023).
- McIntyre, G., Wright, J., Wong, H. T., Lamendella, R., Chan, J. Effects of FUdR on gene expression in the C. elegans bacterial diet OP50. BMC Research Notes. 14 (1), 207 (2021).
- Cabreiro, F., et al. Metformin retards aging in c. Elegans by altering microbial folate and methionine metabolism. Cell. 153 (1), 228-239 (2013).
- Worthy, S. E., et al. Identification of attractive odorants released by preferred bacterial food found in the natural habitats of c. Elegans. PLoS One. 13 (7), e0201158 (2018).
- Chen, Y. C., Seyedsayamdost, M. R., Ringstad, N. A microbial metabolite synergizes with endogenous serotonin to trigger C. elegans reproductive behavior. Proceedings of the National Academy of Sciences of the United States of America. 117 (48), 30589-30598 (2020).
- Kim, D. H., Flavell, S. W. Host-microbe interactions and the behavior of Caenorhabditis elegans. Journal of Neurogenetics. 34 (3-4), 500-509 (2020).
- Gems, D., Riddle, D. L. Genetic, behavioral, and environmental determinants of male longevity in Caenorhabditis elegans. Genetics. 154 (4), 1597-1610 (2000).
- Qi, B., Kniazeva, M., Han, M. A vitamin-b2-sensing mechanism that regulates gut protease activity to impact animal's food behavior and growth. eLife. 6, e26243 (2017).
- Garigan, D., et al. Genetic analysis of tissue aging in caenorhabditis elegans: A role for heat-shock factor and bacterial proliferation. Genetics. 161 (3), 1101-1112 (2002).
- Virk, B., et al. Folate acts in E. coli to accelerate C. elegans aging independently of bacterial biosynthesis. Cell Reports. 14 (7), 1611-1620 (2016).
- Beydoun, S., et al. An alternative food source for metabolism and longevity studies in Caenorhabditis elegans. Communications Biology. 4 (1), 258 (2021).
- Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., Ranganathan, K. Chemical and physical basics of routine formaldehyde fixation. Journal of Oral and Maxillofacial Pathology. 16 (3), 400-405 (2012).
- Felix, H. Permeabilized and immobilized cells. Methods in Enzymology. 137, 637-641 (1988).
- Lobritz, M. A., et al. Antibiotic efficacy is linked to bacterial cellular respiration. Proceedings of the National Academy of Sciences of the United States of America. 112 (27), 8173-8180 (2015).
- Nadanaciva, S., et al. Assessment of drug-induced mitochondrial dysfunction via altered cellular respiration and acidification measured in a 96-well platform. Journal of Bioenergetics and Biomembranes. 44 (4), 421-437 (2012).
- Shtonda, B. B., Avery, L. Dietary choice behavior in Caenorhabditis elegans. The Journal of Experimental biology. 209 (Pt 1), 89-102 (2006).
- MacNeil, L. T., Watson, E., Arda, H. E., Zhu, L. J., Walhout, A. J. Diet-induced developmental acceleration independent of tor and insulin in C. elegans. Cell. 153 (1), 240-252 (2013).
- Kumar, S., et al. Lifespan extension in C. elegans caused by bacterial colonization of the intestine and subsequent activation of an innate immune response. Developmental Cell. 49 (1), 100-117 (2019).
- Nakagawa, H., et al. Effects and mechanisms of prolongevity induced by Lactobacillus gasseri sbt2055 in Caenorhabditis elegans. Aging Cell. 15 (2), 227-236 (2016).
- Kaeberlein, T. L., et al. Lifespan extension in Caenorhabditis elegans by complete removal of food. Aging Cell. 5 (6), 487-494 (2006).
- Beaudoin-Chabot, C., et al. The unfolded protein response reverses the effects of glucose on lifespan in chemically-sterilized C. elegans. Nature Communication. 13 (1), 5889 (2022).
- Komura, T., Takemoto, A., Kosaka, H., Suzuki, T., Nishikawa, Y. Prolonged lifespan, improved perception, and enhanced host defense of Caenorhabditis elegans by Lactococcus cremoris subsp. cremoris.Microbiology Spectrum. 10 (3), e0045421 (2022).
- Ye, X., Linton, J. M., Schork, N. J., Buck, L. B., Petrascheck, M. A pharmacological network for lifespan extension in Caenorhabditis elegans. Aging Cell. 13 (2), 206-215 (2014).
- Hastings, J., et al. Wormjam: A consensus C. elegans metabolic reconstruction and metabolomics community and workshop series. Worm. 6 (2), e1373939 (2017).
- O'Donnell, M. P., Fox, B. W., Chao, P. H., Schroeder, F. C., Sengupta, P. A neurotransmitter produced by gut bacteria modulates host sensory behaviour. Nature. 583 (7816), 415-420 (2020).
- Stuhr, N. L., Curran, S. P. Bacterial diets differentially alter lifespan and healthspan trajectories in C. elegans. Communications Biology. 3 (1), 653 (2020).
- Dirksen, P., et al. Cembio - the Caenorhabditis elegans microbiome resource. G3 (Bethesda). 10 (9), 3025-3039 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados